Микробиология, 2023, T. 92, № 1, стр. 47-56
Система “кворум сенсинга” у Chromobacterium subtsugae (ранее C. violaceum) ингибируется гамма-лактонами – минорными компонентами экстракта листьев эвкалипта
К. С. Инчагова a, Г. К. Дускаев a, Д. Г. Дерябин a, *
a Федеральный научный центр биологических систем и агротехнологий
Российской академии наук
460000 Оренбург, Россия
* E-mail: dgderyabin@yandex.ru
Поступила в редакцию 16.08.2022
После доработки 01.09.2022
Принята к публикации 01.09.2022
- EDN: NMRUHT
- DOI: 10.31857/S0026365622600626
Аннотация
Целью работы является исследование природы ингибирования системы “кворум сенсинга” (QS) у модельной бактерии Chromobacterium subtsugae 026 (ранее – C. violaceum 026) экстрактом листьев эвкалипта прутовидного (Eucalyptus viminalis Labill) с идентификацией в его составе молекул с соответствующим вариантом биологической активности. Тестирование цельного экстракта показало выраженную QS-ингибирующую активность, развивающуюся в широком диапазоне концентраций, в несколько десятков раз ниже требуемых для подавления бактериального роста (соотношение МИК50/EC50 = 43.6). Химический анализ обнаруживал в экстракте присутствие шести малых молекул растительного происхождения (пирогаллол, 2,3-дигидро-3,5-дигидрокси-6-метил-4H-пиран-4-1, цимол, 4-((1E)-3-гидрокси-1-пропенил)-2-метоксифенол, галловая и пальмитиновая кислоты). QS-ингибирующий эффект этих соединений в отношении Chromobacterium spp. ранее был показан в экспериментах in vitro или предсказан на моделях in silico. Среди минорных компонентов анализируемого экстракта идентифицированы γ-капролактон и γ-октанолактон, структуры которых демонстрировали сходство с автоиндукторами QS – ацилированными гомосеринлактонами. Исследование химически синтезированных аналогов данных молекул в биотесте на C. subtsugae 026 впервые показало наличие у них QS-ингибирующей активности, характеризуемой величинами ЕС50 = 354.2 и 145.6 мкг/мл соответственно. Обогащение цельного экстракта листьев эвкалипта прутовидного γ‑капролактоном или γ-октанолактоном существенно усиливало QS-ингибирующее действие подобных композиций, при изоболографическом анализе оцениваемое как взаимодополняющий (аддитивный) или взаимно потенцируемый (супераддитивный) эффекты.
“Кворум сенсинг” (англ.: quorum sensing, QS) – это процесс химической коммуникации между бактериальными клетками, основанный на осуществляемых ими биосинтезе, секреции, рецепции и скоординированном ответе на малые сигнальные молекулы, называемые автоиндукторами (Whiteley et al., 2018). Итоговым результатом подобного взаимодействия является синхронное изменение профиля транскрипционной активности бактериальной популяции, наделяющее прокариотические сообщества некоторыми свойствами многоклеточных организмов (Mukherjee, Bassler, 2019).
Известным таксоном, реализующим феномен “кворум сенсинга”, является род Chromobacterium, у представителей которого межклеточная коммуникация опосредуется автоиндукторами из группы ацилированных гомосеринлактонов (АГЛ), образуемых синтазой CviI и воспринимаемых белком-рецептором CviR. Последний, предсуществующий в цитоплазме бактериальных клеток в виде гомодимера, после взаимодействия с двумя молекулами АГЛ переходит из “закрытой” в “открытую” конформацию и связывается С-концевыми доменами с хромосомной ДНК в зонах палиндромов CTGNCCNNNNGGNCAG, где активирует транскрипцию расположенных рядом генов: системы секреции VI типа (CV_1432), хитиназы (CV_4240), транскрипционного регулятора (CV_0577) и гуаниндезаминазы (CV_0578), а также синтазы cviI, что в последнем случае формирует каноническую петлю положительной обратной связи автоиндукции (Stauff, Bassler, 2011). Наиболее же известным фенотипическим проявлением, находящимся под контролем “кворум сенсинга” у Chromobacterium spp., является образование сине-фиолетового пигмента виолацеина, синтезируемого из аминокислоты триптофана под контролем vioABCDE-оперона, промотор которого также имеет сайт для специфического связывания белка CviR (Swem et al., 2009).
Поскольку биосинтез виолацеина позволяет прямо оценивать активность системы QS, хорошо визуально обнаруживается и доступен для количественной регистрации, основанный на нем биотест стал популярной моделью при исследовании различных аспектов “кворум сенсинга” у бактерий (Kothari et al., 2017). При этом наиболее востребованным для указанных целей является лабораторный штамм C. violaceum 026, производный от “дикого” изолята C. violaceum ATCC 31532, но, в отличие от последнего, имеющий инсерцию транспозона mini-Tn5 в гене синтазы cviI (McClean et al., 1997). В результате указанного мутационного события C. violaceum 026 утратил способность к образованию собственного автоиндуктора N-гексаноил-L-гомосеринлактона (С6-АГЛ) и, как следствие, спонтанному синтезу пигмента виолацеина, но сохранил возможность его восстановления в присутствии экзогенно вносимого С6-АГЛ. Несколько лет назад C. violaceum ATCC 31532 и производный от него лабораторный штамм CV026 были реклассифицированы как C. subtsugae (Harrison, Soby, 2020) с сохранением за ними исходных номеров в международных коллекциях и неизменности представлений о реализуемых ими механизмах межклеточной химической коммуникации.
Одним из направлений использования биотеста на основе C. subtsugae 026 является поиск ингибиторов “кворум сенсинга”, актуальность которого определяется наличием аналогичных стереотипно устроенных систем у широкого круга зоопатогенных и фитопатогенных протеобактерий, использующих химическую коммуникацию для скоординированной экспрессии факторов вирулентности и образования биопленок (Remy et al., 2018). При этом на фоне разнообразия предлагаемых подходов, включающих химическую инактивацию автоиндукторов, блокаду воспринимающих их рецепторных белков, а также запускаемых ими внутриклеточных сигнальных каскадов (Zhou et al., 2020), привлекательной альтернативой является поиск природных ингибиторов “кворум сенсинга”, присутствующих в составе лекарственных растений, используемых традиционной (народной) медициной для терапии широкого спектра инфекционных состояний (Дерябин и соавт., 2021). В частности, в одной из наших предшествующих работ скрининг широкого спектра восточно-европейских лекарственных растений показал наиболее выраженную способность к ингибированию “кворум сенсинга” у экстрактов коры дуба и листьев эвкалипта (Tolmacheva et al., 2014). В свою очередь химический анализ экстракта коры дуба позволил идентифицировать в нем молекулярную композицию из семи биоактивных соединений, в совокупности воспроизводящих не менее 95% QS-ингибирующего эффекта исходного растительного экстракта (Deryabin, Tolmacheva, 2015).
Целью настоящего исследования явилось продолжение работ в обозначенном направлении, а именно – анализ природы QS-ингибирующей активности экстракта листьев эвкалипта с идентификацией в нем известных и новых растительных молекул, эффективно ингибирующих “кворум сенсинг” в биотесте на C. subtsugae 026 (ранее – C. violaceum 026).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Бактериальный штамм. В работе использован лабораторный штамм C. subtsugae 026 = NCTC 13274, полученный из National Collection of Type Cultures (UK Health Security Agency, Великобритания). Его генетические особенности, включающие инсерцию транспозона mini-Tn5 в ген синтазы cviI, а также сохранение функциональных cviR гена и vioABCDE-оперона, описаны выше.
Культивирование данного штамма проводили на LB-бульоне при 27°C. Индукцию QS-контролируемого биосинтеза виолацеина запускали внесением химически синтезированного аналога С6-АГЛ с чистотой ≥98% (CAS 147852-83-3) (“Cayman Chemicals”, США), структурная формула которого приведена на рис. 1а.
Рис. 1.
Структурные формулы N-гексаноил-L-гомосерин лактона (а), γ-капролактона (б) и γ-октанолактона (в).

Растительный материал. Объектом исследования являлись листья эвкалипта прутовидного (международное название согласно APG II – Eucalyptus viminalis Labill), находящиеся в сухом измельченном виде в составе коммерчески доступного препарата производства АО “Красногорсклексредства” (Россия); № ЛСР-000609/08, дата выпуска – 11/2021.
Для получения экстракта, в соответствии с инструкцией производителя, к 24 г растительного материала добавляли 200 мл стерильной дистиллированной воды, кипятили на водяной бане (100°С) в течение 15 мин, после чего охлаждали при комнатной температуре в течение 45 мин. Полученный водный экстракт центрифугировали при 1000 об./мин в течение 10 мин для удаления твердых частиц, а супернатант дополнительно фильтровали через шприцевой фильтр из полиэфирсульфона (“Membrane Solutions LLC”, США) с размером пор 0.4 мкм. Полученный экстракт высушивали при 60°С, взвешивали (выход составил 2.94 г или 12.25% от веса исходного растительного материала) и хранили при ‒20°С. Дальнейшие эксперименты выполняли исходя из весовых характеристик сухого экстракта, перерастворяя его в метаноле (для химического анализа) или стерильной дистиллированной воде (для биологического тестирования).
Химический анализ. Исследование компонентного состава экстракта листьев эвкалипта прутовидного проводили методом газовой хроматографии с масс-спектрометрией (ГХ-МС).
Предварительно 10 мг исследуемого сухого экстракта вносили в 1 мл метанола и тщательно перемешивали. Последующий анализ выполняли с использованием газового хроматографа с масс-селективным детектором QCMS-QP 2010 Plus (“Shimadzu”, Япония), снаряженного колонкой HP-5MS (длина 30.0 м, диаметр 0.25 мм). Исследуемый образец объемом 10 мкл вводили в аналитическую ячейку хроматографа с помощью микрошприца Gastight 1700 (“Hamilton”, США). В качестве газа-носителя использовали гелий (99.999%) при постоянной скорости потока 1 мл/мин. Исходная температура печи колонки составляла 100°С; температуру повышали со скоростью 20°С/мин до 290°С. Инжектор устанавливали на 200°С, а детектор на 290°С.
Первичную обработку полученных хроматограмм и масс-спектров проводили с использованием штатного программного обеспечения: GC-MS Solutions и GC-MS PostRun Analysis (“Shimadzu”, Япония). Окончательную идентификацию соединений осуществляли путем сопоставления времени их удерживания и характерных масс-спектров, представленных в библиотеках NIST, Mainlib, CAS, Wiley9 и DD2012. Относительное присутствие отдельных идентифицированных компонентов в экстракте выражали в процентах, соответствующих площади определенного пика в сравнении с суммарной площадью всех пиков на хроматограмме.
Химические соединения – аналоги малых молекул растительного происхождения. По результатам химического анализа в исследование были включены γ-капролактон (CAS: 695-06-7) и γ-октанолактон (CAS: 104-50-7) со степенью чистоты 98 и 97% соответственно, предоставленные “Sigma-Aldrich” (США). Структурные формулы этих молекул приведены на рис. 1б, 1в.
Исследование антибактериальной и QS-ингибирующей активностей растительного экстракта и малых молекул растительного происхождения в биотесте на C. subtsugae 026 проводилось методом серийных разведений в жидкой питательной среде, что позволило количественно охарактеризовать выраженность искомых эффектов величинами минимальных рост-ингибирующих (МИК) и эффективных QS-ингибирующих концентраций (ЕС).
На подготовительном этапе в LB-бульоне формировали серии двукратных разведений исследуемого растительного экстракта или малых молекул растительного происхождения в диапазоне концентраций от 0.3 до 10 000 мкг/мл. В каждое исследование включали дополнительные пробы LB-бульона, не содержащие названных компонентов и используемые в качестве положительного (рост тест-штамма) и отрицательного (стерильного) контролей. На следующем этапе подготовленными пробами в объемах по 100 мкл заполняли ячейки стерильных 96-луночных планшетов (“Jet Biofil”, Канада-Китай), в которые дополнительно вносили по 100 мкл С6-АГЛ в концентрации 0.02 мкг/мл и инокулировали 20 мкл суточной культуры C. subtsugae 026. Для развития анализируемых эффектов в отношении использованного тест-штамма в условиях его контролируемой индукции планшеты инкубировали при 27°C в течение 1 сут.
Оценку результатов эксперимента проводили с использованием многофункционального микропланшетного ридера Infinite 200 PRO (“Tecan”, Австрия), последовательно регистрируя: (1) оптическую плотность биомассы при 450 ± 5 нм как показатель влияния исследуемых компонентов на рост тест-штамма; (2) количество пигмента виолацеина после его этанольной экстракции при 600 ± 5 нм как показатель влияния на активность системы “кворум сенсинга”. Для этого биомассу осаждали при 13 000 об./мин в течение 5 мин, супернатант удаляли, пигмент извлекали путем добавления к каждой пробе по 230 мкл 96% этанола, после чего депигментированную биомассу осаждали центрифугированием в том же режиме, а полученный этанольный экстракт переносили в ячейки 96-луночного планшета для измерений. Значения поглощения отрицательного контроля вычитали, значения положительного контроля принимали за 100%.
При исследовании эффектов композиций из растительного экстракта и малых молекул растительного происхождения их в объемах по 100 мкл попарно вносили в лунки стерильных 96-луночных планшетов в перпендикулярных друг другу направлениях, в результате чего сформированные объемы по 200 мкл содержали различные концентрационные соотношения. Пробами сравнения являлись ряды разведений, содержащие только один из тестируемых компонентов, а также положительный и отрицательный контроли. Дальнейшие инокуляцию C. subtsugae 026, его индукцию С6-АГЛ, культивирование и учет результатов исследования проводили, как описано выше.
Статистическая обработка результатов исследования. Все эксперименты выполнены не менее чем в пяти повторностях. Полученные результаты обработаны в программе Excel для Windows 10. Антибактериальный эффект выражен значениями МИК50 и МИК100, соответствующими 50 и 100% подавления роста тест-штамма. В свою очередь, QS-ингибирующая активность охарактеризована величинами EC50 и EC100, соответствующими аналогичной интенсивности воздействия на биосинтез пигмента виолацеина в растущей культуре. Эффекты композиций растительного экстракта и малых молекул растительного происхождения оценены методом изоболографического анализа (Tallarida, 2006), предусматривающим учет расположения результативных точек в системе координат, описывающих значения EC50 для каждого из исследованных компонентов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дизайн исследования предусматривал использование биотеста на C. subtsugae 026 для первичной характеризации цельного экстракта листьев эвкалипта прутовидного, идентификацию присутствующих в нем природных компонентов с последующим доказательством собственной биоактивности отдельных обнаруженных химических соединений или сформированных на их основе композиций.
Анализ эффектов цельного растительного экстракта в биотесте на C. subtsugae 026. Выполнение количественного биотеста на жидкой питательной среде с использованием предварительно высушенного экстракта листьев эвкалипта прутовидного в концентрациях от 0.3 до 10 000 мкг/мл позволило констатировать существование широкого диапазона концентраций, в котором его QS-ингибирующая активность развивалась в отсутствии или при слабой выраженности рост-ингибирующего эффекта (рис. 2). Так, если для полного подавления бактериального роста (МИК100) требовалась максимальная концентрация тестируемого экстракта, то абсолютное блокирование биосинтеза виолацеина (ЕС100) достигалось уже в концентрации 1250 мкг/мл (табл. 1). В свою очередь, концентрация экстракта, обусловливающая 50%-ое ингибирование QS-контролируемого биосинтеза пигмента виолацеина в биотесте на C. subtsugae 026, составляла 130 мкг/мл против 5666.7 мкг/мл, требующихся для 50%-го подавления бактериального роста (соотношение МИК50/EC50 = 43.6). Следует также отметить, что если рост-ингибирующий эффект развивался при концентрациях, лишь незначительно уступающих присутствию экстрагируемых компонентов в препарате, приготовленном в соответствии с инструкцией производителя (по сухому веществу 14 700 мкг/мл), то QS-ингибирующая активность сохранялась при его более чем 100-кратном разведении.
Рис. 2.
Оценка рост-ингибирующего и QS-ингибирующего эффектов цельного экстракта эвкалипта прутовидного в биотесте на C. subtsugae 026. Обозначения: по оси абсцисс – концентрации действующих соединений (мкг/мл); по оси ординат слева, сплошная линия на графиках (1) – оптическая плотность биомассы (ОП450); по оси ординат справа, пунктирная линия на графиках (2) – оптическая плотность пигмента (ОП600).
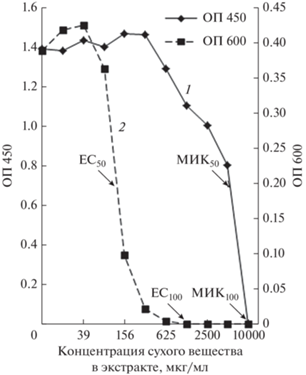
Таблица 1.
Характеристика эффектов экстракта листьев эвкалипта прутовидного и идентифицированных в его составе γ-лактонов в количественном биотесте на C. subtsugae 026
| Исследуемый экстракт или химическое соединение | Параметры рост-ингибирующей активности, мкг/мл | Параметры QS-ингибирующей активности, мкг/мл | ||
|---|---|---|---|---|
| МИК100 | МИК50 | ЕС100 | ЕС50 | |
| Экстракт листьев эвкалипта прутовидного | 10 000 | 5666.7 | 1250 | 130 |
| γ-Капролактон | 10 000 | 2666.7 | 2500 | 354.2 |
| γ-Октанолактон | 5000 | 708.3 | 625 | 145.6 |
Тем самым результаты проведенного исследования расширяют представления о природе биологической (в т.ч. терапевтической) активности экстрактов листьев эвкалипта. При этом полученные данные хорошо согласуются с недавно описанным QS-ингибирующим действием экстракта листьев эвкалипта клубовидного (Eucalyptus camaldulensis), в биотесте на C. subtsugae 026 развивающимся в сходном диапазоне концентраций – от 97 до 780 мкг/мл (Moradi et al., 2020). Аналогичные эффекты зафиксированы и при исследовании экстракта листьев эвкалипта шаровидного (Eucalyptus globulus), ингибирующее действие которого на биосинтез виолацеина у дикого штамма C. violaceum ATCC 12472 дополнялось подавлением QS-контролируемого роения, образования пиоцианина и формирования биопленки у коллекционных и клинических изолятов Pseudomonas aeruginosa со стереотипно организованными системами плотностно-зависимой химической коммуникации (Sagar et al., 2022).
Химический анализ экстракта листьев эвкалипта прутовидного. Использование метода ГХ-МС обеспечило достаточно высокое разрешение между большинством компонентов (пиков) на полученной хроматограмме, среди которых 31 соединение со временем удержания на колонке в диапазоне от 2.595 до 11.070 мин были идентифицированы с вероятностью не менее 80%.
Наиболее значительным присутствием в анализируемом экстракте характеризовались четыре соединения: гидроксиметилфурфурол (время удержания 4.830 мин; относительное содержание 4.2%), 1,2,3-бензентриол/пирогаллол (время удержания 5.990 мин; относительное содержание 4.0%), 2,3-дигидро-3,5-дигидрокси-6-метил-4H-пиран-4-1 (время удержания 4.180 мин; относительное содержание 3.8%) и розифолиол (время удержания 8.935 мин; относительное содержание 3.8%). Пятое соединение со временем удержания на колонке 7.600 мин, также характеризующееся относительно высоким содержанием в анализируемом экстракте (6.4%), идентифицировалось с вероятностью менее 75%, в связи с чем было исключено из последующего анализа.
При этом для двух из названных компонентов различные варианты QS-ингибирующей активности ранее уже были экспериментально показаны, или ее наличие предполагалось по результатам молекулярного докинга (табл. 2). Наиболее хорошо подобные эффекты документированы для пирогаллола, биосинтетически связанного с галловой кислотой (которая также обнаруживается в анализируемом экстракте) и образующегося при ее декарбоксилировании в процессе частичной ферментации растительного сырья (Tor et al., 1996). Впервые ингибирующее воздействие пирогаллола и его аналогов на систему “кворум сенсинга” описано на примере морской люминесцирующей бактерии Vibrio harveyi (Ni et al., 2008) и после критического обсуждения (Defoirdt et al., 2013; Bali et al., 2019) подтверждено в биотесте на C. subtsugae 026 (Инчагова и соавт., 2019). В свою очередь аналогичная активность 2,3-дигидро-3,5-дигидрокси-6-метил-4H-пирана-4-1 к настоящему времени проанализирована только на модели in silico, показавшей возможность его результативного связывания с рецепторным белком CviR у C. violaceum ATCC 12472 (Mashamba et al., 2022), но пока не получившей своего экспериментального подтверждения на моделях in virto.
Таблица 2.
Малые молекулы растительного происхождения с ранее показанной активностью в отношении системы “кворум сенсинга” у Chromobacterium spp., идентифицированные в составе экстракта листьев эвкалипта прутовидного
| Идентифицированное соединение | Структурная формула | Относительное содержание в экстракте, % | Варианты активности in silico или in vitro |
|---|---|---|---|
| 1-Метил-4-пропан-2-илбензол (цимол) |  |
0.2 | Ингибирование биосинтеза виолацеина у C. violaceum ATCC 12472 |
| 2,3-Дигидро-3,5-дигидрокси-6-метил-4H-пиран-4-1 | 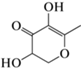 |
3.8 | Связывание с рецепторным белком CviR у C. violaceum ATCC 12472 |
| 1,2,3-Бензентриол (пирогаллол) | 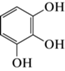 |
4.0 | Ингибирование биосинтеза виолацеина в биотесте на C. subtsugae 026 |
| 3,4,5-Тригидроксибензойная (галловая) кислота | 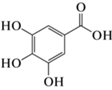 |
0.1 | Связывание с рецепторным белком CviR; ингибирование биосинтеза виолацеина у C. violaceum ATCC 12472 |
| 4-((1E)-3-Гидрокси-1-пропенил)-2-метокси-фенол (конифериловый спирт) | 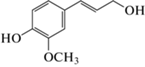 |
1.3 | Ингибирование биосинтеза виолацеина в биотесте на C. subtsugae 026 |
| Гексадекановая (пальмитиновая) кислота | 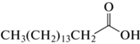 |
0.9 | Связывание с рецепторным белком CviR у Chromobacterium spp. |
Среди других 27 компонентов, характеризующихся относительным содержанием в диапазоне 0.4‒2.8%, по результатам проведенного химического анализа было идентифицировано еще 4 соединения с ранее показанной активностью в отношении системы “кворум сенсинга” у Chromobacterium spp. (табл. 2). Подобное заключение было сделано в отношении 1-метил-4-пропан-2-илбензола/цимола (время удержания 3.185 мин; относительное содержание 0.2%), описанного среди растительных монотерпенов, подавляющих QS-контролируемый биосинтез виолацеина у C. violaceum ATCC 12472 (Ahmad et al., 2015); 4-((1E)-3-гидрокси-1-пропенил)-2-метоксифенола, известного также как “конифериловый спирт” (время удержания 8.410 мин; относительное содержание 1.3%) и ранее показавшего свою активность в биотесте на C. subtsugae 026 (Deryabin, Tolmacheva, 2015); 3,4,5-тригидроксибензойной/галловой кислоты (время удержания 6.895 мин; относительное содержание 0.1%), на модели in silico описанной среди других растительных фенолов, формирующих аффинные взаимодействия с рецептором CviR (Santos et al., 2021) и в эксперименте in vitro обусловившей умеренное подавление биосинтеза виолацеина у C. violaceum ATCC 12472 (Borges et al., 2014); а также гексадекановой/пальмитиновой кислоты (время удержания 9.480 мин; относительное содержание 0.9%), по результатам молекулярного докинга показавшей возможность результативного взаимодействия с белком CviR (Vargas et al., 2021).
Таким образом, результаты проведенного химического анализа свидетельствовали о присутствии в составе анализируемого растительного экстракта сразу нескольких малых молекул (10.3% от общей массы экстрагированных компонентов) с прогнозируемой или доказанной QS-ингибирующей активностью, что согласуется с представлениями о существовании аналогичных молекулярных композиций, ранее описанных в составе экстрактов коры дуба (Deryabin, Tolmacheva, 2015) или семян авокадо (Dereli et al., 2022).
Кроме того, среди обнаруженных молекул обращали на себя внимание два минорных компонента со временем удерживания на колонке в узком диапазоне от 4.525 до 4.700 мин, идентифицированные как γ-капролактон и γ-октанолактон (относительное содержание в экстракте по 0.4% каждый). При этом их структурные особенности, заключающиеся в наличии пятичленного лактонного кольца с присоединенным к нему линейными радикалами различного химического состава и полярности (рис. 1), демонстрировали близость с природными автоиндукторами плотностно-зависимой коммуникации – ацилированными гомосеринлактонами, что позволяло предполагать возможность функциональной интерференции между названными группами малых молекул. В то же время в доступной литературе сведения о QS-ингибирующей активности γ-лактонов растительного происхождения до настоящего времени отсутствуют.
Характеристика QS-ингибирующей активности γ-лактонов, обнаруженных в экстракте листьев эвкалипта прутовидного. В исследование были включены химически синтезированные аналоги γ-капролактона и γ-октанолактона (степень чистоты 97‒98%). Их тестирование в количественном биотесте на C. subtsugae 026 позволило впервые выявить и охарактеризовать рост-ингибирующий и QS-ингибирующий эффекты данных молекул (табл. 1). При этом γ-октанолактон показал себя как более активное соединение, значения ЕС50 = 145.6 мкг/мл и ЕС100 = 625 мкг/мл которого оказывались в 2‒4 раза ниже требующихся для подавления QS-контролируемого биосинтеза виолацеина с использованием γ-капролактона (ЕС50 = 354.2 мкг/мл и ЕС100 = 2500 мкг/мл). Кроме того, у обоих названных соединений зафиксирован слабый рост-ингибирующий эффект, формирующийся в концентрациях, кратно превосходящих требуемые для развития QS-ингибирующего эффекта (соотношения МИК50/EC50 соответствовали 7.5 для γ-капролактона и 4.9 для γ-октанолактона).
В то же время использование анализируемых γ-лактонов в количествах, соответствующих их содержанию в составе экстракта листьев эвкалипта прутовидного, позволило зафиксировать достаточно слабый эффект (не достигающий 50% подавления QS-контролируемого биосинтеза виолацеина) при использовании γ-октанолактона или его отсутствие при использовании γ-капролактона, что может объясняться выходом из диапазона их эффективных концентраций. Указанное обстоятельство явилось основанием для предположения о том, что в естественных условиях биоактивность γ-лактонов реализуется в составе молекулярной композиции из нескольких химических соединений, присутствующих в экстракте листьев эвкалипта прутовидного (см. выше) и обеспечивающих совместный QS-ингибирующий эффект.
Оценка воздействия молекулярных композиций с участием γ-лактонов на QS-контролируемый биосинтез виолацеина у C. subtsugae 026. Эффекты γ‑лактонов как участников молекулярных композиций проанализированы при обогащении ими цельного экстракта листьев эвкалипта прутовидного, содержащего всю совокупность малых молекул растительного происхождения. При этом серии разведений цельного экстракта были обогащены γ-капролактоном или γ-октанолактоном в диапазоне концентраций 1‒10 000 мкг/мл, что делало их относительное содержание сопоставимым с таковым у основных компонентов, обнаруженных в анализируемом растительном экстракте.
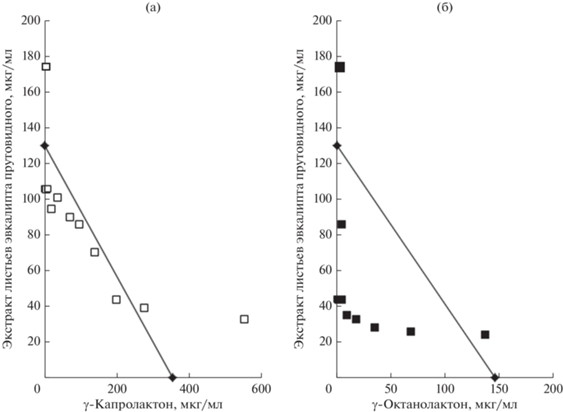
Исследование комбинированного действия сформированных композиций с последующим анализом полученного результата методом изоболографического анализа позволило констатировать увеличение выраженности QS-ингибирующего эффекта в отношении C. subtsugae 026, превосходящего таковой при использовании как индивидуальных молекул, так и цельного растительного экстракта. Так анализ композиций с участием γ-капролактона показал сосредоточение большинства экспериментальных точек вдоль линии изоболы (рис. 3а), что указывало на развитие взаимодополняющего (аддитивного) эффекта. В свою очередь, обогащение экстракта листьев эвкалипта прутовидного γ-октанолактоном приводило к формированию взаимно потенцируемого (супераддитивного) эффекта, показателем которого являлось расположение большинства экспериментальных точек существенно ниже линии изоболы, соединяющей значения ЕС50 при изолированном использовании каждого из участников композиции (рис. 3б). Соответственно, в широком диапазоне концентраций γ‑октанолактона концентрации цельного растительного экстракта, требуемые для достижения 50% ингибирования QS-контролируемого биосинтеза виолацеина у C. subtsugae 026, могли быть снижены в 4‒6 раз относительно эффектов при их раздельном использовании.
Рис. 3.
Изоболографический анализ эффекта комбинаций γ-капролактона (a) и γ-октанолактона (б) с цельным экстрактом листьев эвкалипта прутовидного на QS-контролируемый биосинтез пигмента виолацеина в биотесте на C. subtsugae 026. Изоболы представлены в виде прямых линий, соединяющих значения ЕС50 для каждого отдельного компонента. Результат совместного действия показан путем нанесения на график точек с координатами, соответствующими концентрациям в композиции, обеспечивающим достижение ЕС50.
Лекарственные растения традиционно рассматриваются в качестве важнейших источников природных соединений с различными вариантами биологических активностей, значимых для медицинского и ветеринарного использования. При этом одним из актуальных направлений подобного поиска является обнаружение и исследование их воздействия на системы плотностно-зависимой химической коммуникации у зоопатогенных и фитопатогенных бактерий, в настоящее время рассматриваемых в качестве новой перспективной “мишени” для антимикробной терапии.
Результатом проведенного исследования явилась демонстрация подобной активности у экстракта листьев эвкалипта прутовидного с идентификацией в нем композиции растительных молекул, ингибирующих систему химической коммуникации лабораторного штамма C. subtsugae 026 (ранее – C. violaceum 026). При этом полученные данные хорошо согласуются с ранее описанными аналогичными эффектами экстрактов листьев эвкалипта клубовидного и эвкалипта шаровидного, что свидетельствует о типичности QS-ингибирующего эффекта у названных растительных субстратов и объясняет эффективность их использования для профилактики и терапии широкого круга инфекционных состояний. В свою очередь, проведение химического анализа позволило обнаружить в экстракте листьев эвкалипта прутовидного целый ряд малых молекул растительного происхождения (пирогаллол; 2,3-дигидро-3,5-дигидрокси-6-метил-4H-пиран-4-1; цимол; 4-((1E)-3-гидрокси-1-пропенил)-2-метоксифенол; галловая и пальмитиновая кислоты), ингибирующее воздействие которых на систему плотностно-зависимой химической коммуникации у Chromobacterium spp. ранее уже было показано в экспериментах in vitro или предсказано на моделях in silico.
Среди минорных соединений, также идентифицированных в исследуемом растительном экстракте, наше внимание было обращено на γ-лактоны, структуры которых демонстрировали существенное сходство с природными автоиндукторами плотностно-зависимой коммуникации у бактерий – ацилированными гомосеринлактонами, что предполагает возможность функциональной интерференции между названными группами малых молекул. Проведенный анализ их химически синтезированных аналогов в биотесте на C. subtsugae 026 подтвердил данное предположение и впервые показал наличие QS-ингибирующей активности у γ-капролактона и γ-октанолактона. В то же время использование названных γ-лактонов в количествах, соответствующих присутствию в экстракте листьев эвкалипта прутовидного, не позволяло достичь выраженного QS-ингибирующего эффекта, что объяснялось их выходом из диапазона биоактивных концентраций.
Последующее обогащение γ-лактонами исходного растительного экстракта показало возможность существенного усиления совместной QS-ингибирующей активности, при использовании γ-капролактона развивающегося как взаимодополняющий (аддитивного) эффект, а при использовании γ-октанолактона позволяющего достичь взаимно потенцируемого (супераддитивного) эффекта.
Обсуждая фундаментальный аспект полученного результата, следует указать на развитие представлений о многокомпонентной природе QS-ингибирующего эффекта растительных экстрактов, функционирующих по принципу молекулярных композиций с взаимодополняющими и взаимно усиливающими эффектами. Кроме того, в качестве “нового” участника подобных композиций результаты проведенного исследования впервые показывают соединения из группы γ‑лактонов, ранее преимущественно описываемые как вкусовые и ароматические компоненты растительного происхождения (Labuda, 2009). В свою очередь практически-ориентированный аспект проведенного исследования определяется демонстрацией возможности использования γ-лактонов для обогащения цельных растительных экстрактов или формирования на их основе композиций из малых молекул растительного происхождения, что позволяет существенно усилить воздействие на системы плотностно-зависимой химической коммуникации. При этом отсутствие у γ-лактонов токсических или иных нежелательных свойств, а также разрешенное использование некоторых из них в качестве вкусо-ароматических добавок, существенно снижает порог для их возможного включения в схемы фитотерапии инфекционных заболеваний.
Список литературы
Дерябин Д.Г., Галаджиева А.А., Косян Д.Б., Дускаев Г.К. Растительные ингибиторы плотностно-зависимой коммуникации у бактерий: разнообразие структур, механизмов действия и источников происхождения // Микробиология. 2021. Т. 90. С. 660–680.
Deryabin D.G., Galadzhieva A.A., Kosyan D.B., Duskaev G.K. Plant-derived inhibitors of density-dependent communication in bacteria: diversity of structures, bioactivity mechanisms, and sources of origin // Microbiology (Moscow). 2021. V. 90. P. 702–720.
Инчагова К.С., Дускаев Г.К., Дерябин Д.Г. Подавление “кворум сенсинга” Chromobacterium violaceum при воздействии комбинаций амикацина с активированным углем или малыми молекулами растительного происхождения (пирогаллолом и кумарином) // Микробиология. 2019. Т. 88. С. 72–82.
Inchagova K.S., Duskaev G.K., Deryabin D.G. Quorum sensing inhibition in Chromobacterium violaceum by amikacin combination with activated charcoal or small plant-derived molecules (pyrogallol and coumarin) // Microbiology (Moscow). 2019. V. 88. P. 63–71.
Ahmad A., Viljoen A.M., Chenia H.Y. The impact of plant volatiles on bacterial quorum sensing // Lett. Appl. Microbiol. 2015. V. 60. P. 8–19.
Bali E.B., Turkmen K.E., Erdonmez D., Saglam N. Comparative study of inhibitory potential of dietary phytochemicals against quorum sensing activity of and biofilm formation by Chromobacterium violaceum 12472, and swimming and swarming behaviour of Pseudomonas aeruginosa PAO1 // Food Technol. Biotechnol. 2019. V. 57. P. 212–221.
Borges A., Serra S., Cristina Abreu A., Saavedra M.J., Salgado A., Simoes M. Evaluation of the effects of selected phytochemicals on quorum sensing inhibition and in vitro cytotoxicity // Biofouling. 2014. V. 30. P. 183–195.
Defoirdt T., Pande G.S., Baruah K., Bossier P. The apparent quorum-sensing inhibitory activity of pyrogallol is a side effect of peroxide production // Antimicrob. Agents Chemother. 2013. V. 57. P. 2870–2873.
Dereli F.T.G., Onem E., Arin E., Ozaydin A.G., Muhammed M.T. Persea americana Mill.: as a potent quorum sensing inhibitor of Pseudomonas aeruginosa PAO1 virulence // Int. J. Second. Metabol. 2022. V. 9. P. 14–26.
Deryabin D.G., Tolmacheva A.A. Antibacterial and anti-quorum sensing molecular composition derived from Quercus cortex (Oak bark) extract // Molecules. 2015. V. 20. P. 17093–17108.
Harrison A.M., Soby S.D. Reclassification of Chromobacterium violaceum ATCC 31532 and its quorum biosensor mutant CV026 to Chromobacterium subtsugae // AMB Express. 2020. V. 10. P. 202.
Kothari V., Sharma S., Padia D. Recent research advances on Chromobacterium violaceum // Asian Pac. J. Trop. Med. 2017. V. 10. P. 744–752.
Labuda I. Flavor compounds // Encyclopedia of Microbiology. 3rd ed. / Editor-in-Chief: Schaechter M. Oxford: Academic Press, 2009. P. 305–320.
Mashamba T.G., Adeosun I.J., Baloyi I.T., Tshikalange E.T., Cosa S. Quorum sensing modulation and inhibition in biofilm forming foot ulcer pathogens by selected medicinal plants // Heliyon. 2022. V. 8. P. e09303.
McClean K.H., Winson M.K., Fish L., Taylor A., Chhabra S.R., Camara M., Daykin M., Lamb J.H., Swift S., Bycroft B.W., Stewart G.S.A.B., Williams P. Quorum sensing and Chromobacterium violaceum: exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones // Microbiology (Reading). 1997. V. 143. P. 3703–3711.
Moradi F., Hadi N., Bazargani A. Evaluation of quorum-sensing inhibitory effects of extracts of three traditional medicine plants with known antibacterial properties // New Microbes New Infect. 2020. V. 38. P. 100769.
Mukherjee S., Bassler B.L. Bacterial quorum sensing in complex and dynamically changing environments // Nat. Rev. Microbiol. 2019. V. 17. P. 371–382.
Ni N., Choudhary G., Li M., Wang B. Pyrogallol and its analogs can antagonize bacterial quorum sensing in Vibrio harveyi // Bioorg. Med. Chem. Lett. 2008. V. 18. P. 1567–1572.
Remy B., Mion S., Plener L., Elias M., Chabriere E., Daude D. Interference in bacterial quorum sensing: a biopharmaceutical perspective // Front. Pharmacol. 2018. V. 9. P. 203.
Sagar P.K., Sharma P., Singh R. Inhibition of quorum sensing regulated virulence factors and biofilm formation by E-ucalyptus globulus against multidrug-resistant Pseudomonas aeruginosa // J. Pharmacopuncture. 2022. V. 25. P. 37–45.
Santos C.A, Lima E.M.F., Franco B.D.G.M., Pinto U.M. Exploring phenolic compounds as quorum sensing inhibitors in foodborne bacteria // Front. Microbiol. 2021. V. 12. P. 735931.
Stauff D.L, Bassler B.L. Quorum sensing in Chromobacterium violaceum: DNA recognition and gene regulation by the CviR receptor // J. Bacteriol. 2011. V. 193. P. 3871–3878.
Swem L.R., Swem D.L., O’loughlin C.T., Gatmaitan R., Zhao B., Ulrich S.M., Bassler B.L. A quorum-sensing antagonist targets both membrane-bound and cytoplasmic receptors and controls bacterial pathogenicity // Mol. Cell. 2009. V. 35. P. 143–153.
Tallarida R.J. An overview of drug combination analysis with isobolograms: perspectives in pharmacology // Pharmacol. Exp. Ther. 2006. V. 319. P. 1–7.
Tolmacheva A.A., Rogozhin E.A., Deryabin D.G. Antibacterial and quorum sensing regulatory activities of some traditional Eastern-European medicinal plants // Acta. Pharm. 2014. V. 64. P. 173–186.
Tor E.R., Francis T.M., Holstege D.M., Galey F.D. GC/MS determination of pyrogallol and gallic acid in biological matrices as diagnostic indicators of oak exposure // J. Agric. Food Chem. 1996. V. 44. P. 1275–1279.
Vargas E.L.G., de Almeida F.A., de Freitas L.L., Pinto U.M., Vanetti M.C.D. Plant compounds and nonsteroidal anti-inflammatory drugs interfere with quorum sensing in Chromobacterium violaceum // Arch. Microbiol. 2021. V. 203. P. 5491–5507.
Whiteley M., Diggle S.P., Greenberg E.P. Progress in and promise of bacterial quorum sensing research // Nature. 2017. V. 551. P. 313–320.
Zhou L., Zhang Y., Ge Y., Zhu X., Pan J. Regulatory mechanisms and promising applications of quorum sensing-inhibiting agents in control of bacterial biofilm formation // Front. Microbiol. 2020. V. 11. P. 589640.
Дополнительные материалы отсутствуют.


