Микроэлектроника, 2022, T. 51, № 2, стр. 110-117
Молекулярное наслаивание оксидных наноструктур на поверхности металлических матриц
Ю. К. Ежовский a, *, С. В. Михайловский a
a Санкт-Петербургский государственный технологический институт (технический университет)
190013 Санкт-Петербург, Московский проспект, д. 26, Россия
* E-mail: ezhovski1@mail.ru
Поступила в редакцию 13.07.2021
После доработки 04.10.2021
Принята к публикации 04.10.2021
- EDN: LAJZUY
- DOI: 10.31857/S0544126922020053
Аннотация
Представлены обобщенные результаты изучения процессов формирования нанослоев оксидов кремния, тантала, алюминия и хрома, полученных методом молекулярного наслаивания (атомно-слоевого осаждения) на поверхности металлических матриц: тантала, алюминия и хрома. Определены условия слоевого механизма формирования оксидных наноструктур. Проведена оценка их диэлектрических характеристик.
1. ВВЕДЕНИЕ
Системы “оксидная пленка/металл” как самостоятельно, так и в составе более сложных и многослойных структур, имеют большое значение для совершенно разных областей науки и техники – микроэлектроники [1–3], гетерогенного катализа [4–7], медицины [8–13], пищевой промышленности [14, 15], конструкционных материалов [16] и многих других. Оксидная пленка может выступать в роли защитного и/или декоративного покрытия [11, 16]; покрытия, способствующего увеличению или уменьшению адгезии какого-либо материала к металлической матрице [8–11, 13–15]; катализатора (сокатализатора) [4–7]; диэлектрика или полупроводника [1–3] и т.д.
Формирование оксидных пленок на поверхности металлов осуществляют различными физическими (например, [1, 12]), химическими (например, [6, 9, 13, 17, 18]) и электрохимическими (например, [2, 10, 11, 16]) методами и их сочетанием. Одним из немногих методов, позволяющих контролировать состав и толщину синтезируемой пленки на уровне одного монослоя (субмонослоя), является метод молекулярного наслаивания (МН) [19–23]. Это может оказывать решающее значение на свойства пленки, и важно для современной микроэлектроники, а точнее, наноэлектроники.
Метод МН разработан еще в 60-х годах XX века и известен многим под названием “атомно-слоевое осаждение”. Синтез тонкопленочных структур данным методом осуществляется путем последовательной обработки поверхности модифицируемой матрицы реагентами, являющимися прекурсорами (предшественниками) какого-либо из компонентов этих структур, по заданной программе. Например, при синтезе алюмооксидной пленки (Al2O3) на кремниевой пластине с использованием паров триметилалюминия (ТМА, Al(CH3)3) и воды (H2O) матрицей является кремний (Si), прекурсором алюминия – ТМА, а прекурсором кислорода – вода. При этом полагается, что взаимодействие реагентов с матрицей протекает только за счет химических реакций, и только с поверхностью матрицы, а точнее – с ее реакционными центрами, в качестве которых чаще всего выступают поверхностные функциональные группы. Таким образом, при последовательной попеременной обработке поверхности разными прекурсорами состав ее функциональных групп постоянно изменяется.
В случае кремниевой пластины в качестве исходных функциональных групп выступают силанольные группы (≡Si−OH), представляющие собой гидрокисльные группы (−OH), связанные с поверхностными атомами кремния. При обработке поверхности кремния (а точнее тонкого кремнийоксидного слоя на поверхности кремниевой пластины) парами триметиалюминия большая часть гидроксильных групп замещается на оксоалюмометильные ((−O−)nAl(CH3)(3 –n)). Однако при последующей обработке поверхности, модифицированной такими группами, вновь образуются гидроксильные группы, хотя уже в составе групп (=Al−OH), а не (≡Si−OH), и эти группы вновь могут взаимодействовать с парами ТМА. Использующие газофазную подачу реагентов (хотя возможна и жидкофазная подача) и имеющие самоорганизующийся характер, процессы МН позволяют осуществлять групповую обработку изделий микроэлектроники, что обеспечивает их рентабельность.
В настоящей работе представлены обобщенные результаты исследований процессов синтеза и основных диэлектрических характеристик нанослоев оксидов кремния, тантала, алюминия и хрома, полученных методом МН на поверхности металлических матриц.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение оксидных нанослоев проводилось на танталовых, хромовых и алюминиевых матрицах, широко используемых в электронном приборостроении. В качестве матриц использовались пленки этих металлов толщиной 0.1–0.5 мкм, полученные вакуумным напылением на ситалловые, поликоровые и стеклянные подложки, а также обработанные по 14 классу и прошедшие химическую полировку металлические пластины (тантал высокой чистоты марки ВЧ, содержание Ta составляет 99.9%, алюминий особо чистый марок A5N и A6N).
Аналогично с примером синтеза алюмооксидного слоя на кремниевой пластине за счет поверхностных силанольных групп, существующих на тонком приповерхностном кремнийоксидном слое здесь предполагается тот же механизм за счет групп M−OH (M = Al, Ta, Cr), существующих на тонком приповерхностном слое MOx.
Существование алюмооксидной пленки на активном металлическом алюминии, предотвращающей дальнейшее его окисление на атмосфере, широко известно. Чистая поверхность тантала без адсорбатов оказывается не менее активной, и может не только приводить к нежелательным побочным процессам разложения органической части молекул металлорганических прекурсоров в процессах химического осаждения из газовой фазы, но и взаимодействовать с N2 в атмосфере азота в достаточно мягких условиях с образованием нитридных пленок [24]. Таким образом, в стандартных условиях в воздушной атмосфере такая поверхность тантала легко образует естественный оксидный слой. Его толщина составляет порядка нескольких нанометров. Например, согласно данным [2], полученным с помощью просвечивающей электронной микроскопии, она равна 3.3 ± 0.5 нм. Аналогично ведет себя и чистая свежая поверхность хрома, на которой образуется тонкий пассивирующий оксидный слой [25], причем как на свежеполированном объемном материале, так и на свеженапыленных пленках. Согласно [14, 15], на поверхности хромирующего слоя толщиной менее 10 нм, в свою очередь находящемся на стальной фольге, присутствует гидратированный хромоксидный слой толщиной также менее 10 нм. Более того, на многокомпонентной хромсодержащей нержавеющей стали AISI 316, согласно данным рентгеновской фотоэлектронной спектроскопии, также образуется естественный пассивирующий оксидный слой толщиной около 3 нм, состоящий, в основном, из оксидов хрома и железа, причем атомное соотношение Cr/Fe в нем заметно выше со стороны внешней границы, чем в объемном материале, и уменьшается в сторону границы раздела оксидный слой-металл [16].
Эллипсометрические измерения показали, что во всех случаях на поверхности металлических пленок, используемых в данной работе в качестве матриц, имелся слой оксида толщиной ~2 нм, что хорошо согласуемся с литературными данными. Процесс синтеза оксидных нанослоев осуществлялся по аналогии с полупроводниковыми матрицами [22, 26] в вакуумно-проточной установке (давление остаточных газов не выше 10–1 Па) при взаимодействии паров хлоридов металлов (SiCl4, AlBr3, TaCl5 и СrO2Cl2) с гидроксильными группами поверхности в диапазоне температур 323–600 К и последующим гидролизом парами воды для возобновления гидроксильного покрова. Поверхностные реакции паров галогенидов и воды должны проходить в неравновесных условиях, обеспечивающих полноту их протекания, для чего необходима достаточно высокая активность гидроксильных групп поверхности.
Несмотря на то, что гидроксильные группы поверхностных оксидов металлических матриц обладают достаточно высокой протонодонорной способностью [27], электроннонасыщенный остов матрицы значительно подавляет индуктивный эффект тонкого поверхностного оксида, что снижает протонизацию гидроксилов. Поэтому для их активации использовался триэтиламин (ТЭА). Этот реагент, обладая сильными протоноакцепторными свойствами, одновременно может выполнять ряд функций: стабилизировать гидроксильный покров дополнительными водородными связями, активировать реакцию за счет образования промежуточного комплекса и связывать выделяющийся хлористый водород, что обеспечивает полноту протекания реакций. При синтезе триэтиламин, не склонный к реакциям нуклеофильного замещения, подавался с парами воды (H2O + N(C2H5)3), при этом образующийся на поверхности комплекс типа $ \equiv {\kern 1pt} {\text{Si}}{\kern 1pt} - {\kern 1pt} {\text{OH}} \cdots {\text{N(}}{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{)}}}_{3}}$ способствовал протонизации гидроксильных групп.
Толщина синтезируемых нанослоев определялась по эллипсометрическим параметрам Δ и Ψ, и рассчитывалась в приближение однослойной модели Друде-Тронстона [28]. Параметры Δ и Ψ измерялись на эллипсометре, собранном по схеме PQSA [29] с фиксированным компенсатором. В качестве источника линейно поляризованного света использовался лазер ЛГ-75 с длиной волны излучения 632.8 нм. Для повышения точности измерений осуществлялась магнитная модуляция светового луча и погрешность в определении параметров Δ и Ψ не превышала ±0.1/. Толщина синтезируемых слоев составляла 0.5–40 нм.
Состав слоев контролировался по данным рентгено-фотоэлектронной спектроскопии (РФЭС) с использованием спектрометра НР-5950А (излучение AlKα c ЕKα = 1486 эВ). Отсчет энергии осуществлялся по углеродному стандарту С1s1/2 c Ест = 285.0 эВ. Максимальная глубина проникновения зонда в поверхностный слой при указанных энергиях не превышала 8 нм [30]. Идентификацию энергетических линий исследуемых элементов (Еs) проводили по данным работ [3, 30], и состав слоев определяли с использованием соотношения:
(1)
$\frac{{{{I}_{1}}}}{{{{I}_{2}}}} = \frac{{{{n}_{1}}{{\sigma }_{1}}\sqrt {{{E}_{{K2}}}} }}{{{{n}_{2}}{{\sigma }_{2}}\sqrt {{{E}_{{K1}}}} }},$3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изучение зависимостей толщины слоя (d) от количества циклов обработки (N) (рис. 1) показало, что во всем диапазоне N соблюдался их линейный характер:
Рис. 1.
Динамика роста пленок с использованием ТЭА: а – Al2O3 на Та; б – Та2О5 на Al; при Тп = 423 К (1), Тп = 473 К (2) и Тп = 573 К (3).
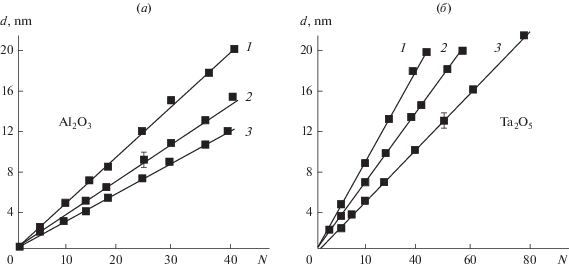
Значение коэффициента d0, (параметра роста слоя), показывающего усредненную толщину пленки, синтезируемой за один цикл, позволяет оценить степень заполнения поверхности и служит критерием для определения механизма формирования пленок.
Анализ серии зависимостей d = f(N), полученных при различных температурах подложки для слоев SiO2, Al2O3 и Та2О5, позволил установить влияние этого фактора на параметр роста слоев (рис. 2). По этой зависимости можно судить о механизме формирования слоев и определить условия слоевого роста наноструктур.
Рис. 2.
Температурная зависимость параметра роста пленок SiO2 (1), Та2О5 (2), Al2O3 (3) и оксида хрома (4) на танталовой и алюминиевой матрицах.
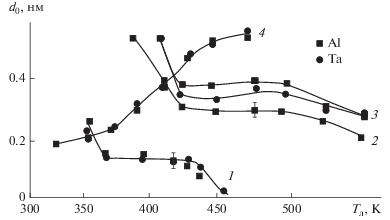
Первоначальное снижение параметра d0 с ростом температуры синтеза для всех оксидов, кроме оксида хрома, указывает на полимолекулярную сорбцию реагентов и их взаимодействие с парами H2O в адсорбированном слое с образованием гидратированного оксида. При дальнейшем повышении температуры подложки (Тп) для исследуемых оксидов, кроме оксида хрома наблюдался участок стабилизации параметра d0, что позволило полагать о реализации слоевого механизма. Для SiO2 слоевой рост удалось реализовать в достаточно узком диапазоне Тп = 370–430 К (рис. 2) с параметром роста почти вдвое меньше средних размеров тетраэдров для этого оксида. Более высокие температуры приводили к резкому снижению d0. Участок слоевого роста для Та2О5 с параметром роста, близким к монослойному (d0 = 0.3 нм), и с диапазоном Тп = 423–523 К выявился достаточно отчетливо. Для Al2O3 он составлял около 0.4 нм и, если предположить, что хемосорбция Al2Br6 осуществляется в той же ориентации, что и на кремнии [3], то соотношение d0/d0(расч)= Θ ≈ 0.7. По всей вероятности на этих матрицах в реакцию вовлекаются различные типы ОН-групп, и она протекает с другими возможными ориентациями димера Al2Br6. В любом случае, наблюдаемая величина d0 = 0.4 нм может характеризовать слоевой механизм роста этого оксида. Тем не менее, полученные данные указывают на сравнительно малую активность и термоустойчивость гидроксильных групп поверхности металлических матриц, несмотря на то, что оксиды тантала и алюминия проявляют сравнительно высокую кислотность.
Особенностью динамики роста нанослоев оксида хрома по сравнению с другими оксидами является возрастание угла наклона прямых зависимостей d = f(N), а, следовательно, и параметра роста d0 (рис. 2) с увеличением температуры синтеза. Это указывает на активационный характер поверхностных реакций и увеличение выхода синтезируемого продукта. По всей вероятности это вызвано малой толщиной естественного оксидного слоя (~2 нм) и сильным ингибирующим действием остова металлических матриц, не проявляющей необходимой эффективной электроотрицательности.
Изучение состава слоев, полученных с использованием ТЭА, по результатам РФЭС, показало, что спектры не содержат каких либо пиков вблизи энергий 401–402 эВ, характерных для 1s-уровней азота группы ${\text{NR}}_{4}^{ + }$ [30]. Следовательно, в процессе синтеза ТЭА полностью десорбируется. По сопоставлению площадей пиков кислорода (Есв = 530–534 эВ) и соответствующих металлов (Есв = 74.6 эВ – Al2р, Есв = 118.8 эВ – Al2s и Есв = = 26.8 эВ – Та4f) было определено соотношение кислорода и металла в оксидном слое при различных температурах синтеза. Данные представлены в табл. 1.
Таблица 1.
Соотношение кислорода и металла в слоях оксидов алюминия и тантала в зависимости от температуры синтеза
| Тп, K | 423 | 473 | 523 | 553 | 573 |
| [O]/[Al] | 4.0 | 2.3 | 1.8 | 1.6 | 1.6 |
| [O]/[Ta] | 4.6 | 3.0 | 2.6 | 2.5 | 2.5 |
Согласно этим данным можно полагать, что синтезированные оксиды являются Та2О5 и Al2O3 соответственно. Повышенное содержание кислорода при низких температурах синтеза, на наш взгляд, вызвано гидратацией оксидов, а при повышенных (в основном для Al2O3) – небольшим вкладом кислорода оксидного слоя матрицы.
В УФ спектрах отражения пленок диоксида кремния, полученных при Тп < 373 К наблюдалось небольшое поглощение в области ближнего ультрафиолета (200–250 нм), что указывало на наличие следов координационно-связанной воды. Это указывало на определяющую роль гидратного покрова металлических матриц в реакциях с галогенидами металлов.
Сравнивая результаты синтеза оксидных слоев на металлической и полупроводниковых матрицах [3, 22], следует отметить, что общий характер закономерностей молекулярного наслаивания соблюдается во всех исследованных системах, за исключением слоев оксида хрома, где существенную роль играют пиролитические процессы.
Активирующее действие триэтиламина при хемосорбции галогенидов кремния и алюминия на металлической матрице проявлялось только до температур 430 К для SiO2 (рис. 2, кривая 1) и 500 К для Al2O3 (рис. 2, кривая 3). Это указывало на то, что при более высоких температурах комплекс ТЭА с гидроксильной группой поверхности не образуется. Наблюдаемые для этих матриц значения d0 ниже, чем аналогичные для кремниевой матрицы [3]. Это вызвано только частичным заполнением поверхности при хемосорбции реагентов и малой активностью гидроксильных групп, причем полный выход реакции с галогенидами не достигается даже с использованием ТЭА.
Синтез хромоксидных слоев на металлических матрицах проходил практически с теми же количественными характеристиками (рис. 2) и по тем же закономерностям, что и на кремнии. Влияние природы подложки практически не проявлялось. На наш взгляд, если бы эти отличия и были, то зафиксировать их было бы затруднительно, из-за существенного вклада окислительно-восстановительных процессов при пиролитическом разложении оксихлорида хрома(VI), которые преобладали при Тп > 353 К (рис. 2, кривая 4). По результатам РФЭС нанослои оксида хрома содержали шести- и трехвалентный хром, причем доля последнего увеличивалась с повышением температуры, что указывало на протекание пиролитических процессов.
Исследование структуры синтезированных оксидных нанослоев дифракцией медленных электронов показало, что слои оксида кремния во всех случаях аморфны. В пленках оксида алюминия появление кристаллической фазы наблюдалось только при Т > 500 К и толщинах более 10 нм. Средний размер кристаллитов, составляющий макроструктуру слоя и оцененный по уширению интерференционных колец, возрастал с толщиной слоя, однако не превышал 5 нм при толщинах до 40 нм. В этом случае микрокристаллическая структура “толстого” слоя формировалась при переходе от аморфного состояния (d < 10 нм) к поликристаллическому с относительно жестким дальним порядком в пределах границ зерен. Толщина слоев около 10 нм является как бы критической, и, по-видимому, аморфная фаза представляет собой переходной слой, компенсирующий большое кристаллографическое несоответствие между подложкой и структурой слоя. Устойчивость аморфного оксида алюминия при малых толщинах обусловлена сильной химической связью между подложкой и растущим слоем. Формирование кристаллитов как надмолекулярных образований, может происходить по мере роста слоя за счет ансамблей (кластеров) близко расположенных гидроксилов.
Изучение электрофизических параметров оксидных слоев проводилось в системе металл-диэлектрик-металл (МДМ) при использовании в качестве подложки и одного из электродов танталовой или алюминиевой матрицы. В качестве противоэлектрода использовались металлы, имеющие необходимую работу выхода электронов [31]: серебро, никель, олово или жидкий индий-галлиевый сплав (In : Ga = 5 : 1).
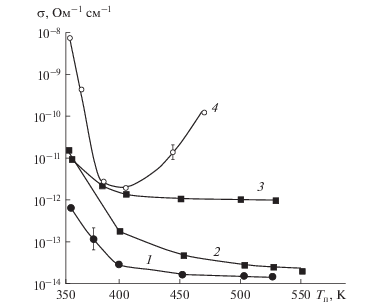
Установлено, что проводимость оксидных слоев существенно зависела от температурных условий синтеза (рис. 3). Для всех оксидов, кроме оксида хрома, с повышением температуры наблюдалось значительное снижение проводимости до минимальных значений, которые наблюдались при температурах слоевого роста наноструктур. Для оксида хрома более высокие температуры синтеза вызывали повышение проводимости слоев почти двух порядков. Повышенная проводимость слоев при пониженных температурах (Т < 400 К для SiO2, Al2O3, Та2О5 и (Cr2O3–CrO3)) по всей вероятности вызвана присутствием координационно-связанной воды в аморфизированных слоях. Для Al2O3 и Та2О5 снижение проводимости хорошо коррелировало с данными РФЭС по соотношению концентраций кислорода и металла в синтезированных слоях (см. табл. 1).
Рис. 3.
Влияние температуры синтеза пленок SiO2 (1), Al2O3 (2), Та2О5 (3) и оксида хрома (4) на удельную проводимость. Толщина диэлектрика d = 25–30 нм, Е = 105 В/см.
При d < 10 нм проводимость слоев, по мере уменьшения толщины, резко возрастала (рис. 4), что вызвано переходом от прыжкового механизма к туннелированию через трапецеидальный барьер. Так, для пленок SiO2 и Al2O3 переход к туннельному механизму проводимости наблюдался наиболее отчетливо, о чем свидетельствовала линеаризация вольтамперных характеристик (ВАХ) в координатах lg(J/V) = f(V) (J – плотность тока) и значительная асимметрия проводимости даже для электродов с близкими значениями работы выхода (структуры Та–SiO2–Sn и Та–Al2O3–Ni) (рис. 4). Такая зависимость вызвано тем, что высота барьера определялась не столько работой выхода электронов, сколько зарядовыми состояниями границы раздела металл–диэлектрик. В структурах Та–SiO2–Sn наличие дополнительной границы синтезированного оксида с собственным оксидом матрицы Та2О5–SiO2 (Та2О5–Al2O3) должно существенно снижать туннельный ток.
Рис. 4.
ВАХ туннельной структуры Та–SiO2–Sn в координатах I–V (1) и lg(J/V)–V (2). Толщина диэлектрика 5 нм. Потенциал “+” на Sn-электроде.
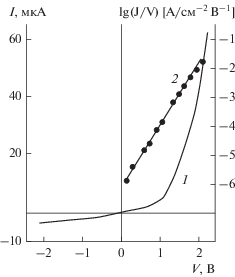
Следует отметить, что при толщине синтезированного диэлектрического слоя d > 3 нм туннельные структуры практически не имели коротких замыканий, хотя и существовали области с пониженной электрической прочностью. В результате испытаний более чем 100 туннельных структур Та–SiO2–Sn площадью 10–2 см2 и c толщиной диэлектрика около 5 нм около 70% структур имели напряжение пробоя свыше 2 В, что указывало на хорошую сплошность и электрическую прочность синтезированных слоев.
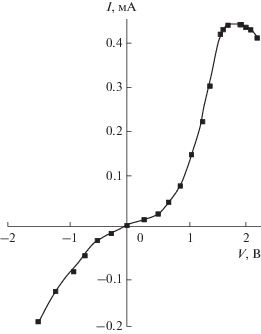
Для структур Та–(Cr2O3–CrO3)–Sn, (d < 5нм, σ ≈ 10–12 Ом–1 см–1) также наблюдался перенос заряда по туннельному механизму (рис. 4). Однако, значительно больший туннельный ток (до 400 мкА) был получен в структурах Cr–(Cr2O3–CrO3)–Ag (рис. 5) и Та–Та2О5–Ni. Меньшая плотность поверхностных состояний на границе раздела в этой системе, обусловленная прослойкой естественного оксида, позволила получить туннельные структуры, с участком отрицательного дифференциального сопротивления. В этой области наблюдалась электролюминесценция, вызванная взаимодействием туннелирующих электронов с границей раздела металл-диэлектрик [32].
Рис. 5.
ВАХ туннельной структуры Cr–(Cr2O3–CrO3)–Ag. Толщина диэлектрика 5 нм. Потенциал “+” на хромовом электроде.
Проведенный комплекс электрофизических исследований показал (табл. 2), что по своим диэлектрическим параметрам оксидные нанослои, синтезированные методом МН, не уступают “толстым” диэлектрическим слоям того же состава, полученными другими методами, а танталоксидные и хромоксидные слои обладают даже более низкой проводимостью.
Таблица 2.
Диэлектрические параметры оксидных слоев, полученных методом МН
| № пп | Состав оксида | Удельная проводимость, σ, Ом–1 см–1 | Электрическая прочность, Е, В/см | Диэлектрическая проницаемость, ε | Тангенс потерь, tg δ |
|---|---|---|---|---|---|
| 1 | SiO2 | 10—13–10–14 | 4 × 106 | 3.9–4.3 | 0.001–0.01 |
| 2 | (Cr2O3–CrO3) | 10—10–10–12 | 2 × 106 | 6–8 | 0.005–0.02 |
| 3 | Al2O3 | 10—13–10–14 | 5 × 106 | 8–10 | 0.005 |
| 4 | Та2О5 | 10—11–10–12 | ∼106 | 20–22 | 0.02 |
Важным преимуществом является то, что достаточно хорошими диэлектрическими характеристиками обладают слои толщиной даже менее 5 нм. Так, ультратонкие слои SiO2 и Al2O3 благодаря своим высоким диэлектрическим характеристикам могут быть использованы при разработке и тонкопленочных конденсаторов с малыми токами утечки.
ЗАКЛЮЧЕНИЕ
Сравнивая результаты синтеза оксидных слоев на металлических и полупроводниковых матрицах, следует отметить, что общий характер закономерностей молекулярного наслаивания соблюдается во всех исследованных системах, за исключением роста слоев оксида хрома, где существенную роль играют пиролитические процессы.
По итогам рассмотрения электрофизических характеристик поверхностных наноструктур, полученных методом МН, следует отметить, что по своим параметрам они не уступают пленкам, полученным традиционными методами, а по ряду параметров и превосходят их. Например, высокая электрическая прочность диэлектриков при нанометровых толщинах делает их незаменимыми в структурах, работающих на квантовых эффектах. Технологическая простота синтеза многослойных систем позволяет в широких пределах направлено изменять их свойства и создавать новые типы приборов.
Работа выполнена с использованием оборудования Первого всероссийского инжинирингового центра технологии молекулярного наслаивания СПбГТИ(ТУ) (Соглашение Минобрнауки России № 075-15-2021-028).
Список литературы
Mannequin C., Tsuruoka T., Hasegawa T., Aono M. Identification and roles of nonstoichiometric oxygen in amorphous Ta2O5 thin films deposited by electron beam and sputtering processes // Applied Surface Science. 2016. V. 385. P. 426–435.
Freeman Y., Lessner P., Kramer A.J. et al. Low Voltage Specific Charge (CV/g) Loss in Tantalum Capacitors // J. The Electrochemical Society. 2010. V. 157. № 7. P. G161−G165.
Ежовский Ю.К. Формирование и диэлектрические характеристики нанослоев оксидов тантала и алюминия // Микроэлектроника. 2013. Т. 42. № 6. С. 447–453.
Jaksic M.M., Botton G.A., Papakonstantinou G.D. et al. Primary Oxide Latent Storage and Spillover Enabling Electrocatalysts with Reversible Oxygen Electrode Properties and the Alterpolar Revertible (PEMFC versus WE) Cell // J. Phys. Chem. C. 2014. V. 118. I. 17. P. 8723−8746.
Gan L.-Y., Zhao Y.-J. Inverse NiO1 –x/Cu Catalyst with High Activity toward Water–Gas Shift // J. Phys. Chem. C. 2012. V. 116. I. 30. P. 16089–16092.
Malygin A.A., Ermilova M.M., Gryaznov V.M. et al. The new catalytic membranes with low sized phosphorus oxide structures on a surface // Desalination. 2002. V. 144. I. 1–3. P. 433–435.
Pauletto G., Vaccari A., Groppi G. et al. FeCrAl as a Catalyst Support // Chem. Rev. 2020. V. 120. I. 15. P. 7516–7550.
Milleret V., Buzzi S., Gehrig P. et al. Protein adsorption steers blood contact activation on engineered cobalt chromium alloy oxide layers // Acta Biomaterialia. 2015. V. 24. P. 343–351.
Mas-Moruno C., Garrido B., Rodriguez D. et al. Biofunctionalization strategies on tantalum-based materials for osseointegrative applications // J. Materials Science: Materials in Medicine. 2015. V. 26. I. 2. Article № 109. 12 p.
Uslu E., Öztatlı H., Garipcan B., Ercan B. Fabrication and cellular interactions of nanoporous tantalum oxide // J. Biomed Mater Res. 2020. V. 108. I. 7. P. 2743–2753.
Wang N., Li H., Wang J. et al. Study on the Anticorrosion, Biocompatibility, and Osteoinductivity of Tantalum Decorated with Tantalum Oxide Nanotube Array Films // ACS Appl. Mater. Interfaces. 2012. V. 4. I. 9. P. 4516−4523.
Meng F., Li Z., Liu X. Synthesis of tantalum thin films on titanium by plasma immersion ion implantation and deposition // Surface & Coatings Technology. 2013. V. 229. P. 205–209.
Wang L., Zhou B., Liu Z. et al. Surface hydroxylation regulates cellular osteogeneses on TiO2 and Ta2O5 nanorod films // Colloids and Surfaces B: Biointerfaces. 2018. V. 167. P. 213–219.
Liu J., Zhang Q., Zhang B., Yu M. The Bonding Mechanism of the Micro-Interface of Polymer Coated Steel // Polymers. 2020. V. 12. I. 12. Article № 3052. 18 p.
Zumelzu E., Rull F., Boettcher A.A. Characterization and micro- and ultra-structural analysis of PET-based Co-rolled composite electrolytic chromium coated steel (ECCS) // J. Materials Processing Technology. 2006. V. 173. I. 1. P. 34–39.
Abreu C.M., Cristóbal M.J., Losada R. et al. High frequency impedance spectroscopy study of passive films formed on AISI 316 stainless steel in alkaline medium // J. Electroanalytical Chemistry. 2004. V. 572. I. 2. P. 335–345.
Ганц О.Ю., Юдина А.Д., Жирнова В.О. и др. Синтез оксида рутения(IV) на тантале методом атомно-слоевого осаждения // Известия высших учебных заведений. Серия “Химия и химическая технология”. 2020. Т. 63. № 7. С. 26–30.
Свинцицкий Д.А., Кибис Л.С., Стадниченко А.И. и др. Реакционная способность и термическая стабильность кластеров окисленной меди на поверхности оксида тантала(V) // Кинетика и катализ. 2013. Т. 54. № 4. С. 524–532.
Малыгин А.А., Малков А.А., Соснов Е.А. Структурно-размерные эффекты и их применение в системах “ядро-нанооболочка”, синтезированных методом молекулярного наслаивания // Известия Академии наук. Серия химическая. 2017. № 11. С. 1939–1962.
Ahvenniemi E., Akbashev A.R., Ali S. et al. Review Article: Recommended reading list of early publications on atomic layer deposition – Outcome of the “Virtual Project on the History of ALD” // J. Vac. Sci. Technol. A. 2017. V. 35. № 1. Article № 010801. 13 p.
Malygin A.A., Drozd V.E., Malkov A.A., Smirnov V.M. From V.B. Aleskovskii’s ‘framework’ hypothesis to the method of molecular layering/atomic layer deposition // Chemical Vapor Deposition. 2015. V. 21. I. 10. P. 216–240.
Ежовский Ю.К. Формирование диэлектрических нанослоев оксидов алюминия и кремния на полупроводниках AIIIBV // Микроэлектроника. 2019. Т. 48. № 2. С. 106–110.
Ежовский Ю.К. Химическая нанотехнология оксидных и нитридных низкоразмерных структур на полупроводниковых матрицах // Микроэлектроника. 2010. Т. 39. № 3. С. 202–209.
Machado E., Kaczmarski M., Ordejón P. et al. First-Principles Analyses and Predictions on the Reactivity of Barrier Layers of Ta and TaN toward Organometallic Precursors for Deposition of Copper Films // Langmuir. 2005. V. 21. I. 16. P. 7608–7614.
Hinge M., Ceccato M., Kingshott P. Electrochemical modification of chromium surfaces using 4-nitro- and 4-fluorobenzenediazonium salts // New J. Chem. 2009. V. 33. I. 12. P. 2405–2408.
Ежовский Ю.К., Клюйков А.И. Оценка реакционной способности гидроксильных групп поверхности ряда оксидов металлов на основе корреляционных соотношений // Журн. физ. химии. 1998. Т. 72. № 5. С. 908–911.
Громов В.К., Кольцов С.И. Эллипсометрия – метод исследования поверхности / Под ред. Ржанова А.В. Cб.-Новосибирск. Наука, 1983. С. 73–76.
Громов В.К. Введение в эллипсометрию. Л.: Изд. ЛГУ, 1986. 192 с.
Нефедов В.И., Черепин В.Т. Физические методы исследования поверхности твердых тел. М.: Наука, 1983. 296 с.
Нефедов В.И. Рентгено-электронная спектроскопия химических соединений. М.: Химия. 1984. 256 с.
Родерик Э.Х. Контакты металл-полупроводник. М.: Радио и связь, 1982. 208 с.
Whitely S.R., Gustafson F.K. Stationary state model for normal metal tunnel junction phenomena // IEEE J. Quantum Electronics. 1982. V. 18. I. 9. P. 1387–1398.
Дополнительные материалы отсутствуют.
Инструменты
Микроэлектроника


