Микология и фитопатология, 2020, T. 54, № 3, стр. 214-220
Изменение ацидофицирующей активности штаммов Aspergillus niger при адаптации к стрессу
К. В. Сазанова 1, *, Д. Ю. Власов 2, **
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: ksazanova@binran.ru
** E-mail: dmitry.vlasov@mail.ru
Поступила в редакцию 11.12.2019
После доработки 15.12.2019
Принята к публикации 20.12.2019
Аннотация
Выполнено сравнение штаммов Aspergillus niger, выделенных с поверхности природных и искусственных субстратов из различных регионов (Антарктида, Египет, Севастополь, Санкт-Петербург) по их способности продуцировать органические кислоты и адаптироваться к стрессовым воздействиям. Показано, что штаммы, изолированные с поверхности штукатурного покрытия и природного камня, являются более активными продуцентами щавелевой кислоты, в сравнении со штаммами, изолированными с поверхности древесины и бумаги. Антарктические штаммы отличаются большей резистентностью к стрессу, чем штаммы из умеренных широт. Для одного региона штаммы-гиперпродуценты щавелевой кислоты были более устойчивы к действию меди и биоцида метатин, чем штаммы, выделяющие щавелевую кислоту менее активно. По чувствительности к цинку в высоких концентрациях вариабельности среди исследованных штаммов A. niger не выявлено. Под действием цинка общее количество щавелевой кислоты у A. niger возрастало, а под действием меди снижалось. Влияние биоцида метатин на образование кислот проявлялось в увеличении образования оксалата у наиболее устойчивых штаммов и подавлении его образования у более чувствительных штаммов.
ВВЕДЕНИЕ
Aspergillus niger Tiegh. является сапротрофным космополитным микромицетом, обитающим на различных типах субстратов. Поселяясь на поверхности камня, строительных материалов, древесине или бумаге, A. niger вызывает их повреждение. Особенно актуальна проблема микоповреждений по отношению к объектам, имеющим культурную и историческую ценность (Farooq et al., 2015; Salvadori, Municchia, 2016; Castillo et al., 2019).
A. niger – один из основных модельных объектов в микробиологии, биохимии и генетике. Он активно используется в промышленной биотехнологии как продуцент ферментов (амилазы, пектиназы и ксиланазы) и органических кислот (Andersen et al., 2011). В природных условиях выделение в среду органических кислот имеет существенное экологическое значение. Ацидофикация во многом определяет геохимическую роль микромицетов, их участие в процессах выветривания горных пород и первичного почвообразования. Органические кислоты играют важную роль в изменении растворимости многих химических соединений (Blaudez et al., 2001; Rosling et al., 2004; Salvadori, Municchia, 2016). Известно, что органические кислоты являются фактором адаптации грибов к условиям окружающей среды. Имеются ограниченные данные о роли щавелевой кислоты в увеличении активности ферментов антиоксидантной защиты (супероксиддисмутазы, пероксидазы, аскорбатоксидазы), снижении активности липоксигеназы, замедлении формирования активных форм кислорода и уменьшении интенсивности перекисного окисления липидов (Zheng et al., 2007). Значительно больше данных известно о способности органических кислот к связыванию ди- и тривалентных катионов, таких как Al3+, Fe3+, Mg2+, Са2+, Mn2+, Zn2+, Cu2+ и др. Образование комплексных соединений снижает активность и токсичность свободных катионов в почве или на минеральном субстрате, а также способствует выживанию грибов в среде с их высоким содержанием (Fomina et al., 2005; Munir et al., 2005; Abbas et al., 2014; Chandran et al., 2014). Среди низкомолекулярных органических кислот наиболее сильным связывающим агентом является щавелевая кислота, взаимодействие которой с металлами может происходить как экстраклеточно, так и внутри клетки. Формируя с рядом металлов устойчивые комплексы и/или нерастворимые соли, она сильно снижает их биодоступность, поэтому продуцирование щавелевой кислоты рассматривается как высокоэффективный способ иммобилизации многих металлов (Munir et al., 2005; Chandran et al., 2014). На каменистом субстрате под действием A. niger можно наблюдать образование оксалатов металлов биогенного происхождения (Shturm et al., 2015).
Способность к активному выделению органических кислот (главным образом лимонной кислоты) послужила причиной для детального исследования метаболизма A. niger и поиска штаммов-гиперпродуцентов органических кислот (Andersen et al., 2011). Штаммовая вариабельность грибов по их способности выделять кислоты может быть связана с условиями их обитания, в том числе может отражать их субстратную специфичность, а также зависеть от климатических и экологических условий региона.
В антропогенной среде грибы подвергаются интенсивному техногенному воздействию, а также влиянию биоцидов, используемых для борьбы с биоповреждениями. Исследования устойчивости грибов к этим и другим воздействиям на штаммовом уровне важны для понимания физиологических механизмов адаптации грибов к стрессу, возможного использования грибов для целей биоремедиации и противодействия биоповреждениям, вызываемых грибами.
Цель данной работы состояла в сравнительном анализе штаммов A. niger по образованию ими органических кислот при стрессовых воздействиях.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование было включено десять штаммов A. niger (табл. 1), выделенных с поверхности природных и искусственных субстратов из различных регионов (Антарктида, Египет, Севастополь, Санкт-Петербург). Штаммы поддерживались в условиях субкультуры на кафедре ботаники Cанкт-Петербургского государственного университета (СПбГУ).
Таблица 1.
Характеристика исследованных штаммов Aspergillus niger
| Штамм | Место выделения | Субстрат | Год выделения |
|---|---|---|---|
| Ch 4/07 | Севастополь | мрамор | 2007 |
| S 1/11 | Санкт-Петербург | штукатурное покрытие | 2011 |
| P 2/08 | Санкт-Петербург | картон | 2008 |
| А 1/10 | Антарктида | каменистый субстрат | 2010 |
| А 2/12 | Антарктида | гнейс | 2012 |
| Е 1/04 | Египет | мрамор | 2004 |
| S 2/12 | Санкт-Петербург | штукатурное покрытие | 2012 |
| P 1/12 | Санкт-Петербург | бумага | 2012 |
| В 1/10 | Санкт-Петербург | древесина | 2010 |
| Bm-53 | Санкт-Петербург | бумага | 2010 |
Для культивирования использовали среду Чапека (NaNO3 – 3.0 г/л, КН2РО4 – 1.0; МgSO4 · · 7Н2О – 0.5; КСl – 0.5; FeSO4 · 7Н2О – 0.015; глюкоза – 30.0 г/л). Грибы выращивали при температуре 25°С.
В экспериментах по исследованию продукции органических кислот грибами в присутствии цинка и меди металлы вносили в среду в форме сульфатных солей ZnSO4 · 7H2O и CuSO4 · 5H2O в концентрациях 100, 500 и 2000 мкмоль/1000 мл среды. В опытах по исследованию влияния биоцидов на продукцию органических кислот использовали фунгицид метатин в концентрации 0.05%.
Для характеристики роста грибов измеряли биомассу мицелия и линейную скорость роста колоний. Исследование микроморфологии культур проводилось методами световой микроскопии с использованием микроскопов Axio Scope A1 и Stemi 2000 (Carl Zeiss, Германия) на базе ресурсного центра Ботанического института им. В.Л. Комарова РАН.
Для определения общего содержания органических кислот в культуральной жидкости грибов пробы подкисляли 0.1Н HCl до рН 1.0 с целью растворения солей щавелевой кислоты. Далее аликвоту фильтрата пропускали через катионообменную смолу марки KУ – 2–8, что дало возможность получить свободные кислоты из их солей. Чтобы освободиться от избытка сахаров, пробы после катионита пропускали через анионообменную смолу марки АН-2ФН. С анионита кислоты вытесняли 0.2Н NaOH и снова пропускали через катионит. Полученный водный раствор органических кислот выпаривали, сухой остаток растворяли в пиридине. Далее с использованием N, O-бис-(триметилсилил) трифторацетамида (BSTFA) получали TМС (триметилмилил)-производные.
Анализ синтезированных грибами карбоновых кислот проводили методом газовой хромато-масс-спектрометрии (ГХ-МС) на приборе Agilent с масс-селективным детектором 5975С (США), колонка HP-5MS, 30 м × 0.25 мм. Хроматографирование проводили при линейном программировании температуры от 70°C до 320°C со скоростью 4°C/мин. Сбор данных осуществляли с помощью программного обеспечения Agilent ChemStation. Обработку и интерпретацию масс-спектрометрической информации проводили с использованием программы AMDIS (http://www.admis.net/index.html) и стандартной библиотеки NIST2005. Количественная интерпретация хроматограмм проводилась методом внутренней стандартизации по углеводороду С23 или С18 с помощью программы UniChrom (http://www.unichrom.com/unichrome.shtml).
Эксперименты проводили в трехкратной повторности. Статистическую обработку результатов проводили методами непараметрической статистики с использованием t-критерия Стьюдента с помощью программы Microsoft Excel. Средние значения данных приводятся в следующем виде: Х ± σ, где Х – среднее арифметическое, σ – среднее квадратическое отклонение.
РЕЗУЛЬТАТЫ
Изученные штаммы A. niger имели незначительные морфологические различия. Штаммы S 1/11; P 2/08; В 1/10 и S 2/12 формировали конидиеносцы меньшего размера (200–250 мкм), чем другие штаммы, размер конидиеносцев которых достигал 450 µm. Взаимосвязи между этим показателем и физиологическими свойствами грибов выявлено не было.
Анализ кислотообразующей активности у различных штаммов A. niger показал, что интенсивность образования и выделения кислот грибами сильно варьирует в зависимости от типа субстрата, из которого был получен штамм. Результаты исследования, представленные в таблице 2, свидетельствуют о том, что наибольшей способностью выделять щавелевую кислоту отличались штаммы, изолированные с поверхности штукатурного покрытия. Самыми слабыми продуцентами оксалата оказались штаммы A. niger, изолированные с поверхности бумаги, картона и древесины. Штаммы, изолированные с поверхности природного камня, выделяли на 40–50% меньше щавелевой кислоты, чем штаммы, изолированные со штукатурного покрытия, но значительно больше, чем штаммы, изолированные с поверхности бумаги. В то же время, наибольшей способностью выделять лимонную кислоту обладал один из двух штаммов, изолированных с бумаги.
Таблица 2.
Образование органических кислот различными штаммами Aspergillus niger (10-е сутки роста)
| Штамм | Органические кислоты (мг/г мицелия) | |||||
|---|---|---|---|---|---|---|
| щавелевая | янтарная | фумаровая | яблочная | лимонная | глюконовая | |
| Ch 4/07 | 246.3 ± 28.1 | 0.9 ± 0.1 | 0.4 ± 0.1 | 0.9 ± 0.3 | 1.7 ± 0.6 | 5.6 ± 2.4 |
| S 1/11 | 512.5 ± 78.6 | 0.5 ± 0.7 | 0.40 ± 0.06 | 0.8 ± 0.2 | 27.3 ± 58.3 | – |
| P 2/08 | 122.6 ± 125.0 | 0.4 ± 0.04 | 0.23 ± 0.04 | 0.16 ± 0.03 | 0.21 ± 0.04 | – |
| А 1/10 | 201.5 ± 38.0 | 0.8 ± 0.2 | 0.36 ± 0.06 | 0.24 ± 0.07 | 7.4 ± 0.9 | 6.6 ± 0.8 |
| А 2/12 | 255.2 ± 34.1 | 0.7 ± 0.2 | 0.5 ± 0.1 | 0.7 ± 0.1 | 8.1 ± 1.1 | 7.2 ± 0.4 |
| Е 1/04 | 140.2 ± 12.4 | – | – | – | 1.8 ± 0.4 | – |
| S 2/12 | 516.0 ± 39.1 | – | – | – | – | 4.4 ± 0.9 |
| P 1/12 | 140.4 ± 83.1 | – | – | – | 34.2 ± 0.6 | 7.1 ± 2.4 |
| В 1/10 | 143.8 ± 23.1 | 0.5 ± 0.1 | 0.3 ± 0.1 | 0.8 ± 0.2 | 5.4 ± 1.0 | 13.2 ± 3.1 |
| Bm-53 | 133.3 ± 32.8 | – | – | – | – | – |
Среди факторов среды, оказывающих стрессовое влияние на микроорганизмы в антропогенной среде, большую роль играют элементы техногенного происхождения. В данном исследовании был проведен сравнительный анализ штаммов A. niger по их устойчивости к цинку и меди и образованию ими органических кислот под действием этих металлов.
У всех исследуемых штаммов на среде с Zn в концентрациях 100 и 500 мкмоль наблюдалась стимуляция роста мицелия, а его подавление наблюдалось при 2000 мкмоль. Наибольшую биомассу имели культуры, выращенные на среде Чапека с концентрацией цинка 100 мкмоль. Для изученных грибов медь оказалась более токсичной в сравнении с цинком. Сравнение штаммов A. niger по их устойчивости к цинку не выявило достоверно значимых различий между ними, в то время как по отношению к меди наибольшую устойчивость проявляли культуры, выделенные с поверхности каменистого субстрата. При концентрации Cu 2000 мкмоль их рост ингибировался на 35–55%. При этом штаммы из Антарктиды (А 1/10 и А 2/12) отличались большей устойчивостью к металлам, чем штаммы умеренных широт. Штаммы, выделенные с поверхности бумаги и картона, отличались наименьшей устойчивостью к повышенным концентрациям Cu. Медь в концентрации 2000 µM подавляла их рост на 60–65% (табл. 3).
Таблица 3.
Изменения ростовых показателей штаммов Aspergillus niger при различном содержании в среде меди и цинка
| Штамм | Происхождение | Субстрат | Zn | Cu | ||||
|---|---|---|---|---|---|---|---|---|
| Концентрация, мкмоль | ||||||||
| 100 | 500 | 2000 | 100 | 500 | 2000 | |||
| стимуляция роста относительно контроля, % | подавление роста относительно контроля, % | |||||||
| Ch 4/07 | Севастополь | мрамор | 22 ± 3 | 6 ± 1 | 10 ± 2 | 11 ± 4 | 29 ± 2 | 49 ± 3 |
| S 1/11 | Санкт-Петербург | штукатурное покрытие | 21 ± 2 | 8 ± 2 | 11 ± 2 | 13 ± 1 | 31 ± 4 | 46 ± 4 |
| А 1/10 | Антарктида | каменистый субстрат | 21 ± 2 | 7 ± 2 | 10 ± 1 | 10 ± 3 | 20 ± 2 | 39 ± 2 |
| А 2/12 | Антарктида | гнейс | 20 ± 2 | 6 ± 1 | 9 ± 2 | 7 ± 1 | 21 ± 3 | 35 ± 3 |
| Е 1/04 | Египет | мрамор | 18 ± 1 | 7 ± 1 | 8 ± 2 | 18 ± 2 | 31 ± 4 | 55 ± 4 |
| S 2/12 | Санкт-Петербург | штукатурное покрытие | 19 ± 3 | 6 ± 1 | 10 ± 1 | 14 ± 2 | 34 ± 2 | 45 ± 5 |
| P 2/08 | Санкт-Петербург | картон | 23 ± 4 | 7 ± 1 | 14 ± 4 | 18 ± 2 | 35 ± 3 | 59 ± 4 |
| P 1/12 | Санкт-Петербург | бумага | 20 ± 4 | 8 ± 2 | 10 ± 2 | 22 ± 3 | 42 ± 3 | 64 ± 5 |
| В 1/10 | Санкт-Петербург | древесина | 24 ± 4 | 6 ± 1 | 13 ± 3 | 17 ± 2 | 40 ± 3 | 61 ± 4 |
| Bm-53 | Санкт-Петербург | бумага | 19 ± 2 | 6 ± 1 | 9 ± 2 | 16 ± 3 | 44 ± 3 | 60 ± 3 |
Для анализа влияния металлов на продукцию органических кислот было выбрано два штамма (Ch 4/07 и A 2/12), полученных из различных регионов. Эти штаммы были сходны по интенсивности выделения щавелевой кислоты, но различались по устойчивости к меди. Для данного исследования использовалась концентрация металлов 2000 мкмоль для цинка и 500 мкмоль для меди. Конролем служил вариант без добавления металлов. Полученные результаты показали, что у обоих штаммов под действием цинка общее количество щавелевой кислоты возрастает (табл. 4). При этом имеют место существенные различия по соотношению растворимой и нерастворимой форм оксалата. Под действием меди количество продуцируемой щавелевой кислоты снижается у обоих штаммов, а более 50% оксалата содержится именно в растворимой форме. Лимонная, яблочная, фумаровая, янтарная и глюконовая кислоты в контроле продуцировались в незначительном количестве. При внесении в среду цинка количество этих кислот оставалось низким, а на среде с медью снижалось до следовых количеств.
Таблица 4.
Влияние цинка и меди на образование щавелевой кислоты штаммами Aspergillus niger
| Вариант опыта | Ch 4/07 | A 2/12 | ||
|---|---|---|---|---|
| Содержание оксалата в среде, мг/г мицелия | ||||
| нерастворимая форма оксалата | растворимая форма оксалата | нерастворимая форма оксалата | растворимая форма оксалата | |
| Контроль | 54.5 ± 12.1 | 152.2 ± 13.4 | 62.4 ± 8.1 | 128.2 ± 10.2 |
| ZnSO4 2 mM | 278.4 ± 18.8 | 2.6 ± 0.4 | 269.1 ± 23.4 | 9.2 ± 1.3 |
| CuSO4 0.5 mM | 3.9 ± 0.2 | 41.7 ± 7.8 | 5.1 ± 0.4 | 36.9 ± 8.1 |
Для защиты от биоповреждений, вызываемых грибами, синтезировано большое количество фунгицидов, различающихся по химической природе и принципу действия (Sukharevich et al., 2005; Shilova et al., 2015). Использование этих веществ может оказывать фунгицидное или фунгистатическое действие, влияя на физиолого-биохимические свойства грибов.
В данной работе выполнено сравнение четырех штаммов A. niger (Ch 4/07; S 1/11; А 2/12; P 1/12) по их устойчивости к действию биоцида метатин (Rocima G), представляющего собой смесь 2-метил-4-изотиазолинон-3-ОН и 5-хлор-2-метил-3(2Н)-изотиазолинон-3-ОН в соотношении 1 : 3, и выделению ими органических кислот под действием этого вещества.
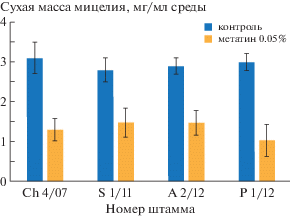
Проведенные исследования показали, что наибольшей устойчивостью к действию метатина в концентрации 0.05% обладал штамм S 1/11, выделенный с поверхности штукатурного покрытия в Санкт-Петербурге и антарктический штамм А 2/12 (рис. 1). Метатин подавлял их рост на 47 и 49% соответственно на 8-е сутки культивирования. Рост колоний штамма Ch 4/07, изолированного с поверхности камня в Херсонесе, замедлялся на 58%, а штамма P 1/12, выделенного с поверхности бумаги в Санкт-Петербурге – на 66%.
Влияние метатина на образование кислот проявлялось в увеличении образования оксалата у наиболее устойчивых штаммов (А 2/12 и S 1/11) и подавлении его образования у более чувствительных штаммов (Ch 4/07 и P 1/12) (табл. 5).
Таблица 5.
Влияние метатина (0.05%) на образование органических кислот Aspergillus niger
| Штамм | Вариант опыта | Количество органических кислот, мг/г мицелия | |||||
|---|---|---|---|---|---|---|---|
| щавелевая | лимонная | фумаровая | янтарная | яблочная | глюконовая | ||
| Ch 4/07 | Контроль | 88.8 ± 24.1 | 9.5 ± 2.4 | 1.7 ± 0.4 | 2.5 ± 0.9 | 2.1 ± 0.7 | 3.6 ± 0.8 |
| Метатин | 79.3 ± 12.2 | 3.1 ± 0.5 | – | – | – | – | |
| Sh 1/11 | Контроль | 125.0 ± 14.1 | 6.8 ± 0.5 | 0.8 ± 0.3 | 1.5 ± 0.7 | 1.7 ± 0.6 | – |
| Метатин | 194.8 ± 28.7 | 8.1 ± 2.3 | 0.3 ± 0.1 | 0.4 ± 0.2 | 0.8 ± 0.3 | – | |
| А 2/12 | Контроль | 79.1 ± 13.3 | 8.9 ± 1.5 | 1.2 ± 0.3 | 1.1 ± 0.2 | 1.4 ± 0.3 | – |
| Метатин | 104.8 ± 18.6 | 3.1 ± 0.3 | 0.5 ± 0.2 | 0.1 ± 0.02 | 0.3 ± 0.1 | – | |
| P 1/12 | Контроль | 79.1 ± 8.1 | 5.8 ± 1.5 | 1.9 ± 0.4 | 1.6 ± 0.4 | 1.5 ± 0.3 | – |
| Метатин | 64.9 ± 8.7 | – | – | – | – | – | |
ОБСУЖДЕНИЕ
Проведенные исследования показали вариабельность штаммов A. niger по способности продуцировать органические кислоты и устойчивости к внешним стрессовым воздействиям. Наиболее активно выделяют щавелевую кислоту штаммы с поверхности штукатурного покрытия и природного камня. Штукатурное покрытие представляет собой известково-глинистый материал, используемый при строительстве. Известно, что интенсивное выделение щавелевой кислоты часто наблюдается у грибов, обитающих на субстратах с высоким содержанием Са2+ (Adamo, Violante, 2000; Kolo, Claeys, 2005). Добавление карбоната кальция в среду способствует усилению продукции щавелевой кислоты (Tuason, Arocena, 2009; Barinova et al., 2010). Грибы и растения, растущие в почвах, обогащенных кальцием, могут использовать органические кислоты для связывания его избыточных количеств (Adamo, Violante, 2000; Tuason, Arocena, 2009).
Глюконовая, лимонная, фумаровая, янтарная и яблочная кислоты отмечались в среде в небольших количествах, а каких-либо штаммовых особенностей, связанных с накоплением этих кислот, не прослеживалось. Их низкое содержание, вероятно, обусловлено относительно невысокой концентрацией сахаров в среде и стадией онтогенеза: в лог-фазе часто наблюдается преимущественное накопление щавелевой кислоты на фоне снижения концентрации всех остальных кислот (Sazanova et al., 2016). В данном исследовании условия культивирования и его длительность были подобраны таким образом, чтобы оценить накопление в среде в первую очередь щавелевой кислоты.
Можно полагать, что гиперпродукция оксалата является физиологическим свойством грибов в условиях их обитания на каменистых (природных и искусственных) субстратах. На других типах субстрата, таких как древесина и бумага, щавелевая кислота может способствовать их разрушению, но, вероятно, не имеет адаптивного значения для гриба.
Штаммовая вариабельность A. niger проявляется также при сравнении устойчивости к стрессовым факторам: тяжелым металлам и биоцидам. Штаммы A. niger не различались по толерантности к Zn, а наибольшую устойчивость к меди проявляли штаммы, выделенные с поверхности каменистого субстрата. В то же время, грибы, выделенные с бумаги и картона, отличались наименьшей устойчивостью к повышенным концентрациям меди. Стоит отметить, что антарктические штаммы A. niger отличались большей устойчивостью к стрессовым воздействиям, чем штаммы из умеренных широт.
Физиологические механизмы адаптации грибов к цинку и меди на примере штамма Ch 4/07 были исседованы и подробно обсуждались в предшествующих работах (Sazanova et al., 2015, 2016). Сравнение антарктического и севастопольского штаммов показали, что закономерности влияния металлов на выделение щавелевой и других кислот схожи у обоих штаммов, несмотря на различия в устойчивости к меди.
Штаммовые различия были также выявлены и при анализе устойчивости грибов к действию биоцида метатин. Причем, в данном случае отличия зависели как от региона происхождения штамма, так и от субстрата, из которого он был выделен. Большей устойчивостью к метатину обладал антарктический штамм А 2/12 и штамм S 1/11, который характеризовался как наиболее активный продуцент щавелевой кислоты. В целом, метатин оказывал стимулирующее действие на образование оксалата у наиболее устойчивых штаммов (А 2/12 и S 1/11) и незначительно подавлял его образование у менее устойчивых (Ch 4/07 и P 1/12).
Метатин не является специфическим ингибитором ферментов метаболизма щавелевой и других кислот у грибов. Он представляет собой биоцидный препарат на основе азолов и действует главным образом на ферменты пути синтеза эргостерола. Азолы являются сильными ингибиторами 14α-деметилирования ланостерина и эбурикола (24-метиленгидроланостерола), что приводит к торможению биосинтеза эргостерола и, впоследствии, к изменениям в работе мембрано-связанных ферментов. Предполагается также ингибирование фермента С 22-стерол-десатуразы (ERG 5) (Bhanderi et al., 2009). Возможно щавелевая кислота в данном случае может способствовать поддержанию целостности мембран и соответственно большей устойчивости к действию биоцида, что согласуется с гипотезой о роли щавелевой кислоты в поддержании стабильности мембран (Zheng et al., 2007).
Как в экспериментах с тяжелыми металлами (при добавлении меди в среду в высокой концентрации), так и при воздействии биоцида метатин, антарктические штаммы A. niger отличались большей устойчивостью к стрессу, чем штаммы умеренных широт. В настоящее время устойчивость полярных штаммов микроорганизмов к тяжелым металлам и другим стрессовым факторам отмечают во многих исследованиях (Fernández et al., 2017; Ruisi et al., 2018; Kan et al., 2019). Эта устойчивость связана с углеродным метаболизмом, азотным метаболизмом, а также процессами фолдинга белков (Kan et al., 2019). Очевидно, что антарктические штаммы A. niger обладают биохимическим потенциалом, позволяющим адаптироваться к неблагоприятным условиям.
ЗАКЛЮЧЕНИЕ
Таким образом, способность к выделению щавелевой кислоты можно рассматривать как фактор адаптации A. niger к существованию на каменистом субстрате. Предполагаемые механизмы защитного действия щавелевой кислоты заключаются в связывании избыточных количеств катионов металлов, а также в защите мембран от повреждающего воздействия. Антарктические штаммы отличаются большей устойчивостью к неблагоприятным факторам среды, что делает их перспективными объектами для дальнейших исследований резистентности грибов к стрессу, разработок в области биоремедиации и биотехнологий.
Работа выполнена при поддержке Российского научного фонда (проект № 19-17-00141 “Современное минералообразование при участии микроорганизмов”).
Список литературы
Abbas S.H., Ismail I.M., Mostafa T.M., Sulaymon A.H. Biosorption of heavy metals: A review. J. Chemical Science and Technology. 2014. V. 3 (4). P. 74–102.
Adamo P., Violante P. Weathering of rocks and neogenesis of minerals associated with lichen activity. Applied Clay Science. 2000. V. 16. P. 229–256.
Andersen M.R., Salazar M.P., Schaap P.J., van de Vondervoort P.J., Culley D., Thykaer J., Frisvad J.C., Nielsen K.F., Albang R., Albermann K., Berka R.M., Braus G.H., Braus-Stromeyer S.A., Corrochano L.M., Dai Z., van Dijck P.W., Hofmann G., Lasure L.L., Magnuson J.K., Menke H., Meijer M., Meijer S.L., Nielsen J.B., Nielsen M.L., van Ooyen A.J., Pel H.J., Poulsen L., Samson R.A., Stam H., Tsang A., van den Brink J.M., Atkins A., Aerts A., Shapiro H., Pangilinan J., Salamov A., Lou Y., Lindquist E., Lucas S., Grimwood J., Grigoriev I.V., Kubicek C.P., Martinez D., van Peij N.N., Roubos J.A., Nielsen J., Baker S.E. Comparative genomics of citric-acid-producing Aspergillus niger ATCC 1015 versus enzyme-producing CBS 513.88. Genome Res. 2011. V. 21 (6). P. 885–897.
Barinova K.V., Shchiparev S.M., Shavarda A.L., Vlasov D.Yu. The influence of calcium carbonate on the acidifying activity of micromycetes. Vestnik Sankt-Peterburgskogo gosudarstvennogo universiteta. 2010. Ser. 3 (3). P. 93–98 (in Russ.).
Bhanderi B.B., Yadav M.M., Roy A. Antifungal drug resistance – concerns for veterinarians. Veterinary World. 2009. V. 2 (50). P. 204–207.
Blaudez D., Jacob C., Turnau K., Colpaer J.V., Jonnarth T.A., Finlay R., Boton B., Chalot M. Differential responses of ectomycorrhizal fungi to heavy metals in-vitro. Mycol. Res. 2001. V. 104. P. 1366–1371.
Castillo I.F., Guillén E.G., Fuente J.M., Filomena S., Mitchell S.G. Preventing fungal growth on heritage paper with antifungal and cellulase inhibiting magnesium oxide nanoparticles. Mater. Chem. 2019. V. 7. P. 6412–6419.
Chandran C.S., Shijith K.V., Vipin K.V., Augusthy R.A. Study on heavy metals toxicity biomarkers in Aspergillus niger. Journal of advances in pharmacy, biology and chemistry. 2014. V. 3 (2). P. 458–464.
De Leo F., Urzi C. Microfungi from deteriorated materials of cultural heritage. In: Misra J.K., Tewari J.P., Desh-mukh S.K., Vágvölgyi C. (eds). Fungi from different substrates. N.Y.: CRC Press, Taylor and Francis group, 2015, pp. 144–158.
Farooq M., Hassan M., Hassan M., Gul F. Mycobial deterioration of stone monuments of Dharmarajika, Taxila. Journal of Microbiology and Experimentation. 2015. V. 2 (1). P. 29–33.
Fernández P.M., Martorell M.M., Blaser M.G., Ruberto L.A.M., de Figueroa L.C., Mac Cormack W.P. Phenol degradation and heavy metal tolerance of Antarctic yeasts extremophiles. 2017. V. 21 (5). P. 445–457.
Fomina M., Hillier S., Charnock J.M., Melville K., Alexander I.J., Gadd G.M. Role of oxalic acid overexcretion in transformations of toxic metal minerals by Beauveria caledonica. Appl. Envir. Microbiol. 2005. V. 71 (1). P. 371–381.
Kan G., Wang X., Jiang J., Zhang C., Chi M., Ju Y., Shicorresponding C. Copper stress response in yeast Rhodotorula mucilaginosa AN5 isolated from sea ice, Antarctic. Microbiologyopen. 2019. V. 8 (3): e00657.
Kolo K., Claeys Ph. In vitro formation of Ca-oxalates and the mineral glushinskite by fungal interaction with carbonate substrates and seawater. Biogeosciences Discuss. 2005. V. 2. P. 451–497.
Munir E., Hattori T., Shimada M. Role for oxalate acid biosynthesis in growth of copper tolerant wood-rotting and pathogenic fungi under environmental stress. In: The 55th meeting of the Japan wood research society. 2005. P. 1–7.
Rosling A., Lindahl B.D., Taylor A.F.S., Finlay R.D. Mycelial growth and substrate acidic cation of ectomycorrhizal fungi in response to diferent minerals. Microbiol. Ecol. 2004. V. 47. P. 31–37.
Ruisi S., Barreca D., Selbmann L., Zucconi L., Onofri Silvano. Fungi in Antarctica. Rev. Envir. Sci. BioTech. 2007. V. 6 (1). P. 127–141.
Salvadori O., Municchia A.C. The role of fungi and lichens in the biodeterioration of stone monuments. The Open Conference Proceedings Journal. 2016. V. 7 (suppl 1: M4). P. 39–54.
Sazanova K., Osmolovskaya N., Schiparev S., Yakkonen K., Kuchaeva L., Vlasov D. Organic acids induce tolerance to Zinc- and Copper-exposed fungi under various growth conditions. Current Microbiol. 2015. V. 70. P. 520–527.
Sazanova K.V., Vlasov D.Yu., Osmolovskay N.G., Schiparev S.M., Rusakov A.V. Significance and regulation of acids production by rock-inhabited fungi. In: Frank-Kamenetskaya O.V. etc. (eds). Biogenic – abiogenic interactions in natural and anthropogenic Systems. Springer, 2016, pp. 379–392.
Shilova E.A., Levanchuk A.V., Sazonova A.M. Methodology for the selection of biocidal drugs to combat biodegradation caused by the micromycete community. Naukovedenie. 2015. T 7 (2). http://naukovedenie.ru/PDF/31TVN215.pdf (in Russ.).
Sturm E.V., Frank-Kamenetskaya O., Vlasov D., Zelenskaya M., Sazanova K., Rusakov A., Kniep R. Crystallization of calcium oxalate hydrates by interaction of calcite marble with fungus Aspergillus niger. American Mineralogists. 2015. V. 10. P. 2559–2565.
Suharevich V.I., Kuzikova I.L., Medvedeva N.G. The effect of fungicides of various chemical nature on the physiological and biochemical properties of micromycetes. Biotekhnologiya. 2005. № 5. P. 17–21 (in Russ.).
Tuason M.M., Arocena J.M. Calcium oxalate biomineralization by Piloderma fallax in response to various levels of calcium and phosphorus. Appl. Environ. Microbiol. 2009. V. 75 (22). P. 7079–7085.
Zheng X., Tian S., Meng X., Li B. Physiological and biochemical responses in peach fruit to oxalic acid treatment during storage at room temperature. Food Chemistry. 2007. № 104. P. 156–162.
Баринова К.В., Щипарев С.М., Шаварда А.Л., Власов Д.Ю. (Barinova et al.) Влияние карбоната кальция на ацидофицирующую активность микромицетов. Вестник СПбГУ. 2010. Сер. 3 (3). С. 93–98.
Сухаревич В.И., Кузикова И.Л., Медведева Н.Г. (Sukharevich et al.) Влияние фунгицидов различной химической природы на физиолого-биохимические свойства микромицетов. Биотехнология. 2005. № 5. С. 17–21.
Шилова Е.А., Леванчук А.В., Сазонова А.М. (Shilova et al.) Методика подбора биоцидных препаратов для борьбы с биодеструкцией, вызванной сообществом микромицетов. Науковедение. 2015. Т 7 (2). http://naukovedenie.ru/PDF/31TVN215.pdf.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология