Молекулярная биология, 2019, T. 53, № 1, стр. 74-83
Различия в экспрессии генов титина и небулина в скелетных мышцах крыс, хронически алкоголизированных разными методами
Ю. В. Грицына a, *, А. Д. Уланова a, b, Н. Н. Салмов a, А. Г. Бобылёв a, b, В. К. Жалимов c, И. М. Вихлянцев a, b
a Инcтитут теоретической и экспериментальной биофизики Российской академии наук
142290 Московская обл., Пущино, Россия
b Пущинcкий государственный естественно-научный институт
142290 Московская обл., Пущино, Россия
c Институт биофизики клетки Российской академии наук
142290 Московская обл., Пущино, Россия
* E-mail: gri23.86@mail.ru
Поступила в редакцию 23.04.2018
После доработки 04.06.2018
Принята к публикации 27.06.2018
Аннотация
Методами гель-электрофореза в денатурирующих условиях и иммуноблотинга изучены изменения в содержании основных белков кальпаиновой системы (Са2+-активируемой протеазы μ-кальпаина и фрагментов ее аутолиза, ингибитора кальпастатина) и субстратов μ-кальпаина (гигантских белков саркомерного цитоскелета – титина и небулина) в скелетных мышцах (m. gastrocnemius, m. soleus, m. longissimus dorsi) крыс, алкоголизированных в течение 3 мес. разными методами: с использованием агара, содержащего 30% этанола, и сбалансированного по питательным веществам жидкого корма, содержащего 5% этанола. У алкоголизированных крыс обеих групп не зарегистрировано уменьшения соотношения масса мышцы/масса тела, указывающего на развитие атрофии, повышенного аутолиза μ-кальпаина, свидетельствующего об увеличении активности этого фермента, изменения содержания интактного титина (Т1), небулина, μ-кальпаина и кальпастатина, а также общей активности кальпаинов, измеренной с использованием Calpain Activity Assay Kit. С использованием флуоресцентного красителя фосфатных групп белков Pro-Q Diamond не выявлено изменений общего уровня фосфорилирования титина в мышцах крыс алкогольных групп. Статистически значимых различий в содержании мРНК титина и небулина в скелетных мышцах контрольных крыс и алкоголизированных с использованием агара не обнаружено. У крыс, алкоголизированных методом жидкого корма, уровень мРНК титина и небулина увеличился в 1.5–2.5 раза, возможно, из-за более высокого содержания жиров в таком рационе. Представленные данные могут быть полезны при выборе модели хронической алкоголизации животных.
Дисбаланс между синтезом и распадом белков, вызванный хронической алкогольной интоксикацией, лежит в основе развития алкогольной миопатии [1, 2], которая сопровождается атрофическими изменениями в скелетных мышцах как человека [3–6], так и животных [1, 7, 8]. На фоне этих изменений в мышцах снижается общее содержание РНК и ряда белков толстых и тонких нитей [7, 9–11]. Ранее мы выявили важную роль µ-кальпаина в развитии атрофии скелетных мышц крыс, хронически алкоголизированных в течение 6 мес. [11].
Кальпаины – семейство распространенных цитозольных Са2+-активируемых цистеиновых протеаз [12]. К настоящему времени у млекопитающих известно 16 компонентов кальпаиновой системы: 15 протеаз и ингибитор кальпаинов – кальпастатин [13, 14]. В поперечно-полосатых мышцах животных основными по содержанию являются μ-кальпаин (активируется в присутствии микромолярных концентраций ионов кальция – 2–200 мкМ) и m-кальпаин (активируется при субмиллимолярных концентрациях ионов кальция – 400–800 мкМ) [13, 15]. μ-Кальпаин подвергается процессингу (аутолизу) в присутствии ионов Ca2+ [15–17]. Протеолитическая активность фермента, как показано in vitro, при этом повышается [15].
Миофибриллярные белки толстых и тонких нитей мышечных саркомеров, в том числе титин и небулин – гигантские белки саркомерного цитоскелета, расщепляются кальпаинами, в частности μ-кальпаином [13, 18]. Предполагается, что обмен белков в мышечных клетках инициируется кальпаинзависимым протеолизом титина, небулина и других саркомерных белков с последующей деградацией протеолитических фрагментов до аминокислотных остатков по убиквитин-протеасомному пути [14]. Ранее мы зарегистрировали повышенный аутолиз μ-кальпаина в m. soleus и m. gastrocnemius крыс, хронически алкоголизированных в течение 6 мес. [11]. Эти изменения сопровождались снижением содержания титина и небулина, гиперфосфорилированием титина, атрофией мышц задних конечностей, а также снижением экспрессии генов титина и небулина в m. gastrocnemius.
Нами изучены изменения протеолитической активности μ-кальпаина, содержания титина, небулина, кальпастатина, экспрессии генов титина и небулина, а также степени фосфорилирования титина в скелетных мышцах (m. soleus, m. gastrocnemius и m. longissimus dorsi) крыс, хронически алкоголизированных в течение 3 мес. с использованием двух различных методик.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Хроническая алкоголизация крыс. В работе использовали самцов крыс линии Wistar. Масса каждого животного в начале эксперимента составляла 150 ± 5 г. Животных содержали в отдельных клетках в условиях вивария Института теоретической и экспериментальной биофизики (ИТЭБ) РАН и Института биофизики клетки (ИБК) РАН (г. Пущино, Московская обл.). Проведение опытов на животных одобрено Комиссиями по биомедицинской этике ИТЭБ РАН и ИБК РАН. Хроническую алкоголизацию животных проводили в течение 3 мес., используя два метода: 1) метод “I” [19] ‒ крысы получали воду, содержащую 10% этанола, а также агаровые блоки с 30%-ным содержанием этанола (по пять животных в контрольной и опытной группах, среднесуточное потребление этанола 26.6 ± 3.0 г/кг/сутки; и 2) метод “II” [20] – животные получали сбалансированный по питательным веществам жидкий корм, содержащий 5% этанола (по четыре крысы в контрольной и опытной группах, среднесуточное потребление этанола 19.1 ± 2.0 г/кг/сутки.
Крысы, алкоголизированные по методу “I”, и контрольные животные получали стандартный сухой корм: сырой протеин – не менее 19%, сырой жир – не более 5%, сырая зола – не более 9%, сырая клетчатка – не более 4%, кальций – 1.8%, фосфор – 1.1%, витамин А – не менее 5000 МЕ/кг, витамин D – не менее 500 МЕ/кг, витамин E – не менее 30 МЕ/кг, влажность – не более 13.5%; энергетическая ценность – 295 ккал/100 г (ООО “Лабораторкорм”, Москва, Россия).
Содержание питательных веществ в жидком корме животных, алкоголизированных по методу “II”, было следующим: белки – 28.2, жиры – 29.9, клетчатка – 7.2, зола – 5.4, углеводы – 25.5%, влажность менее 10%. Энергетическая ценность – 1000 ккал/л. Содержание питательных веществ в жидком корме контрольных для этой группы животных, было следующим: белки – 16.7, жиры – 17.7, клетчатка – 4.3, зола – 3.3, углеводы – 54.3%, влажность менее 10%. Энергетическая ценность – 1000 ккал/л. Жидкий корм, который получали животные обеих групп, содержал жирные кислоты, минералы, витамины и другие ингредиенты (более подробно состав корма см. на сайте http://www.bio-serv.com/product/LD82SP.html).
В крови крыс, алкоголизированных по методу “II” [20], содержание этанола, измеренное с помощью набора Ethanol FS (DiaSys), составило 25.9 ± 4.8 мМ. Содержание этанола в крови крыс, алкоголизированных по методу “I” [19], не определяли.
При моделировании алкогольной миопатии по методу “I” [19] привыкание животных к алкоголю формировали постепенно, увеличивая содержание этанола в питьевой воде и агаре. В частности, в течение первых 3 суток содержание этанола в воде составляло 5%, после 3 суток и до окончания эксперимента – 10%. Содержание этанола в агаре увеличивали на 5% каждые 3 суток (до конечной концентрации 30%).
После завершения периода хронической алкоголизации животных взвешивали и выводили из эксперимента путем эвтаназии, используя препарат Золетил (“Virbac Sante Animale”, Франция) из расчета 25 мг/кг веса животного, что трехкратно превышает терапевтическую дозу (7–8 мг/кг). Камбаловидную мышцу m. soleus (содержит преимущественно медленные волокна типа I), латеральную и медиальную головки икроножной мышцы (m. gastrocnemius, содержит преимущественно быстрые волокна типа II) вырезали и взвешивали. Спинную мышцу longissimus dorsi (содержит волокна обоих типов) вырезали из пояснично-крестцового отдела. Эту мышцу из-за невозможности ее полного изъятия не взвешивали. Мышцы замораживали в жидком азоте и хранили при температуре –75°С.
Выделение РНК. РНК из мышечной ткани выделяли с использованием набора AurumTM Total RNA Fatty and Fibrous Tissue Kit (“Bio-Rad”, США) согласно протоколу изготовителя. Качество РНК определяли по сохранности 18S и 28S рРНК с помощью электрофореза в 1%-ном агарозном геле. Концентрацию РНК определяли спектрофотометрически с помощью NanoDrop ND-1000 (“NanoDrop Technologies”, США). Раствор РНК хранили при температуре –75°С.
Обратная транскрипция и ПЦР в режиме реального времени. Реакцию обратной транскрипции проводили на суммарной РНК (концентрация 0.2 мкг/мкл) с использованием обратной транскриптазы MMLV (“Евроген”, Россия) и стандартного праймера олиго-dT12. Полученную кДНК использовали для проведения ПЦР. Ген GAPDH, кодирующий глицеральдегид-3-фосфат-дегидрогеназу, использовали в качестве референсного. Нуклеотидные последовательности праймеров к генам титина, небулина и референсному гену GAPDH синтезированы фирмой “Евроген” (Россия) (таблица). Праймеры подбирали с помощью программы Vector NTI Advance 11. ПЦР в реальном времени проводили на амплификаторе ДТ-322 (“ДНК-Технология”, Россия) c использованием Tersus ДНК-полимеразы (“Евроген”) и флуоресцентного красителя SYBR Green I (“Invitrogen”, США). Режим ПЦР был следующим: 1) “горячий старт” – 95°C, 5 мин; 2) денатурация – 95°C, 15 с; 3) отжиг праймеров – 64°C, 20 с; 4) элонгация – 72°C, 20 с. Этапы 2–4 повторяли 35 раз. Изменение экспрессии генов рассчитывали по методу 2–ΔΔСt [21]. Значения ΔΔСt рассчитывали по формуле ΔΔСt = ΔСt (контроль) – ΔСt (опыт). Каждое значение ΔСt рассчитывали по формуле ΔСt = Сt (исследуемый ген) – Сt (референсный ген). Продукты амплификации разделяли в 2%-ном агарозном геле. Ампликоны выделяли из геля согласно протоколу Cleanup Standard (“Евроген”). Фрагменты ДНК секвенировали в “Евроген”.
Таблица 1.
Пары праймеров для ПЦР в реальном времени
| Праймер | Нуклеотидная последовательность | Размер продукта, п.н. |
|---|---|---|
| Ttn F Ttn R |
CAGCAGCCAAGAAAGCCGCT CACCACTCTGATACTCTGAGGCTCTG |
71 |
| Neb F Neb R |
CACCAGAAATCATGTTGGCG GCTTCGCAAGTCATAGCCTT |
104 |
| Gapdh F Gapdh R |
GCAAGAGAGAGGCCCTCAG TGTGAGGGAGATGCTCAGTG |
74 |
Гель-электрофорез в денатурирующих условиях и иммуноблотинг кальпаина и кальпастатина. μ-Кальпаин выделяли из скелетных мышц крысы согласно [16]. Кальпастатин и референсный белок GAPDH выделяли с использованием лизирующего буфера (12 мM Трис-HCl, 1.2% додецилсульфата Na (ДСН), 5 мM EGTA, 10% глицерина, 2% β-меркаптоэтанола, 5 мкг/мл леупептина или E64, pH 7.0). Образцы белка нагревали при 95°С в течение 4 мин. На дорожки наносили одинаковые объемы образцов, выровненных по концентрации суммарного белка. Концентрацию суммарного белка определяли методом Бредфорда по протоколу изготовителя (“Силекс”, Россия), используя в качестве стандарта бычий сывороточный альбумин. ДСН-электрофорез μ-кальпаина проводили по методу [22] в 6.5%-ном ПААГ, кальпастатина и GAPDH – в 9.5%-ном. Белки переносили из геля на PVDF-мембрану. Использовали первичные антитела к μ-кальпаину (“Abcam”, ab28258, разведение 1 : 4000), кальпастатину (“Abcam”, ab28252, Англия, разведение 1 : 3000) и GAPDH (“Abcam”, ab37168, разведение 1 : 2000). В качестве вторичных антител использовали антитела, конъюгированные со щелочной фосфатазой (“Abcam”, ab6722, разведение 1 : 3000). Для визуализации белковых полос использовали раствор NBT/BCIP (“Roche”, Германия).
ДСН-гель-электрофорез титина и небулина. Для электрофоретического разделения небулина (мол. масса 770 кДа) и высокомолекулярных изоформ титина-1 (Т1, мол. масса 3300–3700 кДа) скелетных мышц [23] использовали крупнопористый 2.1–2.2%-ный ПААГ с ДСН и 0.5%-ным содержанием агарозы, приготовленный по методу Татсуми–Хаттори [24] с нашими модификациями [25]. Пробы подготавливали с использованием метода, исключающего нагревание выше 40°С [25] для предотвращения разрушения титина.
Определение уровня фосфорилирования титина. Уровень фосфорилирования титина оценивали с помощью флуоресцентного красителя фосфатных групп белков Pro-Q Diamond (“Invitrogen”) по методу [26] c незначительными модификациями, описанными ниже. После электрофореза гель фиксировали в течение 12–18 ч в растворе, содержащем 50% этанола и 10% уксусной кислоты. После отмывки в течение 30 мин в дистиллированной воде гель окрашивали в течение 1.5 ч красителем Pro-Q Diamond, затем отмывали в готовом растворе (Pro-Q® Diamond Phosphoprotein Gel Destaining Solution) в течение 1.5 ч. Полосы титина, содержащие фосфатные группы, визуализировали с помощью системы гель-документирования и оценки содержания фосфатных групп в белках (Pharos FX Plus Molecular Image, “Bio-Rad”, США). Далее гели окрашивали Coomassie Brilliant Blue G-250 и R-250 (“Serva”, Германия), смешанными в cоотношении 1 : 1 для контрольной оценки содержания белка.
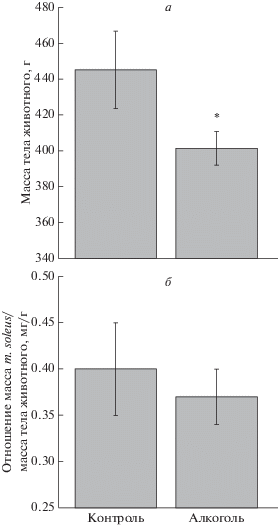
Рис. 1.
Изменение массы тела (а) и отношения “масса m. soleus/масса тела животного” (б) у крыс, алкоголизированных по методу “I” *р ≤ 0.05.
Определение активности кальпаинов. Активность кальпаинов в белковых экстрактах скелетных мышц определяли методом флуоресцентной спектрофотометрии с использованием набора Calpain Activity Assay Kit (“Abcam”) согласно протоколу изготовителя. Измерения проводили на многофункциональном микропланшетном флуориметре Infinite F200 (“Tecan”, Австрия).
Денситометрия и статистическая обработка данных. Отмытые гели и мембраны сканировали, оцифровывали, а затем проводили денситометрическую обработку с помощью компьютерной программы Total Lab v1.11. Содержание титина и небулина оценивали по отношению к содержанию тяжелых цепей миозина [27]. С этой целью значения оптической плотности титина и небулина соотносили со значениями оптической плотности тяжелых цепей миозина. Известно, что белки толстых и тонких нитей (миозин, титин, небулин) связаны в саркомере друг с другом в определенном соотношении (в частности, шесть молекул титина на каждую миозиновую нить в половине саркомера) [28]. Этот способ оценки содержания титина и небулина широко используется, он более точен, чем метод определения содержания этих белков исходя из суммарного белка в пробе.
Статистическую обработку данных проводили с использованием непараметрического U-критерия Манна–Уитни, значения в контроле принимали за 100%. При определении изменений содержания титина и небулина, а также уровня фосфорилирования титина рассчитывали среднее контрольное значение по результатам, полученным при использовании не менее трех контрольных образцов. Стандартные отклонения при этом не превышали 5, 7 и 10% для небулина, титина и уровня фосфорилирования титина соответственно.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Не обнаружено статистически значимых различий в массе m. soleus, m. gastrocnemius и массе тела контрольных и алкоголизированных по методу “II” крыс (данные не показаны). Cравнение параметра “масса мышц/масса тела животного”, характеризующего развитие гипертрофических (при увеличении соотношения) или атрофических (при снижении соотношения) изменений у контрольных крыс и у животных, алкоголизированных по методу “II”, также не выявило статистически значимых различий.
Обнаружено статистически значимое уменьшение (на 10%, р ≤ 0.05) (рис. 1а) массы тела крыс, алкоголизированных по методу “I”, что согласуется со сходными изменениями массы тела после 14 недель хронической алкоголизации, проведенной аналогичным способом [19]. Не выявлено статистически значимых различий в массе m. gastrocnemius, а также параметра “масса m. gastro-cnemius/масса тела животного” у контрольных и алкоголизированных по методу “I” крыс (данные не показаны), однако отмечено снижение (на 16.7%, р ≤ 0.05) массы m. soleus у крыс этой алкогольной группы. При этом отсутствовали статистически значимые различия в параметре “масса m. soleus/масса тела животного” у контрольных крыс и алкоголизирванных по методу “I” (рис. 1б). Таким образом, полученные результаты свидетельствуют об отсутствии атрофических изменений в исследованных мышцах задних конечностей крыс, алкоголизированных в течение 3 мес. c использованием двух различных методик.
Принимая во внимание полученные нами результаты, а также данные о том, что атрофические изменения в m. soleus и m. gastrocnemius крыс, алкоголизированных в течение 6 мес., сопровождались увеличением содержания аутолитического фрагмента µ-кальпаина [11], мы не ожидали обнаружить повышения аутолиза µ-кальпаина в скелетных мышцах крыс после хронической алкоголизации в течение 3 мес. Действительно, методом иммуноблотинга не выявлено статистически значимых различий в содержании интактного µ-кальпаина (мол. масса 80 кДа) и фрагмента его аутолиза (мол. масса 78 кДа) в m. gastrocnemius у крыс контрольных и алкоголизированных групп (рис. 2а). Не обнаружено различий в содержании интактного µ-кальпаина в m. soleus и m. longissimus dorsi крыс исследуемых групп (рис. 2а). По данным иммуноблотинга в этих скелетных мышцах отсутствовал аутолитический фрагмент µ-кальпаина. Этот феномен интересен тем, что аутолизированная форма µ-кальпаина была представлена как в m. soleus [11], так и в m. longissimus dorsi более взрослых крыс, хроническая алкоголизация которых продолжалась 6 мес. (неопубликованные данные). Вполне вероятно, что в мышцах с достаточно высоким содержанием медленных волокон, аутолитические изменения µ-кальпаина менее интенсивны и более зависимы от возраста животного, чем в мышцах с бóльшим количеством быстрых волокон. Несомненно, что для выяснения причин и закономерностей этих различий необходимы дополнительные исследования.
Рис. 2.
Иммуноблотинг µ-кальпаина (а) и кальпастатина (б) скелетных мышц крыс: контрольных и алкоголизированных по методу “II”. Содержание µ-кальпаина (80 кДа) и его аутолизированного фрагмента (78 кДа) в m. gastrocnemius крыс контрольной группы составило: 75.9 ± 3.8 и 24.1 ± 3.8 соответственно; в “алкогольной” группе – 70.3 ± 6.5 и 29.7 ± 6.5 соответственно. Соотношение содержания µ-кальпаина и кальпастатина в скелетных мышцах крыс алкоголизированной группы и в мышцах крыс контрольной группы – 108.8 ± 10.8 и 98.3 ± 3.4 (m. longissimus dorsi), 96.8 ± 16.6 и 106 ± 4.3 (m. gastrocnemius), 100.8 ± 9.5 и 98 ± 6.7 (m. soleus) соответственно.
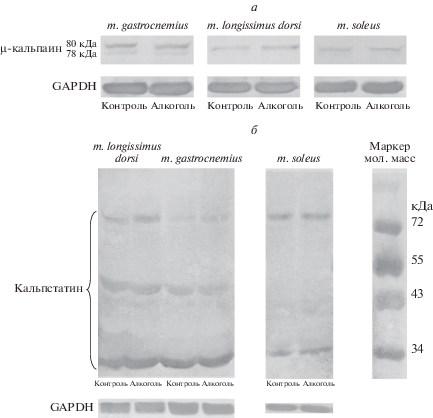
Методом иммуноблотинга в скелетных мышцах контрольных и алкоголизированных животных не выявлено статистически значимых различий в содержании кальпастатина (рис. 2б), полипептиды которого в разных тканях имеют молекулярные массы 34–300 кДа [13]. Флуориметрические измерения, проведенные с использованием Calpain Activity Assay Kit (“Abcam”), также не выявили различий в общей активности кальпаинов в белковых экстрактах скелетных мышц крыс исследованных групп (рис. 3).
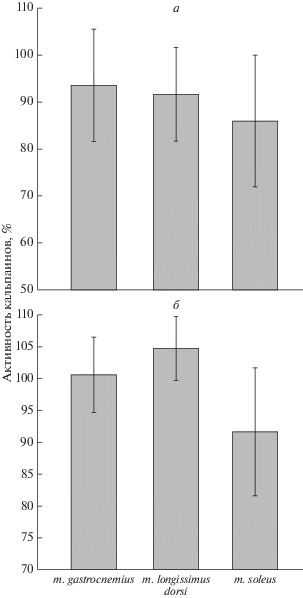
Рис. 3.
Суммарная активность кальпаинов в белковых экстрактах скелетных мышц крыс, алкоголизированных c использованием методов “I” (а) и “II” (б). Данные, представленные в процентах относительно контрольных значений, принятых за 100%, получены с использованием набора Calpain Activity Assay Kit (“Abcam”).
Данные о содержании µ-кальпаина и кальпастатина в скелетных мышцах контрольных животных и крыс, алкоголизированных по методу “I”, не приведены. Статистически значимых различий в содержании µ-кальпаина, его аутолитического фрагмента и кальпастатина в скелетных мышцах крыс контрольных и алкоголизированных групп не выявлено.
Таким образом, полученные результаты указывают на отсутствие изменений в содержании µ-кальпаина и кальпастатина, а также в протеолитической активности µ-кальпаина в скелетных мышцах крыс, алкоголизированных в течение 3 мес. с помощью двух различных методик. Наши результаты согласуются с данными [29] об отсутствии изменений в активности µ- и m-кальпаинов в мышцах задних конечностей крыс, алкоголизированных в течение 6 недель по методу “II”.
На рис. 4 и рис. 5 представлены результаты электрофоретического анализа содержания титина и небулина (субстратов кальпаинов) в скелетных мышцах крыс контрольных и алкоголизированных групп. Принимая во внимание данные об отсутствии изменений общей активности кальпаинов и повышенного аутолиза µ-кальпаина, мы не ожидали обнаружить снижение содержания гигантских белков саркомерного цитоскелета. Действительно, не выявлено статистически значимых изменений в содержании небулина и изоформ интактного Т1 (NT, N2A) в скелетных мышцах крыс двух алкоголизированных групп (рис. 4, рис. 5б). При этом в m. soleus крыс, алкоголизированных по методу “II”, наблюдали увеличение содержания протеолитических Т2-фрагментов (в ~1.3 раза, р ≤ 0.01) (pис. 4б, рис. 5б), что свидетельствует о повышенном обмене белка в камбаловидной мышце. Повышенный (в 2.5 раза, р ≤ 0.01) уровень экспрессии гена титина в этой мышце (рис. 6б) может обеспечить повышение синтеза этого белка, тогда как увеличенная деградация может быть следствием изменения уровня фосфорилирования титина и связанного с этим изменения чувствительности к протеолизу.
Рис. 4.
Содержание титина и небулина в скелетных мышцах крыс, алкоголизированных по методу “I” (а) и методу “II” (б). Данные представлены в процентах относительно контрольных значений, принятых за 100%. *р ≤ 0.01. Т1 – интактный титин; Т2 – протеолитические фрагменты интактного Т1.
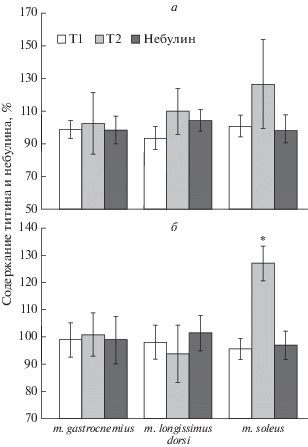
Рис. 5.
Фосфорилирование титина (а, Pro-Q Diamond) и содержание титина и небулина (б, Coomassie Brilliant Blue) в m. soleus контрольных и алкоголизированных c использованием метода “II” крыс. ДСН-гель-электрофорез в 2.1%-ном полиакриламидном геле, укрепленном агарозой. ТЦМ – тяжелые цепи миозина; Т1 – интактный титин; Т2 – протеолитические фрагменты интактного Т1; NT, N2A – изоформы интактного Т1.

Способность титина к фосфорилированию in vivo была показана в 1988 году [30]. К настоящему времени известно, что титин фосфорилируется протеинкиназами PKА [31, 32], PKG [32], PKC [33], ERK1/2 [34], а также Ca2+/кальмодулинзавиcимой киназой [35]. Установлено, что чувствительность белковых субстратов к протеолизу кальпаинами изменяется в зависимости от уровня их фосфорилирования. В частности, опосредованное PKA фосфорилирование тpопонина-I снижало его чувствительность к деградации µ-кальпаином, тогда как фосфорилирование РКС, наоборот, увеличивало чувствительность тpопонина-I к протеолизу [36]. Прямых экспериментальных подтверждений, свидетельствующих об изменении чувствительности титина к протеолизу при изменении уровня его фосфорилирования, мы не обнаружили. Однако имеются косвенные данные, указывающие на то, что гиперфосфорилирование титина сопровождается увеличением протеолитической деградации этого белка. В частности, c использованием флуоресцентного красителя фосфатных групп белков Pro-Q Diamond показано, что атрофические изменения в m. gastrocnemius мышей в условиях реальной микрогравитации сопровождались не только снижением содержания титина, но и увеличением (в 1.3 и 3.3 раза, р ≤ 0.01) степени фосфорилирования Т1 и Т2 соответственно [37]. Аналогичные изменения уровня фосфорилирования Т1 и Т2, сопровождающиеся повышенным протеолизом интактного титина, обнаружены при развитии индуцируемой алкоголем атрофии в m. gastrocnemius и m. soleus крыс [11]. Известны результаты, полученные c применением моноклональных антител к фоcфоcеpину pS26, согласно которым трехкратное увеличение степени фосфорилирования PEVK-участка (расположен в зоне I молекулы) титина в четырехглавой мышце бедра пациентов c синдромом Элеpcа–Данлоcа сопровождалось снижением (на ~20%) содержания этого белка [38]. Учитывая наши результаты и опубликованные данные, мы предположили, что гиперфосфорилирование титина, в основном Т2-фрагмента его молекулы, способствует увеличению чувствительности этого белка к протеолизу [11].
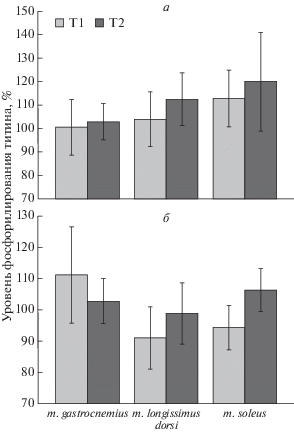
Нами не обнаружено статистически значимых различий в уровне фосфорилирования Т1 и Т2 в m. soleus контрольных и алкоголизированных по методу “II” крыс (рис. 5а (Pro-Q Diamond), рис. 7б). Аналогичные результаты получены и для других скелетных мышц крыс всех исследованных групп (рис. 7). Таким образом, полученные результаты не позволяют сделать обоснованного заключения о роли фосфорилирования титина в повышенном обмене этого белка в камбаловидной мышце крыс, алкоголизированных по методу “II” (рис. 4б, рис. 5б).
Обсуждая изменение экспрессии генов титина и небулина в скелетных мышцах крыс, алкоголизированных разными методами, следует обратить внимание на следующее. При некой тенденции к снижению экспрессии генов титина и небулина не выявлено статистически значимых различий в экспрессии генов этих белков в скелетных мышцах контрольных и алкоголизированных по методу “I” крыс (pис. 6а). Напротив, в мышцах крыс, алкоголизированных по методу “II”, экспрессия генов титина и небулина была в 1.5–2.5 раза выше, чем в контроле (pис. 6б). Индуцированные алкоголем разнонаправленные изменения экспрессии генов саркомерных (миозина, титина, небулина) и других (в том числе µ-кальпаина и кальпастатина) белков поперечно-полосатых мышц ранее были обнаружены у человека [2] и животных [9, 11, 39–41]. Эти данные свидетельствуют о сложных механизмах регуляции экспрессии генов мышечных белков при хронической алкогольной интоксикации.
Рис. 6.
Изменение уровня экспрессии генов титина и небулина в скелетных мышцах крыс, алкоголизированных по методу “I” (а) и “II” (б). Данные представлены в процентах относительно контрольных значений, принятых за 100%. *р ≤ 0.01.
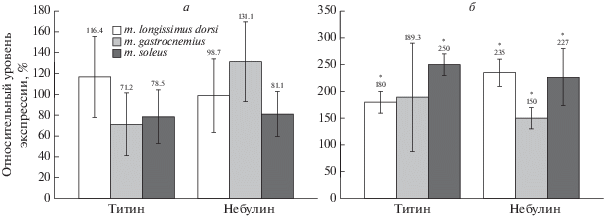
Рис. 7.
Уровень фосфорилирования титина в скелетных мышцах крыс, алкоголизированных по методу “I” (а) и “II” (б). Данные представлены в процентах относительно контрольных значений, принятых за 100%. Т1 – интактный титин; Т2 – протеолитические фрагменты интактного Т1.
Причина различий в экспрессии генов титина и небулина в исследованных нами мышцах крыс, алкоголизированных разными методами (рис. 6), не ясна, однако можно сделать следующее предположение. Известно, что липиды играют важную роль в модуляции мышечной массы, участвуя в регуляции активности анаболических и катаболических сигнальных путей (см. [42]). Возможно, свой вклад в увеличение экспрессии генов титина и небулина в мышцах крыс, алкоголизированных по методу “II”, внесло более высокое содержание жиров в жидком корме, чем в сухом (см. Экспериментальную часть). Для выяснения молекулярных механизмов этих изменений необходимы дополнительные исследования.
Подводя итог, можно отметить следующее. Не зарегистрировано атрофических изменений в скелетных мышцах крыс, алкоголизированных в течение 3 мес разными методами. Не обнаружено повышенного аутолиза μ-кальпаина, изменений общей активности кальпаинов, содержания интактного титина, небулина, μ-кальпаина и кальпастатина, а также уровня фосфорилирования титина в скелетных мышцах хронически алкоголизированных крыс. Выявлено повышение (в 1.5–2.5 раза) экспрессии генов титина и небулина в скелетных мышцах крыс, алкоголизированных по методу “II”. Полученные данные могут быть полезны при выборе модели хронической алкоголизации животных.
Работа выполнена в рамках Государственного задания Института теоретической и экспериментальной биофизики (ИТЭБ) РАН при финансовой поддержке гранта Российского фонда фундаментальных исследований (№ 14-04-00112) с использованием оборудования коллективного пользования ИТЭБ РАН и ИБК РАН.
Список литературы
Steiner J.L., Lang C.H. (2015) Dysregulation of skeletal muscle protein metabolism by alcohol. Am. J. Physiol. Endocrinol. Metab. 308, E699–E712.
Shenkman B.S., Belova S.P., Zinovyeva O.E., Samkhaeva N.D., Mirzoev T.M., Vilchinskaya N.A., Altaeva E.G., Turtikova O.V., Kostrominova T.Y., Nemirov-skaya T.L. (2018) Effect of chronic alcohol abuse on anabolic and catabolic signaling pathways in human skeletal muscle. Alcohol. Clin. Exp. Res. 42(1), 41–52.
Hanid A., Slavin G., Mair W., Sowter C., Ward P., Webb J., Levi J. (1981) Fiber type changes in striated muscle of alcoholics. J. Clin. Pathol. 34, 991–995.
Freilich R., Kirsner R., Whelan G., Chmiel R., Byrne E. (1996) Quantitative measure of muscle strength and size in chronic alcoholism: an early indication of tissue damage. Drug Alcohol. Rev. 15, 277–287.
Шенкман Б.С., Маслова Г.А., Стогова Ю.В., Зиновьева О.Е., Яхно Н.Н. (2009) Атрофия медленных и быстрых волокон локомоторной мышцы у больных хроническим алкоголизмом. Клинико-физиологический анализ. Технологии живых систем. 8, 3–10.
Немировская Т.Л., Шенкман Б.С., Зиновьева О.Е., Казанцева Ю.Н., Самхаева Н.Д. (2015) Развитие клинических и морфологических проявлений хронической алкогольной миопатии у мужчин на фоне длительной алкогольной интоксикации. Физиология человека. 41(6), 65–69.
Preedy V.R., Peters T.J. (1988) The effect of chronic ethanol ingestion on protein metabolism in type-I- and type-II-fibre-rich skeletal muscles of the rat. Biochem. J. 254, 631–639.
Лысенко Е.А., Туртикова О.В., Морозкина Е.В., Хотченков В.П., Попов В.О., Шенкман Б.С. (2012) Эффекты рекомбинантного механозависимого фактора роста на фоне хронической алкоголизации крыс. Рос. Физиол. Журн. им. И.М. Сеченова. 98, 283–292.
Reilly M.E., McKoy G., Mantle D., Peters T.J., Goldspink G., Preedy V.R. (2000) Protein and mRNA levels of the myosin heavy chain isoforms Ibeta, IIa, IIx and IIb in type I and type II fibre-predominant rat skeletal muscles in response to chronic alcohol feeding. J. Muscle Res. Cell Motil. 21, 763–773.
Hunter R.J., Neagoe C., Järveläinen H.A., Martin C.R., Lindros K.O., Linke W.A., Preedy V.R. (2003) Alcohol affects the skeletal muscle proteins, titin and nebulin in male and female rats. J. Nutr. 133, 1154–1157.
Gritsyna Y.V., Salmov N.N., Bobylev A.G., Ulano-va A.D., Kukushkin N.I., Podlubnaya Z.A., Vikhlyantsev I.M. (2017) Increased autolysis of μ-calpain in skeletal muscles of chronic alcohol-fed rats. Alcohol. Clin. Exp. Res. 41, 1686–1694.
Suzuki K. (1990) The structure of the calpains and the calpain gene, in intracellular calcium-dependent proteolysis. Eds Mellgren R.L., Murachi T. Boca Raton, FL: CRC Press, 25–35.
Goll D.E., Thompson V.F., Li H., Wei W., Cong J. (2003) The calpain system. Physiol. Rev. 83, 731–801.
Goll D.E., Neti G., Mares S.W., Thompson V.F. (2008) Myofibrillar protein turnover: the proteasome and the calpains. J. Anim. Sci. 86, E19–35.
Baki A., Tompa P., Alexa A., Molnar O., Friedrich P. (1996) Autolysis parallels activation of mu-calpain. Biochem. J. 318, 897–901.
Murphy R.M., Snow R.J., Lamb G.D. (2006) mu-Calpain and calpain-3 are not autolyzed with exhaustive exercise in humans. Am. J. Physiol. Cell. Physiol. 290, C116–C122.
Murphy R.M., Verburg E., Lamb G.D. (2006) Ca2+ activation of diffusible and bound pools of mu-calpain in rat skeletal muscle. J. Physiol. 576, 595–612.
Mohrhauser D.A., Underwood K.R., Weaver A.D. (2011) In vitro degradation of bovine myofibrils is caused by μ-calpain, not caspase-3. J. Anim. Sci. 89, 798–808.
Lang C.N., Wu D., Frost R.A., Jefferson L.S., Kimball S.R., Vary T.C. (1999) Inhibition of muscle protein synthesis by alcohol is associated with modulation of eIF2B and eIF4E. Am. J. Physiol. Endocrinol. Metab. 277, E268 –E276.
Lieber C.S., DeCarli L.M. (1989) Liquid diet technique of ethanol administration: 1989 update. Alcohol Alcohol. 24, 197–211.
Livak K.J., Schmittgen T.D. (2001) Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25, 402–408.
Laemmli U.K. (1970) Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227, 680–685.
Вихлянцев И.М., Подлубная З.А. (2012) Новые изоформы тайтина (коннектина) и их функциональная роль в поперечно-полосатых мышцах млекопитающих: факты и предположения. Успехи биол. химии. 52, 239–280.
Tatsumi R., Hattori A. (1995) Detection of giant myofibrillar proteins connectin and nebulin by electrophoresis in 2% polyacrylamide slab gels strengthened with agarose. Anal. Biochem. 224, 28–31.
Vikhlyantsev I.M., Podlubnaya Z.A. (2017) Nuances of electrophoresis study of titin/connectin. Biophys. Rev. 9, 189–199.
Borbely A., Falcao-Pires I., van Heerebeek L., Hamdani N., Edes I., Gavina C., Leite-Moreira A.F., Bronzwaer J.G., Papp Z., van der Velden J., Stienen G.J., Paulus W.J. (2009) Hypophosphorylation of the stiff N2B-titin isoform raises cardiomyocyte resting tension in failing human myocardium. Circ. Res. 104, 780–786.
Cazorla O., Freiburg A., Helmes M., Centner T., McNabb M., Wu Y., Trombitas K., Labeit S., Granzier H. (2000) Differential expression of cardiac titin isoforms and modulation of cellular stiffness. Circ. Res. 86, 59–67.
Liversage A.D., Holmes D., Knight P.J., Tskhovrebova L., Trinick J. (2001) Titin and the sarcomere symmetry paradox. J. Mol. Biol. 305, 401–409.
Koll M., Ahmed S., Mantle D., Donohue T.M., Palmer T.N., Simanowski U.A., Seltz H.K., Peters T.J., Preedy V.R. (2002) Effect of acute and chronic alcohol treatment and their superimposition on lysosomal, cytoplasmic, and proteosomal protease activities in rat skeletal muscle in vivo. Metabolism. 51, 97–104.
Somerville L.L., Wang K. (1988) Sarcomere matrix of striated muscle: in vivo phosphorylation of titin and nebulin in mouse diaphragm muscle. Arch. Biochem. Biophys. 262, 118–129.
Krüger M., Linke W.A. (2006) Protein kinase-A phosphorylates titin in human heart muscle and reduces myofibrillar passive tension. J. Muscle Res. Cell Motil. 27, 435–444.
Kötter S., Gout L., Von Frieling-Salewsky M., Mül-ler A.E., Helling S., Marcus K., Dos Remedios C., Linke W.A., Krüger M. (2013) Differential changes in titin domain phosphorylation increase myofilament stiffness in failing human hearts. Cardiovasc. Res. 99, 648–656.
Hidalgo C., Hudson B., Bogomolovas J., Zhu Y., Anderson B., Greaser M., Labeit S., Granzier H. (2009) PKC phosphorylation of titin’s PEVK element: a novel and conserved pathway for modulating myocardial stiffness. Circ. Res. 105, 631–638.
Gautel M., Goulding D., Bullard B., Weber K., Fürst D.O. (1996) The central Z-disk region of titin is assembled from a novel repeat in variable copy numbers. J. Cell Sci. 109, 2747–2754.
Hidalgo C.G., Chung C.S., Saripalli C., Methawasin M., Hutchinson K.R., Tsaprailis G., Labeit S., Mattiazzi A., Granzier H.L. (2013) The multifunctional Ca2+/calmodulin-dependent protein kinase II delta (CaMKIIδ) phosphorylates cardiac titin’s spring elements. J. Mol. Cell Cardiol. 54, 90–97.
Di Lisa F., De Tullio R., Salamino F., Barbato R., Melloni E., Siliprandi N., Schiaffino S., Pontremoli S. (1995) Specific degradation of troponin T and I by µ-calpain and its modulation by substrate phosphorylation. Biochem. J. 308, 57–61.
Ulanova A., Gritsyna Y., Vikhlyantsev I., Salmov N., Bobylev A., Abdusalamova Z., Rogachevsky V., Shenkman B., Podlubnaya Z. (2015) Isoform composition and gene expression of thick and thin filament proteins in striated muscles of mice after 30-day space flight. Biomed. Res. Int. 2015, 104735. doi 10.1155/2015/104735
Ottenheijm C.A., Voermans N.C., Hudson B.D., Irving T., Stienen G.J., van Engelen B.G., Granzier H. (2012) Titin-based stiffening of muscle fibers in Ehlers–Danlos syndrome. J. Appl. Physiol. (1985). 112, 1157–1165.
Vary T.C., Deiter G. (2005) Long-term alcohol administration inhibits synthesis of both myofibrillar and sarcoplasmic proteins in heart. Metabolism. 54, 212–219.
Грицына Ю.В., Салмов Н.Н., Вихлянцев И.М., Уланова А.Д., Шарапов М.Г., Теплова В.В., Подлубная З.А. (2013) Изменение экспрессии гена и содержания тайтина (коннектина) в поперечно-полосатых мышцах хронически алкоголизированных крыс. Молекуляр. биология. 47, 996–1003.
Гpицына Ю.В., Cалмов Н.Н., Бобылёв А.Г., Фадеева И.С., Фесенко Н.И., Садикова Д.Г., Кукушкин Н.И., Подлубная З.А., Виxлянцев И.М. (2017) Хроническая алкогольная интоксикация не сопровождается увеличением протеолитической активности кальпаинов в сердечной мышце крыс. Биохимия. 82 (2), 280–289.
Lipina C., Hundal H.S. (2017) Lipid modulation of skeletal muscle mass and function. Cachexia Sarcopenia Muscle. 8(2), 190–201. doi 10.1002/jcsm.12144
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


