Молекулярная биология, 2019, T. 53, № 2, стр. 303-310
Роль растворимого HLA-G при вертикальной передаче инфекции Toxoplasma gondii
H. F. Wang a, c, Y. Z. Jiang a, L. Q. Ren b, X. B. Liu a, H. X. Zhang a, X. M. Hu a, b, *
a Department of Immunology, Binzhou Medical University
264003 Shandong Province, Yantai, China
b Medical and Pharmaceutical Research Center, Binzhou Medical University
264003 Shandong Province, Yantai, China
c Department of Immunology, Shandong College of Traditional Chinese Medicine
264003 Shandong Province, Yantai, China
* E-mail: xue-mei-hu@163.com
Поступила в редакцию 03.04.2018
После доработки 14.07.2018
Принята к публикации 17.07.2018
Аннотация
Растворимый лейкоцитарный антиген G (sHLA-G) человека играет ключевую роль при беременности, взаимодействуя с ингибиторными рецепторами децидуальных естественных киллерных клеток (dNK) плацентарного барьера. С целью исследовать возможную роль sHLA-G во время беременности, отягощенной инфекцией Toxoplasma gondii, мы проанализировали концентрацию мышиного функционального гомолога sHLA-G, Qa-2, у инфицированных и не инфицированных T. gondii беременных мышей линии C57BL/6, а также содержание sHLA-G в культуральной среде линии BeWo. Кроме того, проведена оценка уровней экспрессии KIR2DL4 на клетках dNK человека и NKG2A у беременных мышей. Показано, что инфекция T. gondii приводит к значительному повышению уровней Qa-2 и NKG2A у беременных мышей. В клетках человека инфекция T. gondii также приводила к усилению экспрессии sHLA-G и KIR2DL4. При обработке антителами против sHLA-G уровень KIR2DL4, повышающийся при инфекции T. gondii, снижался. Таким образом, sHLA-G индуцирует усиление экспрессии KIR2DL4, что приводит к чрезмерной иммунологической толерантности. В результате T. gondii избегает иммунного ответа и передается плоду по механизму вертикальной трансмиссии, что может приводить к неблагоприятным исходам беременности.
ВВЕДЕНИЕ
Toxoplasma gondii – условно патогенный паразит, который может приводить к серьезным последствиям для беременных женщин и иммунокомпроментированных индивидов. Так, T. gondii входит в перечень возбудителей TORCH-группы [1]. При заражении токсоплазмой на первом триместре беременности паразит может передаться вертикально и вызвать самопроизвольный аборт, мертворождение или аномалии развития плода, в том числе повреждения мозга и глаз [2]. Однако иммунные механизмы, ассоциированные с вертикальной трансмиссией T. gondii, до сих пор не выяснены.
Взаимодействие между иммунными клетками децидуальной оболочки и трофобластом плода играет важную роль в нормально протекающей беременности. В формировании иммунологической толерантности при беременности задействован человеческий лейкоцитарный антиген G (HLA-G), неклассический белок главного комплекса гистосовместимости класса I, экспрессия которого ограничена клетками экстраворсинчатого трофобласта [3, 4]. Растворимую форму HLA-G (sHLA-G) детектируют в амниотической жидкости, пуповинной крови, материнской сыворотке и плацентарной крови [5]. Из-за его широкого распространения исследователи предположили, что sHLA-G играет важную роль в формировании иммунной толерантности в качестве иммуносупрессивной молекулы [6]. В последнее время появляется все больше работ, посвященных изучению этого белка. sHLA-G можно детектировать в супернатантах эмбриональных культур после искусственного оплодотворения, он является важным маркером имплантации эмбриона [7]. Белок Qa-2 мыши считается гомологом человеческого HLA-G. Мышиный Qa-2, как и HLA-G у человека, вовлечен в регуляцию иммунитета в процессе эмбрионального развития [8].
В ряде исследований показано, что концентрация sHLA-G в сыворотке крови беременных женщин падает при неблагоприятных исходах беременности, таких как преэклампсия и самопроизвольный аборт [9]. Отсюда следует, что sHLA-G связан с нормальным протеканием беременности. sHLA-G подавляет цитотоксичность децидуальных естественных киллеров (dNK) путем взаимодействия с ингибиторными рецепторами на их поверхности и таким образом формирует иммунную толерантность плацентарного барьера [10]. К упомянутым ингибиторным рецепторам относятся Ig-подобный рецептор 2DL4 клеток-киллеров (KIR2DL4) и гетеродимер CD94/NKG2A [11]; при этом HLA-G – единственный известный лиганд KIR2DL4, экспрессия которого в основном ограничена NK-клетками CD56bright/CD16dim (они в основном и образуют популяцию dNK) [12]. Взаимодействие sHLA-G и KIR2DL4 необходимо для трансдукции ингибиторного сигнального каскада [12].
Ранее нами показано, что экспрессия HLA-G трофобластом усиливается при инфекции T. gondii [13]. В данном исследовании мы сосредоточились на дальнейшем изучении in vivo и in vitro уровней экспрессии sHLA-G во время беременности, отягощенной инфекцией T. gondii, и роли sHLA-G в вертикальной передаче инфекции T. gondii от матери плоду.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Мышиная модель инфекции. Исследование проведено на мышах линии C57BL/6 (самки в возрасте 6–8 недель и самцы в возрасте 8–10 недель). Беременных самок распределяли по двум группам случайным образом. Самкам из испытуемой группы на восьмые сутки беременности вводили внутрибрюшинно 400 тахизоитов T. gondii в 200 мкл стерильного фосфатного буфера (PBS), мышам из контрольной группы вводили равный объем стерильного буфера. У животных анализировали течение беременности и состояние плода.
Использование мышей для исследования были одобрены Комитетом по этике Медицинского колледжа Университета Биньчжоу (University of Binzhou Medical College Ethics Committee). Все эксперименты с животными проводили в соответствии с Национальными рекомендациями по содержанию животных, и все относящиеся к ним данные были одобрены для публикации Экспертным советом колледжа.
Клеточная модель инфекции. Клетки линии BeWo, используемые в качестве экспериментальной модели клеток трофобласта [14] в этом исследовании, были любезно предоставлены Институтом акушерства и гинекологии Университета Фудань (Institute of Gynecology and Obstetrics of Fudan University, Китай). Клетки инфицировали штаммом T. gondii RH в соотношении 3 : 1 (паразиты : : клетки) в течение 24 ч. К контрольной группе вместо инфекционного агента добавляли тот же объем PBS.
Клетки dNK изолировали из тканей, полученных от 20 пациенток, добровольно сделавших аборт в отделении акушерства и гинекологии Янтайской больницы китайской медицины и Янтайской больнице Юй Хуан Дин (Department of Obstetrics and Gynecology, Yantai Chinese Medicine Hospital and Yantai Yu Huang Ding Hospital, Китай). Аборты были сделаны в первом триместре, между 6 и 12 неделями беременности. Из полученных децидуальных тканей выделяли клетки dNK по методу, разработанному в нашей лаборатории. В соответствии со схемой исследования, очищенные dNK-клетки из каждого образца разделяли на 4 группы: контрольную, инфицированную, sHLA-G и анти-HLA-G-Ab (обработанную нейтрализующими sHLA-G антителами). Клетки из всех групп, кроме контрольной, смешивали с 5.0 × 106 тахизоитов T. gondii в соотношении 5 : 1 (паразиты : клетки). Кроме того, клетки из sHLA-G-группы инкубировали с супернатантом клеток BeWo, а клетки из последней группы инкубировали с супернатантом клеток BeWo, предварительно обработанным антителами против HLA-G – anti-HLA-G mAb 87G (“Exbio”, Великобритания).
Процедуры сбора образцов для исследования были одобрены Комитетом по этике Медицинского колледжа Университета Биньчжоу (University of Binzhou Medical College Ethics Committee), от всех пациентов получили информированное согласие.
Иммуноферментный анализ (ИФА). Сыворотки, амниотические жидкости и супернатанты тканей плаценты собирали и анализировали на наличие цитокина Qa-2 при помощи коммерческого набора Mouse Qa-2 ELISA (“R&D”, США) согласно инструкциям производителя. Для определения содержания sHLA-G в супернатанте клеток BeWo использовали коммерческий набор sHLA-G ELISA (“BD Pharmingen”, США) в соответствии с инструкциями производителя. Для каждого эксперимента калибровочную кривую строили с использованием рекомбинантного цитокина. Каждое измерение проводили в трех повторах.
Проточная цитофлуориметрия. Для анализа клеток методом проточной цитофлуориметрии использованы следующие моноклональные антитела (mAb): конъюгированные с фикоэритрином (PE) анти-NKG2A, конъюгированные с PE/CY5.5 анти-NK1.1, (“eBioscience”, США), конъюгированные с PE aнти-KIR2DL4 (“Biolegend”, США) и конъюгированные с PE/CY5.5 анти-CD56 (“BD Pharmingen”). Все образцы инкубировали с антителами в темноте в течение 30 мин при 4°С в соответствии с инструкциями производителя. Двухцветный анализ клеточных популяций проводили на проточном цитофлуориметре FACS с программным обеспечением Cell Quest (“BD”, США).
Статистический анализ. Данные представлены как среднее значение ± стандартная ошибка среднего. Статистический анализ проводили с использованием программного обеспечения SPSS версии 17.0. Для сравнения двух независимых групп использовали непарный t-критерий Стьюдента. При p-value < 0.05 или 0.01 результаты считались соответственно значимыми или высоко значимыми.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Инфекция T. gondii приводит к неблагоприятному исходу беременности у мышей
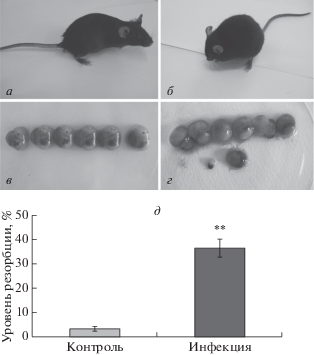
Для проведения исследования была разработана достоверная животная модель инфекции T. gondii. У беременных самок мышей из инфицированной группы (рис. 1б) наблюдали нарушение равновесия, согбенность и пиломоторный рефлекс. Плаценты были светлыми и ишемизированными, а плоды отличались неоднородностью размеров (рис. 1г). Фенотип беременных самок из контрольной группы был в норме (рис. 1а): плацента нормально снабжалась кровью, была кроваво-красного цветы, а размер эмбрионов был однородный (рис. 1в). Как показано на рис. 1д, частота резорбции плода в инфицированной группе была значительно выше, чем в контрольной (p < 0.001).
Рис. 1.
Влияние инфекции T. gondii на беременных мышей и исход беременности. Беременным самкам из инфицированной группы на восьмые сутки беременности вводили тахизоиты (внутрибрюшинно), самкам из контрольной группы вводили PBS. Мышей усыпляли через 7 суток после инфицирования и анализировали исход беременности и состояние плодов. а – Неинфицированные беременные самки из контрольной группы выглядят активными. б – У инфицированных токсоплазмой беременных мышей нарушено поведение и появилась согбенность и взъерошенность. в – Плоды самок из контрольной группы одного размера и нормально развиты; амниотическая жидкость прозрачная; плаценты кроваво-красные, с нормальным кровоснабжением. г – Плоды самок из инфицированной группы разного размера, есть уже умершие; амниотическая жидкость мутная; плаценты светлые и ишемизированные. д – Частота резорбции плода в инфицированной группе значительно выше, чем в контрольной (**p < 0.001).
Инфекция T. gondii приводит к повышению концентрации Qa-2 у беременных мышей
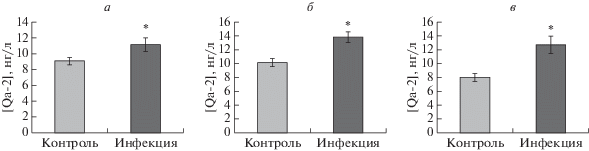
С целью проанализировать влияние инфекции токсоплазмой на продукцию белка Qa-2 оценивали содержание Qa-2 в сыворотке крови, амниотических жидкостях и супернатантах тканей плаценты у инфицированных и неинфицированных мышей методом ИФА. Как показано на рис. 2, уровень Qa-2 в этих трех биологических образцах в инфицированной группе значимо превышал таковой в контрольной (11.15 ± 0.89 нг/л против 9.06 ± 0.47 нг/л в сыворотке, 13.81 ± 0.83 нг/л против 10.17 ± 0.56 нг/л в амниотической жидкости, 12.61 ± 1.21 нг/л против 7.99 ± 0.56 нг/л в супернатанте тканей плаценты, p < 0.05).
Рис. 2.
Концентрации Qa-2 в сыворотке, амниотической жидкости и супернатанте тканей плаценты беременной мыши. У усыпленных мышей из инфицированной T. gondii и контрольной групп собирали сыворотку крови, амниотическую жидкость и супернатант тканей плаценты и измеряли в них концентрацию Qa-2 с использованием коммерческого набора для ИФА. Уровни Qa-2 в сыворотке (а), амниотической жидкости (б) и супернатанте тканей плаценты (в) были значимо повышены в инфицированной группе по сравнению с контрольной (*p < 0.05).
Инфекция T. gondii приводит к усилению экспрессии NKG2A на клетках dNK мышей
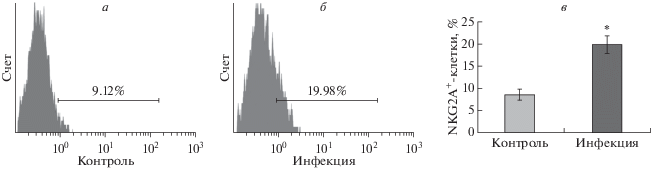
С целью проверить, влияет ли инфекция T. gondii на уровень экспрессии NKG2A, ингибиторного рецептора для Qa-2 на dNK-клетках мыши, подсчитывали содержание клеток NKG2A+ в общем пуле клеток плаценты при помощи проточной цитометрии. Процент клеток NKG2A+ в плацентах составил 19.78 ± 1.81% в инфицированной группе и только 8.59 ± 1.25% в контрольной группе (p < 0.05) (рис. 3).
Рис. 3.
Экспрессия NKG2A на dNK-клетках беременных мышей. Клеточные суспензии плацент усыпленных беременных мышей из контрольной и инфицированной групп получали путем разрезания ткани на мелкие кусочки, осаждения и фильтрации через стерильный сетчатый фильтр. Перед анализом образцов эритроциты в клеточной суспензии лизировали. Процентное содержание NKG2A+-клеток в контрольной группе составило 8.59 ± 1.25% от общего числа клеток (а), а в инфицированной группе 19.78 ± 1.81% (б). в – По сравнению с контрольной группой, экспрессия NKG2A на dNK-клетках мышей из инфицированной группы значимо возросла (*p < 0.05).
Инфекция T. gondii приводит к увеличению продукции sHLA-G клетками BeWo
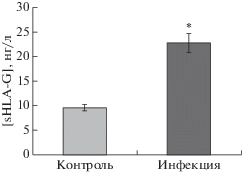
С целью проанализировать влияние инфекции токсоплазмой на уровень синтеза sHLA-G оценивали концентрацию sHLA-G в супернатантах инфицированных T. gondii и неинфицированных клеток BeWo методом ИФА. Как показано на рис. 4, уровень синтеза sHLA-G значительно возрос в инфицированной группе по сравнению с контрольной группой (22.82 ± 1.82 нг/л против 9.56 ± 0.58 нг/л, p < 0.05).
Рис. 4.
Экспрессия sHLA-G в супернатантах клеток BeWo. Клетки BeWo инфицировали штаммом T. gondii RH (инфицированная группа) или добавляли PBS (контрольная группа). Через 24 ч супернатанты клеток BeWo собирали и оценивали в них концентрацию sHLA-G. Концентрация sHLA-G в супернатанте инфицированных клеток по сравнению с контрольной группой была значимо выше (*p < 0.05).
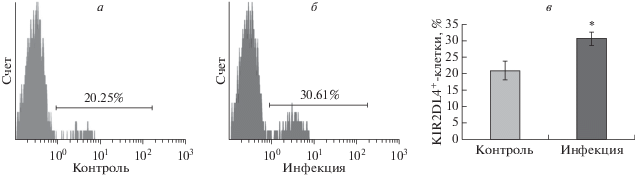
Инфекция T. gondii ведет к усилению экспрессии KIR2DL4 на клетках dNK человека
С целью выяснить, влияет ли инфекция T. gondii на уровень экспрессии KIR2DL4, ингибиторного рецептора к sHLA-G на dNK-клетках человека, детектировали клетки KIR2DL4+ при помощи проточной цитометрии. Согласно результатам эксперимента, процент KIR2DL4+-клеток составил 30.66 ± 2.03% в инфицированной группе и только 20.94 ± 2.89% в контрольной группе (p < < 0.05) (рис. 5).
Рис. 5.
Экспрессия KIR2DL4 на dNK-клетках человека. Клетки dNK изолировали из тканей плаценты, полученных из абортивного материала. Аборты были сделаны донорами тканей добровольно в первом триместре беременности. После 12 ч культивирования dNK-клетки смешивали с тахизоитами T. gondii в инфицированной группе или PBS в контрольной группе; через 24 ч клетки собирали для анализа методом проточной цитометрии. Процентное содержание клеток KIR2DL4+ составило 20.94 ± 2.89% в контрольной группе (а) и 30.66 ± 2.03% в инфицированной группе (б). в – По сравнению с контрольной группой уровень экспрессии KIR2DL4 на dNK-клетках в инфицированной группе было значимо выше (*p < 0.05).
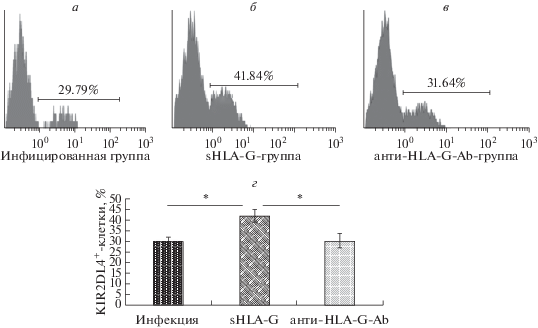
Влияние sHLA-G на экспрессию KIR2DL4 в условиях инфекции T. gondii
С целью оценить влияние sHLA-G на экспрессию KIR2DL4 в инфицированных T. gondii dNK-клетках человека ее сравнили в присутствии и в отсутствие супернатанта клеток BeWo. Как показано на рис. 6, уровень экспрессии KIR2DL4 оказался значимо выше в sHLA-G-группе (в присутствии супернатанта BeWo) по сравнению с просто инфицированной группой клеток (42.12 ± 2.86% против 29.96 ± 2.03%, p < 0.05). Затем измеряли уровень экспрессии KIR2DL4 на инфицированных T. gondii dNK-клетках в присутствии супернатанта клеток BeWo, предварительно обработанного mAb 87G против HLA-G. Согласно полученным данным, доля клеток KIR2DL4+ составила 30.38 ± 3.23% в этой группе, что значительно ниже, чем в sHLA-G-группе (p < 0.05) (рис. 6). Таким образом, впервые показано, что sHLA-G может активировать экспрессию KIR2DL4 на поверхности dNK-клеток человека в условиях инфекции T. gondii.
Рис. 6.
Экспрессия KIR2DL4 в условиях инфекции T. gondii. Очищенные dNK-клетки случайным образом раcпределяли по 4 группам: контрольную, инфицированную, sHLA-G и анти-HLA-G-Ab. В sHLA-G-группе в дополнение к тахизоитам T. gondii к dNK -клеткам добавляли супернатант клеток BeWo, а в анти-HLA-G-Ab-группе – супернатант клеток BeWo, предварительно обработанный mAb 87G против HLA-G. Процент клеток KIR2DL4+ составил 29.96 ± 2.03% в инфицированной группе (а), 42.12 ± 2.86% в sHLA-G-группе (б) и 30.38 ± 3.23% в анти-HLA-G-Ab-группе (в). г – Уровень экспрессии KIR2DL4 в sHLA-G-группе был значимо выше, чем в инфицированной (*p < 0.05) и в анти-HLA-G-Ab-группе (*p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Основная патогенная форма T. gondii представлена тахизоитами, которые могут инфицировать клетки трофобласта в составе плаценты и таким образом передаваться плоду и приводить к неблагоприятным исходам беременности [15]. С целью выяснить возможные механизмы, ассоциированные с аномальным протеканием беременности при инфекции T. gondii, мы прежде всего разработали мышиную модель этой инфекции. Как можно видеть на рис. 1, в инфицированной группе частота резорбции эмбрионов была значимо выше, чем в контрольной здоровой группе. Таким образом, мы убедились, что в этой мышиной модели инфекция T. gondii приводит к аномальным исходам беременности.
Ранее показано, что у инфицированных вирусом иммунодефицита человека или вирусом гепатита пациентов повышен уровень sHLA-G, что приводит к развитию иммунной толерантности и облегчает ускользание вируса от иммунного ответа [16–18]. В других исследованиях показано, что и больных малярией уровень sHLA-G повышен, что позволяет патогенам внедряться в иммунную систему хозяина [19, 20]. Нами обнаружено, что уровень продукции Qa-2 у зараженных T. gondii мышей значительно выше, чем у животных в контрольной группе. По результатам эксперимента in vitro также выявлены повышенные уровни экспрессии sHLA-G клетками BeWo, инфицированными T. gondii, по сравнению с неинфицированными клетками. Эти результаты согласуются с данными [21], что содержание sHLA-G в амниотической жидкости инфицированных T. gondii плодов значительно выше, чем у неинфицированных. Также сообщалось [22] о повышенной концентрации sHLA-G в амниотической жидкости при преждевременных родах, сопряженных с внутриутробной инфекцией. Основываясь на этих данных, мы предположили, что sHLA-G участвует в регуляции иммунного ответа хозяина против внутриутробной инфекции T. gondii.
Механизм поддержания иммунной толерантности с участием sHLA-G во время беременности заключается во взаимодействии белка с ингибиторными рецепторами на поверхности dNK-клеток и подавлении цитотоксичности натуральных киллеров [9]. KIR2DL4, хорошо изученный рецептор sHLA-G на клетках dNK человека, непосредственно контактирует с трофобластом и играет важную роль в формировании плацентарного барьера во время беременности [12, 23]. Мы проанализировали уровни экспрессии NKG2A у инфицированных T. gondii и неинфицированных беременных мышей линии C57BL/6 и уровни экспрессии KIR2DL4 на dNK-клетках человека. Показано, что экспрессия рецепторов NKG2A и KIR2DL4 усиливается при инфекции T. gondii, что согласуется с результатами, полученными нами ранее [24]. С целью выяснить роль sHLA-G в неблагоприятных исходах беременности, ассоциированных с инфекцией T. gondii, мы измерили уровень экспрессии KIR2DL4 на инфицированных T. gondii dNK-клетках человека в присутствии супернатанта клеток BeWo, предварительно обработанного mAb 87G против sHLA-G (анти-HLA-G-Ab-группа). Согласно полученным результатам, доля клеток KIR2DL4+ в этой группе оказалась значительно ниже, чем в sHLA-G-группе. Следовательно, обработка антителом против sHLA-G противодействует усилению экспрессии KIR2DL4, вызванному инфекцией T. gondii.
Полученные результаты можно рассматривать как подтверждение гипотезы, что sHLA-G играет важную роль в поддержании нормального хода беременности, способствуя активации экспрессии KIR2DL4, ингибиторного рецептора на dNK-клетках. Однако sHLA-G может участвовать и в повреждение плода в условиях инфекции T. gondii. Таким образом, поддержание баланса между борьбой с инфекцией и обеспечением иммунной толерантности по отношению к плоду критично для благоприятного исхода беременности у женщин, инфицированных патогенами. В качестве иммуносупрессивной молекулы sHLA-G подавляет цитотоксичность dNK-клеток во время инфекции токсоплазмой, так как повышение продукции sHLA-G может индуцировать возрастание уровня экспрессии KIR2DL4, ингибиторного рецептора dNK-клеток. Повышение продукции sHLA-G и супрессия dNK-клеток могут привести к развитию избыточной иммунной толерантности, что используется T. gondii для ускользания от иммунной системы и эффективного проникновения через плаценту. Таким образом, избыточная экспрессия sHLA-G приводит к инфицированию плода по механизму вертикальной трансмиссии и последующим неблагоприятным исходам беременности, отягощенной инфекцией T. gondii.
ЗАКЛЮЧЕНИЕ
Нами показано, что инфекция T. gondii ассоциирована с повышенной продукцией sHLA-G у беременных. Избыточный sHLA-G индуцирует повышение уровня KIR2DL4, ингибиторного рецептора, экспрессированного на NK-клетках. Это способствует тому, что T. gondii ускользает от иммунного ответа, реализует путь вертикальной трансмиссии и приводит к неблагополучному исходу беременности. В результате проведенного исследования получено механистическое объяснение участия sHLA-G в вертикальной трансмиссии T. gondii и стал понятнее молекулярный механизм, лежащий в основе аномального течения беременности при инфекции T. gondii.
БЛАГОДАРНОСТИ
Работа получила финансовую поддержку Национального фонда естественных наук Китая (National Natural Science Foundation of China, project 81171591 и 81672049) и Фонда естественных наук провинции Шаньдун (Natural Science Foundation of the Shandong Province, project no. ZR2014HP010).
ВКЛАД АВТОРОВ В РАБОТУ
XMH, HFW и YZJ планировали исследование, собирали данные, проводили статистический анализ и отвечали за подготовку рукописи. LQR рецензировал схему эксперимента и редактировал рукопись. XBL и HXZ внесли вклад в анализ данных и подготовку рукописи.
Все авторы прочитали и одобрили финальную версию статьи.
Список литературы
Mahalakshmi B., Therese K.L., Devipriya U., Pushpalatha V., Margarita S., Madhavan H.N. (2010) Infectious aetiology of congenital cataract based on TORCHES screening in a tertiary eye hospital in Chennai, Tamil Nadu, India. Indian J. Med. Res. 131, 559–564.
Bssieres M.H., Berrebi A., Rolland M., Bloom M.C., Roques C., Cassaing S., Courjault C., Séguéla J.P. (2001) Neonatal screening for congenital toxoplasmosis in a cohort of 165 women infected during pregnancy and influence of in utero treatment on the results of neonatal tests. Eur. J. Obstet. Gynecol. Reprod. Biol. 94, 37–45.
Abbasi M., Kowalewska-Grochowska K., Bahar M.A., Kilani R.T., Winkler-Lowen B., Guilbert L.J. (2003) Infection of placental trophoblasts by Toxoplasma gondii. J. Infect. Dis. 188, 608–616.
Tarrade A., Lai Kuen R., Malassine A. (2001) Cluaracterization of human villous and extravillous trophoblasts isolated from first trimester placenta. Lab. Inveal. 8l, 1199–1211.
Sipak-Szmigiel O., Ronin-Walknowska E., Cybulski C., Plonka T., Lubiński J. (2007) Antigens HLA-G, sHLA-G and sHLA-class I in reproductive failure. Folia Histochem. Cytobiol. 45, S137–141.
Pfeiffer K.A., Rebmann V., Pässler M., van der Ven K., van der Ven H., Krebs D., Grosse-Wilde H. (2000) Soluble HLA levels in early pregnancy after in vitro fertilization. Hum. Immunol. 61, 559–564.
Rebmann V., Switala M., Eue I., Grosse-Wilde H. (2010) Soluble HLA-G is an independent factor for the prediction of pregnancy outcome after ART: a German multi-centre study. Hum. Reprod. 25, 1691–1698.
Lee M., Choi B., Kwon H.J., Shim J.A., Park K.S., Lee E.S., Sohn S. (2010) The role of Qa-2, the functional homolog of HLA-G, in a Behcet’s disease-like mouse model induced by the herpes virus simplex. J. Inflamm. (Lond). 7, 31–42.
Lindaman A., Dowden A., Zavazava N. (2006) Soluble HLA-G molecules induce apotosis in natural killer cells. Am. J. Peprod. Immunol. 56, 68–76.
Park G.M., Lee S., Park B., Kim E., Shin J., Cho K., Ahn K. (2004) Soluble HLA-G generated by proteolytic shedding inhibits NK-mediated cell lysis. Biochem. Biophys. Res. Commun. 3, 606–611.
Riley J.K., Yokoyama W.M. (2008) NK cell tolerance and the maternal-fetal interface. Am. J. Reprod. Immunol. 59, 371–387.
Morandi F., Ferretti E., Castriconi R., Dondero A., Petretto A., Bottino C., Pistoia V. (2011) Soluble HLA-G dampens CD94/NKG2A expression and function and differentially modulates chemotaxis and cytokine and chemokine secretion in CD56bright and CD56dim NK cells. Blood. 118, 5840–5850.
Zhao M., Zhang R., Xu X., Liu Y., Zhang H., Zhai X., Hu X. (2013) IL-10 reduces levels of apoptosis in Toxoplasma gondii-infected trophoblasts. PLoS One. 8, e56455.
Barbosa B.F., Silva D.A., Costa I.N., Mineo J.R., Ferro E.A. (2008) BeWo trophoblast cell susceptibility to Toxoplasma gondii is increased by interferon-gamma, interleukin-10 and transforming growth factor-beta1. Clin. Exp. Immunol. 151, 536–545.
Cowen D., Wolf A. (1950) Experimental congenital toxoplasmosis II. Transmission of toxoplasmosis to the placenta and fetus following vaginal infection in the pregnant mouse. J. Exp. Med. 92, 403–416.
Weng P.J., Fu Y.M., Ding S.X., Xu D.P., Lin A., Yan W.H. (2011) Elevation of plasma soluble human leukocyte antigen-G in patients with chronic hepatitis C virus infection. Hum. Immunol. 72, 406–411.
Celsi F., Catamo E., Kleiner G., Tricarico P.M., Vuch J., Crovella S. (2013) HLA-G/C, miRNAs, and their role in HIV infection and replication. Biomed. Res. Int. 2013, 693646.
Thibodeau V., Lajoie J., Labbé A.-C., Zannou M.D., Fowke K.R., Alary M., Poudrier J., Roger M. (2011) High level of soluble HLA-G in the female genital tract of Beninese commercial sex workers is associated with HIV-1 infection. PLoS One. 6, e25185.
d’Almeida T.C., Sadissou I., Milet J., Cottrell G., Mondière A., Avokpaho E., Gineau L., Sabbagh A., Massougbodji A., Moutairou K., Donadi E.A., Favier B., Carosella E., Moreau P., Rouas-Freiss N., Courtin D., Garcia A. (2017) Soluble human leukocyte antigen-G during pregnancy and infancy in Benin: mother/child resemblance and association with the risk of malaria infection and low birth weight. PLoS One. 12, e0171117.
Sadissou I., d’Almeida T., Cottrell G., Luty A., Krawice-Radanne I., Massougbodji A., Moreau P., Moutairou K., Malar J. (2014) High plasma levels of HLA-G are associated with low birth weight and with an increased risk of malaria in infancy. Malar. J. 13, 312–319.
Robert-Gangneux F., Gangneux J.P., Vu N., Jaillard S., Guiguen C., Amiot L. (2011) High level of soluble HLA-G in amniotic fluid is correlated with congenital transmission of Toxoplasma gondii. Clin. Immunol. 138, 129–134.
Kusanovic J.P., Romero R., Jodicke C., Mazaki-Tovi S., Vaisbuch E., Erez O., Mittal P., Gotsch F., Chaiworapongsa T., Edwin S.S., Pacora P., Hassan S.S. (2009) Amniotic fluid soluble human leukocyte antigen-G in term and preterm parturition, and intra-amniotic infection/inflammation. J. Matern. Fetal. Neonatal. Med. 22, 1151–1166.
Salcedo M., Bousso P., Ljunggren H.G., Kourilsky P., Abastado J.P. (1998) The Qa-1b molecule binds to a large subpopulation of murine NK cells. Eur. J. Immunol. 28, 4356–4361.
Xu X., Fu Q., Zhang Q., Zhao M., Gao Z., Liu X., Liu Y., Hu X. (2013) Changes of human decidual natural killer cells cocultured with YFP-Toxoplasma gondii: implications for abnormal pregnancy. Fertil. Steril. 99, 427–432.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


