Молекулярная биология, 2019, T. 53, № 3, стр. 430-435
Множественный характер взаимодействия транскрипционного фактора Oct-1 (POU2F1) с последовательностями PORE и MORE
А. Г. Степченко a, *, С. Г. Георгиева a, Е. В. Панкратова a
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: sstepalex@mail.ru
Поступила в редакцию 23.11.2018
После доработки 09.01.2019
Принята к публикации 16.01.2019
Аннотация
Фактор транскрипции POU2F1(Oct-1) – один из важнейших регуляторных белков человека и других млекопитающих. Повышение уровня Oct-1 обеспечивает устойчивость клеток к окислительному и цитотоксическому стрессу, а также к действию ионизирующего излучения. Высокий уровень Oct-1, обнаруженный во многих опухолях человека, коррелирует с низкой выживаемостью. Транскрипционный фактор Oct-1(POU2F1) взаимодействует со своими геномными сайтами в виде мономера, димера или мультимера. Нуклеотидная последовательность сайта связывания определяет характер взаимодействия и конформацию Oct-1 на ДНК-мишени, что, в свою очередь, определяет спектр корепрессоров и коактиваторов Oct-1. Нами введены нуклеотидные замены во все положения последовательностей PORE и MORE, определено их влияние на способность белка образовывать мономерные и димерные ДНК-белковые комплексы. Полученные данные свидетельствуют о том, что положение и характер нуклеотидных замен могут изменять характер ДНК-белкового взаимодействия. Одни замены способны подавлять образование димеров, другие способствуют этому. Некоторые нуклеотидные замены полностью устраняют связывание с ДНК как мономеров, так и димеров Oct-1. Очень важный параметр, влияющий на характер ДНК-белкового взаимодействия, – концентрация белка Oct-1 в клетке. Выполненный нами анализ позволяет предсказать характер взаимодействия и аффинность любых PORE- и MORE-сайтов в геноме человека по их нуклеотидной последовательности.
Белок POU2F1(Oct-1) – фактор транскрипции, контролирующий экспрессию широкого спектра генов в клетках высших эукариот. В геноме человека обнаружены разнообразные сайты, с которыми Oct-1 взаимодействует в виде мономера, димера или мультимера. Аффинность сайтов связывания и ориентация взаимодействующего с ними белка варьируют в очень широких пределах, а разнообразие сайтов связывания позволяет очень тонко регулировать экспрессию генов, контролируемых Oct-1.
POU2F1(Oct-1) охарактеризован достаточно давно, однако интерес к нему в настоящее время существенно вырос, так как выявлена тесная корреляция между степенью злокачественности опухоли, ее устойчивостью к терапии и высоким уровнем экспрессии POU2F1(Oct-1) в опухолевых клетках. В процессе дифференцировки и при онкотрансформации клеток концентрация Oct-1 может изменяться более чем в 10 раз [1–4]. Одновременно может меняться и соотношение изоформ Oct-1 [5].
Транскрипционный фактор Oct-1 (POU2F1) относится к семейству белков Oct, регулирующих множество биологических процессов в клетке [6–9]. Известно не менее 18 белков человека с POU-доменом, среди которых только Oct-1 представлен пятью изоформами с идентичными ДНК-связывающими POU-доменами, но различными N- или С-концевыми аминокислотными остатками. Биологическая активность Oct-1 регулируется на уровне посттрансляционной модификации (фосфорилирование, О-гликозилирование, сумоилирование). Транскрипция гена Oct-1 с альтернативных промоторов и альтернативный сплайсинг приводят к появлению изоформ, выполняющих различные функции [10–12].
ДНК-связывающий POU-домен, идентичный у всех изоформ Oct-1, состоит из двух субдоменов – POU-специфического (POUsp) и POU-гомеодомена (POUh), объединенных подвижным линкером. Оба субдомена способны автономно связываться при взаимодействии с ДНК. Первоначально установлено, что Oct-1 взаимодействует с так называемым каноническим octa-сайтом (5'-ATGCAAAT-3') как мономер [9], а также образует мономерный комплекс с последовательностью GARAT – 5'-TAATGARAT-3'.
Известно, что Oct-1 может образовывать гомо- и гетеродимеры с другими факторами с POU-доменом на специфических последовательностях [13, 14]. Oct-1 образует димеры с последовательностями PORE (Palindromic Oct Factor Recognition Element) 5'-ATTTGAAATGCAAAT-3' и MORE (more than PORE) 5'-ATGCATATGCAT-3' [15].
Методом иммунопреципитации хроматина с последующим секвенированием в регуляторных участках генов идентифицировано множество последовательностей с которыми взаимодействует Oct-1, в которых в большинстве случаев невозможно идентифицировать канонические octa-сайты, PORE- и MORE-сайты (данные суммированы на www.genecards.org). В связи с этим возникает несколько, на наш взгляд, принципиальных вопросов: почему столь велико разнообразие мишеней Oct-1, все ли идентифицированные сайты связывания функциональны, каково значение низкоаффинных участков взаимодействия, как изменяется транскрипция генов при заменах нуклеотидов в Oct-1-сайтах.
В представленной работе изучено взаимодействие Oct-1 с нуклеотидными последовательностями, способствующими образованию димеров. Нами произведены нуклеотидные замены во всех положениях элементов PORE и MORE, определено их влияние на способность белка образовывать мономерные и димерные ДНК-белковые комплексы. Выполненный анализ позволяет предсказывать характер взаимодействия и аффинность любых PORE- и MORE-сайтов, найденных в геноме человека, по их нуклеотидной последовательности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клонирование кДНК POU-домена Oct-1, выделение и очистка белка. кДНК Oct-1 синтезирована на мРНК из клеток Namalwa и клонирована в векторе pcDNA 3-1. Фрагмент ДНК, соответствующий POU-домену, клонирован в модифицированном нами экспрессионном векторе pET15b, в котором заменен полилинкер, элиминированы все tag-последовательности pET15b, и в 5'-области нового полилинкера клонирована последовательность, соответствующая шести остаткам гистидина. Наработку белка и его очистку проводили согласно протоколу производителя аффинного сорбента Ni2+ Sepharose (“QIAGEN”, Германия). По данным электрофореза в 12%-ном полиакриламидном геле степень очистки POU-белка превышала 95%. Концентрацию белка определяли по методу Бредфорда.
Олигонуклеотиды. Синтезированные олигонуклеотиды с заменами в PORE- или MORE-сайтах связывания имели общую структуру:
5'-GCGTTCGGAGCTCTAG-(сайт связывания PORE, MORE)-CTCGAGCCGAGGTAGC-3'. Последовательности, фланкирующие PORE- и MORE-сайты, не взаимодействуют с POU-белком. Олигонуклеотид 5'-GCTACCTCGGCTCGAG-3' метили по 5'-концу, используя [γ-32P]ATP, отжигали с мутированными последовательностями PORE и MORE, комплементарную цепь достраивали фрагментом Кленова ДНК-полимеразы E. сoli. Олигонуклеотиды L1–L5 имели те же фланкирующие последовательности, что и мутантные олигонуклеотиды PORE и MORE.
Определение ДНК-белковых взаимодействий методом EMSA и ДНК-белковых комплексов. ДНК-белковые взаимодействия изучали в буфере, содержащем 20 мМ HEPES pH 7.9, 60 мМ KCl, 0.5 мМ EDTA, 0.5 мМ DTT, 4% глицерина, бычий сывороточный альбумин (100 мкг/мл) в объеме 20 мкл, содержащем 0.5 нг радиоактивно меченного зонда и 10 нг POU-домена (в экспериментах, представленных на рис. 1 и 2) и 30 нг POU-белка (рис. 3). Реакционную смесь (15 мкл) инкубировали в течение 30 мин при комнатной температуре и наносили на 6%-ный неденатурирующий полиакриламидный гель [14].
Рис. 1.
Определение взаимодействия POU-домена белка Oct-1 с MORE-последовательностями с заменами нуклеотидов в позициях 1–6 сайта связывания методом EMSA. d – димер, m – мономер, f – не связавшийся ДНК-зонд.

Рис. 2.
Взаимодействие POU-домена белка Oct-1 с природными MORE-сайтами связывания в регуляторных областях генов человека, определенное методом EMSA. Wt – каноническая MORE-последовательность. L1 – ген PolII; L2 – ген Hmgb3; L3 – ген Rras; L4 – ген Barhl2; L5 –ген Pol1a-1; d – димер, m – мономер, f – не связавшийся ДНК-зонд.
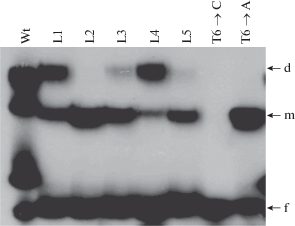
Рис. 3.
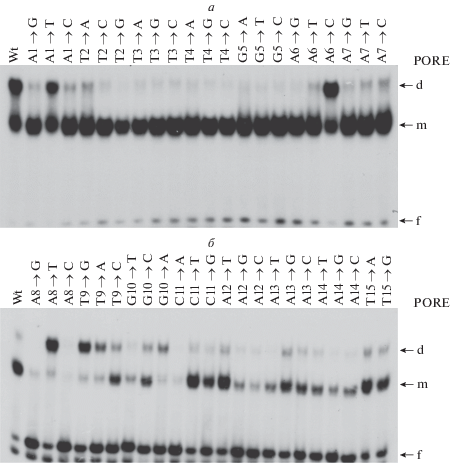
Определение взаимодействия POU-домена белка Oct-1 с PORE-последовательностями методом EMSA. а – Замены нуклеотидов в позициях 1–7. б – Замены нуклеотидов в позициях 8–15. В верхней строке обозначены нуклеотидные замены; Wt – каноническая PORE-последовательность; d – димер; m – мономер; f – не связавшийся ДНК-зонд.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Взаимодействие POU Oct-1 с MORE-последовательностями
На нуклеотидных последовательностях определенной структуры белок Oct-1 способен образовывать как мономерные, так и димерные ДНК-белковые комплексы. Известно два типа таких последовательностей – PORE и MORE. Каноническая последовательность MORE представляет собой палиндром:
1 2 3 4 5 6
5'-A T G C A T A T G C A T
T A C G T A T A C G T A-5'
6' 5' 4' 3' 2' 1'
Среди природных MORE-последовательностей только две (промоторный участок онкогена Ebxl10 и 5'-область гена Zmiz2(Zimp7) канонические, а остальные (идентифицированные методом ChIP-Seq) могут содержать одну–три нуклеотидные замены в позициях 1, 4, 5', 4', 3', 2', 1'. Наиболее вариабельны позиции 1, 4', 1' [1].
Чтобы определить влияние замен нуклеотидов в сайте связывания на способность образовывать димеры и аффинность ДНК-белкового взаимодействия, мы синтезировали последовательности со всеми возможными заменами в каждом положении сайта связывания и определили их способность образовывать комплекс с POU-белком Oct-1 методом задержки подвижности в геле комплекса ДНК-белок (EMSA) (рис. 1). Опыты проводили при низкой и высокой концентрации белка.
Замены A1-C1/T1/G1, T2-G2/C2, G3-A3 не влияют существенно на аффинность их связывания, а способностью образовывать димеры и мономеры обладает олигонуклеотид дикого типа. Замены G3-T3, C4-G4, T6-A6/G6 практически устраняют формирование димерных комплексов, а замена T6-C6 полностью устраняет связывание. Остальные замены снижают способность образовывать как мономерные, так и димерные комплексы. Методом EMSA мы проверили MORE-последовательности из регуляторных областей генов человека, имеющие множественные замены нуклеотидов в участке связывания (рис. 2). Последовательность L1 5'-ATGCATATtCAg (ген Pol2a#1) содержит мутации A1'-C1' и C4'-A4', которые не влияют существенно на характер связывания POU-домена.
Последовательность L2 – 5'-ATGCATATtaAg (ген Hmgb3) имеет замены в позициях 1', 3', и 4'. Мутация G3'-T3' полностью определяет характер связывания. L2 MORE образует только мономеры с высокой аффинностью. L3 – 5'-cTGCATAatCAT (ген Rras) содержит одну нуклеотидную замену в левой половине сайта связывания и две в правой. Поскольку замены A1-C1 и C'4-A'4 не влияют на связывание, характер взаимодействия L3 MORE определяется только заменой A5'-T5', которая ослабляет формирование димерных комплексов. Таким же образом L4 MORE – 5'-cTGCATATtCAg (ген Barhl2) связывается c POU-доменом преимущественно в виде димера, что определяется заменой C4'-A4'.
Последовательность L5 – 5'-cTGCATATGaAT-3' – имеет замены нуклеотидов в позициях 1 и 3. Как и в L2, мутация в 3'-положении L5 определяет характер взаимодействия. L5 MORE образует мономеры с высокой аффинностью.
Как уже сказано, большинство известных MORE, найденных в регуляторных участках генов, содержат одну–три нуклеотидные замены в сайте связывания [1]. Наши данные свидетельствуют о том, что положение и характер замен нуклеотидов в сайте MORE могут быть критичными для ДНК-белкового взаимодействия, они определяют формирование димерных комплексов с белком Oct-1. Одни мутации могут существенно снижать образование димеров, тогда как другие значительно усиливают димеризацию или полностью устраняют связывание. К очень важным параметрам, влияющим на ДНК-белковое взаимодействие, относится концентрация белка Oct-1 в клетке.
Таким образом, данные для синтетических мутантных MORE полностью совпадают с результатами EMSA по связыванию с природными MORE, что позволяет предсказывать характер взаимодействия и аффинность любых MORE-сайтов в геноме человека по их нуклеотидной последовательности без использования EMSA. Следует отметить, что ни в одной из известных MORE-последовательностей не найдены мутации T6-C6 и T6'-C6', полностью устраняющие связывание.
Взаимодействие POU-домена Oct-1 с последовательностями PORE
Последовательность PORE – это 15-нуклеотидный сайт связывания, состоящий из двух частично пересекающихся участков взаимодействия с белком Oct-1:
Левая часть сайта связывания (подчеркнута) – инвертированный повтор ATTTGAAAT – с центром симметрии в положении G5. Канонический oct-сайт связывания ATGCAAAT (выделен жирным) расположен в 3'-области. Оба сайта связывания имеют перекрест в два нуклеотида A8,T9. Oct-1 взаимодействует с PORE и образует мономерные комплексы при низкой концентрации белка, а димеры и мономеры – при повышении концентрации Oct-1 POU. При одинаковой концентрации POU-домена способность PORE образовывать димер ниже, чем у MORE. PORE-сайты, структура которых опубликована, не являются каноническими.
Любые нуклеотидные замены в левой части сайта связывания – позиции 1–7 – не влияют на способность POU-домена образовывать мономерные комплексы. Замены A1-T1 и A6-C6 не влияют на образование димеров (взаимодействие почти такое же, как у немутированного олигонуклеотида). Замены A1-G1/C1, T2-A2, A7-T7/C7 примерно в 4 раза снижают способность образовывать димеры по сравнению с канонической PORE. Все остальные замены в левой части PORE препятствуют образованию димеров (рис. 3а).
Мутации в правой части сайта связывания A8-G8/C8, C11-A11, A13-T13, A14- C14/G14 критичны для формирования димерных комплексов. Замены A8-T8, T9-G9/A9, G10-A10 способствуют образованию преимущественно димеров (рис. 3б). Так как левая часть PORE-сайта нативна, то эти замены, по-видимому, способствуют более тесным контактам между двумя POU-доменами при взаимодействии с ДНК. Это приводит к большей стабилизации димерного комплекса, чем в случае нативного PORE. При низкой концентрации POU-домена нуклеотидные замены в позициях 1–7 приводят к полной потере димеризации POU-домена. Поэтому влияние замен в позициях 1–7 изучено при концентрации POU-домена в 6 раз большей, чем в эксперименте, представленном на рис. 3б.
Можно предположить, что взаимодействие белка Oct-1 с PORE происходит в два этапа. На первом этапе Oct-1 связывается с большей аффинностью с правой частью сайта, тогда как с левой частью Oct-1 взаимодействует с низкой аффинностью, и образованию димера способствует установление белок-белковых связей между двумя молекулами POU-домена.
Мутации в других позициях либо не изменяют характер связывания, либо частично снижают формирование как димеров, так и мономеров.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Из результатов нашей работы следует, что повышение концентрации белка Oct-1 в клетке должно приводить к изменению характера его взаимодействия с ДНК-мишенями. При низкой концентрации Oct-1 взаимодействует только с высокоаффинными сайтами, при этом независимо от типа последовательности (octa, PORE или MORE) формируются преимущественно мономерные комплексы. При повышении концентрации Oct-1 низкоаффинные сайты также становятся мишенями для связывания. При этом на сайтах PORE и MORE образуются димеры белка Oct-1. Ориентация белка/ов Oct-1 и принятие ими той или иной конформации на ДНК индуцируется самим сайтом связывания. В частности, димерные комплексы Oct-1, образующиеся на сайтах PORE и MORE, имеют разную ориентацию. Белки-коактиваторы и корепрессоры узнают сайтзависимую конформацию Oct-1 и, как следствие, определяют репрессию или активацию определенных генов [16].
Полученные нами результаты говорят о том, что повышение уровня белка Oct-1 при злокачественной трансформации клеток может приводить к расширению спектра ДНК-сайтов, изменению конформации белка Oct-1 за счет его димеризации на этих сайтах и, как следствие, к изменению набора регулируемых им генов. Анализ взаимодействия Oct-1 c ДНК важен для понимания протуморогенного эффекта высоких концентраций Oct-1 в опухолевых клетках. Многие исследования выявляют положительную корреляцию между высоким уровнем белка POU2F1(Oct-1) в злокачественных опухолях и более низким уровнем выживаемости больных. Определение уровня POU2F1(Oct-1) в опухоли имеет даже более высокое прогностическое значение, чем определение стадии (I–IV) заболевания по AJCC [17].
Анализ профиля экспрессии генов в 200 образцах рака желудка, показал, что POU2F1(Oct-1) несомненно участвует в координированной регуляции экспрессии генов, связанных с раком желудка [18]. Выявлены множественные гены, POU2F1-зависимая транскрипция которых повышена при раке желудка диффузного типа и рака желудка кишечного типа. POU2F1(Oct-1) присутствует среди топ-5 факторов транскрипции, чьи сайты связывания, как показано методом ChIP-Seq, максимально заняты в опухолях [18]. Показано повышение частоты обогащения ДНК-сайтов белком POU2F1(Oct-1) при раке молочной железы [19].
Представленные нами данные позволяют без проведения EMSA предсказать, будут ли определенные последовательности в регуляторных участках генов человека взаимодействовать с белком Oct-1, возможно ли образование димерных или мономерных комплексов. Эти данные позволяют оценить относительную стабильность комплексов Oct-1-ДНК и изменение характера связывания при разной концентрации белка Oct-1.
Работа поддержана Российским фондом фундаментальных исследований (№ 16-04-01875) и Программой фундаментальных исследований государственной академии наук на 2013–2020 годы (тема № 01201363822).
Список литературы
Kang J., Gemberling M., Nakamura M., Whitby F.G., Handa H., Fairbrother W.G., Tantin D. (2009) A general mechanism for transcription regulation by Oct1 and Oct4 in response to genotoxic and oxidative stress. Genes Dev. 23, 208–222.
Xiao S., Liao S., Zhou Y., Jang B., Li Y., Xue M. (2014) High expression of octamer transcription factor 1 in cervical cancer. Oncol. Lett. 7, 1889–1894.
Maddox J., Shakya A., South S., Shelton D., Andersen J.N., Chidester S., Kang J., Gligorich K.M., Jones D., Spangrude G.J., Welm B.E., Tantin D. (2012) Transcription factor Oct1 is a somatic and cancer stem cell determinant. PLoS Genet. 8, e1003048. doi https://doi.org/10.1371/ journal.pgen.1003048
Wang Y.P., Song G.H., Chen J., Xiao C., Li C., Zhong L., Sun X., Wang Z.W., Deng G.L., Yu F.D., Xue Y.M., Tang H.M., Peng Z.H., Wang X.L. (2016) Elevated Oct-1 participates in colon tumorigenesis and independently predicts poor prognoses of colorectal cancer patients. Tumor Biol. 37, 3247–3255.
Pankratova E.V., Stepchenko A.G., Krylova I.D., Portseva T.N., Georgieva S.G. (2018) The regulatory interplay between Oct-1 isoforms contributes to hematopoiesis and the isoforms imbalance correlates with a malignant transformation of B cells. Oncotarget. 9, 29892–29905.
Kang J., Shakya A., Tantin D. (2009) Stem cells, stress, metabolism and cancer: a drama in two Octs. Trends Biochem. Sci. 34, 491–499.
Yang J., Muller-Immergluck M.M., Seipel K., Janson L., Westin G., Schaffner W., Pettersson U. (1991) Both Oct-1 and Oct-2A contain domains which can activate the ubiquitously expressed U2 snRNA genes. EMBO J. 10, 2291–2296.
Strom A.C., Forsberg M., Lillhager P., Westin G. (1996) The transcription factors Sp1 and Oct-1 interact physically to regulate human U2 snRNA gene expression. Nucl. Acids Res. 24, 1981–1986.
Sturm R.A., Das G., Herr W. (1998) The ubiquitous octamer-binding protein Oct-1 contains a POU domain with a homeo box subdomain. Genes Dev. 2, 1582–1599.
Pankratova E.V., Sytina E.V., Luchina N.N., Krivega I.V. (2003) The regulation of the oct-1 gene transcription is mediated by two promoters. Immunol. Lett. 88, 15–20.
Pankratova E.V., Sytina E., Polanovsky O. (2006) Autoregulation of Oct-1 gene expression is mediated by two Octa-sites in alternative promoter. Biochimie. 88, 1323–1329.
Pankratova E.V., Stepchenko A.G., Portseva T., Mogila V.A., Georgieva S.G. (2016) Different N-terminal isoforms of Oct-1 control expression of distinct sets of genes and their high levels in Namalwa Burkitt’s lymphoma cells affect a wide range of cellular processes. Nucl. Acids Res. 44, 9218–9230.
Verrijer G.P., Alkema M.G., van Weperen W.W., Van Leeuwen H.C., Strating M.J., Van der Vliet P.C. (1992) The DNA binding specificity of the bipartite POU domain and its subdomains. EMBO J. 11, 4993–5003.
Stepchenko A.G. (1994) Noncanonical Oct-sequences are targets for mouse Oct-2B transcription factor. FEBS Lett. 337, 175–178.
Tomilin A., Remenyi A., Lins K., Bak H., Leidel S., Vrieno G., Wilmanns M., Scholer H.R. (2000) Synergism with the coactivator OBF-1 (OCA-B, BOB-1) is mediated by a specific POU dimer configuration. Cell. 103, 853–864.
Сытина Е.В., Панкратова Е.В. (2003) Фактор транскрипции Oct-1 – пластичность и полифункциональность. Молекуляр. биология. 37, 755–767.
Qian J., Kong X., Deng N., Tan P., Chen H., Wang J., Li Z., Hu Y., Zou W., Xu J., Fang J.Y. (2015) Oct-1 is a determinant of synbindin-related ERK signaling with independent prognostic significance in gastric cancer. Gut. 64, 37–48.
Kalamohan K., Periasamy J., Bhaskar Rao D., Barnabas G.D., Ponnaiyan S., Ganesan K. (2014) Transcriptional coexpression network reveals the involvement of varying stem cell features with different dysregulations in different gastric cancer subtypes. Mol. Oncol. 8, 1306–1325.
Hwang-Verslues W.W., Chang P.H., Jeng Y.M., Kuo W.H., Chiang P.H., Chang Y.C., Hsieh T.H., Su F.Y., Lin L.C., Abbondante S., Yang C.Y., Hsu H.M., Yu J.C., Chang K.J., Shew J.Y., Lee E.Y., Lee W.H. (2013) Loss of corepressor PER2 under hypoxia up-regulates Oct-1-mediated ENT gene expression and enhances tumor malignancy. Proc. Natl. Acad. Sci. USA. 110, 12331–12336.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


