Молекулярная биология, 2019, T. 53, № 3, стр. 497-501
Влияние кардиомиоцитарных транскрипционных факторов Meis на адипоцитарную дифференцировку
A. Greco a, Д. В. Вайпан b, В. А. Ткачук b, c, Д. Н. Пеньков a, c, *
a The FIRC Institute of Molecular Oncology
20139 Milan, Italy
b Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
c Национальный медицинский исследовательский центр кардиологии Министерства здравоохранения
Российской Федерации
121552 Москва, Россия
* E-mail: dpenkov@yahoo.com
Поступила в редакцию 25.12.2018
После доработки 11.01.2019
Принята к публикации 11.01.2019
Аннотация
Гомеодоменсодержащие транскрипционные факторы играют значительную роль в адипоцитарной дифференцировке. Ранее была установлена роль Pbx1 и Prep1, двух белков из семейства TALE (Three Amino acid Loop Extension), в адипоцитарной дифференцировке мезенхимальных стромальных клеток и клеток линии 3T3-L1. В этой работе методом РНК-интерференции показано, что другой транскрипционный фактор из этого семейства, Meis1, важнейший белок зрелых кардиомиоцитов, играет роль репрессора адипогенеза, причем его активность выше, чем у паралога Meis2. Установлен ряд генов-мишеней фактора Meis1; ими оказались маркеры адипоцитов, что свидетельствует о транскрипционном влиянии Meis1 на адипоцитарную дифференцировку мышиных преадипоцитов.
ВВЕДЕНИЕ
Процессам дифференцировки клеток-предшественников в клетки жировой ткани посвящено много исследований, что обусловлено растущей потребностью в разработке новых лекарственных средств для лечения ожирения и диабета [1, 2]. Одна из самых распространенных моделей адипоцитарной дифференцировки in vitro – клеточная линия мышиных преадипоцитов 3T3-L1 [3]. На ней исследовано действие транскрипционных факторов: начиная c тех, которые необходимы на самой ранней стадии дифференцировки, и заканчивая факторами, поддерживающими адипоциты в зрелом состоянии. Недавно установлено, что, наряду с мастер-регулятором адипогенеза Pparγ (peroxisome proliferator-activated receptor γ), не менее важную роль играет фактор C/ebpβ (CCAAT-enhancer-binding protein β), активирующийся на ранних стадиях адипогенеза [4]. Активированный C/ebpβ образует мультимерные комплексы с другими белками, необходимыми для его связывания с хроматином. Среди транскрипционных факторов, находящихся в комплексе с C/ebpβ, есть гомео-доменсодержащие белки – именно они стали предметом наших исследований. Ранее установлено [4, 5], что Pbx1 (Pre-B-cell leukemia transcription factor 1) непосредственно взаимодействует с C/ebpβ, подавляя адипогенез. Нами показано [6], что для высокоафинного связывания с ДНК Pbx1 необходим партнер из группы TALE (Three Amino acid Loop Extension) гомеодоменсодержащих белков (Prep или Meis). На основании полученных нами данных [7] о роли Prep1 в подавлении адипогенеза и результатов полногеномных исследований, где выявлена высокая степень перекрывания сайтов связывания Pbx1 и Prep1 [6], мы предположили, что партнером Pbx1 служит Prep1.
Теперь мы исследовали роль других партнеров Pbx1 в адипогенезе. Белки Meis (Meis1, Meis2, Meis3) – незаменимые факторы дифференцировки кардиомиоцитов и эмбрионального развития сердца. Установлено, что Meis1 отвечает за переход из предшественников кардиомиоцитов в кардиомиоциты [8], в то время как Meis2 – за выбор пути дифференцировки предшественников Isl1+, обладающих потенциалом дифференцировки в кардиомиоциты, гладкомышечные клетки и эндотелиальные клетки [9]. Несмотря на то, что оба этих белка (Prep и Meis) могут быть партнерами Pbx1, в норме их функции различны и они конкурируют за свой облигатный партнер Pbx1. В результате проведенных нами исследований различных клеток обнаружена очень низкая степень перекрывания сайтов связывания Prep1 и Meis1 и отсутствие взаимодействия между ними. В связи с этим была выдвинута гипотеза, что Meis, вытесняя Prep1 из комплекса с Pbx1, приводит к активации адипогенеза.
Для проверки этого предположения мы исследовали влияние подавления экспрессии генов Meis1 и Meis2 на адипоцитарную дифференцировку в клеточной линии 3T3-L1 и показали, что Meis1, как и Prep1, играет роль репрессора в этом процессе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культивирование клеток. В работе использовали клеточную линию мышиных преадипоцитов 3T3-L1. Клетки растили в среде DMEM с добавлением 10% сыворотки теленка (BCS) при 37°С в увлажненной атмосфере с 5% СО2.
Для подавления экспрессии Meis1 и Meis2 клетки 3T3-L1 инфицировали лентивирусными частицами на основе вектора pLKO.1 [10], содержащего короткие шпилечные РНК (shРНК): 5'-CAGUGAAGAUGUAACAAGAUC-3' (shMeis1) и 5'-AAGUCGCGACAAAUAUCAUGA-3' (shMeis2), полученных по стандартной методике [6]. Для получения контрольных клеток использовали рандомизированную (scrambled) shРНК – shScr. Селекцию клеток пуромицином проводили в течение 3 суток.
Иммуноблотинг. Уровень экспрессии генов Meis1, Meis2, Pparg и Cebpa оценивали с помощью иммуноблотинга, который проводили по стандартному протоколу [11]. Общий лизат клеток после электрофоретического разделения переносили на нитроцеллюлозную мембрану и для гибридизации использовали следующие первичные антитела: поликлональное C17 против Meis1/2 (“Santa Cruz Biotechnology”, Cat. # sc-10599), моноклональное 81B8 против Pparγ (“Cell Signaling Technology”, Cat. # 2443), моноклональное D56F10 против C/ebpα (“Cell Signaling Technology”, Cat. # 8178). Антитела против тубулина (DM1A, “Sigma-Aldrich”, Cat. # T9026) и против винкулина (hVIN-1, “Sigma-Aldrich”, Cat. # V9131) использовали для нормализации.
Адипоцитарная дифференцировка. Для анализа дифференцировки среду культивирования клеток 3T3-L1, через 2 суток после достижения конфлюентности, заменяли на среду I для дифференцировки, содержащую 1 мкМ дексаметазона, 0.5 мМ 3-изобутил-1-метилксантина и 1 мкг/мл инсулина в DMEM с 10% фетальной сыворотки крупного рогатого скота (FBS). Через 2 суток после индукции дифференцировки среду заменяли на среду II для дифференцировки, содержащую только 1 мкг/мл инсулина и 10% FBS. Через 4 суток дифференцировки среду заменяли на среду III для дифференцировки, содержащую только 10% FBS.
Окрашивание по Oil-red O. Дифференцированные клетки 3T3-L1 окрашивали красителем Oil-red O, следуя стандартному протоколу [12]. Коротко, клетки фиксировали в 3.7%-ном растворе формальдегида в фосфатно-солевом буфере (PBS) в течение 30 мин при комнатной температуре, после чего окрашивали в растворе 0.3%-ного Oil-red O в 60%-ном изопропаноле в течение 30 мин при комнатной температуре.
Анализ генной онтологии. Для анализа генной онтологии использовали программу GREAT, предназначенную для интерпретации функций цис-регуляторных участков генов человека и мыши (http://great.stanford.edu) [13].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для подавления экспрессии генов Meis1 и Meis2 в клетках линии 3T3-L1 использовали специфические shРНК. После селекции клеток пуромицином были получены линии клеток с подавленными уровнями экспрессии Meis1 (shMeis1) и Meis2 (shMeis2). Эффективность подавления подтверждали в анализе вестерн-блот с использованием антитела, специфичного к обоим белкам (рис. 1).
Рис. 1.
Экспрессия генов Meis1 и Meis2 в клетках 3T3-L1. Для подавления экспрессии генов Meis1 и Meis2 применяли РНК-интерференцию соответствующими shРНК (shMeis1 и shMeis2). В качестве контроля использована рандомизированная shРНК (shScr; scrambled). В анализе вестерн-блот использованы первичные антитела: против Meis1/Meis2 и против тубулина (внутренний контроль) – и вторичные антитела, меченные пероксидазой хрена: anti-rabbit IgG-HRP (Cat. #170-6515) и anti-mouse IgG-HRP (Cat. #170-6516, “Bio-Rad Laboratories”).
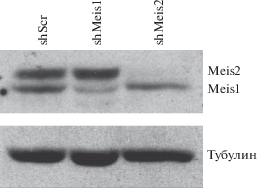
Как видно из рис. 1, для каждого из двух генов наблюдалась высокая эффективность подавления экспрессии кодируемых ими белков: для Meis1 на 70–80%, а для Meis2 практически на 100%.
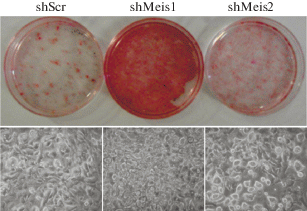
Для индукции адипоцитарной дифференцировки использовали стандартный адипогенный коктейль (среда I; см. раздел “Экспериментальная часть”), который вводили через 2 суток после достижения клетками конфлюентности. Для оценки эффективности дифференцировки применяли метод окрашивания клеток красителем Oil-red O, который связывается с нейтральными триглицеридами и липидами в клетке. Как показано на рис. 2, через 4 суток после инициации дифференцировки клеток, содержащих липидные капли, было гораздо больше в случае shMeis1, чем в контроле (shScr) и в клетках shMeis2.
Рис. 2.
Подавление экспрессии гена Meis1 приводит к усилению адипоцитарной дифференцировки in vitro. Окрашивание красителем Oil-red O клеток линии 3T3-L1 через 72 ч после добавления адипогенного коктейля (верхняя панель). shScr – клетки, инфицированные рандомизированной (контрольной) shРНК; shMeis1 и shMeis2 – клетки, инфицированные соответственно shРНК к Meis1 и shРНК к Meis2. На нижней панели в проходящем свете показаны клетки линии 3T3-L1 через 72 ч после добавления адипогенного коктейля.
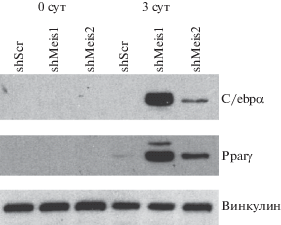
Для подтверждения полученных результатов исследована экспрессия генов-маркеров зрелых адипоцитов в процессе адипоцитарной дифференцировки клеток с подавленной экспрессией Meis1 и Meis2. Проанализирована экспрессия двух генов: Cebpa и Pparg. Кодируемые этими генами белки относятся к достаточно поздним, но специфичным маркерам адипогенеза. Как показано на рис. 3 (верхняя панель), в клетках shMeis2 и, в особенности, shMeis1 уровень экспрессии Cebpa повышался через 3 суток после введения адипогенного коктейля, в то время как в контрольных клетках экспрессия этого белка не изменялась. Экспрессия другого маркера адипогенной дифференцировки, Pparg, также резко возрастала в клетках с пониженной экспрессией Meis1 и, в меньшей степени, в клетках с пониженной экспрессией Meis2. Является ли это следствием роста числа клеток, содержащих липидные капли, или увеличением уровня экспрессии Pparg и/или Cebpa в отдельных клетках, требует дополнительного исследования.
Рис. 3.
Анализ экспрессии адипоцитспецифичных генов в клетках 3T3-L1. Анализ лизатов клеток 3T3-L1 до (0 сут) и на третьи сутки (3 сут) после введения адипогенного коктейля методом иммуноблотинга с антителами к C/ebpα, Pparγ и винкулину (для нормировки нанесения). shScr – клетки, инфицированные рандомизированной (контрольной) shРНК, shMeis1 и shMeis2 – клетки, инфицированные соответственно shРНК к Meis1 и shРНК к Meis2.
Как уже было отмечено, подобная зависимость эффективности адипоцитарной дифференцировки от уровня экспрессии Meis1 сходна с зависимостью дифференцировки от уровня Prep1 [7]. Для выяснения возможного объяснения наблюдаемого эффекта нами проведено полногеномное исследование связывания факторов Meis в клетках 3T3-L1 через 4 ч после добавления адипогенного коктейля (ChIP-seq с антителом, специфичным к двум белкам: Meis1 и Meis2). Детальное обсуждение полученных результатов будет приведено в другой, готовящейся к публикации, статье. При анализе Meis-связанных локусов хроматина выявлено, что в подавляющем большинстве случаев (>75%) Meis связывается с хроматином далеко (>20 тыс.н.) от старта инициации транскрипции генов, что не позволяет однозначно ассоциировать определенный ген с сайтом связывания Meis. Принимая это во внимание, мы провели анализ онтологии генов, которые связываются с Meis на расстоянии <20 тыс.н. от старта инициации транскрипции. Этим критериям отвечало 2175 генов. Подавляющее большинство (>70%) анализируемых локусов содержит сайт связывания Meis, установленный нами ранее [6]. Несмотря на то, что наиболее статистически значимыми были категории, ассоциированные с дифференцировкой кардиомиоцитов, некоторые гены-мишени фактора Meis образуют статистически значимую категорию “регуляция дифференцировки жировых клеток” (таблица). Среди них идентифицированы такие специфичные для адипогенеза гены, как Adipoq, Cebpa, Foxo1, Id2, Pparg, Wnt10b и Wnt5b.
Таблица.
Наиболее статистически значимые категории онтологии генов, с которыми связывается фактор Meis на расстоянии менее 20 тыс.н. от старта инициации транскрипции
| Категория | p-value |
|---|---|
| Развитие сосудистой системы | 5.3 × 10–15 |
| Развитие кровеносных сосудов | 7.0 × 10–15 |
| Регуляция клеточной адгезии | 6.0 × 10–8 |
| Морфогенез внутреннего уха | 1.6 × 10–7 |
| Положительная регуляция клеточной адгезии | 5.6 × 10–7 |
| Морфогенез эмбриональной системы скелета | 6.6 × 10–7 |
| Дифференцировка остеобластов | 7.5 × 10–7 |
| Регуляция дифференцировки жировых клеток | 2.0 × 10–6 |
На основании полученных результатов можно предполагать, что факторы Meis1 и/или Meis2 регулируют экспрессию генов-мишеней на транскрипционном уровне, таким образом регулируя адипогенез. Для проверки этой гипотезы необходимы дополнительные исследования. Интересно проанализировать и возможность взаимосвязанного влияния Meis на адипоцитарную и кардиомиоцитарную дифференцировку.
Таким образом, в результате проведенного исследования установлено, что гомеодоменсодержащий транскрипционный фактор Meis1, в отличие от близкого по гомологии белка Meis2, подавляет адипоцитарную дифференцировку клеток преадипоцитов мыши 3T3-L1, и предложено возможное молекулярное объяснение этого эффекта.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 18-015-00465).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Siersbæk R., Nielsen R., John S., Sung M.H., Baek S., Loft A., Hager G.L., Mandrup S. (2011) Extensive chromatin remodelling and establishment of transcription factor ‘hotspots’ during early adipogenesis. EMBO J. 30, 1459–1472.
Siersbaek R., Nielsen R., Mandrup S. (2012) Transcriptional networks and chromatin remodeling controlling adipogenesis. Trends Endocrinol. Metab. 23, 56–64.
Fu M., Sun T., Bookout A.L., Downes M., Yu R.T., Evans R.M., Mangelsdorf D.J. (2005) A Nuclear Receptor Atlas: 3T3-L1 adipogenesis. Mol. Endocrinol. 19, 2437–2450.
Siersbæk R., Baek S., Rabiee A., Nielsen R., Traynor S., Clark N., Sandelin A., Jensen O.N., Sung M.H., Hager G.L., Mandrup S. (2014) Molecular architecture of transcription factor hotspots in early adipogenesis. Cell Rep. 7, 1434–1442.
Monteiro M.C., Sanyal M., Cleary M.L., Sengenès C., Bouloumié A., Dani C., Billon N. (2011) PBX1: a novel stage-specific regulator of adipocyte development. Stem Cells. 29, 1837–1848.
Penkov D., Mateos San Martín D., Fernandez-Díaz L.C., Rosselló C.A., Torroja C., Sánchez-Cabo F., Warnatz H.J., Sultan M., Yaspo M.L., Gabrieli A., Tkachuk V., Brendolan A., Blasi F., Torres M. (2013) Analysis of the DNA-binding profile and function of TALE homeoproteins reveals their specialization and specific interactions with Hox genes/proteins. Cell Rep. 3, 1321–1333.
Maroni G., Tkachuk V.A., Egorov A., Morelli M.J., Luongo R., Levantini E., Blasi F., Magli M.C., Penkov D. (2017) Prep1 prevents premature adipogenesis of mesenchymal progenitors. Sci. Rep. 7, 15573.
Liu Q., Jiang C., Xu J., Zhao M.T., Van Bortle K., Cheng X., Wang G., Chang H.Y., Wu J.C., Snyder M.P. (2017) Genome-wide temporal profiling of transcriptome and open chromatin of early cardiomyocyte differentiation derived from hiPSCs and hESCs. Circ. Res. 121, 376–391.
Quaranta R., Fell J., Rühle F., Rao J., Piccini I., Araúzo-Bravo M.J., Verkerk A.O., Stoll M., Greber B. (2018) Revised roles of ISL1 in a hES cell-based model of human heart chamber specification. Elife. 7, e31706.
Moffat J., Grueneberg D.A., Yang X., Kim S.Y., Kloepfer A.M., Hinkle G., Piqani B., Eisenhaure T.M., Luo B., Grenier J.K., Carpenter A.E., Foo S.Y., Stewart S.A., Stockwell B.R., Hacohen N., Hahn W.C., Lander E.S., Sabatini D.M., Root D.E. (2006) A lentiviral RNAi libraryfor human and mouse genes applied to an arrayed viral high-content screen. Cell. 124, 1283–1298.
Longobardi E., Blasi F. (2003) Overexpression of PREP-1 in F9 teratocarcinoma cells leads to a functionally relevant increase of PBX-2 by preventing its degradation. J. Biol. Chem. 278, 39235–39241.
Kraus N.A., Ehebauer F., Zapp B., Rudolphi B., Kraus B.J., Kraus D. (2016) Quantitative assessment of adipocyte differentiation in cell culture. Adipocyte. 5, 351–358.
McLean C.Y., Bristor D., Hiller M., Clarke S.L., Schaar B.T., Lowe C.B., Wenger A.M., Bejerano G. (2010) GREAT improves functional interpretation of cis-regulatory regions. Nat. Biotechnol. 28, 495–501.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


