Молекулярная биология, 2019, T. 53, № 3, стр. 485-496
Характеристика альтернативных промоторов гена аполипопротеина A-I человека
Д. А. Могиленко a, b, c, В. С. Шавва a, b, Э. Б. Диже a, С. В. Орлов a, b, *
a Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
c Université de Lille, Inserm, Institut Pasteur de Lille
59000 Lille, France
* E-mail: serge@iem.sp.ru
Поступила в редакцию 09.12.2018
После доработки 29.12.2018
Принята к публикации 29.12.2018
Аннотация
Аполипопротеин A-I (ApoA-I) человека ‒ главный структурный и функциональный белковый компонент липопротеинов высокой плотности (ЛПВП), на долю которого приходится 75% белкового состава ЛПВП. Основными местами синтеза и секреции ApoA-I являются печень и тонкий кишечник. Механизмы, контролирующие тканеспецифическую транскрипцию гена apoA-I в тканях и органах, отличных от печени и тонкого кишечника, практически не изучены. Известно существование двух дополнительных промоторов гена apoA-I человека, но сами промоторы почти не изучены. В настоящей работе охарактеризованы альтернативные промоторы гена apoA-I человека. Впервые картированы точки инициации транскрипции c проксимального и дистального альтернативных промоторов, показан феномен конкуренции промоторов, выдвинута гипотеза о роли альтернативных промоторов в экспрессии гена аpoA-I в клетках тканей, отличных от печени и тонкого кишечника.
Многочисленные клинические и эпидемиологические исследования показали, что низкий уровень липопротеинов высокой плотности (ЛПВП) в плазме крови является важным фактором риска развития атеросклероза [1]. ЛПВП выполняют защитную роль, препятствуя процессам атерогенеза [2]. Основной структурный и функциональный белковый компонент ЛПВП человека ‒ аполипопротеин A-I (ApoA-I), на долю которого приходится 75% белкового состава ЛПВП. ApoA-I синтезируется преимущественно в печени и тонком кишечнике, которые секретируют его в кровь в составе ЛПВП, хиломикронов и липопротеинов очень низкой плотности (ЛПОНП) [3, 4].
Ген apoA-I человека расположен на хромосоме 11 (11q23) в составе кластера, содержащего гены apoC-III, apoA-IV и apoA-V [5]. Экспрессия гена apoA-I регулируется его 5'-регуляторной областью и общим кластерным энхансером, расположенным в 5'-регуляторном районе гена apoC-III [6‒9]. Хотя ген apoA-I человека активно изучают в течение последних 30 лет, большинство работ посвящены относительного короткому району, расположенному в области –256…+1 относительно канонической точки инициации транскрипции (ТИТ). В ранних работах [6, 7] показано, что минимального промотора гена apoA-I (–41…+1) и гепатоцитарного энхансера (–222…–110) достаточно для эффективной транскрипции в печени. Тканеспецифическая транскрипция в эпителии тонкого кишечника в основном контролируется общим кластерным энхансером [8, 9]. Роль более удаленной 5'-регуляторной области гена apoA-I (–2500…–250) до сих пор практически неизвестна. Гепатоцитарный энхансер состоит из трех основных сайтов: А (–214…–192), B (–169…–146) и C (–134…–119). Сайты A и C содержат цис-элементы, специфически взаимодействующие с ядерными рецепторами. Ядерные рецепторы HNF4α [10], PPARα [11], LRH-1 [12] активируют транскрипцию гена apoA-I в гепатоцитах, тогда как белки LXR [13], FXR [14] и PPARγ [15] угнетают промотор гена apoA-I. Сайт B содержит последовательности, специфически связывающиеся с факторами транскрипции семейства Forkhead – FOXA1-3 [16] и FOXO1 [17, 18]. Кроме того, в состав гепатоцитарного энхансера входят два сайта связывания с фактором транскрипции EGR1 [19].
Опубликованы сообщения об экспрессии гена apoA-I в плаценте [20], сердце [21], хряще [22] взрослых людей, в нервной системе зародышей человека [23]. Недавно мы выявили синтез ApoA-I в клетках моноцитарно-макрофагального ряда [24, 25]. Механизмы, контролирующие тканеспецифическую транскрипцию гена apoA-I в тканях и органах, отличных от печени и тонкого кишечника, практически не изучены. Ранее мы обнаружили два альтернативных промотора гена аpoA-I и показали, что их регуляция в ответ на стимуляцию клеток провоспалительным цитокином TNFα отличается от регуляции канонического промотора apoA-I в клетках гепатомы человека HepG2 (модель гепатоцитов) и клетках аденокарциномы Caco2 (модель энтероцитов) [26]. Установлено, что эти отличия определяются факторами транскрипции – ядерными рецепторами LXRα, LXRβ, PPARα и PPARγ, взаимодействующими с сайтами A и C гепатоцитарного энхансера гена apoA-I [15, 26]. Вместе с тем, альтернативные промоторы гена apoA-I остались практически неизученными – не известны ТИТ с этих промоторов, их взаимодействия между собой и с каноническим промотором в различных типах клеток и их относительный вклад в общую экспрессию гена apoA-I. Настоящая работа посвящена альтернативным промоторам гена apoA-I человека. Впервые картированы ТИТ с проксимального и дистального альтернативных промоторов, показан феномен конкуренции промоторов, выдвинута гипотеза о роли альтернативных промоторов в экспрессии гена аpoA-I в тканях, отличных от печени и тонкого кишечника.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные линии. Линии клеток гепатомы человека HepG2, аденокарциномы прямой кишки Caco-2, аденокарциномы двенадцатиперстной кишки Hutu-80, нейробластомы Sk-N-SH и фибробластов человека VH10 получены из банка клеточных культур Института цитологии РАН, Санкт-Петербург.
Обратная транскрипция. Суммарную РНК выделяли из культивируемых клеток с использованием реагента RNA STAT-60 (“Tel-Test”, США) в соответствии с инструкциями изготовителя. После обработки ДНКазой I, свободной от РНКаз (“Roche Applied Science”, ФРГ), в течение 30 мин при 37°C реакцию останавливали, добавляя EDTA в конечной концентрации 2 мM (15 мин при 70°C для инактивации ДНКазы). Концентрацию суммарной РНК и ее чистоту определяли при помощи спектрофотометра Avaspec-2048 (“Avantes”, Нидерланды). Отношение оптических плотностей образцов РНК при 260 и 280 нм рассматривали как соответствующее очищенной от примесей РНК, если оно превышало 2.0, а отношение оптических плотностей образцов РНК при 260 и 230 нм превышало 1.7. Целостность фракций рРНК проверяли при помощи электрофореза в 1%-ном агарозном геле. Реакцию обратной транскрипции проводили с использованием суммарной РНК (2 мкг), oligo-dT (“Invitrogen”, США) в качестве праймера и обратной транскриптазы M-MLV (“Promega”, США) для получения одноцепочечной кДНК (15 мин при 70°C с праймером dT16, 1 мин на льду, 60 мин при 42°C в реакционной смеси, содержащей 0.5 мM dNTP, 0.3 мM MgCl2, 75 мM KCl, 10 мM DTT и 8 ед./мкл обратной транскриптазы, а затем 15 мин при 70°C для инактивации обратной транскриптазы).
Полуколичественная ПЦР. Экспрессию гена apoA-I анализировали с использованием следующих праймеров: первая пара Apo1/Apo2 (5'-CCTGGGATCGAGTGAAGGAC-3' и 5'-CGTGCTCAGATGCTCGGTGG-3') охватывала участок 587 п.н. кДНК гена apoA-I человека и позволяла детектировать канонические транскрипты гена apoA-I; вторая пара Apo12/Apo10 (5'-CCACATTGCCAGGACCAG-3' и 5'-CTCCCCGTCAGGAAGAGC-3') охватывала участок 194 п.н. кДНК гена apoA-I человека (–127…+67 относительно канонической ТИТ); третья пара Apo9/Apo10 (5'-AATGGCAACTGCCCACAC-3' и Apo10 (смотри выше)) охватывала участок в 403 п.н. кДНК гена apoA-I человека (–335…+67 относительно канонической ТИТ). Уровень экспрессии гена домашнего хозяйства человека, кодирующего глицеральдегид-3-фосфат-дегидрогеназу (GAPDH), использовали в качестве внутреннего контроля и нормирования результатов полуколичественной ОТ-ПЦР. GAPDH амплифицировали с помощью следующих праймеров: 5'-tcaccatcttccaggagcga-3' и 5'-acatggcctccaaggagtaa-3'. Температуры отжига для пар праймеров составляли: 60°C для Apo1/Apo2; 56°C для Apo12/Apo10 и Apo9/Apo10; 55°C для GAPDH. Оптимальное число циклов – 20 для GAPDH, 17 – apoA-I, 27 ‒ Apo10/Apo12 и 34 ‒ Apo9/Apo10 – подобрано в предварительных экспериментах.
ПЦР в реальном времени (ПЦР-РВ). Праймеры и зонды для референсных генов GAPDH [26], β-актина [27], циклофилина A [17], а также для анализа активности канонического и альтернативных промоторов гена apoA-I [26] описаны ранее. В качестве отрицательного контроля использовали следующие варианты: а) без добавления обратной транскриптазы в реакционную смесь; б) без добавления матрицы для проверки загрязнения реакционной смеси молекулами ДНК. Реакцию ПЦР-РВ проводили в следующих условиях: 95°C 300 c, затем 50 циклов ‒ 95°C 25 с и 60°C 45 с – при использовании TaqMan; и 95°C 300 с, затем 50 циклов ‒ 95°C 30 с, 60°C 20 с и 72°C 30 с в случае SyberGreen. Использовали наборы для проведения TaqMan и SyberGreen RealTime-PCR производства компании “Синтол” (Россия, каталожные номера R-412 и R-402). Реакцию проводили с помощью амплификатора CFX-96 производства компании “Bio-Rad” (США). Число циклов (значения Ct), необходимое для достижения порогового уровня флуоресценции, превышающего 10 стандартных отклонений от уровня флуктуаций фоновой флуоресценции, определяли при помощи встроенного программного обеспечения “Bio-Rad”. Относительные значения количества кДНК (в процентах от контрольного образца) рассчитывали по формуле (2Ctcontrol – Ctsample) × 100. Рассчитанные количества кДНК каждого из генов нормировали по среднему геометрическому, вычисленному по уровню экспрессии трех референсных генов (GAPDH, β-актин и циклофилин A) согласно [28], и представляли как относительный уровень экспрессии, принимая за 100% уровень экспрессии гена в контрольных клетках.
Быстрая амплификация 5'-концов кДНК – 5'RACE. ТИТ гена apoA-I человека идентифицировали с помощью 5'/3'RACE Kit (“Roche Applied Science”, кат. номер 03353621001) в соответствии с инструкциями изготовителя. Реакцию обратной транскрипции проводили на 10 мкг суммарной РНК, выделенной из клеток HepG2, используя обратный праймер Apo2 (5'-CGTGCTCAGATGCTCGGTGG-3'). Для картирования проксимальной альтернативной ТИТ гена apoA-I человека использовали праймер RACE1 (5'-GCCCTGTTGCTGCTCACT-3'). Картирование дистальной альтернативной ТИТ гена apoA-I человека проводили методом гнездовой ПЦР, используя два обратных праймера ApoR4 (5'-GGCAGGGGTCAAGGGTTC-3') и RACE2 (5'-CGGGAGGGGAGTGTCTGC-3'). Амплифицированные фрагменты субклонировали в вектор pBluescript и секвенировали.
Генетические конструкции. pCMVL, вектор экспрессии бактериального гена-репортера lacZ под контролем промотора предранних генов цитомегаловируса человека (CMV), сконструирован ранее [29]. pCMVHNF4, вектор экспрессии фактора транскрипции HNF4α человека, любезно предоставлен Dr. Fukamizu (University of Tsukuba, Japan). pCMVHNF4D, вектор экспрессии доминантно-негативного мутантного фактора транскрипции HNF4α человека, любезно предоставлен Dr. Leff (Wayne State University School of Medicine, USA). PCMVEgr1, вектор экспрессии фактора транскрипции Egr1, любезно предоставлен Dr. Milbrandt (Washington University, USA). Плазмида pAlg, содержащая EcoRI-фрагмент геномного локуса (11q23) человека с координатами 116 252 251–116 239 958 (http://genome.ucsc.edu/cgi-bin/hgBlat), который включает полноразмерный ген apoA-I и его 5'-регуляторную область, любезно предоставлена Dr. Chan (Baylor College, Texas, USА). Плазмида pALT, содержащая ген люциферазы под контролем 5'-регуляторной области гена apoA-I человека (–2498…+173), описана ранее [29]. Плазмиды, содержащие ген люциферазы под контролем делеционных вариантов 5'-регуляторного участка гена apoA-I человека pA1d119 (–2498…–119), pA1d119S (–256…–119) и pA1d256 (–2498…–256), получали, используя стандартные методы генной инженерии.
Трансфекция клеток, люциферазный и β-галактозидазный тесты. Клетки HepG2, Hutu80, Sk-N-SH, VH10 культивировали в среде DMEM с добавлением 10% эмбриональной сыворотки крупного рогатого скота (FCS) в атмосфере 5% CO2 при 37°С. Клетки Caco-2 культивировали в тех же условиях, но при концентрации FCS 20%. Для изучения динамики экспрессии гена apoA-I в ходе дифференцировки клетки Caco-2 высевали на 30 мм чашки Петри с плотностью 1 × 104 клеток на 1 см2. В ходе культивирования культуральную среду заменяли свежей каждые 72 ч. Жизнеспособность клеток контролировали по окрашиванию трипановым синим. Во всех экспериментах уровень жизнеспособности клеток не опускался ниже 95%. Клетки HepG2, Hutu80, Sk-N-SH и VH10 высевали на 30-мм чашки Петри и культивировали до достижения субконфлюентного монослоя (24‒48 ч). Клетки трансфицировали методом кальций-фосфатной преципитации, как описано ранее [30]. Общая нагрузка плазмидной ДНК составляла 10 мкг на 30 мм чашку. Уровень трансфекции контролировали с использованием плазмиды pCMVL, содержащей ген бактериальной β-галактозидазы под контролем промотора предранних генов цитомегаловируса человека [29]. Уровень β-галактозидазной активности в лизатах трансфицированных клеток определяли по стандартному протоколу с использованием в качестве субстрата o-нитрофенил-β-D-галактопиранозида. Относительную активность β-галактозидазы рассчитывали в единицах оптической плотности D420 за 1 ч реакции в пересчете на 1 мг суммарного белка в клеточных лизатах. Относительную активность люциферазы (RLU) измеряли на люминометре 20/20n (“Turner BioSystems”), используя Luciferase Assay System (“Promega”) в соответствии с рекомендациями изготовителя. Активность люциферазы (RLU) выражали как число световых импульсов за 1 мин реакции в пересчете на 1 мг суммарного белка в клеточных лизатах. Концентрацию белка измеряли по методу Брэдфорда. Все результаты нормировали по уровню β-галактозидазной активности.
Статистическая обработка. Результаты представлены как средние значения. Планки погрешностей соответствуют стандартной ошибке среднего. Статистический анализ различий между сравниваемыми группами проводили, используя непарный t-тест Стьюдента. Различия считали статистически значимыми при p < 0.05. Анализ проводили с помощью программного обеспечения Statistica 5.0 (StatSoft Inc., США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Компьютерный анализ альтернативных форм мРНК apoA-I человека
Существование альтернативных форм мРНК apoA-I, отличающихся 5'-концом, проверяли, проведя поиск среди EST человека с помощью программы BLAST и последовательности гена apoA-I человека (–350…+1 относительно канонической ТИТ) в качестве мишени. Обнаружены различные EST, соответствующие мРНК apoA-I человека с 5'-концом, отличным от классической ТИТ (рис. 1). Большинство таких EST начинались в районе –120…–100 относительно канонической ТИТ apoA-I человека, но одна последовательность, клонированная из семенников, содержала дополнительные 210 п.н. на 5'-конце и начиналась в положении –346 относительно канонической ТИТ гена apoA-I человека. Эти данные допускали существование альтернативного промотора (или нескольких) с ТИТ, локализованной, по крайней мере, в координате –346 относительно ТИТ c канонического промотора.
Рис. 1.
Поиск необычных EST гена apoA-I человека с протяженным 5'-концом. В качестве запроса (Query) использовали фрагмент 5'-регуляторной области гена apoA-I человека (–350…+1 п.н. относительно канонической точки инициации транскрипции (ТИТ)). Звездочки и решетки соотносят конкретные последовательности с диаграммой, иллюстрирующей степень перекрывания конкретного EST c Query.
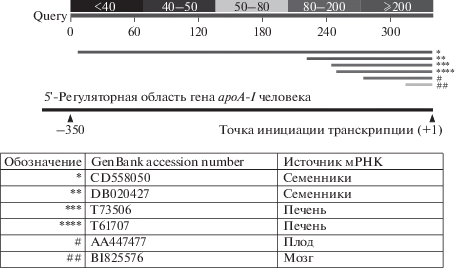
Можно предложить три возможных объяснения полученных результатов. Это, во-первых, существование одного дистального альтернативного промотора гена apoA-I человека, локализованного в области около –350 п.н. относительно канонической ТИТ. В таком случае более короткие альтернативные EST apoA-I могли образоваться в результате преждевременной терминации реакции обратной транскрипции. Во-вторых, возможно существование по меньшей мере двух альтернативных промоторов (либо ТИТ) гена apoA-I человека – дистального, лoкализованного в области около –350 п.н., и проксимального в области около –120 п.н. В-третьих, появление альтернативных EST apoA-I человека могло быть артефактом, обусловленным контаминацией базы EST геномными последовательностями, либо быть связанным с рекомбинацией при получении библиотеки EST в бактериях. Вместе с тем, выявленные нами ранее различия в регуляции промоторов ‒ альтернативных и канонического ‒ гена apoA-I под действием TNFα свидетельствовали в пользу существования двух альтернативных промоторов (проксимального и дистального) [26].
Идентификация альтернативных форм мРНК apoA-I человека и картирование ТИТ с альтернативных промоторов
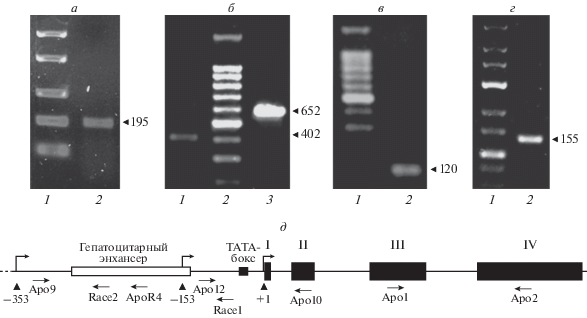
Для подтверждения существования альтернативных форм мРНК apoA-I человека в линии клеток гепатомы человека HepG2 и в линии клеток аденокарциномы прямой кишки Caco-2 (модельные объекты экспрессии гена apoA-I) мы использовали метод ОТ-ПЦР. Были подобраны две пары праймеров: одну применяли для определения часто встречающейся среди EST альтернативной формы мРНК apoA-I человека (предполагаемая ТИТ ~ –100 п.н.); другую ‒ для определения редкой среди EST альтернативной изоформы (предположительная ТИТ ~ –300 п.н.), (см. рис. 2д и “Экспериментальную часть ”). ОТ-ПЦР c обеими парами праймеров позволила выявить позитивные сигналы в клетках HepG2 и Caco-2 (рис. 2а, б). Специфичность продуктов ПЦР проверена с помощью клонирования и последующего секвенирования. Таким образом, экспериментально подтверждено существование альтернативных изоформ мРНК гена apoA-I человека в клетках HepG2. Следующая задача состояла в определении ТИТ с альтернативных промоторов гена apoA-I. ТИТ картировали с помощью метода 5'-RACE. ТИТ с проксимального промотора определяли с использованием обратного праймера, комплементарного области –93…–76 относительно канонической ТИТ. Электрофоретический анализ продуктов 5'-RACE в агарозном геле выявил фрагмент ~120 п.н. (рис. 2в). Клонирование и секвенирование этого фрагмента с последующим его выравниванием с 5'-регуляторной областью гена apoA-I позволило идентифицировать ТИТ с проксимального альтернативного промотора гена apoA-I в позиции –153 п.н. относительно канонической ТИТ. Сходным образом проведено картирование ТИТ с дистального альтернативного промотора. Пару обратных праймеров (–208…–191 и –217…–234) использовали для “вложенной” (nested) ПЦР в ходе 5'-RACE. В результате амплифицирован, клонирован и секвенирован фрагмент ~150 п.н. (рис. 2г). Выравнивание последовательности данного фрагмента c 5'-регуляторной областью гена apoA-I позволило определить ТИТ с дистального промотора в позиции –353 п.н. относительно канонической ТИТ. Таким образом, в результате нам удалось картировать две дополнительные ТИТ в 5'-регуляторной области гена apoA-I человека, активные в клетках HepG2.
Рис. 2.
Характеристика двух альтернативных промоторов гена apoA-I человека. а – Обнаружение короткой альтернативной мРНК apoA-I человека (начало транскрипции примерно –150 п.н. относительно канонической точки инициации транскрипции) в клетках HepG2 методом ОT-ПЦР: 1 – ДНК-маркеры молекулярной массы (п.н.); 2 – ОТ-ПЦР с праймерами Apo12/Apo10. б – Обнаружение длинной альтернативной мРНК apoA-I человека (начало транскрипции примерно –360 п.н. относительно канонической точки инициации транскрипции) в клетках HepG2 методом ОT-ПЦР: 1 – ОТ-ПЦР с праймерами Apo9/Apo10; 2 – ДНК-маркеры молекулярной массы (п.н.); 3 – положительный контроль (ПЦР с геномной ДНК человека). в – 5'-RACE-анализ для определения точки инициации транскрипции с проксимального альтернативного промотора: 1 – ДНК-маркеры молекулярной массы (п.н.); 2 – фрагмент ~120 п.н., амплифицированный в результате 5'-RACE с праймером Race1. г – Фрагмент ~155 п.н., амплифицированный в результате 5'-RACE с праймерами ApoR4 и Race2. д – Общая схема 5 '-регуляторной и кодирующей областей гена apoA-I человека с обозначенными праймерами, использованными для ОТ-ПЦР и 5'-RACE. Черными прямоугольниками с римскими цифрами показаны экзоны.
Сравнение активности альтернативных и канонического промоторов гена apoA-I человека в ходе дифференцировки клеток линии Caco-2
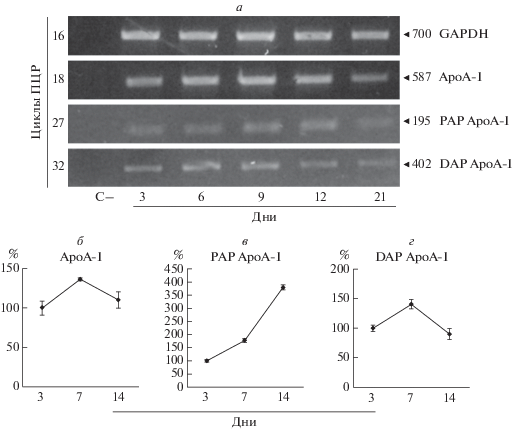
Принадлежат ли выявленные нами новые ТИТ общему промотору apoA-I, или они указывают на существование двух альтернативных промоторов этого гена? Этот вопрос оставался открытым, хотя результаты нашей работы [26] свидетельствовали в пользу второго варианта. Чтобы подтвердить существование двух альтернативных промоторов гена apoA-I мы определяли активность всех трех промоторов методами ОТ-ПЦР и ОТ-ПЦР в реальном времени в ходе дифференцировки клеток линии Caco-2, которая служит моделью эпителия тонкой кишки. Клетки Caco-2 в отличие от клеток HepG2 начинают экспрессировать ген apoA-I только на второй день после посева. При этом уровень экспрессии гена apoA-I повышается примерно до 14 дня культивирования (максимальный уровень экспрессии), а после этого постепенно уменьшается [31]. На рис. 3 приведены результаты изучения динамики экспрессии гена apoA-I методом полуколичественной ОТ-ПЦР (рис. 3a) и ОТ-ПЦР в реальном времени (рис. 3б‒г). Продукты транскрипции с проксимального альтернативного и канонического промотора проявляют сходную динамику экспрессии, максимум которой приходится на 14 день дифференцировки. Вместе с тем, активность дистального альтернативного промотора существенно отличается. Максимум его активности приходится на 6‒7 день дифференцировки клеток. Таким образом, полученные результаты подтверждают различия в регуляции альтернативных и канонической ТИТ и, следовательно, подтверждают существование альтернативных промоторов гена apoA-I человека как отдельных регуляторных элементов.
Рис. 3.
Динамика активности промоторов гена apoA-I человека в ходе дифференцировки клеток Caco-2 (ОТ-ПЦP-анализ). а – Полуколичественная ОТ-ПЦР. б‒г – ОТ-ПЦР в реальном времени. ApoA-I – канонический промотор, PAP – проксимальный альтернативный промотор, DAP – дистальный альтернативный промотор. Цифры указывают размер фрагментов (п.н.), дни — время после посева клеток.
Конкуренция промоторов гена apoA-I человека
С целью более детального изучения вклада альтернативных промоторов в регуляцию транскрипции гена apoA-I человека получены генетические конструкции, содержащие репортерный ген люциферазы, сцепленный с различными делеционными вариантами 5'-регуляторной области гена apoA-I человека, содержащими канонический промотор (СР), дистальный (DAP) и проксимальный (PAP) альтернативные промоторы в различных сочетаниях (рис. 4а).
Рис. 4.
Анализ активности альтернативных промоторов гена apoA-I человека в клетках HepG2, Hutu80, Sk-N-SH и VH-10. а ‒ Схема генетических конструкций, использованных в эксперименте. HE ‒ гепатоцитарный энхансер, CP ‒ канонический промотор, PAP ‒ проксимальный альтернативный промотор, DAP ‒ дистальный альтернативный промотор, LUC ‒ ген люциферазы. б ‒ Люциферазный тест. Клетки трансфицировали плазмидами pALT, pA1d119, pA1d119S, pA1d256 (7 мкг на 30-мм чашку Петри). В качестве внутреннего контроля ко всем пробам добавлена плазмида pCMVL (2 мкг). Приведены средние значения, полученные из четырех независимых экспериментов. Планки погрешности соответствуют стандартной ошибке среднего. в ‒ Анализ активности альтернативных промоторов гена apoA-I человека в клетках Hutu80 и Sk-N-SH, трансфицированных плазмидами pAlg (7 мкг на 30-мм чашку Петри) и pCMVL (2 мкг, внутренний контроль трансфекции), с помощью полуколичественной ОТ-ПЦР. GAPDH ‒ ОТ-ПЦР c праймерами к референсному гену gapdh; LacZ – ОТ-ПЦР c праймерами к гену lacZ (внутренний стандарт); ApoA-I – ОТ-ПЦР c праймерами Apo1/Apo2 (амплифицируют каноническую изоформу мРНК аpoA-I); PAP ApoA-I – ОТ-ПЦР c праймерами Apo12/Apo10 (амплифицируют проксимальную альтернативную изоформу мРНК аpoA-I); DAP ApoA-I – ОТ-ПЦР c праймерами Apo9/Apo10 (амплифицируют дистальную альтернативную изоформу мРНК аpoA-I). Оптимальное число циклов для каждой пары праймеров (конец экспоненциальной фазы ПЦР) определено в предварительных экспериментах. Эксперимент повторяли 3 раза с получением сходных результатов.
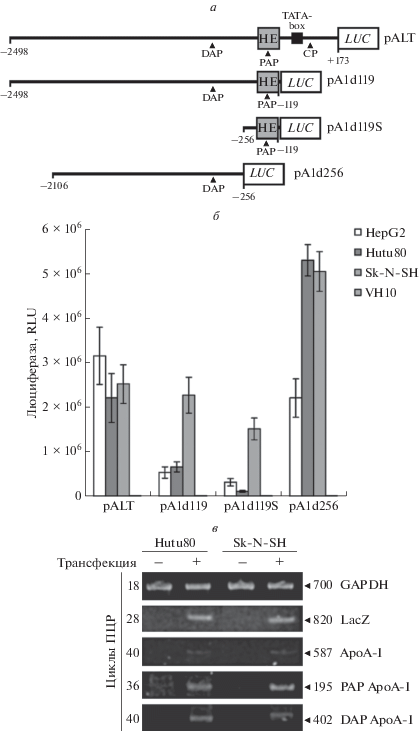
Полученные генетические конструкции тестировали в клетках HepG2, Hutu80 (модельный объект клеток двенадцатиперстной кишки), Sk-N-SH (нейробластома) и фибробластах кожи человека VH10 (рис. 4). Все конструкции были активны в указанных клеточных линиях, но не в фибробластах. Удаление канонического промотора ослабляло, но не устраняло люциферазную активность в клетках HepG2. Более того, конструкции, экспрессирующие ген люциферазы, управляемый альтернативными промоторами (дистальным и проксимальным) гена apoA-I человека, были также активны в люциферазном тесте. Эти результаты подтверждают данные, полученные с помощью ОТ-ПЦР (рис. 2, 3). Кроме того, активность дистального промотора (плазмида pA1d256) в клетках Sk-N-SH и Hutu80, в которых эндогенный ген apoA-I в нормальных условиях не экспрессируется, была более высокой, чем в клетках HepG2.
Обнаруженный факт позволяет предположить специфическую роль различных промоторов гена apoA-I человека в регуляции этого гена в клетках разного типа. Если промоторы гена apoA-I не зависят друг от друга, то общая транскрипционная активность 5'-регуляторного региона гена apoA-I (содержащего все три промотора) должна быть равна арифметической сумме активностей всех промоторов. Однако в наших экспериментах активность плазмиды pA1d256 (содержащей только дистальный альтернативный промотор) была почти такой же высокой, как и плазмиды pALT (содержащей три промотора гена apoA-I человека) в клетках HepG2 (рис. 4). Эти данные противоречат результатам ОТ-ПЦР, в которых активность дистального промотора (DAP) была значительно слабее активности канонического промотора (CP) (рис. 2, 3). Полученные результаты можно интерпретировать как существование конкуренции между различными промоторами гена apoA-I. Можно допустить, что более проксимальный промотор подавляет активность дистального промотора за счет конкуренции за общие факторы транскрипции и/или за РНК-полимеразу II. Таким образом, удаление канонического и проксимального альтернативного промоторов ведет к значительному повышению активности дистального альтернативного промотора до уровня канонического промотора (наивысшей при эндогенной экспрессии гена apoA-I) (рис. 4б).
С целью дальнейшей проверки гипотезы о конкуренции промоторов клетки Hutu80 и Sk-N-SH трансфицировали плазмидой pAlg, содержащей фрагмент геномного локуса человека, включающий ген apoA-I c протяженной 5'-регуляторной областью. Если гипотеза о конкуренции промоторов верна, то можно ожидать, что активность альтернативных промоторов гена apoA-I в этих клеточных линиях будет выше активности канонического промотора. На рис. 4в представлены результаты анализа активности трех промоторов гена apoA-I в клетках Hutu80 и Sk-N-SH, трансфицированных плазмидой pAlg, методом полуколичественной ОТ-ПЦР. Активность проксимального альтернативного промотора оказалась приблизительно в 16 раз выше, чем у канонического и дистального альтернативного промоторов. Более того, по-видимому, мРНК, синтезируемая с проксимального альтернативного промотора, подвергается альтернативному сплайсингу, так как праймеры к каноническим транскриптам ее не выявляют. Для прояснения данного вопроса требуются дополнительные исследования. Таким образом, представленные результаты подтверждают гипотезу о конкуренции промоторов и предполагают возможную роль альтернативных промоторов в экспрессии гена apoA-I в клетках, отличных от гепатоцитов и энтероцитов.
Регуляция альтернативных промоторов гена apoA-I человека факторами транскрипции Egr1 и HNF4α
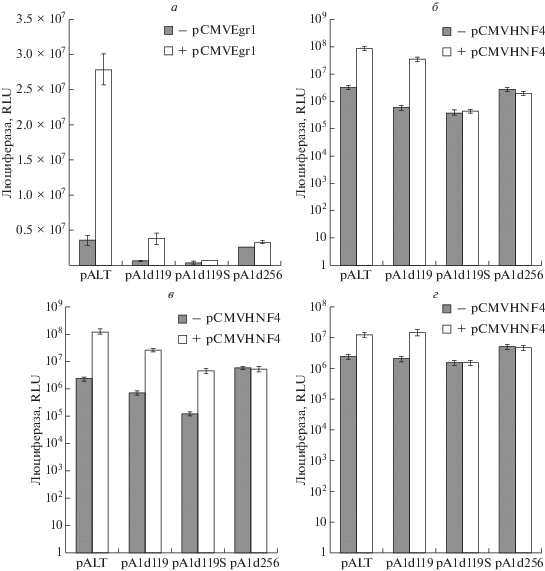
5'-Регуляторная область гена apoA-I человека содержит хорошо охарактеризованные сайты связывания факторов транскрипции HNF4α и Egr1 [10, 19]. Мы предприняли попытку изучить роль этих факторов в регуляции различных промоторов гена apoA-I. Клетки котрансфицировали векторами, экспрессирующими Egr1 и HNF4α (рис. 5). Сверхэкспрессия гена Egr1 в клетках HepG2 вела к значительной стимуляции активности 5'-регуляторной области гена apoA-I в плазмиде pALT, что соответствовало ранее опубликованным результатам [19]. Удаление канонического промотора гена apoA-I не затрагивало сайты связывания Egr1, локализованные в координатах –190 и –220 п.н. относительно канонической ТИТ, а воздействие Egr1 на плазмиду pA1d119 было таким же, как и на плазмиду pALT. Интересно, что удаление большей части 5'-регуляторного района гена apoA-I с сохранением только гепатоцитарного энхансера и проксимального альтернативного промотора (–256…–119) вело к ослаблению опосредованной Egr1 стимуляции активности промотора гена apoA-I, несмотря на то что такая делеция не затрагивает сайты связывания Egr1. Эти данные могут указывать на возможность дифференциального влияния Egr1 на проксимальный альтернативный промотор и на канонический промотор гена apoA-I человека. Другое объяснение – это существование неохарактеризованных сайтов связывания Egr1 в дистальной части 5'-регуляторного района гена apoA-I (левее точки –256 п.н. относительно канонической ТИТ). В пользу последней гипотезы свидетельствует то, что сверхэкспрессия Egr1 вызывает незначительную стимуляцию дистального альтернативного промотора apoA-I в плазмиде pA1d256, несмотря на отсутствие в этой конструкции известных сайтов связывания Egr1 (рис. 5a). Сходные результаты получены и при изучении фактора транскрипции NHF4α. Два сайта связывания HNF4α локализованы в пределах гепатоцитарного энхансера гена apoA-I человека (–222…–110 п.н. относительно канонической ТИТ) [10]. Сверхэкспрессия HNF4α в клетках HepG2 (рис. 5б), Hutu80 (рис. 5в) и Sk-N-SH (рис. 5г) приводила к значительному усилению активности люциферазы в клетках, трансфицированных плазмидами pALT (все три промотора) и pA1d119 (только два альтернативных промотора). Делеция канонического и проксимального альтернативных промоторов гена apoA-I (плазмида pA1d256) приводила к удалению сайтов связывания HNF4α, поэтому не удивительно, что сверхэкспрессия HNF4α не влияла на активность конструкции pA1d256. Интересно, что экспрессия плазмиды pA1d119S, содержащей только проксимальный альтернативный промотор гена apoA-I, позитивно регулировалась HNF4α только в клетках Hutu80. HNF4α не влиял на проксимальный альтернативный промотор гена apoA-I в клетках HepG2 и Sk-N-SH (рис. 5а, г). Специфичность регуляции активности промоторов гена apoA-I человека фактором HNF4α подтверждена в экспериментах по котрансфекции клеток конструкциями, содержащими указанный фрагмент регуляторного района apoA-I, и доминантно-негативным геном HNF4α (данные не приведены). Более того, влияние доминантно-негативного HNF4α на активность проксимального альтернативного промотора гена apoA-I было специфичным для типа клеток.
Рис. 5.
Влияние факторов транскрипции Egr1 и HNF4α на активность делеционных вариантов 5'-регуляторной области гена apoA-I человека (люциферазный тест). а – Эффект сверхэкспрессии гена Egr1 на активность плазмид pALT, pA1d119, pA1d119S и pA1d256 в клетках HepG2. б‒г – Влияние сверхэкспрессии гена HNF4α на активность плазмид pALT, pA1d119, pA1d119S и pA1d256 в клетках HepG2, Hutu80 и Sk-N-SH (б–г соответственно). Клетки (30-мм чашка Петри) трансфицировали генетической конструкцией с геном люциферазы (7 мкг), плазмидой pCMVL (2 мкг, внутренний стандарт), вектором, экспрессирующим факторы транскрипции (0.5 мкг). В контрольные точки, не содержащие векторы экспрессии, добавляли 0.5 мкг плазмиды pCMVgfp.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В настоящей работе нами впервые картированы две дополнительные ТИТ в 5'-регуляторной области гена apoA-I человека. Известно, что промоторы многих генов содержат множественные ТИТ, поэтому открытым оставался вопрос, можно ли говорить об альтернативных промоторах гена apoA-I, или только об альтернативных ТИТ. Множественные ТИТ в пределах одного промотора регулируются сходным образом под действием внутри- и внеклеточных стимулов и имеют сходную тканевую специфичность. Наоборот, различные промоторы одного гена часто характеризуются различной тканевой специфичностью и независимой регуляцией. Основываясь на данном критерии, можно утверждать, что в 5'-регуляторной области гена apoA-I человека расположены именно альтернативные промоторы. В пользу существования альтернативных промоторов гена apoA-I убедительно свидетельствуют различия в динамике активности в ходе дифференцировки клеток Caco-2, выявленный нами феномен конкуренции промоторов и, наконец, описанные ранее различия в регуляции под действием провоспалительного цитокина TNFα [26]. Оба альтернативных промотора в отличие от канонического лишены выраженного TATA-бокса. Вместо TATA-бокса оба альтернативных промотора содержат кластеры GC-богатых цис-элементов для фактора транскрипции Sp1, характерных для промоторов, которые не содержат TATA-бокс.
Хорошо известно, что канонический промотор гена apoA-I обладает высокой тканевой специфичностью, он активен в основном в гепатоцитах и энтероцитах [6‒9]. Следовательно, можно предположить, что именно альтернативные промоторы гена apoA-I обеспечивают его экспрессию в клетках и тканях, отличных от гепатоцитов и энтероцитов, где канонический промотор частично или полностью репрессирован. Хотя эта гипотеза требует экспериментальной проверки, несколько фактов косвенно свидетельствуют в ее пользу. Во-первых, проведенный нами делеционный анализ 5'-регуляторной области гена apoA-I выявил конкуренцию между каноническим и альтернативными промоторами. Следовательно, репрессия канонического промотора в тканях и органах, отличных от печени и тонкого кишечника, может приводить к ослаблению конкуренции и к активации альтернативных промоторов. Во-вторых, проведенные нами эксперименты по трансфекции клеток нейробластомы Sk-N-SH и аденокарциномы двенадцатиперстной кишки геномным локусом apoA-I частично подтвердили данное предположение, поскольку проксимальный альтернативный промотор оказался более активным, чем канонический. Тем не менее, данную гипотезу нельзя считать полностью доказанной. Так, активность альтернативных промоторов не выявлена нами в клетках моноцитарно-макрофагального ряда, где также экспрессируется ген apoA-I [24]. Для окончательного ответа на этот вопрос необходимо проверить роль альтернативных промоторов гена apoA-I в нетрадиционных местах синтеза его продукта (плацента, хрящ, нервная система и т.п.).
мРНК аpoA-I, синтезируемые с альтернативных промоторов, содержат дополнительный 5'-концевой участок. Хотя в этой области выявлено несколько кодонов ATG, максимальная протяженность открытой рамки считывания с этих кодонов не превышает 41 аминокислотный остаток. Более того, в окружении этих ATG-кодонов отсутствует выраженная консенсусная последовательность Козак, необходимая для эффективного старта трансляции [32]. Альтернативная транскрипция часто сопряжена с альтернативным сплайсингом. С помощью 3'-RACE нами показано, что обе альтернативные мРНК apoA-I, считываемые с проксимального и дистального промоторов в клетках HepG2, содержат полноразмерную открытую рамку считывания (данные не представлены). Следовательно, белковые продукты, транслируемые с трех изоформ мРНК apoA-I, по-видимому, идентичны. Недавно описана длинная некодирующая антисмысловая РНК, перекрывающаяся с участком экзона 4 гена apoA-I и негативно регулирующая экспрессию трех генов кластера apoA-I – apoA-I, apoC-III и apoA-IV [33]. Влияние этой РНК на дифференциальную активность промоторов гена apoA-I еще предстоит оценить.
В настоящей работе охарактеризованы два новых альтернативных промотора гена apoA-I человека. Существование минимум трех промоторов в 5'-регуляторной области гена apoA-I человека свидетельствует о сложной регуляции экспрессии данного гена. Нами впервые описан механизм конкуренции промоторов гена apoA-I и высказано предположение о роли конкуренции в установлении тканевой специфичности соответствующих промоторов. Более того, обнаруженные нами ранее различия во влиянии провоспалительного цитокина TNFα на промоторы гена apoA-I [26] лучше всего объясняются именно в контексте ослабления конкуренции промоторов под действием TNFα. Полученные нами результаты позволяют предположить, что альтернативные промоторы гена apoA-I могут отвечать за его экспрессию в клетках, отличных от гепатоцитов и энтероцитов.
Работа выполнена при финансовой поддержке Российского научного фонда (№ 17-15-01326).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Gordon D.J., Probstfield J.L., Garrison R.J., Neaton J.D., Castelli W.P., Knoke J.D., Jacobs D.RJ., Bangdiwala S., Tyroler H.A. (1989) High-density lipoprotein cholesterol and cardiovascular disease. Four prospective American studies. Circulation. 79, 8‒15.
Stein O., Stein Y. (1999) Atheroprotective mechanisms of HDL. Atherosclerosis. 144, 85‒301.
Eggerman T.L., Hoeg J.M., Meng M.S., Tombragel A., Bojanovski D., Brewer H.BJ. (1991) Differential tissue-specific expression of human apoA-I and apoA-II. J. Lipid Res. 32, 821–828.
Srivastava R.A., Srivastava N. (2000) High density lipoprotein, apolipoprotein A-I, and coronary artery disease. Mol. Cell. Biochem. 209, 131‒144.
Higuchi K., Law S.W., Hoeg J.M., Schumacher U.K., Meglin N., Brewer H.B.J. (1988) Tissue-specific expression of apolipoprotein A-I (ApoA-I) is regulated by the 5'-flanking region of the human ApoA-I gene. J. Biol. Chem. 263, 18530‒18536.
Sastry K.N., Seedorf U., Karathanasis S.K. (1988) Different cis-acting DNA elements control expression of the human apolipoprotein AI gene in different cell types. Mol. Cell. Biol. 8, 605‒614.
Kardassis D., Laccotripe M., Talianidis I., Zannis V. (1996) Transcriptional regulation of the genes involved in lipoprotein transport. The role of proximal promoters and long-range regulatory elements and factors in apolipoprotein gene regulation. Hypertension. 27, 980‒1008.
Kardassis D., Tzameli I., Hadzopoulou-Cladaras M., Talianidis I., Zannis V. (1997) Distal apolipoprotein C-III regulatory elements F to J act as a general modular enhancer for proximal promoters that contain hormone response elements. Synergism between hepatic nuclear factor-4 molecules bound to the proximal promoter and distal enhancer sites. Arterioscler. Thromb. Vasc. Biol. 17, 222‒232.
Tzameli I., Zannis V.I. (1996) Binding specificity and modulation of the ApoA-I promoter activity by homo- and heterodimers of nuclear receptors. J. Biol. Chem. 271, 8402‒8415.
Harnish D.C., Malik S., Kilbourne E., Costa R., Karathanasis S.K. (1996) Control of apolipoprotein AI gene expression through synergistic interactions between hepatocyte nuclear factors 3 and 4. J. Biol. Chem. 271, 13621‒13628.
Martin C., Duez H., Blanquart C., Berezowski V., Poulain P., Fruchart J.-C., Najib-Fruchart J., Glineur C., Staels B. (2001) Statin-induced inhibition of the Rho-signaling pathway activates PPARalpha and induces HDL apoA-I. J. Clin. Invest. 107, 1423–1432.
Delerive P., Galardi C.M., Bisi J.E., Nicodeme E., Goodwin B. (2004) Identification of liver receptor homolog-1 as a novel regulator of apolipoprotein AI gene transcription. Mol. Endocrinol. 18, 2378‒2387.
Huuskonen J., Vishnu M., Chau P., Fielding P.E., Fielding C.J. (2006) Liver X receptor inhibits the synthesis and secretion of apolipoprotein A1 by human liver-derived cells. Biochemistry. 45, 15068‒15074.
Claudel T., Sturm E., Duez H., Torra I.P., Sirvent A., Kosykh V., Fruchart J., Dallongeville J., Hum D.W., Kuipers F., Staels B. (2002) Bile acid-activated nuclear receptor FXR suppresses apolipoprotein A-I transcription via a negative FXR response element. J. Clin. Invest. 109, 961‒971.
Shavva V.S., Mogilenko D.A., Bogomolova A.M., Nikitin A.A., Dizhe E.B., Efremov A.M., Oleinikova G.N., Perevozchikov A.P., Orlov S.V. (2016) PPARgamma represses apolipoprotein A-I gene but impedes TNFalpha-mediated ApoA-I downregulation in HepG2 cells. J. Cell. Biochem. 117, 2010‒2022.
Kilbourne E.J., Evans M.J., Karathanasis S.K. (1998) E1A represses apolipoprotein AI enhancer activity in liver cells through a pRb- and CBP-independent pathway. Nucl. Acids Res. 26, 1761‒1768.
Shavva V.S., Bogomolova A.M., Nikitin A.A., Dizhe E.B., Tanyanskiy D.A., Efremov A.M., Oleinikova G.N., Perevozchikov A.P., Orlov S.V. (2017) Insulin-mediated downregulation of apolipoprotein A-I gene in human hepatoma cell line HepG2: the role of interaction between FOXO1 and LXRbeta transcription factors. J. Cell. Biochem. 118, 382‒396.
Shavva V.S., Bogomolova A.M., Nikitin A.A., Dizhe E.B., Oleinikova G.N., Lapikov I.A., Tanyanskiy D.A., Perevozchikov A.P., Orlov S.V. (2017) FOXO1 and LXRalpha downregulate the apolipoprotein A-I gene expression during hydrogen peroxide-induced oxidative stress in HepG2 cells. Cell Stress Chaperones. 22, 123‒134.
Kilbourne E.J., Widom R., Harnish D.C., Malik S., Karathanasis S.K. (1995) Involvement of early growth response factor Egr-1 in apolipoprotein AI gene transcription. J. Biol. Chem. 270, 7004‒7010.
Richardson B., Palgunachari M.N., Anantharamaiah G.M., Richards R.G., Azrolan N., Wiginton D., Handwerger S. (1996) Human placental tissue expresses a novel 22.7 kDa apolipoprotein A-I-like protein. Biochemistry. 35, 7580‒7585.
Baroukh N., Lopez C.E., Saleh M.C., Recalde D., Vergnes L., Ostos M.A., Fiette L.J., Fruchart C., Castro G., Zakin M.M., Ochoa A. (2004) Expression and secretion of human apolipoprotein A-I in the heart. FEBS Lett. 557, 39‒44.
Gentili C., Tutolo G., Pianezzi A., Cancedda R., Descalzi C.F. (2005) Cholesterol secretion and homeostasis in chondrocytes: a liver X receptor and retinoid X receptor heterodimer mediates apolipoprotein A1 expression. Matrix Biol. 24, 35‒44.
Воробьев Е.В., Перевозчиков А.П. (1992) Исследование экспрессии гена аполипопротеина A-I на ранних стадиях эмбриогенеза человека методом гибридизации in situ. Онтогенез. 23, 469‒479.
Mogilenko D.A., Orlov S.V., Trulioff A.S., Ivanov A.V., Nagumanov V.K., Kudriavtsev I.V., Shavva V.S., Tanyan-skiy D.A., Perevozchikov A.P. (2012) Endogenous apolipoprotein A-I stabilizes ATP-binding cassette transporter A1 and modulates Toll-like receptor 4 signaling in human macrophages. FASEB J. 26, 2019‒2030.
Shavva V.S., Mogilenko D.A., Nekrasova E.V., Tru-lioff A.S., Kudriavtsev I.V., Larionova E.E., Babina A.V., Dizhe E.B., Missyul B.V., Orlov S.V. (2018) Tumor necrosis factor alpha stimulates endogenous apolipoprotein A-I expression and secretion by human monocytes and macrophages: role of MAP-kinases, NF-kB, and nuclear receptors PPARalpha and LXRs. Mol. Cell. Biochem. 448, 211‒223.
Orlov S.V., Mogilenko D.A., Shavva V.S., Dizhe E.B., Ignatovich I.A., Perevozchikov A.P. (2010) Effect of TNFalpha on activities of different promoters of human apolipoprotein A-I gene. Biochem. Biophys. Res. Commun. 398, 224‒230.
Mogilenko D.A., Kudriavtsev I. V., Trulioff A.S., Shavva V.S., Dizhe E.B., Missyul B.V., Zhakhov A.V., Ischenko A.M., Perevozchikov A.P., Orlov S.V. (2012) Modified low density lipoprotein stimulates complement C3 expression and secretion via liver X receptor and toll-like receptor 4 activation in human macrophages. J. Biol. Chem. 287, 5954‒5968.
Mogilenko D.A., Kudriavtsev I.V., Shavva V.S., Diz-he E.B., Vilenskaya E.G., Efremov A. M., Perevozchikov A.P., Orlov S.V. (2013) Peroxisome proliferator-activated receptor alpha positively regulates complement C3 expression but inhibits TNFalpha-mediated activation of C3 gene in mammalian hepatic derived cells. J. Biol. Chem. 288, 1726‒1738.
Лапиков И.А., Могиленко Д.А., Диже Э.Б., Игнатович И.А., Орлов С.В., Перевозчиков А.П. (2008) Ap1-подобные цис-элементы в 5'-регуляторной области гена аполипопротеина A-I человека. Молекуляр. биология. 42, 295‒305.
Graham F.L., van der Eb A.J. (1973) A new technique for the assay of infectivity of human adenovirus 5 DNA. Virology. 52, 456‒467.
Reisher S.R., Hughes T.E., Ordovas J M., Schaefer E.J., Feinstein S.I. (1993) Increased expression of apolipoprotein genes accompanies differentiation in the intestinal cell line Caco-2. Proc. Natl. Acad. Sci. USA. 90, 5757‒5761.
Kozak M. (1997) Recognition of AUG and alternative initiator codons is augmented by G in position +4 but is not generally affected by the nucleotides in positions +5 and +6. EMBO J. 16, 2482‒2492.
Halley P., Kadakkuzha B.M., Faghihi M. A., Magistri M., Zeier Z., Khorkova O., Coito C., Hsiao J., Lawrence M., Wahlestedt C. (2014) Regulation of the apolipoprotein gene cluster by a long noncoding RNA. Cell Rep. 6, 222‒230.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


