Молекулярная биология, 2019, T. 53, № 3, стр. 502-512
Регуляция экспрессии BRCA1 и эстрогеновых рецепторов α в клетках рака молочной железы
А. М. Щербаков a, Е. А. Шестакова a, *, К. Е. Галеева a, Т. А. Богуш a
a Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
Министерства здравоохранения Российской Федерации
115478 Москва, Россия
* E-mail: elenaanshestakova@mail.ru
Поступила в редакцию 09.11.2018
После доработки 17.01.2019
Принята к публикации 23.01.2019
Аннотация
Белок BRCA1 (breast cancer 1) участвует в поддержании стабильности генома, выполняя свою основную функцию репарации ДНК, главным образом, путем гомологичной рекомбинации. Нарушение этой функции BRCA1 ассоциировано с развитием рака молочной железы (РМЖ), рака яичников. Несмотря на важную роль BRCA1 в репарации повреждений ДНК во всех типах клеток, развитие BRCA1-ассоциированного рака наблюдается, в основном, в эстрогензависимых тканях организма, таких как ткань молочной железы и яичников. В экспериментах in vitro с использованием клеток РМЖ линии MCF-7 продемонстрировано ингибирующее действие эстрогена 17β-эстрадиола (Е2), фитоэстрогенов (генистеина и апигенина) и антиэстрогенов (тамоксифена и фулвестранта) на экспрессию эстрогеновых рецепторов α (ЭРα); при этом только генистеин оказывал влияние на BRCA1, усиливая его экспрессию. В условиях гипоксии, одного из факторов прогрессии сóлидных опухолей, в клетках MCF-7 отмечено уменьшение экспрессии BRCA1 и ЭРα. Следовательно, гипоксия влияет на BRCA1-ассоциированные процессы репарации ДНК и одновременно воздействует на гормональную регуляцию роста клеток РМЖ. Таким образом, продемонстрирована взаимосвязь BRCA1 и сигнальных путей стероидных гормонов в клетках РМЖ и обсуждается целесообразность комплексного изучения механизмов регуляции экспрессии BRCA1 и эстрогеновых рецепторов, включая эпигенетическую регуляцию экспрессии генов.
ВВЕДЕНИЕ
Продукт гена BRCA1 (breast cancer 1), белок BRCA1, участвует в поддержании стабильности генома, выполняя свою основную функцию репарации ДНК путем гомологичной рекомбинации [1–3] и негомологичного соединения концов ДНК [4]. Это белок с молекулярной массой 220 кДа, экспрессия которого регулируется эпигенетическими механизмами [1, 5, 6].
Нарушение функционирования BRCA1 приводит к развитию ряда онкологических заболеваний, в основном, рака молочной железы (РМЖ) и рака яичников. Несмотря на большую роль мутаций в гене BRCA1 в развитии наследственных форм BRCA1-ассоциированных онкологических заболеваний [7, 8], спорадические формы BRCA1-ассоциированного рака, кроме небольшого числа случаев, вызванных соматическими мутациями [9], определяются эпигенетической регуляцией экспрессии BRCA1 [5].
Эпигенетические механизмы регуляции экспрессии BRCA1 детально освещены в обзорах [5, 6]. К настоящему времени известно несколько основных молекулярных механизмов нарушения функции BRCA1: 1) эпигенетическое ингибирование синтеза мРНК и белка BRCA1, происходящее в результате метилирования CpG-островков в промоторе гена BRCA1 [10, 11], 2) изменение экспрессии BRCA1 за счет ковалентных модификаций гистонов в гене BRCA1 [12, 13] и 3) регуляция факторами транскрипции [14]. Также следует упомянуть потерю гетерозиготности, приводящую к полному отсутствию как мРНК, так и белка BRCA1 [15], амплификацию гена BRCA1 [16] и аберрантное увеличение уровня экспрессии BRCA1 [3].
Уменьшение уровня белка BRCA1 при гипоксии, эпителиально-мезенхимальном переходе (ЭМП) сопровождается модификациями гистонов в промоторе гена BRCA1 [12, 13]. Уменьшение экспрессии BRCA1 при гипоксии обусловлено рядом модификаций в гистоне Н3: деметилированием Lys в позиции 4 (Н3K4me), деацетилированием Н3K9ac, сопряженным с метилированием Н3K9 [12]. При ЭМП снижение экспрессии BRCA1 связано с деметилированием H3K4me2 [13].
Несмотря на ключевую роль BRCA1 в репарации повреждений ДНК во всех типах клеток, развитие BRCA1-ассоциированного рака наблюдается в основном в эстрогензависимых тканях организма, таких как ткань молочной железы и яичников. Описанная в литературе взаиморегуляция экспрессии BRCA1 и эстрогенового рецептора α (ЭРα), как на уровне транскрипции, так и на уровне посттрансляционных модификаций белков, проливает свет на возможные причины тканеспецифичности развития BRCA1-ассоциированных онкологических заболеваний. С одной стороны, ген, кодирующий ЭРα, ESR1, служит мишенью коактиватора транскрипции – BRCA1 (рис. 1а). В связи с этим количество транскриптов ЭРα, синтезируемых с гена ESR1, прямо пропорционально количеству немутированного, функционального белка BRCA1. BRCA1 в комплексе с фактором транскрипции Oct-1 активируют транскрипцию гена ESR1 в линиях клеток РМЖ: MCF-7 и T47D (рис. 1а) [17]. С другой стороны, ген BRCA1, будучи мишенью ЭРα, регулируется ЭРα в ассоциации с фактором транскрипции AP1 (с-Jun/с-Fos) и коактиваторами – ацетилтрансферазами гистонов (CBP/p300) (рис. 1б) [18–20]. В результате в опухолях молочной железы с уменьшенным содержанием белка BRCA1, как правило, снижено содержание белка ЭРα [17]. Таким образом, нарушение функционирования белка BRCA1 в результате эпигенетического ингибирования гена BRCA1 приводит к обращению статуса ЭРα в опухоли с положительного на отрицательный и к развитию BRCA1-зависимых ЭРα-негативных опухолей, не поддающихся лечению таргетной, антиэстрогеновой, терапией.
Рис. 1.
Взаиморегуляция экспрессии BRCA1 и ЭРα. а – Ген ESR1, кодирующий ЭРα, – мишень коактиватора транскрипции BRCA1. BRCA1 и фактор транскрипции Oct-1 активируют транскрипцию гена ESR1. б – Ген BRCA1 – мишень ЭРα и регулируется активированным эстрогеном ЭРα совместно с фактором транскрипции AP-1 (c-Jun/с-Fos) и коактиватором транскрипции – ацетилтрансферазой гистонов CBP/p300.
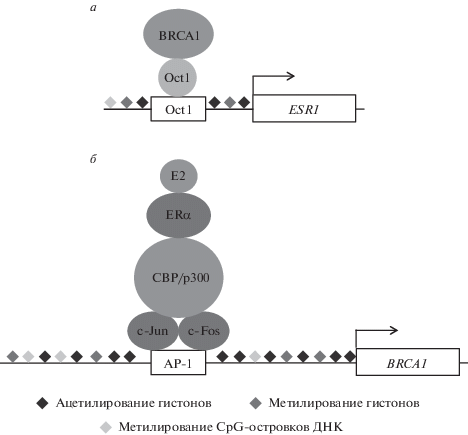
Помимо регуляции на уровне генов BRCA1 ингибирует активность ЭРα за счет белок-белковых взаимодействий – в результате BRCA1-зависимого убиквитинирования рецептора и ингибирования его ацетилирования [21], что приводит к нарушению регуляции генов, зависимых от ЭРα. Одна из мишеней ЭРα – ген прогестеронового рецептора (ПР), нарушение уровня экспрессии которого приводит к развитию некоторых подтипов РМЖ [22–24]. Более того, ген ESR1 – мишень своего продукта, ЭРα, а также ЭРβ [25]. Следует отметить, что Oct-1 и ЭРβ, регулирующие ген ESR1, имеют похожую структуру, так как узнаются моноклональным антителом 14С8, широко используемым для детектирования ЭРβ в ткани опухоли и в культурах клеток [26].
Среди лигандов, связывающихся и влияющих на активность ЭРα, выделяют эстрогены, в большинстве случаев активирующие ЭРα, такие как 17β-эстрадиол (Е2) и фитоэстроген генистеин, и антиэстрогены, ингибирующие ЭРα, такие как тамоксифен и фулвестрант.
В ряде последних исследований продемонстрирована прогностическая и предиктивная значимость BRCA1, а также другого белка репарации ДНК – ERCC1 [5, 6, 27]. При анализе уровней экспрессии BRCA1 в ЭР-негативных и ЭР-позитивных опухолях Богуш и др. [28] выявили, что пониженный уровень экспрессии BRCA1 может быть прогностическим маркером неблагоприятного течения РМЖ. В этом исследовании для точной количественной оценки уровня экспрессии белка BRCA1 в ткани РМЖ нами был применен метод иммунофлуоресцентного анализа, ассоциированного с проточной цитофлуориметрией (ИФ-ПЦФ). Этот метод был усовершенствован и широко применялся в нашей лаборатории для количественной оценки уровня экспрессии белковых онкомаркеров, включая рецепторы эстрогенов, маркер репарации ДНК, ERCC1, маркеры множественной лекарственной резистентности [29–31].
Теперь нами исследовано влияние (фито)эстрогенов и антиэстрогенов на экспрессию BRCA1 и ЭРα в клетках РМЖ линии MCF-7 и определена экспрессия этих белков в условиях гипоксии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клетки. Клетки MCF-7, полученные из Американской коллекции типовых культур (American Type Culture Collection, США), до проведения экспериментов хранили в криобанке Национального медицинского исследовательского центра онкологии им. Н.Н. Блохина. Идентичность и стабильность линий подтверждали с помощью анализа коротких тандемных повторов (“GORDIZ”, Россия). Клетки культивировали в среде DMEM, содержащей 10% эмбриональной сыворотки телят (“HyClone”, CША), 50 ед./мл гентамицина (“ПанЭко”, Россия) и 0.1 мг/мл пирувата натрия (“Santa Cruz”, США) при 37°С, 5% СО2 и относительной влажности 80–85%. Во всех экспериментах использовали клетки в логарифмической фазе роста.
Анализ экспрессии ЭРα и BRCA1 в клетках MCF-7. В экспериментах по влиянию эстрогенов и антиэстрогенов на экспрессию ЭРα и BRCA1 клетки РМЖ линии MCF-7 культивировали в среде DMEM без фенолового красного с добавлением сыворотки телят без стероидов (SH30068/03, “HyClone”, США). Инкубацию клеток с эстрогенами и антиэстрогенами проводили в течение 24 ч. В экспериментах использовали 10-нМ 17β-эстрадиол (Е2; Cat. # E2758; “Sigma-Aldrich”), 5-мкМ тамоксифен (Cat. # 13258; “Cayman Chemical”, США), 0.1-мкМ фулвестрант, генистеин (концентрация 0.5, 10, 15, 20 и 30 мкМ) и апигенин (концентрация 15 мкМ и 30 мкМ). Суспензии клеток инкубировали с первичными мышиными моноклональными антителами (АТ) к BRCA1 (0.006 мкг/мл; Cat.# SD118, “Calbiochem”) или первичными мышиными моноклональными АТ к ЭРα (0.008 мкг/мл или 0.032 мкг/мл; Cat. # ab27614, клон SP-1, “Abcam”) в течение 15–20 ч и с соответствующими вторичными флуоресцентными АТ (DyLight650, Cat. # ab98729 и Cat. # ab98510; “Abcam”) в течение 1.5 ч. Флуоресценцию клеток измеряли с помощью проточного цитофлуориметра Navios (“Beckman Coulter”, США).
В экспериментах по влиянию гипоксии на экспрессию маркеров клетки инкубировали в среде DMEM, содержащей 10% сыворотки телят, в течение 24, 96, 144 или 240 ч в атмосфере, содержащей 1% О2.
В экспериментах по влиянию на экспрессию маркеров тирапазамина (TPZ) – соединения, активируемого в условиях гипоксии и вызывающего двухцепочечные разрывы в молекуле ДНК, – клетки инкубировали в условиях гипоксии в течение 72 ч, а затем в присутствии 5 или 10 мкМ TPZ в условиях гипоксии в течение 24 ч. В качестве контроля использовали клетки, которые инкубировали в нормальных условиях с теми же концентрациями TPZ и в течение того же времени. Уровни экспрессии маркеров в клетках определяли методом ИФ-ПЦФ, как указано выше.
Обработка результатов. Показатели экспрессии BRCA1 и ЭРα получены с помощью программы FlowJo 10.0 (https://www.flowjo.com) с использованием статистического метода Колмогорова-Смирнова [32]. Экспрессию маркеров оценивали по следующим показателям: 1) уровень (L, level) определяли как процентное содержание специфически флуоресцирующих клеток относительно показателя в контроле (инкубация со вторичными антителами); 2) интенсивность (I, intensity) – как отношение специфической флуоресценции клеток в опытном образце к контролю; 3) индекс (Pr, product) – как произведение уровня и интенсивности экспрессии маркера, деленное на 100.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние фитоэстрогенов на экспрессию BRCA1 и ЭРα
Изучение влияния фитоэстрогенов (генистеина и апигенина) на экспрессию BRCA1 и ЭРα проведено в культуре клеток линии MCF-7 гормонозависимого РМЖ. Экспрессию белка BRCA1 анализировали в условиях, при которых происходят изменения в экспрессии генов и эпигенетические модификации хроматина (гистоновых белков и ДНК). К таким условиям относится индуцируемая фитоэстрогенами активация гена BRCA1 [33–35].
Продемонстрировано зависимое от дозы фитоэстрогена генистеина изменение экспрессии BRCA1 и ЭРα. При воздействии генистеина в низкой концентрации (0.5 мкМ) наблюдалось увеличение индекса экспрессии BRCA1 в 1.7 раза (табл. 1). При более высокой концентрации генистеина (10 мкМ) индекс экспрессии BRCA1 повышался в 1.3 раза, а увеличение концентрации генистеина до 20 мкМ не изменяло исходный индекс экспрессии BRCA1.
Таблица 1.
Влияние эстрогенов и антиэстрогенов на экспрессию BRCA1 и ЭРα в клетках РМЖ линии MCF-7
| Соединение, концентрация | Изменение показателя экспрессии маркера* | |||||
|---|---|---|---|---|---|---|
| BRCA1 | ЭРα | |||||
| L | I | Pr | L | I | Pr | |
| Генистеин, мкМ | ||||||
| 0.5 | 1.2↑ | 1.4↑ | 1.7↑ | 1.2↓ | 2.4↓ | 2.9↓ |
| 10.0 | 1.1↑ | 1.2↑ | 1.3↑ | 1.3↓ | 3.0↓ | 3.9↓ |
| 20.0 | 1.0 | 1.0 | 1.0 | 1.3↓ | 3.1↓ | 4.0↓ |
| Апигенин, мкМ | ||||||
| 15.0 | 1.1↓ | 1.1↓ | 1.2↓ | 1.6↓ | 2.9↓ | 4.6↓ |
| Тамоксифен, мкМ | ||||||
| 5.0 | 1.0 | 1.1↑ | 1.1↑ | 1.0 | 1.2↓ | 1.2↓ |
| 17β-Эстрадиол, нМ | ||||||
| 10.0 | 1.0 | 1.1↑ | 1.1↑ | 1.1↓ | 3.7↓ | 4.1↓ |
| Фулвестрант, мкМ | ||||||
| 0.1 | 1.1↓ | 1.0 | 1.1↓ | 1.2↓ | 4.5↓ | 5.4↓ |
В отношении экспрессии ЭРα (табл. 1) эффект генистеина был противоположным. В ряду концентраций фитоэстрогена 0.5 → 10 → 20 мкМ отмечено уменьшение индекса экспрессии ЭРα в 2.9, 3.9 и 4.0 раза соответственно, то есть влияние генистеина было максимальным при концентрации 20 мкМ. Таким образом, результат воздействия генистеина на экспрессию ЭРα противоположен по направленности и более выражен, чем на BRCA1.
Важно заметить и качественные различия воздействия генистеина на индекс экспрессии BRCA1 и ЭРα. Как упоминалось выше, это интегральный показатель экспрессии маркеров, который включает процентное содержание клеток, экспрессирующих маркер, и его количество в каждой клетке. К снижению индекса экспрессии ЭРα привело изменение интенсивности и в меньшей степени уровня маркера. При исследовании BRCA1 выявлено воздействие фитоэстрогена на оба показателя. Иными словами, генистеин индуцировал повышенную экспрессию белка не только в BRCA1-позитивных клетках, но и в исходно BRCA1-негативных. Это наблюдение согласуется с ранее опубликованными результатами, полученными методом иммуноблоттинга, по активации экспрессии BRCA1 под влиянием генистеина в низких концентрациях [33]. Как видно из данных, представленных табл. 1, апигенин (фитоэстроген из класса флавонов) не вызывал изменений в экспрессии BRCA1, но значимо снижал экспрессию ЭРα. Инкубация клеток с апигенином в концентрации 15 мкМ приводила к уменьшению индекса экспрессии ЭРα в 4.6 раза; при увеличении концентрации апигенина до 30 мкМ изменений индекса экспрессии ЭРα не было.
На основании полученных результатов можно предполагать, что механизмы воздействия двух фитоэстрогенов на экспрессию BRCA1 различны, так как генистеин усиливал экспрессию BRCA1, а апигенин не влиял на нее. При воздействии как генистеина, так и апигенина отмечено значительное снижение экспрессии ЭРα.
На основании как литературных данных последних лет, так и результатов наших исследований, можно сделать вывод, что фитоэстрогены проявляют высокую цитотоксическую активность в отношении клеток РМЖ [36–38]. Так, фитоэстроген генистеин оказывает цитотоксическое действие на клетки РМЖ различных молекулярных подтипов и рассматривается как перспективный цитостатический и проапоптотический агент [36, 37]. В настоящее время активно обсуждается применение генистеина в комплексной терапии рака [39]. В исследовательских центрах по всему миру проходят клинические испытания этого фитоэстрогена в качестве перспективного противоопухолевого препарата, а также как средства для поддерживающей терапии (номера исследований в базе www.clinicaltrials.gov: NCT01126879, NCT02336087, NCT00078923, NCT00276835).
Теперь нами выявлено, что воздействие генистеина на клетки гормонозависимого РМЖ отчасти реализуется через усиление экспрессии опухолевого супрессора BRCA1.
Влияние эстрогенов и антиэстрогенов на экспрессию BRCA1 и ЭРα
Изучение влияния эстрогена 17β-эстрадиола (Е2), а также антиэстрогенов, тамоксифена и фулвестранта, на экспрессию BRCA1 и ЭРα проведено на той же культуре клеток MCF-7 гормонозависимого РМЖ. Экспрессию BRCA1 анализировали в условиях, сопровождающихся активацией или ингибированием ЭРα.
Как представлено в табл. 1, антиэстроген тамоксифен незначительно влиял на показатели экспрессии ЭРα и BRCA1. При инкубации клеток с Е2 или с фулвестрантом – необратимым ингибитором ЭРα, вызывающим деградацию рецептора, – не выявлено существенных изменений уровня, интенсивности и индекса экспрессии BRCA1 по сравнению с контролем (табл. 1, рис. 2).
Рис. 2.
Воздействие эстрогена 17β-эстрадиола (Е2), антиэстрогенов тамоксифена (Там) и фулвестранта (Фулв) на экспрессию BRCA1 и ЭРα в клетках MCF-7. E2, тамоксифен и фулвестрант не влияли на экспрессию BRCA1, в то время как E2 и фулвестрант значимо снижали экспрессию ЭРα.

Напротив, показатели экспрессии ЭРα в этих условиях значительно снизились. При инкубации с Е2 интенсивность и индекс экспрессии ЭРα снизились соответственно в 3.7 и 4.1 раза, а под действием фулвестранта – в 4.5 и 5.4 раз. Необходимо отметить, что в обоих случаях снижение индекса экспрессии ЭРα происходило в результате уменьшения интенсивности экспрессии ЭРα; при этом уровень экспрессии маркера уменьшался незначительно (табл. 1). Иными словами, инкубация с эстрогеном или необратимым ингибитором ЭРα не изменяет количества клеток, экспрессирующих ЭРα, но приводит к выраженному уменьшению внутриклеточного содержания маркера.
Таким образом, E2 и антиэстрогены, фулвестрант и тамоксифен, не оказывали влияния на уровень экспрессии BRCA1, определенный методом ИФ-ПЦФ, в клетках линии MCF-7. Что касается ЭРα, то E2 и фулвестрант значительно снижали его экспрессию, в то время как тамоксифен, вызывающий стабилизацию неактивного ЭРα в цитоплазме, почти не влиял на показатели экспрессии этого маркера.
Влияние гипоксии на экспрессию BRCA1 и ЭРα
Прогрессия сóлидных новообразований сопровождается, как правило, постепенным снижением оксигенации опухолевой ткани, или гипоксией. Согласно данным литературы, рост сóлидных опухолей в условиях гипоксии характеризуется изменениями метаболизма клеток, а также их пониженной чувствительностью к радио- и химиотерапии [40–43]. При исследовании влияния гипоксии на экспрессию BRCA1 и ЭРα нами выявлено, что при переводе клеток MCF-7 в условия гипоксии (1% О2), то есть при понижении концентрации кислорода с 21 до 1%, снижение показателей экспрессии BRCA1 зависело от времени инкубации (табл. 2). Так, по сравнению с контрольными клетками MCF-7 (нормоксия) в помещенных в условия гипоксии клетках уже через 24 ч уровень экспрессии снижался в 1.3 раза, а индекс в 1.6 раза. С увеличением времени инкубации происходило уменьшение этих показателей: через 96 ч индекс экспрессии BRCA1 снижался в 1.7 раз, через 144 ч – в 1.8 раз и через 240 ч – в 2.1 раза.
Таблица 2.
Экспрессия BRCA1 и ЭРα в клетках MCF-7 в условиях гипоксии
| Время*, ч | Изменение показателей экспрессии (относительно контроля) | |||||
|---|---|---|---|---|---|---|
| BRCA1 | ЭРα | |||||
| L | I | Pr | L | I | Pr | |
| 24 | 1.3↓ | 1.2↓ | 1.6↓ | 1.1↓ | 1.3↓ | 1.4↓ |
| 96 | 1.4↓ | 1.2↓ | 1.7↓ | 1.0 | 1.0 | 1.0 |
| 144 | 1.5↓ | 1.2↓ | 1.8↓ | 1.1↓ | 1.2↓ | 1.3↓ |
| 240 | 1.9↓ | 1.1↓ | 2.1↓ | 1.5↓ | 2.1↓ | 3.2↓ |
В условиях гипоксии также наблюдалось уменьшение интенсивности и индекса экспрессии ЭPα по сравнению с контрольными клетками. Так, при инкубации клеток в течение 240 ч этот интегральный показатель снижался в 3.2 раза (табл. 2). Обобщая сказанное, следует отметить, что уменьшение индекса экспрессии BRCA1 в условиях гипоксии, в основном, было вызвано снижением уровня маркера (то есть, количества клеток, экспрессирующих маркер), а не интенсивности экспрессии, которая оставалась приблизительно одинаковой при увеличении длительности гипоксических условий (табл. 2). В случае ЭPα уменьшение индекса экспрессии в условиях гипоксии было связано с понижением как уровня маркера, так и интенсивности экспрессии (табл. 2). Такое влияние гипоксии на экспрессию BRCA1 принципиально отличается от эффекта фитоэстрогена генистеина на экспрессию этого маркера: в условиях гипоксии выявлена тенденция к уменьшению экспрессии BRCA1, в основном, за счет снижения уровня экспрессии BRCA1, а при воздействии фитоэстрогена генистеина наблюдалось увеличение экспрессии BRCA1, в основном, за счет повышения интенсивности экспрессии. Другими словами, в условиях гипоксии снижение экспрессии BRCA1 вызвано, в значительной мере, уменьшением количества клеток, экспрессирующих маркер, а при воздействии фитоэстрогена генистеина повышение экспрессии BRCA1, в основном, обусловлено увеличением количества маркера в уже экспрессирующих его клетках.
TPZ – цитотоксин, селективно активируемый ферментами в клетках при снижении уровня кислорода (гипоксии). TPZ вызывает двухцепочечные разрывы в молекуле ДНК и последующий апоптоз в условиях гипоксии. Это соединение считается кандидатом в лекарственные средства для терапии ряда сóлидных новообразований [44]. Инкубация клеток с TPZ в условиях нормоксии не вызывала существенных изменений индекса экспрессии BRCA1 (табл. 3). Однако TPZ в концентрации 5 мкМ влиял на экспрессию ЭРα в условиях нормоксии – индекс возрос в 1.4 раза. Инкубация клеток с 5 мкМ TPZ в гипоксических условиях не приводила к существенным изменениям в индексе экспрессии ЭPα и BRCA1. Увеличение концентрации TPZ до 10 мкМ приводило к повышению индекса экспрессии BRCA1 в 1.5 раза с одновременным снижением индекса экспрессии ЭPα в 4.1 раза (табл. 3). Возрастание индекса экспрессии BRCA1 в основном обусловлено увеличением уровня экспрессии BRCA1, а не интенсивности экспрессии маркера. Это значит, что повышение экспрессии BRCA1 под действием TPZ обусловлено, в основном, увеличением числа новых клеток, экспрессирующих BRCA1. Таким образом, появление двухцепочечных разрывов в ДНК в условиях гипоксии приводит не только к транслокации BRCA1 в места повреждений ДНК [3], но и к увеличению количества клеток, экспрессирующих этот белок репарации ДНК.
Таблица 3.
Экспрессия BRCA1 и ЭРα в клетках MCF-7 при воздействия TPZ
| Условия | [TPZ], мкМ | Изменение показателя экспрессии (относительно контроля)* | |||||
|---|---|---|---|---|---|---|---|
| BRCA1 | ЭРα | ||||||
| L | I | Pr | L | I | Pr | ||
| Нормоксия | 5 | 1.2↓ | 1.1↓ | 1.3↓ | 1.3↑ | 1.1↑ | 1.4↑ |
| 10 | 1.1↓ | 1.1↓ | 1.2↓ | 1.2↑ | 1.0 | 1.2↑ | |
| Гипоксия | 5 | 1.2↑ | 1.0 | 1.2↑ | 1.1↓ | 1.1↓ | 1.2↓ |
| 10 | 1.4↑ | 1.1↑ | 1.5↑ | 2.7↓ | 1.5↓ | 4.1↓ | |
В случае ЭPα уменьшение индекса экспрессии, в основном, обусловлено снижением уровня и, в меньшей степени, интенсивности экспрессии. Следовательно, при инкубации с TPZ уменьшение экспрессии ЭPα происходит, главным образом, за счет уменьшения числа клеток, его экспрессирующих (табл. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В проведенных экспериментах in vitro выявлены некоторые особенности регуляции экспрессии белков BRCA1 и ЭРα в клетках РМЖ линии MCF-7. Обнаружено, что два исследованных фитоэстрогена, генистеин и апигенин, по-разному влияли на экспрессию BRCA1 и ЭРα: первый вызывал усиление экспрессии BRCA1 и снижение ЭРα, в то время как второй снижал экспрессию ЭРα, но не влиял на BRCA1.
Эстроген 17β-эстрадиол (E2) и антиэстроген фулвестрант снижали экспрессию ЭРα, но не влияли на BRCA1. Согласно литературным данным [45, 46], E2 индуцирует снижение уровня ЭРα, одновременно усиливая экспрессию белков, гены которых служат мишенями ЭPα: прогестеронового рецептора, pS2, GREB1 и SDF1. При рассмотрении механизма действия Е2 следует отметить, что ЭРα, как и многие другие факторы транскрипции, подвергается ассоциированному с транскрипцией генов-мишеней протеолизу [47]. Известно, что Е2 вызывает Src-зависимое фосфорилирование ЭРα по Tyr537, это приводит к ассоциации ЭРα с коактиватором Е6-АР, активации генов-мишеней ЭРα, убиквитинированию ЭРα на промоторах генов pS2 и GREB1 в результате действия Е6-АР с убиквитинлигазной активностью и последующей протеасомной деградации ЭРα [47]. Ранее показано, что Е2 активирует убиквитинирование ЭРα и его протеасомную деградацию [48], а протеасомные ингибиторы индуцируют повышение уровня ЭРα, но при этом нарушают транскрипцию ряда его генов-мишеней [49]. Кроме того, деубиквитиназа OTUB1 деубиквитинирует ЭРα и понижает его транскрипционную активность [50]. Таким образом, убиквитинирование ЭРα необходимо для эффективной транскрипции генов-мишеней и в тоже время приводит к его последующей деградации. В связи с этим неудивительно, что в эстроген-негативных опухолях регистрируют высокие уровни мРНК ЭРα, но не транслируемого белка [51]. По-видимому, причина этого кроется в сопряженном с транскрипцией генов-мишеней убиквитинировании ЭРα и его последующей протеасомной деградации [47].
Следует также отметить, что лиганды, влияющие на экспрессию генов с участием эпигенетических механизмов, включая модификации гистонов, не всегда приводят к пропорциональному изменению синтеза соответствующих мРНК и белков. Такое несоответствие уровней мРНК и белка может быть связано с регуляцией на уровне трансляции мРНК под влияние различных факторов, например, при нарушении клеточного метаболизма, в процессе развития или клеточной транформации [52, 53]. Регуляцией экспрессии гена BRCA1 на уровне трансляции кодируемой им мРНК, по-видимому, можно объяснить зарегистрированные нами изменения в синтезе белка ВRCA1 (приблизительно в 2 раза) при воздействии фитоэстрогенов и под влиянием гипоксии. По литературным данным, в некоторых случаях синтез мРНК увеличивается значительно сильнее, чем синтез белка, например, при воздействии Е2 на синтез мРНК и белка BRCA1 в клетках РМЖ линии MCF-7 [54]. Иногда эффект того или иного соединения можно зарегистрировать только на уровне мРНК и не обнаружить на уровне белка – как при воздействии фитоэстрогена ресвератрола на экспрессию того же гена BRCA1 [55]. По-видимому, в этих случаях действуют молекулярные механизмы, ингибирующие синтез белка на той или иной стадии трансляции (РНК-интерференция, ингибирование инициации и элонгации трансляции) и/или приводящие к его посттрансляционной модификации и деградации. Такая система представляет большой интерес в плане исследования непосредственного эффекта модификаций гистонов на изменение синтеза мРНК BRCA1, вне зависимости от количества конечного продукта – белка BRCA1.
Dagdemir и др. [34] изучали изменения в модификациях гистонов, локализующихся в области промоторов генов BRCA1 и ESR1 (кодирует ЭРα), при действии фитоэстрогенов и эстрогенов. Используя метод иммунопреципитации хроматина, авторы обнаружили, что при воздействии генистеина, дэдзеина, эквола или Е2 на промоторах генов BRCA1 и ESR1 снижен уровень модификаций гистона Н3: H3K9me3 и H3K27me3, – ингибирующих транскрипцию, и увеличен уровень активирующих транскрипцию модификаций: H3K4ac и H4K8ac. Однако вне поля зрения авторов остались другие модификации гистонов, важные при регуляции генов, активируемых Е2-ЭРα (ген pS2), такие как Н3K14ac, Н3K18ac, Н3K23ac и Н3R17me [56]. Несмотря недостаточную изученность этой проблемы, можно предположить, что, по аналогии с промотором гена pS2 в клетках MCF-7 РМЖ, в случае BRCA1 (другого гена, активируемого Е2-ЭРα) справедлива та же E2-зависимая активация промотора с участием ацетилтрансферазы гистонов CBP и Arg-специфичной метилтрансферазы гистонов CARM1 [56]. Более детально это выглядит так: под действием Е2 гистоны H3, находящиеся на промоторе гена BRCA1, ацетилируются вначале по Lys18 (Н3K18ac), затем по Lys23 (Н3K23ac) и, наконец, метилируются по Arg17 (Н3R17me); при этом Lys14 может быть ацетилирован как в присутствии, так и в отсутствие Е2-воздействия (Н3K14ac) [56].
Обобщая сказанное, можно предложить несколько возможных механизмов наблюдаемой нами регуляции экспрессии BRCA1 и ЭРα фитоэстрогенами. С одной стороны, фитоэстроген генистеин может активировать ЭРα, что приводит к формированию комплекса с ацетилтрансферазой гистонов CBP/p300, ацетилированию гистонов в области промотора гена BRCA1 и к усилению синтеза мРНК и белка BRCA1. С другой стороны, генистеин, как ингибитор метилтрансфераз ДНК [57, 58], может снижать уровень гиперметилирования ДНК в промоторе BRCA1 и тем самым индуцировать усиление транскрипции мРНК BRCA1 и повышение уровня транслируемого с нее белка.
В результате проведенного нами исследования по воздействию гипоксии на экспрессию BRCA1 и ЭРα в клетках MCF-7 выявлена тенденция к снижению экспрессии этих двух белков. Гипоксический цитотоксин TPZ не оказывал значительного влияния на индекс экспрессии BRCA1 в условиях нормоксии. В условиях гипоксии обнаружено повышение экспрессии BRCA1 под воздействием TPZ, который, активизируясь до цитотоксического радикала при снижении уровня кислорода, вызывает двухцепочечные разрывы ДНК. Это новые механизмы ответа злокачественных клеток на действие гипоксических цитотоксинов. Антиэстрогеновые эффекты TPZ в клетках РМЖ, обнаруженные при гипоксии, представляют большой интерес для дальнейших исследований. Нельзя исключить, что гипоксия влияет на BRCA1-ассоциированные процессы репарации ДНК и одновременно воздействует на гормональную регуляцию роста клеток РМЖ.
На основании полученных результатов по воздействию таких биологически активных соединений, как фитоэстрогены, эстрогены, антиэстрогены, на экспрессию BRCA1 и ЭРα в клетках РМЖ можно сделать вывод, что изменения интегрального показателя экспрессии, индекса, происходили, в основном, за счет изменений интенсивности, а не уровня экспрессии целевого белка. В условиях же гипоксии и под действием гипоксического цитотоксина TPZ, напротив, изменения индексов экспрессии BRCA1 и ЭРα обусловлены в большей степени изменениями уровней, а не интенсивности их экспрессии. Иными словами, при воздействии фитоэстрогенов, эстрогенов и антиэстрогенов число клеток, экспрессирующих эти опухолевые маркеры, остается почти неизменным, но изменяется количество маркеров в уже экспрессирующих их клетках; и, напротив, при воздействии гипоксии и гипоксического цитотоксина TPZ изменяется число клеток, экспрессирующих BRCA1 или ЭРα, и почти не меняется количество маркеров в уже экспрессирующих их клетках. В целом, в результате проведенного исследования выявлена координированная взаимосвязь BRCA1-ассоциированной репарации ДНК и сигнальных путей стероидных гормонов. Кроме того, показано, что в условиях гипоксии в клетках РМЖ одновременно снижаются гормональная зависимость пролиферации и роста клеток и экспрессия ключевого опухолевого супрессора BRCA1. В дальнейших исследованиях планируется установить роль этих молекулярных механизмов в формировании химиорезистентности опухолей со значительными гипоксическими регионами.
В заключение следует сказать, что полученные результаты послужат основой для последующего комплексного исследования молекулярных путей регуляции экспрессии маркера репарации ДНК, BRCA1, и маркера пролиферации, ЭРα, в том числе эпигенетической регуляции экспрессии их генов.
Исследование поддержано грантом РФФИ 18-29-09017 (эксперименты с клеточными культурами).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Clark S., Rodriguez A.M., Snyder R.R., Hankins G.D.V., Boehning D. (2012) Structure-function of the tumor suppressor BRCA1. Comput. Struct. Biotechnol. J. 1, 1–8. pii: e201204005
Silver D.P., Dimitrov S.D., Feunteun J., Gelman R., Drapkin R., Lu S.D., Shestakova E., Soundarapandian V., DeNunzio N., Dragomir S., Mar J., Liu X., Rottenberg S., Jonkers J., Ganesan S., Livingston D.M. (2007) Further evidence for BRCA1 communication with the inactive X chromosome. Cell. 128, 991–1002.
Hu Y., Scully R., Sobhian B., Xie A., Shestakova E., Livingston D.M. (2011) RAP80-directed tuning of BRCA1 homologous recombination function at ionizing radiation-induced nuclear foci. Genes Dev. 25, 685–700.
Saha J., Davis A.J. Unsolved mystery: the role of BRCA1 in DNA end-joining. (2016) J. Radiat. Res. 57, Suppl. 1, i18–i24.
Shestakova E.A. (2016) Epigenetic regulation of BRCA1 expression and its role in breast cancer stem cell development. Turk. J. Biol. 40, 981–989.
Богуш Т.А., Шестакова Е.А., Вихлянцева Н.О., Богуш Е.А., Чемерис Г.Ю., Давыдов М.М. (2017) Эпигенетические механизмы регуляции BRCA1. Онкогинекология. 22(2), 4–11.
Sokolenko A.P., Imyanitov E.N. (2017) Molecular tests for the choice of cancer therapy. Curr. Pharm. Des. 23, 4794–4806.
Iyevleva A.G., Imyanitov E.N. (2016) Cytotoxic and targeted therapy for hereditary cancers. Hered. Cancer Clin. Pract. 14, 17.
Hosking L., Trowsdale J., Nicolai H., Solomon E., Foulkes W., Stamp G., Signer E., Jeffreys A. (1995) A somatic BRCA1 mutation in an ovarian tumour. Nat. Genet. 9, 343–344.
Esteller M., Silva J.M., Dominguez G., Bonilla F., Matias-Guiu X., Lerma E., Bussaglia E., Prat J., Harkes I.C., Repasky E.A., Gabrielson E., Schutte M., Baylin S.B., Herman J.G. (2000) Promoter hypermethylation and BRCA1 inactivation in sporadic breast and ovarian tumors. J. Natl. Cancer Inst. 92, 564–569.
Esteller M. (2006) CpG island methylation and histone modifications: biology and clinical significance. In: Ernst Schering Research Foundation Workshop. The Histone Code and Beyond. New Approaches to Cancer The-rapy, vol. 57. Eds Berger S.L., Nakanishi O., Haendler B. Springer, pp. 115–126.
Lu Y., Chu A., Turker M.S., Glazer P.M. (2011) Hypoxia-induced epigenetic regulation and silencing of the BRCA1 promoter. Mol. Cell. Biol. 31, 3339–3350.
Wu Z.Q., Li X.Y., Hu C.Y., Ford M., Kleer C.G., Weiss S.J. (2012) Canonical Wnt signaling regulates Slug activity and links epithelial-mesenchymal transition with epigenetic Breast Cancer 1, Early Onset (BRCA1) repression. Proc. Natl. Acad. Sci. USA. 109, 16654–16659.
McCoy M.L., Mueller C.R., Roskelley C.D. (2003) The role of the breast cancer susceptibility gene 1 (BRCA1) in sporadic epithelial ovarian cancer. Reprod. Biol. Endocrinol. 1, 72.
Russel P.A., Pharoah P.D., De Foy K., Ramus S.J., Symmonds I., Wilson A., Scott I., Ponder B.A., Gayther S.A. (2000) Frequent loss of BRCA1 mRNA and protein expression in sporadic ovarian cancers. Int. J. Cancer. 87, 317–321.
Ribeiro I.P., Marques F., Caramelo F., Pereira J., Patricio M., Prazeres H., Ferrao J., Juliao M.J., Castelo-Branco M., de Melo J.B., Baptista IP, Carreira IM. (2014) Genetic gains and losses in oral squamous cell carcinoma: impact on clinical management. Cell Oncol. (Dordr.). 37, 29–39.
Hosey A.M., Gorski J.J., Murray M.M., Quinn J.E., Chung W.Y., Stewart G.E., James C.R., Farragher S.M., Mulligan J.M., Scott A.N., Dervan P.A., Johnston P.G., Couch F.J., Daly P.A., Kay E., McCann A., Mullan P.B., Harkin D.P. (2007) Molecular basis for estrogen receptor alpha deficiency in BRCA1-linked breast cancer. J. Natl. Cancer Inst. 99, 1683–1694.
Jeffy B.D., Hockings J.K., Kemp M.Q., Morgan S.S., Hager J.A., Beliakoff J., Whitesell L.J., Bowden G.T., Romagnolo D.F. (2005) An estrogen receptor-αp300 complex activates the BRCA-1 promoter at an AP-1 site that binds Jun/Fos transcription factors: repressive effects of p53 on BRCA-1 transcription. Neoplasia. 7, 873–882.
Di L.J., Fernandez A.G., De Siervi A., Longo D.L., Gardner K. (2010) Transcriptional regulation of BRCA1 expression by a metabolic switch. Nat. Struct. Mol. Biol. 17, 1406–1413.
Suba Z. (2015) DNA stabilization by the upregulation of estrogen signaling in BRCA gene mutation carriers. Drug Des. Dev. Ther. 9, 2663–2675.
Ma Y., Fan S., Hu C., Meng Q., Fuqua S.A., Pestell R.G., Tomita Y.A., Rosen E.M. (2010) BRCA1 regulates acetylation and ubiquitination of estrogen receptor-alpha. Mol. Endocrinol. 24, 76–90.
Petz L.N., Ziegler Y.S., Loven M.A., Nardulli A.M. (2002) Estrogen receptor alpha and activating protein-1 mediate estrogen responsiveness of the progesterone receptor gene in MCF-7 breast cancer cells. Endocrinology. 143, 4583–4591.
Schultz J.R., Petz L.N., Nardulli A.M. (2003) Estrogen receptor alpha and Sp1 regulate progesterone receptor gene expression. Mol. Cell. Endocrinol. 201, 165–175.
Petz L.N., Ziegler Y.S., Schultz J.R., Kim H., Kemper J.K., Nardulli A.M. (2004) Differential regulation of the human progesterone receptor gene through an estrogen response element half site and Sp1 sites. J. Steroid Biochem. Mol. Biol. 88, 113–122.
Donaghue C., Westley B.R., May F.E.B. (1999) Selective promoter usage of the human estrogen receptor-alpha gene and its regulation by estrogen. Mol. Endocrinol. 13, 1934–1950.
Andersson C., Sundberg M., Pristovsek N., Ibrahim A., Jonsson P., Katona B., Clausson C.M., Zieba A., Ramstrom M., Soderberg Williams C, Asplund A. (2017) Insufficient antibody validation challenges oestrogen receptor beta research. Nat. Commun. 8, 15840.
Богуш Т.А., Попова А.С., Дудко Е.А., Богуш Е.А., Тюляндина А.С., Тюляндин С.А., Давыдов М.И. (2015) ERCC1 как маркер резистентности рака яичников к препаратам платины. Антибиотики и химиотерапия. 60, 42–50.
Богуш Т.А., Дудко Е.А., Шестакова Е.А., Гришанина А.Н., Богуш Е.А., Кирсанов В.Ю., Рябинина О.М., Вихлянцева Н.О. (2016) Количественная оценка уровня экспрессии белка BRCA1 в ткани рака молочной железы с использованием метода проточной цитофлуориметрии. Рос. Биотерапевт. журн. 15, 49–52.
Богуш Т.А., Шатурова А.С., Дудко Е.А., Джураев Э.Э., Полоцкий Б.Е., Давыдов М.И. (2011) Количественная иммунофлуоресцентная оценка с использованием проточной цитофлуориметрии экспрессии эстрогеновых рецепторов β в солидных опухолях человека. Вестник МГУ. Сер. 2. Химия. 52, 305–312.
Богуш Т.А., Шатурова А.С., Дудко Е.А., Богуш Е.А., Полоцкий Б.Е., Тюляндин С.А., Давыдов М.И. (2014) Сравнительная оценка экспрессии эстрогеновых рецепторов бета в ткани немелкоклеточного рака легкого и метастазов в легком опухолей других первичных локализаций. ДАН. 454, 720–724.
Богуш Т.А., Дудко Е.А., Семаков А.В., Богуш Е.А., Тюляндина А.С., Заркуа В.Т., Тюляндин С.А., Давыдов М. И. (2014) Иммунофлуоресцентный анализ и оценка клинической значимости экспрессии ERCC1 в ткани рака яичников. ДАН. 457, 481–486.
Реброва О.Ю. (2002) Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М., МедиаСфера.
Fan S., Meng Q., Auborn K., Carter T., Rosen E.M. (2006) BRCA1 and BRCA2 as molecular targets for phytochemicals indole-3-carbinol and genistein in breast and prostate cancer cells. Br. J. Cancer. 94, 407–426.
Dagdemir A., Durif J., Ngollo M., Bignon Y.J., Bernard-Gallon D. (2013) Histone lysine trimethylation or acetylation can be modulated by phytoestrogen, estrogen or anti-HDAC in breast cancer cell lines. Epi-genomics. 5, 51–63.
Bosviel R., Dumollard E., Dechelotte P., Bignon Y.J., Bernard-Gallon D. (2012) Can soy phytoestrogens decrease DNA methylation in BRCA1 and BRCA2 oncosuppressor genes in breast cancer? OMICS. 16, 235–244.
Ono M., Ejima K., Higuchi T., Takeshima M., Wakimoto R., Nakano S. (2017) Equol enhances apoptosis-inducing activity of genistein by increasing Bax/Bcl-xL expression ratio in MCF-7 human breast cancer cells. Nutr. Cancer. 6, 1300–1307.
Scherbakov A.M., Andreeva O.E. (2015) Apigenin inhibits growth of breast cancer cells: the role of ERα and HER2/neu. Acta Naturae. 7, 133–139.
Kaushik S., Shyam H., Sharma R., Balapure A.K. (2016) Genistein synergizes centchroman action in human breast cancer cells. Indian J. Pharmacol. 48, 637–642.
Messina M. (2014) Soy foods, isoflavones, and the health of postmenopausal women. Am. J. Clin. Nutr. 100 (Suppl. 1), 423S–430S.
Щербаков А.М., Вавилов Н.Э., Андреева О.Е., Тяглов Б.В., Миронов А.С., Шакулов Р.С., Лобанов К.В., Яроцкий С.В., Штиль А.А. (2017) Действие акадезина на клетки рака молочной железы в условиях гипоксии. Успехи молекулярной онкологии. 4, 60–64.
Sorokin D.V., Scherbakov A.M., Yakushina I.A., Semina S.E., Gudkova M.V., Krasil’nikov M.A. (2016) The mechanism of adaptation of breast cancer cells to hypoxia: role of AMPK/mTOR signaling pathway. Bull. Exp. Biol. Med. 160, 555–559.
Gilkes D.M. (2016) Implications of hypoxia in breast cancer metastasis to bone. Int. J. Mol. Sci. 17, E1669.
Milani M., Harris A.L. (2008) Targeting tumour hypoxia in breast cancer. Eur. J. Cancer. 44, 2766–2773.
Lin W.H., Yeh S.H., Yeh K.H., Chen K.W., Cheng Y.W., Su T.H., Jao P., Ni L.C., Chen P.J., Chen D.S. (2016) Hypoxia-activated cytotoxic agent tirapazamine enhances hepatic artery ligation-induced killing of liver tumor in HBx transgenic mice. Proc. Natl. Acad. Sci. USA. 113, 11937–11942.
Ferrand N., Stragier E., Redeuilh G., Sabbah M. (2012) Glucocorticoids induce CCN5/WISP-2 expression and attenuate invasion in oestrogen receptor-negative human breast cancer cells. Biochem. J. 447, 71–79.
Rae J.M., Johnson M.D., Scheys J.O., Cordero K.E., Larios J.M., Lippman M.E. (2005) GREB 1 is a critical regulator of hormone dependent breast cancer growth. Breast Cancer Res. Treat. 92, 141–149.
Sun J., Zhou W., Kaliappan K., Nawaz Z., Slingerland J.M. (2012) ERα phosphorylation at Y537 by Src triggers E6-AP-ERα binding, ERα ubiquitylation, promoter occupancy, and target gene expression. Mol. Endocrinol. 26, 1567–1577.
Nawaz, Z., Lonard D.M., Dennis A.P., Smith C.L., O’Malley B.W. (1999) Proteasome-dependent degradation of the human estrogen receptor. Proc. Natl Acad. Sci. USA. 96, 1858–1862.
Reid G., Hubner M.R., Metivier R., Brand H., Denger S., Manu D., Beaudouin J., Ellenberg J., Gannon F. (2003) Cyclic, proteasome-mediated turnover of unliganded and liganded ERalpha on responsive promoters is an integral feature of estrogen signaling. Mol. Cell. 11, 695–707.
Stanisic V., Malovannaya A., Qin J., Lonard D.M., O’Malley B.W.J. (2009) OTU Domain-containing ubiquitin aldehyde-binding protein 1 (OTUB1) deubiquitinates estrogen receptor (ER) alpha and affects ERalpha transcriptional activity. Biol. Chem. 284, 16135–16145.
Prat A., Adamo B., Cheang M.C., Anders C.K., Carey L.A., Perou C.M. (2013) Molecular characterization of basal-like and non-basal-like triple-negative breast cancer. Oncologist. 18, 123–133.
Hentze M.W. (1995) Translational regulation: versatile mechanisms for metabolic and developmental control. Curr. Opin. Cell Biol. 7, 393–398.
Silvera D., Formenti S.C., Schneider R.J. (2010) Translational control in cancer. Nat. Rev. Cancer. 10, 254–66.
Gudas J.M., Nguyen H., Li T., Cowan K.H. (1995) Hormone-dependent regulation of BRCA1 in human breast cancer cells. Cancer Res. 55, 4561–4565.
Fustier P., Corre L.L, Chalabi N., Vissac-Sabatier C., Communal Y., Bignon Y.J., Bernard-Gallon D.J. (2003) Resveratrol increases BRCA1 and BRCA2 mRNA expression in breast tumour cell lines. Br. J. Cancer. 89, 168–172.
Daujat S., Bauer U.M., Shah V., Turner B., Berger S., Kouzarides T. (2002) Crosstalk between CARM1 methylation and CBP acetylation on histone H3. Curr. Biol. 12, 2090–2097.
Fang M.Z., Chen D., Sun Y., Jin Z., Christman J.K., Yang C.S. (2005) Reversal of hypermethylation and reactivation of p16INK4a, RARbeta, and MGMT genes by genistein and other isoflavons from soy. Clin. Cancer Res. 11, 7033–7041.
King-Batoon A., Leszczynska J.M., Klein C.B. (2008) Modulation of gene methylation by genistein or lycopene in breast cancer cells. Environ. Mol. Mutagen. 49, 36–45.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


