Молекулярная биология, 2019, T. 53, № 3, стр. 411-420
Миниген антитромбина III человека с оптимизированным паттерном сплайсинга
М. В. Шепелев a, *, Е. К. Саакян a, С. В. Калиниченко a, И. В. Коробко a
a Институт биологии гена Российской академии наук
119334 Москва, Россия
* E-mail: mshepelev@mail.ru
Поступила в редакцию 16.11.2018
После доработки 16.11.2018
Принята к публикации 11.12.2018
Аннотация
Антитромбин III (AT3) – белок из суперсемейства ингибиторов сериновых протеаз (серпинов), является основным физиологическим антикоагулянтом. На основе гена SERPINC1 сконструирован миниген, кодирующий значимый для медицины и биотехнологии белок AT3 человека. Для этого использовали минимизацию размера протяженных интронов с сохранением последовательностей, фланкирующих сайты сплайсинга. Анализ паттерна сплайсинга минигена AT3 выявил один корректный транскрипт и два альтернативных, образующихся вследствие либо пропуска второго и третьего экзонов минигена, либо встраивания аберрантного экзона путем использования криптических сайтов сплайсинга в первом интроне минигена. Паттерн сплайсинга минигена AT3 успешно оптимизирован с помощью сайт-направленного мутагенеза криптических сайтов сплайсинга, что позволило предотвратить формирование альтернативных транскриптов. Присутствие в первом интроне минигена криптических сайтов сплайсинга, подтвержденное с использованием программы Human Splicing Finder v.3.1, указывает на принципиальную возможность выявления сайтов альтернативного сплайсинга в минимизированных или гибридных интронах минигенов и их удаления с помощью мутагенеза еще до экспериментальной проверки паттерна сплайсинга. Описанный подход к дизайну минигенов вкупе с биоинформатическим анализом нуклеотидных последовательностей интронов может использоваться при конструировании минигенов для получения трансгенных животных с продукцией экономически значимых рекомбинантных белков в молоке.
ВВЕДЕНИЕ
Белок антитромбин III (АТ3), входящий в суперсемейство ингибиторов сериновых протеаз (серпинов), является основным физиологическим антикоагулянтом, ингибирующим тромбин и факторы свертывания Xa и IXa [1]. Как наследственная, так и приобретенная недостаточность АТ3 у человека проявляется прежде всего венозными тромбозами [1]. Для профилактики тромбозов при хирургических вмешательствах или родах пациентам с недостаточностью АТ3 показаны препараты АТ3, который получают из крови человека или из молока трансгенных коз [2, 3].
Продукция рекомбинантных белков в молоке трансгенных животных представляет актуальное направление биотехнологии [4]. Рекомбинантный AT3 под коммерческим названием Atryn® был первым одобренным FDA (Управление по контролю качества пищевых продуктов и лекарственных препаратов США) лекарственным средством, получаемым из молока трансгенных животных [5]. Белоккодирующая последовательность, используемая для получения трансгенных животных, продуцирующих рекомбинантные белки, может входить в состав полноразмерной копии гена, кДНК или минигена, содержащего гетерологичные, гибридные или минимизированные нативные интроны целевого гена [4]. В частности, трансгенные козы, молоко которых содержит рекомбинантный АТ3 человека, получены с использованием генетической конструкции, несущей кДНК АТ3 человека [6]. Тем не менее, считается, что присутствие интронов положительно влияет на уровень экспрессии трансгена и продукцию рекомбинантного белка [7, 8]. Однако полноразмерные копии генов человека зачастую имеют очень большой размер (до десятков тысяч пар нуклеотидов), что затрудняет проведение генно-инженерных манипуляций и обуславливает необходимость минимизации размера генетической конструкции, в том числе с помощью минигена. В частности, описанный ранее миниген, кодирующий АТ3 человека, содержал лишь часть первого интрона гена [9], а его экспрессию изучали только на клетках в культуре.
Цель данной работы состояла в конструировании минигена, кодирующего белок AT3, с использованием стратегии, предполагающей удаление наиболее протяженных интронов гена с сохранением коротких последовательностей (около 150 п.н.), фланкирующих сайты сплайсинга.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Штаммы Escherichia coli, выделение ДНК. Для генно-инженерных манипуляций и получения плазмидной ДНК в препаративных количествах использовали штамм E. coli XL-1 Blue MRF' (“Stratagene”, США). Плазмидную ДНК выделяли с помощью наборов GenElute Plasmid Miniprep Kit (“Sigma-Aldrich”, США) или GeneJET Plasmid Miniprep Kit (“Thermo Fisher Scientific”, США) в соответствии с протоколами производителей. Геномную ДНК человека, используемую в качестве матрицы в ПЦР, выделяли из крови здорового донора с помощью набора реагентов QIAamp DNA Blood Mini Kit (“Qiagen”, Германия). Геномную ДНК мышей гибридной линии F1(CBA × C57BL/6), служащую матрицей в ПЦР, выделяли из фрагмента хвоста с помощью набора GenElute Mammalian Genomic DNA Miniprep kit (“Sigma-Aldrich”). Нуклеотидные последовательности всех амплифицированных в ПЦР фрагментов ДНК и фрагментов минигена после проведения мутагенеза в соответствующих плазмидах верифицировали путем секвенирования с помощью набора реактивов ABI PRISM® BigDye™ Terminator v. 3.1 с последующим анализом продуктов реакции на автоматическом секвенаторе Applied Biosystems 3730 DNA Analyzer в ЦКП “Геном” Института молекулярной биологии им. В.А. Энгельгардта РАН, Россия.
Конструирование минигена, кодирующего анти-тромбин III человека. Фрагменты генома человека, используемые для конструирования минигена, кодирующего АТ3, амплифицировали с помощью ПЦР. При необходимости введения сайтов рестрикции эти фрагменты реамплифицировали с использованием соответствующих праймеров. Все ПЦР-продукты клонировали в вектор pCR-Blunt (“Invitrogen”, США), при необходимости выбирая клоны с определенной ориентацией вставки. Описание амплифицированных фрагментов генома человека, последовательности олигонуклеотидных праймеров и названия плазмид приведены в табл. 1. В нуклеотидной последовательности плазмиды phAT3ex35-3 при секвенировании обнаружен сайт рестрикции PstI, отсутствующий в референсной геномной последовательности гена SERPINC1 человека и представленный, вероятно, полиморфизмом. Референсную нуклеотидную последовательность восстанавливали с помощью сайт-направленного мутагенеза по протоколу QuikСhange (“Agilent Technologies”, США) с олигонуклеотидными праймерами 5'-ccagaggtgctgcaagagtggctggatga-3' и 5'-tcatccagccactcttgcagcacctctgg-3'.
Фрагмент генома мыши размером 2209 п.н. (“левое плечо” геномного локуса гена Serpinc1, кодирующего АТ3), включавший 3'-часть первого интрона транcкрипта AT3 мыши (NM_080844.4) (2004 п.н.), второй экзон (143 п.н.) и 5'-часть второго интрона (62 п.н.) амплифицировали в ПЦР с использованием праймеров 5'-ctggaagctcaggaagataac-3' и 5'-gagagtccttcagaggtcaga-3'. Далее 5'-область левого плеча АТ3 мыши реамплифицировали с праймерами 5'-aatccttagcggccgcataaaggt-3' и 5'-gagagtccttcagaggtcaga-3'. ПЦР-продукт клонировали в вектор pCR-Blunt и получили плазмиду pmATLA-Not. 3'-Oбласть левого плеча реамплифицировали с праймерами 5'-caaactcgaggctagcccgtcagag-3' и 5'-gagagtccttcagaggtcaga-3' и клонировали в вектор pCR-Blunt, получив плазмиду pmAT3LA.
Таблица 1.
Фрагменты гена SERPINC1 человека, амплифицированные с помощью ПЦР для конструирования минигена
| Фрагмент гена SERPINC1 | Праймеры 5' → 3' | ПЦР-продукт, п.н. | Плазмида | Сайты клонирования |
|---|---|---|---|---|
| 3'-Часть первого экзона (94 п.н.) + 5'-часть первого интрона (146 п.н.) | F: gcctcagatcacactatctcc R: aatgacgtcttccaaacaggtc |
239 | phAT3ex1 | |
| 3'-Часть первого интрона (303 п.н.) + экзон 2 (367 п.н.) + + 5'-часть второго интрона (102 п.н.) | F: cacaaacaggaagcttctcattc R: tagtggcctgcagtgttggt |
772 | ------ | |
| 3'-Часть первого интрона (232 п.н.) + экзон 2 (367 п.н.) + + 5'-часть второго интрона (102 п.н.) | F: atcagatctttctaattccaacatg R: tagtggcctgcagtgttggt |
701 | phAT3ex2-BgP | BglII (введен)–PstI (эндогенный) |
| 3'-Часть второго интрона (237 п.н.) + экзон 3 (216 п.н.) + + интрон 3 (907 п.н.) + 5'-часть экзона 4 (120 п.н.) | F: ctttaggtggcaacctagtctc R: aaccagcaccagaacagtgag |
1480 | ------ | |
| 3'-Часть интрона 3 (146 п.н.) + экзон 3 (216 п.н.) + + интрон 3 (907 п.н.) + 5'-часть экзона 4 (120 п.н.) | F: gagcatttctgcagtcccagg R: aaccagcaccagaacagtgag |
1389 | phAT3ex35-5 | PstI (введен)–SacI (эндогенный) |
| Экзон 4 (138 п.н.) + интрон 4 (811 п.н.) + + экзон 5 (391 п.н.) + 5'-часть интрона 5(113 п.н.) | F: gaaaatgcagagcaatccagag R: cagtatccaggagtcctgac |
1453 | ------ | |
| 3'-Часть экзона 4 (62 п.н.) + интрон 4 (811 п.н.) + + экзон 5 (391 п.н.) + 5'-часть интрона 5 (113 п.н.) | F: ttccctcggaagccatcaatg R: caggatccaggagtcctgac |
1377 | phAT3ex35-3 | SacI (эндогенный)–BamHI (введен) |
| 3'-Часть интрона 2 (146 п.н.) + экзон 3 (216 п.н.) + + интрон 3 (907 п.н.) + интрон 4 (811 п.н.) + + экзон 5 (391 п.н.) + 5'-часть интрона 5 (113 п.н.) | Фрагмент SacI-SacI клонировали из плазмиды phAT3ex35-3 в плазмиду phAT3ex35-5 по сайту SacI | 2722 | phAT3ex35-PB | PstI (введен)–BamHI (введен) |
| 3'-Часть интрона 5 (151 п.н.) + экзон 6 (65 п.н.) + + 5'-часть интрона 6 (164 п.н.) | F: cattgtgagagtatgattaggtg R: aggcagaacaatcacaccatg |
380 | ------ | |
| 3'-Часть интрона 5 (13 п.н.) + экзон 6 (65 п.н.) + 5'-часть интрона 6(164 п.н.) | F: aggtgaagatctaggatttcttct R: aggcagaacaatcacaccatg |
362 | phATex6-BgSp | BglII (введен)–SphI (эндогенный) |
| 3'-Часть интрона 6 (145 п.н.) + 5'-часть экзона 7 (216 п.н.), включая стоп-кодон и 39 п.н. из 3'-НТО | F: tctggagggaatccaacctg R: aaaccaaaaataggaagaggtgc |
361 | ------ | |
| 3'-Часть интрона 6 (145 п.н.) + 5'-часть экзона 7 (209 п.н.), включая стоп-кодон и 32 п.н. из 3'-НТО | F: tctggagggcatgcaacctg R: cagtcgacacaatctagaaataggaagaggtgc |
354 | phATex7-SpXS | SphI (введен)–XbaI/SalI (введены) |
Далее с помощью ПЦР сконструировали гибридную молекулу ДНК, включающую “левое плечо” геномного локуса AT3 мыши, слитое с последовательностью первого экзона гена AT3 человека (рис. 1г). C этой целью частично перекрывающиеся фрагменты левого плеча AT3 и первого экзона АТ3 человека амплифицировали с использованием праймеров 5'-caaactcgaggctagcccgtcagag-3' и 5'-ctatcacattggaatacatggccgatgctc-3' на матрице плазмиды pmAT3LA и праймеров 5'-taggagcatcggccatgtattccaatgtga-3' и 5'-acggatccttgactgtaactaccag-3' на матрице плазмиды phAT3ex1. Полученные ПЦР-продукты смешивали, гибридизовали и проводили три цикла ПЦР без добавления праймеров для элонгации гибридных молекул ДНК, сформированных в результате отжига перекрывающихся последовательностей исходных продуктов ПЦР. Далее добавляли фланкирующие праймеры 5'-caaactcgaggctagcccgtcagag-3' и 5'-acggatccttgactgtaactaccag-3' и амплифицировали полноразмерный гибридный фрагмент ДНК, который клонировали в вектор pCR-Blunt. Таким образом получили плазмиду pAT3LAhyb. Далее фрагмент плазмиды pAT3LAhyb XhoI (обработан фрагментом Кленова)–BamHI клонировали в плазмиду pBluescriptSKII(–)(“Stratagene”, США) по сайтам XbaI (обработан фрагментом Кленова)–BamHI и получили плазмиду pBl-AT3LAhyb. Затем фрагмент NotI–NheI, включающий 5'-область геномного локуса АТ3 мыши, клонировали из плазмиды pATLA-Not по сайтам NotI–NheI в вектор pBl-AT3LAhyb, получив плазмиду pATLA, содержащую левое плечо геномного локуса АТ3 мыши, слитое с последовательностью первого экзона гена SERPINC1 человека.
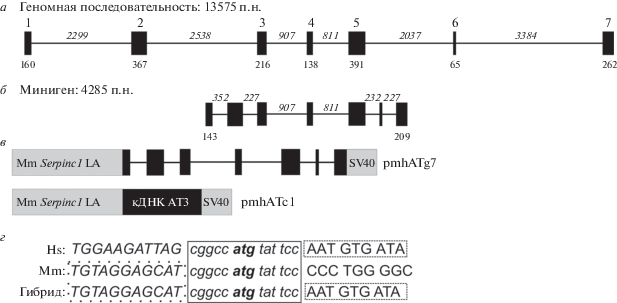
Рис. 1.
Схемы экзон-интронной структуры гена SERPINC1 человека, минигена AT3, плазмидных конструкций и области формирования гибридной последовательности ДНК. а – Схема экзон-интронной структуры гена SERPINC1 человека. Геномная последовательность экзонов 1–7 имеет длину 13 575 п.н. Экзоны показаны черными прямоугольниками, над и под которыми приведены их номера и длина (п.н.) соответственно. Интроны показаны тонкими черными линиями, длины интронов (п.н.) приведены сверху. б – Схема экзон-интронной структуры минигена AT3. Экзоны и интроны обозначены, как в панели а. Указаны длины лишь тех экзонов (1 и 7), размер которых был уменьшен при конструировании минигена. Длины всех интронов минигена указаны сверху. в – Схема плазмидных конструкций, кодирующих миниген АТ3 (pmhATg7) и кДНК AT3 (pmhATc1). Экзоны и кДНК показаны черными прямоугольниками, интроны – тонкими черными линиями, левое плечо геномного локуса AT3 мыши (LA, left arm) и последовательность полиаденилирования вируса SV40 показаны серыми прямоугольниками. г – Нуклеотидные последовательности участка формирования гибридной молекулы между левым плечом геномного локуса AT3 мыши и первым экзоном или кДНК гена AT3 человека. Идентичные нуклеотиды выделены курсивом и сплошной рамкой. Кодон инициации трансляции показан полужирным шрифтом. Нуклеотидные последовательности из левого плеча геномного локуса AT3 мыши, присутствующие в гибридной молекуле, выделены рамкой из точек. Последовательности первого экзона/кДНК AT3 человека, присутствующие в гибридной молекуле, выделены пунктирной рамкой. Mm – мышь, Hs – человек.
Сборку минигена AT3 осуществляли путем последовательного клонирования фрагментов, содержащих экзоны и интроны гена SERPINC1 человека (табл. 1). В частности, фрагмент EcoRI–PstI, содержащий экзон 2, клонировали из плазмиды phATex2-BgP по сайтам EcoRI–PstI в вектор pBluescriptSKII(–) и получили плазмиду phATg1. Затем фрагмент PstI–BamHI плазмиды phATex35-PB, содержащий экзоны 3–5, клонировали в плазмиду phATg1 по сайтам PstI–BamHI и получили плазмиду phATg2. Из плазмиды phATg2 удаляли сайт рестрикции SalI, разрезая ее рестриктазой SalI, обрабатывая фрагментом Кленова с последующим лигированием плазмиды саму на себя. Фрагмент BamHI–NotI, содержащий экзон 7, клонировали из плазмиды phATex7-SpXS в вектор pBluescriptSKII(-) по сайтам BamHI–NotI с получением плазмиды phATg3. После этого фрагмент XhoI–SphI, содержащий экзон 6, клонировали из плазмиды phATex6-BgSp в плазмиду phATg3 по сайтам XhoI–SphI, получая таким образом плазмиду phATg4. Затем фрагмент BglII–NotI, содержащий экзоны 6 и 7, клонировали из плазмиды phATg4 в плазмиду phATg2 по сайтам BamHI–NotI. В результате получили плазмиду phATg5, в которую затем по сайтам XbaI–SalI клонировали последовательность полиаденилирования вируса SV40 из вектора pGL3-Control (“Promega”, США) и получили плазмиду phATg6.
Для получения конечной плазмиды, кодирующей миниген АТ3, фрагмент BglII–SalI, содержащий экзоны 2–7 минигена АТ3 и сигнал полиаденилирования SV40, клонировали из плазмиды phATg6 по сайтам BamHI–SalI в плазмиду pATLA, содержащую гибридную последовательность левого плеча геномного локуса гена Serpinc1 мыши и первого экзона гена SERPINC1 человека, и получили плазмиду pmhATg7 (схема плазмидной конструкции показана на рис. 1в).
Клонирование кДНК AT3 человека. кДНК AT3 человека амплифицировали в виде двух фрагментов на матрице первых цепей кДНК из печени человека. 5'-Область кДНК амплифицировали с использованием олигонуклеотидных праймеров 5'-gcctcagatcacactatctcc-3' и 5'-aaccagcaccagaacagtgag-3' и клонировали в вектор pCR-Blunt, получив таким образом плазмиду pcAT5. 3'-Область кДНК амплифицировали с использованием олигонуклеотидных праймеров 5'-tccctcggaagccatcaatg-3' и 5'-aaaccaaaaataggaagaggtgc-3', реамплифицировали с праймерами 5'-tccctcggaagccatcaatg-3' и 5'-cagtcgacacaatctagaaataggaagaggtgc-3' для введения SalI- и XbaI-сайтов. Затем клонировали в вектор pCR-Blunt, получив при этом плазмиду pcAT3XS. Фрагмент SacI–SalI c 3'-областью кДНК AT3 плазмиды pcAT3XS клонировали по сайтам SacI–SalI в плазмиду pBluescriptSKII(–) и получили плазмиду pBI-cAT3. Затем в плазмиду pB1-cAT3 клонировали последовательность полиаденилирования вируса SV40 из вектора pGL3-Control по сайтам XbaI–SalI, получив таким образом плазмиду pcAT3SV.
Гибридную молекулу ДНК, включающую левое плечо геномного локуса AT3 мыши, слитое с последовательностью кДНК AT3 человека, конструировали, как и при сборке минигена. Частично перекрывающиеся фрагменты ДНК амплифицировали с праймерами 5'-caaactcgaggctagcccgtcagag-3' и 5'-ctatcacattggaatacatggccgatgctc-3' на матрице плазмиды pmAT3LA, с праймерами 5'-taggagcatcggccatgtattccaatgtga-3' и 5'-aaccagcaccagaacagtgag-3' на матрице плазмиды pcAT5. Полноразмерную молекулу амплифицировали с фланкирующими праймерами 5'-caaactcgaggctagcccgtcagag-3' и 5'-aaccagcaccagaacagtgag-3' и клонировали в вектор pCR-Blunt, получив в результате плазмиду pcAT5hyb. Далее фрагмент XhoI (обработан фрагментом Кленова)–BamHI плазмиды pcAT5hyb клонировали в плазмиду pBluescriptSKII(–) по сайтам XbaI (обработан фрагментом Кленова)–BamHI и получили плазмиду pBl-cAT5hyb. Далее фрагмент NotI—NheI, включающий часть “левого плеча” геномного локуса АТ3 мыши, клонировали из плазмиды pATLA-Not по сайтам NotI–NheI в вектор pBl-cAT5hyb, получив плазмиду pcATLA, содержащую левое плечо геномного локуса АТ3 мыши, слитое с кДНК AT3 человека.
Для получения конечной плазмиды pmhATc1 фрагмент SacI–SalI, содержащий 3'-область кДНК АТ3 и сигнал полиаденилирования SV40, клонировали из плазмиды pcAT3SV по сайтам SacI–SalI в плазмиду pсATLA (схема конструкции показана на рис. 1в).
Оптимизация паттерна сплайсинга минигена с помощью сайт-направленного мутагенеза. Для проведения мутагенеза криптических сайтов сплайсинга и введения комплементарных шпилек в первый интрон минигена АТ3 фрагменты NheI–Cfr9I минигена (691 п.н., содержит часть левого плеча АТ3 мыши, первый экзон и часть первого интрона минигена) и Cfr9I–EcoRV (1263 п.н., содержит часть первого интрона, второй экзон, второй интрон, третий экзон и часть третьего интрона минигена) клонировали из вектора pmhATg7 в плазмиды pBK-CMV (“Stratagene”) и pBluescriptSKII(–) соответственно. В результате получили плазмиды pBK-ATg7NC и pBl-ATg7CRV, которые использовали в качестве матриц для ПЦР-мутагенеза. В плазмиде pBK-ATg7NC мутировали акцепторный криптический сайт сплайсинга и вводили последовательность для формирования шпильки вблизи донорного сайта сплайсинга первого экзона минигена. В плазмиде pBl-ATg7CRV мутировали донорный криптический сайт сплайсинга и вводили последовательность для формирования шпильки вблизи акцепторного сайта сплайсинга второго экзона минигена. Мутации вводили с помощью сайт-направленного мутагенеза с двумя комплементарными олигонуклеотидными праймерами на основе протокола QuikСhange Site-Directed Mutagenesis kit (“Agilent Technologies”). ПЦР проводили с использованием ДНК-полимеразы AccuPrime™ Pfx DNA Polymerase (“Invitrogen”) в реакционной смеси объемом 50 мкл, включавшей 1× реакционный буфер, 300 нМ прямого и обратного праймеров, 100 нг плазмидной матрицы и 2.5 ед. ДНК-полимеразы при следующих условиях: 94°С, 3 мин, [94°С, 40 с; 55°C, 1 мин; 68°С, 5 мин] – 15 циклов, 68°С, 3 мин. Продукт ПЦР обрабатывали рестриктазой DpnI в течение 2 ч для расщепления плазмидной матрицы и трансформировали в химически компетентные клетки.
Мутагенез проводили с использованием следующих праймеров: мутация акцепторного криптического сайта сплайсинга – 5'-tccaacatgaccacgtcctctcaactgaactgtcccctg-3' и 5'-caggggacagttcagttgagaggacgtggtcatgttgga-3'; мутация донорного криптического сайта сплайсинга – 5'-cctttctcttggccacaccactagggctggaatcctctg-3' и 5'-cagaggattccagccctagtggtgtggccaagagaaagg-3'; введение последовательности для формирования шпильки вблизи донорного сайта сплайсинга первого экзона – 5'-ggtgagctttcccccactaccttgcctgcccct-3' и 5'-aggggcaggcaaggtagtgggggaaagctcacc-3'; введение последовательности для формирования шпильки вблизи акцепторного сайта сплайсинга второго экзона – 5'-tgggcagtggggctagtagtggggggttgcag-3' и 5'-ctgcaaccccccactactagccccactgccca-3'. Измененные нуклеотиды и последовательности, введенные для формирования шпилек, выделены полужирным курсивом. Используя плазмиду pBK-ATg7NC как матрицу для ПЦР, получали конструкции с мутацией акцепторного криптического сайта сплайсинга (AccMut), с последовательностью, введенной для формирования шпильки вблизи донорного сайта сплайсинга первого экзона (DonLoop), или с их комбинацией (AccMut DonLoop). Используя плазмиду pBl-ATg7CRV как матрицу для ПЦР, получали конструкции с мутацией донорного криптического сайта сплайсинга (DonMut), с последовательностью, введенной для формирования шпильки вблизи акцепторного сайта сплайсинга второго экзона (AccLoop), или с их комбинацией (DonMut AccLoop).
Далее фрагменты минигена AT3 NheI–Cfr9I из плазмиды pBK-ATg7NC, содержащей соответствующие мутации (AccMut, DonLoop и AccMutDonLoop), клонировали в вектор pmhATg7 по сайтам NheI–Cfr9I. Затем в полученные плазмиды клонировали фрагменты минигена AT3 Cfr9I-EcoRV из плазмид pBl-ATg7CRV, содержащих мутации DonMut, AccLoop и DonMutAccLoop. Таким образом получили плазмиды, кодирующие миниген с мутациями криптических сайтов сплайсинга в первом интроне (Spl), содержащие последовательности для формирования шпилек (Loop) или их комбинацию (Spl Loop).
Культуры клеток и трансфекция. Клетки линии HEK293 культивировали в среде DMEM (“HyClone”, США) с добавлением 10% фетальной бычьей сыворотки (“HyClone”), 100 ед./мл пенициллина и 100 мкг/мл стрептомицина (“Gibco”, США). Для трансфекции клеток плазмидной ДНК использовали реагент EcoTransfect (“OZ Bioscience”, Франция).
Выделение РНК, обратная транскрипция и ПЦР. Клетки HEK293 рассевали по 5 ×105 клеток в лунку шестилуночного планшета, на следующий день трансфицировали соответствующими плазмидами (2 мкг на лунку) либо оставляли нетрансфицированными в качестве отрицательного контроля. Cуммарную РНК выделяли через 48 ч после трансфекции с использованием набора RNeasy Mini Kit (“Qiagen”) и обрабатывали ДНКазой из набора RNase-Free DNase Set (“Qiagen”) для минимизации содержания примесей геномной и плазмидной ДНК в препарате РНК. Реакцию обратной транскрипции проводили в объеме 10 мкл с использованием 0.5 мкг РНК и мастермикса SuperScript™ IV VILO™ Master Mix with ezDNase™ Enzyme (“Invitrogen”), включая обработку РНК ферментом ezDNase™ в соответствии с протоколом производителя. Продукты реакции обратной транскрипции (первые цепи кДНК) использовали в качестве ПЦР-матрицы.
Полноразмерный транскрипт минигена амплифицировали с использованием ДНК-полимеразы Platinum™ Taq DNA Polymerase High Fidelity (“Invitrogen”, #11304011) и олигонуклеотидных праймеров 5'-atctctgtaggagcatcggc-3' и 5'-cgactctagaaataggaagagg-3', специфичных для транскрипта минигена, в реакции объемом 25 мкл, содержащей 1 × буфер High Fidelity PCR buffer (60 мМ Трис-SO4 (pH 8.9) и 18 мМ (NH4)2SO4), 2 мМ MgSO4, 400 нМ dNТP, 400 нМ прямого и обратного праймеров, 1 ед. акт. ДНК-полимеразы и 1 мкл реакционной смеси обратной транскрипции в качестве матрицы. ПЦР проводили в следующих условиях: 94°С, 2 мин; 35 циклов: 94°С, 30 с, 50°С, 30 с и 68°С, 2 мин. Продукты амплификации разделяли в 0.9%-ном TAE-агарозном геле и визуализировали, окрашивая бромистым этидием. Результаты электрофореза документировали и анализировали с помощью системы гель-документации ChemiDoc XRS (“Bio-Rad”, США) и программного обеспечения QuantityOne 4.6.2 (“Bio-Rad”). Для анализа нуклеотидных последовательностей транскриптов минигена фрагменты ДНК очищали из агарозного геля с помощью набора QiaexII Gel Extraction kit (“Qiagen”), клонировали в вектор pJET1 (“Thermo Fisher Scientific”) и секвенировали.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Конструирование минигена, кодирующего антитромбин III человека
Для валидации стратегии минимизации нативных интронов, используемых в генетической конструкции для трансгенеза, сконструирован миниген, кодирующий белок АТ3 человека. Ген SERPINC1 человека (Gene ID: 432), кодирующий АТ3, расположен на хромосоме 1 и содержит семь экзонов и шесть интронов. Длина геномной последовательности, включающей первый и последний экзоны гена, составляет 13575 п.н. В то же время, длина кодирующей последовательности AT3 (изоформа 1, NM_000488.3) составляет 1392 п.н. (464 аминокислотных остатка). При этом наиболее протяженные первый, второй, пятый и шестой интроны гена SERPINC1 имеют длину 2299, 2538, 2037 и 3384 п.н. соответственно. Считается, что основные элементы интронов, обеспечивающие правильный сплайсинг транскрипта, расположены в пределах 100 п.н. от донорного и акцепторного сайтов [9, 10]. Поэтому мы использовали стратегию конструирования минигена, которая предполагает удаление большей части протяженных интронов гена SERPINC1 с сохранением небольших участков этих интронов (около 100–150 п.н.), прилежащих к сайтам сплайсинга. Третий и четвертый интроны гена SERPINC1 имеют относительно небольшую протяженность (907 и 811 п.н. соответственно), поэтому для создания минигена использовали интактные нуклеотидные последовательности этих интронов (рис. 1а, б).
Для проверки функциональности минигена AT3 на трансгенных животных в конструкцию, кодирующую миниген, ввели последовательность из геномного локуса АТ3 мыши, включающую протяженный первый интрон гена Serpinc1. Эта последовательность содержит регуляторные элементы для активации транскрипции минигена в составе плазмид при транзиторной трансфекции в клетки млекопитающих. Она может быть использована как левое плечо гомологии для встраивания минигена АТ3 человека в геномный локус АТ3 мыши с помощью CRISPR/Cas9-опосредованной гомологичной рекомбинации. Для этого создана конструкция, содержащая геномную последовательность локуса AT3 мыши, слитую с первым экзоном гена AT3 человека (рис. 1г). В результате первый экзон минигена AT3 длиной 143 п.н. включает 97 п.н. 5'-области второго экзона гена Serpinc1 мыши, 14 п.н. вблизи кодона инициации трансляции, идентичных у человека и мыши, и 32 п.н. из 3'‑области первого экзона гена SERPINC1 человека (рис. 1в, г). Таким образом сконструирован миниген для экспрессии АТ3 человека под контролем регуляторных последовательностей гена Serpinc1 мыши. Этот миниген содержит минимизированные первый, второй, пятый и шестой интроны гена SERPINC1 и последовательность полиаденилирования вируса SV40 (рис. 1б, в). При этом длина белоккодирующей части генетической конструкции (включая экзоны 1–7) уменьшилась в 3 раза (13575–4285 п.н.). Сходным образом создана контрольная плазмида, несущая кДНК AT3 человека под контролем регуляторных элементов гена Serpinc1 мыши. Схемы конструкций, кодирующих миниген AT3 человека (плазмида pmhATg7) и кДНК AT3 человека (pmhATc1), показаны на рис. 1в.
Анализ паттерна сплайсинга транскрипта минигена антитромбина III
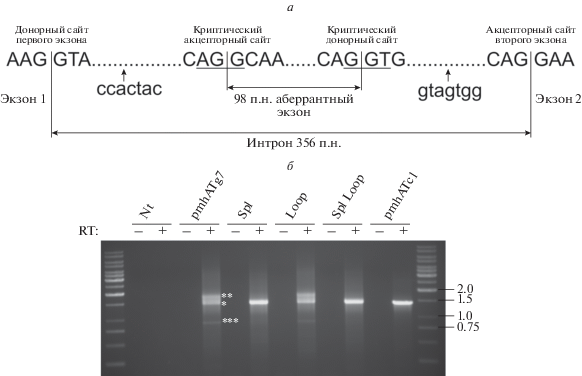
Для анализа функциональности минигена и правильности сплайсинга первичного транскрипта, кодируемого минигеном, плазмидные конструкции трансфицировали в клетки линии HEK293, выделяли суммарную РНК, проводили ОТ-ПЦР и амплифицировали полноразмерный транскрипт АТ3 с помощью ПЦР с праймерами, специфичными к транскрипту АТ3, кодируемому минигеном. Обнаружено, что с плазмиды pmhATc1 экспрессируется транскрипт ожидаемого размера 1457 п.н., тогда как с плазмиды pmhATg7 экспрессируются три транскрипта (рис. 2б, дорожка pmhATg7), один из которых по размеру соответствует корректному транскрипту AT3 (рис. 2б, положение полосы в геле указано *). Однако обнаружен также длинный транскрипт (рис. 2б, положение полосы в геле указано **) и укороченный транскрипт длиной порядка 800 п.н. (рис. 2б, положение полосы в геле указано ***). Индивидуальные полосы были выделены из геля, клонированы и секвенированы. Установлено, что эта полоса (*) действительно представляет собой правильно сплайсированный транскрипт минигена АТ3, полоса (**) представляет собой транскрипт минигена, содержащий аберрантный экзон длиной 98 н., расположенный между первым и вторым экзонами минигена, а полоса (***) соответствует альтернативно сплайсированному транскрипту, у которого пропущены второй и третий экзоны. При этом в обнаруженных альтернативных транскриптах нарушена рамка считывания белка АТ3.
Рис. 2.
Анализ и оптимизация паттерна сплайсинга минигена AT3 человека в клетках линии HEK293. а – Схема сайтов сплайсинга первого интрона минигена. Показаны нуклеотидные последовательности донорного сайта сплайсинга первого экзона минигена, акцепторного сайта сплайсинга второго экзона минигена, криптических акцепторного и донорного сайтов сплайсинга в первом интроне минигена. Вертикальные полосы показывают границы экзонов и интронов. Длина первого интрона минигена – 356 п.н., длина аберрантного экзона – 98 п.н. Подчеркнуты нуклеотидные последовательности AGG и GGT, соответствующие криптическим сайтам сплайсинга, которые при оптимизации паттерна сплайсинга заменили на TCT и CTA соответственно. Места встраивания комплементарных последовательностей для формирования стабильной шпилечной структуры (ccactac, через 21 п.н. от границы первого экзона и интрона; gtagtgg, за 18 п.н. до точки ветвления вблизи акцепторного сайта второго экзона) показаны стрелками. б – Электрофоретический анализ в 0.9%-ном ТАЕ-агарозном геле амплифицированных в ПЦР транскриптов минигена АТ3, детектируемых в клетках HEK293. Клетки HEK293 трансфицировали плазмидами для экспрессии минигена AT3 (pmhATg7), кДНК АТ3 (pmhATc1) и минигена с мутациями криптических сайтов сплайсинга (Spl) с введенными в первый интрон последовательностями для формирования шпилек (Loop) или с их комбинацией (Spl Loop). Nt – нетрансфицированные клетки. Положение фрагментов ДНК, соответствующее различным транскриптам, показано звездочками. * Корректно сплайсированный транскрипт AT3 (ожидаемый размер продукта ПЦР 1457 п.н.). ** Транскрипт с инсерцией 98 п.н. в первом интроне минигена. *** Укороченный транскрипт с пропущенными экзонами 2 и 3. В качестве матрицы в ПЦР использовали образцы, полученные в реакции обратной транскрипции с добавлением (RT+) или без добавления (RT–) обратной транскриптазы. Справа указаны длины фрагментов ДНК-маркера O’GeneRuler 1kb DNA Ladder (“Thermo Fisher Scientific”) (т.п.н.).
В базе данных GenВank представлены две изоформы мРНК AT3 человека. Изоформа 1 (NM_000488.3) кодирует полноразмерный белок (464 аминокислотных остатка), тогда как изоформа 2 (NM_001365052 или XM_005245198) предположительно может кодировать укороченный белок, из которого удалены 48 N-концевых аминокислот, а трансляция начинается с остатка метионина в положении 49 (NP_001351981.1). Анализ нуклеотидной последовательности транскрипта NM_001365052 выявил аберрантный экзон длиной 169 п.н., локализованный между первым и вторым экзонами гена SERPINC1, который нарушает рамку считывания AT3 за счет внесения нескольких стоп-кодонов. Таким образом, альтернативным инициирующим кодоном может быть лишь метионин в позиции 49. Однако несмотря на присутствие транскрипта NM_001365052 и белка NP_001351981.1 в базах данных, нам не удалось найти опубликованных экспериментальных доказательств обнаружения этих молекул.
Сравнение транскрипта NM_001365052 и выявленного нами альтернативного транскрипта с аберрантным экзоном длиной 98 п.н. показало, что донорный сайт сплайсинга аберрантного экзона транскрипта NM_001365052 совпадает с донорным сайтом сплайсинга аберрантного экзона длиной 98 п.н. из первого интрона минигена. Таким образом, мы обнаружили, что первый интрон гена SERPINC1 человека действительно содержит криптический сайт сплайсинга, который в определенных условиях может функционировать как донорный, приводя к инсерции аберрантного экзона в транскрипт. Мы не смогли проверить функциональность акцепторного сайта сплайсинга аберрантного экзона из транскрипта NM_001365052, так как область интрона, включающая данный сайт, была удалена при конструировании минигена.
Оптимизация паттерна сплайсинга транскрипта минигена антитромбина III
Нами проведен анализ нуклеотидной последовательности первого интрона минигена длиной 356 п.н. и фланкирующих экзонных последовательностей с помощью программы Human Splicing Finder v.3.1 (http://www.umd.be/HSF3). Установлено, что среди всех обнаруженных потенциальных сайтов сплайсинга наибольшее консенсусное значение (число от 0 до 100, значимыми считаются результаты с показателем 80 и более) имеют донорный сайт первого экзона минигена и акцепторный сайт второго экзона, которые являются сайтами сплайсинга корректного транскрипта гена SERPINC1 (табл. 2). При этом криптические сайты сплайсинга в интроне минигена также имели высокие консенсусные значения (табл. 2). Можно предположить, что удаление большей части первого интрона гена SERPINC1 позволяет эффективно протекать альтернативному сплайсингу между донорным сайтом первого экзона минигена и криптическим акцепторным сайтом в первом интроне, и, соответственно, между криптическим донорным сайтом в первом интроне и акцепторным сайтом во втором экзоне минигена.
Таблица 2.
Анализ нуклеотидной последовательности первого интрона минигена с помощью программы Human Splicing Finder v.3.1
| Позиция нуклеотида | Тип сайта сплайсинга | Потенциальный сайт сплайсинга | Консенсусное значение (0–100) |
|---|---|---|---|
| 25 | Донорный | AAGgtaaga | 96.71 |
| 34 | Донорный | GGGgtgagc | 90.05 |
| 82 | Акцепторный | aaggactcacagGA | 81.08 |
| 129 | Акцепторный | tctccctggtagTT | 80.09 |
| 135 | Акцепторный | tggtagttacagTC | 81.69 |
| 172 | Акцепторный* | gaccacgtccagGC | 84.1 |
| 242 | Акцепторный | cttggttcaaagGA | 80.43 |
| 270 | Акцепторный | tggccacaccagGT | 85.95 |
| 279 | Донорный* | CAGgtgggc | 88.33 |
| 318 | Донорный | GTGgtgggc | 81.82 |
| 368 | Акцепторный | gtctccttgcagGA | 94.08 |
Примечание. Показаны результаты с консенсусным значением выше 80. Экзонные последовательности выделены прописным шрифтом. Донорный сайт первого экзона минигена и акцепторный сайт второго экзона показаны полужирным. Криптические сайты сплайсинга, используемые в альтернативном транскрипте со вставкой аберрантного экзона длиной 98 п.н., показаны полужирным курсивом и отмечены звездочкой.
Для оптимизации паттерна сплайсинга минигена АТ3 использовали два подхода: (а) сайт-направленный мутагенез криптических сайтов сплайсинга в первом интроне минигена; (б) введение в первый интрон вблизи корректных донорного и акцепторного сайтов сплайсинга комплементарных нуклеотидных последовательностей, потенциально способных формировать вторичные структуры (шпильки) в молекуле пре-мРНК, тем самым стерически сближая сайты сплайсинга и способствуя правильному протеканию сплайсинга [9]. С помощью сайт-направленного мутагенеза созданы плазмидные конструкции с мутациями криптических сайтов сплайсинга (Spl), с последовательностями для формирования вторичных структур (Loop) и с их комбинацией (Spl Loop). Анализ с помощью программы Human Splicing Finder v.3.1, проведенный после внесения мутаций и введения последовательностей для формирования шпилек, показал, что оба криптических сайта сплайсинга успешно удалены из интрона (данные не показаны). Анализ паттерна сплайсинга в случае плазмидных конструкций, транзиентно трансфицированных в клетки HEK293, позволил установить, что мутагенез криптических сайтов сплайсинга в первом интроне минигена эффективно предотвращает формирование альтернативных транскриптов, включая формирование укороченного транскрипта с пропущенными вторым и третьим экзонами (рис. 2б, дорожки Spl или Spl Loop). Введение комплементарных последовательностей для формирования шпилек не влияло существенно на образование альтернативных транскриптов (рис. 2б, дорожка Loop).
Таким образом, путем удаления наиболее протяженных интронов гена SERPINC1 человека с сохранением последовательностей длиной около 150 п.н. вблизи сайтов сплайсинга нами был сконструирован функциональный миниген АТ3 человека. Анализ характера сплайсинга минигена AT3 в клетках млекопитающих выявил один корректный транскрипт и два альтернативных со вставкой аберрантного экзона между первым и вторым экзонами минигена и с пропущенными вторым и третьим экзонами. Оптимизация паттерна сплайсинга минигена с помощью сайт-направленного мутагенеза криптических сайтов в первом интроне позволила эффективно предотвратить формирование альтернативных транскриптов, тогда как подход, основанный на стерическом сближении корректных сайтов сплайсинга путем введения последовательностей для формирования вторичных структур в пре-мРНК, оказался неэффективным. Кроме того, показана функциональность одного из криптических сайтов сплайсинга, находящихся в первом интроне гена SERPINС1 человека. Анализ нуклеотидной последовательности минимизированного первого интрона минигена с помощью программы Human Splicing Finder v.3.1 выявил присутствие в нем криптических сайтов сплайсинга. Таким образом, возможные сайты альтернативного сплайсинга минигена в минимизированных или гибридных интронах можно выявить еще до экспериментальной проверки паттерна сплайсинга и эффективно удалить их с помощью мутагенеза.
В целом, нами показана возможность дизайна минигенов путем удаления наиболее протяженных интронов. Описанный подход вкупе с биоинформатическим анализом нуклеотидных последовательностей интронов минигена может применяться при конструировании минигенов, используемых для получения трансгенных животных с продукцией экономически значимых рекомбинантных белков в молоке. Кроме того, минигены с интронами гена SERPINC1 человека могут использоваться для изучения влияния интронных мутаций на характер сплайсинга транскрипта AT3, которые встречаются у пациентов с недостаточностью АТ3.
В работе использована инфраструктура Центра коллективного пользования Института биологии гена Российской академии наук “Биология живой клетки и биомедицинские нанотранспортеры лекарств”.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 16-14-00150).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Luxembourg B., Delev D., Geisen C., Spannagl M., Krause M., Miesbach W., Heller C., Bergmann F., Schmeink U., Grossmann R., Lindhoff-Last E., Seifried E., Oldenburg J., Pavlova A. (2011) Molecular basis of antithrombin deficiency. Thromb. Haemost. 105, 635–646.
Konkle B.A., Bauer K.A., Weinstein R., Greist A., Holmes H.E., Bonfiglio J. (2003) Use of recombinant human antithrombin in patients with congenital antithrombin deficiency undergoing surgical procedures. Transfusion. 43, 390–394.
Paidas M.J., Triche E.W., James A.H., DeSancho M., Robinson C., Lazarchick J., Ornaghi S., Frieling J. (2016) Recombinant human antithrombin in pregnant patients with hereditary antithrombin deficiency: integrated analysis of clinical data. Am. J. Perinatol. 33, 343–349.
Shepelev M.V., Kalinichenko S.V., Deykin A.V., Korobko I.V. (2018) Production of recombinant proteins in the milk of transgenic animals: current state and prospects. Acta Naturae. 10, 40–47.
Lavine G. (2009) FDA approves first biological product derived from transgenic animal. Am. J. Health Syst. Pharm. 66(6), 518. doi https://doi.org/10.2146/news090023
Edmunds T., Van Patten S.M., Pollock J., Hanson E., Bernasconi R., Higgins E., Manavalan P., Ziomek C., Meade H., McPherson J.M., Cole E.S. (1998) Transgenically produced human antithrombin: structural and functional comparison to human plasma-derived antithrombin. Blood. 91, 4561–4571.
Palmiter R.D., Sandgren E.P., Avarbock M.R., Allen D.D., Brinster R.L. (1991) Heterologous introns can enhance expression of transgenes in mice. Proc. Natl. Acad. Sci. USA. 88, 478–482.
Choi T., Huang M., Gorman C., Jaenisch R. (1991) A generic intron increases gene expression in transgenic mice. Mol. Cell. Biol. 11, 3070–3074.
Raker V.A., Mironov A.A., Gelfand M.S., Pervouchine D.D. (2009) Modulation of alternative splicing by long-range RNA structures in Drosophila. Nucl. Acids Res. 37, 4533–4544.
Gelfand M.S. (1989) Statistical analysis of mammalian pre-mRNA splicing sites. Nucl. Acids Res. 17, 6369–6382.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


