Молекулярная биология, 2019, T. 53, № 4, стр. 654-662
Двойное мечение и синхронное наблюдение за локализацией Hsp70 и Hsf-1 в линии клеток SCC-25, выращенных при кратковременном недостатке лейцина с последующим тепловым шоком
Z. Luo a, W. Fang a, C. L. Wang b, c, d, *, W. Q. Ma a, **
a Stomatological Hospital, Southern Medical University
510280 Guangzhou, China
b Department of Stomatology, Yancheng Hospital, Medical School of Southeast University
224001 Yancheng, China
c Department of Stomatology, The Third People’s Hospital of Yancheng
224001 Yancheng, China
d Department of Stomatology, The Sixth Affiliated Hospital of Nantong University
224001 Yancheng, China
* E-mail: wangchanglin89@outlook.com
** E-mail: Maweiqun0504@outlook.com
Поступила в редакцию 07.11.2018
После доработки 31.01.2019
Принята к публикации 01.02.2019
Аннотация
Плоскоклеточный рак полости рта (OSCC) – основная причина смертности, связанной с опухолями ротовой полости. Потенциальными биомаркерами OSCC могут служить Hsf-1 и Hsp70. Разработана система мультиплексной визуализации на основе квантовых точек для синхронного наблюдения за Hsf-1 и Hsp70 после теплового шока и оценки степени инактивации Hsf-1 при комбинировании химиотерапии с лейциндепривационной терапией. Клетки линии SCC-25 растили в условиях голодания по лейцину в течение 0, 1, 2, 3 и 4 суток, после чего подвергали тепловому шоку при 42°C в течение 30 мин. Через 6 ч после действия теплового шока в клетках, не получавших лейцин в течение 0, 1 и 2 суток, наблюдали активацию Hsf-1 и его транслокацию в ядро; при этом уровень экспрессии Hsp70 и Hsf-1 достигал максимума и оба белка аккумулировались в ядре. Однако в клетках, не получавших лейцин в течение 3 или 4 суток, синтез и активность Hsf-1 и Hsp70 значительно снижались. Таким образом, отсутствие лейцина в питательной среде в течение минимум трех суток, по-видимому, приводит к инактивации Hsf-1 и тем самым к снижению синтеза Hsp70 в клетках. Следовательно, комбинация химиотерапии и лейциндепривации может стать эффективным подходом в терапии опухолей ротовой полости.
ВВЕДЕНИЕ
По всему миру, плоскоклеточный рак полости рта (OSCC) один из наиболее распространенных типов опухоли ротовой полости и челюстно-лицевой области. OSCC – основная причина смертности, связанной с опухолями ротовой полости [1–6]. В инициации и развитии OSCC участвуют транскрипционный фактор теплового шока 1 (Hsf-1) и белок теплового шока 70 (Hsp70). Активация Hsf-1 и синтез Hsp70 ассоциированы со многими процессами, ведущими к развитию опухоли. Таким образом, эта система служит потенциальным биомаркером в онкологических исследованиях [7–16].
Метаболизм аминокислот выполняет важную роль в физиологических реакциях организма. Концентрация аминокислот вносит весомый вклад в регуляцию экспрессии генов на таких уровнях, как транскрипция, стабильность мРНК и трансляция [17]. Лейцин – одна из восьми незаменимых аминокислот, недостаток которой характерен для современного рациона питания; однако внутриклеточные регуляторные механизмы лейцина до сих пор плохо изучены.
Квантовые точки (QDs) – это полупроводниковые нанокристаллы диаметром от 2 до 10 нанометров, обладающие уникальными фотофизическими свойствами, такими как контролируемая флуоресценция, высокий квантовый выход, устойчивость к фотовыцветанию [18–25]. Благодаря этим уникальным оптическим свойствам, квантовые точки имеют большой потенциал применения в многочисленных приложениях, таких как наблюдение за адресной доставкой лекарственных средств и мультиплексная оптическая визуализация [26–36].
В работе применена технология мультиплексного мечения QDs для исследования уровней и паттернов совместной локализации белков Hsp70 и Hsf-1 в клетках линии SCC-25 после теплового шока. На основании полученных результатов обсуждается возможность применения комбинации термотерапии и лейциндепривации для подавления активности Hsf-1 у больных с опухолями ротовой полости.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Первичные мышиные антитела против Hsp70 человека и первичные кроличьи антитела против Hsf-1 человека приобретены у компании “Abcam” (Великобритания). Вторичные антитела против мышиного QD525nm-IgG и кроличьего QD655nm-IgG приобретены у компании “Invitrogen” (США). Среда DMEM/F12 с добавлением или без лейцина приобретена у компании “Sigma” (США). Лазерная конфокальная микроскопия выполнена на приборе Leica TCS SP2 (“Leica Microsystems”, Германия)
Ведение клеточных культур. Клетки линии SCC-25 (плоскоклеточной карциномы языка человека) растили в среде DMEM/F12 с добавлением лейцина в атмосфере 5% CO2 при 37°C. Через 3 суток использовали 0.25%-ный раствор трипсина для перевода клеток в суспензию с последующей их культивацией на специальной посуде, совместимой с конфокальной микроскопией, до плотности 1 × 105 клеток/мл.
Выращивание клеток на среде без лейцина. Ростовую среду меняли на DMEM/F12, не содержащую лейцин. Культуры разделили на пять групп: A, Б, B, Г и Д. Клетки SCC-25 в группе A культивировали при нормальном уровне лейцина в течение 4 суток, в группе Б – при нормальном уровне лейцина в течение 3 суток, затем в течение одних суток при лейциновом голодании; в группе В – при нормальном уровне лейцина в течение 2 суток, затем в течение 2 суток при лейциновом голодании; в группе Г – при нормальном уровне лейцина в течение 1 суток, затем в течение 3 суток при лейциновом голодании; в группе Д – в безлейциновой среде в течение 4 суток.
Тепловой шок. Клетки инкубировали при 42°C в течение 30 мин и помещали в инкубатор при 37°C в течение 0 ч (группа I), 6 ч (группа II) и 10 ч (группа III).
Иммунофлуоресцентное окрашивание. Анализ иммунофлуоресценции проводили во всех группах. Клетки SCC-25 выдерживали с Triton X-100 в течение 10 мин, отмывали и инкубировали при 4°C в течение ночи с первичными мышиными антителами против Hsp70 человека или первичными кроличьми антителами против Hsf-1 человека (в разведении 1 : 100). После промывки TBS (0.02 M Трис-HCl, pH 7.2, 0.15 M NaCl) клетки в этом же буферном растворе на 10 мин помещали во влажную камеру с температурой 37°C, а затем добавляли взятые в эквивалентных соотношениях козьи антитела против IgG мыши, QD525nm-IgG, и против IgG кролика, QD655nm-IgG (оба в разведении 1 : 100), и инкубировали в течение 1 ч в той же камере. После трехкратной промывки клеток буфером TBST (TBS c 0.05% Tween-20) детектировали сигнал, соблюдая условия защиты от дневного света. Каждый эксперимент повторяли 5 раз.
Сигнал детектировали методом лазерной конфокальной микроскопии и анализировали с помощью программного обеспечения Image-Pro Plus. Данные представляли в виде среднее ± стандартное отклонение (SD). Сравнение средних между группами проводили с помощью одностороннего теста ANOVA. Отличия принимали статистически значимыми при P ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Hsp70 и Hsf-1 одновременно метили с помощью QD525nm (зеленый цвет) и QD655nm (красный цвет), конъюгированных с соответствующими антителами (см. раздел “Экспериментальная часть”).
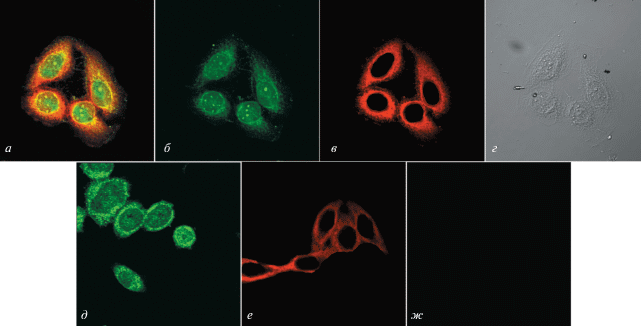
На рис. 1а представлены результаты двухцветной иммунофлуоресцентной детекции этих белков методом конфокальной микроскопии. На совмещенном изображении желтый цвет указывает на колокализацию белков. Ядро окрашено только зеленым цветом, что указывает на присутствие в нем Hsp70, но не Hsf-1. Цитоплазма окрашена только красным цветом, что указывает на присутствие в ней Hsf-1, но не Hsp70. На рис. 1б, в представлены изображения, регистрируемые соответственно в красном и зеленом монохромном канале. QD525nm-меченый Hsp70 четко виден в цитоплазме и ядре. QD655nm-меченый Hsf-1 в основном детектируется в цитоплазме. На рис. 1г представлено изображение клеток в световой микроскоп. Изображения контрольной группы клеток, полученные с помощью лазерного конфокального микроскопа, представлены на рис. 1д–ж. На рис. 1д видно, что Hsp70, меченный QD525nm, находится как в цитоплазме, так и в ядре (зеленая флуоресценция); а на рис. 1е видно, что Hsf-1, меченный QD655nm, локализуется преимущественно в цитоплазме (красная флуоресценция). На рис. 1ж представлен полученный от контрольной группы клеток темный фон (без флуоресценции).
Рис. 1.
Двухцветное иммунофлуоресцентное окрашивание Hsp70 и Hsf-1, меченных соответственно QD525nm и QD655nm. а–г – Флуоресцентное окрашивание клеток, регистрируемое в четырех каналах. Клетки инкубировали со смесью первичных антител против Hsp70 и Hsf-1, затем со смесью вторичных антител: к IgG мыши (QD525nm-IgG,) и IgG кролика (QD655nm-IgG). Регистрировали три флуоресцентных сигнала: красный, зеленый и желтый. Желтый сигнал получен совмещением красной и зеленой флуоресценции, что указывает на одновременное присутствие целевых белков в тех или иных компартментах клетки. д и е – Клетки инкубировали с равным количеством первичных антител либо против Hsp70, либо против Hsf-1 и затем со смесью вторичных антител. Только зеленую или только красную флуоресценцию наблюдали в этих контрольных клетках. ж – Клетки инкубировали с TBS в течение ночи. Флуоресцентный сигнал не регистрировали в этой контрольной группе.
Зависимость распределения Hsf-1 и Hsp70 в культуре клеток от длительности недостатка лейцина в питательной среде
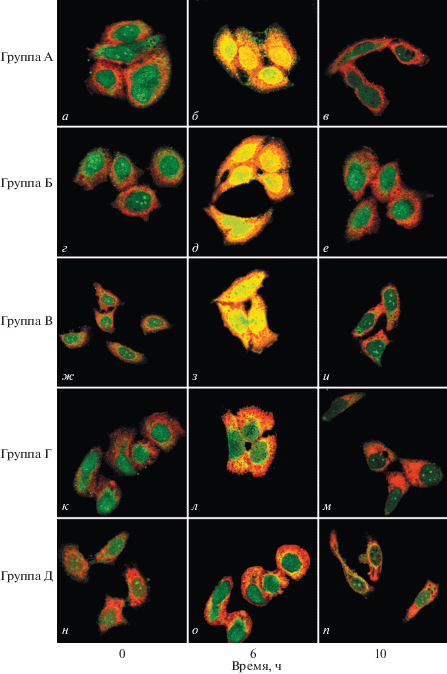
Ранее показано, что кратковременный недостаток лейцина приводит к инактивации Hsf-1, что ведет к незначительному накоплению Hsp70, который, однако, не локализуется в ядре в течение 6 ч после одночасового теплового шока. С целью оценить влияние кратковременного недостатка лейцина клеточную линию SCC-25 культивировали с ограничением по лейцину в течение 1, 2, 3 или 4 суток. Согласно результатам конфокальной микроскопии, желтая флуоресценция имеет тенденцию накапливаться в ядре (рис. 2б, д и з). Это указывает на то, что в клетках, лишенных источника лейцина в течение 0, 1 или 2 суток, белки Hsp70 и Hsf-1 имеют тенденцию собираться в ядре. Но при более длительном недостатке лейцина (3 и 4 суток), как видно из рис. 2л, о, в ядрах клеток детектируется только зеленый сигнал, а желтый исчезает, что указывает на отсутствие в них Hsf-1. Процесс активации Hsf-1 включает в себя тримеризацию, транспорт в ядро, посттрансляционные модификации и связывание с промоторными областями генов HSP посредством ДНК-связывающего домена. На основании полученных результатов можно сделать вывод о том, что недостаток лейцина в течение 3 и 4 суток ведет к инактивации Hsf-1.
Рис. 2.
Внутриклеточное распределение белков Hsp70 и Hsf-1 в клетках, выращенных при кратковременном недостатке лейцина (0, 1, 2, 3 или 4 суток) после действия теплового шока через 0 ч (а, г, ж, к, н), 6 ч (б, д, з, л, о) и 10 ч (в, е, и, м, п). Максимальный уровень Hsp70 и Hsf-1 наблюдали через 6 ч после теплового шока в клетках, выращенных при недостатке лейцина в течение 0 (б), 1 (д) и 2 (з) суток, белки локализовались преимущественно в ядре. Однако в клетках, выращенных при недостатке лейцина в течение 3 (л) и 4 (о) суток, значительного увеличения количества Hsp70 и колокализации его с Hsf-1 в ядре не наблюдали.
Полуколичественное определение Hsp70 и Hsf-1 в клетках в период восстановления после теплового шока
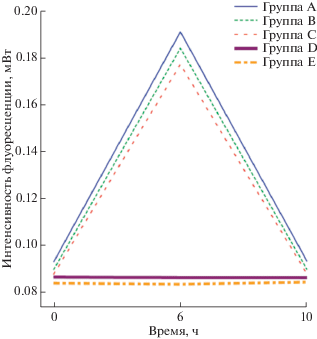
С целью оценить различия в активности Hsf-1 между группами Г и Д (клетки, выращенные при недостатке лейцина в течение 3 или 4 суток) и группами A–В (клетки, выращенные при недостатке лейцина в течение 0, 1 или 2 суток) провели полуколичественный анализ уровней содержания Hsp70 и Hsf-1. Детекцию Hsp70 и Hsf-1 повторяли 5 раз для каждой из групп клеток и полученные 65 фотофлуорограмм анализировали с помощью программного обеспечения Image-Pro Plus. Результаты представлены в виде среднего с разбросом по стандартному отклонению (mean ± SD). Как следует из результатов, представленных в табл. 1 и на рис. 3, уровень синтеза Hsp70 в клетках, выращенные при недостатке лейцина в течение 0 (группа A), 1 (группа Б) или 2 (группа В) суток, значительно повышался через 6 ч после теплового шока, но к 10 ч снижался до наблюдаемого в 0 ч. Уровень Hsp70 в клетках, которые растили в безлейциновой среде 3 (группа Г) или 4 (группа Д) суток, увеличивался незначительно в течение всего периода восстановления после теплового шока (P > 0.05). На основании этих результатов можно предполагать, что отсутствие лейцина в среде культивирования клеток SSC-25 в течение 3–4 суток приводит к инактивации Hsf-1, в то время как при лейциновом голодании в течение 2 суток (группы А, Б и В) активность Hsf-1 не изменяется статистически значимо.
Таблица 1.
Уровень Hsp70 в культуре клеток, выращенных в условиях кратковременного недостатка лейцина
| Группа клеток | Интенсивность флуоресценции, мВт | ||
|---|---|---|---|
| 0 ч | 6 ч | 10 ч | |
| А | 0.0927703 ± 0.00190486 | 0.1910320 ± 0.00076952 | 0.0930388 ± 0.00580913 |
| Б | 0.0895062 ± 0.00029818 | 0.1840492 ± 0.00227693 | 0.0895329 ± 0.00029220 |
| В | 0.0874923 ± 0.00144838 | 0.1771308 ± 0.00406705 | 0.0875726 ± 0.00139283 |
| Г | 0.0863863 ± 0.00176738 | 0.0861982 ± 0.00171748 | 0.0861598 ± 0.00171873 |
| Д | 0.0837646 ± 0.00204716 | 0.0832943 ± 0.00207270 | 0.0842418 ± 0.00195760 |
Рис. 3.
Полуколичественное определение содержания Hsp70 в культуре клеток, выращенной при кратковременном недостатке лейцина в 10-часовой период восстановления после теплового шока. Уровень Hsp70 в клетках, выращенных при недостатке лейцина в течение 0 (группа A), 1 (группа Б) или 2 (группа В) суток, значительно увеличивался к 6 ч, а к 10 ч снижался до исходного. Содержание Hsp70 в клетках, выращенных в условиях недостатка лейцина в течение 3 (группа Г) или 4 (группа Д) суток, лишь незначительно увеличивалось в течение всего периода восстановления после теплового шока.
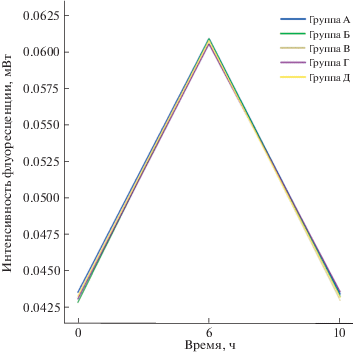
В то же время, в соответствии с результатами, представленными в табл. 2 и на рис. 4, содержание Hsf-1 в клетках, выращенных при недостатке лейцина в течение 0, 1, 2, 3 и 4 суток, значительно повышалось к 6 ч (P < 0.05), а к 10 ч снижалось до исходного уровня. Из этого следует, что значительное накопление Hsf-1 еще не означает его активации.
Таблица 2.
Уровень Hsf-1 в культуре клеток, выращенных в условиях кратковременного недостатка лейцина
| Группа клеток | Интенсивность флуоресценции, мВт | ||
|---|---|---|---|
| 0 ч | 6 ч | 10 ч | |
| А | 0.0434678 ± 0.00180207 | 0.0608726 ± 0.00048379 | 0.0433454 ± 0.00166846 |
| Б | 0.0427669 ± 0.0012037 | 0.0608477 ± 0.00050051 | 0.0431758 ± 0.00181496 |
| В | 0.0431982 ± 0.00207794 | 0.0607594 ± 0.00049496 | 0.0429011 ± 0.00098606 |
| Г | 0.0430145 ± 0.00184044 | 0.0604994 ± 0.00030535 | 0.0435094 ± 0.00198057 |
| Д | 0.0431882 ± 0.00172385 | 0.0606791 ± 0.00039471 | 0.0431186 ± 0.00196393 |
Рис. 4.
Полуколичественное определение содержания Hsf-1 в культуре клеток, выращенной при кратковременном недостатке лейцина в течение 10-часового периода восстановления после теплового шока. Содержание Hsf-1 в клетках, выращенных в условиях недостатка лейцина в течение 0, 1, 2, 3 и 4 суток (граппы А, Б, В, Г и Д соответственно) возрастало к 6 ч, а к 10 ч снижалось до исходного.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Системе HSF/HSP придается большое значение в диагностике OSCC и в противоопухолевой терапии [37–47]. В отсутствие точного количественного анализа и оценки совместной локализации Hsf-1 и Hsp70, патологам сложно классифицировать OSCC, а клиницистам принять решение о назначении стратегии лечения, например, термотерапии. Термотерапия используется при лечении пациентов с OSCC, и ее эффективность доказана. Однако действие термотерапии нейтрализуется активацией Hsf-1 и сверхэкспрессией Hsp70, поэтому ингибирование Hsf-1 и Hsp70 потенциально повысит эффективность термотерапии.
Лейцин – незаменимая аминокислота, которая не синтезируется в организме человека, а поступает в него с пищей. Ранее показано [24], что недостаток лейцина приводит к инактивации Hsf-1 и подавлению синтеза Hsp70. Совет по продовольствию и питанию Института медицины США (The Food and Nutrition Board of the U.S. Institute of Medicine, США) установил рекомендуемую суточную норму потребления лейцина для взрослых (19 лет и старше) на уровне 42 мг/кг массы тела.
С целью оценить влияние кратковременного дефицита лейцина на активность Hsp70 клетки линии SCC-25 культивировали в условиях лейцинового голодания в течение 1, 2, 3 или 4 суток. Согласно полученным результатам (табл. 1 и рис. 3), значительное увеличение содержания Hsp70 наблюдали через 6 ч после теплового шока, но только в клетках, выращенных в условиях недостатка лейцина в течение 0–2 суток. В то же время лейциновое голодание в течение 3 или 4 суток вызывало лишь незначительное увеличение содержания Hsp70 в течение всего 10-часового периода восстановления после теплового шока. На основании полученных результатов можно предположить, что недостаток лейцина в течение 3 суток и более приводит к инактивации Hsp70. Однако точные механизмы, лежащие в основе инактивации Hsp70 при низких концентраций лейцина, не известны.
С целью прояснить эти механизмы мы проанализировали уровни и паттерны локализации Hsp70 и Hsf-1 с помощью QD. Белок Hsf-1 человека состоит из нескольких доменов, которые регулируют его связывание и активность: ДНК-связывающий домен, домен олигомеризации (представлен лейциновой молнией), регуляторный домен и трансактиваторный домен. В физиологических условиях Hsf-1 существует в виде неактивного мономера. Активность мономерной формы Hsf-1 репрессирована белковым комплексом, включающим Hsp70 и Hsp90. Активация Hsf-1 опосредуется последовательной реализацией нескольких механизмов, включающих диссоциацию Hsf-1 из репрессорного комплекса, тримеризацию мономеров Hsf-1, накопление в ядре и пост-трансляционные модификации.
В результате проведенного исследования выявлено статистически значимое увеличение содержания Hsf-1 в клетках, выращенных при недостатке лейцина в течение 0, 1, 2, 3 и 4 суток, тогда как Hsf-1 в ядрах аккумулируется только при лейциновом голодании в течение 0, 1 и 2 суток (табл. 2 и рис. 3, 4). Таким образом, лейциндепривация в течение 3 суток и более приводит к инактивации Hsf-1, что, скорее всего, связано с подавлением накопления Hsf-1 в ядре, чем с диссоциацией Hsf-1 из репрессорного комплекса. Диссоциация Hsf-1 из репрессорного комплекса, как таковая, видимо, не приводит к полноценной активации Hsf-1, а скорее лишь запускает этот процесс.
В заключение можно сделать вывод о том, что система HSF/HSP вовлечена в ответ клеток OSCC на противоопухолевую терапию. Исследование кинетики Hsf-1/HSP с помощью QD позволит выяснить механизм действия и оценить эффективность сочетанного применения термотерапии и лейциндепривационной терапии у пациентов с опухолями ротовой полости. Лейциновое голодание в течение не менее 3 суток, возможно, будет блокировать побочные эффекты термотерапии OSCC, связанные с активацией Hsf-1 и сверхэкспрессией Hsp70. Сочетание термотерапии и кратковременного дефицита лейцина – для инактивации Hsf-1 – может стать новым подходом в терапии опухолей ротовой полости.
Работа выполнена при поддержке гранта Стоматологического колледжа Южного медицинского университета (Stomatological Hospital of Southern Medical University Project no. PY2017010), Китай.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Настоящая статья не содержит каких-либо исследований с использованием животных в качестве объектов.
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований.
Список литературы
Parkin D.M., Pisani P., Ferlay J. (1993) Estimates of the worldwide incidence of eighteen major cancers in 1985. Int. J. Cancer. 54, 594–606.
Kademani D. (2007) Oral cancer. Mayo Clin. Proc. 7, 878–887.
Bhattacharya S., Muhammad N., Steele R., Peng G., Ray R.B. (2016) Immunomodulatory role of bitter melon extract in inhibition of head and neck squamous cell carcinoma growth. Oncotarget. 22, 33202–33209.
Li W., Tian H., Li L., Li S., Yue W., Chen Z., Qi L., Hu W., Zhu Y., Hao B., Gao C., Si L., Gao F. (2012) Diallyl trisulfide induces apoptosis and inhibits proliferation of A549 cells in vitro and in vivo. Acta Biochim. Biophys. Sin. 7, 577–583.
Wang L., Yin W., Shi C. (2017) E3 ubiquitin ligase, RNF139, inhibits the progression of tongue cancer. BMC Cancer. 1, 452.
Kuo I.C., Kao H.K., Huang Y., Wang C.I., Yi J.S., Liang Y., Liao C.T., Yen T.C., Wu C.C, Chang K.P. (2017) Endoplasmic reticulum aminopeptidase 2 involvement in metastasis of oral cavity squamous cell carcinoma discovered by proteome profiling of primary cancer cells. Oncotarget. 37, 61698–61708.
Amberger A., Hala M., Saurwein-Teissl M., Metzler B., Grubeck-Loebenstein B., Xu Q., Wick G. (1999) Suppressive effects of anti-inflammatory agents on human endothelial cell activation and induction of heat shock proteins. Mol. Med. 2, 117–128.
Liu C.C., Jan Y.J., Ko B.S., Wu Y.M., Liang S.M., Chen S.C., Lee Y.M., Liu T.A., Chang T.C., Wang J., Shyue S.K., Sung L.Y., Liou J.Y. (2014) 14-3-3σ induces heat shock protein 70 expression in hepatocellular carcinoma. BMC Cancer. 14, 425.
Bhardwaj M., Paul S., Jakhar R., Khan I., Kang J.I., Kim H.M., Yun J.W., Lee S.J., Cho H.J., Lee H.G., Kang S.C. (2017) Vitexin confers Hsf-1 mediated autophagic cell death by activating JNK and ApoL1 in co-lorectal carcinoma cells. Oncotarget. 68, 112426–112441.
Roccisana J.L., Kawanabe N., Kajiya H., Koide M., Roodman G.D., Reddy S.V. (2004) Functional role for heat shock factors in the transcriptional regulation of human RANK ligand gene expression in stromal/osteoblast cells. J. Biol. Chem. 11, 10500–10507.
Amberger A., Hala M., Saurwein-Teissl M., Metzler B., Grubeck-Loebenstein B., Xu Q., Wick G. (1999) Suppressive effects of anti-inflammatory agents on human endothelial cell activation and induction of heat shock proteins. Mol. Med. 2, 117–128.
Cañuelo A., Gilbert-López B., Pacheco-Liñán P., Martínez-Lara E., Siles E., Miranda-Vizuete A. (2012) Tyrosol, a main phenol present in extra virgin olive oil, increases lifespan and stress resistance in Caenorhabditis elegans. Mech. Ageing Dev. 8, 563–574.
Liu C.C., Jan Y.J., Ko B.S., Wu Y.M., Liang S.M., Chen S.C., Lee Y.M., Liu T.A., Chang T.C., Wang J., Shyue S.K., Sung L.Y., Liou J.Y. (2014) 14-3-3σ induces heat shock protein 70 expression in hepatocellular carcinoma. BMC Cancer. 14, 425.
Markopoulos A.K., Deligianni E., Antoniades D.Z. (2009) Heat shock protein 70 membrane expression in oral cancer: a possible new target in antineoplastic therapy? Chemotherapy. 55, 211–214.
Voellmy R., Zürcher O., Zürcher M., de Viragh P.A., Hall A.K., Roberts S.M. (2018) Targeted heat activation of HSP promoters in the skin of mammalian animals and humans. Cell Stress Chaperones. 4, 455–466.
Le Masson F., Christians E. (2011) HSFs and regulation of Hsp70.1 (Hspa1b) in oocytes and preimplantation embryos: new insights brought by transgenic and knockout mouse models. Cell Stress Chaperones. 3, 275–285
Eliasen M.M., Brabeu M., Gerner C., Pollheimer J., Auer H., Zellner M., Weinqartmann G., Garo F., Roth E., Oehler R. (2006) Reduced stress tolerance of glutamine-deprived human monocytic cells is associated with selective down-regulation of Hsp70 by decreased mRNA stability. J. Mol. Med. 84, 147–158
Rizvi S.B., Rouhi S., Taniguchi S., Yang S.Y., Green M., Keshtgar M., Seifalian A.M. (2014) Near-infrared quantum dots for HER2 localization and imaging of cancer cells. Int. J. Nanomedicine. 9, 1323–1337.
Soenen S.J., Manshian B.B., Aubert T., Himmelreich U., Demeester J., De Smedt S.C., Hens Z., Braeckmans K. (2014) Cytotoxicity of cadmium-free quantum dots and their use in cell bioimaging. Chem. Res. Toxicol. 6, 1050–1059.
Benito-Alifonso D., Tremel S., Hou B., Lockyear H., Mantell J., Fermin D.J., Verkade P., Berry M., Ga-lan M.C. (2014) Lactose as a “Trojan horse” for quantum dot cell transport. Angew Chem. Int. Ed. Engl. 3, 810–814.
Pan X., Li Z., Wang T., Xie J., Wang P.N., Chen J.Y., Chen L., Mi L. (2014) Study of polycation-capped Mn:ZnSe quantum dots as a novel fluorescent probe for living cells. J. Fluoresc. 3, 767–774.
Tan L., Wan A., Li H. (2014) Synthesis of near-infrared quantum dots in cultured cancer cells. ACS Appl. Mater. Interfaces. 1, 18–23.
Zhao J.J., Chen J., Wang Z.P., Pan J., Huang Y.H. (2011) Double labeling and comparison of fluorescence intensity and photostability between quantum dots and FITC in oral tumors. Mol. Med. Report. 4, 425–429.
Chen J., Pan J., Zhao J., Qiu X., Zheng J., Wang Z., Huang Y., Chu H. (2013) Quantum dot imaging for Hsp70 and Hsf-1 kinetics in SCC‑25 cells with or without leucine deprivation following heat shock. Oncol. Rep. 29, 2255–2260.
Hanaki K., Momo A., Oku T., Komoto A., Maenosono S., Yamaguchi Y., Yamamoto K. (2003) Semiconductor quantum dot/albumin complex is a long-life and highly photostable endosome marker. Biochem. Biophys. Res. Commun. 302, 496–501.
Madani S.Y., Shabani F., Dwek M.V., Seifalian A.M. (2013) Conjugation of quantum dots on carbon nanotubes for medical diagnosis and treatment. Int. J. Nanomedicine. 8, 941–950.
Chen H., Zhang M., Li B., Chen D., Dong X., Wang Y., Gu Y. (2015) Versatile antimicrobial peptide-based ZnO quantum dots for in vivo bacteria diagnosis and treatment with high specificity. Biomaterials. 53, 532–544.
Tripathi S.K., Kaur G., Khurana R.K., Kapoor S., Singh B. (2015) Quantum dots and their potential role in cancer theranostics. Crit. Rev. Ther. Drug Carrier Syst. 6, 461–502.
Han S., Xia T., Li Q., Guo J., Lu P. (2013) Application of functional quantum dots in cancer diagnosis and therapy: a review. Sheng Wu Gong Cheng Xue Bao. 1, 10–20.
Alexiou A., Vairaktarakis C., Tsiamis V., Ashraf G.M. (2015) Application of efficient nanoparticles for early diagnosis and treatment of cancer. Curr. Drug Metab. 8, 662–675.
Hutter E., Maysinger D. (2011) Gold nanoparticles and quantum dots for bioimaging. Microsc. Res. Tech. 7, 592–604.
Nair L.V., Nagaoka Y., Maekawa T., Sakthikumar D., Jayasree R.S. (2014) Quantum dot tailored to single wall carbon nanotubes: a multifunctional hybrid nanoconstruct for cellular imaging and targeted photothermal therapy. Small. 14, 2771–2775.
Acharya A. (2013) Luminescent magnetic quantum dots for in vitro/in vivo imaging and applications in therapeutics. J. Nanosci. Nanotechnol. 6, 3753–3768.
Sigot V. (2014) Assembly, characterization, and delivery of quantum dot labeled biotinylated lipid particles. Methods Mol. Biol. 1199, 113–127.
Chinnathambi S., Chen S., Ganesan S., Hanagata N. (2014) Silicon quantum dots for biological applications. Adv. Healthc. Mater. 1, 10–29.
Gao X., Liu Z., Lin Z., Su X. (2014) CuInS(2) quantum dots/poly((L)-glutamic acid)-drug conjugates for drug delivery and cell imaging. Analyst. 4, 831–836.
Zepeda A.B., Figueroa C.A., Abdalla D.S., Maranhão A.Q., Ulloa P.H., Pessoa A., Jr., Farías J.G. (2014) Hsf-1, HIF-1 and HSP90 expression on recombinant Pichia pastoris under fed-batch fermentation. Braz. J. Microbiol. 2, 485–490.
Singh V., Aballay A. (2006) Heat shock and genetic activation of Hsf-1 enhance immunity to bacteria. Cell Cycle. 21, 2443–2446.
Bijur G.N., Jope R.S. (2000) Opposing actions of phosphatidylinositol 3-kinase and glycogen synthase kinase-3beta in the regulation of Hsf-1 activity. J. Neurochem. 6, 2401–2408.
Thakur P., Nehru B. (2014) Long-term heat shock proteins (HSPs) induction by carbenoxolone improves hallmark features of Parkinson’s disease in arotenone-based model. Neuropharmacology. 79, 190–200.
Johnson J.R., Rajamanoharan D., McCue H.V., Rankin K., Barclay J.W. (2016) Small heat shock proteins are novel common determinants of alcohol and nicotine sensitivity in Caenorhabditis elegans. Genetics. 3, 1013–1027.
Lam K.K., Cheng P.Y., Lee Y.M., Liu Y.P., Ding C., Liu W.H., Yen M.H. (2013) The role of heat shock protein 70 in the protective effect of YC-1 on heat stroke rats. Eur. J. Pharmacol. 1, 67–73.
Ganguly S., Home T., Yacoub A., Kambhampati S., Shi H., Dandawate P., Padhye S., Saluja A.K., McGuirk J., Rao R. (2015) Targeting HSF1 disrupts HSP90 chaperone function in chronic lymphocytic leukemia. Oncotarget. 31, 31767–31779.
Mortaz E., Redegeld F.A., Nijkamp F.P., Wong H.R., Engels F. (2006) Acetylsalicylic acid-induced release of Hsp70 from mast cells results in cell activation through TLR pathway. Exp. Hematol. 1, 8–18.
Horowitz M., Robinson S.D. (2007) Heat shock proteins and the heat shock response during hyperthermia and its modulation by altered physiological conditions. Prog. Brain Res. 162, 433–446.
Reuter S., Bangen P., Edemir B., Hillebrand U., Pavenstädt H., Heidenreich S., Lang D. (2009) The HSP72 stress response of monocytes from patients on haemodialysis is impaired. Nephrol. Dial. Transplant. 9, 2838–2846.
Hensen S.M., Heldens L., van Enckevort C.M., van Genesen S.T., Pruijn G.J., Lubsen N.H. (2012) Heat shock factor 1 is inactivated by amino acid deprivation. Cell Stress Chaperones. 17, 743–755.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


