Молекулярная биология, 2019, T. 53, № 4, стр. 663-673
Особенности структуры и экспрессии генов NPM и NCL при меланоме кожи
Д. А. Понкратова a, А. А. Лушникова a, *
a Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
Министерства здравоохранения Российской Федерации
115478 Москва, Россия
* E-mail: LAN21@yandex.ru
Поступила в редакцию 12.02.2019
После доработки 05.03.2019
Принята к публикации 07.03.2019
Аннотация
Злокачественная меланома кожи (МК) – крайне агрессивное онкологическое заболевание, для которого характерны высокая метастатическая активность, неблагоприятный прогноз, высокая частота рецидивов, а также резистентность к большинству видов лекарственной терапии. На долю МК приходится 80% летальных исходов от всех злокачественных новообразований кожи. Перспективными мишенями для молекулярной терапии меланомы считаются белки нуклеолин/С23 и нуклеофозмин/В23, которые вместе составляют около 70% объема ядрышек. Эти белки выполняют в клетке множество важных функций. Нарушение структуры генов NCL и/или NPM и экспрессии кодируемых ими белков С23 и В23 может приводить к неограниченной клеточной пролиферации и развитию опухолей. Именно поэтому исследование структуры и экспрессии генов, кодирующих белки С23 и В23, представляет собой актуальную проблему, решение которой необходимо для понимания механизмов канцерогенеза МК и разработки новых терапевтических подходов. В статье представлены данные о новых полиморфных вариантах генов NCL и NPM, а также результаты исследования экспрессии кодируемых ими белков в нормальной и опухолевой ткани больных МК и меланомой слизистых оболочек.
ВВЕДЕНИЕ
Злокачественная меланома кожи (МК) – крайне агрессивное онкологическое заболевание, возникающее в результате неопластической трансформации меланоцитов и меланобластов. Для МК характерны высокая метастатическая активность и неблагоприятный прогноз. В 2016 году заболеваемость МК в России составила, в среднем, 59.3 на 100 тыс. населения [1]. Для распространенной МК характерна высокая частота рецидивов, а также резистентность к большинству лекарственных препаратов. На долю МК приходится 80% летальных исходов от всех злокачественных новообразований кожи, одна из причин высокой смертности – трудность диагностики на ранних стадиях развития заболевания.
Молекулярно-генетические подходы при исследовании МК важны для разработки методов ранней диагностики, профилактики и лечения этого заболевания. Благодаря молекулярно направленной (таргетной) терапии, стал возможным персонализированный подход к лечению МК, улучшающий выживаемость и качество жизни пациентов. Однако в большинстве случаев используемые таргетные препараты оказывают кратковременное действие, вызывая стабилизацию опухолевого процесса с последующим развитием резистентности к большинству лекарственных средств. Эту проблему можно преодолеть путем разработки подходов для адресной доставки молекулярно-направленных препаратов в опухолевые клетки. Это позволит снизить лекарственную токсичность и улучшить лечебный патоморфоз.
Перспективными мишенями для молекулярной терапии МК могут служить белки нуклеолин/С23 и нуклеофозмин/В23, которые составляют около 70% объема ядрышек. Эти белки вовлечены в регуляцию функций РНК-полимеразы, участвуют в транскрипции, репликации и рекомбинации ДНК, процессинге рРНК, стабилизации структуры клеточных белков, хроматина и мРНК, регулируют митоз и апоптоз. Они выполняют транспортную функцию, а также контролируют клеточный сигналинг и ангиогенез. Нарушение структуры генов NCL и/или NPM, изменение уровня экспрессии кодируемых ими белков С23 и В23 приводит к неограниченной клеточной пролиферации и развитию опухолей. Таким образом, исследование структуры и экспрессии генов NCL и NPM важно для понимания механизмов канцерогенеза МК и разработки новых терапевтических подходов.
Нуклеофозмин (В23, NPM), или ньюматрин, относится к семейству многофункциональных негистоновых белков с высоко консервативной структурой. Нуклеофозмин играет ключевую роль во многих процессах жизнедеятельности клетки, включая репарацию ДНК, биогенез рибосом, процессинг мРНК, реконструкцию хроматина, регуляцию апоптоза, ангиогенеза, контроль клеточного цикла, сигналинг и стабилизацию генома [2].
Ген NPM, кодирующий белок В23, картирован на хромосоме 5q35. Он состоит из 12 экзонов и 11 интронов [3]. На 5'-концевом участке нуклеотидной последовательности NPM идентифицирован сайт связывания с транскрипционным фактором YY1 [4]. Первый интрон гена NPM содержит последовательность, с которой связывается онкогенный фактор транскрипции с-Мус [5]. Еще одна важная структурная особенность гена NPM – наличие так называемого “сайта ломкости”, локализованного в последовательности интрона 4, где наиболее часто происходят транслокации генов и протяженных участков хромосом. В таких случаях образуются слитные (fusion) белки, обнаруженные в некоторых типах неопластических клеток [4, 6]. В результате альтернативного сплайсинга пре-мРНК, транскрибируемой с гена NPM, образуется 3 изоформы белка: первая содержит 294 аминокислотных остатка, вторая – 259 вследствие делеции экзона 12, третья – 265 из-за делеции последовательности вблизи 3'-конца пре-мРНК [7–9].
В молекуле В23 имеются уникальные области, ответственные за олигомеризацию, шаперонную активность, связывание с нуклеиновыми кислотами и белками [10, 11]. Первые 15 аминокислотных остатков в молекуле В23 обогащены метионином, однако функциональное значение этого мотива до конца не выяснено. Возможно, он ускоряет процесс инициации трансляции других белков, так как метиониновые кодоны входят в состав консенсусной последовательности Козак, фланкирующей старт-кодон и важной для трансляции. Met-богатый аминокислотный мотив может повлиять на конформацию молекулы В23. Кислые, отрицательно заряженные, мотивы участвуют в связывании нуклеофозмина с гистонами. В состав С-концевого домена входят ароматические радикалы, взаимодействующие с нуклеиновыми кислотами, сайты связывания молекул ATP и гистонов. Известно, что С-концевой домен обладает рибонуклеазной активностью и содержит сигнал ядрышковой локализации (NoLS) [12]. Кроме того, этот домен В23 вовлечен в специфичное распознавание G-квадруплексов – последовательностей ДНК, обогащенных гуанином и имеющих специфичную 4-цепочную структуру [13, 14].
Функциональная активность молекул В23 зависит от степени фосфорилирования. В молекуле В23 есть несколько сайтов фосфорилирования: для серинтреониновой протеинкиназы PLK2 из семейства polo-киназ, тирозинфосфатазы CDC 25C из семейства фосфатаз Cdc-25, ядерной протеинкиназы NII и казеинкиназы СК II [15]. Фосфорилирование молекул В23 чрезвычайно важно для регуляции клеточного цикла и контролируется также пептидилпролил-цис/транс-изомеразой, а нарушение этого процесса резко снижает пролиферацию клеток и опухолевую прогрессию [16]. Фосфорилирование Ser4 в молекуле В23 киназой PLK2 опосредует прохождение клеткой контрольной точки в фазе G1/S и дупликацию центромеры в S-фазе митоза [17]. Известно, что фосфорилирование молекул В23 по остаткам Ser4 и Thr199, Thr234, Thr237 связано с высокой метастатической активностью гепатоцеллюлярной карциномы, рака предстательной железы, рака легкого и ряда других сóлидных опухолей [18]. Показано также, что функциональная активность молекул В23 зависит от фосфорилирования остатков Ser10 и Ser70 циклинзависимой киназой 2 (Cdk2). Обнаружено, что одновременная инактивация фосфорилирования этих аминокислотных остатков молекулы В23 в клетках мышиного лейкоза ускоряет прохождение фазы G2/М клеточного цикла и прохождение клеткой контрольной точки G2/М [17]. Фосфорилирование В23 протеинкиназой СК II крайне важно для распределения молекул В23 в клеточном ядре. Нарушение взаимодействия В23 и СК II приводит к снижению скорости пролиферации и к индукции апоптоза [19]. Фосфорилирование по Ser125 вызывает диссоциацию субстрата от В23. Фосфорилирование по этому остатку, помимо того, изменяет способность В23 к внутриклеточным и внутриядерным перемещениям [20 ] .
Дефосфорилирование В23 в клетке происходит с помощью локализованной в ядрышках δ-изоформы протеинфосфотазы типа I – серинтреониновой фосфатазы [21].
Кроме фосфорилирования, модификация молекул В23 возможна путем ацетилирования, убиквитинирования и связывания с убиквитинподобными белками-модификаторами (SUMO), белками-супрессорами BRCA2 и р53, протеазами SENP3 и SENP5. Эти пока не до конца изученные процессы играют определенную роль в активации и поддержании стабильной структуры ядрышка, обеспечивая его функции [22, 23]. Молекулы В23, локализованные на плазматической мембране, гликозилированы и связываются с различными вне- и внутриклеточными лигандами, регулируя молекулярный транспорт и сигналинг [24].
Кроме фосфорилирования и других модификаций, на функции В23 влияет олигомеризация и местоположение в клетке. Олигомеризация молекул В23 усиливает их шаперонную активность, увеличивает сродство к нуклеиновым кислотам и белкам и ускоряет созревание рибосом. Мономеры В23 ассоциируют с образованием пентамерных ассиметрично заряженных комплексов, так что положительный и отрицательный заряды распределяются снаружи в области полюсов олигомера. Это способствует взаимодействию нуклеофозмина как с гистонами хроматина, так и с нуклеиновыми кислотами, а также с различными по заряду белками. Пентамеры могут объединяться в декамер, сохраняющий структурную пластичность благодаря “гибкому” межмолекулярному интерфейсу [25]. Олигомеризация В23 in vivo в виде гексамера стимулирует экспрессию целого ряда генов, что указывает на онкогенную активность В23 [7, 26]. В последнее время предложены подходы к ингибированию процессов олигомеризации и деградации В23 путем связывания с соответствующими лигандами, что позволяет рассматривать нуклеофозмин как перспективную мишень для молекулярно-направленной таргетной терапии быстрорастущих и устойчивых к химиотерапии опухолей человека [27]. Экспрессия, локализация и олигомеризация обусловливают про- или антиапоптотические свойства белка как в нетрансформированных, так и в опухолевых клетках.
Нуклеолин (С23, или NCL) высоко экспрессирован в быстро растущих клетках и входит в состав фибриллярного и, в меньшей степени, гранулярного компонентов ядрышек. Это многофункциональный белок, связывающий как РНК, так и белки и участвующий в сборке хроматина, межмолекулярных взаимодействиях и внутриклеточном транспорте молекул, формировании множественной лекарственной устойчивости опухолевых клеток. Нуклеолин/С23 участвует также в регуляции биогенеза рибосом, включая регуляцию транскрипции генов, кодирующих рРНК, в процессинге пре-рРНК и сборке рибосомных субъединиц. Кроме того, С23 обладает аутопротеолитической активностью, а также контролирует метаболизм ДНК и РНК, опосредуя функции ДНК- и РНК-хеликаз и ДНК-зависимой ATPазы [28].
Ген NCL, кодирующий C23, картирован на хромосоме 2q37.1. Он содержит 14 экзонов и 13 интронов протяженностью около 11 т.п.н., причем интрон 11 кодирует малую ядерную РНК U20. Молекула C23 состоит из 710 аминокислотных остатков, на N-конце локализовано несколько сайтов фосфорилирования, важных для регуляции транскрипции мРНК и созревания пре-рРНК. Центральный участок молекулы содержит четыре РНК-связывающих домена (RBD), C-концевая область – Arg/Gly-обогащенные структурные домены (RGG), взаимодействующие с мРНК и рибосомными белками [29].
В клетке С23 локализуется преимущественно в ядре, а также в цитоплазме и на поверхности клеточной мембраны. Молекулы С23 в цитоплазматической фракции участвуют в транспорте в клеточное ядро различных белков и регулируют протеолиз, метилирование и фосфорилирование киназами СК II, CDC 2 других белков путем специфического связывания с белковыми молекулами и фолдинга. Молекулы С23, локализованные на поверхности клеток, располагаются кластерами в липидном слое клеточной мембраны и взаимодействуют с различными лигандами, включая факторы роста, вирусные и другие белки. Затем эти комплексы проникают в клетку путем эндоцитоза. Рецепторные молекулы С23 на поверхности клеток гликозилированы и содержат О-, N-связанные гликаны, в состав которых входит сиаловая кислота [28, 30]. В молекулах поверхностного С23 нет гидрофобного трансмембранного домена для заякоривания в плазматической мембране, поэтому они связываются с тяжелой цепью внутриклеточного миозина и с актиновым цитоскелетом [31–33]. Большинство лигандов поверхностного С23 играет критическую роль в онкогенезе и ангиогенезе. Таким образом, молекулы С23 на поверхности мембраны функционируют как медиаторы внеклеточных сигналов [31].
Экспрессия С23 опосредует целый ряд жизненно важных для клетки процессов: сигналинг, молекулярный транспорт, фолдинг и ренатурацию белков, сборку хроматина и митотического веретена, рекомбинацию и репликацию ДНК, транскрипцию РНК РНК-полимеразой I и процессинг рРНК, стабилизацию мРНК, прохождение клеточного цикла и апоптоз [28]. Цель данной работы – анализ полиморфизма генов NCL и NPM, а также экспрессии кодируемых ими белков в нормальной и опухолевой ткани больных МК и меланомой слизистых оболочек.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В работе использованы образцы опухолей и нормальной ткани, полученные от 137 пациентов с метастатической МК (60 мужчин и 77 женщин, средний возраст 52–53 года), и образцы опухолей, полученные от 18 пациентов с меланомой слизистых оболочек (1 мужчина и 17 женщин, средний возраст 54 года). В парах опухоль–норма в качестве контроля использовали образцы верифицированной патологоанатомом нормальной ткани тех же пациентов (внутренний контроль) и образцы крови 94 здоровых лиц (популяционный контроль). В группе здоровых были только индивиды с неотягощенной семейной историей и отсутствием хронических заболеваний в анамнезе; соотношение полов и средний возраст исследуемых пациентов и контрольной группы статистически не различались.
ПЦР генов NCL и NPM. Геномную ДНК выделяли из срезов свежезамороженной биопсийной ткани или парафинированных срезов архивного материала, верифицированного патологоанатомом, а также из образцов крови с помощью набора АмплиПрайм®ДНК-сорб-В (“ИнтерЛабСервис”, Россия), согласно инструкции производителя. Для ПЦР использовали готовые наборы производства НПО “СибЭнзим” (Россия) с ДНК-полимеразой Hot Start. Праймеры, подобранные к “горячим” точкам генов NCL и NPM, приведены в табл. 1. Реакцию проводили в тонкостенных пробирках для ПЦР на амплификаторе “Терцик-1” (НПФ “ДНК-Технология”, Россия), как описано ранее [33]. Полученные ПЦР-продукты анализировали электрофорезом в ПААГ с последующим секвенированием в Центре коллективного пользования “Геном” (Россия) на автоматическом секвенаторе ABI PRISM® (“Applied Biosystems”, США).
Таблица 1.
Праймеры для амплификации последовательностей генов NCL и NPM
| № | Названиеa | Последовательность (5' → 3') | Тотжb, °C |
|---|---|---|---|
| 1 | NPM_Ex7_For NPM_Ex7_Rev |
AAGTTCCTTTTCCCATGTGC GAACAAGAGCTGTTCTATCACCAA |
59 |
| 2 | NPM_Ex8_For NPM_Ex8_Rev |
TCACTTCAAGGTCCTGCTTTC ATGATCTCCCACACCAGCTT |
59 |
| 3 | NPM_Ex10_For NPM_Ex10_Rev |
AGCTTTATAAGGGAGTTTTGTGAGAA AAACATTCAAGTCTATGCAAACCA |
58 |
| 4 | NCL_Ex2_For NCL_Ex2_Rev |
GCGTATGAACACTAATGGCAAA TTGCCACAGATATCCAATTTCA |
58 |
| 5 | NCL_Ex3_For NCL_Ex3_Rev |
GGGGCTGGACTTACTGGTTT CTTGGCATTCTTGCCATTCT |
58 |
| 6 | NCL_Ex3_For1 NCL_Ex3_Rev1 |
CAGCCAAAGCAGTTACCACA ACCTTGTAATCAGAAGCCCAGT |
58 |
| 7 | NCL_Ex4_For NCL_Ex4_Rev |
TGTTGGTTTTGGGAGATTGC CCTCCTTTAAACATAACTCATGTCG |
58 |
Анализ экспрессии генов NCL и NPM. Для анализа экспрессии генов NCL и NPM тотальную клеточную РНК выделяли из исследуемых образцов тканей пациента (из нормальной и опухолевой свежезамороженной ткани, и/или срезов архивного материала) с помощью набора NucleoSpin RNAIIMN (“Macherey-Nagel”, Германия) по инструкции производителя. Для первого раунда ПЦР использовали набор с MMLV-полимеразой и протокол для ПЦР с обратной транскрипцией (ОТ-ПЦР) с использованием случайных праймеров (М13), предложенный производителем (“Silех”, Россия). Для второго раунда ОТ-ПЦР на матрице кДНК использовали пары праймеров, приведенные в табл. 2.
Таблица 2.
Праймеры для второго раунда ОТ-ПЦР на матрице кДНК
| № | Названиеa | Последовательность (5' → 3') | Тотжb, °C |
|---|---|---|---|
| 1 | NCL_For NCL_Rev |
AACCTCTCCTACAGTGCAACA CTGGCTTCTGGCATTAGGTG |
60 |
| 2 | Gapdh_For Gapdh_Rev |
GATGATCTTGAGGCTGTTGTC CAGGGCTGCTTTTAACTCTG |
60 |
| 3 | β-actin_For β-actin_Rev |
TCCTGTGGCATCCACGAAACT GAAGCATTTGCGGTGGACGAT |
60 |
Иммуногистохимическое исследование экспрессии белков С23 и В23. Для визуализации белков С23 и В23 использовали иммуногистохимическое окрашивание срезов, полученных из свежезамороженного биопсийного материала, и гуманизированные моноклональные антитела, анти-NCL и анти-NPM, меченные биотином (“Sigma Aldrich”, США), в разведении 1 : 1000 и систему EnVision с пероксидазой хрена (НПО “Лабораторная диагностика”, Россия) – по инструкции производителя. Для количественного анализа уровней экспрессии С23 и В23 изображения (не менее 20 полей зрения) анализировали под микроскопом ZEISS LSM (“ZEISS”, Германия) с помощью пакета программ MatLab 7.0 (https://imagej.nih.gov/ij/). Определяли соотношение суммарной площади окрашенных гранул (в пикселях) к суммарной площади клеток (в пикселях) в выбранном поле зрения с поправкой на коэффициент контрастности k. Статистически значимыми считали различия при р < 0.05.
Статистический анализ. Для статистической обработки данных использовали программу Statistica 6.1: t-тест Стьюдента (достоверность различий между частотой встречаемости полиморфных вариантов в исследуемых выборках), критерий Спирмена (оценка корреляции между полиморфными вариантами и экспрессией исследуемых белков). Достоверными считали различия при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Изменения в структуре генов NPM и NCL
В исследованных контрольных и клинических образцах МК с помощью ПЦР c последующим прямым секвенированием ампликонов по Сенгеру выявлены структурные изменения генов NPM и NCL, затрагивающие преимущественно интронные последовательности. Для удобства сравнения описываемые изменения обозначены как полиморфные варианты – ПВ (табл. 3).
Таблица 3.
Обнаруженные полиморфные варианты генов NCL и NРМ у больных МК и здоровых индивидов
| Ген | Вариант | Структура* |
|---|---|---|
| NРМ | ПВ1 | IVS5 – 31G/A IVS6 + 42G/A |
| NРМ | ПВ4 | IVS6 – 39A/G + (–42C/A) |
| NРМ | ПВ5 | IVS8 – 63A/G |
| NCL | ПВ2 | IVS2 + 31G/A |
| NCL | ПВ3 | 149 GAG/GAA p.E149E, exon 3 |
| NCL | del | del c.255GAT, exon 4 |
Эти изменения не ограничены соматическими клетками, поскольку представлены как в опухолевой, так и в нормальной тканях и носят популяционный характер. При сравнении с базами данных BLAST 2.0, Ensembl, Cosmic оказалось, что выявленные нами структурные особенности генов NPM и NCL описаны впервые – за исключением ПВ3 [34]. Эти ПВ встречались как самостоятельно, так и в комбинациях с другими полиморфными вариантами генов NPM и NCL. У пациентов с МК обнаружено несколько гаплотипов, ранее не выявленных у здоровых лиц.
Сравнительный анализ частот встречаемости и комбинаций полиморфных вариантов NCL и NPM в образцах опухолей и нормальных тканей
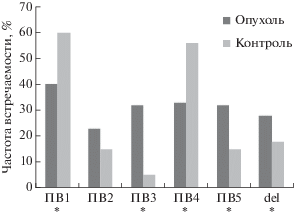
При электрофоретическом анализе ПЦР-продуктов, полученных на матрице ДНК из клинических образцов с последующим секвенированием, обнаружено, что частота встречаемости ПВ1 (40%) у пациентов с МК выше, чем частоты ПВ3–5 и del (ПВ3 – 32%, ПВ4 – 33%, ПВ5 – 32%) и ПВ2 (23%). При сравнении частот и спектра указанных ПВ у пациентов с МК и здоровых лиц в контрольной группе выявлены достоверные различия по всем парам ПВ, кроме ПВ2 (рис. 1).
Рис. 1.
Сравнение частот встречаемости полиморфных вариантов генов NCL и NРМ у пациентов с МК и в контрольной группе. *р < 0.05.
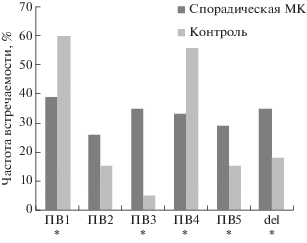
Среди исследуемой выборки 63% составили пациенты со спорадической МК. В эту группу вошли больные МК без первично-множественных злокачественных образований, без онкологических заболеваний в семье и без МК, возникших на фоне невуса, так как невусы относятся к факторам высокого риска развития меланомы. В результате проведенного сравнительного анализа выявлено, что спектры ПВ при спорадической МК и в контроле сходные, однако эти группы достоверно различаются по частоте ПВ1, ПВ3, ПВ4 и ПВ5 (рис. 2).
Рис. 2.
Сравнение частот встречаемости полиморфных вариантов генов NCL и NРМ у пациентов со спорадической МК и в контрольной группе. *р < 0.05.
У здоровых лиц в контрольной группе изменения в гене NCL встречаются реже, чем у пациентов с МК. Наиболее часто в обеих группах встречаются ПВ в гене NPM (рис. 3).
Рис. 3.
Сравнение суммарных частот структурных изменений в генах NPM и NCL. N – суммарное число всех ПВ, обнаруженных в выборках.
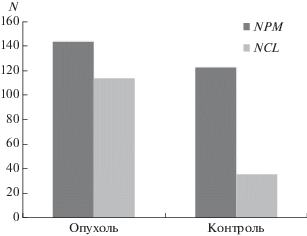
Для больных с меланомой слизистых характерны высокие частоты ПВ4, ПВ3, ПВ2 и del, а также уникальные комбинации ПВ. Для пациентов с МК характерна высокая частота ПВ1–3 и ПВ5, а также del (экзон 4 NCL). У здоровых лиц отмечена высокая частота ПВ1 (60%) и ПВ4 (56%).
Для пациентов с МК характерны единичные ПВ, комбинации двух и трех ПВ в обоих генах и высокий полиморфизм гена NPM. В контрольной группе преобладают комбинации двух ПВ, в основном в гене NPM, и наиболее часто – комбинация ПВ1 + ПВ4 (рис. 4).
Рис. 4.
Комбинации ПВ генов NCL и NPM у пациентов с МК (а) и в контрольной группе (б), N – число случаев с различными комбинациями ПВ в двух генах.
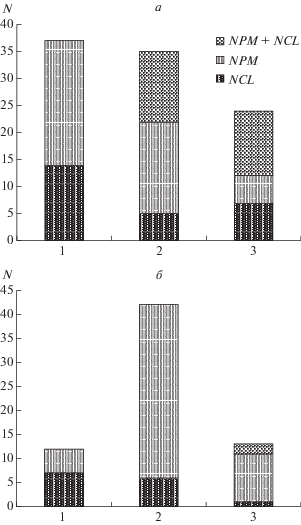
Рис. 5.
Суммарная частота полиморфных вариантов генов NCL и NPM у пациентов с МК и в контрольной группе. N – число случаев с различными комбинациями ПВ в двух генах.
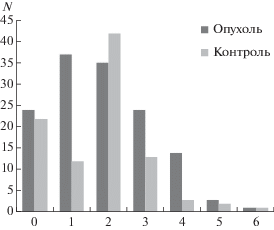
Пациенты с МК и контрольная группа существенно отличались по числу выявленных в комбинациях ПВ. В целом, частота комбинаций одного, двух, трех и четырех ПВ у пациентов с МК выше, чем у здоровых индивидов. Комбинации пяти и шести ПВ обнаружены лишь в единичных случаях (рис. 5). Как указывалось выше, для пациентов с МК характерны единичные ПВ, комбинации двух и трех ПВ в обоих генах и высокий полиморфизм гена NPM, а также специфичные комбинации ПВ, отличающие их от популяции здоровых лиц.
Клинико-генетический анализ
У пациентов со сходной локализацией и гистологией опухоли, а также сходным спектром генетических изменений наблюдали различия в течении опухолевого процесса. Четкой взаимосвязи клинических характеристик и генетических изменений не обнаружено. Однако у пациентов со спорадической МК комбинацию ПВ1 + ПВ5 в гене NPM выявляли чаще, чем в контрольной группе: 8/89 и 1/94 соответственно. Во всех этих случаях наблюдалось отдаленное метастазирование МК в легкие и головной мозг, что снижает пятилетнюю выживаемость до 10–15%. Для подтверждения и корректной интерпретации этих результатов необходимы дальнейшие исследования.
Анализ экспрессии генов NPM и NCL в клетках МК и в нормальной ткани
Большой интерес представляет изучение особенностей экспрессии белков С23 и В23 в метастатической меланоме. При сравнительном анализе уровней мРНК этих белков в опухолевой и нормальной ткани больных с метастатической МК обнаружены высокие уровни экспрессии генов NPM и NCL в опухоли, что может быть связано с эпигенетической регуляцией их активности.
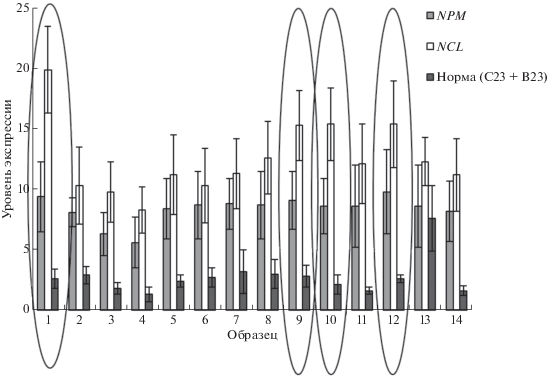
При иммуногистохимическом исследовании окрашенных попарных срезов опухолевой и нормальной ткани у 15 пациентов с метастатической МК выявлены следующие закономерности. Во-первых, уровень экспрессии С23 во всех случаях выше уровня экспрессии В23; причем относительно высокий уровень экспрессии С23 и В23 обнаружен в опухолях пациентов с отдаленными метастазами в головной мозг. Таким образом, гиперэкспрессии С23 и В23 может быть прогностическим маркером неблагоприятного течения МК (рис. 6). Во-вторых, наблюдается корреляция уровней экспрессии этих белков в опухолевых клетках (r = 0.79; р < 0.05).
Рис. 6.
Иммуногистохимический анализ экспрессии белков С23 (NPM) и В23 (NCL) в опухоли и в нормальной ткани (Норма) пациентов с МК. Овалом выделены случаи МК с отдаленным метастазированием.
С помощью критерия Спирмена выявлено:
1) ПВ1 отрицательно коррелирует с del (r = –0.70; р < 0.05). Частота встречаемости ПВ1 и del среди больных МК составляет 14 из 137 (10%) случаев.
2) ПВ1 отрицательно коррелирует с экспрессией С23 (r = –0.59; р < 0.05). ПВ1 локализован в гене NPM, однако его наличие отрицательно влияет на уровень экспрессии NCL. Напротив, при отсутствии структурных изменений в гене NPM (дикий тип) уровень экспрессии С23 высокий – в диапазоне от 15 до 19, исключение составил пациент с гаплотипом ПВ1 + ПВ2 + ПВ4, т.е. с изменениями в двух генах одновременно (табл. 2).
3) Присутствие ПВ5 отрицательно коррелирует с del (r = –0.60; р < 0.05). Частота встречаемости ПВ5 + del составляет 9 из 137 (7%) случаев, частота комбинации ПВ1 + ПВ5 + del – 3 из 137 (2%) случаев. Однако частота встречаемости единичного ПВ5 у больных МК составила 44 из 137 (32%) случаев, а у здоровых лиц – 14 из 94 (15%).
4) Наличие del положительно коррелирует с экспрессией С23 (r = 0.71; р < 0.05). Вполне вероятно, что отрицательная корреляция между наличием ПВ1/5 и del и низкая частота встречаемости их комбинации ПВ1 + ПВ5 + del обусловлена противоположным влиянием гаплотипов ПВ1/ПВ5 и del на экспрессию С23.
5) Наличие ПВ5 отрицательно коррелирует как с уровнем экспрессии В23, так и С23 (r = –0.77 и r = –0.79 соответственно; р < 0.05).
Единичные ПВ1 или ПВ5 отрицательно коррелируют с экспрессией С23. Оказалось, что уровень экспрессии С23 в образцах с этими ПВ ниже, чем в их отсутствие, за исключением пациента с гаплотипом ПВ1 + ПВ2 + ПВ4. Однако у большинства пациентов с комбинацией ПВ1 + ПВ5 наблюдались отдаленные метастазы в легкие и головной мозг.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее при исследовании экспрессии нуклеолина, С23, и нуклеофозмина, В23, в опухолях, на мышиных ксенотрансплантатах и в культурах клеток рака толстой кишки, рака молочной железы и рака легкого нами выявлено [34], что в опухолевых клетках их уровень выше, чем в нормальных.
Обнаруженная нами герминальная делеция p.D255GAT(c.763–765delGAT) в экзоне 4 гена NCL затрагивает Arg-богатый домен молекулы С23 – сайт связывания РНК (по базе данных BLAST 2.0). Наличие del положительно коррелирует с экспрессией С23 (r = 0.71; р < 0.05). Нуклеолин регулирует целый ряд важных процессов: сборку хроматина, рекомбинацию и репликацию ДНК, транскрипцию РНК РНК-полимеразой I, а также процессинг рРНК, стабилизацию мРНК, прохождение клеточного цикла и апоптоз [34]. На клетках HeLa показано, что при гиперэкспрессии С23 снижается транскрипционная активность промотора онкогена c-MYC в области G4. Так называемый G-квадруплекс (G4) представляет собой 4-цепочечную ДНК, состоящую из 4 остатков гуанина (G), расположенных в одной плоскости. Такие структуры играют большую роль в регуляции теломеразной активности и в поддержании целостности теломер; при этом молекулы С23 стабилизируют G4, препятствуя раскручиванию суперспирализованной ДНК и активации транскрипции онкогена c-MYC. Транскрипционная активность онкогена c-MYC на 85–90% контролируется путем связывания и стабилизации молекул С23 в области G-квадруплексной структуры промотора c-MYC. На С-конце молекулы С23 локализованы РНК-связывающие домены, необходимые для репрессии активности с-Мус [35].
Помимо участия в канцерогенезе, ангиогенезе и активации ключевых сигнальных путей экспрессия С23 на клеточной поверхности – необходимое условие для эффективной вирусной и/или бактериальной инфекции клеток [36, 37]. Избыточная экспрессия С23 в опухолевых клетках коррелирует с прогрессией таких новообразований, как рак шейки матки, желудка, легкого, толстой кишки и ряда других [38–40]. При гиперэкспрессии С23 подавляется трансляция мРНК р53 и, как следствие, снижается уровень опухолевого супрессора р53 и его активность при повреждениях ДНК [41, 42]. Рост опухоли стимулируется при взаимодействии С23 с пептидом F3, ассоциированным с эндотелием кровеносных сосудов, которые пронизывают опухоль. Этот пептид охарактеризован как маркер скорости ангиогенеза в опухолях и как возможная мишень для таргетной терапии онкологических заболеваний, а его активность напрямую зависит от уровня экспрессии С23 [43].
Поскольку В23 стимулирует экспрессию рецептора фактора роста эндотелия сосудов VEGFR-A, то С23 и В23 служат мощными индукторами неоангиогенеза. Как правило, уровень экспрессии С23 в пролиферирующих клетках, в том числе стволовых и опухолевых, значительно выше, чем в нормальных дифференцированных клетках. Это усиливает РНК-связывающую и антиапоптозную активности С23. Известно, например, что связывание С23 с мРНК Bcl-2 приводит к повышению уровня протоонкогена, который блокирует апоптоз в опухолевых клетках. Кроме того, С23 взаимодействует с мРНК AKT1, тем самым повышая экспрессию протеазы, необходимой для выживания клеток [44].
Интронный ПВ2 представляет не меньший интерес, чем полиморфизмы в экзонах 3 и 4 гена NCL, так как не кодирующая белки ДНК (ncДНК) также функционально значима. Дело в том, что соответствующая некодирующая РНК (ncРНК) может выполнять регуляторные функции, включая опосредованный транскрипцией ncДНК сайленсинг соседних генов и их промоторов – транскрипционную интерференцию. Более того, интрон 11 кодирует малую ядерную РНК U20 [29]. Наличие интронных вариантов гена NCL указывает на возможное изменение регуляторных функций в случае ncРНК. Этот вопрос также требует дальнейшего изучения.
Структурные изменения последовательности гена NPM способствуют изменению первичной структуры функционально важных доменов, а также определяют тип олигомеризации молекул В23. Полиморфизмы, обнаруженные в гене NPM, затрагивают исключительно интронные последовательности. Как известно, первый интрон гена NPM содержит последовательность, отвечающую за связывание с онкогенным фактором транскрипции с-Мус и опосредованную регуляцию сигнальных путей AKT/PI3K [5]. В большинстве опухолей наблюдается повышенный уровень экспрессии В23 и его колокализация с белками-продуктами онкогенов или генов-супрессоров: c-Fos, c-Myc, p53 и рRb, – например, в клетках гепатокарциномы человека линии SMMC-772 [45].
Как следует из полученных результатов, ПВ5 в гене NPM отрицательно коррелирует с экспрессией белка В23 (р < 0.05), что указывает на возможную транскрипционную интерференцию. Гиперэкспрессия гена NPM и высокая концентрация белка В23, характерные для опухолевых клеток, приводят к усилению транскрипции рибосомных генов, стимулируют транспорт в цитоплазму рибосомных субъединиц и репликацию ДНК в S-фазе митоза [12].
Мета-анализ полученных на микрочипах данных по экспрессии генов в клетках нормального кишечника, при аденомах кишечника и колоректальном раке выявил дифференциальную экспрессию NPM в зависимости от степени прогрессии опухолей. Подавление экспрессии гена NPM в культуре клеток с помощью малых ядерных РНК приводило к р53-опосредованному аресту клеточного цикла и к подавлению опухолевого роста [46]. Более того, профиль экспрессии гена NPM в культуре клеток колоректального рака коррелировал с миграцией опухолевых клеток и с их инвазией [47].
В контрольной группе образцов геномной ДНК преобладал дикий тип исследуемых последовательностей генов NPM и NCL, в то время как у больных МК чаще встречались описанные выше ПВ. Гаплотипы меланомы слизистых оболочек преимущественно уникальны. Следует сказать, что эта форма меланомы менее агрессивна по сравнению с МК и отдаленного метастазирования у участвовавших в исследовании пациентов не выявлено. У больных МК и в контрольной группе чаще встречаются единичные ПВ, в то время как у больных с меланомой слизистой оболочки чаще встречаются ПВ2 (56%), ПВ3 (61%) и ПВ4 (78%) в комбинациях из трех и более ПВ, при этом del в одиночном варианте в изученных образцах меланомы слизистых оболочек не обнаружена. Частота ПВ в образцах МК и меланомы слизистых оболочек различается: ПВ, редко встречающиеся в образцах МК, часто обнаруживали в меланоме слизистых оболочек.
Таким образом, многофункциональные белки С23 и В23 локализованы в ядрышках, цитозоле, а также в при- или надмембранном пространстве. Они играют ключевую роль в большинстве жизненно важных клеточных процессов: регулируют скорость прохождения клеточного цикла, сборку веретена деления, структуру хроматина и G-квадруплекса, транспорт и фолдинг белков, киназную активность, клеточный сигналинг, ангиогенез и апоптоз, процессы созревания рибосом, внутриклеточный и межклеточный транспорт молекул. Многие из молекулярных механизмов, регулирующих эти процессы, изучены недостаточно.
Структура генов NCL и NPM и характер экспрессии С23 и В23 имеет ряд принципиальных различий в клетках МК и в нормальной ткани. Это относится к частоте встречаемости и к спектру обнаруженных полиморфных вариантов (ПВ и мутации del GAT в экзоне 4 гена NCL), а также их комбинаций. Выявленные генетические изменения в клетках МК и меланомы слизистой оболочки отличаются по частоте, спектру и комбинациям, что может отражать их гистоспецифичность и возможную роль в канцерогенезе.
Исследование поддержано проектом Государственное задание Минздрава России, НИР (регистрационный номер Госреестра № 114112440122).
Проведение исследования одобрено этическим комитетом “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России. Все образцы получены от пациентов, которые дали письменное информированное согласие на использование своей ткани в исследовательских целях.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Стандартизованные показатели онкоэпидемиологической ситуации 2016 г. (2018) Евразийский онкологический журнал. 6(2), 49–62.
Box J.K., Paquet N., Adams M.N., Boucher D., Bolderson E., O’Byrne K.J., Richard D.J. (2016) Nucleophosmin: from structure and function to disease development. BMC Mol. Biol. 17, 19–30.
Umekawa H., Chang J.H., Correia J.J., Wang D., Wingfield P.T., Olson M.O. (1993) Nucleolar protein B23: bacterial expression, purification, oligomerization and secondary structures of two isoforms. Cell. Mol. Biol. Res. 39(7), 635–645.
Chan P.K., Chan F.Y., Morris S.W., Xie Z. (1997) Isolation and characterization of the human nucleophosmin/B23 (NPM) gene: identification of the YY1 binding site at the 5' enhancer region. Nucleic Acids Res. 6, 1225–1232
Zeller K.I., Haggerty T.J., Barrett J.F. (2001) Characterization of nucleophosmin (B23) as a Myc target by scanning chromatin immunoprecipitation. J. Biol. Chem. 51, 48285–48291
Cordell J.L., Pulford K.A., Bigerna B., Roncador G., Banham A., Colombo E., Pelicci P.G., Mason D.Y., Falini B. (1999) Detection of normal and chimeric nucleophosmin in human cells. Blood. 2, 632–642.
Kuramitsu Y., Hayashi E., Okada F. (2010) Proteomic analysis for nucleolar proteins related to tumor malignant progression: a comparative proteomic study between malignant progressive cells and regressive cells. Anticancer Res. 6, 2093–2099.
Lim M.J., Wang X.W. (2006) Nucleophosmin and human cancer. Cancer Detect. Prev. 30(6), 481–490.
Dalenc F., Drouet J., Ader I., Delmas C., Rochaix P., Favre G., Cohen-Jonathan E., Toulas C. (2002) Increased expression of a COOH-truncated nucleophosmin resulting from alternative splicing is associated with cellular resistance to ionizing radiation in HeLa cells. Int. J. Cancer. 100(6), 662–668
Gjerset R. (2006) DNA damage, p14ARF, nucleophosmin (NPM1/B23), and cancer. J. Mol. Histol. 5–7, 239–251.
Hingorani K., Szebem A., Olson M.O. (2000) Mapping the functional domains of nucleolar protein B23. J. Biol. Chem. 32, 24451–24457.
Lindstrom M. (2011) NPM/B23: a multifunctional chaperone in ribosome biogenesis and chromatin remodeling. Biochem. Res. Int. 2011, 195209.
Bañuelos S., Lectez B., Taneva S. G., Ormaza G., Alonso-Mariño M., Calle X., Urbaneja M. A. (2013) Recognition of intermolecular G-quadruplexes by full length nucleophosmin. Effect of a leukaemia-associated mutation. FEBS Lett. 14, 2254–2259.
Scognamiglio P.L., Di Natale C., Leone M., Poletto M., Vitagliano L., Tell G., Marasco D. (2014) G-quadruplex DNA recognition by nucleophosmin: new insights from protein dissection. Biochim. Biophys. Acta. 6, 2050–2059.
Mitrea D.M., Kriwacki R.W. (2012) Cryptic disorder: an order-disorder transformation regulates the function of nucleophosmin. Pac. Symp. Biocomput. 152–163.
Zhao X., Ji J., Yu L.R. (2015) Cell cycle-dependent phosphorylation of nucleophosmin and its potential regulation by peptidyl-prolyl cis/trans isomerase. J. Mol. Biochem. 4, 95–103.
Dabbous M., Jefferson M., Haney L. (2011) Biomarkers of metastatic potential in cultured adenocarcinoma clones. Clin. Exp. Metastasis. 2, 101–111.
Ching R.H., Lau E.Y., Ling P.M. (2015) Phosphorylation of nucleophosmin at threonine 234/237 is associated with HCC metastasis. Oncotarget. 6, 43483–43495.
Qi W., Shakalya K., Stejskal A. (2008) NSC348884, a nucleophosmin inhibitor disrupts oligomer formation and induces apoptosis in human cancer cells. Oncogene. 27(30), 4210–4220.
Scott D.D., Oeffinger M. (2016) Nucleolin and nucleophosmin: nucleolar proteins with multiple functions in DNA repair. Biochem. Cell Biol. 94(5), 419–432.
Kotani H., Ito M., Hamaguchi T. (1998) The delta isoform of protein phosphatase type 1 is localized in nucleolus and dephosphorylates nucleolar phosphoproteins. Biochem. Biophys. Res. Commun. 1, 292–296.
Szebeni A., Mehrotra B., Baumann A. (1997) Nucleolar protein B23 stimulated nuclear import of the HIV-1 Rev protein and NLS-conjugated albumin. Biochemistry. 13, 3941–3949.
Tulchin N., Chambon M., Juan G. (2010) BRCA1 protein and nucleolin colocalize in breast carcinoma tissue and cancer cell lines. Am. J. Pathol. 3, 1203–1214.
Brandt R., Nawka M., Kellermann J. (2004) Nucleophosmin is a component of the fructoselysine-specific receptor in cell membranes of Mono Mac 6 and U937 monocyte-like cells. Biochim. Biophys. Acta. 2, 132–136.
Lee H.H., Kim H.S., Kang J.Y., Lee B.I., Ha J.Y., Yoon H.J., Lim S.O., Jung G., Suh S.W. (2007) Crystal structure of human nucleophosmin-core reveals plasticity of the pentamer–pentamer interface. Proteins. 69(3), 672–678.
Okuwaki M. (2008) The structure and functions of NPM1/nucleophosmin/B23, a multifunctional nucleolar acidic protein. J. Biochem. 4, 441–448.
Di Matteo A. Franceschini M., Chiarella S. (2016) Molecules that target nucleophosmin for cancer treatment an update. Oncotarget. 28, 44821–44840.
Зенит-Журавлева Е.Г., Полковниченко Е.М., Лушникова А.А., Трещалина Е.М., Букаева И.А., Райхлин Н.Т. (2012) Нуклеофозмин и нуклеолин: кодирующие гены и экспрессия в различных тканях животных и человека. Молекуляр. медицина. 4, 24–31.
Abdelmohsen K., Gorospe M. (2012) RNA-binding protein nucleolin in disease. RNA Biol. 9(6), 799–808
Joo E.J., Wasik B.R., Parrish C., Paz H., Mϋhlenhoff M., Abdel-Azim H., Groffen J., Heisterkamp N. (2018) Pre-B acute lymphoblastic leukemia expresses cell surface nucleolin as a 9-O-acetylated sialoglycoprotein. Sci. Rep. 8(1), 17174.
Losfeld M.E., Khoury D.E., Mariot P., Carpentier M., Krust B., Briand J.P., Mazurier J., Hovanessian A.G., Legrand D. (2009) The cell surface expressed nucleolin is a glycoprotein that triggers calcium entry into mammalian cells. Exp. Cell Res. 315(2), 357–369.
Fang L. Wang K.K., Jiang L., Jiang BM, Wei X., Song L., Deng G.H., Xiao X.Z. (2008) Role of cell-surface nucleolin in lipopolysacharide-stimulated expression and secretion of TNF-alpha and IL-1beta. Zhong Nan Da Xue Xue Bao Yi Xue Ban. 33(11), 999–1004.
Reyes-Reyes E.M., Akiyama S.K. (2008) Cell-surface nucleolin is a signal transducing P-selectin binding protein for human colon carcinoma cell. Exp. Cell Res. 314(11–12), 2212–2223.
Зенит-Журавлева Е.Г., Лушникова А.А., Понкратова Д.А., Цыганова И.В., Вихрова А.С., Трещалина Е.М., Мазуренко Н.Н. (2014) Некоторые генетические особенности метастатической меланомы кожи. Молекуляр. медицина. 4, 57–64.
Gonzalez V., Harley L.H. (2010) The C-terminal of nucleolin promotes the formation of the c-MYC G-quadruplex and inhibits c-MYC promoter activity. Biochemistry. 49(45), 9706–9714.
Barrel M., Meibom K., Charbit A. (2010) Nucleolin, a shuttle protein promoting infection of human monocytes by Francisella tularensis. PLoS One. 5(12), 14193.
Said A.E. Courty J., Svab J., Delbé J., Krust B., Hovanessian A.G. (2005) Pleiotrophin inhibits HIV infection by binding the cell surface expressed nucleolin. FEBS J. 272(18), 4646–4659.
Fujiki H., Watanabe T., Suganuma M. (2014) Cell-surface nucleolin acts as a central mediator for carcinogenic, anti-carcinogenic, and disease-related ligands. J. Cancer Res. Clin. Oncol. 140(5), 689–699.
Meng G.Z., Zi Y., Li H.Q., Huang M., Gao T. (2015) Nucleolin expression is correlated with carcinogenesis and progression of cervical squamous cell carcinoma. Nan Fang Yi Ke Da Xue Xue Bao. 35(10), 1511–1514.
Yang Y., Yang C., Zhang J. (2015) C23 protein meditates bone morphogenetic protein-2-mediated EMT via up-regulation of Erk1/2 and Akt in gastric cancer. Med. Oncol. 32(3), 76.
Hu J., Lin M., Liu T., Li J, Chen B., Chen Y. (2011) DIGE-based proteomic analysis identifies nucleophosmin/B23 and nucleolin/C23 as over-expressed proteins in relapsed/refractory acute leukemia. Leuk. Res. 35(8), 1087–1092.
Rickards B., Flint S., Cole M., LeRoy G. (2007) Nucleolin is required for RNA polymerase I transcription in vivo. Mol. Cell. Biol. 27(3), 937–948.
Frehlick L., Eirin-Lopez J., Ausio J. (2007) New insights into the nucleophosmin/nucleoplasmin family of nuclear chaperones. Bioessays. 29(1), 49–59.
Hers I., Vincent E.E., Tavare J.M. (2011) Akt signaling in health and disease. Cell. Signal. 23(10), 1515–1527.
Krause A., Hoffmann I. (2010) Polo-like kinase 2-dependent phosphorylation of NPM/B23 on serine 4 triggers centriole duplication. PLoS One. 5(3), 9849.
Wong J.C., Hasan M.R., Rahman R., Yu A.C., Chan S.K., Schaeffer D.F., Kennecke H.F., Lim H.J., Owen D., Tai I.T. (2013) Nucleophosmin 1, upregulated in adenoma and cancers of the colon, inhibits p53-mediated cellular senescence. Int. J. Cancer. 133(7), 1567–1577.
Liu Y., Zhang X-F, Qi L.-Sh., Qi L.S., Yang L., Guo H., Zhang N. (2012) Expression of nucleophosmin/NPM1 correlates with migration and invasiveness of colon cancer cells. J. Biochem. Sci. 19, 53.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


