Молекулярная биология, 2019, T. 53, № 4, стр. 638-647
Динамика функциональной активности и экспрессии субъединиц протеасом в условиях адаптации клетки к тепловому шоку
А. В. Морозов a, *, А. В. Буров a, b, Т. М. Астахова c, Д. С. Спасская a, Б. А. Маргулис d, В. Л. Карпов a
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Биологический факультет Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
c Институт биологии развития им. Н.К. Кольцова Российской академии наук
119334 Москва, Россия
d Институт цитологии Российской академии наук
194064 Санкт-Петербург, Россия
* E-mail: Runkel@inbox.ru
Поступила в редакцию 06.11.2018
После доработки 26.11.2018
Принята к публикации 26.11.2018
Аннотация
Убиквитин-протеасомная система (УПС) осуществляет протеолиз большинства внутриклеточных белков. Ключевые элементы УПС – мультисубъединичные белковые комплексы протеасомы, играют важную роль в адаптации клеток к различным видам стресса. Нами проведен анализ динамики активности протеасом, содержания субъединиц протеасом, а также уровня экспрессии генов каталитических субъединиц протеасом в клетках линии U937 гистиоцитарной лимфомы человека сразу после теплового шока и через 2, 4, 6, 9, 24 и 48 ч после него. Выявлено изначальное снижение (до 62%) активности протеасом в лизатах клеток, затем через 10 ч после теплового шока происходило постепенное восстановление активности. Количество α-субъединиц протеасом в клетках снижалось уже через 2 ч после теплового шока, к 24–48 ч их концентрация также постепенно восстанавливалась. Показано волнообразное изменение содержания специфических мРНК в клетках с максимумом через 2 ч и постепенным снижением к 48 ч после теплового шока. Оценено среднее количество копий мРНК протеасомных генов в пересчете на одну клетку, составлявшее от 10 для низко- до 150 для высокоэкспрессируемых генов. Нами оценена эффективность восстановления функционального состояния УПС после теплового шока, отражающая важную роль протеасом в поддержании гомеостаза клетки.
ВВЕДЕНИЕ
Убиквитин-протеасомная система (УПС) осуществляет деградацию большинства внутриклеточных белков, поэтому она участвует практически во всех основных метаболических процессах и в поддержании гомеостаза клетки [1]. Центральный элемент УПС – 20S протеасома, представляет собой бочкоподобную структуру, образованную четырьмя кольцами по семь субъединиц в каждом. Каждое из двух внешних колец состоит из семи α-субъединиц (α1–7) и выполняет структурную, а также защитную функцию, предотвращая случайный доступ субстратов в каталитическую камеру, образованную двумя кольцами β-субъединиц. Три из семи β-субъединиц в каждом кольце обладают каталитической активностью и осуществляют гидролиз полипептидной цепи после кислых (β1), основных (β2) и гидрофобных остатков (β5) [2]. Кроме того, в состав протеасом вместо конститутивных субъединиц могут входить так называемые иммунные (β1i, β2i, β5i), экспрессия которых стимулируется различными цитокинами (интерферон-γ (ИФНγ), фактором некроза опухолей-α (ФНОα)) и повышается при окислительном стрессе [3]. В клетках 20S протеасома может функционировать как сама по себе, так и образовывать комплексы с регуляторами, образуя различные формы протеасом [4, 5]. Регуляторы обеспечивают субстратную специфичность протеасом, а также, облегчают проникновение субстратов, влияя тем самым на ее активность. Основным параметром, характеризующим функциональное состояние протеасомы, считается ее каталитическая активность.
Протеасомы играют ключевую роль в защите клеток от различных стрессовых воздействий. Так, разрушая окисленные и поврежденные белки, протеасомы помогают клетке справиться с последствиями окислительного стресса [6]. Поврежденные белки активно накапливаются во время стресса, вызванного повышением температуры окружающей среды. Состояние УПС после теплового шока (ТШ) рассмотрено в ряде работ [7‒9], однако изменения активности протеасом и их количества в клетках после ТШ изучено недостаточно. В данной работе изучено функциональное состояние протеасом в клетках линии U937 гистиоцитарной лимфомы человека до и на протяжении 48 ч после ТШ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клетки. Клетки гистиоцитарной лимфомы человека линии U937 (любезно предоставлены В.С. Прасоловым, ИМБ РАН) культивировали в среде RPMI 1640 (“Gibco”, Великобритания), содержащей 10% эмбриональной сыворотки крупного рогатого скота (ФБС) (“HyClone”, Великобритания), 2 мМ L-глутамина и антибиотики (пенициллин/стрептомицин) при 37°C, 5% CO2 и 95%-ной влажности.
Тепловой шок. Перед проведением ТШ число клеток U937 подсчитывали в камере Горяева, затем собирали в отдельные пробирки так, чтобы в каждой было по 1 × 106 клеток. Пробирки помещали в водяную баню (43°С) и инкубировали в течение 1 ч. После окончания инкубации клетки переносили во флаконы для культивирования, помещали в инкубатор и содержали при 37°C, 5% CO2 и 95% влажности. Перед ТШ, сразу после и через 2, 4, 6, 9, 24 и 48 ч клетки собирали центрифугированием, пересчитывали в камере Горяева, отмывали фосфатным буфером (ФБ) и либо замораживали при –80°C (для измерения активности протеасом или выделения РНК), либо лизировали в буфере (50 мМ Трис-HCl pH 8.0, 150 мМ NaCl, NP-40 1%, EDТА 5 мМ, коктейль ингибиторов протеаз Complete mini EDTA free (“Roche”, Швейцария)) из расчета 1 мкл буфера на 104 клеток. Для получения ядерных и цитоплазматических фракций использовали набор NE-PER Nuclear and cytoplasmic extraction reagents (“Thermo Scientific”, США) согласно рекомендациям производителя.
Измерение активности протеасом. Химотрипсиноподобную активность протеасом в гомогенатах клеток оценивали, как описано ранее [10]. Клетки размораживали и гомогенизировали из расчета 1 × 106 клеток в 70 мкл буфера для гомогенизации (50 мM Tрис-HCl (pH 7.5), 100 мM NaCl, 5 мM MgCl2, 1 мM EDTA, 1 мM дитиотреитол, 10% глицерина, 10 мM Na2S2O5 и 2 мM ATР). Концентрацию общего белка в образцах измеряли по методу Лоури [11]. Химотрипсиноподобную активность протеасом определяли по уровню гидролиза флуорогенного субстрата Suc-LLVY-AMC (“Sigma-Aldrich”, США) с использованием VersaFluor Fluorometer (“Bio-Rad”, США). Активность измеряли в трех повторностях в 100 мкл буфера для определения активности, содержащего 6 мкл осветленного гомогената [12]. Специфическую активность протеасом контролировали, определяя ее также в пробах, в которые кроме гомогената вносили 10 мкМ ингибитора протеасомы MG132 (“Sigma-Aldrich”, США). Полученные значения пересчитывали на 1 мкл осветленного гомогената, умножали на уравнивающий коэффициент (получен после определения концентрации белка в пробах), вычисляли среднее значение и стандартное отклонение, после чего пересчитывали содержание (%) относительно уровня активности в контрольных клетках.
Ингибиторный анализ и иммуноблотинг. Динамику содержания протеасом после ТШ оценивали также в лизатах клеток, обработанных ингибиторами протеасомного и лизосомного протеолиза. Перед ТШ в культуральную среду клеток добавляли ингибитор протеасом MG132 (“Sigma-Aldrich”) в концентрации 5 мкМ или ингибитор лизосомного протеолиза – хлорохин (“Sigma-Aldrich”), в концентрации 10 мкМ. Далее проводили ТШ и последующие манипуляции, как описано выше.
Субъединичный состав протеасом в лизатах клеток анализировали методом иммуноблотинга. Белки разделяли с помощью электрофореза в 12%-ном денатурирующем (содержащим додецилсульфат натрия (ДСН)) полиакриламидном геле (ПААГ) в Трис-глициновом буфере, после чего переносили на нитроцеллюлозную мембрану (“Bio-Rad”, США). Эффективность переноса оценивали, окрашивая мембраны 0.1%-ным раствором Ponceau Rouge (“Sigma-Aldrich”). Для выявления субъединиц протеасом мембраны инкубировали с первичными антителами (табл. 1) в течение 2 ч, затем отмывали ФБ, содержащим 0.1% Tween 20 (“Fisher Scientific”, США) и инкубировали с соответствующими вторичными антителами (табл. 1), конъюгированными с пероксидазой хрена. Блоты проявляли с помощью набора ECL Prime (“GE Healthcare”, Великобритания). Для нормирования сигнала мембраны отмывали от антител сначала буфером для снятия антител (ФБ, 2% ДСН, 100 мМ β-меркаптоэтанол), а затем дополнительно ФБ. Мембраны инкубировали с первичными антителами к β-актину (табл. 1), после чего отмывали и инкубировали с соответствующими вторичными антителами, меченными пероксидазой хрена (табл. 1) и проявляли, как описано выше.
Таблица 1.
Антитела, использованные в работе
| Антитела | Производитель |
|---|---|
| Моноклональные антитела мыши против набора α-субъединиц протеасом α1,2,3,5,6,7 | “Enzo”, США |
| Поликлональные антитела кролика против субъединицы β-5 | “GeneTex”, США |
| Моноклональные антитела кролика против субъединицы β-5i | “Cell signaling”, США |
| Поликлональные антитела кролика к белку теплового шока 70 | Любезно предоставлены Евгеньевым М.Б. |
| Моноклональные антитела мыши против субъединицы Rpt6 регулятора 19S | “Enzo”, США |
| Моноклональные антитела кролика против β-актина | “Sigma-Aldrich”, США |
| Антитела козы против IgG мыши, конъюгированные с пероксидазой хрена | “Enzo”, США |
| Поликлональные антитела козы против IgG кролика, конъюгированные с пероксидазой хрена | “Abcam”, Великобритания |
Ультрацентрифугирование. Для оценки секреции протеасом в составе внеклеточных везикул клетками, подвергнутыми ТШ, среду культивирования клеток заменяли свежей, а затем проводили ТШ. Культуральную жидкость собирали сразу после ТШ, а также через 2, 4, 6, 9, 24 и 48 ч, центрифугировали при 400 g в течение 5 мин, а затем при 5000 g в течение 5 мин. После каждого центрифугирования отбирали надосадочную жидкость, переносили ее в новую пробирку, а осадки выбрасывали. Полученные образцы центрифугировали через 10%-ный раствор сахарозы в ультрацентрифуге Beckman Ultima (“Beckman”, США) при 100 000 g в течение 2 ч. Осадки растворяли в ФБ и анализировали с помощью иммуноблотинга, как описано выше.
Разработка системы для проведения ПЦР в реальном времени. Из клеток, подвергнутых ТШ и замороженных при –80°С, выделяли суммарную РНК с помощью набора GeneJET RNA Purification Kit (“Thermo Scientific”) согласно рекомендациям производителя. Концентрацию и чистоту РНК в образцах определяли спектрофотометрически, используя прибор NanoDrop (“Thermo Scientific”). Образцы РНК обрабатывали с помощью набора RapidOut DNA Removal kit (“Thermo Scientific”) для удаления ДНК. Далее проводили реакцию обратной транскрипции, используя обратную транскриптазу Maxima H Minus (“Thermo Scientific”) и праймер oligo(dT)20 для получения кДНК (1.5 мкг суммарной РНК в реакционной смеси). Уровень экспрессии генов каталитических субъединиц протеасом (PSMB5, PSMB6, PSMB7, PSMB8, PSMB9, PSMB10), а также генов, кодирующих β-актин (Actb) и белок теплового шока 70 (БТШ70, ген HSPA1A), оценивали методом ПЦР в реальном времени. Праймеры для ПЦР (табл. 2) подобраны на базе платформы IDT (https://eu.idtdna.com) и приложения OligoAnalizer с учетом критериев, описанных в [13]. С помощью этих праймеров получены ПЦР-продукты, которые после очистки из агарозного геля клонировали (кроме HSPA1A) в вектор pAL-2T, используя набор Quick TA kit (“Евроген”, Россия). Таким образом был получен набор плазмид, содержащих короткие фрагменты генов, соответствующих ПЦР-продуктам. После измерения концентрации плазмид при помощи онлайн-ресурса EndMemo (http://www.endmemo.com/bio/dnacopynum.php) было определено количество копий каждой из них в единице объема. На следующем этапе оценивали эффективность амплификации специфических фрагментов с помощью ПЦР. Матрицей при этом служили серийные разведения плазмид. Продукты ПЦР анализировали в 2.5%-ном агарозном геле (см. Приложение на сайте http://www.molecbio.ru/ downloads/2019/4/supp_Morozov_rus.pdf, рис. 1). В ходе тестов определяли оптимальные параметры проведения реакции и чувствительность системы. Затем эффективность амплификации с каждой парой праймеров оценивали в ПЦР в реальном времени, используя набор Luminaris Color HiGreen qPCR Master Mix (“Thermo Scientific”), а также серийные разведения плазмид и серийные разведения кДНК (Приложение, рис. 2, 3). Реакции с контрольными плазмидами проводили в присутствии 100 нг ДНК-носителя (ДНК из спермы лосося (“Thermo Scientific”). На этапе применения разработанной системы для оценки уровней экспрессии генов каталитических субъединиц протеасом методом ПЦР в реальном времени в каждую реакцию вносили по 2 мкл разбавленной в 4 раза кДНК. Каждую опытную точку (К, 0, 2, 4, 6, 9, 24 и 48 ч) для всех генов анализировали в двух повторностях, а калибровку системы осуществляли по серии разведений плазмид (в реакцию вносили 2, 10, 102, 103, 104, 106, 107 копий каждой плазмиды). ПЦР в реальном времени проводили в приборе LightCycler 480 (“Roche”). Выходные данные прибора, в том числе значения пороговых циклов, анализировали, используя приложение Microsoft Excel. По построенной калибровочной кривой (значения пороговых циклов для серийных разведений соответствующей плазмиды) определяли количество копий транскрипта каждого гена в единице объема. Далее подсчитывали количество транскриптов, приходящихся на 1 мкг суммарной РНК. После чего оценивали среднее количество транскриптов гена в одной клетке. Для этого необходимо было оценить среднее количество суммарной РНК, приходящееся на одну клетку. Поэтому проводили дополнительный эксперимент. Из известного количества клеток трижды выделяли РНК и измеряли ее концентрацию. Среднее значение РНК в одной клетке линии U937 составило 12 ± 1 пг. Это значение использовали при вычислении количества транскриптов каждого гена, приходящихся на одну клетку. Нормирование проводили по уровню экспрессии гена Actb.
Таблица 2.
Праймеры, использованные в работе
| Праймер | Нуклеотидная последовательность 5' → 3' | Длина, п.н | Положение по референсной мРНК | Размер ампликона, п.н. | Термодинамические параметры* | ||
|---|---|---|---|---|---|---|---|
| Tm, °С | Гомодимеры и шпильки, ΔG не менее, ккал/моль | Гетеродимеры, ΔG не менее, ккал/моль |
|||||
| PSMB5 fw | CTCCAAACTGCTTGCCAAC | 19 | NM_002797.4 п.н. 678–696 |
Экзон–экзон, 121 | 61.9 | –3.9 | –3.29 |
| PSMB5 rev | GTTCCCTTCACTGTCCACG | 19 | NM_002797.4 п.н. 798–780 |
62.5 | –3.61 | ||
| PSMB6 fw | AAGCCGAGAAGTTTCCACT | 19 | NM_002798.2 п.н. 132–150 |
Экзон–экзон, 102 | 61.7 | –3.61 | –4.64 |
| PSMB6 rev | GCGATGTAGGACCCAGT | 17 | NM_002798.2 п.н. 233–217 |
60.7 | –3.61 | ||
| PSMB7 fw | CTGAAGGGATGGTTGTTG | 18 | NM_002799.3 п.н. 239–256 |
Экзон–экзон, 128 | 58 | –1.94 | –3.55 |
| PSMB7 rev | CAGGTTGGAAGAAATGAGC | 19 | NM_002799.3 п.н. 366–348 |
58.8 | –3,14 | ||
| PSMB8 fw | GGTGAACAAGGTGATTGAG | 19 | NM_148919.3 п.н. 349–367 |
Экзон–экзон, 128 | 58.5 | –3.9 | –4.86 |
| PSMB8 rev | GTTCTCCATTTCGCAGATAG | 20 | NM_148919.3 п.н. 476–457 |
58.5 | –3.61 | ||
| PSMB9 fw | GCTGCTGATGCCCAAGC | 17 | NM_002800.4 п.н. 274–290 |
Экзон–экзон, 117 | 63.9 | –4.74 | –4.74 |
| PSMB9 rev | GCTGATATTTCTCACCACATTTGC | 24 | NM_002800.4 п.н. 390–367 |
62.9 | –3.91 | ||
| PSMB10 fw | GGTTCCAGCCGAACATGA | 18 | NM_002801.3 п.н. 667–684 |
Экзон–экзон, 106 | 62.2 | –5.38 | –3.61 |
| PSMB10 rev | ATGCGTCCACATTGCCC | 17 | NM_002801.3 п.н. 772–756 |
63.1 | –3.61 | ||
| Actb fw | TTGGCAATGAGCGGTTCC | 18 | NM_001101.4 п.н. 941–958 |
Экзон–экзон, 93 | 63.2 | –3.9 | –3.9 |
| Actb rev | GAGTTGAAGGTAGTTTCGTGG | 21 | NM_001101.4 п.н. 1033–1014 |
60.8 | –3.61 | ||
| Hsp70 fw | GAGTCCTACGCCTTCAACAT | 20 | NM_005345.5 п.н. 1870–1980 |
Один и тот же экзон, 110 | 61.9 | –3.61 | –5.47 |
| Hsp70 rev | CGAGATGACCTCTTGACACTT | 21 | 61.8 | –3.61 | |||
| T7 Primer | TAATACGACTCACTATAGGG | 20 | 55.5 | –6.59 | |||
* Термодинамические параметры праймеров оценивали с помощью приложения IDT OligoAnalizer Tool (https://eu.idtdna.com/pages) при условиях содержания солей [Na+] – 50 мМ, [Mg2+] – 3 мМ, [dNTP] – 0.8 мМ.
Рис. 1.
Динамика химотрипсиноподобной активности протеасом в лизатах клеток U937 после теплового шока. Активность протеасом определяли по гидролизу флуорогенного субстрата Suc-LLVY-AMC. Опыт проводили в трех повторностях.
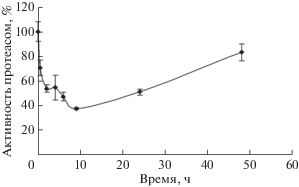
Рис. 2.
Анализ содержания субъединиц протеасом в клетках U937 после ТШ. а – Иммуноблотинг лизатов контрольных клеток, а также клеток, инкубированных в течение 0, 2, 4, 6, 9, 24 и 48 ч после ТШ с антителами к субъединицам протеасом, регулятору 19S и БТШ70. Проводили не менее двух биологических повторностей, в опыте по изучению динамики содержания α-субъединиц протеасом, n = 4. Представлены репрезентативные результаты каждого эксперимента. б – График изменения содержания субъединиц протеасом и регулятора протеасом после ТШ. График построен по средним значениям оптической плотности соответствующих сигналов, полученных после сканирования рентгеновских пленок и обработки результатов с помощью программы ImageJ. Среднее значение оптической плотности в контроле принято за 100%. Кривые: 1 – Σα, 2 – β5, 3 – β5i, 4 – Rpt6. в – Сравнительный анализ содержания α-субъединиц протеасом в лизатах цитоплазматической и ядерной фракций контрольных клеток и U937 через 2 ч после ТШ. г – Накопление БТШ70 в клетках U937 после ТШ. График построен по средним значениям оптической плотности соответствующих сигналов, полученных после сканирования рентгеновских пленок и обработки результатов с помощью программы ImageJ. Среднее значение оптической плотности в контроле принято за 100%.
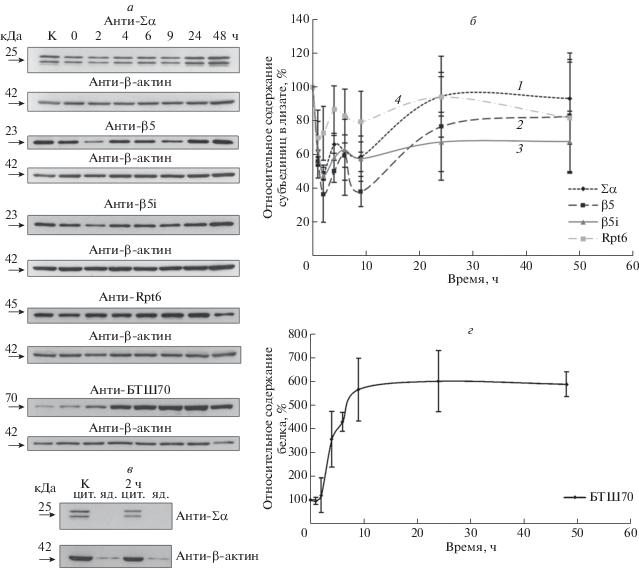
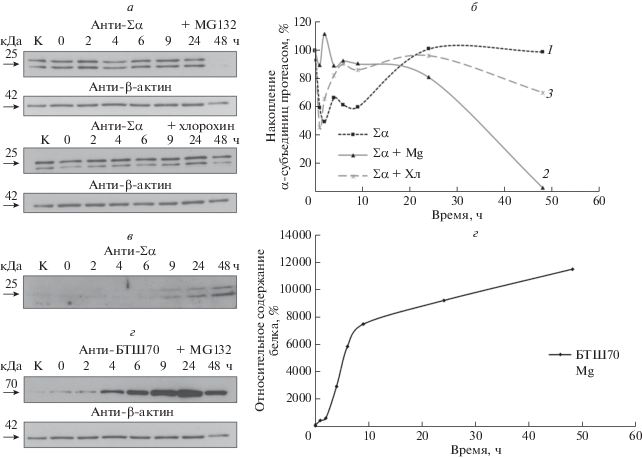
Рис. 3.
Влияние ингибитора протеасом MG132 и ингибитора лизосомного протеолиза хлорохина на динамику накопления α-субъединиц протеасом в лизатах клеток U937 после ТШ. а – Иммуноблотинг лизатов клеток с антителами к α-субъединицам протеасом. Клетки подвергали ТШ в присутствии ингибиторов, после чего получали лизаты клеток сразу после ТШ, а также через 2, 4, 6, 9, 24 и 48 ч. б – График изменения содержания α-субъединиц протеасом после ТШ в присутствии ингибиторов (Mg – MG132, Хл – хлорохин). График построен по средним значениям оптической плотности соответствующих сигналов, полученных после сканирования рентгеновских пленок и обработки результатов с помощью программы ImageJ. Среднее значение оптической плотности в контроле принято за 100%. Кривые: 1 ‒ Σα, 2 – Σα + MG132, 3 ‒ Σα + хлорохин. в – Иммуноблотинг сконцентрированных в 100 раз ультрацентрифугированием образцов культуральной жидкости клеток U937, полученных через разные промежутки после ТШ. На гель наносили по 20 мкл каждого образца. г ‒ Иммуноблотинг лизатов клеток U937 после проведения ТШ в присутствии ингибитора протеасом MG132 с антителами к БТШ70. д ‒ Накопление БТШ70 в клетках U937 после ТШ в присутствии ингибитора протеасом MG132. График построен по средним значениям оптической плотности соответствующих сигналов, полученных после сканирования рентгеновских пленок и обработки результатов с помощью программы ImageJ. Среднее значение оптической плотности в контроле принято за 100%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Динамика активности протеасом в клетках U937 после теплового шока
Выявлено резкое снижение активности протеасом в клетках U937, подвергнутых ТШ (рис. 1). Так, сразу после ТШ химотрипсиноподобная активность протеасом составляла 70% от изначальной, а через 2 ч – 54%. Наименьший уровень активности протеасом в лизатах клеток U937 – 38% от изначального – отмечен через 9 ч после ТШ (рис. 1). После чего активность постепенно восстанавливалась и спустя 48 ч после ТШ достигала примерно 85% от уровня в контрольных клетках. Результаты экспериментов, указывающие на снижение активности протеасом, хорошо согласуются с данными, полученными ранее при измерении активности протеасом через 2 ч после ТШ (25 мин при 42°С на клетках линии RMA) [7]. В то же время профиль активности протеасом, определенный нами, отличался от данных, полученных на фибробластах человека после проведения ТШ в течение 1 ч при 41 или 42°C [8]. В частности, через 5 ч после ТШ снижение химотрипсиноподобной активности протеасом составляло примерно 14% [8], после чего следовал резкий ее рост. Однако данные [8] указывают на более существенное снижение активности протеасом в клетках, подвергнутых ТШ при более высоких температурах (например, при 43°С) [8]. Таким образом, в ответе различных клеток на повышение температуры просматриваются общие закономерности, хотя протокол проведения ТШ, а также тип использованных клеток, по-видимому, сильно влияют на изменение активности протеасом. Среди возможных причин снижения активности можно отметить более низкую эффективность “созревания” протеасом, посттрансляционные модификации их субъединиц [7], а также уменьшение количества уже собранных комплексов. Поэтому мы анализировали динамику содержания субъединиц протеасом в лизатах клеток после ТШ.
Динамика содержания протеасом и БТШ70 в лизатах клеток U937 после теплового шока
Содержание протеасом в лизатах клеток оценивали методом иммуноблотинга с антителами к структурным α-субъединицам (α1, 2, 3, 5, 6, 7), а также к каталитическим субъединицам β5 и β5i, отвечающим за химотрипсиноподобную активность протеасом. Кроме того, определяли содержание субъединицы Rpt6 регулятора 19S. Количество протеасом в лизатах клеток начинало снижаться сразу после ТШ и достигало минимума уже через 2 ч (рис. 2а, б). Затем количество субъединиц протеасом и регулятора 19S восстанавливалось. Однако количество протеасом восстанавливалось неравномерно. Так, содержание субъединиц росло в интервале 2–6 ч после ТШ, затем следовала стабилизация или спад, продолжавшийся до 9-го часа, с последующим восстановлением количества протеасом (рис. 2а, б). Учитывая нашу методику получения лизатов клеток (мягкий лизис без разрушения ядер), и данные, приведенные в [7], указывающие на изменение внутриклеточной локализации протеасом после ТШ, мы сравнили содержание протеасом в ядерной и цитоплазматической фракциях, полученных из контрольных клеток и клеток, инкубированных в течение 2 ч после ТШ (рис. 2в). Мы не обнаружили существенного увеличения количества протеасом в лизатах ядер, более того, в ядерной фракции клеток U937 практически отсутствовали α-субъединицы протеасом. Эти результаты согласуются с недавно опубликованными результатами, указывающими на преимущественно цитоплазматическую локализацию активных протеасом, как минимум, в некоторых клеточных линиях [14]. Данные о снижении количества протеасом отличаются от представленных ранее [8], однако различия могут быть объяснены использованием других клеточных линий и другого протокола проведения ТШ. В качестве дополнительного контроля мы оценили количество БТШ70 в лизатах клеток U937, которое начинало резко расти через 2–4 ч после окончания ТШ и достигало пика в районе 9 ч, после чего уровень белка стабилизировался и оставался на том же уровне даже спустя 48 ч после ТШ (рис. 2а, г).
Влияние ингибиторов протеасом и лизосом на содержание протеасом в клетках после теплового шока
В условиях стресса протеасомы разрушаются путем аутофагии [15, 16]. Известно, что ТШ (43°C) стимулирует аутофагию, при этом маркеры аутофагии LC3I и LC3II накапливаются в промежутке между 3–6 ч после ТШ [17]. Для оценки вклада аутофагии в наблюдаемое уменьшение количества протеасом в лизатах клеток U937, ТШ проводили в в присутствии ингибитора лизосомного протеолиза – хлорохина. Показано, что в присутствии хлорохина восстановление количества протеасом в клетках происходит быстрее (рис. 3а, б). В лизатах клеток, инкубированных с хлорохином, количество протеасом практически не снижалось через 6 и 9 ч после ТШ, что может указывать на деградацию части протеасом в аутофагасомах через 6–9 ч после ТШ, однако это не до конца объясняет снижение количества протеасом через 2–4 ч после ТШ (рис. 3а, б). Известно, что протеасомы могут секретироваться из клеток в составе внеклеточных везикул как в норме, так и под действием факторов стресса [18, 19]. Поэтому мы оценили возможную секрецию протеасом в составе экзосом или микровезикул из клеток после ТШ. Анализ результатов ультрацентрифугирования образцов культуральной жидкости клеток выявил постепенное увеличение количества инкапсулированных α-субъединиц протеасом, что указывает на вероятное отсутствие какого-либо стремительного выброса протеасом из клеток в составе внеклеточных везикул сразу после ТШ (рис. 3в).
Можно предположить, что субъединицы протеасом, не входящие в состав комплекса, могут быть разрушены в других протеасомах. Действительно, показана деградация субъединицы Rpn5 регулятора 19S в клетках дрожжей [20]. Также известно, что многие субъединицы протеасом активно убиквитинируются, при этом, как минимум, часть из них подвергается этой модификации не входя в состав комплекса [21]. Хотя субъединицы протеасом подвергаются в основном моноубиквитинированию, однако, как показано недавно, этого может быть вполне достаточно для деградации субстратов в протеасомах [22]. Кроме того, ТШ вызывает активную деградацию de novo синтезироваванных белков [23]. В наших экспериментах мы наблюдали стабилизацию количества α-субъединиц протеасом в лизатах в присутствии ингибитора протеасом MG132 через 2 ч после ТШ. Это может указывать на деградацию субъединиц протеасом, не входящих в состав комплексов, в функционирующих протеасомах или на нарушения механизмов, отвечающих за деградацию самих протеасом. Последнее представляется менее вероятным, учитывая сохранение снижения количества субъединиц протеасом при ингибировании аутофагии (рис. 3а, б). При этом резкое снижение количества протеасом спустя 24 ч после ТШ может быть следствием активации аутофагии, вызванной ингибированием протеасом [24]. Накопление БТШ70 в лизатах клеток было более выражено в присутствии MG132 (рис. 3г, д), однако самый значительный рост концентрации белка начинался, как и в опытах без добавления ингибитора, через 4 ч после ТШ. Эти данные указывают на совместное действие ингибирования протеасом и ТШ, что хорошо согласуется с результатами, опубликованными ранее [25–27].
Динамика содержания мРНК генов протеасом в клетках после теплового шока
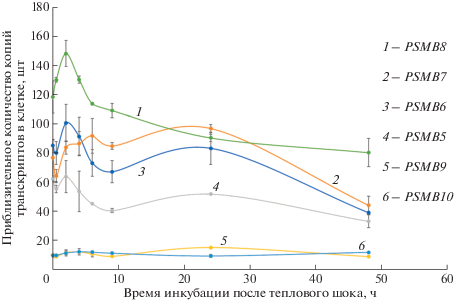
Используя разработанную систему для анализа уровней экспрессии протеасомных генов методом ПЦР в реальном времени, мы оценили накопление специфических транскриптов в клетках после ТШ. Определено содержание мРНК генов PSMB5, PSMB6, PSMB7, PSMB8, PSMB9 и PSMB10, кодирующих субъединицы β5, β1, β2, β5i, β1i и β2i, соответственно, а также уровень экспрессии гена HSPA1A. Показано, что в норме количество транскриптов протеасомных генов в клетках U937 варьирует от 10 (гены PSMB9 и PSMB10) до порядка 120 копий на клетку (PSMB8) (рис. 4). Эти данные указывают на гетерогенность пула протеасом в клетках U937 и преобладание промежуточных протеасом, содержащих набор каталитических субъединиц β1, β2, β5i, что хорошо согласуется с результатами масс-спектрометрического анализа [28]. После ТШ сначала наблюдалось некоторое снижение количества мРНК генов, кодирующих конститутивные субъединицы протеасом (β1, β2, β5). Затем, уже через 2 ч после ТШ, содержание транскриптов возрастало, после чего снижалось, но спустя 9 ч после ТШ снова начинало расти, приближаясь к значениям, близким к значениям до ТШ. Рост числа транскриптов через 2 ч после ТШ может объяснять повышение концентрации субъединиц протеасом через 4 ч после ТШ, выявленное ранее (рис. 2а, б). Другая динамика выявлена в случае генов иммунных субъединиц PSMB8 и PSMB10. Так, после пика через 2 ч после ТШ следовал плавный спад на протяжении 46 ч. Эти данные могут частично объяснить крайне медленное увеличение количества субъединицы β5i (рис. 2а, б). В целом, результаты экспериментов указывают на перестройку пула протеасом в клетках и увеличение доли конститутивных протеасом спустя 24 ч после ТШ. Уровень экспрессии гена, кодирующего БТШ70, был представлен пиком с максимумом через 9 ч после ТШ, при этом количество копий в одной клетке по приблизительным оценкам достигало 8000, после чего достаточно быстро снижалось и к 48 ч приближалось к контрольным значениям (Приложение, рис. 4). Следует отметить, что нами определено приблизительное количество транскриптов на клетку, так как оно не учитывает эффективность выделения РНК из клеток, а также эффективность и процессивность обратной транскриптазы.
Рис. 4.
Накопление мРНК протеасомных генов в клетках U937 после теплового шока, определенное методом ПЦР в реальном времени.
Таким образом, получены дополнительные данные, указывающие на комплексный характер процесса адаптации УПС к ТШ. Изменения функциональной активности протеасом после ТШ обусловлены, по всей видимости, действием целого набора факторов, включающего изменение уровня экспрессии субъединиц, деградацию протеасом и их субъединиц, нарушение процессов сборки комплексов, посттрансляционные модификации субъединиц протеасом. Учитывая важную роль протеасом в поддержании гомеостаза в нормальных и особенно в опухолевых клетках, а также развитие методов термической абляции опухолей [29], исследования молекулярных механизмов адаптации УПС к ТШ могут дать необходимые сведения для модификации протоколов, применяемых в терапии злокачественных новообразований.
Авторы выражают благодарность В.А. Морозову за участие в обсуждении результатов.
Система для анализа уровней экспрессии протеасомных генов с помощью ПЦР в реальном времени разработана, протестирована и отлажена при финансовой поддержке Российского научного фонда (грант № 18-74-10095). Исследования активности и субъединичного состава протеасом в лизатах клеток U937 выполнены при поддержке гранта Президента Российской Федерации для молодых ученых кандидатов наук (грант № МК3613.2017.4) и финансирования в рамках программы ФНИ государственных академий наук на 2013–2020, тема № 01201363823.
Настоящая статья не содержит каких-либо исследований с использованием животных в качестве объектов.
Настоящая статья не содержит каких-либо исследований с участием людей в качестве объектов исследований.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Goldberg A.L. (2007) Functions of the proteasome: from protein degradation and immune surveillance to cancer therapy. Biochem. Soc. Transactions. 35, 12‒17.
Livneh I., Cohen-Kaplan V., Cohen-Rosenzweig C., Avni N., Ciechanover A. (2016) The life cycle of the 26S proteasome: from birth, through regulation and function, and onto its death. Cell Res. 26, 869‒885.
Pickering A.M., Linder R.A., Zhang H., Forman H.J., Davies K.J. (2012) Nrf2-dependent induction of proteasome and Pa28alphabeta regulator are required for adaptation to oxidative stress. J. Biol. Chem. 287, 10021‒10031.
Fort P., Kajava A.V., Delsuc F., Coux O. (2015) Evolution of proteasome regulators in eukaryotes. Genome Biol. Evol. 7, 1363‒1379.
Morozov A.V., Karpov V.L. (2018) Biological consequences of structural and functional proteasome diversity. Heliyon. 4, e00894.
Pickering A.M., Koop A.L., Teoh C.Y., Ermak G., Grune T., Davies K.J. (2010) The immunoproteasome, the 20S proteasome and the PA28alphabeta proteasome regulator are oxidative-stress-adaptive proteolytic complexes. Biochem. J. 432, 585‒594.
Kuckelkorn U., Knuehl C., Boes-Fabian B., Drung I., Kloetzel P.M. (2000) The effect of heat shock on 20S/26S proteasomes. Biol. Chem. 381, 1017‒1023.
Kraft D.C., Deocaris C.C., Rattan S.I. (2006) Proteasomal oscillation during mild heat shock in aging human skin fibroblasts. Ann. N.Y. Acad. Sci. 1067, 224‒227.
Kim H.J., Joo H.J., Kim Y.H., Ahn S., Chang J., Hwang K.B., Lee D.H., Lee K.J. (2011) Systemic analysis of heat shock response induced by heat shock and a proteasome inhibitor MG132. PLoS One. 6, e20252.
Морозов А.В., Юринская М.М., Митькевич В.А., Гарбуз Д.Г., Преображенская О.В., Винокуров М.Г., Евгеньев М.Б., Карпов В.Л., Макаров А.А. (2017) Белок теплового шока 70 снижает активность протеасом в клетках нейробластомы человека в присутствии изомеризованного по Asp7 бета-амилоида 1‒42. Молекуляр. биология. 51(1), 166‒171. .
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. (1951) Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193, 265‒275.
Карпова Я.Д., Люпина Ю.В., Астахова Т.М., Степанова А.А., Ерохов П.А., Абрамова Е.Б., Шарова Н.П. (2013) Иммунные протеасомы в развитии иммунной системы крысы. Биоорган. химия. 39(4), 400‒410.
Morozov V.A., Morozov A.V., Denner J. (2016) New PCR diagnostic systems for the detection and quantification of porcine cytomegalovirus (PCMV). Arch. Virol. 161, 1159‒1168.
Dang F.W., Chen L., Madura K. (2016) Catalytically active proteasomes function predominantly in the cytosol. J. Biol. Chem. 291, 18765‒18777.
Cohen-Kaplan V., Livneh I., Avni N., Fabre B., Ziv T., Kwon Y.T., Ciechanover A. (2016) p62- and ubiquitin-dependent stress-induced autophagy of the mammalian 26S proteasome, Proc. Natl. Acad. Sci. USA. 113, E7490–E7499.
Cuervo A.M., Palmer A., Rivett A.J., Knecht E. (1995) Degradation of proteasomes by lysosomes in rat liver. Eur. J. Biochem. 227, 792‒800.
Zhao Y., Gong S., Shunmei E., Zou J. (2009) Induction of macroautophagy by heat. Mol. Biol. Rep. 36, 2323‒2337.
Bochmann I., Ebstein F., Lehmann A., Wohlschlaeger J., Sixt S.U., Kloetzel P.M., Dahlmann B. (2014) T lymphocytes export proteasomes by way of microparticles: a possible mechanism for generation of extracellular proteasomes. J. Cell. Mol. Med. 18, 59‒68.
Tucher C., Bode K., Schiller P., Classen L., Birr C., Souto-Carneiro M.M., Blank N., Lorenz H.M., Schiller M. (2018) Extracellular Vesicle subtypes released from activated or apoptotic T-lymphocytes carry a specific and stimulus-dependent protein cargo. Front. Immunol. 9, 534.
Peters L.Z., Karmon O., David-Kadoch G., Hazan R., Yu T., Glickman M.H., Ben-Aroya S. (2015) The protein quality control machinery regulates its misassembled proteasome subunits, PLoS Genetics. 11, e1005178.
Moiseeva T.N., Bottrill A., Melino G., Barlev N.A. (2013) DNA damage-induced ubiquitylation of proteasome controls its proteolytic activity. Oncotarget. 4, 1338‒1348.
Braten O., Livneh I., Ziv T., Admon A., Kehat I., Caspi L.H., Gonen H., Bercovich B., Godzik A., Jahandideh S., Jaroszewski L., Sommer T., Kwon Y.T., Guharoy M., Tompa P., Ciechanover A. (2016) Numerous proteins with unique characteristics are degraded by the 26S proteasome following monoubiquitination. Proc. Natl. Acad. Sci. USA. 113, E4639‒4647.
Medicherla B., Goldberg A.L. (2008) Heat shock and oxygen radicals stimulate ubiquitin-dependent degradation mainly of newly synthesized proteins. J. Cell Biol. 182, 663‒673.
Sha Z., Schnell H.M., Ruoff K., Goldberg A. (2018) Rapid induction of p62 and GABARAPL1 upon proteasome inhibition promotes survival before autophagy activation. J. Cell Biol. 217, 1757‒1776.
Grossin L., Etienne S., Gaborit N., Pinzano A., Cournil-Henrionnet C., Gerard C., Payan E., Netter P., Terlain B., Gillet P. (2004) Induction of heat shock protein 70 (Hsp70) by proteasome inhibitor MG 132 protects articular chondrocytes from cellular death in vitro and in vivo. Biorheology. 41, 521‒534.
Mathew A., Mathur S.K., Morimoto R.I. (1998) Heat shock response and protein degradation: regulation of HSF2 by the ubiquitin-proteasome pathway. Mol. Cell. Biol. 18, 5091‒5098.
Bush K.T., Goldberg A.L., Nigam S.K. (1997) Proteasome inhibition leads to a heat-shock response, induction of endoplasmic reticulum chaperones, and thermotolerance. J. Biol. Chem. 272, 9086‒9092.
Fabre B., Lambour T., Garrigues L., Ducoux-Petit M., Amalric F., Monsarrat B., Burlet-Schiltz O., Bousquet-Dubouch M.P. (2014) Label-free quantitative proteomics reveals the dynamics of proteasome complexes composition and stoichiometry in a wide range of human cell lines. J. Proteome Res. 13, 3027‒3037.
Chu K.F., Dupuy D.E. (2014) Thermal ablation of tumours: biological mechanisms and advances in therapy. Nat. Rev. Cancer. 14, 199‒208.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


