Молекулярная биология, 2019, T. 53, № 4, стр. 674-684
Резерпин как еще один ингибитор трансмембранного эффлюксного насоса AcrB
A. Shaheen a, b, W. A. Afridi a, S. Mahboob b, M. Sana a, N. Zeeshan b, F. Ismat a, O. Mirza c, M. Iqbal a, M. Rahman a, *, **
a Drug Discovery and Structural Biology Group, Health Biotechnology Division, National Institute for Biotechnology
and Genetic Engineering (NIBGE)
44000 Faisalabad, Punjab, Pakistan
b Department of Biochemistry and Biotechnology, University of Gujrat, Hafiz Hayat Campus
50700 Gujrat, Punjab, Pakistan
c Department of Drug Design and Pharmacology, Faculty of Health and Medical Sciences, University of Copenhagen
1165 Copenhagen, Denmark
* E-mail: moazur.rahman@fulbrightmail.org
** E-mail: moaz@nibge.org
Поступила в редакцию 09.07.2018
После доработки 15.12.2018
Принята к публикации 10.01.2019
Аннотация
Белок B устойчивости к акрифлавину (AcrB) – типичный представитель суперсемейства RND (Resistance-Nodulation-Division) эффлюксных транспортеров множественной лекарственной устойчивости. Доказано, что AcrB может служить мишенью для различных лекарственных средств, в том числе для многочисленных синтетических и природных ингибиторов, принадлежащих к пиранопиридинам, нафтамидам и пимозидам. Растительные акалоиды, такие как резерпин, ингибируют и АТP-связывающие кассетные транспортеры, и эффлюксные транспортеры суперсемейства MFS (major facilitator superfamily). Нами установлено, что резерпин ингибирует RND-транспортер AcrB. Предварительный анализ методом докинга указывает на то, что резерпин связывает тот же участок AcrB, что и ципрофлоксацин, известный субстрат AcrB, а также, вероятно, действует как его конкурентный ингибитор. Для экспериментов in vivo кДНК acrB Salmonella typhi клонировали под контроль промотора tac, и трансформировали клетки Escherichia coli C41 (DE3) полученным вектором. После добавления индуктора клетки, сверхэкспрессирующие ген acrB, инкубировали в среде, содержащей одновременно и ципрофлоксацин, и резерпин. Такая комбинированная обработка приводила к уcилению ингибирования роста бактерий, сверхпродуцирующих AcrB, ципрофлоксацином, по сравнению с контрольными клетками, которые трансформировали контрольным “пустым” вектором. Анализ кинетики роста клеток подтвердил сделанные наблюдения. Нами впервые показано, что резерпин ингибирует AcrB. Разработанный метод позволяет быстро и воспроизводимо оценивать влияние субстрата/ингибитора на AcrB и родственные белки-транспортеры.
ВВЕДЕНИЕ
Белок B устойчивости к акрифлавину (AcrB) – один из наиболее хорошо изученных трансмембранных эффлюксных насосов [1–6]. Этот транспортер принадлежит к суперсемейству белков RND (resistance nodulation division) и обеспечивает устойчивость грамотрицательных бактерий к широкому спектру соединений. Проведенные ранее исследования частично пролили свет на значимость “карманов” AcrB для связывания субстрата и на механизм транслокации субстратов AcrB через мембрану [7, 8]. В структуре AcrB выделяют три части – одна расположена на внутренней мембране, вторая образует канал во внешней мембране, третья представляет собой периплазматический адаптерный белок [2]. AcrB использует электрохимический градиент протонов в качестве источника энергии для выкачивания из клеток многих субстратов, включая фторхинолоны, хлорамфеникол, аминогликозиды, макролиды, тетрациклины, бета-лактамы, красители, детергенты и органические растворители [4, 9 ] . Вынос этих субстратов из клетки достигается путем согласованного действия AcrB с периплазматическим белком слияния мембран AcrA и каналом TolC внешней мембраны, которые формируют трехкомпонентную систему [10]. Для эффективного транспорта молекул необходимы все три компонента, поскольку повреждение любого из них делает бактерии крайне восприимчивыми к антибактериальным агентам [11].
В Protein Data Bank представлены более 30 структур AcrB [12] в апо- и субстрат-связанных формах [3]. Эти структуры соответствуют механизму функционального вращения, которой реализуется при транспорте субстратов, и независимо подтверждают результаты многочисленных биохимических и мутационных исследований [2, 13, 14]. AcrB организован в асимметричные гомотримеры, в которых каждый мономер, разделенный на три домена, совершает функциональное вращение, проходя через три состояния: доступ, связывание и выталкивание [1, 2, 13].
К мощным ингибиторам AcrB относятся производные индола [15], артесунат [16], MBX2319 [17], MC270,110 [9 ] и производные пиранопиридина [4], пимозида [18] и нафтамида [5], часто обладающие токсичностью. С другой стороны, соединения растительного происхождения, активные в отношении патогенов растений, благодаря механизму, называемому синергией [19], проявляют минимальную токсичность и потенциально могут использоваться для борьбы с устойчивостью бактерий к антибиотикам. Например, феофорбид порфирина, силибин, метоксифлавоны и изофлавон действуют синергично в отношении белка NorA золотистого стафилококка [20, 21]. В качестве примера растительных ингибиторов эффлюксных насосов можно привести пургин II ‒ димерный гликозидный эфир из смолы Ipomoea purga [22], антибактериальный продукт, выделенный из Hypericum olympicum L. cf. uniflorum [23], резерпин из корней Rauwolfia vomitoria [24], рамнозид кемпферола Persea lingue Nees [25] и кофейно-хинную кислоту Artemisia absinthium [26].
Резерпин относится к ингибиторам эффлюксных насосов, он подавляет эффлюксный насос Bmr, главный мембранный транспортер Bacillus subtilis [27]. Резерпин также усиливает действие тетрациклина на штаммы золотистого стафилококка, продуцирующие белок Tet (K) устойчивости к тетрациклину [28], а также отменяет множественную лекарственную устойчивость Staphylococcus aureus [29], возникновение которой связано с белком NorA.
В настоящей работе мы выяснили, ингибирует ли резерпин белок AcrB Salmonella enterica typhi (S. typhi). Данные о появлении в Пакистане штаммов, обладающих исключительно высокой устойчивостью к антибиотикам [30], указывают на необходимость детального изучения детерминант лекарственной устойчивости и способов воздействия на них. Филогенетически геном S. typhi высокогомологичен геному Escherichia coli. Важное различие между этими бактериями состоит в том, что S. typhi, как патоген, приспособившийся к определенному хозяину, вызывает системное заболевание. Сначала мы провели компьютерный анализ доступных в открытых ресурсах структур AcrB E. coli, который показал, что в активном сайте AcrB S. typhi в отличие от активного сайта AcrB кишечной палочки модифицированы два аминокислотных остатка. Молекулярный докинг (моделирование связывания) известных субстратов и лигандов AcrB ‒ резерпина и ципрофлоксацина, показал, что резерпин потенциально может связывать те же участки в молекуле AcrB, что и ципрофлоксацин. В соответствии с этим выдвинута гипотеза, согласно которой резерпин действует как конкурентный ингибитор AcrB, препятствующий выносу ципрофлоксацина, что увеличивает гибель бактерий. Чтобы подтвердить эту гипотезу, ген acrB S. typhi клонировали и экспрессировали в клетках E. coli. Показано, что резерпин усиливает активность ципрофлоксацина в этих клетках, ингибируя насос AcrB. Результаты нашей работы указывают на необходимость скрининга аналогов резерпина с целью определения их способности ингибировать выведение лекарственных средств белком AcrB, мембранным транспортером грамотрицательных бактерий-патогенов. Поиск ингибиторов AcrB имеет огромное значение для восстановления эффективности существующих антибиотиков против лекарственно устойчивых патогенных микроорганизмов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Филогенетический анализ AcrB и моделирование связывания резерпина с AcrB. Аминокислотные последовательности AcrB, использованные для проведения филогенетического анализа, получены из баз данных GenBank и Uniprot, филогенетические деревья строили с помощью программы MEGA7 [31]. Попарное выравнивание AcrB E. coli и S. typhi проводили в программе Jalview [32]. В выровненных последовательностях дополнительно сравнивали остатки, выстилающие дистальный и проксимальный карманы связывания, в соответствии с представленными Vargiu и Nikaido структурами [7]. На основании этого более детального анализа в субстратсвязывающем кармане были выявлены два остатка, которые мутировали с помощью UCSF-Chimera [33], используя в качестве матрицы структуру AcrB E. coli (PDB: 2DHH) [13]. Полученную структуру минимизировали, чтобы сгладить несоответствия и учесть необходимые контакты. Результирующую структуру использовали в качестве модели AcrB S. typhi и моделирования связывания субстрата. Процедуру докинга проводили с помощью AutoDock Vina [34], как описано ранее [8]. Для моделирования связывания удаляли миноциклиновый лиганд; структура транспортера была подготовлена к процедуре докинга путем добавления зарядов и атомов водорода. Подготовку лиганда к докингу проводили, используя также Autodock. В базе Ligand docking проведен поиск бокса объемом 3.0 нм3, расположенного в центре связывающего кармана. Связывание миноциклина использовали для сравнения, чтобы обосновать параметры поиска.
Клонирование и экспрессия гена acrB S. typhi. Ген acrB амплифицировали, используя в качестве матрицы ДНК из клинического изолята S. typhi [35] и специфические праймеры (прямой: 5'-CGCCAATTGTATGCCTAATTTCTTTATCGATCG-3' и обратный: 5'-AAATCTAGA GCGATGTTCTGTCGAATGACTATG-3'), содержащиие сайты узнавания MfeI и XbaI. Рестриктазами MfeI и XbaI гидролизовали продукт амплификации гена аcrB, полученный фрагмент клонировали по сайтам EcoRI и XbaI в вектор pMR4, производное pTTQ18, с добавлением на С-конец последовательности, кодирующей 8×His [35]. В результате получили конструкцию pMR4-АcrB, которой трансформировали штамм E. coli C41(DE3) [36]. Трансформированные клетки бактерий использовали для анализа экспрессии и in vitro экспериментов по ингибирующему действию резерпина, которое оценивали с помощью теста на диффузию в агар и анализа кривых роста бактерий. Среду LB и LB-агар использовали для выращивания бактерий, в которых проводили клонирование. Среда для аутоиндукции описана Studier [37], ее использовали для индукции продукции AcrB, которую анализировали с помощью Вестерн-блотинга. Аутоиндукционную среду применяли также при анализе ингибирования AcrB резерпином, для которого необходима среда с агаром.
Экстракция внешней бактериальной мембраны и Вестерн-блотинг. Препарат внешних мембран E. coli, содержащих рекомбинантный AcrB S. typhi, получали методом водного лизиса [35] и ресуспендировали в буферном растворе, содержащем 0.1 M фосфат натрия (~ 0.2 мл, pH 7.2). Концентрацию белка определяли по Брэдфорду. Для Вестерн-блотинга 20 мкг мембранного белка наносили на денатурирующий полиакриламидный гель (ПААГ-ДСН), разделяли с помощью электрофореза, а затем переносили на поливинилиденфторидную мембрану (PVDF) путем полусухого переноса. Для связывания с первичными антителами мембрану инкубировали с моноклональными антителами к гистидиновому довеску (“Sigma”, cat. # H1029) в Трис-содержащем буфере в разведении 1 : 3000. Мембрану отмывали тем же буфером без антител и инкубировали в растворе вторичных антител (антимышиные IgG, конъюгированные со щелочной фосфатазой, “Sigma”, cat. # A3562) в разведении 1 : 10 000. Раствор субстрата щелочной фосфатазы (“Sigma”, cat. # B5655) добавляли к мембране на ~3–5 мин до появления пурпурноого окрашивания. Реакцию останавливали, добавляя 2 мМ EDТА (10 мл), после чего мембрану высушивали на воздухе.
Измерение ингибирующего эффекта резерпина. Ингибирующую активность резерпина определяли методом диффузии в агар и построения кривых роста клеток. Использовали следующие экспериментальные процедуры.
Приготовление клеток E. coli, экспрессирующих ген acrB. Получение штамма E. coli, экспрессирующего ген acrB. Компетентные клетки E. coli C41(DE3) трансформировали вектором, содержащим клонированный ген acrB, pMR4-AcrB, и вектором pMR4 без вставки соответственно. Трансформированные клетки pMR4-AcrB/C41(DE3) и pMR4/C41(DE3) выращивали в среде LB для получения стоковой культуры. Аликвоты этой культуры помещали в 30 мл среды с аутоиндуктором [37], содержащей 50 мкг/мл ампициллина, и растили при постоянном перемешивании (225 об./мин при 37°C) до достижения OD600 = 0.8, затем температуру снижали до 20°C, продолжая инкубацию в течение ночи при 225 об./мин. Эта стадия необходима для достижения высокого уровня продукции белка перед проведением функциональных исследований. Из ночной культуры отбирали аликвоты, составляющие 0.2% (v/v), которые переносили в 30 мл свежей аутоиндукционной среды с 50 мкг/мл ампициллина и продолжали растить до OD600 = 0.6‒0.7. Эти клетки использовали в опытах по диффузии в агар и измерений, необходимых для построения кривых роста.
Метод диффузии в агар. Суспензию клеток разбавляли до OD600 = 0.1 стерильной средой для аутоиндукции, содержащей 1% (w/v) агара и 50 мкг/мл ампициллина, при умеренной температуре. Эту смесь клеток и среды с агаром выливали в чашки Петри, которые маркировали pMR4/C41(DE3) или pMR4-AcrB/C41(DE3) в зависимости от типа клеток. Агару давли остыть и затвердеть в течение 15‒20 мин. Диски из фильтровальной бумаги диаметром 6 мм, пропитанные ципрофлоксацином и резерпином по отдельности или в комбинации, а также контрольные диски (табл. 1S, см. в Приложении на сайте http://www.molecbio.ru/ downloads/2019/4/supp_Shaheen_rus.pdf) после высушивания помещали на поверхность агара и инкубировали чашки в течение 24 ч при 37°C. Измеряли размер прозрачных зон вокруг дисков, в которых произошло ингибирование роста бактерий. По результатам трех измерений определяли средние значения.
Таблица 1.
Результаты анализа диффузии в гель
| E. coli C41(DE3), трансформированные плазмидами | Ципрофлоксацин и комбинация ципрофлоксацин/резерпин, нг | Увеличение размеров зоны ингибирования роста в присутствии комбинации CIP/RES | |||
|---|---|---|---|---|---|
| 3.75 нг CIP + ДМСО | 3.75 нг CIP + 120 нг RES | 7.5 нг CIP + ДМСО | 7.5 нг CIP + 120 нг RES | ||
| pMR4-AcrB | 6 ± 1 | 12 ± 1 | 15 ± 1 | 20 ± 1.5 | 6 ± 1 |
| pMR4 (контроль) | 10 ± 1 | 8 ± 1 | 19 ± 2 | 18 ± 2 | 0 |
Примечание: Как показано на рис. 4, в присутствии 120 нг резерпина не наблюдали ингибирования роста. Растворитель ДМСО также использовали в контрольных экспериментах, чтобы исключить его влияние на рост клеток. Приведены ± значения стандартных отклонений от средних размеров зон ингибирования. ДМСО ‒ диметилсульфоксид; CIP ‒ ципрофлоксацин; RES ‒ резерпин.
Кривые клеточного роста. OD600 всех использованных типов клеток (pMR4/C41(DE3), pMR4-AcrB/C41(DE3)) доводили до значения 0.1 индукционной средой с 50 мкг/мл ампициллина. Суспензии разделяли на четыре равные части и переносили в стерильные пробирки, в которые добавляли разные концентрации ципрофлоксацина, резерпина и необходимые контрольные растворы (см. табл. 2S), и инкубировали при 37°C при перемешивании при 225 об./мин. Рост клеток анализировали через 0, 1, 2, 3, 4 и 5 ч, измеряя OD600. Проводили три независимых эксперимента, на основании полученных результатов определяли стандартные отклонения.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Филогенетический анализ AcrB грамотрицательных бактерий
Согласно данным филогенетического анализа белок AcrB S. typhi в значительной степени гомологичен белкам AcrB E. coli, Klebsiella sp. и Shigella sp. (рис. 1S, см. в Приложении на сайте http://www. molecbio.ru/downloads/2019/4/supp_Shaheen_rus.pdf). AcrB S. typhi, S. typhimurium и E. coli состоят из 1049 аминокислотных остатков. Более тщательное сравнение AcrB E. coli и S. typhi показало, что белки отличаются только по 57 положениям и идентичны на 94.47% (рис. 1). Остатки аминокислот, формирующие полость, в которой происходит связывание субстрата, практически идентичны, за исключением двух остатков ‒ Ile в позиции 277 AcrB E. coli заменен на Val у S. typhi, а Met573 у E. coli заменен на Leu (рис. 1). Следует отметить, что замена в положении 573 затрагивает структуру и проксимального, и дистального карманов связывания [7].
Рис. 1.
Сравнение AcrB S. typhi и E. coli, показывающее неконсервативные аминокислотные остатки (верхняя панель) и консенсусные последовательности (внизу). Остатки, образующие дистальный карман, находятся в красных рамках, а формирующие проксимальный карман – в синих. Черным выделены остатки аминокислот, входящие в состав двух карманов. Звездочкой отмечены неконсервативные остатки в составе карманов.

Моделирование связывания ципрофлоксацина и резерпина с AcrB
Связывание ципрофлоксацина и резерпина с AcrB анализировали, используя структуру белка AcrB S. typhi, которую in silico мутировали по двум упомянутым выше аминокислотным остаткам, и результирующую минимизированную структуру в качестве рецептора (рис. 2). Моделирование связывания референсного соединения миноциклина показало, что лучший третий вариант связывания соответствует совместно кристаллизованному состоянию с энергией связывания 7.8 ккал (рис. 2S). Эти данные хорошо согласуются с результатами моделирования связывания [8] и подтверждены симуляциями молекулярной динамики [7]. Мы продолжили анализ in silico, включив в него молекулы ципрофлоксацина и резерпина.
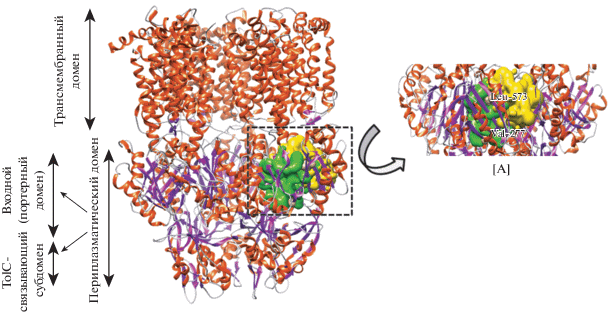
Рис. 2.
Структура AcrB (PDB ID:2DRD). Структура разделена на два больших домена, трансмембранный и цитоплазматический. Последний домен можно разделить на два субдомена ‒ входной и связывающий TolC. Поскольку аминокислотные последовательности белков AcrB E. coli и S. typhi идентичны на 94.47%, можно ожидать, что сходными будут и их общие пространственные структуры. Спирали показаны оранжевым, β-слои пурпурным, а повороты серым. Остатки, отмеченные зеленым, формируют дистальный карман, желтым – проксимальный. На вкладке [А] структура AcrB повернута вправо для того, чтобы показать нарисованные в виде шаров остатки, отличающиеся в структуре S. typhi.
Методом докинга показано, что связывание ципрофлоксацина в самой выгодной позиции стабилизировано остатками Ser48, Phe178, Ser180, Asn274, Val277, Phe610, Val612, Phe615 и Phe628 (рис. 3а). Это расположение соответствует самому правому положению связывания миноциклина в составе кристалла, в то время как остальные четыре из пяти наиболее выгодных структур занимают нижнюю левую полость (рис. 3S). В стабилизации пяти лучших конформаций большую роль играет Asn274, критически важный для связывания ципрофлоксацина в этом положении. При таких параметрах моделирования связывания AcrB Takatsuka и соавт. [8] считали ципрофлоксацин способным к “смешанному связыванию”. Этот термин авторы применяли к субстратам, которые в связанном виде занимали пространство, соответствующее положению миноциклина в составе кристаллической структуры, а именно, узкую область, напоминающую бороздку (бороздочное связывание), а также нижний более широкий карман (связывание в кармане) [8]. В нашем компьютерном исследовании к ципрофлоксацину применимо понятие связывающего бороздку, тогда как связывание в полости кармана не обнаружено.
Рис. 3.
Наиболее выгодные положения ципрофлоксацина (а) и резерпина (б), окруженных взаимодействующими остатками аминокислот. В число остатков, участвующих в связывании сразу двух субстратов, входят Ser48, Phe в позициях 178, 610, 615 и 628; Asn274 и Val277.
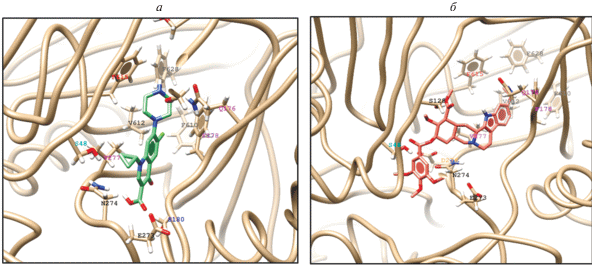
В результате проведенного анализа выявлено связывание резерпина в ориентациях, схожих с положением ципрофлоксацина. Самое выгодное положение было стабилизировано остатками Ser48, Ser128, Gln176, Phe178, Asn274, Asp276, Val277, Phe610, Val612, Phe615 и Phe628 (рис. 3б). Способность к связыванию в бороздке обнаружена во всех девяти вариантах докинга (рис. 3S, см. Приложение). Более того, пять лучших вариантов связывания резерпина показывают сходное расположение молекулы с небольшими различиями в положении углеродного скелета. В табл. 3S суммированы энергии связывания всех субстратов для докинга. Предсказанная энергия связывания резерпина выше, чем у ципрофлоксацина, причем энергия связывания ципрофлоксацина находится в том же интервале, что и у миноциклина. Сравнение положений, в которых связаны ципрофлоксацин и резерпин, показывает, что оба соединения занимают примерно одинаковый объем при связывании.
Клонирование и экспрессия гена acrB
Ген acrB клонировали в вектор pMR4 и секвенировали его перед тем как использовать в экспериментах in vitro. Этой плазмидой, pMR4-AcrB, содержащей промотор tac, трансформировали компетентные клетки E. coli C41(DE3). Синтез белка аутоиндуцировали и подтверждали с помощью Вестерн-блотинга (рис. 4S). Подвижность полосы AcrB в геле соответствует примерно 100 кДа (предсказанная молекулярная масса 114.6 кДа) и согласуется с данными предшествующих исследований [38]. Такие различия в молекулярной массе могут быть связаны с гидрофобностью мембранных белков, которая обуславливает связывание с белком избытка SDS, что увеличивает подвижность в геле белка, связанного с SDS [39].
Определение ингибирования AcrB резерпином in vitro
После подтверждения продукции белка было изучено ингибирование функции AcrB резерпином. В качестве контроля использовали клетки, трансформированные пустой плазмидой pMR4. В тестах по диффузии в агар проведена оптимизация концентраций ципрофлоксацина на дисках, поэтому в дальнейшем использовали 3.75 и 7.5 нг ципрофлоксацина на диск. Аналогичным образом установлено, что резерпин в количестве 120 нг/диск не влияет на скорость роста бактерий; поэтому эта концентрация была выбрана для тестирования комбинации веществ. Клетки E. coli C41(DE3), продуцирующие AcrB, образовывали зоны ингибирования размером 6 и 15 мм, соответственно, вокруг дисков, содержащих 3.75 и 7.5 нг ципрофлоксацина (рис. 4). Комбинации ципрофлоксацина и резерпина приводили к увеличению размеров зоны ингибирования роста с 6 до 12 мм и с 15 до 20 мм соответственно (рис. 4), что подразумевает нарушение функции транспортера AcrB. Чтобы исключить возможный вклад растворителя в ингибирование роста использовали контроль на эффект растворителя, но не выявили влияния растворителя на рост бактерий. Показано также, что трансформация клеток плазмидой без вставки практически не влияет на размеры зоны ингибирования ‒ 10 и 19 мм в присутствии только ципрофлоксацина, 8 и 18 мм в присутствии комбинации ципрофлоксацина и резерпина (рис. 4), что позволяет сделать вывод о практически одинаковом влиянии ципрофлоксацина и комбинации ципрофлоксацин/резерпин на штамм pMR4/E. coli C41(DE3). В то же время, штамм pMR4-AcrB/E. coli C41(DE3) по-другому реагировал на такие обработки (табл. 1). Эти результаты свидетельствуют о том, что активность AcrB может подавляться под действием резерпина ‒ известного ингибитора мембранных транспортеров.
Рис. 4.
Влияние ингибирования AcrB резерпином на миграцию клеток в гель. На чашки с агаром, содержащим аутоиндукционную среду, помещали клетки E. coli C41(DE3), трансформированные пустым вектором (pMR4/C41(DE3)) и плазмидой с геном аcrB (pMR4-AcrB/C41(DE3)), с конечной оптической плотностью OD600 = 0.1. CIP ‒ ципрофлоксацин; RES ‒ резерпин.

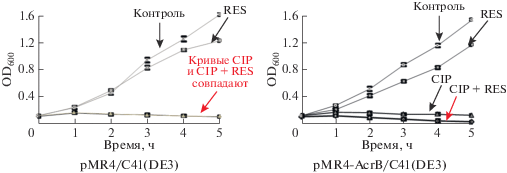
Чтобы не ограничивать исследования только экспериментами в твердой среде, мы оценили скорость роста бактерий в аутоиндукционной среде. Скорость роста клеток E. coli C41(DE3), трансформированных либо pMR4, либо pMR4-AcrB, определяли через 0, 1, 2, 3, 4 и 5 ч после обработки соответствующими веществами. Выявлено зависимое от времени ингибирование роста pMR4/E. coli C41(DE3) и pMR4-AcrB/E. coli C41(DE3), обработанных 7.5 мкг/10 мл резерпина и 0.3125 мкг/10 мл ципрофлоксацина (табл. 2S) (рис. 5). Можно видеть, что клетки E. coli C41(DE3) с плазмидой pMR4-AcrB в присутствии комбинации ципрофлоксацина и резерпина росли медленнее, чем клетки, содержащие pMR4 (пустой вектор), что свидетельствует об ингибировании AcrB резерпином. Более того, клетки, трансформированные контрольным вектором, имели сходную динамику роста при обработке только ципрофлоксацином и комбинацией ципрофлоксацин + резерпин. Нами получены перекрывающиеся кривые роста этого штамма, что подразумевает отсутствие чувствительности к резерпину в отсутствие AcrB в мембране.
Рис. 5.
Кривые роста бактерий, показывающие ингибирование AcrB резерпином. В среду для аутоиндукции инокулировали трансформированные плазмидами клетки E. coli C41(DE3) ‒ pMR4/C41(DE3) и pMR4-AcrB/C41(DE3), до конечного значения OD600 менее 0.1. На кривых отмечены значения стандартной ошибки в измерении OD600. Кривые CIP и CIP + RES совпадают в случае pMR4/C41(DE3). Концентрации резерпина и ципрофлоксацина, которые использовали в этом эксперименте, приведены в табл. 2S . CIP ‒ ципрофлоксацин; RES ‒ резерпин.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Salmonella enterica серовар typhi ‒ одна из главных угроз человеческой жизни в субконтинентальной части Индии. Эпидемии брюшного тифа являются серьезной проблемой в плотно населенных областях с низким уровнем гигиены. Данное исследование направлено на изучение ингибирования белка-транспортера AcrB S. typhi под действием растительного алакалоида – резерпина. Алкалоиды резерпин, эфедрин и кокаин действуют на мембранные транспортеры [40]. Резерпин относится к индольным алкалоидам, производным триптофана [41].
В соответствии с основным вкладом AcrB в повышение устойчивости бактериальной клетки к лекарственным средствам существует большой интерес к разработке ингибиторов, способных снижать активность AcrB. Большинство исследований сконцентрировано на синтезе новых ингибиторов, относящихся к соединениям разных классов [5], однако нами показано, что резерпин необходимо рассматривать как усилитель действия антибиотиков против таких смертоносных инфекций, как тиф. Следует отметить, что резерпин в малых дозах рекомендован для нормализации повышенного или умеренно высокого артериального давления и лечения психических заболеваний [41]. Докинг резерпина в структуре AcrB указывает на его способность связаться с AcrB в субстратсвязывающем кармане. Связывание резерпина с AcrB может обеспечиваться главным образом гидрофобными взаимодействиями между остатками фенилаланина и валина в молекуле белка и ароматическим скелетом резерпина. Вклад полярных и заряженных аминокислотных остатков AcrB, в частности, аспарагиновой кислоты, серина, глутамина и аспарагина, свидетельствует о частично ионном характере взаимодействия. Подобное частично ионное связывание остатков мембранного транспортера с резерпином обнаружено также в кристаллической структуре связанного с резерпином белка MdfA E. coli [42], члена суперсемейства MFS. В трехмерной структуре MdfA, связанного с резерпином, три метоксильных группы резерпина расположены вблизи остатка Asp в положении 34, который, возможно, формирует водородные связи, стабилизирующие структуру [42].
Количественное определение снижения активности AcrB с помощью метода диффузии в агар не позволяло получить воспроизводимые результаты из-за меняющегося уровня продукции белка при индукции с помощью IPTG (результаты не приведены). Метод продукции белков в условиях аутоиндукции позволяет достичь одновременной индукции экспрессии соответствующего гена в трансформированных клетках в условиях насыщения, повышая тем самым продукцию белка [37], что позволяет устранить проблему невоспроизводимых результатов, с которой мы столкнулись при попытках проведения экспериментов in vivo. Более того, метод диффузии в гель, который рутинно использовали для категоризации патогенных бактерий на резистентные к антибиотикам, промежуточные и восприимчивые к лекарствам, теперь можно было использовать при наличии подходящего контроля для изучения влияния субстратов и ингибиторов на трансмембранные транспортеры. Результаты экспериментов in vitro, проводимых с использованием твердых и жидких сред, показали, что в присутствии резерпина активность AcrB снижается, а действие ципрофлоксацина на бактерии усиливается. Предполагается, что действие резерпина обусловлено его прямым связыванием с молекулой транспортера и конкурентным ингибированием эффлюксного насоса на стадии согласованного переноса через мембрану протона/субстрата [42]. Конкурентные свойства резерпина более выражены в присутствии ципрофлоксацина, чем других фторхинолонов, что можно объяснить наличием менее громоздкого заместителя в позиции C-7, а также гидрофильными свойствами ципрофлоксацина [43].
Резерпин – это индольный алкалоид [44], известный как средство от гипертонической болезни, рассматривается также как многообещающее средство для химиотерапии рака, поскольку он подавляет выведение противоопухолевых препаратов из линий опухолевых клеток, сверхпродуцирующих Р-гликопротеин. [44]. Ранее было показано, что резерпин ингибирует транспортеры суперсемейства MFS, такие как NorA S. aureus и Bmr B. subtilis [29, 45] и транспортеры суперсемейства белков, содержащих АТР-связывающую кассету (ABC), например EfrAB E. faecalis [46] и Р-гликопротеин человека, из устойчивых к лекарственным препаратам клеток опухолей [44]. Результаты нашего исследования говорят о потенциале резерпина в снижении активности наиболее распространенного RND-транспортера грамотрицательных бактерий, а именно AcrB. Необходимо серьезное изучение возможностей ингибирования AcrB, особенно у бактерий рода Salmonella, поскольку роль AcrB связана не только с повышением лекарственной устойчивости. Еще одну важную проблему представляет опосредованная AcrB вирулентность при остром сальмонеллезе [6]. Детальный скрининг аналогов резерпина и других индольных алкалоидных ингибиторов AcrB, как ожидается, позволит получить более полезную информацию. Поскольку резерпин разрешен к применению в качестве антидепрессанта и антигипертонического средства, его можно рассматривать как один из вариантов борьбы с возможной устойчивостью к антибиотикам в тяжелых случаях брюшного тифа. Необходимо проведение химического синтеза или поиска и выделения индольных аклалоидов, которые могут ингибировать AcrB.
ЗАКЛЮЧЕНИЕ
Представленная работа посвящена роли резерпина в увеличении эффлюксной активности S. typhi, обусловленной белком AcrB. S. typhi входит в число главных причин смертности во многих разввающихся странах [30], однако исследования эффлюксных транспортеров лекарственных средств у S. typhi малочисленны [35]. Моделирование связывания, проведенное нами, говорит о том, что резерпин и ципрофлоксацин имеют перекрывающиеся сайты связывания с AcrB. Руководствуясь этой информацией, мы провели эксперименты in vitro, сначала используя метод диффузии в гель, а затем построив кривые зависимости роста бактерий от времени. Представленные методики признаны нами пригодными для воспроизводимого измерения активности мембранных транспортеров. В условиях ограниченных ресурсов такие альтернативные подходы могут применяться для определения активности мембранных транспортеров и влияния субстратов. Эта работа расширяет понимание роли резерпина как ингибитора мембранных транспортеров суперсемейства RND и указывает на то, что ингибиторы на основе акалоидов могут действовать как модуляторы активности транспортера AcrB.
Эта работа была финансирована Комиссией высшего образования Пакистана (грант № 20-1504 под руководством M. Rahman).
Авторы не имеют конфликта интересов.
Статья не содержит результатов исследований с использованием животных объектов.
Список литературы
Seeger M.A., Diederichs K., Eicher T., Brandstatter L., Schiefner A., Verrey F., Pos K.M. (2008) The AcrB efflux pump: conformational cycling and peristalsis lead to multidrug resistance. Curr. Drug Targets. 9, 729–749.
Seeger M.A., Schiefner A., Eicher T., Verrey F., Diederichs K., Pos K.M. (2006) Structural asymmetry of AcrB trimer suggests a peristaltic pump mechanism. Science. 313, 1295–1298.
Shaheen A., Iqbal M., Mirza O., Rahman M. (2017) Structural biology meets drug resistance: an overview on multidrug resistance transporters. J. Indian Inst. Sci. 97, 165–175.
Opperman T.J., Kwasny S.M., Kim H.S., Nguyen S.T., Houseweart C., D’Souza S., Walker G.C., Peet N.P., Nikaido H., Bowlin T.L. (2014) Characterization of a novel pyranopyridine inhibitor of the AcrAB efflux pump of Escherichia coli. Antimicrob. Agents Chemother. 58, 722–733.
Wang Y., Mowla R., Ji S., Guo L., De Barros Lopes M.A., Jin C., Song D., Ma S., Venter H. (2018) Design, synthesis and biological activity evaluation of novel 4-subtituted 2-naphthamide derivatives as AcrB inhibitors. Eur. J. Med. Chem. 143, 699–709.
Wang-Kan X., Blair J.M.A., Chirullo B., Betts J., La Ragione R.M., Ivens A., Ricci V., Opperman T.J., Piddock L.J.V. (2017) Lack of AcrB efflux function confers loss of virulence on Salmonella enterica serovar Typhimurium. MBio. 8(4). pii: e00968-17. https://doi.org/10.1128/mBio.00968-17
Vargiu A.V., Nikaido H. (2012) Multidrug binding properties of the AcrB efflux pump characterized by molecular dynamics simulations. Proc. Natl. Acad. Sci. USA. 109, 20637–20642.
Takatsuka Y., Chen C., Nikaido H. (2010) Mechanism of recognition of compounds of diverse structures by the multidrug efflux pump AcrB of Escherichia coli. Proc. Natl. Acad. Sci. USA. 107, 6559–6565.
Aparna V., Dineshkumar K., Mohanalakshmi N., Velmurugan D., Hopper W. (2014) Identification of natural compound inhibitors for multidrug efflux pumps of Escherichia coli and Pseudomonas aeruginosa using in silico high-throughput virtual screening and in vitro validation. PLoS One. 9, e101840.
Pakzad I., Zayyen Karin M., Taherikalani M., Boustanshenas M., Lari A.R. (2013) Contribution of AcrAB efflux pump to ciprofloxacin resistance in Klebsiella pneumoniae isolated from burn patients. GMS Hyg. Infect. Control. 8(2), Doc15. https://doi.org/10.3205/dgkh000215
Das D., Xu Q.S., Lee J.Y., Ankoudinova I., Huang C., Lou Y., DeGiovanni A., Kim R., Kim S.H. (2007) Crystal structure of the multidrug efflux transporter AcrB at 3.1A resolution reveals the N-terminal region with conserved amino acids. J. Struct. Biol. 158, 494–502.
Berman H.M., Westbrook J., Feng Z., Gilliland G., Bhat T.N., Weissig H., Shindyalov I.N., Bourne P.E. (2000) The Protein Data Bank. Nucleic Acids Res. 28, 235–242.
Murakami S., Nakashima R., Yamashita E., Matsumoto T., Yamaguchi A. (2006) Crystal structures of a multidrug transporter reveal a functionally rotating mechanism. Nature. 443, 173–179.
Soparkar K., Kinana A.D., Weeks J.W., Morrison K.D., Nikaido H., Misra R. (2015) Reversal of the drug binding pocket defects of the AcrB multidrug efflux pump protein of Escherichia coli. J. Bacteriol. 197, 3255–3264.
Zeng B., Wang H., Zou L., Zhang A., Yang X., Guan Z. (2010) Evaluation and target validation of indole derivatives as inhibitors of the AcrAB-TolC efflux pump. Biosci. Biotechnol. Biochem. 74, 2237–2241.
Li B., Yao Q., Pan X.C., Wang N., Zhang R., Li J., Ding G., Liu X., Wu C., Ran D., Zheng J., Zhou H. (2011) Artesunate enhances the antibacterial effect of beta-lactam antibiotics against Escherichia coli by increasing antibiotic accumulation via inhibition of the multidrug efflux pump system AcrAB-TolC. J. Antimicrob. Chemother. 66, 769–777.
Vargiu A.V., Ruggerone P., Opperman T.J., Nguyen S.T., Nikaido H. (2014) Molecular mechanism of MBX2319 inhibition of Escherichia coli AcrB multidrug efflux pump and comparison with other inhibitors. Antimicrob. Agents Chemother. 58, 6224–6234.
Bohnert J.A., Schuster S., Kern W.V. (2013) Pimozide inhibits the AcrAB-TolC efflux pump in Escherichia coli. Open Microbiol. J. 7, 83–86.
Hemaiswarya S., Kruthiventi A.K., Doble M. (2008) Synergism between natural products and antibiotics against infectious diseases. Phytomedicine. 15, 639–652.
Stermitz F.R., Tawara-Matsuda J., Lorenz P., Mueller P., Zenewicz L., Lewis K. (2000) 5'-Methoxyhydnocarpin-D and pheophorbide A: berberis species components that potentiate berberine growth inhibition of resistant Staphylococcus aureus. J. Nat. Prod. 63, 1146–1149.
Stermitz F.R., Beeson T.D., Mueller P.J., Hsiang J., Lewis K. (2001) Staphylococcus aureus MDR efflux pump inhibitors from a Berberis and a Mahonia (sensu strictu) species. Biochem. Syst. Ecol. 29, 793–798.
Castaneda-Gomez J., Figueroa-Gonzalez G., Jacobo N., Pereda-Miranda R. (2013) Purgin II, a resin glycoside ester-type dimer and inhibitor of multidrug efflux pumps from Ipomoea purga. J. Nat. Prod. 76, 64–71.
Shiu W.K., Malkinson J.P., Rahman M.M., Curry J., Stapleton P., Gunaratnam M., Neidle S., Mushtaq S., Warner M., Livermore D.M., Evangelopoulos D., Basavannacharya C., Bhakta S., Schindler B.D., Seo S.M., Coleman D., Kaatz G.W., Gibbons S. (2013) A new plant-derived antibacterial is an inhibitor of efflux pumps in Staphylococcus aureus. Int. J. Antimicrob. Agents. 42, 513–518.
Schmitz F.J., Fluit A.C., Luckefahr M., Engler B., Hofmann B., Verhoef J., Heinz H.P., Hadding U., Jones M.E. (1998) The effect of reserpine, an inhibitor of multidrug efflux pumps, on the in vitro activities of ciprofloxacin, sparfloxacin and moxifloxacin against clinical isolates of Staphylococcus aureus. J. Antimicrob. Chemother. 42, 807–810.
Holler J.G., Christensen S.B., Slotved H.C., Rasmussen H.B., Guzman A., Olsen C.E., Petersen B., Molgaard P. (2012) Novel inhibitory activity of the Staphylococcus aureus NorA efflux pump by a kaempferol rhamnoside isolated from Persea lingue Nees. J. Antimicrob. Chemother. 67, 1138–1144.
Fiamegos Y.C., Kastritis P.L., Exarchou V., Han H., Bonvin A.M., Vervoort J., Lewis K., Hamblin M.R., Tegos G.P. (2011) Antimicrobial and efflux pump inhibitory activity of caffeoylquinic acids from Artemisia absinthium against Gram-positive pathogenic bacteria. PLoS One 6, e18127.
Neyfakh A.A., Bidnenko V.E., Chen L.B. (1991) Efflux-mediated multidrug resistance in Bacillus subtilis: similarities and dissimilarities with the mammalian system. Proc. Natl. Acad. Sci. USA. 88, 4781–4785.
Gibbons S., Udo E.E. (2000) The effect of reserpine, a modulator of multidrug efflux pumps, on the in vitro activity of tetracycline against clinical isolates of methicillin resistant Staphylococcus aureus (MRSA) possessing the tet(K) determinant. Phytother. Res. 14, 139–140.
Neyfakh A.A., Borsch C.M., Kaatz G.W. (1993) Fluoroquinolone resistance protein NorA of Staphylococcus aureus is a multidrug efflux transporter. Antimicrob. Agents Chemother. 37, 128–129.
Klemm E.J., Shakoor S., Page A.J., Qamar F.N., Judge K., Saeed D.K., Wong V.K., Dallman T.J., Nair S., Baker S., Shaheen G., Qureshi S., Yousafzai M.T., Saleem M.K., Hasan Z., Dougan G., Hasan R. (2018) Emergence of an extensively drug-resistant Salmonella enterica serovar Typhi clone harboring a promiscuous plasmid encoding resistance to fluoroquinolones and third-generation cephalosporins. MBio. 9(1), pii: e00105-18. https://doi.org/10.1128/mBio.00105-18
Kumar S., Stecher G., Tamura K. (2016) MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Mol. Biol. Evol. 33, 1870–1874.
Waterhouse A.M., Procter J.B., Martin D.M., Clamp M., Barton G.J. (2009) Jalview version 2-a multiple sequence alignment editor and analysis workbench. Bioinformatics. 25, 1189–1191.
Pettersen E.F., Goddard T.D., Huang C.C., Couch G.S., Greenblatt D.M., Meng E.C., Ferrin T.E. (2004) UCSF chimera – a visualization system for exploratory research and analysis. J. Comput. Chem. 25, 1605–1612.
Trott O., Olson A.J. (2010) AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading. J. Comput. Chem. 31, 455–461.
Shaheen A., Ismat F., Iqbal M., Haque A., De Zorzi R., Mirza O., Walz T., Rahman M. (2015) Characterization of putative multidrug resistance transporters of the major facilitator-superfamily expressed in Salmonella Typhi. J. Infect. Chemother. 21, 357–362.
Miroux B., Walker J.E. (1996) Over-production of proteins in Escherichia coli: mutant hosts that allow synthesis of some membrane proteins and globular proteins at high levels. J. Mol. Biol. 260, 289–298.
Studier F.W. (2005) Protein production by auto-induction in high density shaking cultures. Protein Expr. Purif. 41, 207–234.
Hayashi K., Nakashima R., Sakurai K., Kitagawa K., Yamasaki S., Nishino K., Yamaguchi A. (2016) AcrB-AcrA fusion proteins that act as multidrug efflux transporters. J. Bacteriol. 198, 332–342.
Ward A., Sanderson N.M., O’Reilly J., Rutherford N.G., Poolman B., Henderson P.J.F. (1999) The amplified expression, identification, purification, assay, and properties of hexahistidine-tagged bacterial membrane transport proteins. Membrane Transport–A Practical Approach edit. Oxford: Oxford University Press.
Wink M. (2008) Ecological roles of alkaloids. In: Modern Alkaloids: Structure, Isolation, Synthesis, and Biology. Eds Fattorusso E., Taglialatela-Scafati O. John Wiley & Sons, V. 1, p. 665.
Roberts M.F. (2013) Enzymology of alkaloid biosynthesis. In: Alkaloids: Biochemistry, Ecology, and Medicinal Applications. Ed. Roberts M.F. Springer Science & Business Media, US, p. 482.
Liu M., Heng J., Gao Y., Wang X. (2016) Crystal structures of MdfA complexed with acetylcholine and inhibitor reserpine. Biophys. Rep. 2, 78–85.
Beyer R., Pestova E., Millichap J.J., Stosor V., Nos-kin G.A., Peterson L.R. (2000) A convenient assay for estimating the possible involvement of efflux of fluoroquinolones by Streptococcus pneumoniae and Staphylococcus aureus: evidence for diminished moxifloxacin, sparfloxacin, and trovafloxacin efflux. Antimicrob. Agents Chemother. 44, 798–801.
Abdelfatah S.A., Efferth T. (2015) Cytotoxicity of the indole alkaloid reserpine from Rauwolfia serpentina against drug-resistant tumor cells. Phytomedicine. 22, 308–318.
Ahmed M., Borsch C.M., Neyfakh A.A., Schuldiner S. (1993) Mutants of the Bacillus subtilis multidrug transporter Bmr with altered sensitivity to the antihypertensive alkaloid reserpine. J. Biol. Chem. 268, 11086–11089.
Lee E.W., Huda M.N., Kuroda T., Mizushima T., Tsuchiya T. (2003) EfrAB, an ABC multidrug efflux pump in Enterococcus faecalis. Antimicrob. Agents Chemother. 47, 3733–3738.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


