Молекулярная биология, 2019, T. 53, № 4, стр. 541-560
Перспективы использования пептидов против респираторно-синцитиального вируса
И. П. Шиловский a, *, С. М. Андреев a, К. В. Кожихова a, А. А. Никольский a, М. Р. Хаитов a
a Государственный научный центр “Институт иммунологии”
Федерального медико-биологического агентства
115522 Москва, Россия
* E-mail: ip.shilovsky@nrcii.ru
Поступила в редакцию 20.02.2019
После доработки 13.03.2019
Принята к публикации 13.03.2019
Аннотация
Один из самых распространенных вирусных патогенов – респираторно-синцитиальный вирус (РСВ). Он поражает нижние дыхательные пути, что может приводить к бронхиолиту и/или пневмонии. Попытки создать профилактическую вакцину оказались неудачными. Для терапии РСВ в настоящее время применяется Виразол (Рибавирин), который вызывает многочисленные побочные эффекты. В настоящее время разработаны препараты на основе вируснейтрализующих моноклональных антител: IGIV (Respigam), Palivizumab (Synagis) и MEDI-524 (Numab). Сейчас они проходят клинические испытания, но уже понятно, что их использование будет ограничено высокой стоимостью. Одно из перспективных направлений исследований – использование природных пептидов (дефензинов и кателицидинов) или их синтетических аналогов в качестве противовирусных агентов. Большинство исследований по пептидным противовирусным препаратам сконцентрировано на вирусах иммунодефицита человека, герпеса и гриппа. В то же время накоплены экспериментальные данные по противовирусным свойствам пептидов в отношении РСВ. Главные преимущества пептидных препаратов – широкий спектр противовирусной активности и низкая токсичность. Однако внедрению таких препаратов в медицинскую практику препятствует, прежде всего, низкая устойчивость к действию протеаз. Учитывая, что РСВ поражает эпителий респираторного тракта, где активность протеаз существенно ниже, чем в системном кровотоке, вполне оправдано создание местно действующих пептидных препаратов, например, ингаляционных лекарственных форм. Кроме того, повышения устойчивости пептидов можно добиться путем их модификации, например, синтезом разветвленных пептидов или рекомбинантных форм белков-предшественников. Пептиды с анти-РСВ-активностью по механизму действия можно разделить на несколько групп. Во-первых, ингибиторы прикрепления и/или слияния вириона с клеткой-мишенью. Во-вторых, пептиды с прямым вирулицидным действием – разрушающие оболочку вириона. Такие пептиды подавляют ранние стадии жизненного цикла РСВ, поэтому их считают перспективными препаратами для профилактического применения. Для ряда пептидов описаны иммунорегулирующие свойства, поэтому их можно рассматривать как потенциальные терапевтики. В обзоре обобщены сведения по пептидам, активным в отношении РСВ, проанализированы возможные механизмы их противовирусной активности и перспективы развития технологии противовирусных пептидов.
ВВЕДЕНИЕ
Таксономически респираторно-синцитиальный вирус (РСВ) относится к порядку Mononegavirales, семейству Pneumoviridae, роду Orthopneumovirus. РСВ – один из самых значимых патогенов, вызывающих тяжелые заболевания верхних и нижних дыхательных путей, особенно в группах риска (новорожденные, дети раннего возраста, лица с иммунодефицитами, пациенты с бронхиальной астмой и хронической обструктивной болезнью легких) [1]. Ежегодно в мире в результате заболеваний нижних дыхательных путей, связанных с РСВ, умирает несколько миллионов детей младше 5 лет [2]. Эффективной вакцины против РСВ в настоящее время нет. Попытки создать вакцину от РСВ оказались неудачными по причине побочных эффектов или неспособности индуцировать адекватный иммунный ответ [3]. К сожалению, эффективных, безопасных и при этом доступных методов лечения РСВ-инфекции до сих пор не разработано. Применение рибавирина ограничено побочными эффектами [4]. Использование препаратов на основе моноклональных антител: IGIV (Respigam), Palivizumab (Synagis) и MEDI-524 (Numab) – ограничено их высокой стоимостью [5]. Ведутся работы над созданием специфических ингибиторов транскрипции генов вируса на основе малых интерферирующих РНК (siРНК) [6]. Технологии применения наночастиц в качестве антивирусных агентов также находятся в состоянии разработки [7]. За последние 15 лет синтезирован ряд низкомолекулярных органических соединений, которые, связываясь с белком слияния (белок F) РСВ, ингибируют проникновение вирионов в клетки (блокирование слияния вируса с клеткой). Однако в результате мутаций в белке F быстро появляются устойчивые к ингибиторам варианты РСВ [8]. Таким образом, остро стоит вопрос о необходимости разработки принципиально новых подходов к конструированию средств для терапии РСВ-инфекции.
Одним из актуальных направлений в разработке новых противовирусных препаратов считается использование природных пептидов, таких как дефензины и кателицидины. Главное преимущество этих соединений – широкий спектр противовирусной активности, когда один пептид активен в отношении целого ряда патогенов, что объясняется разнообразием механизмов действия; один и тот же пептид может оказывать влияние на разные стадии жизненного цикла вируса. На сегодняшний день в экспериментах in vitro и in vivo продемонстрирована противовирусная активность дефензинов и кателицидинов в отношении многих вирусов, включая ВИЧ-1, вирусы герпеса, папилломы человека, гепатита В и С [9]. Появляется все больше свидетельств о способности природных пептидов ингибировать респираторные вирусы [10]. К немаловажным преимуществам природных пептидов, помимо широкого спектра действия, можно отнести их биосовместимость и низкую токсичность. К настоящему времени для более 15 пептидсодержащих потенциальных антибактериальных и противовирусных препаратов успешно завершены доклинические исследования и начаты клинические испытания [11].
Несмотря на очевидные преимущества пептидов как потенциальных лекарственных препаратов, есть ряд проблем, препятствующих их внедрению в медицинскую практику. Во-первых, высокая себестоимость пептидов, как при их выделении из природных источников, так и при искусственном синтезе их полноразмерных форм. Дело в том, что укорочение пептидов приводит к изменению их трехмерной структуры и, как следствие, к утрате противовирусной активности [12]. Во-вторых, низкая устойчивость линейных пептидов в системном кровотоке – их быстро расщепляют протеазы сыворотки крови. В-третьих, большинство авторских коллективов рассматривают пептидные соединения лишь в качестве профилактических средств, так как они чаще всего нарушают ранние этапы инфекционного процесса.
Конечно, проблемы с использованием соединений пептидов в качестве лекарственных средств есть, но они преодолимы. И такие подходы уже разработаны. В обзоре обобщены сведения по противовирусной активности пептидов в отношении РСВ, проанализированы возможные механизмы их действия и перспективы использования в терапии РСВ-инфекции.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ РСВ С КЛЕТКОЙ
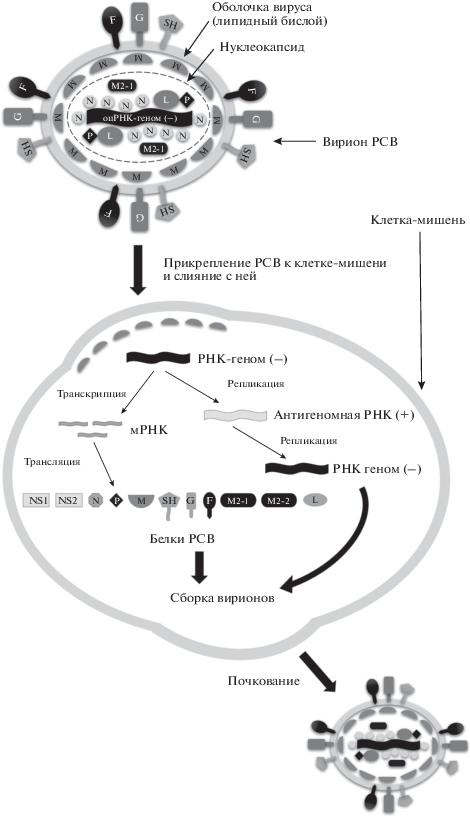
Геном РСВ представлен одноцепочечной несегментированной молекулой РНК негативной полярности размером 15191–15226 нуклеотидов (штамм А2, GenBank Acc. № M74568). Геном РСВ кодирует 10 генов: NS1, NS2, N, P, M, SH, G, F, M2 и L, – которые в ходе экспрессии первоначально транскрибируются в виде индивидуальных молекул мРНК, каждая из которых кодирует соответствующий белок, за исключением мРНК гена M2, которая имеет в своей структуре две перекрывающиеся открытые рамки считывания для белков M2-1 и M2-2 [13]. Негативный РНК-геном вируса инкапсулирован в нуклеокапсид, который состоит из белка N, РНК-полимеразы (белка L) и его кофактора (белка P), а также белка М2-1. Матриксный белок, М, окружает нуклеокапсид, тем самым играя роль “мостика” между нуклеокапсидом и оболочкой вириона, сформированной липидным бислоем, в который включены гликопротеины: белок слияния F, белок G и малый гидрофобный белок SH. Белок М2-2 и два неструктурных белка, NS1 и NS2, не обнаружены в составе вирионов РСВ [14] (рис. 1).
Жизненный цикл РСВ начинается с этапа прикрепления вириона к клетке-мишени с последующим слиянием мембраны вируса и клеточной мембраны, что обеспечивается двумя гликопротеинами: G и F соответственно. В результате геном вируса проникает в цитоплазму клетки, где происходит его транскрипция и трансляция вирусных белков. Кроме того, на геномной, (–)-цепи, РНК идет репликация комплементарной, (+)-цепи, РНК, называемой антигеномной РНК, с которой затем синтезируются новые (–)-цепи РНК РСВ. Вновь образовавшаяся молекула геномной РНК ассоциирует с белком N и упаковывается в нуклеокапсид, который также содержит белки L и P. Этот нуклеопротеиновый комплекс транспортируется к плазматической мембране клетки, где через белок M взаимодействует с вирусными гликопротеинами. В результате образуются вирусные частицы, которые отпочковываются от клетки-мишени в виде сформированных инфекционных вирионов [14] (рис. 1).
При рассмотрении подходов к терапии РСВ-инфекции в качестве мишеней для вирусспецифичных препаратов могут быть гликопротеины оболочки вируса (белки G, F и SH), а также их лиганды – клеточные рецепторы, опосредующие связывание и проникновение вируса в клетку. Из трех гликопротеинов оболочки белок G необходим для прикрепления вириона к клетке, а белок F для слияния с ней. Функция белка SH до конца неясна. По-видимому, F-белок играет ключевую роль в инфекционном цикле РСВ, так как он даже в отсутствии других поверхностных гликопротеинов – белков G и SH – способен осуществлять как прикрепление вириона к клетке-мишени, так процесс слияния с ней [14]. На роль вероятных клеточных рецепторов для РСВ “претендовало” множество кандидатов. Показано, что РСВ эффективно связывается с иммортализованными линейными клетками – их поверхность характеризуется высокой плотностью протеогликанов HSPG [15]. Однако таких молекул нет на клетках реснитчатого эпителия, которые служат первичными воротами РСВ-инфекции in vivo. В то же время установлено, что белок G связывается с хемокиновым рецептором CX3CR1, который экспрессируется на апикальной поверхности реснитчатых эпителиальных клеток бронхов [16]. Кроме того, экспериментально показано, что для проникновения РСВ в клетку важен 100-кДа белок, нуклеолин, с которым связывается вирусный белок F [17]. Таким образом, при внедрении в клетку-мишень РСВ, видимо, может использовать в качестве рецепторов несколько клеточных компонентов (рис. 1).
После входа вируса в клетку инициируется этап репликации его генома и транскрипции генов. В репликации генома участвуют три белка: N, P и L. Белки P и L – это субъединицы РНК-зависимой РНК-полимеразы, а белок N, связываясь с геномной РНК, защищает ее от нуклеаз клетки. Транскрипция мРНК осуществляется тем же ферментом; при этом РНК-полимераза распознает старт- и стоп-кодоны генома вируса, то есть, полимераза РСВ способна “переключаться” с репликативного на транскрипционный режим. В результате транскрипции синтезируется 10 зрелых мРНК [13] (рис. 1).
В сборку вирионов вовлечен актиновый цитоскелет клетки, который транспортирует гликопротеины вируса (белки F, G и SH) к апикальной поверхности мембраны клетки. Одновременно, белок N связывается с заново синтезированной геномной РНК вируса и РНК-зависимой РНК-полимеразой (белками L и P), формируя рибонуклеопротеиновый комплекс, который дополнительно ассоциируется с белком M, и затем также транспортируется к апикальной поверхности мембраны клетки – месту локализации гликопротеинов. Сборка вирионов РСВ внутри инфицированной клетки происходит за счет олигомеризации М-белка, связанного как с белками F и G, так и с рибонуклеопротеиновым комплексом. После сборки происходит отпочковывание вириона от клетки, в ходе которого формируется “выпячивание” мембраны клетки и отделение зрелого вириона путем разрезания мембраны в основании выпячивания [18] (рис. 1).
Понимание молекулярных механизмов РСВ-инфекции позволяет выявить наиболее значимые молекулярные мишени для таргетной терапии. Помимо очевидных мишеней: белков G и F, необходимых для прикрепления вириона к клетке и слияния с ней, и клеточных рецепторов РСВ, – заслуживают внимания белки L и P – как субъединицы фермента, необходимого для реализации инфекционного цикла вируса, а также белок N, обеспечивающий “выживание” геномной РНК в инфицированной клетке.
ПРИРОДНЫЕ ПЕПТИДЫ КАК ПЕРСПЕКТИВНЫЕ ПРОТИВОВИРУСНЫЕ СРЕДСТВА
Природные пептиды составляют неотъемлемую часть врожденной иммунной системы у различных организмов (насекомые, рептилии, птицы и млекопитающие) и выполняют антимикробную, иммуномодулирующую и противовирусную роль. У млекопитающих выделяют два главных семейства природных пептидов: дефензины и кателицидины.
Дефензины
Дефензины представляют собой катионные пептиды, которые генерируются в организме из пептидов-предшественников путем протеолиза. В зависимости от трехмерной структуры дефензины подразделяются на подсемейства: альфа, бета и тета. Альфа-дефензины обнаружены у ряда млекопитающих, в том числе шесть у человека: HNP1–4 и HD5–6. Они продуцируются главным образом нейтрофилами, а также эпителиальными клетками. Большинство исследований альфа-дефензинов посвящено их антимикробным свойствам [19]. Однако имеются экспериментальные доказательства противовирусной активности альфа-дефензинов, например, в отношении вируса простого герпеса, цитомегаловируса и вируса везикулярного стоматита [20]. Показана способность альфа-дефензинов ингибировать инфекционный цикл ВИЧ-1 как на стадии проникновения вируса в клетку, так и на этапах обратной транскрипции и сборки вирионов [21]. Также альфа-дефензины обладают противовирусной активностью в отношении респираторных вирусов, например, вируса гриппа [22]. Стоит отметить, что максимальная противовирусная активность альфа-дефензинов зарегистрирована в безсывороточных условиях, в то время как контакт с сывороткой приводит к инактивации. Это свидетельствует о низкой стабильности этих природных пептидов, что, соответственно, ограничивает возможности их системного применения. Таким образом, в настоящее время альфа-дефензины можно рассматривать только в перспективе их использования в качестве препаратов топического (местного) действия.
Бета-дефензины структурно представляют собой пептиды с одной α-спиралью и тремя β-тяжами, стабилизированными дисульфидными связями. Они обнаружены у широкого круга животных, как позвоночных, так и беспозвоночных. У человека выявлено более 30 пептидов этого семейства. Как и для альфа-дефензинов, для бета-дефензинов изучена в основном антибактериальная активность [23]. В ряде исследований выявлены и их противовирусные свойства. В частности, бета-дефензины нарушают инфекционный цикл вируса простого герпеса, препятствуя связыванию вируса с клеткой и его последующему проникновению [24], ингибируют инфекцию ВИЧ-1, подавляя экспрессию CXCR4 на поверхности CD4-клеток и напрямую воздействуя на вирионы [25]. Продемонстрирована способность бета-дефензинов подавлять репликацию вируса гриппа [26] и РСВ [27].
Тета-дефензины существенно отличаются от альфа- и бета-дефензинов тем, что имеют циклическую структуру. В организме человека не выявлено тета-дефензинов, хотя в геноме существует ряд псевдогенов, с которых потенциально могут экспрессироваться эти пептиды. На основе анализа таких псевдогенов тета-дефензины человека были искусственно воспроизведены (так называемые ретроциклины) и изучены их биологические свойства. Оказалось, что ретроциклины RC1 и RC2 ингибируют репликацию вируса простого герпеса in vitro путем блокирования этапа проникновения вируса в клетку [28], а также инактивируют вирионы ВИЧ-1 [29]. Ретроциклины активны также в отношении респираторных вирусов, например, вируса гриппа [30]. Однако, как и в случае альфа-дефензинов, противовирусная активность ретроциклинов значительно нивелируется сывороткой, что затрудняет их системное применение, хотя остается возможность их использования в форме топических антивирусных средств.
Кателицидины
Кателицидины представляют собой отдельное семейство природных катионных пептидов, отличающихся от дефензинов тем, что состоят из консервативного домена кателина (cathelin) и вариабельного C-концевого региона, который подвергается процессингу, в результате чего образуется зрелый функциональный пептид [9]. У человека обнаружен один кателицидин размером 18 кДа (hCAP-18). Протеаза-3 расщепляет hCAP-18 до активной формы LL-37 – катионного пептида размером 4.5 кДа с α-спиральной структурой [9]. Для LL-37 хорошо изучены антимикробные свойства [31]. Описаны его и противовирусные свойства, например, в отношении ВИЧ-1 [32], а также вируса гриппа [33] и РСВ [34].
Таким образом, в результате анализа мировой научной литературы можно сделать вывод, что природные пептиды (дефензины и кателицидины) помимо антимикробных проявляют и противовирусные свойства, в том числе по отношению к респираторным вирусам. Однако их внедрение в практическую медицину ограничено рядом недостатков. Во-первых, природные пептиды быстро инактивируются протеазами сыворотки крови, что затрудняет их системное (например, внутривенное) применение. Во-вторых, получение природных пептидов или их рекомбинантных форм – дорогостоящее производство, что затруднит их коммерциализацию. В-третьих, ввиду плейотропного биологического эффекта пептидов трудно установить точный механизм их действия. Несмотря на эти недостатки, к использованию пептидов как потенциальных противовирусных средств интерес растет, о чем свидетельствует тот факт, что не менее 15 пептидсодержащих противомикробных препаратов находится на стадии клинических испытаний [11].
ПЕПТИДЫ С АНТИ-РСВ АКТИВНОСТЬЮ
Бета-дефензин-2 человека
Бета-дефензин-2 человека (human beta-defensin-2, HBD2) – это богатый цистеином катионный пептид, размером 41 аминокислотных остатков (а.о.). У человека идентифицировано 2 бета-дефензина: HBD1 и HBD2. Ген, кодирующий HBD1, DEFB1, не содержит регуляторного элемента для NF-kB и экспрессируется конституционно, главным образом в эпителии урогенитального тракта. Наоборот, ген DEFB4A, кодирующий HBD-2, содержит регуляторный элемент для связывания с фактором NF-kB, а его экспрессия индуцируется в ответ на провоспалительные стимулы. Экспрессия HBD-2 зафиксирована преимущественно в коже и легких. В ряде исследований показано, что провоспалительный цитокин TNF обладает противовирусной активностью в отношении РСВ, которая развивается по NF-kB-зависимому и интерфероннезависимому механизму [27, 35]. При более детальном исследовании доказано, что HBD2, активирующийся в эпителиальных клетках легких по TNF/NF-kB-пути, обладает выраженными противовирусными свойствами по отношению к РСВ; при этом инактивация HBD2 в клетках частично нивелирует противовирусные свойства TNF. По всей видимости, помимо HBD2 есть и другие факторы противовирусной защиты, активирующиеся в ответ на TNF [27]. Предполагается, что HBD2 дестабилизирует оболочку вируса и, как следствие, блокирует его проникновение в клетку, так как предварительная инкубация РСВ с HBD2 в диапазоне концентраций от 1 до 6 мкг/мл (оптимум 2 мкг/мл, что соответствует 0.46 мкМ) снижала титр вируса в зараженных клетках более чем в 100 раз (табл. 1). Цитотоксичность, изученная в стандартном МТТ-тесте на культуре клеток А549 (карцинома легкого человека), зарегистрирована для HBD2 в концентрации 80–100 мкг/мл [27]. Таким образом, HBD2 обладает анти-РСВ-активностью в нетоксичном диапазоне концентраций, что позволяет рассматривать его как перспективный противовирусный препарат. Однако размер HBD2 довольно внушительный (41 а.о.), поэтому искусственно синтезировать его экономически нецелесообразно.
Таблица 1.
Пептиды, обладающие противовирусной активностью в отношении РСВ*
| Пептид | Последовательность | Структура | EC50, мкМ | Ссылки |
|---|---|---|---|---|
| HBD2 | GIGDPVTCLKSGAICHPVFCPRRYKQIGTCGLPGTKCCKKP | н.д. | 0.46 | [27] |
| T-118 | FDASISQVNEKINQSLAFIRKSDELLHNVNAOKST | н.д. | 0.051 | [36] |
| G149–197 | KQRQNKPPSKPNNDFHFEVFNFVPCSICSNNPTCWAICKRIPNKKPGKK | н.д. | 80.0 | [37] |
| G163–197 | FHFEVFNFVPCSICSNNPTCWAICKRIPNKKPGKK | н.д. | 80.0 | [37] |
| G149–189 | KQRQNKPPSKPNNDFHFEVFNFVPCSICSNNPTCWAICKR | н.д. | 12.0 | [37] |
| G154–189 | KPPSKPNNDFHFEVFNFVPCSICSNNPTCWAICKR | н.д. | 12.0 | [37] |
| G158–189 | KPNNDFHFEVFNFVPCSICSNNPTCWAICKR | н.д. | 25.0 | [37] |
| G149–177 | KQRQNKPPSKPNNDFHFEVFNFVPBSIBG | н.д. | 4.0 | [37] |
| G154–177 | KPPSKPNNDFHFEVFNFVPBSIBG | н.д. | 5.0 | [37] |
| G158–177 | KPNNDFHFEVFNFVPBSIBG | н.д. | 50.0 | [37] |
| G162–177 | DFHFEVFNFVPBSIBG | н.д. | 60.0 | [37] |
| G166–177 | EVFNFVPBSIBG | н.д. | 80.0 | [37] |
| G149–173 | KQRQNKPPSKPNNDFHFEVFNFVPB | н.д. | 80.0 | [37] |
| G154–171 | KPPSKPNNDFHFEVFNFV | н.д. | 14.0 | [37] |
| G154–170 | KPPSKPNNDFHFEVFNF | н.д. | 7.0 | [37] |
| HRSV-B G154-177 | NPPKKPKDDYHFEVFNFVPBSIBG | н.д. | 21.0 | [37] |
| Б.Н. | Ac-cyclo-(3,7),(8,12)-FP[KDEFD][KSIRD]V-NH2 | αС | 0.036 | [12] |
| SB056-dim | WKKIRVRLSA | Д.П. | 3.2 | [38, 39] |
| SB007-pyrE | pyrE-KKIRVRLSA | Р.П. | 2.4 | [38, 39] |
| SB105 | ASLRVRIKKQ | Р.П. | 3.0 | [38, 39] |
| SB105-A10 | ASLRVRIKK | Р.П. | 0.25 | [38, 39] |
| LL-37 | LLGDFFRKSKEKIGKEFKRIVQRIKDFLRNLVPRTES | н.д. | 0.67–5.60 | [34, 40] |
| LL-37 (Core) | KIGKEFKRIVQRIKDFLRNLVP | н.д. | 1.1–9.3 | [34, 40] |
| CXCL9 (74–103) | CLNPDSADVKELIKKWEKQVSQKKKQKNGK | н.д. | 23.0 | [41] |
| Acetyl-CXCL9(74–103)-amide | CLNPDSADVKELIKKWEKQVSQKKKQKNGK | н.д. | 31.0 | [41] |
| CXCL9 (74–93) | CLNPDSADVKELIKKWEKQV | н.д. | 50.0 | [41] |
| CXCL12γ (68–98) | RQVCIDPKLKWIQEYLEKALNKGRREEKVGK | н.д. | 115.0 | [41] |
| CXCL12γ (77–98) | KWIQEYLEKALNKGRREEKVGK | н.д. | 109.0 | [41] |
| Мелиттин | GIGAVLKVLTTGLPALISWIKRKRQQ | αС | 0.12 | [42] |
| RhoA77–95 | TDVILMCFSIDSPDSLENI | н.д. | 0.25 | [43, 44] |
| LTP | R8K4K2KAC-NH2 | Р.П. | 0.64 | [45] |
Пептид Т-118 белка F
В исследованиях ВИЧ-1 показано, что синтетические пептиды DP-107 и DP-178 – производные спирализованных доменов трансмембранного белка gp4l – эффективно ингибируют вирусную инфекции. Учитывая хорошо изученную структуру белка gp4l, Lambert с соавт. [36] провели биоинформационный анализ белка F РСВ и идентифицировали в нем аналогичные домены. Как упоминалось выше, белок F необходим для слияния вириона с клеткой-мишенью. В составе F-белка есть два гидрофобных участка: первый (близкий к С-концу) заякоривает белок в оболочке вируса, второй (близкий к N-концу) взаимодействует с клеткой-мишенью, тем самым инициируя процесс слияния. Затем была синтезирована библиотека из 16 пептидов размером 35 а.о. каждый, перекрывающих идентифицированные домены белка F, и проведен скрининг их антивирусной активности на предмет способности блокировать образование синцития при РСВ-инфекции. Проведенный скрининг выявил, что 13 из 16 пептидов проявляли противовирусные свойства в диапазоне EC50 (концентрация, при которой происходит снижение титра вируса на 50%) от 6 до 30 мкг/мл (что соответствует 0.1–0.5 мкМ). Для более детального изучения некоторые высокоактивные пептиды очистили и проанализировали их противовирусную активность. В результате выявлен наиболее активный в отношении РСВ пептид – T-118 с EC50 0.05 мкM.
Показано, что пептид T-118 специфичен именно к РСВ – репликацию других вирусов, таких как вируса парагриппа и ВИЧ-1, не ингибировал или ингибировал в значительно более высокой концентрации. Его цитотоксичность проявлялась только при высоких концентрациях – 50%-ная цитотоксическая концентрация, CC50, установленная на основе экспериментов in vitro, превышала 500 мкг/мл (128 мкМ) (табл. 1). По мнению авторов, наиболее вероятный молекулярный механизм действия пептида T-118 – его связывание с белком F, что приводит к неспособности последнего изменять свою конформацию и осуществлять слияние РСВ с клеткой-мишенью. Несмотря на высокую биологическую активность пептида, его химический синтез в промышленном масштабе будет нерентабельным – из-за большого размера (35 а.о.) [36].
Пептид из белка G
Белок G – гликопротеин, необходимый для прикрепления РСВ к клетке-мишени, состоит из нескольких доменов: цитоплазматического (I), трансмембранного (II) и эктодомена (III). В последнем выделяют три субдомена: негликозилированный центральный и два гликозилированных вариабельных, которые фланкируют центральный.
В результате биоинформатического анализа аминокислотной последовательности белка G субтипов А и В РСВ человека, а также РСВ крупного рогатого скота и овец установлено, что именно центральный негликозилированный субдомен высоко консервативен и, по-видимому, важен для реализации функциональной активности G-белка – взаимодействия с его рецептором на клетке. Gorman и др. [37] привели экспериментальные доказательства значимости этой области белка G для инфекционного процесса. Они синтезировали пептид из центрального негликозилированного субдомена белка G (G149–197) размером 48 а.о., который в экспериментах in vitro ингибировал РСВ-инфекцию в культуре клеток HEp-2; ЕС50 составила 80 мкМ (таб. 1). Противовирусный эффект пептида можно объяснить его взаимодействием с рецептором РСВ на поверхности клетки, что препятствует связыванию с ним G-белка и, следовательно, абсорбции вирионов РСВ на клетке-мишени [37]. Все эти данные указывают на значимость белка G для жизненного цикла РСВ и на перспективность его использования в качестве мишени при разработке препаратов прямого противовирусного действия.
Пептид, формирующий α-спираль белка F
Как упоминалось выше, белок F необходим для процесса слияния РСВ и клетки-мишени. Стоит отдельно упомянуть, что после трансляции внутри инфицированной клетки белок F разрезается протеазой на две субъединицы: F1 и F2, – которые остаются связаны между собой дисульфидными мостиками. На поверхности зрелого вириона этот белок находится в виде тримера F1/F2-гетеродимеров. На N-конце субъединицы F1 располагается пептид слияния (FP) с прилегающим к нему α-спиральным участком HR-N. На С-конце F1 располагается трансмембранный домен (TM) с α-спиральным участком HR-C, который обеспечивает заякоривание белка в оболочке вируса. В процессе слияния пептид FP взаимодействует с мембраной клетки-мишени, после чего происходит реорганизация пространственной структуры белка F, в ходе которой участки HR-C и HR-N сближаются, формируя шпилечную структуру. Это приводит к сближению мембран клетки и вириона и, в итоге, к их слиянию (рис. 2).
Рис. 2.
Структура белка F и молекулярный механизм его участия в процессе слияния вириона и клетки-мишени. а – Доменная структура белка F. Белок F в ходе процессинга разрезается на две субъединицы, F1 и F2. FP – пептид слияния, необходим для взаимодействия с мембраной клетки-мишени. ТМ – трансмембранный домен, необходим для заякоревания белка F в оболочке РСВ. HR-C и HR-N – регионы, формирующие α-спиральную структуру белка F. Домены D1, D2 и D3 формируют главный глобулярный домен белка F. б – Схематическое изображение структуры F-белка. Функциональный белок F представляет собой тример F1/F2 гетеродимеров. В нем выделяют главный глобулярный домен, формируемый доменами D1, D2, D3, FP и спиральным участком HR-N, а также “ствол” белка, формируемый спиральной областью HR-C и ТМ. в – Механизм слияния РСВ и клетки-мишени. Белок F заякорен в оболочке РСВ за счет ТМ. FP взаимодействует с мембраной клетки-мишени, что инициирует пространственную перестройку белка F, заключающуюся в сближении α-спиральных областей HR-C и HR-N, что в итоге приводит к формированию шпилечной структуры и сближению мембран вируса и клетки. В результате мембраны вируса и клетки сливаются и геном РСВ проникает в цитоплазму клетки.
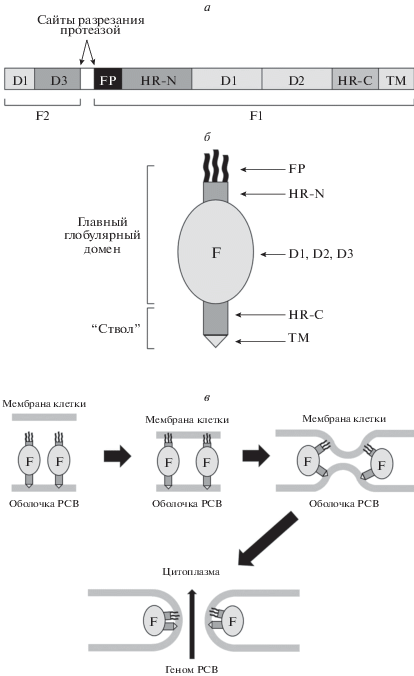
На основании анализа молекулярных механизмов процесса слияния вириона РСВ и клетки гидрофобный участок HR-N рассматривают как перспективную мишень для дизайна ингибиторов слияния, так как при нарушении структуры этого участка шпилечная структура F-белка не образуется и, как следствие, не происходит сближения мембран вириона и клетки. Учитывая структуру белка F, Shepherd и соавт. [12] изучили функциональную значимость α-спирального участка HR-C длиной 13 а.о. (483FPSDEFDASISQV495). Искусственно синтезированный линейный пептид HR-C483–495, формирующий эту спиралевидную область в белке F, не проявлял противовирусных свойств в экспериментах in vitro. По всей видимости, это связано с тем, что 13-членный пептид не способен формировать вторичную структуру, которая присуща этой области в полноразмерном белке, и тем самым не может быть его конкурентным ингибитором. На основе той же последовательности синтезирован пептид Ac-cyclo-(3,7),(8,12)-FP[KDEFD][KSIRD]V-NH2, который содержал лактамные мостики между остатками 3K и 7D, а также 8K и 12D, стабилизирующие α‑спиральную структуру этого короткого пептида. Стабилизированный пептид обладал выраженными противовирусными свойствами в отношении РСВ (ЕС50 0.036 мкМ при CC50 более 80 мкМ) [12] (табл. 1).
Дендримерный пептид SB105-A10
РСВ взаимодействует с протеогликанами гепарансульфата, HSPG, на поверхности клеток-мишеней, в связи с чем HSPG рассматривают как возможную мишень анти-РСВ-препаратов. Dona-lisio с соавт. [38] синтезировали библиотеку из 9 пептидных конструкций с различной структурой (линейные, димерные, дендримерные пептиды), которые содержат кластер положительно заряженных аминокислотных остатков, потенциально способных взаимодействовать с HSPG и блокировать инфекционный процесс [38].
HSPG состоит из белкового кора, содержащего гликозаминогликановые цепи, которые в свою очередь содержат неразветвленные цепи гепарансульфатов, структурно схожих с гепарином [46]. Отрицательно заряженные сульфатированные или карбоксильные группы HSPG или гепарина взаимодействуют с кластером положительно заряженных аминокислотных остатков гепарин-связывающего домена (heparin-binding domain, HBD) белка G РСВ. Сходные с HBD домены выявлены и в вирусном белке F [47].
В экспериментах in vitro выявлена противовирусная активность четырех пептидов этой библиотеки: димерного пептида SB056-dim5 и трех тетрамерных пептидов (SB007-pyrE, SB105, и SB105-A10) [38]. Значения ЕС50 варьировали в диапазоне концентраций 0.25–4.40 мкМ; при этом самым эффективным ингибитором РСВ оказался тетрамерный (разветвленный дендримерный пептид) пептид SB105-A10 (ЕС50 0.25 мкМ). Значения CC50 для этих пептидов превышали 20 мкМ, так что их анти-РСВ-активность не связана с цитотоксическим действием (табл. 1). При исследовании механизма действия пептидов РСВ инкубировали с SB105-A10, заражали клетки и определяли титр вируса. Показано, что преинкубация РСВ с пептидом не влияла на репликативную активность вируса, то есть SB105-A10 не проявлял вирулицидных свойств в отношении РСВ. Однако пептид SB105-A10 взаимодействовал с HSPG на поверхности клеток HEp-2 и А549, что показано конкурентным ингибированием гепарином [38]. Следовательно, пептид SB105-A10, связываясь с клеточным рецептором РСВ, HSPG, ингибирует их взаимодействие.
Известно, что образование синцитиев (слившихся инфицированных клеток) – один из механизмов передачи вируса от клетки к клетке. С целью оценить влияние SB105-A10 на этот процесс Donalisio с соавт. [38] инфицировали вирусом культуру клеток HEp-2, после чего добавляли пептид и инкубировали его с клетками с последующей оценкой числа и размера синцитиев. В концентрации 21.3 мкМ дендримерный пептид SB105-A10 подавлял процесс образования синцитиев; при этом гепарин не ингибировал инфекционность РСВ [38, 39].
Пептид SB105-A10 содержит область оснóвных аминокислотных остатков ASLRVRIKK, которые имитируют HBD-домены гликопротеинов G и F вируса. По всей видимости, противовирусные свойства этого пептида обусловлены конкурентным ингибированием белков G и F за связывание с клеточным рецептором – HSPG. Эта гипотеза отчасти подтверждается тем, что SB105-A10 блокирует инфекционность других вирусов, использующих HSPG в качестве рецептора для проникновения в клетки-мишени (вирус папилломы человека, вирус простого герпеса и цитомегаловирус), но не проявляет противовирусной активности против ротавирусов и аденовирусов, которые используют другие клеточные рецепторы в инфекционном цикле [39]. Нельзя исключать и иных механизмов противовирусного действия SB105-A10, например, блокирование межклеточной передачи вируса [38].
Кателицидин – пептид LL-37
Единственный кателицидин, обнаруженный у человека, – катионный антимикробный пептид LL-37, активная форма которого образуется в результате протеолитического расщепления белка-предшественника hCAP-18. LL-37 продуцируется нейтрофилами и эпителиальными клетками. Антибактериальные свойства этого пептида хорошо изучены и накапливаются сведения и о его противовирусной активности. Currie с соавт. [34] провели серию экспериментов in vitro, в которых клетки HEp-2 инфицировали РСВ и одновременно обрабатывали пептидом, а через 24 ч оценивали количество бляшек. Как оказалось, LL-37 в концентрациях от 3 до 25 мкг/мл (1.1–9.3 мкМ) значительно снижал репликацию РСВ (таб. 1). Этот пептид секретируется во внеклеточное пространство, поэтому для имитации естественных условий, когда вирус и пептид контактируют до попадания вируса в клетку, РСВ инкубировали с LL-37 до заражения клеток. В такой постановке эксперимента антивирусный эффект пептида регистрировали, но он был ниже, чем при совместной инкубации пептида, РСВ и клеток. В то же время отложенная на 2 ч и более инкубация пептида с клетками (пептид вносили в культуру клеток через 2 ч после их инфицирования РСВ) нивелировала противовирусный эффект; в случае же преинкубации пептида с клетками его антивирусная активность была хорошо выражена. Таким образом, анти-РСВ-активность пептида LL-37 обусловлена прямым воздействием как на клетки-мишени, так и на вирионы [34].
С целью выяснить молекулярные механизмы антивирусного действия LL-37 Currie и др. [34] конъюгировали его с флуоресцентным красителем TAMRA и с помощью конфокальной микроскопии исследовали его клеточную локализацию. Установлено, что пептид проникает внутрь клетки и локализуется вокруг ядра. По-видимому, используя не известный нам пока механизм, LL-37 активирует внутри клетки так называемое “антивирусное состояние”, чем и объясняется его противовирусный эффект в режиме преинкубации с клетками – до их заражения РСВ. Ранее показано [48], что LL-37 модулирует активность интерферонов I типа – факторов с доказанными противовирусными свойствами, поэтому дополнительно были проведены исследования на культуре клеток с нокаутом по генам этих интерферонов. Показано, что инактивация интерферонов не снижала противовирусный эффект LL-37. Таким образом LL-37 защищает клетки от действия РСВ по неустановленному интерфероннезависимому механизму. Не исключено, что интернализованный пептид ингибирует внутриклеточные стадии репликации РСВ, приводя к снижению числа отпочковавшихся вирионов. С целью выяснить влияние пептида на появление новых инфекционных вирионов клетки Hep-2 инфицировали РСВ и культивировали в присутствии LL-37. По сравнению с необработанными клетками в присутствии пептида накопление жизнеспособных вирусных частиц в супернатанте клеток (что определяли методом титрования на клетках Hep-2) происходило значительно медленнее. Из этого следует, что пептид LL-37 может ингибировать распространение РСВ, например, посредством блокирования почкования вирионов от инфицированной клетки [34].
Три года спустя эта же группа исследователей опубликовала новые данные по анти-РСВ-активности LL-37 – уже в системе in vivo. Мышей заражали РСВ интраназально; одновременно, тоже интраназально, вводили LL-37 в дозе 10 мкг/мышь, после чего продолжали курс LL-37 в течение 6 суток. У животных, получавших пептид в таком режиме, не наблюдали потери массы тела, при этом репликация РСВ в ткани легких была снижена в 2 раза [40]. Как обсуждалось выше, в экспериментах in vitro введение LL-37 в клетки перед заражением их РСВ ингибировало инфекционный процесс [34]. Однако аналогичный режим введения пептида – перед инфицированием в экспериментах in vivo (пептид LL-37 вводили за 1 ч до инфекции) – не оказывал протективного действия на мышей. В то же время при одновременном введении РСВ и LL-37 животным противовирусный эффект регистрировали. Следовательно, LL-37 работает как противовирусный агент при контакте с РСВ [40].
Как обсуждалось выше, в исследовании Currie и соавт. [34] показано, что LL-37 проявляет антивирусные свойства по механизмам, не зависимым от экспрессии интерферонов I и III типов. По всей видимости, анти-РСВ эффект LL-37 связан с прямым повреждающим действием на вирионы. При профилактическом режиме введения (за 1 ч до инфекции) LL-37 не защищал животных от заражения РСВ, что, скорее всего, связано с коротким периодом полужизни пептида или с его интернализацией внутрь клетки [40].
При исследовании механизмов антивирусного действия LL-37 Currie и соавт. [34] оценивали аффинность связывания РСВ с LL-37 в формате иммуноферментного анализа (ИФА) и выявили специфическое взаимодействие между ними. Чтобы понять, приводит ли это связывание к разрушению вирионов, проведено окрашивание вирусных частиц флуоресцентно меченными моноклональными антителами против поверхностного белка F и белка N, который локализуется внутри вириона. Интактные вирусные частицы имели высокий уровень колокализации белков N и P, в то время как при контакте с LL-37 происходило двукратное снижение степени колокализации указанных белков, что свидетельствует о нарушении целостности вирионов. Чтобы убедиться в способности LL-37 подавлять инфекцию эпителиальных клеток проведены эксперименты in vitro, в которых клетки HEp-2 инкубировали с пептидом и РСВ при +4°C (при данной температуре происходит прикрепление вируса к клетке, но не происходит его слияния с ней) с последующим окрашиванием вируса моноклональными антителами к F-белку и детекцией методом проточной цитометрии. В результате выявлено, что в присутствии LL-37 с клетками связано меньше вирионов РСВ, чем в его отсутствие. На основании полученных данных авторы сделали вывод, что контакт РСВ с LL-37 на начальном этапе инфекционного цикла приводит к повреждению вирусных частиц и, как следствие, к утрате их способности связываться с клетками-мишенями [40].
Катионные пептиды из С-концевых участков хемокинов CXCL9 и CXCL12γ
Гликозаминогликаны представляют собой полисахариды, локализующиеся на поверхности многих типов клеток. Они подразделяются на несколько подклассов: гепарин, гепарансульфаты, хондроитинсульфаты, дерматансульфаты, кератансульфаты и гиалуроновые кислоты. Гепарансульфаты за счет сульфатных групп обладают значительным отрицательным зарядом, что позволяет им взаимодействовать с положительно заряженными белками, например, поверхностными белками вирусов (в том числе РСВ), и участвовать в инициации инфекционного процесса. Недавно показано, что хемокины CXCL9 и CXCL12γ обладают значительным положительным зарядом, особенно на С-концевых участках (до 50% аминокислотных остатков положительно заряжены), причем это не характерно для других хемокинов. Такие особенности первичной структуры CXCL9 и CXCL12γ привлекли к ним внимание по следующим причинам. Логично предположить, что CXCL9 и CXCL12γ могут взаимодействовать с гликозаминогликанами вирусов и тем самым обладать противовирусной активностью, в том числе и в отношении РСВ.
Vanheule и др. [41] синтезировали 8 пептидов из С-концевых участков CXCL9 и CXCL12γ (6 пептидов из CXCL9 и 2 пептида из CXCL12γ). Прежде всего исследовали способность синтезированных пептидов взаимодействовать с гепарином, предварительно меченным биотином. Методом поверхностного плазмонного резонанса установлено, что 6 из 8 изучаемых пептидов с большой аффинностью связываются с гепарином и гепарансульфатами. Это связывание, по всей видимости, обеспечивается присутствием в структуре пептидов гликозаминогликансвязывающих доменов (BBXB и XBBBXXBX), где B – положительно заряженный аминокислотный остаток, а Х – остаток любой другой аминокислоты. Действительно, пептиды CXCL9(74–103), Acetyl-CXCL9(74–103)-amide, CXCL9(74–93), CXCL12γ(68–98) и CXCL12γ(77–98), содержащие по 2 гликозаминогликансвязывающих домена, обладали максимальной аффинностью. Аффинность пептида CXCL9(86–103), в составе которого этих доменов нет, к гепарину оказалась на 2 порядка ниже, чем вышеупомянутых с двумя доменами. Пептиды CXCL9(79–103) и CXCL9(74–86) с одним гликозаминогликансвязывающим доменом также оказались низкоаффинными. По-видимому, наличие 2 гликозаминогликансвязывающих доменов необходимо для стабилизации взаимодействия пептидов с рецептором [41].
Выявив варианты пептидов с высоким сродством к гепарину, авторы изучили их способность связываться с гликозаминогликанами на поверхности клеток. Для этого по N-концу пептида вводили биотиновую метку, инкубировали с клетками СНО и окрашивали их флуоресцентно меченным стрептавидином; интенсивность флуоресценции детектировали методом проточной цитометрии. Обнаружено, что пептиды связываются с поверхностью клеток, причем через гликозаминогликаны – это показано с использованием ингибитора экспрессии гликозаминогликанов, NaClO3 [41].
Противовирусная активность в отношении РСВ выявлена для 5 из 8 исследованных пептидов: CXCL9(74–103), Acetyl-CXCL9(74–103)-amide, CXCL9(74–93), CXCL12γ(68–98) и CXCL12γ(77–98). Значения ЕС50 варьировали от 23 до 115 мкМ, а CC50 превышали 150 мкМ (таб. 1). Учитывая, что противовирусная активность пептидов коррелировала с их аффинностью к гепарину, логично предположить, что они блокируют процесс связывания РСВ с клеточными рецепторами – гликозаминогликанами [41].
Мелиттин
Пептид мелиттин представляет собой катионный пептид с α-спиральной структурой размером 26 а.о. Мелиттин, главный компонент пчелиного яда (до 40%) с выраженной антимикробной активностью, а также противовирусным действием в отношении ряда оболочечных вирусов (вируса гриппа, вируса везикулярного стоматита, вируса простого герпеса и др.) [42]. Uddin с соавт. [42] исследовали противовирусную активность мелиттина в отношении РСВ. Мелиттин вносили в культуру клеток HEp-2 на 2 ч, после чего клетки инфицировали РСВ. Расчитанное значение ЕС50 составило 0.35 мкг/мл (0.12 мкМ; табл. 1), что сопоставимо со значениями для других оболочечных вирусов: 1.18 мкг/мл (0.4 мкМ) для вируса везикулярного стоматита и 0.94 мкг/мл (0.32 мкМ) для вируса простого герпеса, – а также необолочечных: 0.76 мкг/мл (0.26 мкМ) для энтеровируса-71 и 0.99 мкг/мл (0.33 мкМ) для вируса Коксаки.
При изучении механизма действия мелиттина на оболочечные вирусы выявлено, что 5-минутная инкубация пептида с вирусом везикулярного стоматита приводит к ингиброванию репликации вируса, при этом процесс приклепления и внедрения вируса в клетку не нарушается. На примере вируса гриппа показано, что при инкубации с мелиттином и последующем центрифугировании в градиенте плотности поверхностные вирусные гликопротеины, гемагглютинин и нейраминидаза, оказываются в верхних слоях сахарозного градиента (20%-ная сахароза), тогда как цельные вирионы в нижних слоях (40%-ная сахароза). По-видимому, мелиттин разрушает вирионы оболочечных вирусов.
Механизм антивирусного действия мелиттина по отношению к необолочечным вирусам остается неизвестным.
Ранее предполагали, что мелиттин индуцирует систему интерферонов I типа и тем самым активирует в клетке “антивирусное состояние”. Однако Uddin и др. [42] не нашли подтверждения этой гипотезе: хотя препарат пчелиного яда активировал экспрессию интерферона-β, очищенный мелиттин не проявлял такого действия.
Ввиду высокой противовирусной активности мелиттин считается перспективным соединением для внедрения в медицинскую практику, однако технология его выделения и очистки из природного сырья – пчелиного яда – сложный и дорогостоящий процесс. Вот почему необходимы дальнейшие исследования по его картированию и выявлению минимального фрагмента, обладающего антивирусной активностью, – это позволит удешевить его наработку, в том числе в промышленном масштабе.
Пептиды из GTPазы RhoA
Белки, поддерживающие целостность мембраны клетки, могут участвовать в РСВ-инфекции. Один из таких белков – GTPаза RhoA, локализующаяся на мембране клетки, для которой показана способность связываться с F-белком РСВ и облегчать процесс прикрепления/слияния вириона с клеткой. Pastey с соавт. [43] синтезировали ряд взаимно перекрывающихся пептидов из RhoA размером 19 а.о. и изучили их противовирусные свойства. Обработка вируса одним из пептидов, RhoA77-95, предотвращала образование синцития; величина EC50 для него составила 0.54 мкг/мл (0.25 мкМ; табл. 1). Иммуноферментным анализом не выявлено вирусных белков внутри клеток, обработанных пептидом, что свидетельствует о блокировании ранних стадий инфекционного процесса – этапа прикрепления и/или слияния вириона и клетки-мишени. Анти-РСВ-активность RhoA77-95 изучена в экспериментах in vivo и показано, что при интраназальном введении пептида в дозе 500 мкг/мышь непосредственно перед заражением или через 2 ч после него признаки инфекции были нивелированы: у животных не происходило значительного падения массы тела и наблюдалось значимое снижение вирусной нагрузки в легких [43].
Механизм действия, посредством которого RhoA77-95 предотвращает РСВ-инфекцию, по всей видимости, заключается в конкурентном ингибировании процессов прикрепления и/или слияния вириона и клетки-мишени. Это предположение авторы проверили методом ИФА в формате конкурентного ингибирования связывания белка F, сенсибилизированного на планшете, с RhoA в присутствии пептида RhoA77-95. Для детекции использовали моноклональные антитела к RhoA. Показано, что пептид RhoA77-95 эффективно ингибирует связывание RhoA с F и, следовательно, его можно рассматривать в качестве потенциального анти-РСВ-препарата [43].
Дендримерный пептид LTP
Учитывая тот факт, что противовирусная активность катионных пептидов, таких как HBD2 [27], LL-37 [40] и мелиттина [42], направлена непосредственно на вирионы РСВ, Сундукова (Sundukova) и соавт. [45] сконструировали дендримерный пептид LTP, богатый аргинином и лизином. Показано, что LTP с высокой эффективностью подавляет репликацию РСВ: значение ЕС50 составляет 1.5 мкг/мл (0.64 мкМ). Высокой противовирусной активности этого пептида, по-видимому, удалось достичь за счет разветвленной структуры с высокой плотностью положительного заряда: из 17 а.о. 16 несут положительных заряд. Как правило, заряженные пептиды оказывают литическое действие не только на мембрану вируса, но и на мембраны клеток, приводя к их гибели. В связи с этим важно заметить, что цитотоксичность LTP оказалась невысокой – величина CC50 составляла 1 мг/мл (427 мкМ), что значительно выше EC50 [45].
МЕХАНИЗМЫ ПРОТИВОВИРУСНОГО ДЕЙСТВИЯ ПЕПТИДОВ
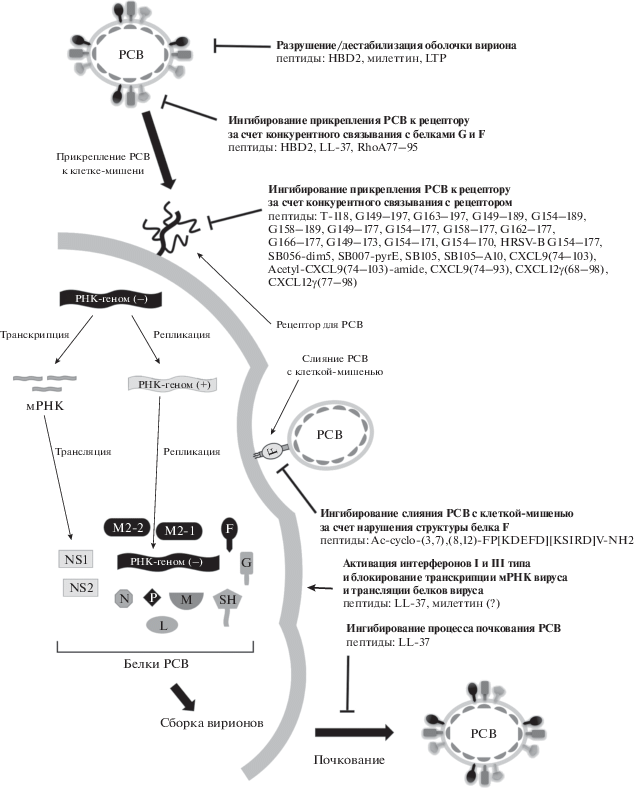
В современной научной литературе описано несколько различных механизмов антивирусного действия: ингибирование прикрепления вириона к клетке-мишени и слияния с ней, разрушение оболочки вириона и влияние на внутриклеточные процессы репликации вируса.
Ингибирование прикрепления вириона к клетке и слияния мембран
Процесс ингибирования прикрепления вириона к клетке и слияния вирусной и клеточной мембран может быть реализован двумя путями: во-первых, связыванием пептида с белками G и F вируса, которые необходимы РСВ на этих начальных стадиях инфекции; во-вторых, взаимодействием пептида с рецепторами РСВ на поверхности клеток-мишеней (рис. 3). Большинство описанных на сегодняшний день пептидов с анти-РСВ-активностью действуют по первому пути – эффективно ингибируют прикрепление и слияние вириона с клеткой (EC50 от нескольких десятков нМ [12, 36] до 100 мкМ [37–39], см. табл. 1). Однако стоит отметить, что пептиды с таким механизмом действия могут быть эффективны только в профилактическом режиме применения, то есть непосредственно перед началом инфекционного процесса, и не активны в терапевтическом режиме – когда вирион уже слился с клеткой-мишенью и началась внутриклеточная стадия репликации вируса.
Разрушение мембраны РСВ
Оболочка РСВ включает мембрану, которая в свою очередь содержит в своей структуре так называемые липидные рафты – участки, богатые сфинголипидами и холестерином, несущие отрицательный заряд. Взаимодействие пептида с мембраной вируса опосредуентся электростатическими взаимодействями, поскольку притивовирусные пептиды в подавляющем большинстве катионного типа, то есть несут положительный заряд (рис. 3). Проводя аналогию с механизмом дейсвия природных катионных антимикробных пептидов, можно предлопожить следующий молекулярный механизм разрушения оболочки вируса [49]. На начальной стадии катионный пептид взаимодействует с отрицательно заряженным участком мембраны вириона; далее после достижения опредленной критической концентрации пептида на поверхности мембраны формируется разрыв и пора, через которую низкомолекулярные соединения проникают внутрь капсида и вносят дополнительный вклад в его разрушение, после чего компоненты вириона могут высвобождаться из него, что приводит к утрате инфекционности [50].
Ингибирование репликации вируса
Геном РСВ представлен одноцепочечной молекулой РНК отрицательной полярности, а за репликацию геномной РНК отвечает фермент РНК-полимераза, которая состоит из белка L и его кофактора – белка Р. Белки L и P удерживаются в едином комплексе за счет нековалентных связей, поэтому нарушение этих связей позволит предотвратить сборку активного фермента в клетке и тем самым блокировать процесс репликации вируса. Пептиды, которые сопосбны нарушать процесс репликации РСВ, в настоящий момент не описаны, однако существуют пептиды с подобным механизмом действия в отношении другого респираторного вируса – вируса гриппа. РНК-полимераза вируса гриппа состоит из субъединиц PB1, PB2 и PA, которые удерживаются в едином комплексе за счет нековалентных связей. Ghanem и соавт. [51] создали пептиды PB11_25 и PB715_740, которые связываются с субъединицей PA, блокируя сборку функциональной РНК-полимеразы, и тем самым ингибируют репликацию вируса. Аналогичный подход возможен и для подавления репликации РСВ, однако он еще не реализован.
Другие механизмы действия
Условно механизмы противовирусного действия пептидов можно подразделить на два вида: опосредованные вирусом (прямой лизис вирионов или блокирование вирусных лигандов, ответственных за инфекцию, и др.) или опосредованные клеткой (инактивация клеточных рецепторов, ингибирование процесса слияния и т.д.). Для природных пептидов описан целый ряд опосредованных клеткой механизмов противовирусного действия. Так, для дефензинов показано, что они ингибируют киназу PKC, которая необходима для перемещения вириона внутри инфицированной клетки [52]. Дефензины усиливают способность нейтрофилов поглощать вирионы и тем самым их нейтрализуют [53], однако этот механизм действия не относится к вирусспецифичным – он же задействован и в ответе клетки на бактериальные инфекции. В экспериментах in vivo выявлена иммунорегуляторная функция кателицидина LL-37. Не исключено, что противовирусная активность LL-37 обусловлена именно этой особенностью. По всей видимости, в организме млекопитающих LL-37, благодаря своему высокому положительному заряду, связывается с отрицательно заряженными нуклеиновыми кислотами, присутствующими в клетках и внеклеточном прострастве, после чего образовавшийся комплекс LL-37/нуклеиновая кислота связывается с Toll-подобными рецепторами и активирует их [54].
По результатам проведенного анализа механизмов антивирусного действия пептидов стало очевидным их разнообразие. Некоторые пептиды реализуют противовирусную активность по нескольким различным механизмам, что обусловливает широкий спектр их действия, не ограниченный только РСВ. Важно, что такой плейотропный противовирусный эффект, характерный для пептидов, не способствует развитию резистентности у патогена.
ПЕРСПЕКТИВНЫЕ НАПРАВЛЕНИЯ РАЗВИТИЯ ТЕХНОЛОГИИ ПРОТИВОВИРУСНЫХ ПЕПТИДОВ
Картирование пептидов
Технологии получения природных пептидов или их рекомбинантных аналогов относятся к дорогостоящим процессам, что ограничивает широкое применение этих биологически активных соединений в медицинской практике. Для снижения себестоимости ряд исследовательских коллективов предлагает картировать пептиды и тем самым создавать более короткие синтетические аналоги. Ранее экспериментально показано, что укороченные до 13–14 а.о. аналоги природных пептидов также проявляют выраженную антибактериальную активность [55, 56]. Аналогичный подход был реализован и по отношению к противовирусным пептидам. Так, пептид из центрального негликозилированного субдомена белка G, G149–197, размером 48 а.о. проявлял анти-РСВ-активность с ЕС50 около 80 мкМ. Gorman и др. [37] провели его картирование с целью выявления минимальной аминокислотной последовательности, необходимой для проявления антивирусного эффекта. Укорочение пептида G149–197 с N-конца на 14 а.о. (пептид G163–197 размером 34 а.о.) не привело к изменению противовирусной активности, в то время как дополнительное укорочение еще на 8 а.о. (пептид G171–197 размером 26 а.о.) значительно ее снизило Укорочение пептида G149–197 с С-конца на 8 а.о. (G149–189 размер 40 а.о.) приводило к значительному увеличению как цитотоксичности, так и противовирусной активности; значение ЕС50 составило 12 мкМ. При дополнительном укорочении пептида G149–189 на 5 а.о. с N-конца (пептид G154–189 размером 35 а.о.) не приводило к снижению антивирусной активности. В итоге, укорочение пептида G149–197 на 13 а.о. (с 48 до 35 а.о.), до G154–189, не только не снизило его биологическую активность, но, наоборот, привело к почти семикратному ее увеличению – с 80 до 12 мкМ (табл. 1) [37].
LL-37 – относительно крупный пептид, его длина составляет 37 а.о. Для выявления биологически значимого участка Currie и др. [34, 40] синтезировали укороченные аналоги LL-37 с размером 22 а.о.: N-концевой фрагмент (1–22), центральный коровый пептид (12–33) и С-концевой фрагмент (16–37). Только пептид из центральной части LL-37 сохранял выраженную противовирусную активность, сопоставимую с полноразмерным LL-37, в то время как N- и С-концевые фрагменты были инертны [34, 40].
Таким образом, на примере пептидов G149–197 и LL-37 продемонстрирована перспективность картирования как подхода к созданию укороченных аналогов природных пептидов, что позволит упростить технологию их производства. Такой подход вполне может быть применен и к другим крупным природным пептидам, например к бета-дефензину HBD2, размер которого 41 а.о., но пока о таких исследованиях не сообщалось.
Стабилизация структуры пептида
Конечно, картирование представляется перспективным инструментом в проектировании противовирусных пептидов, хотя значительное укорочение аминокислотной цепи может приводить к утрате антивирусных свойств из-за потери той пространственной структуры, которую этот участок аминокислотной цепи имел в составе белка и исходного пептида. Это связано с тем, что короткие пептиды не способны поддерживать функционально активную трехмерную структуру. В связи с этим применяют различные способы стабилизации необходимой третичной структуры коротких пептидов.
Так, Gorman и др. [37] в исследовании по картированию пептида G149–197 размером 49 а.о. получили укороченный на 14 а.о. пептид G154–189 (размер 35 а.о.), который сохранял противовирусную активность. Дальнейшее уменьшение размера исходного пептида до G149–177 и G154–177 длиной соответственно 28 и 25 а.о. привело к полной утрате активности. Однако авторы установили, что замена аминокислот His159 и Tyr170 соответственно на Pro и Phe приводит к восстановлению и даже усилению противовирусной активности (значение ЕС50 снизилось до 5 мкМ) (табл. 1). Боковые группы аминокислот Pro и Phe повышают гидрофобность пептида, что, по всей видимости, приводит к увеличению стабильности его пространственной структуры за счет гидрофобных взаимодействий с другими аминокислотными остатками [37].
С аналогичной трудностью столкнулись Shepherd и др. [12]. Они синтезировали относительно короткий пептид длиной 13 а.о. (483FPSDEFDASISQV495), который в составе белка F формирует α-спираль в области HR-C, но в виде индивидуального пептида не проявлял противовирусной активности, по-видимому, из-за невозможности образовать спиральную структуру. Однако после стабилизации этого пептида лактамными связями (пептид Ac-cyclo-(3,7),(8,12)-FP[KDEFD][KSIRD]V-NH2) он проявлял выраженные антивирусные свойства по отношению к РСВ (см. раздел “Пептид, формирующий α-спираль белка F”) [12].
Таким образом, стабилизация структуры пептидов путем рационального дизайна позволяет получать биологически активные соединения с небольшим числом аминокислотных остатков, что повышает экономическую целесообразность их наработки методом химического синтеза.
Дендримеризация пептидов
Другая проблема широкого использования пептидов – их низкая устойчивость к протеазам. Повысить устойчивость синтетических пептидов можно путем их модификации, например, получая разветвленные (дендримерные) пептиды. Таких пептидов в природе нет, так как в их структуре содержатся ε-амидные связи. Предполагают, что благодаря этим структурным отличиям дендримерные пептиды менее подвержены гидролизу протеазами, что повысит их стабильность и позволит использовать в схемах не только местной, но и системной терапии.
Дендримерными пептидами называют сверхразветвленные полимеры, состоящие из аминокислотных остатков. Пептиды такого рода не встречаются в природе, их синтезируют искусственно. Методология их синтеза описана еще в 40-х годах, но лишь в 70–80-х годах разработаны методы синтеза таких полимеров разной химической природы и начаты исследования их биологических эффектов [57–59]. Пока мало сведений по применению пептидных дендримеров в качестве антивирусных средств. В нескольких работах исследована противовирусная активность таких пептидов. Так, два дендримера, несущие на поверхности короткие положительно заряженные пептиды (заряд 4+), были активны против цитомегаловируса. Выяснен и механизм их действия – они ингибировали присоединение вируса к клетке-мишени [60]. Описаны дендримерные пептиды, активные против вируса папилломы человека [39] и вируса простого герпеса [61].
Известно только две публикации, в которых исследовано противовирусное действие дендримерных пептидов, SB105-A10 [38] и LTP [45], в отношении РСВ. Показано, что эти дендримерные пептиды проявляют более выраженную антивирусную активность в сравнении с линейными пептидами. Таким образом, перспективность исследований таких структур как дендримерные пептиды не вызывает сомнений. Это направление может стать прорывным в области разработки новых противовирусных средств.
Помимо устойчивости к действию протеолитических ферментов и высокой биологической активности, дендримерные пептиды относительно недороги в получении. Так, дендример LTP состоит из 17 а.о., но для его синтеза необходимо всего 6 циклов присоединения аминокислот – благодаря разветвленной структуре. Для сравнения скажем, что при синтезе линейного пептида такого же размера придется сделать 17 циклов. С учетом того, что в ходе химического синтеза потери конечного продукта происходят на каждом цикле, синтез дендримера, безусловно, потребует меньше затрат, чем линейного пептида аналогичного размера.
Получение рекомбинантных пептидов
В качестве альтернативы картированию крупных пептидов может выступать технология создания рекомбинантных ДНК-конструктов и получения с их помощью полноразмерных пептидов в клетках-продуцентах. Однако сложность использования продуцентов-прокариот, таких как традиционные штаммы Escherichia coli, состоит в том, что продуцируемые противовирусные пептиды токсичны по отношению к бактериям, что приводит к гибели продуцентов либо существенно снижает выход конечного продукта за счет подавления их роста при ферментации. Для преодоления этой сложности целевой продукт получают в виде неактивного предшественника, после чего проводят дополнительные стадии его гидролиза и очистки, что, безусловно, сказывается на себестоимости конечного продукта.
Недавно предпринята попытка удешевить способ получения пептида RhoA77–95, обладающего анти-РСВ-активностью, за счет использования эукариотического продуцента [44]. Авторы разработали генетические конструкты, способные экспрессировать этот пептид в клетках растений, и получили рекомбинантный белок – пептид RhoA77–95, соединенный с белком-носителем: лихеназой (LicKM) или вирусным белком оболочки (CP). В результате анализа противовирусных свойств полученных химер RhoA-LicKM и RhoA-СР показано, что их анти-РСВ-активность в 10 раз превышает таковую для синтетически полученного RhoA77–95. Возможно, этот эффект связан с тем, что в исходной генетической конструкции закодировано несколько копий пептида [44]. Описанный подход, с использованием альтернативных E. coli продуцентов, вполне соответствует современным технологиям производства биологически активных препаратов – как по дизайну целевых продуктов, так и по способам их наработки, так как системы ферментации эукариотических клеток неуклонно развиваются.
ЗАКЛЮЧЕНИЕ
Высокая распространенность РСВ-инфекции, отсутствие доступных и при этом безопасных препаратов для ее лечения привели к необходимости поиска новых противовирусных средств. Применение природных пептидов считается перспективным направлением в создании таких препаратов. Изучение противовирусных свойств ряда пептидов, описанных в представленном образе, по отношению к РСВ подтвердило принципиальную возможность реализации такого подхода. Однако применение природных пептидов в медицинской практике сопряжено с рядом проблем; а именно: процесс выделения пептидов из природных источников затратен, а химический синтез крупных (40–50 а.о.) природных пептидов обходится ненамного дешевле; кроме того, линейные пептиды легко разрушаются протеазами.
Несмотря на вышеуказанные сложности есть способы их преодоления. В первую очередь это картирование крупных пептидов и выявление в их структуре биологически-значимой части. Благодаря такому подходу можно добиться снижения размера целевого пептида (с 40–50 до 22–35 а.о.), тем самым снизив издержки на их получение, при этом сохранив биологическую активность. Во-вторых, это стабилизация структуры пептидов за счет введения точечных аминокислотных замен или дополнительных химических связей. Применяя этот подход, можно добиться не только более значительного сокращения размера пептида (до 13–25 а.о.), но и усиления его противовирусной активности. В-третьих, путем дендримеризация пептидов можно добиться повышения их стабильности и биологической активности, а также упростить процесс синтеза за счет сокращенного числа циклов присоединения аминокислот к наращиваемой пептидной цепи. В качестве четвертого направления будущего развития технологии противовирусных пептидов можно назвать разработку способов получения рекомбинантных форм пептидов в альтернативных организмах-продуцентах, например, в клетках растений, которые по сравнению с E. coli более устойчивы к токсическому действию таких пептидов.
Большинство описанных пептидов, активных по отношению к РСВ, ингибируют ранние стадии инфекционного цикла: прикрепление вириона к клетке и слияние с ней. Это ограничивает их возможное применение только препаратами профилактического действия. Однако стоит отметить, что в большинстве опубликованных работ эти пептиды исследованы в системах in vitro, которые не в полной мере отражают естественные условия. Мы полагаем, что пептиды могут быть эффективны против РСВ и в терапевтическом режиме, так как их введение на фоне развивающейся инфекции будет ингибировать взаимодействие вновь образующихся вирионов с клетками, и тем самым предотвращать инфицирование последних. Конечно, чтобы подтвердить эту гипотезу, необходимо провести множество исследований и, прежде всего, на лабораторных животных in vivo.
Низкая устойчивость большинства пептидов к действию протеаз, даже в системах in vitro, не позволяет надеяться на их использование в качестве лекарственных препаратов для системного применения, поэтому большинство исследователей отводит им в будущем роль препаратов для местного (топического) применения. Учитывая тот факт, что РСВ поражает эпителий нижнего отдела респираторного тракта, вполне возможна разработка ингаляционных лекарственных форм на основе противовирусных пептидов.
Таким образом, разработка противовирусных средств на основе пептидов для профилактики и терапии РСВ-инфекции заслуживает того, чтобы стать перспективным направлением биомедицинских исследований в силу его экспериментальной и технологической обоснованности.
Работа выполнена при поддержке гранта РНФ 18-74-10002.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Jartti T., Gern J.E. (2017) Role of viral infections in the development and exacerbation of asthma in children. J. Allergy Clin. Immunol. 140, 895–906.
Hall C.B., Weinberg G.A., Iwane M.K., Blumkin A.K., Edwards K.M., Staat M.A., Auinger P., Griffin M.R., Poehling K.A., Erdman D., Grijalva C.G., Zhu Y., Szilagyi P. (2009) The burden of respiratory syncytial virus infection in young children. N. Engl. J. Med. 360, 588–598.
Muralidharan A., Li C., Wang L., Li X. (2017) Immunopathogenesis associated with formaldehyde-inactivated RSV vaccine in preclinical and clinical studies. Exp. Rev. Vaccines. 16, 351–360.
Janai H.K., Marks M.I., Zaleska M., Stutman H.R. (1990) Ribavirin: adverse drug reactions, 1986 to 1988. Pediatr. Infect. Dis. J. 9, 209–211.
Wang D., Cummins C., Bayliss S., Sandercock J., Burls A. (2008) Immunoprophylaxis against respiratory syncytial virus (RSV) with palivizumab in children: a systematic review and economic evaluation. Health Technol. Assessment. 12, 1–86.
Хаитов М.Р., Литвин Л.С., Шиловский И.П., Башкатова Ю.Н., Файзулоев Е.Б., Зверев В.В. (2010) Интерференция РНК. Новые подходы к разработке противовирусных препаратов. Иммунология. 31, 69–76.
Osminkina L.A., Timoshenko V.Yu., Shilovsky I.P., Kornilaeva G.V., Shevchenko S.N., Gongalsky M.B., Tamarov K.P., Abramchuk S.S., Nikiforov V.N., Khaitov M.R., Karamov E.V. (2014) Porous silicon nanoparticles as scavengers of hazardous viruses. J. Nanoparticle Res. 16, 2430.
Battles M.B., Langedijk J.P., Furmanova-Hollenstein P., Chaiwatpongsakorn S., Costello H.M., Kwanten L., Vranckx L., Vink P., Jaensch S., Jonckers T.H., Koul A., Arnoult E., Peeples M.E., Roymans D., McLellan J.S. (2016) Molecular mechanism of respiratory syncytial virus fusion inhibitors. Nat. Chem. Biol. 12, 87–93.
Findlay E.G., Currie S.M., Davidson D.J. (2013) Cationic host defence peptides: potential as antiviral therapeutics. BioDrugs. 27, 479–493.
Zhao H., Zhou J., Zhang K., Chu H., Liu D., Poon V.K.M., Chan C.C.S., Leung H.C., Fai H., Lin Y.P., Zhang A.J.X., Jin D.Y., Yuen K.Y., Zheng B.J. (2016) A novel peptide with potent and broad-spectrum antiviral activities against multiple respiratory viruses. Sci. Rep. 6, 22008.
Fjell C.D., Hiss J.A., Hancock R.E.W., Schneider G. (2012) Designing antimicrobial peptides: form follows function. Nat. Rev. Drug Discov. 11, 37–51.
Shepherd N.E., Hoang H.N., Desai V.S., Letouze E., Young P.R., Fairlie D.P. (2006) Modular α-helical mimetics with antiviral activity against respiratory syncitial virus. J. Am. Chem. Soc. 128, 13284–13289.
Collins P.L., Fearns R., Graham B.S. (2013) Respiratory syncytial virus: virology, reverse genetics, and pathogenesis of disease. Curr. Top. Microbiol. Immunol. 372, 3–38.
Battles M.B., McLellan J.S. (2019) Respiratory syncytial virus entry and how to block it. Nat. Rev. Microbiol. 17(4), 233–245.
Griffiths C., Drews S.J., Marchant D.J. (2017) Respiratory syncytial virus: infection, detection, and new options for prevention and treatment. Clin. Microbiol. Rev. 30, 277–319.
Johnson S.M., McNally B.A., Ioannidis I., Flano E., Teng M.N., Oomens A.G., Walsh E.E., Peeples M.E. (2015) Respiratory syncytial virus uses CX3CR1 as a receptor on primary human airway epithelial cultures. PLoS Pathogens. 11, e1005318.
Tayyari F., Marchant D., Moraes T.J., Duan W., Mastrangelo P., Hegele R.G. (2011) Identification of nucleolin as a cellular receptor for human respiratory syncytial virus. Nat. Med. 17, 1132–1135.
Shahriari S., Gordon J., Ghildyal R. (2016) Host cytoskeleton in respiratory syncytial virus assembly and budding. Virology J. 13, 161.
Ericksen B., Wu Z., Lu W., Lehrer R.I. (2005) Antibacterial activity and specificity of the six human {alpha}-defensins. Antimicrob. Agents Chemother. 49, 269–275.
Holly M.K., Diaz K., Smith J.G. (2017) Defensins in viral infection and pathogenesis. Annu. Rev. Virol. 4, 369–391.
Demirkhanyan L.H., Marin M., Padilla-Parra S., Zhan C., Miyauchi K., Jean-Baptiste M., Novitskiy G., Lu W., Melikyan G.B. (2012) Multifaceted mechanisms of HIV-1 entry inhibition by human α-defensin. J. Biol. Chem. 287, 28821–28838.
Skalickova S., Heger Z., Krejcova L., Pekarik V., Bastl K., Janda J., Kostolansky F., Vareckova E., Zitka O., Adam V., Kizek R. (2015) Perspective of use of antiviral peptides against influenza virus. Viruses. 7, 5428–5442.
Chow B.T., Soto M., Lo B.L., Crosby D.C., Camerini D. (2012) Antibacterial activity of four human beta-defensins: HBD-19, HBD-23, HBD-27, and HBD-29. Polymers. 4, 747–758.
Hazrati E., Galen B., Lu W., Wang W., Ouyang Y., Keller M.J., Lehrer R.I., Herold B.C. (2006) Human alpha- and beta-defensins block multiple steps in herpes simplex virus infection. J. Immunol. 177, 8658–8666.
Lafferty M.K., Sun L., Christensen-Quick A., Lu W., Garzino-Demo A. (2017) Human beta defensin 2 selectively inhibits HIV-1 in highly permissive CCR6+CD4+ T cells. Viruses. 9, 111.
Jiang Y., Yang D., Li W., Wang B., Jiang Z., Li M. (2012) Antiviral activity of recombinant mouse β-defensin 3 against influenza A virus in vitro and in vivo. Antivir. Chem. Chemother. 22, 255–262.
Kota S., Sabbah A., Chang T.H., Harnack R., Xiang Y., Meng X., Bose S. (2008) Role of human β-defensin-2 during tumor necrosis factor-α/NF-κB-mediated innate antiviral response against human respiratory syncytial virus. J. Biol. Chem. 283, 22417–22429.
Yasin B., Wang W., Pang M., Cheshenko N., Hong T., Waring A.J., Herold B.C., Wagar E.A., Lehrer R.I. (2004) Theta defensins protect cells from infection by herpes simplex virus by inhibiting viral adhesion and entry. J. Virol. 78, 5147–5156.
Seidel A., Ye Y., de Armas L.R., Soto M., Yarosh W., Marcsisin R.A., Tran D., Selsted M.E., Camerini D. (2010) Cyclic and acyclic defensins inhibit human immunodeficiency virus type-1 replication by different mechanisms. PLoS One. 5, e9737.
Prantner D., Shirey K.A., Lai W., Lu W., Cole A.M., Vogel S.N., Garzino-Demo A. (2017) The θ-defensin retrocyclin 101 inhibits TLR4- and TLR2-dependent signaling and protects mice against influenza infection. J. Leukoc. Biol. 102, 1103–1113.
Fabisiak A., Murawska N., Fichna J. (2016) LL-37: Cathelicidin-related antimicrobial peptide with pleiotropic activity. Pharmacol. Rep. 68, 802–808.
Wong J.H., Legowska A., Rolka K., Ng T.B., Hui M., Cho C.H., Lam W.W., Au S.W., Gu O.W., Wan D.C. (2011) Effects of cathelicidin and its fragments on three key enzymes of HIV-1. Peptides. 32, 1117–1122.
Barlow P.G., Svoboda P., Mackellar A., Nash A.A., York I.A., Pohl J., Davidson D.J., Donis R.O. (2011) Antiviral activity and increased host defense against influenza infection elicited by the human cathelicidin LL-37. PLoS One. 6, e25333.
Currie S.M., Findlay E.G., McHugh B.J., Mackellar A., Man T., Macmillan D., Wang H., Fitch P.M., Schwarze J., Davidson D.J. (2013) The human cathelicidin LL-37 has antiviral activity against respiratory syncytial virus. PLoS One. 8, e73659.
Bose S., Kar N., Maitra R., DiDonato J., Banerjee A.K. (2003) Temporal activation of NF-κB regulates an interferon-independent innate antiviral response against cytoplasmic RNA viruses. Proc. Natl. Acad. Sci. USA. 100, 10890–10895.
Lambert D.M., Barney S., Lambert A.L., Guthrie K., Medinas R., Davis D.E., Bucy T., Erickson J., Merutka G., Petteway S.R. Jr. (1996) Peptides from conserved regions of paramyxovirus fusion (F) proteins are potent inhibitors of viral fusion. Med. Sci. 93, 2186–2191.
Gorman J.J., McKimm-Breschkin J.L., Norton R.S., Barnham K.J. (2001) Antiviral activity and structural characteristics of the nonglycosylated central subdomain of human respiratory syncytial virus attachment (G) glycoprotein. J. Biol. Chem. 276, 38988–38994.
Donalisio M., Rusnati M., Cagno V., Civra A., Bugatti A., Giuliani A., Pirri G., Volante M., Papotti M., Landolfo S., Lembo D. (2012) Inhibition of human respiratory syncytial virus infectivity by a dendrimeric heparan sulfate-binding peptide. Antimicrob. Agents Chemother. 56, 5278–5288.
Donalisio M., Rusnati M., Civra A., Bugatti A., Allemand D., Pirri G., Giuliani A., Landolfo S., Lembo D. (2010) Identification of a dendrimeric heparan sulfate-binding peptide that inhibits infectivity of genital types of human papillomaviruses. Antimicrob. Agents Chemother. 54, 4290–4299.
Currie S.M., Gwyer Findlay E., McFarlane A.J., Fitch P.M., Böttcher B., Colegrave N., Paras A., Jozwik A., Chiu C., Schwarze J., Davidson D.J. (2016) Cathelicidins have direct antiviral activity against respiratory syncytial virus in vitro and protective function in vivo in mice and humans. J. Immunol. 196, 2699–2710.
Vanheule V., Vervaeke P., Mortier A., Noppen S., Gouwy M., Snoeck R., Andrei G., Van Damme J., Liekens S., Proost P. (2016) Basic chemokine-derived glycosaminoglycan binding peptides exert antiviral properties against dengue virus serotype 2, herpes simplex virus-1 and respiratory syncytial virus. Biochem. Pharmacol. 100, 73–85.
Uddin M.B., Lee B.H., Nikapitiya C., Kim J.H., Kim T.H., Lee H.C., Kim C.G., Lee J.S., Kim C.J. (2016) Inhibitory effects of bee venom and its components against viruses in vitro and in vivo. J. Microbiol. 54, 853–866.
Pastey M.K., Gower T.L., Spearman P.W., Crowe J.E. Jr., Graham B.S. (2000) A RhoA-derived peptide inhibits syncytium formation induced by respiratory syncytial virus and parainfluenza virus type 3. Nat. Med. 6, 35–40.
Ortega-Berlanga B., Musiychuk K., Shoji Y., Chichester J.A., Yusibov V., Patiño-Rodríguez O., Noyola D.E., Alpuche-Solís Á.G. (2016) Engineering and expression of a RhoA peptide against respiratory syncytial virus infection in plants. Planta. 243, 451–458.
Sundukova M.S., Shilovskiy I.P., Andreev S.M., Kuptsova M.M., Khaitov M.R. (2017) Synthetic ca-tionic peptides with linear helical and dendrimeric structures effectively reduce respiratory virus infection in vitro. Allergy. 72, 300–301.
Bishop J.R., Schuksz M., Esko J.D. (2007) Heparan sulphate proteoglycans fine-tune mammalian physio-logy. Nature. 446, 1030–1037.
Feldman S.A., Audet S., Beeler J.A. (2000) The fusion glycoprotein of human respiratory syncytial virus faci-litates virus attachment and infectivity via an interaction with cellular heparan sulfate. J. Virol. 74, 6442–6447.
Lande R., Gregorio J., Facchinetti V., Chatterjee B., Wang Y.H., Homey B., Cao W., Wang Y.H., Su B., Nestle F.O., Zal T., Mellman I., Schröder J.M., Liu Y.J., Gilliet M. (2007) Plasmacytoid dendritic cells sense self-DNA coupled with antimicrobial peptide. Nature. 449, 564–569.
Marcos J.F., Gandía M. (2009) Antimicrobial peptides: to membranes and beyond. Exp. Opin. Drug Discov. 4, 659–671.
Gordon-Grossman M., Zimmermann H., Wol S.G., Shai Y., Goldfarb D. (2012) Investigation of model membrane disruption mechanism by melittin using pulse electron paramagnetic resonance spectroscopy and cryogenic transmission electron microscopy. J. Phys. Chem. B. 116, 179–188.
Ghanem A., Mayer D., Chase G., Tegge W., Frank R., Kochs G., García-Sastre A., Schwemmle M. (2007) Peptide-mediated interference with influenza A virus polymerase. J. Virol. 81, 7801–7804.
Salvatore M., Garcia-Sastre A., Ruchala P., Lehrer R.I., Chang T., Klotman M.E. (2007) α-Defensin inhibits influenza virus replication by cell-mediated mechanism(s). J. Infect. Dis. 196, 835–843.
Tecle T., White M.R., Gantz D., Crouch E.C., Hartshorn K.L. (2007) Human neutrophil defensins increase neutrophil uptake of influenza A virus and bacteria and modify virus-induced respiratory burst responses. J. Immunol. 178, 8046–8052.
Lai Y., Adhikarakunnathu S., Bhardwaj K., Ranjith-Kumar C.T., Wen Y., Jordan J.L., Wu L.H., Dragnea B., San Mateo L., Kao C.C. (2011) Ll37 and cationic peptides enhance TLR3 signaling by viral double-stranded RNAs. PLoS One. 6, e26632.
Qu P., Gao W., Chen H., Li D., Yang N., Zhu J., Feng X., Liu C., Li Z. (2016) The central hinge link truncation of the antimicrobial peptide fowlicidin-3 enhances its cell selectivity without antibacterial activity loss. Antimicrob. Agents Chemother. 60, 2798–2806.
Lin M.C., Hui C.F., Chen J.Y., Wu J.L. (2013) Truncated antimicrobial peptides from marine organisms retain anticancer activity and antibacterial activity against multidrug-resistant Staphylococcus aureus. Peptides. 44, 139–148.
Boas U., Heegaard P.M.H. (2004) Dendrimers in drug research. Chem. Soc. Rev. 33, 43–63.
Svenson S., Tomalia D.A. (2012) Dendrimers in biomedical applications-reflections on the field. Adv. Drug Del. Rev. 57, 2106–2129.
Cloninger M.J. (2002) Biological applications of dendrimers. Curr. Opin. Chem. Biol. 9, 341.
Luganini A., Giuliani A., Pirri G., Pizzuto L., Landolfo S., Gribaudo G. (2010) Peptide-derivatized dendrimers inhibit human cytomegalovirus infection by blocking virus binding to cell surface heparan sulfate. Antiviral Res. 85, 532–540.
Luganini A., Nicoletto S.F., Pizzuto L., Pirri G., Giuliani A., Landolfo S., Gribaudo G. (2011) Inhibition of herpes simplex virus type 1 and type 2 infections by peptide-derivatized dendrimers. Antimicrob. Agents Chemother. 55, 3231–3239.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология