Молекулярная биология, 2019, T. 53, № 6, стр. 968-981
Молекулярная организация клеточной поверхности дрожжей
Т. С. Калебина a, *, В. В. Рекстина a
a Биологический факультет Московского государственного университета им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: kalebina@gmail.com
Поступила в редакцию 16.05.2019
После доработки 30.06.2019
Принята к публикации 30.06.2019
Аннотация
В обзоре суммированы основные достижения последних лет в области исследований молекулярной организации поверхности клеток дрожжей – компартмента, состоящего из плазматической мембраны, периплазматического пространства и клеточной стенки, функционирующих cкоординированно. Приведены данные о наличии везикулярного транспорта во внешнюю среду через клеточную стенку и формировании в ней каналов, свидетельствующие о возможности динамичных перестроек молекулярной структуры клеточной стенки дрожжей. Даны представления о мозаичном расположении компартментов плазматической мембраны. Сформулирована гипотеза о неоднородности молекулярной структуры клеточной стенки, которую принято рассматривать как монотонную, за исключением зон почкования. Описаны группы белков, формирующих молекулярный ансамбль клеточной поверхности дрожжей. Особое внимание уделено белкам с амилоидными свойствами, включая глюканозилтрансгликозилазу Bgl2p, которая важна для вирулентности патогенных дрожжей, и Gas1p – первого из изученных белков клеточной поверхности, для которого показано участие в регуляции транскрипционного сайленсинга рибосомной ДНК. Приведены сведения о структуре рецепторов, локализованных на клеточной поверхности и о “moonlight”-белках, принимающих участие в ответе клеток дрожжей на стресс.
ВВЕДЕНИЕ
Дрожжи служат объектом изучения в фундаментальных научных исследованиях, представляют значительный интерес как промышленные микроорганизмы и, в то же время, многие виды дрожжей ‒ опасные патогены.
Литература, которая посвящена изучению молекулярной организации поверхности клеток дрожжей, без преувеличения, огромна. За последние два десятилетия достигнуты впечатляющие успехи, отраженные в обзорах, суммирующих сведения, полученные в основном при изучении дрожжей Saccharomyces cerevisiae и Candida albicans [1‒9]. Тем не менее до сих пор прогресс в исследованиях задерживается в связи с пробелами в понимании того, как организованы и как функционируют в различных условиях молекулярные комплекcы, локализованные на клеточной поверхности этих микроорганизмов. В обзоре поставлена задача суммировать основные достижения последних лет в данной области исследований, в первую очередь сделав акцент на отчетливо намечающуюся тенденцию рассматривать клеточную поверхность как единый компартмент, состоящий из плазматической мембраны, периплазматического пространства и клеточной стенки, функционирующих координированно. Также нам хотелось привлечь внимание к ряду вопросов, решение которых важно как для фундаментальной науки, так и для медицины.
КЛЕТОЧНАЯ СТЕНКА – МОЛЕКУЛЯРНЫЙ АНСАМБЛЬ МАННОПРОТЕИНОВ, ЗАКРЕПЛЕННЫХ НА ПОЛИСАХАРИДАХ
Наружной частью компартмента клеточной поверхности, которая непосредственно контактирует с внешней средой, служит клеточная стенка, состоящая из белков и полисахаридов, представленных в сравнимом количестве [3, 8]. Структура полисахаридов, а именно, малоразветвленного β-1,3-глюкана и разветвленного β-1,6-глюкана, в совокупности составляющих основу каркаса ее прочности, достаточно подробно изучена еще в XX веке [10‒12]. Тем не менее в настоящее время интерес к изучению и применению основного полисахарида клеточной стенки – глюкана ‒ не ослабевает [8, 13]. В частности, исследователи успешно используют его как антиген для получения антител в целях эффективной борьбы с такими патогенами как, например, C. albicans [13]. Как правило, β-1,3-глюкан клеточной стенки дрожжей содержит некоторое количество β-1,6-связей. В свою очередь, в β-1,6-связанном глюкане присутствуют β-1,3-связанные остатки глюкозы. Неразветвленный полимер хитин состоит из остатков β-1,4-связанного N-ацетил-глюкозамина и может быть присоединен к глюкану. Степень полимеризации мономеров может достигать 1500 мономерных единиц [14, 15]. Только в начале 2000-х стали складываться в единую картину представления о молекулярной организации клеточной стенки [1, 2]. Это стало возможным сначала благодаря признанию, а затем и активному изучению роли белков в молекулярной организации клеточной стенки дрожжей, а также значительному прогрессу в исследованиях их функциональной значимости [1, 2].
Последнее десятилетие отмечено значительным прогрессом на пути перехода от накопления фактических знаний к изучению молекулярных механизмов участия клеточной поверхности в процессах, определяющим образом влияющих на жизнедеятельность дрожжей [3, 6, 7, 16, 17]. Клеточная поверхность в целом и ее наружный компартмент ‒ клеточная стенка ‒ стали областью исследования молекулярной биологии.
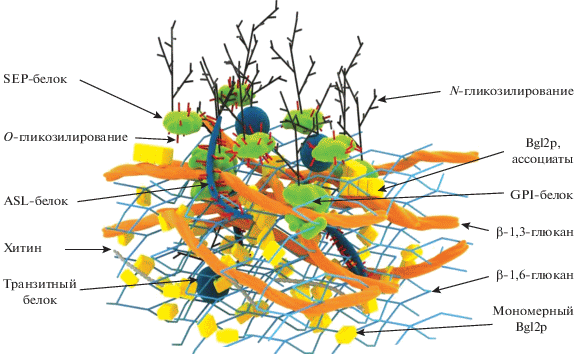
Белки – маннопротеины клеточной стенки – уже давно были разделены на 3 группы: GPI-заякоренные белки (glycosylphosphatidylinositol), ASL-белки, связанные с полисахаридами клеточной стенки щелочелабильной связью (alkali-soluble linkage) и SEP-белки, которые могут быть экстрагированы из клеточных стенок обработкой SDS и восстанавливающими агентами при нагревании (SDS/β-mercaptoethanol extractable proteins) [18]. Это деление актуально до настоящего времени и для разных видов дрожжей [3, 9]. Маннопротеины первых двух групп ковалентно связаны с полисахаридами клеточной стенки, в то время как SEP-белки имеют с ними нековалентную связь. Из клеточных стенок, освобожденных от SEP-белков, после гидролиза β-1,3- или β-1,6-глюканазой можно выделить GPI-белки, а после щелочной экстракции – ASL-белки.
GPI-белки клеточной стенки в отличие от GPI-белков плазматической мембраны лишены липидного компонента в составе GPI-якоря [3, 12, 19]. Остатком GPI-якоря эти белки соединены через β-1,6-глюкан с β-1,3-глюканом – мажорным структурным полисахаридом клеточной стенки. В некоторых случаях GPI-белки клеточной стенки могут быть связаны через β-1,6-глюкан с минорным полисахаридом – хитином [14, 19].
ASL-белки, как правило, связаны непосредственно с β-1,3-глюканом щелочелабильной связью γ-карбоксильной группы глутаминовой кислоты повторяющихся аминокислотных последовательностей DGQхQ (х – любой гидрофобный аминокислотный остаток) [20].
Белки клеточной стенки всех трех групп, как правило, O-гликозилированы и содержат короткие неразветвленные маннозные цепи (до 5 остатков маннозы) с α-1,2- и α-1,3-связями, которые локализуются в основном в Ser/Thr-богатых доменах. N-гликозилированные белки (обычно из групп SEP- и GPI-белков) содержат разветвленные маннозные цепи, присоединенные N-гликозидной связью к остаткам Asn консенсусных областей NxS/T (х – любой аминокислотный остаток, кроме Pro). Исследование гликозилирования белков клеточной поверхности дрожжей имеет многолетнюю историю, и эти работы достаточно полно суммированы в обзоре Orlean [3]. Описано множество фенотипических проявлений мутаций, приводящих к нарушению процессов N- и О‑гликозилирования. Тем не менее интерес к проблеме не только сохраняется, но и растет. Недавно показано, что у дрожжей S. cerevisiae делеция гена MNN9, кодирующего субъединицу комплекса маннозилтрансферазы, который обеспечивает формирование маннозных цепей, приводит к нарушению морфогенеза и значительному снижению выживаемости дрожжей [21]. На основании полученных результатов авторы считают, что дрожжи могут стать важным инструментом при изучении процессов клеточного старения и пролиферации.
Если факт наличия GPI-, ASL- и SEP-белков уже ни у кого не вызывает сомнений, то механизм их встраивания в клеточную стенку до сих пор изучен недостаточно.
БЕЛКИ С АМИЛОИДНЫМИ СВОЙСТВАМИ КЛЕТОЧНОЙ ПОВЕРХНОСТИ ДРОЖЖЕЙ
В последние годы пристальное внимание исследователей привлекает изучение структуры и роли в формировании и функционировании молекулярного ансамбля клеточной поверхности белков со свойствами амилоидов, локализованных в клеточной оболочке дрожжей ‒ как патогенных C. albicans, так и непатогенных S. cerevisiae. Сравнительно недавно обнаруженные свойства этих белков [22‒26] открыли принципиально новые возможности для понимания механизма процессов, происходящих на клеточной поверхности дрожжей при встраивании белков в новосинтезированную клеточную стенку, а также при взаимодействии дрожжевых клеток друг с другом (например, при флокуляции), адгезии на субстратах различного происхождения, в том числе на поверхности клеток высших эукариот.
Можно предположить, что механизм, основанный на способности белков с амилоидными свойствами формировать фибриллярные структуры в сочетании с вероятной обратимостью этого процесса у амилоидных белков клеточной поверхности, может лежать в основе первых этапов на пути встраивания белков трех перечисленных выше групп в молекулярный ансамбль клеточной стенки дрожжей, а именно их удержания и компартментализации в матриксе клеточной стенки после транслокации от плазматической мембраны через периплазматическое пространство.
Работам, в которых экспериментально выявлено наличие белков с амилоидными свойствами в клеточной стенке дрожжей S. cerevisiae и C. albicans [22, 23], предшествовали данные биоинформатического анализа, согласно которым наибольшее число амилоидогенных белков дрожжей локализуется на поверхности клеток S. cerevisiae, в частности, в клеточной стенке [27]. К настоящему времени хорошо охарактеризованы такие белки этой группы, как Als (от англ. agglutinin-like sequence) [23, 28, 29]. Часто их называют адгезинами. Als1p, Als3p и Als5p содержат консервативный потенциально амилоидогенный участок [23]. Сходные участки обнаружены также в аминокислотных последовательностях других дрожжевых адгезинов, например, флокуллинов [28]. В геноме C. albicans идентифицировано 8 генов ALS, каждый из которых кодирует белок с сигнальной последовательностью, необходимой для секреции, и С-концевой последовательностью для присоединения GPI-якоря [30]. У этих белков также идентифицированы домены иммуноглобулинподобного типа (Ig-подобные домены), которые расположены тандемно и принимают участие в связывании субстрата; Thr-богатый домен (T-домен), который нужен для правильного сворачивания Ig-подобного домена, короткие гликозилированные тандемные повторы (TR) и стеблевой домен. TR повышают сродство Ig-подобной области к лигандам, а также могут обеспечивать агрегацию дрожжей, не зависящую от Ig-подобной области. Стеблевые домены позволяют вынести Als-белки на значительное расстояние от поверхности клеточной стенки [30]. Выделенные Als-белки могут образовывать в растворе амилоидные фибриллы [23, 28, 30].
С участием адгезинов формируются биопленки, которые придают C. albicans устойчивость к антимикробным препаратам и облегчают этим дрожжам колонизацию тканей организма хозяина [31, 32]. Als-адгезины способны формировать амилоидные структуры [23, 28, 29], которые, вероятно, способствуют взаимодействию клеток C. albicans друг с другом, что приводит к их агрегации, и с белками внеклеточного матрикса млекопитающих (фибронектином, ламинином, коллагеном IV типа), а также с другими пептидными лигандами и клетками бактерий [30, 32]. Эти свойства Als-белков важны для патогенности дрожжей C. albicans [33‒35].
Глюканремоделирующие ферменты Gas1p и Вgl2p – еще два белка клеточной поверхности дрожжей с амилоидными свойствами. Важно отметить, что Bgl2p локализован в клеточной стенке. Gas1p также может находиться в клеточной стенке, хотя в первую очередь считается белком плазматической мембраны. Таким образом, оба компартмента клеточной поверхности – и наружный и внутренний – содержат белки с амилоидными свойствами.
Gas1p представляет собой GPI-белок, наиболее представленный из белков семейства Gas дрожжей S. cerevisiae, для которого известны гомологи у дрожжей C. albicans, C. maltosa и Aspergillus fumigatus [3, 36]. Gas1p играет основную роль в биогенезе клеточной стенки дрожжей благодаря глюканозилтрансгликозилазной активности, приводящей к удлинению цепей β-1,3-глюкана и, возможно, к их разветвлению с образованием β-1,6-связей [37, 38]. Недавно показано, что Gas1p способен формировать устойчивые к действию 2%-ного раствора SDS при 37°C структуры с фибриллярной морфологией [39].
Bgl2p – это небольшой (около 30 кДа или несколько больше ‒ в зависимости от вида дрожжей) консервативный мажорный SEP-белок, присутствие которого в клеточной стенке показано для многих видов дрожжей, включая S. cerevisiae и C. albicans, а также для некоторых видов Aspergillus [22, 33, 40, 41]. Bgl2p из S. cerevisiae имеет высокую степень гомологии с Bgl2p из C. albicans. Антитела против Bgl2p S. cerevisiae взаимодействуют и с Bgl2p C. albicans [33, 42]. Bgl2p, как и Gas1p, обладает глюканозилтрансгликозилазной активностью, приводящей к разветвлению β-1,3-глюкана с образованием β-1,6-связей [38]. Bgl2p устойчив к гидролизу трипсином и протеиназой К в составе клеточной стенки, а также не может быть экcтрагирован из нее под действием 1%-ного раствора SDS при 37°C [22].
Bgl2p, выделенный из клеточной стенки S. ce-revisiae, образует структуры, которые имеют фибриллярную морфологию [24, 25], отчетливо выявляемую при микроскопических исследованиях, индуцирует специфическую флуоресценцию тиофлавина Т и, по данным кругового дихроизма, обогащен β-структурой [22, 24], что характерно для амилоидов. В аминокислотной последовательности Bgl2p все примененные для анализа компьютерные алгоритмы (FoldAmyloid, TANGO, AGGRESCAN, PASTA, WALTZ и DHPRED) выявляют 4 амилоидогенные последовательности [25]. С использованием как выделенного белка, так и модели на основе синтетических пептидов, соответствующих по последовательности предсказанным биоинформатически потенциально амилоидогенным участкам Bg2p, показано, что при нейтральных и кислых значениях pH среды Bgl2p фибриллизуется, тогда как уже при слабощелочных значениях рН способность формировать амилоидные фибриллы у него снижается [25]. Механизм амилоидообразования Bgl2p в клеточной стенке, как и физиологическую роль этого процесса для функционирования дрожжей, еще только предстоит выяснить. Известно, что в клеточной стенке этот белок закрепляется с участием С-концевой области, которая, по-видимому, важна и для формирования фибриллярной структуры [43].
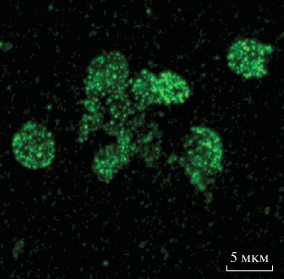
Еще в 2005 году Jeng и соавт. [42] показали, что Bgl2p C. albicans может выполнять роль адгезина, но в перечне адгезинов этот белок часто отсутствует [28, 29]. У Bgl2p S. cerevisiae обнаружены глюкансвязывающие свойства [44], хотя сайтов связывания полисахаридов в его молекуле не выявлено. Следует заметить, что глюкан ‒ это основной компонент клеточной стенки, в которой он распределен равномерно и формирует ее матрикс. Тем не менее Bgl2p после инкубации с клеточными стенками связывается с глюкановым матриксом не однородно, а формирует отдельные микрокомпартменты, расположение которых, по-видимому, определяется избирательным сродством этого белка к отдельным участкам глюканового матрикса в клеточной стенке (рис. 1). С помощью электронной микроскопии показано, что Bgl2p образует фибриллярные структуры типа “отпечатков пальцев” [22].
Рис. 1.
Флуоресцентная микроскопия изолированных клеточных стенок дрожжей Saccharomyces cerevisiae (по методу [22, 25]), проинкубированных с экстрагированной из них глюканозилтрансгликозилазой Bgl2p Окрашивание с помощью антител к Bgl2p. Видно, что белок располагается на клеточной стенке мозаично. Снимок выполнен на базе Университета Ростока (University of Rostock, Rostock, Германия) совместно с С.А. Кузнецовым и печатается с его разрешения.
Сведения об амилоидных белках клеточной поверхности дрожжей дают основание по-новому рассматривать риски от контакта дрожжей (в том числе и патогенных) с клетками животных и человека в аспекте возможности индукции у последних заболеваний амилоидозом. Сказанное можно отнести и к продуктам биотехнологических производств, основанных на дрожжах. Как косвенное подтверждение этому можно рассматривать суммированные в обзоре данные о возможности индукции амилоидозов у высших эукариот амилоидогенными белками клеточной поверхности бактерий [45], а также развитие системного амилоидоза у мышей, инъецированных лиофилизованными клетками Candida sp. [46]. Эти факты хорошо согласуются с тем, что делеция гена BGL2 снижает вирулентность C. albicans [33]. Антитела к Bgl2p C. albicans считаются диагностическим биомаркером системного кандидоза, а их высокий уровень коррелирует со снижением вероятности летального исхода [47]. Так что наши знания относительно роли белков с амилоидными свойствами, как патогенных, так и непатогенных дрожжей, во взаимодействии с клетками высших эукариот еще предстоит восполнить.
На рис. 2 приведена схема строения клеточной стенки дрожжей S. cerevisiae, на которой мы предприняли попытку суммировать современные представления о строении этой органеллы. Помимо традиционно изображаемых на подобных схемах β-1,3- и β-1,6-глюканов, хитина и SEP-белков, а также GPI-белков, N-связанные маннозные цепи которых формируют на поверхности клеточной стенки антигенпрезентирующий слой, на данной схеме изображены собранные в ассоциаты молекулы белка Bgl2p, которые, по нашему представлению, могут формировать отдельные микрокомпартменты. Bgl2p играет важную роль, укрепляя структуру клеточной стенки без формирования ковалентных связей ‒ как между собой так и с полисахаридным компонентом клеточной стенки. Изображены также ASL-белки, которые скрепляют слои полисахаридов в толще клеточной стенки, и транзитные белки ‒ наиболее вариабельная группа белков клеточной стенки, в том числе moonlight-белки, которые будут описаны ниже.
МИКРОКОМПАРТМЕНТЫ ПЛАЗМАТИЧЕСКОЙ МЕМБРАНЫ. МЕХАНОСЕНСОРЫ
Многокомпонентный и полифункциональный молекулярный ансамбль клеточной стенки формируется и функционирует за пределами плазматической мембраны в условиях относительно агрессивной и нестабильной внешней среды. Процессы деградации, синтеза de novo и модификации полимеров, составляющих структурную основу клеточной стенки, должны протекать с высокой точностью, так как серьезные ошибки в формировании этого молекулярного ансамбля влекут за собой, как правило, гибель клетки. Процессы, идущие с участием мембраны, защищены от агрессивного окружения внешней среды клеточной стенкой и периплазматическим пространством. По-видимому, в клеточной стенке работают отлаженные и хорошо сбалансированные механизмы сборки и деградации ее молекулярной структуры, а в их регуляции участвует плазматическая мембрана ‒ внутренний компартмент клеточной поверхности, через который идет передача сигналов от клеточной стенки внутрь клетки и обратно. Изучение этих механизмов невозможно без анализа роли мембраны в каждом конкретном случае.
В состав плазматической мембраны дрожжей входят стерины, сфинголипиды и глицерофосфолипиды, что подробно описано в обзоре, опубликованном ранее [48]. Важно отметить, что плазматическая мембрана дрожжей отличается от мембраны клеток млекопитающих по функциональным параметрам ‒ у нее значительно меньше возможностей для диффузии белков и белковых комплексов [4, 5]. Считается, что мембрана разделена как минимум на два микрокомпартмента: MCP (membrane compartment of Pma1; мембранный компартмент, ассоциированный с [H+]ATPазой Pma1) и MCC (membrane compartment of Can1; мембранный компартмент, ассоциированный с аргининовой пермеазой Can1) [4, 5].
MCP представляет собой сеть, распределенную по всей плазматической мембране, тогда как множественные MCC располагаются в ячейках этой сети. На дрожжевую клетку приходится от 30 до 40 MCC в зависимости от размера клеток. MCC ассоциирован с эйзосомами – мембранными инвагинациями в виде борозд около 300 нм в длину и 50 нм в глубину [4, 49]. Важно отметить, что при делеции белков, участвующих в формировании эйзосом, в частности Pil1, Lsp1 и Sur7, нарушается формирование структуры клеточной стенки и снижается вирулентность дрожжей C. albicans [5, 49, 50].
Такая четкая структурированность плазматической мембраны дрожжей, по-видимому, обеспечивает неслучайное распределение и ограниченность латеральной диффузии по ней белковых комплексов [4, 49, 51], состоящих, например, из механосенсоров Wsc1 и Mid2, ответственных за передачу сигнала в случае нарушения целостности клеточной стенки, или ферментных комплексов, синтезирующих полимеры β-1,3-глюкана и хитина клеточной стенки.
В качестве первого барьера между клеткой и окружающей средой клеточная стенка подвержена таким видам стресса, как солевой, оксидативный, токсический или механический. Стрессовые сигналы из окружающей среды передаются внутрь клетки с помощью каскада, называемого CWI-путем (Cell Wall Integrity pathway; путь целостности клеточной стенки). В процессе функционирования клеточная стенка, периплазматическое пространство и плазматическая мембрана координированно участвуют в передаче сигналов целостности клеточной стенки и регуляции ее синтеза.
Наиболее хорошо изучены механосенсоры CWI-пути S. cerevisiae. Они принимают участие в передаче сигналов при стрессе, индуцированном этанолом, активными формами кислорода (АФК) и тепловым шоком, а также проапоптотических сигналов [52–55]. Недавно показано, что помимо механосенсоров в ответе клеток дрожжей S. cerevisiae на стресс важную роль играют SEP- и ASL-белки клеточной стенки [56].
Механосенсоры можно разделить на два семейства: Wsc и Mid2/Mtl1 [57]. Есть несколько обзоров, посвященных описанию структуры этих белков [4, 57, 58]. Суммируя сведения, приведенные в них, а также данные из статей последних лет, можно сказать, что молекулы механосенсоров различными своими участками пронизывают плазматическую мембрану, пересекают периплазматическое пространство и далее закрепляются в толще клеточной стенки, работая как детекторы напряжения на поверхности клетки [4, 57, 58]. Так начинается сигнальный путь, инициированный нарушением структуры клеточной стенки или плазматической мембраны [58]. Сигнальная способность механосенсоров, по крайней мере в некоторых случаях, повышается путем их кластеризации в конкретных микрокомпартментах. Показано, что механосенсор Wsc1 может образовывать микрокомпартмент с механосенсорами Wsc2 и Wsc3, в формировании которого важную роль отводят Cys-богатому домену Wsc1 [59]. В то же время белки Mid2 и Mtl1, по-видимому, не формируют общий микрокомпармент. Тем не менее по отдельности каждый из пяти сенсоров формирует специфический микрокомпартмент в плазматической мембране. Интересно, что для механосенсоров не выявлено строгой колокализации ни с MCP, ни с MCC [59].
Основные отличия в структуре белков этих семейств обнаруживают в N-концевой области, которая расположена в слое полисахаридов, где соединена с ними и/или белками клеточной стенки [57]. У Wsc-семейства это Cys-богатый домен, который имеет признаки лектинсвязывающего домена и контактирует с глюканом клеточной стенки [16, 60]. N-концевая область сенсоров Mid2 и Mtl1, по-видимому, также контактирует в клеточной стенке с сетью глюкановых фибрилл или маннопротеинами, но вместо Cys-богатого домена имеет N-гликозилирование, что необходимо для осуществления их сенсорной функции [59, 61]. У всех 5 сенсоров присутствует О-маннозилированная область, которая локализуется в клеточной стенке, один трансмембранный домен, обеспечивающий заякоривание в плазматической мембране, и цитоплазматическая часть [62, 63]. Структура последней различается у разных представителей этой группы белков, что, по-видимому, влияет на распределение сенсоров в плазматической мембране [57, 64].
БИОГЕНЕЗ КЛЕТОЧНОЙ СТЕНКИ
Комплекс ферментов: синтетаз, гидролаз и трансфераз – функционирует на поверхности клетки, непрерывно гидролизуя существующий глюкан, синтезируя глюкановые цепи de novo и встраивая синтезированные молекулы полисахаридов в участки растущей клеточной стенки, которые непрерывно формируются как в ее латеральной части, так и в зоне почкования ‒ где эти процессы идут особенно интенсивно [1, 3, 6‒8].
В процессах деградации и формирования клеточной стенки de novo при делении в зоне почковании и делении, а также ремоделировании сформированных участков латеральной клеточной стенки в процессе роста, при половом процессе в зоне конъюгации и ответе на стресс первостепенную важность приобретают глюкансинтетазный комплекс, расположенный в плазматической мембране, и обширная группа глюканремоделирующих ферментов. Синтез полимеров β-1,3-глюкана и хитина в основном происходит на плазматической мембране.
β-1,3-глюкан. Основной структурный полисахарид клеточной стенки β-1,3-глюкан синтезируется глюкансинтетазным комплексом, локализованным в плазматической мембране. В его состав входят регуляторная (Rho1p) и каталитическая (Fks1p) субъединицы. При делеции гена FKS1 (а также при недостатке глюкозы в среде роста) в клетке экспрессируется ген FKS2, кодирующий другую каталитическую субъединицу глюкансинтетазного комплекса. Клетки дрожжей становятся нежизнеспособными при одновременной делеции генов FKS1 и FKS2 [16, 65]. Глюкансинтетазный комплекс локализован в плазматической мембране таким образом, что синтезируемые линейные цепи β-1,3-глюкана поступают в периплазматическое пространство и затем в клеточную стенку в зону активного роста клетки для формирования новой клеточной стенки или в точку ее интеркалярного роста и растяжения. В этом же участке клеточной поверхности в местах инвагинации мембраны закрепляются пучки актинового цитоскелета (actin patches) [3, 65].
Новосинтезированные линейные полимеры глюкана, составляющего в итоге до 60% массы клеточной стенки, подвергаются многочисленным модификациям, в которых непосредственно в момент синтеза молекулы или после его завершения участвуют глюканремоделирующие ферменты, такие как экзогликозилгидролазы Exg1p и Exg2p, гликозилгидролаза Ssg1p (специфичная для фазы споруляции), глюканозилтрансгликозилаза Bgl2p. Многие из таких белков локализованы в периплазматическом пространстве и в клеточной стенке, в которой закреплены нековалентно [1, 3, 66, 67]. Как именно ‒ это один из наиболее интригующих и малоисследованных вопросов по молекулярной организации клеточной поверхности дрожжей.
Еще один белок, вовлеченный в модификацию β-1,3-глюкана, ‒ GPI-заякоренный белок плазматической мембраны, относящийся к семейству Gas (в первую очередь, Gas1p), который может присутствовать и в клеточной стенке [37, 68]. Глюканозилтрансгликозилазы Bgl2p и Gas1p в настоящее время рассматриваются многими авторами как основные глюканремоделирующие ферменты клеточной стенки [38, 69].
β-1,6-глюкан. Не менее важный полисахарид клеточной стенки дрожжей ‒ β-1,6-глюкан. На его долю приходится до 15% массы клеточной стенки [7]. Формирование β-1,6-глюкана, по-видимому, происходит за пределами плазматической мембраны. β-1,6-глюкан содержится в клеточной стенке на всех стадиях роста и относится к важнейшим ее компонентам. Вместе полимеры β-1,3- и β-1,6-глюкана формируют сеть, которая служит остовом для прикрепления маннопротеинов и хитина [7]. Как отмечено ранее, GPI-белки клеточной стенки могут быть связаны через β‑1,6-глюкан с β-1,3-глюканом и в некоторых случаях с хитином [14, 19].
До сих пор до конца неясно, каким образом происходит синтез β-1,6-глюкана, поскольку не обнаружено ферментов, ответственных за этот процесс [3, 16]. Кроме того, мало экспериментальных данных, которые можно использовать для биоинформационного поиска ферментов-кандидатов, ответственных за синтез β-1,6-глюкана [3].
Хитин. Биосинтез хитина – полимера, количество которого, как правило, не превышает 5% массы клеточной стенки, осуществляют, как минимум, три локализованных в плазматической мембране фермента со сложной метаболической регуляцией активности [3, 9, 70, 71]. Хитинсинтетаза Chs1p, каталитическая субъединица которой кодируется геном CHS1, участвует в репарации клеточной стенки дочерней клетки [3, 71]. За формирование первичной септы отвечает хитинсинтетаза Chs2p. Синтез хитинового кольца на месте формирования будущей почки осуществляет хитинсинтетаза Chs3p, которая также необходима для синтеза хитина латеральной клеточной стенки. Таким образом, Chs3p синтезирует почти 90% хитина в клеточной стенке [3, 70, 71]. Chs3p локализуется на плазматической мембране и в зоне кольца септинов [71].
Давно известно, что в клеточной стенке хитин в основном ковалентно связан с β-1,3- и β-1,6-глюканом. Однако только недавно показано, что белки хитинтрансгликозилазы Crh1p и Crh2p принимают участие в присоединении хитина к β‑1,3- и β-1,6-глюкану в клеточной стенке [70]. Процессы встраивания и модификации новосинтезированных молекул хитина в клеточную стенку исследованы в классических работах лаборатории Кабиба [12, 17, 19, 70], однако до сих пор эти процессы во многом не поняты. На этом примере мы убеждаемся, насколько мало нам известно про локализованные в плазматической мембране и периплазматическом пространстве ферменты, которые участвуют во встраивании полимеров в молекулярный ансамбль клеточной стенки.
Активность глюкансинтетазного комплекса, как и хитинсинтетаз, находится под сложным метаболическим контролем. Этим исследованиям посвящено множество статей, но их рассмотрение не входит в задачи данного обзора. Отметим еще раз, что синтез и хитина, и глюкана находится под контролем путей, в регуляции которых принимают участие механосенсоры.
В случае повреждения любого из процессов, приводящих к формированию правильно организованного и функционирующего молекулярного ансамбля клеточной поверхности, клетки активируют сложную цепь компенсаторных событий, позволяющих им при многих нарушениях сохранять клеточную стенку в жизнеспособном состоянии. Говоря об этих компенсаторных процессах, следует упомянуть один важный аспект биосинтеза хитина. Хорошо известен факт отсутствия ярко выраженных, имеющих принципиальное значение для жизнеспособности клеток, фенотипических проявлений при нарушении генов, кодирующих белки, которые непосредственно участвуют в процессах биосинтеза и сборки клеточной стенки дрожжей. И это, скорее, правило, чем исключение. Клетка часто успешно компенсирует делеции подобного рода и в большинстве случаев один из первых компенсационных ответов сопровождается увеличением активности хитинсинтетаз и повышением уровня синтезируемого ими хитина. Содержание хитина в клеточной стенке повышается при снижении уровня β-1,3-глюкана (штаммы-делетанты fks1-Δ, knr4-Δ, gas1-Δ, bgl2-Δ), β-1,6-глюкана (kre6-Δ), а также при нарушении инкорпорации ковалентно связанных белков, N‑гликозилирования белков у дрожжей S. cerevisiae и при нарушении О-гликозилирования белков у дрожжей S. cerevisiae и Hansenula (совр. Ogataea) polymorpha [3, 14, 72‒75].
Не исключено, что отмеченная репарирующая роль хитина в ответ на структурные повреждения клеточной стенки в совокупности с данными о числе ферментов, синтезирующих этот минорный полисахарид клеточной стенки дрожжей (напомним, что основной структурный полисахарид β-1,3-глюкан образуется в результате работы одного синтетазного комплекса, расположенного в плазматической мембране), указывает на важное значение хитина для клеток дрожжей. Это справедливо и для большинства современных мицелиальных грибов, например, аскомицетов и базидиомицетов [9]. По-видимому, в процессе эволюции структурная роль хитина, по крайней мере, у изучаемых дрожжей, была утрачена, хотя их клетки “вспоминают” о хитине как о важнейшем структурном полимере и, возможно, используют его в качестве репарирующего компонента при нарушениях в клеточной стенке. Значительными фенотипическими проявлениями характеризуются, как правило, мутации или делеции генов, кодирующих белки с регуляторной функцией, под контролем которых находится процесс биосинтеза и сборки клеточной стенки в целом. Описанная ситуация сильно усложняет процесс изучения структуры клеточной стенки дрожжей и выявления роли, которую играют составляющие ее биополимеры.
Парадоксы полисахаридремоделирующих ферментов. По современным представлениям, полисахариды клеточной стенки дрожжей связаны ковалентными связями в единую сеть. Это должно приводить к парадоксальной ситуации: полисахаридремоделирующие ферменты, которые находятся в тесном контакте со своим субстратом (полисахаридами клеточной стенки) на протяжении всей жизни клетки и по всей поверхности клеточной стенки, в то же время ограничены в возможности латерального перемещения по ней. Тем не менее они проявляют свою активность только там и тогда, где и когда это необходимо, так как отсутствие контроля за их активностью приведет к лизису клетки. До настоящего времени остаются малоизученными вопросы экспорта, встраивания и механизма регуляции активности полисахаридремоделирующих ферментов клеточной поверхности дрожжей.
На основании всего изложенного можно сформировать представление о способе встраивания белков клеточной поверхности в ее молекулярный ансамбль ‒ с вовлечением амилоидных свойств этих белков. Мы предполагаем, что структура клеточной стенки неоднородна. Наша гипотеза заключается в том, что клеточная стенка характеризуется наличием зон, в которых ремоделирование молекул глюкана с участием таких ферментов, как Bgl2p, происходит более активно. Можно предположить, что увеличение площади клеточной стенки в процессе роста клетки дрожжей происходит по принципу “панциря черепахи”, при котором части с относительно мало изменяемой площадью увеличиваются за счет точек роста по краям. Проверить эту гипотезу можно в исследовании топологии и совместной локализации глюканремоделирующих ферментов плазматической мембраны и клеточной стенки.
ВЕЗИКУЛЫ ЭКЗОЦИТОЗА – СВЯЗУЮЩИЙ КОМПАРТМЕНТ МЕЖДУ ПЛАЗМАТИЧЕСКОЙ МЕМБРАНОЙ, ПЕРИПЛАЗМАТИЧЕСКИМ ПРОСТРАНСТВОМ И КЛЕТОЧНОЙ СТЕНКОЙ И ИНСТРУМЕНТ ДЛЯ КООРДИНАЦИИ ИХ ФУНКЦИЙ
Еще одно новое направление в изучении молекулярной организации и функционирования клеточной стенки дрожжей связано с обнаружением в ней везикул, содержащих белки. Сравнительно недавно при исследовании дрожжей C. albicans показано, что сквозь клеточную стенку может осуществляться везикулярный транспорт в окружающую среду [76, 77]. В составе везикул через клеточную стенку в окружающую среду экспортируются такие белки как гликозилгидролазы клеточной стенки Scw11p и MP65, хитиназы Cht2p и Cht3p, адгезин Als4p, флокуллин, Eno1p и другие гликолитические ферменты, белки теплового шока и т.д. [76]. Механизм процесса транслокации везикул через клеточную стенку пока неясен, но совершенно очевидно, что он четко регулируется скоординированной работой всех трех компартментов клеточной поверхности: плазматической мембраны, периплазматического пространства и клеточной стенки.
Можно предположить, что статическая сетевая структура доменов плазматической мембраны определяет участки клеточной стенки, через которые везикулы могут проникать в окружающую среду. Возможно, расположение полисахаридремоделирующих ферментов в глюкановом каркасе клеточной стенки имеет мозаичную структуру, что мы учли в сформулированной гипотезе. Регуляция функционирования этих ферментов во времени и пространстве соотносится с сетевой структурой плазматической мембраны и, в частности, с участками, где происходит экзоцитоз. Полисахаридремоделирующие ферменты в этих микрокомпартментах, возможно, осуществляют динамичную перестройку клеточной стенки, тем самым облегчая перемещение везикул сквозь нее. Это предположение не противоречит высказанной нами гипотезе о топологии зон роста на поверхности клеточной стенки дрожжей. Безусловно, это еще предстоит подтвердить экспериментально.
Периплазматическое пространство ‒ это расположенный между клеточной стенкой и плазматической мембраной компартмент, который представляет собой полость, насыщенную физиологически активными, в том числе транзитными соединениями, поступающими в клетку из внешней среды через клеточную стенку, а также молекулами, направляющимися из цитоплазмы в клеточную стенку и на экспорт из клетки. Несмотря на очевидную важность процессов, происходящих в этом компартменте, знания о нем ограничены. Исследования в этой области посвящены большей частью анализу процессов на внешней стороне плазматической мембраны, тогда как относительно внутренней, обращенной к периплазматическому пространству стороне клеточной стенки известно мало [78, 79].
Клеточная стенка динамично реагирует на условия окружающей среды, при этом иногда, причем достаточно быстро, на ней могут образовываться области, заметно отличающиеся по составу и сильно измененные морфологически. Сказанное относится не только к зоне почкования, которая, как хорошо известно, претерпевает драматические изменения в процессе инициации формирования почки, ее роста и отделения от материнской клетки. В литературе накапливаются данные о том, что такие зоны быстрых и кардинальных изменений могут формироваться в латеральной клеточной стенке. Эти области носят название каналы. Они могут образовываться, например, при воздействии соединения амиодарона, вызывающего переход клеток дрожжей H. polymorpha к апоптозу [80]. Также каналы в клеточной стенке C. maltosa могут формироваться при выращивании дрожжей в присутствии гексадекана в качестве единственного источника углерода. В каналах клеточной стенки этих дрожжей обнаруживают полифосфаты [81]. Роль полифосфатов в регуляции функциональной активности клеточной оболочки вообще и клеточной стенки в частности исследована очень мало, но есть основания предполагать, что эти полимеры играют важную (если не определяющую) роль в регуляции активности полисахаридремоделирующих ферментов клеточной поверхности [81‒83].
Как уже отмечалось, в последнее время в литературе накапливаются данные о том, что некоторые глюканозилтрансгликозилазы обладают свойствами амилоидных белков [22, 25, 38]. В протеомных исследованиях последних лет показано, что Bgl2p присутствует в культуральной жидкости и принимает участие в формировании биопленок [84]. Эти факты позволяют не только по-новому представить процесс встраивания этих ферментов в глюкановый каркас клеточной стенки, но и предложить способ регуляции их активности, основанный на их способности формировать структуры амилоидного типа.
В свою очередь, способность глюканозилтрансгликозилаз клеточной поверхности дрожжей фибриллизоваться и, возможно, индуцировать фибриллизацию других белков представляет опасность для тех видов, клетки которых контактируют с поверхностью дрожжей, в том числе для человека при использовании этих микроорганизмов в пищевых, биотехнологических и медицинских целях.
MOONLIGHT-БЕЛКИ КЛЕТОЧНОЙ ПОВЕРХНОСТИ – УЧАСТНИКИ ОТВЕТА КЛЕТКИ НА СТРЕСС
Эти белки локализуются в различных компартментах клетки и выполняют не одну функцию. Часто места их локализации и функционирования сильно различаются [85, 86]. Их участие в регуляции ответа клетки на стресс – один из вопросов, от разрешения которого может зависеть понимание роли клеточной поверхности в этом процессе.
О существовании таких белков известно уже более 10 лет [2]. Примером может служить Tsalp (thiol-specific antioxidant-like protein), который обнаружили в клеточной стенке гифальной, но не дрожжевой формы C. albicans [87]. Tsa1p обеспечивает устойчивость к окислительному стрессу клеток дрожжевой формы, оставаясь при этом в цитоплазме и ядре. У S. cerevisiae гомологичный белок обнаружен исключительно в цитоплазме [87].
Еще один белок, принадлежность которого к группе moonlight-белков хорошо доказана и функция которого состоит в защите клеток от окислительного стресса, ‒ енолаза Eno1p. Наряду с енолазой эту функцию могут выполнять и другие белки, в частности гликолитические ферменты, белки теплового шока и высококонсервативные белки, экспрессия генов которых повышается и понижается в присутствии или в отсутствие АФК [88].
Следует обратить внимание еще на один белок, который может быть отнесен к moonlight-белкам. В серии работ продемонстрировано участие глюканозилтрансгликозилазы клеточной поверхности дрожжей – белка Gas1p – в регуляции сайленсинга у дрожжей. Показано, что не только делеция гена, кодирующего этот белок, но и нарушение его каталитического центра приводит к транскрипционному сайленсингу рибосомной ДНК [89, 90]. Строго говоря, в этих работах ядерная локализация Gas1p не доказана, но на основании полученных результатов, включая двугибридный анализ и конфокальную флуоресцентную микроскопию, авторы предположили, что Gas1p может помимо клеточной поверхности локализоваться на периферии ядра, где, по их мнению, принимает участие в гликозилировании гистондеацетилазы Sir2p или неизвестного ассоциированного с ней белка, что препятствует сайленсингу [89, 90]. Еще в одной работе показано, что делеция гена GAS1 приводит к повышению чувствительности клеток к повреждению ДНК и снижению фосфорилирования киназы Rad53, участвующей в передаче сигнала о повреждении ДНК, и к нарушению клеточного цикла [91]. По-видимому, белок Gas1p, помимо участия в транскрипционном сайленсинге рибосомных генов, вовлечен в ответ клетки на повреждение ДНК и регуляцию клеточного цикла. Следует отметить, что пока это единственный интригующий, хотя не до конца понятый, факт прямого участия белка клеточной поверхности в регуляции активности генома.
ЗАКЛЮЧЕНИЕ
Малый размер клетки дрожжей и большая величина отношения площади ее поверхности к объему ‒ определяющие факторы сильной зависимости этих клеток от физических, химических и биологических факторов окружающей среды и условий существования. Сигналы, которые управляют их метаболической активностью, в частности при ответе клеток на стресс, затрагивающий протекание таких фундаментальных процессов, как транскрипция, трансляция, а также деградация белков и нуклеиновых кислот, в значительном числе случаев исходят из внешней по отношению к клетке среды. Первый компартмент, воспринимающий эти сигналы, ‒ клеточная поверхность, в первую очередь, ее наружный компартмент – клеточная стенка. По значимости и числу выполняемых функций этот компартмент занимает исключительное место в системе жизнеобеспечения дрожжей ‒ до четверти их генома прямо участвует или в значительной степени вовлечено в процессы формирования клеточной стенки [1, 7, 9].
Невозможно понять механизмы ответа этих клеток на стресс различного происхождения и механизмы клеточного взаимодействия, включая и взаимодействие клеток высших эукариот с патогенными дрожжами, без детального знания “устройства” клеточной поверхности. Клеточная стенка представляет собой компартмент видо- и штаммспецифичных рецепторов, позволяющих отличать “своих” от “чужих”, а также определять количество “своих” на единицу площади или объема среды. Клеточная поверхность ‒ неотъемлемый участник таких процессов, как эндоцитоз, цитокинез и клеточный морфогенез. Она участвует в формировании всего комплекса морфологических и физиологических изменений клетки, обеспечивающих реализацию флокуляции и полового процесса. Молекулярные механизмы этих процессов в настоящее время изучены недостаточно.
Еще на один важный аспект хотелось бы обратить внимание. Молекулярная структура внешнего компартмента клеточной поверхности дрожжей – клеточной стенки – формируется за пределами плазматической мембраны в нестабильных и часто агрессивных условиях внешней среды. Это позволяет рассматривать процессы формирования молекулярного ансамбля клеточной стенки дрожжей как уникальную модельную систему для изучения механизмов самосборки полифункциональных и многокомпонентных надмолекулярных комплексов живых систем и регуляции функциональной активности белковых молекул, участвующих в них.
Мы выражаем благодарность Университету Ростока (University of Rostock; Rostock, Германия), на базе которого совместно с С.А. Кузнецовым была получена микрофотография, представленная на рисунке 1. Выражаем благодарность компании Visual Science за графическое оформление рисунка 2.
Работа поддержана грантом РФФИ № 18-34-00915мол_а.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Lesage G., Bussey H. (2006) Cell wall assembly in Saccharomyces cerevisiae. Microbiol. Mol. Biol. Rev. 70, 317‒343.
Chaffin W.L. (2008) Candida albicans cell wall proteins. Microbiol. Mol. Biol. Rev. 72, 495‒544.
Orlean P. (2012) Architecture and biosynthesis of the Saccharomyces cerevisiae cell wall. Genetics. 192, 775‒818.
Merzendorfer H., Heinisch J.J. (2013) Microcompartments within the yeast plasma membrane. Biol. Chem. 394(2), 189‒202.
Douglas L.M., Konopka J.B. (2014) Fungal membrane organization: the eisosome concept. Annu. Rev. Microbiol. 68, 377‒393.
Klis F.M., de Koster C.G., Brul S. (2014) Cell wall-related bionumbers and bioestimates of Saccharomyces cerevisiae and Candida albicans. Eukaryot. Cell. 13(1), 2‒9.
Francois J.M. (2016) Cell surface interference with plasma membrane and transport processes in yeasts. Adv. Exp. Med. Biol. 892, 11‒31.
Okada H., Kono K., Neiman A.M., Ohya Y. (2016) Examination and disruption of the yeast cell wall. Cold Spring Harb. Protoc. 8. https://doi.org/10.1101/pdb.top078659
Gow N.A.R., Latge J.P., Munro C.A. (2017) The fungal cell wall: structure, biosynthesis, and function. Microbiol. Spectr. 5(3), FUNK-0035-2016.
Manners D.J., Masson A.J., Patterson J.C. (1973) The structure of a β-(1,3)-D-glucan from yeast cell walls. Biochem. J. 135, 19‒30.
Fleet G.H., Manners D.J. (1976) Isolation and composition of an alkali-soluble glucan from the cell walls of Saccharomyces cerevisiae. J. Gen. Microbiol. 94(1), 180‒192.
Kollar R., Reinhold B.B., Petrakova E., Yeh H.J.C., Ashwell G., Drgonova J., Kapteyn J.C., Klis F.M., Cabib E. (1997) Architecture of the yeast cell wall. β‑(1-6)-glucan interconnects mannoprotein, β-(1-3)-glucan and chitin. J. Biol. Chem. 272, 17762‒17775.
Matveev A.L., Krylov V.B., Khlusevich Y.A., Baykov I.K., Yashunsky D.V., Emelyanova L.A., Tsvetkov Y.E., Karelin A.A., Bardashova A.V., Wong S.S.W., Aimanianda V., Latgé J.P., Tikunova N.V., Nifantiev N.E. (2019) Novel mouse monoclonal antibodies specifically recognizing β-(1→3)-D-glucan antigen. PLoS One. 14(4), e0215535.
Kapteyn J.C., Van Den Ende H., Klis F.M. (1999) The contribution of cell wall proteins to the organization of the yeast cell wall. Biophys. Biochem. Acta. 1426, 373‒383.
Калебина Т.С., Кулаев И.С. (2001) Роль белков в формировании молекулярной структуры клеточной стенки дрожжей. Успехи биологической химии. 41, 105‒130.
Levin D.E. (2011) Regulation of cell wall biogenesis in Saccharomyces cerevisiae: the cell wall integrity signaling pathway. Genetics. 189(4), 1145‒1175.
Cabib E., Arroyo J. (2013) How carbohydrates sculpt cells: chemical control of morphogenesis in the yeast cell wall. Nat. Rev. Microbiol. 11, 648‒655.
Mrsă V., Seidl T., Gentzsch M., Tanner W. (1997) Specific labelling of cell wall proteins by biotinylation. Identification of four covalently linked O-mannosylated proteins of Saccharomyces cerevisiae. Yeast. 30, 1145‒1154.
Kapteyn J.C., Ram A.F.J., Groos E.M., Kollar R., Montijn R.C., Van Den Ende H., Llobell A., Cabib E., Klis F.M. (1997) Altered extent of cross-linking of β1,6-glucosylated mannoproteins to chitin in Saccharomyces cerevisiae mutants with reduced cell wall β-1,3-glucan content. J. Bacteriol. 179, 6279‒6284.
Ecker M., Deutzmann R., Lehle L., Mrsa V., Tanner W. (2006) Pir proteins of Saccharomyces cerevisiae are attached to beta-1,3-glucan by a new protein-carbohydrate linkage. J. Biol. Chem. 281, 11523‒11529.
Molon M., Woznicka O., Zebrowski J. (2018) Cell wall biosynthesis impairment affects the budding lifespan of the Saccharomyces cerevisiae yeast. Biogerontology. 19(1), 67–79.
Kalebina T.S., Plotnikova T.A., Gorkovskii A.A., Selyakh I.O., Galzitskaya O.V., Bezsonov E.E., Gellissen G., Kulaev I.S. (2008) Amyloid-like properties of Saccharomyces cerevisiae cell wall glucantransferase Bgl2p: prediction and experimental evidences. Prion. 2(2), 91–96.
Otoo H.N., Lee K.G., Qiu W., Lipke P.N. (2008) Candida albicans Als adhesins have conserved amyloid-forming sequences. Eukaryot. Cell. 7(5), 776–782.
Безсонов Е.Е., Калебина Т.С., Горковский А.А., Кудряшова И.Б., Семисотнов Г.В., Кулаев И.С. (2010) Температурно-индуцированные конформационные переходы глюкантрансферазы Bgl2p, выделенной из клеточных стенок дрожжей Saccharomyces cerevisiae. Молекуляр. биология. 44(3), 551‒554.
Bezsonov E.E., Groenning M., Galzitskaya O.V., Gorkovskii A.A., Semisotnov G.V., Selyakh I.O., Ziganshin R.H., Rekstina V.V., Kudryashova I.B., Kuznetsov S.A., Kulaev I.S., Kalebina T.S. (2013) Amyloidogenic peptides of yeast cell wall glucantransferase Bgl2p as a model for the investigation of its pH-dependent fibril formation. Prion. 7(2), 175‒184.
Selivanova O.M., Glyakina A.V., Gorbunova E.Y., Mustaeva L.G., Suvorina M.Y., Grigorashvili E.I., Nikulin A.D., Dovidchenko N.V., Rekstina V.V., Kalebina T.S., Surin A.K., Galzitskaya O.V. (2016) Amyloid fibrils for amyloidogenic peptide from Bgl2p-glucantransferase of S. cerevisiae cell wall and its modifying analog. New morphology of amyloid fibrils. Biochim. Biophys. Acta. 1864(11), 1489‒1499.
Tartaglia G.G., Caflisch A. (2007) Computational analysis of the S. cerevisiae proteome reveals the function and cellular localization of the least and most amy-loidogenic proteins. Proteins. 68(1), 273–278.
Willaert R.G. (2018) Adhesins of yeasts: protein structure and interactions. J. Fungi (Basel). 4(4), pii: E119.
Lipke P.N. (2018) What we do not know about fungal cell adhesion molecules. J. Fungi (Basel). 4(2), pii: E59.
Hoyer L.L., Cota E. (2016) Candida albicans agglutinin-like sequence (Als) family vignettes: a review of Als protein structure and function. Front. Microbiol. 7, 280.
Nobile C.J., Mitchell A.P. (2006) Genetics and genomics of Candida albicans biofilm formation. Cell. Microbiol. 8(9), 1382–1391.
Nobile C.J., Johnson A.D. (2015) Candida albicans biofilms and human disease. Annu. Rev. Microbiol. 69, 71–92.
Sarthy A.V., McGonigal T., Coen M., Frost D.J., Meulbroek J.A., Goldman R.C. (1997) Phenotype in Candida albicans of a disruption of the BGL2 gene encoding a 1,3-beta-glucosyltransferase. Microbiology. 143(Pt. 2), 367‒376.
Alves C.T., Wei X.Q., Silva S., Azeredo J., Henriques M., Williams D.W. (2014) Candida albicans promotes invasion and colonisation of Candida glabrata in a reconstituted human vaginal epithelium. J. Infect. 69(4), 396‒407.
Modrzewska B., Kurnatowski P. (2015) Adherence of Candida sp. to host tissues and cells as one of its pathogenicity features. Ann. Parasitol. 61(1), 3‒9.
Mouyna I., Fontaine T., Vai M., Monod M., Fonzi W.A., Diaquin M., Popolo L., Hartland R.P., Latgé J.P. (2000) Glycosylphosphatidylinositol-anchored glucanosyltransferases play an active role in the biosynthesis of the fungal cell wall. J. Biol. Chem. 275(20), 14882-14889.
Mazáň M., Ragni E., Popolo L., Farkaš V. (2011) Catalytic properties of the Gas family β-(1,3)-glucanosyltransferases active in fungal cell-wall biogenesis as determined by a novel fluorescent assay. Biochem. J. 438(2), 275‒282.
Aimanianda V., Simenel C., Garnaud C., Clavaud C., Tada R., Barbin L., Mouyna I., Heddergott C., Popolo L., Ohya Y., Delepierre M., Latge J.P. (2017) The dual activity responsible for the elongation and branching of β-(1,3)-glucan in the fungal cell wall. MBio. 8(3), e00619-17.
Ryzhova T.A., Sopova J.V., Zadorsky S.P., Siniukova V.A., Sergeeva A.V., Galkina S.A. Nizhnikov A.A., Shenfeld A.A., Volkov K.V., Galkin A.P. (2018) Screening for amyloid proteins in the yeast proteome. Curr. Genet. 64(2), 469‒478.
Mouyna I., Hartland R.P., Fontaine T., Diaquin M., Simenel C., Delepierre M., Henrissat B., Latgé J.P. (1998) A 1,3-beta-glucanosyltransferase isolated from the cell wall of Aspergillus fumigatus is a homologue of the yeast Bgl2p. Microbiology. 144(Pt. 11), 3171‒3180.
Mouyna I., Hartl L., Latgé J.P. (2013) β-1,3-glucan modifying enzymes in Aspergillus fumigatus. Front. Microbiol. 4, 81.
Jeng H.W., Holmes A.R., Cannon R.D. (2005) Characterization of two Candida albicans surface mannoprotein adhesins that bind immobilized saliva components. Med. Mycol. 43(3), 209‒217.
Sabirzyanov F.A., Sabirzyanova T.A., Rekstina V.V., Adzhubei A.A., Kalebina T.S. (2018) C-terminal sequence is involved in the incorporation of Bgl2p glucanosyltransglycosylase in the cell wall of Saccharomyces cerevisiae. FEMS Yeast Res. 18(1), fox093.
Mrsa V., Ugarković T., Barbarić S. (1992) Binding of Saccharomyces cerevisiae extracellular proteins to glucane. Arch. Biochem. Biophys. 296(2), 569‒574.
Рекстина В.В., Горковский А.А., Безсонов Е.Е., Калебина Т.С. (2016) Амилоидные белки поверхности микроорганизмов: структура, свойства и значение для медицины. Вестник РГМУ. 1, 4‒12.
Mann S.J., Blank F. (1975) Systemic amyloidosis in mice inoculated with lyophilized Candida cells. Infect. Immun. 11(6), 1371–1374.
Pitarch A., Jiménez A., Nombela C., Gil C. (2006) Decoding serological response to Candida cell wall immunome into novel diagnostic, prognostic, and therapeutic candidates for systemic candidiasis by proteomic and bioinformatic analyses. Mol. Cell. Proteomics. 5(1), 79–96.
Henderson C.M., Block D.E. (2014) Examining the role of membrane lipid composition in determining the ethanol tolerance of Saccharomyces cerevisiae. Appl. Environ. Microbiol. 80(10), 2966.
Wang H.X., Douglas L.M., Veselá P., Rachel R., Malinsky J., Konopka JB. (2016) Eisosomes promote the ability of Sur7 to regulate plasma membrane organization in Candida albicans. Mol. Biol. Cell. 27(10), 1663‒1675.
Douglas L.M., Konopka J.B. (2019) Plasma membrane architecture protects Candida albicans from killing by copper. PLoS Genet. 15(1), e1007911.
Vaskovicova K., Stradalova V., Efenberk A., Opekarova M., Malinsky J. (2015) Assembly of fission yeast eisosomes in the plasma membrane of budding yeast: import of foreign membrane microdomains. Eur. J. Cell Biol. 94(1), 1‒11.
Jin C., Parshin A.V., Daly I., Strich R., Cooper K.F. (2013) The cell wall sensors Mtl1, Wsc1, and Mid2 are required for stress-induced nuclear to cytoplasmic translocation of cyclin C and programmed cell death in yeast. Oxid. Med. Cell. Longev. 2013, 320823.
Rego A., Duarte A.M., Azevedo F., Sousa M.J., Côrte-Real M., Chaves S.R. (2014) Cell wall dynamics modulate acetic acid-induced apoptotic cell death of Saccharomyces cerevisiae. Microb. Cell. 1(9), 303‒314.
Wallace-Salinas V., Brink D.P., Ahrén D., Gorwa-Grauslund M.F. (2015) Cell periphery-related proteins as major genomic targets behind the adaptive evolution of an industrial Saccharomyces cerevisiae strain to combined heat and hydrolysate stress. BMC Genomics. 16(1), 514.
Banavar S.P., Gomez C., Trogdon M., Petzold L.R., Yi T.M., Campàs O. (2018) Mechanical feedback coordinates cell wall expansion and assembly in yeast mating morphogenesis. PLoS Comput. Biol. 14(1), e1005940.
Borovikova D., Teparić R., Mrša V., Rapoport A. (2016) Anhydrobiosis in yeast: cell wall mannoproteins are important for yeast Saccharomyces cerevisiae resistance to dehydration. Yeast. 33(8), 347‒353.
Jendretzki A., Wittland J., Wilk S., Straede A., Heinisch J.J. (2011) How do I begin? Sensing extracellular stress to maintain yeast cell wall integrity. Eur. J. Cell Biol. 90, 740–744.
Kock C., Dufrêne Y.F., Heinisch J.J. (2015) Up against the wall: is yeast cell wall integrity ensured by mechanosensing in plasma membrane microdomains? Appl. Environ. Microbiol. 81(3), 806‒811.
Kock C., Arlt H., Ungermann C., Heinisch J.J. (2016) Yeast cell wall integrity sensors form specific plasma membrane microdomains important for signaling. Cell. Microbiol. 18, 1251‒1267.
Heinisch J.J., Dupres V., Wilk S., Jendretzki A., Dufrêne Y.F. (2010) Single-molecule atomic force microscopy reveals clustering of the yeast plasma membrane sensor Wsc1. PLoS One. 5, e11104.
Hutzler F., Gerstl R., Lommel M., Strahl S. (2008) Protein N-glycosylation determines functionality of the Saccharomyces cerevisiae cell wall integrity sensor Mid2p. Mol. Microbiol. 68, 1438–1449.
Vay H.A., Philip B., Levin D.E. (2004) Mutational analysis of the cytoplasmic domain of the Wsc1 cell wall stress sensor. Microbiology. 150, 3281–3288.
Petkova M.I., Pujol-Carrion N., de la Torre-Ruiz M.A. (2012) Mtl1 O-mannosylation mediated by both Pmt1 and Pmt2 is important for cell survival under oxidative condition sand TOR blockade. Fungal Genet. Biol. 49, 903–914.
Straede A., Heinisch J.J. (2007) Functional analyses of the extra- and intracellular domains of the yeast cell wall integrity sensors Mid2 and Wsc1. FEBS Lett. 581, 4495–4500.
Utsugi T., Minemura M., Hirata A., Abe M., Watanabe D., Ohya Y. (2002) Movement of yeast 1,3-β-glucan synthase is essential for uniform cell wall synthesis. Genes Cells. 7, 1‒9.
Goldman R.C., Sullivan P. A., Zakula D., Capobianco J.O. (1995) Kinetics of beta-1,3-glucan interaction at the donor and acceptor sites of the fungal glucosyltransferase encoded by the BGL2 gene. Eur. J. Biochem. 227(1‒2), 372‒378.
Teparić R., Mrša V. (2013) Proteins involved in building, maintaining and remodeling of yeast cell walls. Curr. Genet. 59(4), 171‒185.
Popolo L., Ragni E., Carotti C., Palomares O., Aardema R., Back J.W., Dekker H.L., de Koning L.J., de Jong L., de Koster C.G. (2008) Disulfide bond structure and domain organization of yeast beta-(1,3)-glucanosyltransferases involved in cell wall biogenesis. J. Biol. Chem. 283(27), 18553‒18565.
Плотникова Т.А., Селях И.О., Калебина Т.С., Кулаев И.С. (2006) Bgl2p и Gas1p ‒ основные глюкантрансферазы, формирующие молекулярный ансамбль клеточной стенки дрожжей. ДАН. 409(6), 828‒831.
Blanco N., Reidy M., Arroyo J., Cabib E. (2012) Crosslinks in the cell wall of budding yeast control morphogenesis at the mother-bud neck. J. Cell Sci. 125(Pt. 23), 5781–5789.
Gohlke S., Heine D., Schmitz H.P., Merzendorfer H. (2018) Septin-associated protein kinase Gin4 affects localization and phosphorylation of Chs4, the regulatory subunit of the Baker’s yeast chitin synthase III complex. Fungal Genet. Biol. 117, 11-20.
Ram A.F., Wolters A. Ten Hoopen R., Klis F.M. (1994) A new approach for isolating cell wall mutants in Saccharomyces cerevisiae by screening for hypersensitivity to calcofluor white. Yeast. 10, 1019‒1030.
Ram A.F.J., Kapteyn J.C., Montijn R.C., Caro L.H.P., Douwes J.E., Baginsky W., Mazur P., Van Den Ende H., Klis F.M. (1998) Loss of the plasma membrane-bound protein Gas1p in Saccharomyces cerevisiae results in release of β-1,3-glucan into the medium and induces a compensation mechanism to ensure cell wall integrity. J. Bacteriol. 180, 1418‒1424.
Соколов С.С., Калебина Т.С., Агафонов М.О., Арбатский Н.П., Кулаев И.С. (2002) Сравнительный анализ структурной роли белков и полисахаридов в клеточных стенках дрожжей Hansenula polymorpha и Saccharomyces cerevisiae. ДАН. 384(3), 411‒414.
Kalebina T.S., Farkas V., Laurinavichiute D.K., Gorlovoy P.M., Fominov G.V., Bartek P., Kulaev I.S. (2003) Deletion of BGL2 results in an increased chitin level in the cell wall of Saccharomyces cerevisiae. Antonie Van Leeuwenhoek. 84(3), 179‒184.
Vargas G., Rocha J.D., Oliveira D.L., Albuquerque P.C., Frases S., Santos S.S., Nosanchuk J.D., Gomes A.M., Medeiros L.C., Miranda K., Sobreira T.J., Nakayasu E.S., Arigi E.A., Casadevall A., Guimaraes A.J., Rodrigues M.L., Freire-de-Lima C.G., Almeida I.C., Nimrichter L. (2015) Compositional and immunobiological analyses of extracellular vesicles released by Candida albicans. Cell. Microbiol. 17, 389‒407.
Rodrigues M.L., Casadevall A. (2018) A two-way road: novel roles for fungal extracellular vesicles. Mol. Microbiol. 110(1), 11‒15.
Pitarch A., Nombela C., Gil C. (2008) Collection of proteins secreted from yeast protoplasts in active cell wall regeneration. Methods Mol. Biol. 425, 241‒263.
Aoyagi H., Ishizaka M., Tanaka H. (2012) Secretory production of cell wall components by Saccharomyces cerevisiae protoplasts in static liquid culture. Biotechnol. Lett. 34(4), 695‒700.
Kalebina T.S., Sokolov S.S., Selyakh I.O., Vanichkina D.P., Severin F.F. (2015) Amiodarone induces cell wall channel formation in yeast Hansenula polymorpha. Springerplus. 5, e11104.
Zvonarev A.N., Crowley D.E., Ryazanova L.P., Lichko L.P., Rusakova T.G., Kulakovskaya T.V., Dmitriev V.V. (2017) Cell wall canals formed upon growth of Candida maltosa in the presence of hexadecane are associated with polyphosphates. FEMS Yeast Res. 17(3), fox026.
Кулаев И.С., Вагабов В.М., Кулаковская Т.В. (2005) Высокомолекулярные неорганические полифосфаты: биохимия, клеточная биология, биотехнология. Москва: Научный мир, 215 с.
Калебина Т.С., Егоров С.Н., Арбатский Н.П., Безсонов Е.Е., Горковский А.А., Кулаев И.С. (2008) О роли высокомолекулярных полифосфатов в активации глюкантрансферазы Bgl2p из клеточной стенки дрожжей Saccharomyces cerevisiae. ДАН. 420(5), 695‒699.
Moreno-García J., Mauricio J.C., Moreno J., García-Martínez T. (2017) Differential proteome analysis of a flor yeast strain under biofilm formation. Int. J. Mol. Sci. 18(4), pii: E720.
Mani M., Chen C., Amblee V., Liu H., Mathur T., Zwicke G., Zabad S., Patel B., Thakkar J., Jeffery C.J. (2015) MoonProt: a database for proteins that are known to moonlight. Nucleic Acids Res. 43(Database issue), D277‒D282.
Jeffery C.J. (2018) Protein moonlighting: what is it, and why is it important? Philos. Trans. R. Soc. Lond. B Biol. Sci. 373(1738), pii: 20160523.
Urban C., Xiong X., Sohn K., Schroppel K., Brunner H., Rupp S. (2005) The moonlighting protein Tsa1p is implicated in oxidative stress response and in cell wall biogenesis in Candida albicans. Mol. Microbiol. 57, 1318–1341.
Serrano-Fujarte I., López-Romero E., Cuéllar-Cruz M. (2016) Moonlight-like proteins of the cell wall protect sessile cells of Candida from oxidative stress. Microb. Pathog. 90, 22‒33.
Koch M. R., Pillus L. (2009) The glucanosyltransferase Gas1 functions in transcriptional silencing. Proc. Natl. Acad. Sci. USA. 106, 11224‒11229.
Ha C.W., Kim K., Chang Y.J., Kim B., Huh W.K. (2014) The β-1,3-glucanosyltransferase Gas1 regulates Sir2-mediated rDNA stability in Saccharomyces cerevisiae. Nucleic Acids Res. 42(13), 8486‒8499
Eustice M., Pillus L. (2014) Unexpected function of the glucanosyltransferase Gas1 in the DNA damage response linked to histone H3 acetyltransferases in Saccharomyces cerevisiae. Genetics. 196(4), 1029‒1039.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология