Молекулярная биология, 2019, T. 53, № 6, стр. 924-932
40 лет импорта РНК в митохондрии: от фундаментальных механизмов к стратегиям генной терапии
П. А. Каменский a, *, И. А. Крашенинников a, И. Тарасов b, **
a Биологический факультет Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
b Molecular Genetics, Genomics and Microbiology (GMGM) – UMR 7156, Strasbourg University
67084 Strasbourg, France
* E-mail: peter@protein.bio.msu.ru
** E-mail: i.tarassov@unistra.fr
Поступила в редакцию 27.05.2019
После доработки 05.06.2019
Принята к публикации 05.06.2019
Аннотация
Импорт кодируемых ядерной ДНК рибонуклеиновых кислот в митохондрии описан у многих организмов. При этом набор импортируемых РНК, а также молекулярные механизмы этого процесса, сильно отличаются у разных видов. На сегодняшний день наиболее изучены в этом отношении пекарские дрожжи Saccharomyces cerevisiae. Более того, процессы импорта РНК дрожжей в митохондрии легли в основу нескольких генно-терапевтических стратегий, направленных на подавление негативного влияния патогенных мутаций в мтДНК человека. В данном обзоре рассмотрены молекулярные механизмы импорта РНК в митохондрии дрожжей, а также упомянутые стратегии генной терапии.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ИМПОРТА РНК В МИТОХОНДРИИ ДРОЖЖЕЙ
Митохондрии с момента их первых наблюдений в конце XIX века постоянно привлекают внимание исследователей. В настоящее время общепринятой считается эндосимбиотическая теория происхождения митохондрий [1], в соответствии с которой далекими предками митохондрий были свободноживущие бактерии, родственные современным риккетсиям. В ходе эволюции митохондриальные гены мигрировали в ядро по неизвестному на сегодняшний день механизму. Тем не менее, современные митохондрии все еще содержат ДНК, которая кодирует несколько белков и РНК, однако этих макромолекул недостаточно для поддержания функций митохондрий. Таким образом, большинство митохондриальных белков и некоторые РНК кодируются ядерным геномом и импортируются в органеллы из цитозоля.
Первые данные об импорте белков в митохондрии были получены в конце 70-х годов ХХ века [2]. Эта область науки развивалась и развивается достаточно интенсивно, и к настоящему времени детально описана сложная система транспорта белков через митохондриальные мембраны [3].
Гипотеза об импорте РНК в митохондрии была впервые выдвинута при изучении некоторых простейших [4], а затем экспериментально подтверждена Martin R.P. и соавт. (Страсбургский университет, Франция) [5]. С помощью двумерного гель-электрофореза во фракции митохондриальных тРНК дрожжей была обнаружена единственная тРНК, кодируемая ядерным геномом, а именно, лизиновая тРНК с антикодоном CUU (далее – тРЛ1). Следует отметить, что основное количество тРЛ1 локализовано в цитозоле, где эта тРНК участвует в трансляции. В митохондриях обнаружено только 2‒5% молекул тРЛ1 [5].
На протяжении многих лет работа Martin R.P. и соавт. [5] оставалась единственной в этой области. Одной из возможных причин этого могло быть некоторое недоверие научного сообщества к полученным результатам. Многие высказывали сомнения в возможности прохождения отрицательно заряженной молекулы РНК через отрицательно заряженные мембраны митохондрий. Кроме того, неясной оставалась биологическая роль тРЛ1 в митохондриях дрожжей. Однако в настоящее время феномен импорта РНК в митохондрии различных организмов не вызывает никаких сомнений в связи с большим количеством накопленных экспериментальных данных [6, 7].
Пекарские дрожжи стали первым модельным организмом, на котором были проведены механистические исследования импорта РНК в митохондрии. В конце 1980-х годов Иван Тарасов и Нина Энтелис (кафедра молекулярной биологии биологического факультета МГУ) разработали системы, позволяющие изучать митохондриальный транспорт РНК in vivo и in vitro [8]. Система in vivo заключалась в электропорации дрожжевых клеток радиоактивно меченными тРНК с дальнейшим радиоавтографическим обнаружением этих тРНК в митохондриальной фракции РНК. Действительно, тРЛ1 была выявлена как в цитозоле, так и в митохондриях, тогда как все другие цитозольные тРНК после электропорации локализовались исключительно в цитозоле. Подход in vitro представлял собой инкубацию изолированных дрожжевых митохондрий с радиоактивно меченными тРНК. С использованием этого подхода показано, что из всех дрожжевых тРНК через митохондриальные мембраны способна проникать только тРЛ1. Установлено, что процесс транслокации зависит от АТР и нуждается в участии некоторых не идентифицированных на том этапе растворимых цитозольных белков [8].
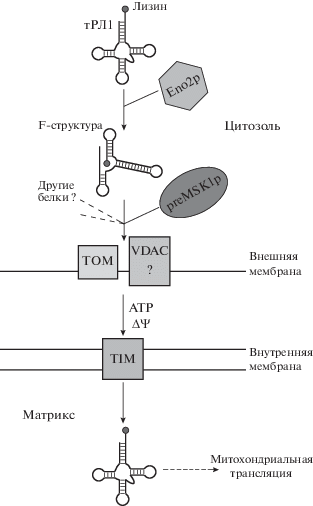
Дальнейшие исследования импорта тРНК в митохондрии дрожжей проводились совместными усилиями лабораторий Московского и Страсбургского университетов. Основным вопросом, занимавшим исследователей, был молекулярный механизм транслокации тРНК через мембраны митохондрий. Показано, что импорт тРЛ1 может быть функционально связан с импортом белков в митохондрии. Оказалось, что в транспорте тРЛ1 участвуют несколько компонентов аппарата импорта белков [9], среди которых идентифицированы Tom20p (рецептор импортируемых белков во внешней мембране) и Tim44p (компонент так называемого “мотора импорта” во внутренней мембране). Еще одним важным наблюдением стала зависимость импорта тРЛ1 от разности электрохимического потенциала на митохондриальных мембранах (ΔΨ) [9]. Эти результаты позволили предположить, что тРЛ1 проникает через мембраны митохондрий по пути белкового импорта. Более поздние исследования, однако, дают основания полагать, что каналом для импорта тРНК во внешней мембране может быть не только Tom40p (единственный канал транспорта белков), но также и потенциалзависимый анионный канал (VDAC) [10]. Аналогичная ситуация (одновременное участие Tom40 и VDAC в митохондриальном транспорте тРНК) описана у высших растений [11]. Тем не менее, рецепторные компоненты аппарата импорта белков, по-видимому, участвуют в импорте тРНК в митохондрии в любом случае [12].
Следует отметить, что ядерный геном дрожжей кодирует две лизиновые тРНК, причем вторая (далее тРЛ2), с антикодоном UUU, отличается от тРЛ1 всего 21-м основанием. В отличие от тРЛ1, тРЛ2 локализована исключительно в цитозоле. Это означает, что должны существовать детерминанты, которые обеспечивают возможность импорта тРЛ1, и/или “антидетерминанты” импорта, запрещающие этот процесс для тРЛ2. Наиболее очевидными детерминантами могли бы быть нуклеотиды, по которым тРЛ1 и тРЛ2 отличаются друг от друга. Для проверки этой гипотезы сконструированы мутантные молекулы тРЛ1 и тРЛ2 со взаимно замененными различающимися основаниями соответственно. Изучение импорта этих тРНК в системах in vitro и in vivo показало, что некоторые нуклеотиды тРЛ1 действительно служат детерминантами импорта: первый нуклеотид антикодона (C34) [13], первая пара оснований аминоакцепторного стебля (G1-U72) и дискриминаторный нуклеотид U73 [14].
Выдвинуто предположение, что перечисленные нуклеотиды могут обеспечивать взаимодействие тРЛ1 с предполагаемыми белковыми факторами процесса импорта [8]. Дальнейшие исследования позволили выявить несколько таких факторов.
Первый идентифицированный белковый фактор, участвующий в митохондриальном транспорте тРЛ1 – это цитозольная лизил-тРНК-синтетаза (Krs1p) [15]. Основная функция Krs1p заключается в аминоацилировании тРЛ1, чтобы эта тРНК могла участвовать в цитоплазматической трансляции. Однако показано, что для импорта в митохондрии тРЛ1 должна быть аминоацилирована. При этом само присутствие аминокислоты на 3'-конце тРЛ1 не является необходимым условием импорта. Создано несколько мутантных версий тРЛ1, которые не подвергались аминоацилированию какой-либо аминокислотой, но все же импортировались в митохондрии как in vitro, так и in vivo [13, 14, 16]. В связи с этим выдвинуто предположение о важности лизинилирования тРЛ1 для каких-то дальнейших этапов процесса импорта.
Эта гипотеза нашла свое экспериментальное подтверждение при идентификации другого белкового фактора, вовлеченного в импорт тРЛ1. Этот фактор ‒ цитозольный предшественник митохондриальной лизил-тРНК-синтетазы (preMsk1p), который синтезируется цитозольными рибосомами, а затем импортируется в митохондрии, где в зрелой форме аминоацилирует кодируемую митохондриальным геномом лизиновую тРНК (далее – тРЛ3). Показано, что в митохондриях штамма дрожжей, лишенного гена MSK1, тРЛ1 не обнаруживается [15]. В экспериментах in vitro установлено, что аминоацилированная тРЛ1 связывает preMsk1p, и это связывание абсолютно необходимо для транспорта тРНК через мембраны изолированных митохондрий. При этом preMsk1p не может ни связывать деацилированную тРЛ1, ни аминоацилировать ее [15]. Интересно, что определяющие импорт тРНК свойства рекомбинантного preMsk1p in vitro зависят от способа его очистки: preMsk1p, выделенный из Escherichia coli в денатурирующих условиях с последующей стадией ренатурации, может связывать тРЛ1 и направлять его импорт, тогда как нативный очищенный белок в данном процессе не компетентен [17]. Используя различные укороченные версии preMsk1p, показано, что его тРЛ1-связывающая и направляющая импорт активность локализована в N-концевом домене [18, 19], который отвечает за первичное распознавание антикодона тРНК при аминоацилировании.
Что касается мутантных версий тРЛ1 и тРЛ2, упомянутых ранее, то следует отметить строгую взаимосвязь между их способностью связываться с preMsk1p и эффективностью импорта в митохондрии [13, 14, 16]. Кроме того, мутантные тРНК, которые не могли подвергаться аминоацилированию, но эффективно импортировались в митохондрии, также обнаруживали высокое сродство к preMsk1p. Эти наблюдения могли быть объяснены тем, что аминоацилирование тРЛ1 придает молекуле тРНК некие структурные свойства, необходимые для ее связывания с preMsk1p, в то время как у мутантных молекул такими свойствами обладает и деацилированная форма. Что касается функциональной значимости связывания тРЛ1 с preMsk1p, то предполагается, что тРЛ1 может импортироваться в митохондрии в комплексе с этим белком. Другими словами, preMsk1p может быть переносчиком тРЛ1 через митохондриальные мембраны.
Третьим идентифицированным фактором импорта тРЛ1 в митохондрии дрожжей стала вторая изоформа гликолитического фермента енолазы (Eno2p) [20]. Этот белок вместе с preMsk1p составляет минимально необходимый набор факторов, обеспечивающий импорт аминоацилированной тРЛ1 в изолированные митохондрии дрожжей. Показано, что Eno2p связывает тРЛ1 (если она аминоацилирована) и способствует образованию комплекса между этой тРНК и preMsk1p [20]. Более того, в экспериментах in vitro показано, что Eno2p частично локализована на поверхности митохондрий [20, 21]. В то же время preMsk1p синтезируется, по крайней мере частично, рибосомами, связанными с внешней митохондриальной мембраной [20]. Эти данные свидетельствуют в пользу транспортной функции Eno2p. Этот белок может связывать тРЛ1 в цитозоле, а затем доставлять его к поверхности митохондрий, где тРЛ1 высвобождается из комплекса с енолазой-2 и связывается с preMsk1p. Следующий этап процесса это, по-видимому, транслокация данного комплекса через митохондриальные мембраны.
Завершая описание белковых факторов импорта тРЛ1, необходимо отметить, что список этих факторов к настоящему моменту не полон. Недавно показано, что в этот процесс могут быть вовлечены и другие, пока не идентифицированные, белки дрожжей [22].
Другой важный аспект импорта тРНК в митохондрии дрожжей связан со структурными перестройками молекулы тРЛ1. Первые признаки значимости структуры тРНК для ее импорта обнаружены в экспериментах, в которых тРЛ1, состоящая из двух нековалентно связанных между собой частей (т.е. содержащая одноцепочечный разрыв), могла импортироваться в митохондрии, но только в том случае, если две половины тРНК были предварительно связаны друг с другом [13]. Таким образом, способность тРЛ1 складываться в правильную структуру необходима для ее импорта. В дальнейшем с использованием метода FRET в геле показано, что молекула тРЛ1 может принимать две различные конформации, а именно, классическую L-форму тРНК и альтернативную структуру, характеризующуюся сближением 3'-конца с Т-стеблем [23]. Эта последняя структура обнаруживалась, когда тРЛ1 находилась в комплексе с Eno2p. Полученные данные свидетельствуют в пользу того, что Eno2p может функционировать, как РНК-шаперон, индуцирующий структурные перестройки молекулы тРЛ1 при связывании с ней, и эти перестройки определяют способность тРЛ1 импортироваться в митохондрии. Компьютерное моделирование показало, что никакие другие цитозольные тРНК дрожжей не могут принимать такую альтернативную структуру [23]. Это объясняет, почему из всех дрожжевых тРНК только тРЛ1 импортируется в митохондрии: ее нуклеотидная последовательность обеспечивает возможность принятия альтернативной конформации, фиксирующейся с помощью Eno2p. Это, в свою очередь, делает возможным последующее взаимодействие тРЛ1 с preMsk1p и транслокацию через мембраны митохондрий. Последовательность событий в цитозоле, предшествующих импорту тРЛ1 в митохондрии, схематически представлена на рис. 1.
Согласно предсказаниям in silico, альтернативная структура тРЛ1 характеризуется формированием двух шпилек: F и D [23]. Предположили, что F-шпильки как структурного элемента достаточно для обеспечения транспорта РНК в митохондрии. Действительно, анализируя набор небольших искусственных РНК, удалось показать, что молекулы РНК со стабильной F-шпилькой импортируются в митохондрии дрожжей как in vitro, так и in vivo с высокой эффективностью. Однако максимальной эффективностью импорта обладают именно версии РНК, содержащие F- и D-шпильки одновременно [23].
Все результаты, описанные выше, связаны с ответом на вопрос ‒ как тРЛ1 импортируется в митохондрии дрожжей? Однако существует еще один важный и, возможно, даже более интригующий вопрос ‒ зачем она импортируется? Долгое время ответа на этот вопрос получить не удавалось. Логично предположить, что после импорта тРЛ1 участвует в митохондриальной трансляции. Действительно, такое участие было выявлено: импортированные производные различных дрожжевых тРНК способны супрессировать нонсенс-мутации в мтДНК дрожжей [24]. Однако физиологическая роль импорта тРЛ1 оставалась неясной. Митохондриальный геном дрожжей кодирует лизиновую тРНК (тРЛ3) с антикодоном 5-карбоксиметиламинометил-2-тио-UUU, способным декодировать оба кодона лизина, ААА и AAG [25]. Таким образом, хотя участие тРЛ1 в митохондриальной трансляции и возможно, но оно представлялось необязательным. Наилучшим подходом к окончательному разрешению этого вопроса стало бы “выключение” импорта тРЛ1 и анализ функции митохондрий, не содержащих этой тРНК. Этого удалось достичь путем замены гена MSK1 в геноме дрожжей Saccharomyces cerevisiae на ортологичный ген других дрожжей, Ashbya gossypii. Предшественник митохондриальной лизил-тРНК-синтетазы из этого организма оказался полностью некомпетентным в направлении импорта тРЛ1 в митохондрии S. cerevisiae, но импортировался в митохондрии и эффективно аминоацилировал тРЛ3 [18]. Функция митохондрий (активность системы OXPHOS, характеризующаяся ростом дрожжей на специальных “дыхательных” средах) рекомбинантного штамма, не изменялась при нормальных условиях роста, но значительно снижалась при повышенных температурах (37°C). Дальнейший анализ показал, что при 37°С первый нуклеотид антикодона тРЛ3 (U34) становится гипомодифицированным, что приводит к неэффективному распознаванию кодонов AAG в митохондриальных мРНК. В этой ситуации присутствие тРЛ1, содержащей антикодон CUU, становится обязательным для нормального протекания митохондриальной трансляции [18]. Таким образом, импорт тРЛ1, по-видимому, связан с механизмом адаптации митохондриальной трансляции к повышенным температурам.
ИМПОРТ ДРОЖЖЕВЫХ РНК В МИТОХОНДРИИ ЧЕЛОВЕКА КАК СПОСОБ ПОДАВЛЕНИЯ ПАТОГЕННЫХ МУТАЦИЙ
Как уже упоминалось, некоторые производные дрожжевой тРЛ1 способны супрессировать мутации в собственной мтДНК [24]. В настоящее время в мтДНК человека описано более 200 патогенных мутаций [26]. Мутации в митохондриальных генах тРНК, одни из наиболее распространенных, приводят к аномальной трансляции в органеллах и значительной потере их функциональности. Направленный импорт тРНК из цитозоля мог бы стать хорошим средством подавления этих мутаций. Вопрос о естественном импорте тРНК в митохондрии человека все еще остается без ответа. Предполагается возможность импорта двух изоацепторных глутаминовых тРНК человека в митохондрии, поскольку в митохондриях человека не найдена система трансаминирования, необходимая для биосинтеза этих тРНК [27]. С другой стороны, аналогичная гипотеза [28] была опровергнута в случае дрожжей [29]. В любом случае, принимая во внимание сходство механизмов транспорта в клетках дрожжей и млекопитающих, предположили, что возможен “искусственный” импорт дрожжевых тРНК в митохондрии клеток человека. Если такое предположение справедливо, то имеются основания думать, что дрожжевые тРНК смогут принять участие в митохондриальной трансляции. Это могло бы стать эффективным способом элиминации негативных последствий патогенных мутаций в генах митохондриальных тРНК.
Действительно, показано, что дрожжевая тРЛ1 и ее мутантные производные импортируются в изолированные митохондрии клеток человека [24]. Также установлено, что все условия этого процесса аналогичны условиям, описанным для дрожжевой системы [30]. Кроме того, ортологи preMsk1p [31] и Eno2p человека [32], как показано позднее, принимают участие в этом искусственном транспорте. Таким образом, в клетках человека, по-видимому, имеется “криптический” механизм импорта тРНК. Кроме того, упомянутые небольшие искусственные РНК со стабильными F- и/или D-шпильками также способны проникать в изолированные митохондрии человека, а эффективность этого процесса даже в несколько раз выше, чем у полноразмерной тРЛ1 [23].
После того, как обнадеживающие результаты получены в системе in vitro, проверили способность производных дрожжевой тРЛ1 проникать через митохондриальные мембраны в культивируемых клетках человека. Действительно, импорт тРНК обнаружен и in vivo [33]. Таким образом стало возможным перейти к попыткам использования пути импорта тРНК для супрессии патогенной мутации в мтДНК человека. Одна из наиболее частых мутаций мтДНК человека, A8344G, локализована в гене лизиновой тРНК. Эта мутация вызывает так называемый синдром MERRF (от англ. myoclonic epilepsy with ragged-red fibers), который на молекулярном уровне проявляется дефектами аминоацилирования тРНК и преждевременной остановкой трансляции в митохондриях на лизиновых кодонах [34]. Импортируемые производные дрожжевых тРЛ1 или тРЛ2, синтезируемые в культивируемых клетках человека с мутацией MERRF, частично восстанавливают нормальный фенотип клеток за счет улучшения эффективности митохондриальной трансляции [33]. Это исследование стало первым успешным случаем супрессии мутации в митохондриальном гене тРНК при помощи импорта РНК из цитозоля. Позже, чтобы расширить спектр мутаций в мтДНК, которые можно супрессировать аналогичным образом, была сконструирована другая версия дрожжевой тРЛ1. Эта тРЛ1 сохранила все детерминанты митохондриального транспорта, а детерминанты аминоацилирования лизином в ней заменены на детерминанты для лейцина [35]. Это позволило супрессировать другую распространенную мутацию, A3243G, локализованную в митохондриальном гене лейциновой тРНК, которая вызывает синдром MELAS (от англ. mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes). Эта мутация, как и мутация MERRF, приводит к аномальной митохондриальной трансляции [36, 37]. Описанная искусственная тРНК может аминоацилироваться лейцином в митохондриях человека и, следовательно, способна принимать участие в митохондриальной трансляции вместо мутантной лейциновой тРНК и супрессировать патогенный фенотип клеток человека, несущих мутацию MELAS [35]. Таким образом, при помощи пути митохондриального импорта РНК удалось успешно супрессировать две точечные мутации в двух разных генах митохондриальных тРНК.
Другой относительно частый тип мутаций в мтДНК человека ‒ протяженные делеции, которые обычно приводят к одновременному удалению из мтДНК нескольких генов. Клетки человека с такими делециями жизнеспособны из-за существования явления гетероплазмии, характерного для подавляющего большинства мутаций в мтДНК человека. Гетероплазмия ‒ это одновременное присутствие в одной и той же клетке мутантных и нормальных молекул мтДНК. Известны пороговые уровни гетероплазмии при многих патогенных митохондриальных мутациях: если доля мутантных молекул ниже этого уровня, то мутантный фенотип отсутствует. Выше этого порога (обычно от 60 до 80% в зависимости от мутации) степень выраженности симптомов зависит от уровня гетероплазмии. Соответственно, снижение уровня гетероплазмии может быть одной из стратегий супрессии мутаций в мтДНК.
Короткие версии импортируемых РНК (содержащие F- и D-шпильки) успешно использовали в качестве векторов для доставки последовательностей РНК, комплементарных участку делеции в мтДНК, на мутантную мтДНК, несущую большую делецию. В эксперимент взяли делецию, вызывающую синдром Кирнса-Сейра (Kearns-Sayre, KSS). Эта делеция приводит к появлению в мтДНК уникальной последовательности. Короткие олигонуклеотиды, комплементарные цепи мтДНК, содержащей эту уникальную последовательность, были либо вставлены между F- и D-детерминантами импорта, либо слиты с одной из них. Показано, что такие молекулы РНК частично импортируются в митохондриальный матрикс и специфическим образом ингибируют репликацию мутантной мтДНК, что приводит к значительному, хотя и кратковременному, уменьшению доли мутантных молекул в клетках человека [38]. Позже установили, что эта же стратегия эффективно снижает уровень гетероплазмии даже в случае точечных мутаций в мтДНК [39].
ПЕРСПЕКТИВЫ
В настоящее время основные механизмы импорта тРНК в митохондрии дрожжей и человека изучены достаточно хорошо. Тем не менее, неизученным остается собственно процесс транслокации тРЛ1 через мембраны митохондрий. Как описано выше, транспорт тРЛ1 через наружную мембрану митохондрий дрожжей происходит либо через канал импорта белков, либо через анионный канал. Не ясно, имеет ли место выбор конкретного канала импорта тРЛ1 либо же тРНК может импортироваться через любой из них случайным образом. Ничего не известно и о том, каким образом тРЛ1 пересекает внутреннюю мембрану и достигает митохондриального матрикса. Современные методы микроскопии и эксперименты по ковалентной сшивке могут помочь решить эти проблемы и идентифицировать белки, которые принимают участие в транслокации тРЛ1 в качестве мембранных каналов и рецепторов/регуляторов этого процесса.
Еще один слабо изученный вопрос ‒ регуляция импорта тРЛ1 в митохондрии. Митохондрии содержат всего 3‒5% общеклеточного пула тРЛ1, тогда как остальные молекулы этой тРНК участвуют в трансляции в цитоплазме. Не ясно, каким образом обеспечивается именно такое соотношение количества импортируемых и неимпортируемых молекул. Вполне возможно, что важную роль здесь играет взаимодействие с Eno2p, но некоторые другие факторы также могут принимать участие в регуляции [22]. С другой стороны, доля импортируемых молекул тРЛ1 также может подвергаться регуляции в зависимости от изменения условий: известно, что убиквитин-протеасомная система связана с процессом импорта тРЛ1 в митохондрии, и нарушения ее работы влияют на количество молекул тРЛ1 в митохондриях [40]. Для выяснения молекулярных механизмов, лежащих в основе этих эффектов, требуются дальнейшие исследования.
Исследования, направленные на использование импорта тРНК в качестве инструмента генной терапии, технически достаточно сложны. Тем не менее, за последние 15‒20 лет в этой области достигнут существенный прогресс. Разработано несколько стратегий супрессии патогенных мутаций в мтДНК человека на основе импорта РНК. Однако все они имеют некоторые общие недостатки, значительно снижающие их терапевтический потенциал. Среди наиболее важных недостатков нужно отметить низкую эффективность и временный режим действия обсуждаемых подходов. Эти трудности удалось частично преодолеть. Показано, что введение дезоксирибонуклеотидов в “терапевтические” РНК или химические модификации их рибонуклеотидов увеличивают продолжительность жизни этих молекул [41]. Разработан метод доставки РНК в митохондрии, основанный на обратимой конъюгации РНК с холестерином [42]. Эти подходы потенциально важны для повышения терапевтической эффективности импорта РНК. В любом случае, исследования в этом направлении должны быть продолжены.
В настоящее время в научном сообществе активно обсуждается возможность внесения направленных изменений в митохондриальный геном при помощи системы CRISPR/Cas9. Эта технология признана самым мощным инструментом редактирования геномов живых существ. мтДНК человека может быть отредактирована с помощью рекомбинантных нуклеаз типа “цинковые пальцы” [43‒45] или технологии TALEN [46]. В этих системах не используются РНК, и в митохондрии импортируются только белки. В случае системы CRISPR/Cas9 в органеллы должны поступить как белок, так и РНК. В последнее время в данной области достигнут некоторый прогресс. Показано, что гидовые РНК, содержащие описанные детерминанты импорта, а также белок Cas9 с пришитой к нему сигнальной последовательностью, проникают в митохондрии клеток человека [47]. Использование системы CRISPR/Cas9 в митохондриях, по-видимому, представляет собой несколько более сложную задачу по сравнению с традиционным редактированием яДНК. Тем не менее, экспериментально показана возможность функциональной активности этой системы в митохондриях человека [47]. Недавно с использованием метода CRISPR/Cas9 в мтДНК Danio rerio была вставлена экзогенная последовательность. Более того, эта ДНК передавалась из поколения F0 в F1 [48]. Эти данные позволяют надеяться, что будет разработана эффективная система CRISPR/Cas9 для редактирования мтДНК.
Мы благодарим всех сотрудников, аспирантов и студентов, работающих или работавших когда-либо в страсбургской и московской лабораториях. Именно они получили бóльшую часть описанных результатов. Мы особенно благодарны Ивану Чичерину (Московский университет), который подготовил рисунок для данного обзора.
Авторы благодарят Французский национальный исследовательский центр (CNRS) и Российский фонд фундаментальных исследований (РФФИ), которые много лет на постоянной основе поддерживают совместные исследования. На данный момент они поддерживаются грантом РФФИ (№ 17-54-16005). И. Тарасов благодарит программы LabEx MitoCross, LIA (Laboratoire Internationale Associé) ARN-mitocure и EUR IMCBio.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Martin W.F., Garg S., Zimorski V. (2015) Endosymbiotic theories for eukaryote origin. Philos. Trans. R. Soc. Lond. B Biol. Sci. 370, 20140330.
Hallermayer G., Zimmermann R., Neupert W. (1977) Kinetic studies on the transport of cytoplasmically synthesized proteins into the mitochondria in intact cells of Neurospora crassa. Eur. J. Biochem. 81, 523‒532.
Pfanner N., Warscheid B., Wiedeman N. (2019) Mitochondrial proteins: from biogenesis to functional networks. Nat. Rev. Mol. Cell. Biol. 20, 267‒284.
Suyama Y. (1967) The origins of mitochondrial ribonucleic acids in Tetrahymena pyriformis. Biochemistry. 6, 2829‒2839.
Martin R.P., Schneller J.M., Stahl A.J., Dirheimer G. (1979) Import of nuclear deoxyribonucleic acid coded lysine-accepting transfer ribonucleic acid (anticodon C-U-U) into yeast mitochondria. Biochemistry. 18, 4600‒4605.
Верещагина Н.А., Константинов Ю.М., Каменский П.А., Мазунин И.О. (2018) Импорт белков и нуклеиновых кислот в митохондрии. Биохимия. 83, 816‒838.
Jeandard D., Smirnova A., Tarassov I., Barrey E., Smirnov A., Entelis N. (2019) Import of non-coding RNAs into human mitochondria: a critical review and emerging approaches. Cells. 8, 1‒27.
Tarassov I.A., Entelis N.S. (1992) Mitochondrially-imported cytoplasmic tRNA(Lys)(CUU) of Saccharomyces cerevisiae: in vivo and in vitro targetting systems. Nucl. Acids Res. 20, 1277‒1281.
Tarassov I., Entelis N., Martin R.P. (1995) An intact protein translocating machinery is required for mitochondrial import of a yeast cytoplasmic tRNA. J. Mol. Biol. 245, 315‒323.
Vyssokikh M.Y., Schirtz T., Kolesnikova O., Entelis N., Antonenko Y.N., Rokitskaya T.I., Tarassov I. (2012) Isoform porin 2 is involved in tRNA(Lys) transport from cytosol to mitochondria in yeast. Biochim. Biophys. Acta. Bioenergetics. 1817, S124‒S125.
Salinas T., Duchene A.M., Delage L., Nilsson S., Glaser E., Zaepfel M., Marechal-Drouard L. (2006) The voltage-dependent anion channel, a major component of the tRNA import machinery in plant mitochondria. Proc. Natl. Acad. Sci. USA. 103, 18362‒18367.
Schirtz T. (2012) Etude du mécanisme de translocation de l’ARNtLys(CUU) dans les mitochondries de Saccharomyces cerevisiae. PhD Thesis, Strasbourg University, Strasbourg. https://tel.archives-ouvertes.fr/file/index/docid/868796/ filename/Schirtz_Tom_2012_ED414.pdf
Entelis N., Kieffer S., Kolesnikova O., Martin R., Tarassov I. (1998) Structural requirement of tRNALys for its import into yeast mitochondria. Proc. Natl. Acad. Sci. USA. 95, 2838‒2843.
Kazakova H.A., Entelis N.S., Martin R.P., Tarassov I.A. (1999) The aminoacceptor stem of the yeast tRNALys contains determinants of mitochondrial import selectivity. FEBS Lett. 442, 193‒197.
Tarassov I., Entelis N., Martin R.P. (1995) Mitochondrial import of a cytoplasmic lysine-tRNA in yeast is mediated by cooperation of cytoplasmic and mitochondrial lysyl-tRNA synthetases. EMBO J. 14, 3461‒3471.
Kolesnikova O., Entelis N., Kazakova H., Brandina I., Martin R.P., Tarassov I. (2002) Targeting of tRNA into yeast and human mitochondria: the role of anticodon nucleotides. Mitochondrion. 2, 95‒107.
Смирнова Е.В., Чичерин И.В., Балева М.В., Энтелис Н., Тарасов И., Каменский П.А. (2016) Способ выделения рекомбинантного белка preMsk1p из клеток E. coli определяет его свойства как фактора импорта тРНК в митохондрии дрожжей. Биохимия. 81, 1349‒1358.
Kamenski P., Kolesnikova O., Jubenot V., Entelis N., Krasheninnikov I.A., Martin R.P., Tarassov I. (2007) Evidence for an adaptation mechanism of mitochondrial translation via tRNA import from the cytosol. Mol. Cell. 26, 625‒637.
Kamenski P., Smirnova E., Kolesnikova O., Krasheninnikov I.A., Martin R.P., Entelis N., Tarassov I. (2010) tRNA mitochondrial import in yeast: Mapping of the import determinants in the carrier protein, the precursor of mitochondrial lysyl-tRNA synthetase. Mitochondrion. 10, 284‒293.
Entelis N., Brandina I., Kamenski P., Krasheninnikov I.A., Martin R.P., Tarassov I. (2006) A glycolytic enzyme, enolase, is recruited as a cofactor of tRNA targeting toward mitochondria in Saccharomyces cerevisiae. Genes Dev. 20, 1609‒1620.
Brandina I., Graham J., Lemaitre-Guillier C., Entelis N., Krasheninnikov I., Sweetlove L., Tarassov I., Martin R.P. (2006) Enolase takes part in a macromolecular complex associated to mitochondria in yeast. Biochim. Biophys. Acta. 1757, 1217‒1228.
Балева М.В., Мейер М., Энтелис Н., Тарасов И., Каменский П., Маскида Б. (2017) Импорт тРНК в митохондрии дрожжей обеспечивается не только енолазой-2 и предшественником митохондриальной лизил-тРНК синтетазы, но и другими белковыми факторами. Биохимия. 82, 1681‒1695.
Kolesnikova O., Kazakova H., Comte C., Steinberg S., Kamenski P., Martin R.P., Tarassov I., Entelis N. (2010) Selection of RNA aptamers imported into yeast and human mitochondria. RNA. 16, 926‒941.
Kolesnikova O.A., Entelis N.S., Mireau H., Fox T.D., Martin R.P., Tarassov I.A. (2000) Suppression of mutations in mitochondrial DNA by tRNAs imported from the cytoplasm. Science. 289, 1931‒1933.
Umeda N., Suzuki T., Yukawa M., Ohya Y., Shindo H., Watanabe K. (2005) Mitochondria-specific tRNA-modifying enzymes responsible for the biosynthesis of the wobble base in mitochondrial tRNAs. Implications for the molecular pathogenesis of human mitochondrial diseases. J. Biol. Chem. 280, 1613‒1624.
Патрушев М.В., Каменский П.А., Мазунин И.О. (2014) Мутации митохондриальной ДНК и методы их коррекции. Биохимия. 79, 1417‒1428.
Rubio M.A., Rinehart J.J., Krett B., Duvezin-Caubet S., Reichert A.S., Soll D., Alfonzo J.D. (2008) Mammalian mitochondria have the innate ability to import tRNAs by a mechanism distinct from protein import. Proc. Natl. Acad. Sci. USA. 105, 9186‒9191.
Rinehart J., Krett B., Rubio M.A., Alfonzo J.D., Soll D. (2005) Saccharomyces cerevisiae imports the cytosolic pathway for Gln-tRNA synthesis into the mitochondrion. Genes Dev. 19, 583‒592.
Frechin M., Senger B., Braye M., Kern D., Martin R.P., Becker H.D. (2009) Yeast mitochondrial Gln-tRNA (Gln) is generated by a GatFAB-mediated transamidation pathway involving Arc1p-controlled subcellular sorting of cytosolic GluRS. Genes Dev. 23, 1119‒1130.
Entelis N.S., Kolesnikova O.A., Dogan S., Martin R.P., Tarassov I.A. (2001) 5S rRNA and tRNA import into human mitochondria. comparison of in vitro requirements. J. Biol. Chem. 276, 45642‒45653.
Gowher A., Smirnov A., Tarassov I., Entelis N. (2013) Induced tRNA import into human mitochondria: implication of a host aminoacyl-tRNA-synthetase. PLoS One. 8, e66228.
Baleva M., Gowher A., Kamenski P., Tarassov I., Entelis N., Masquida B. (2015) A moonlighting human protein is involved in mitochondrial import of tRNA. Int. J. Mol. Sci. 16, 9354‒9367.
Kolesnikova O.A., Entelis N.S., Jacquin-Becker C., Goltzene F., Chrzanowska-Lightowlers Z.M., Lightowlers R.N., Martin R.P., Tarassov I. (2004) Nuclear DNA-encoded tRNAs targeted into mitochondria can rescue a mitochondrial DNA mutation associated with the MERRF syndrome in cultured human cells. Hum. Mol. Genet. 13, 2519‒2534.
Enriquez J.A., Chomyn A., Attardi G. (1995) MtDNA mutation in MERRF syndrome causes defective aminoacylation of tRNA(Lys) and premature translation termination. Nat. Genet. 10, 47‒55.
Karicheva O.Z., Kolesnikova O.A., Schirtz T., Vyso-kikh M.Y., Mager-Heckel A.M., Lombes A., Boucheham A., Krasheninnikov I.A., Martin R.P., Entelis N., Tarassov I. (2011) Correction of the consequences of mitochondrial 3243A>G mutation in the MT-TL1 gene causing the MELAS syndrome by tRNA import into mitochondria. Nucl. Acids Res. 39, 8173‒8186.
Kirino Y., Goto Y., Campos Y., Arenas J., Suzuki T. (2005) Specific correlation between the wobble modification deficiency in mutant tRNAs and the clinical features of a human mitochondrial disease. Proc. Natl. Acad. Sci. USA. 102, 7127‒7132.
Kirino Y., Yasukawa T., Ohta S., Akira S., Ishihara K., Watanabe K., Suzuki T. (2004) Codon-specific translational defect caused by a wobble modification deficiency in mutant tRNA from a human mitochondrial disease. Proc. Natl. Acad. Sci. USA. 101, 15070‒15075.
Comte C., Tonin Y., Heckel-Mager A.M., Boucheham A., Smirnov A., Aure K., Lombes A., Martin R.P., Entelis N., Tarassov I. (2013) Mitochondrial targeting of recombinant tRNA s modulates the level of a heteroplasmic mutation in human mitochondrial DNA associated with Kearns Sayre syndrome. Nucl. Acids Res. 41, 418‒433.
Tonin Y., Heckel A.M., Vysokikh M., Dovydenko I., Meschaninova M., Rotig A., Munnich A., Venyaminova A., Tarassov I., Entelis N. (2014) Modeling of antigenomic therapy of mitochondrial diseases by mitochondrially addressed RNA targeting a pathogenic point mutation in mitochondrial DNA. J. Biol. Chem. 289, 13323‒13334.
Brandina I., Smirnov A., Kolesnikova O., Entelis N., Krasheninnikov I.A., Martin R.P., Tarassov I. (2007) tRNA import into yeast mitochondria is regulated by the ubiquitin-proteasome system. FEBS Lett. 581, 4248‒4254.
Tonin Y., Heckel A.M., Dovydenko I., Meschaninova M., Comte C., Venyaminova A., Pyshnyi D., Tarassov I., Entelis N. (2014) Characterization of chemically modified oligonucleotides targeting a pathogenic mutation in human mitochondrial DNA. Biochimie. 100, 192‒199.
Dovydenko I., Tarassov I., Venyaminova A., Entelis N. (2016) Method of carrier-free delivery of therapeutic RNA importable into human mitochondria: lipophilic conjugates with cleavable bonds. Biomaterials. 76, 408‒417.
Minczuk M., Papworth M.A., Miller J.C., Murphy M.P., Klug A. (2008) Development of a single-chain, quasi-dimeric zinc-finger nuclease for the selective degradation of mutated human mitochondrial DNA. Nucl. Acids Res. 36, 3926‒3938.
Gammage P.A., Rorbach J., Vincent A.I., Rebar E.J., Minczuk M. (2014) Mitochondrially targeted ZFNs for selective degradation of pathogenic mitochondrial genomes bearing large-scale deletions or point mutations. EMBO Mol. Med. 6, 458‒466.
Gammage P.A., Gaude E., Van Haute L., Rebelo-Guiomar P., Jackson C.B., Rorbach J., Pekalski M.L., Robinson A.J., Charpentier M., Concordet J.P., Frezza C., Minczuk M. (2016) Near-complete elimination of mutant mtDNA by iterative or dynamic dose-controlled treatment with mtZFNs. Nucl. Acids Res. 44, 7804‒7816.
Bacman S.R., Williams S.L., Pinto M., Peralta S., Moraes C.T. (2013) Specific elimination of mutant mitochondrial genomes in patient-derived cells by mitoTALENs. Nat. Med. 19, 1111‒1113.
Loutre R., Heckel A.M., Smirnova A., Entelis N., Tarassov I. (2018) Can mitochondrial DNA be CRISP rized: pro and contra. IUBMB Life. 70, 1233‒1239.
Bian W.P., Chen Y.L., Luo J.J., Wang C., Xie S.L., Pei D.S. (2019) Knock-in strategy for editing human and zebrafish mitochondrial DNA using mito-CRISPR/Cas9 system. ACS Synth. Biol. 8, 621‒632.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология