Молекулярная биология, 2020, T. 54, № 1, стр. 51-59
Влияние минорной короткой изоформы секурина (PTTG1) на транскрипцию существенно отличается от воздействия полной изоформы
Д. Э. Демин a, b, *, А. Н. Уварова a, c, А. В. Клепикова d, e, А. М. Шварц a, b
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Московский физико-технический институт
141701 Московская обл., Долгопрудный, Россия
c Биологический факультет Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
d Институт проблем передачи информации им. А.А. Харкевича Российской академии наук
127051 Москва, Россия
e Институт физико-химической биологии им. А.Н. Белозерского, Московский государственный университет
им. М.В. Ломоносова
119992 Москва, Россия
* E-mail: denis.demin@phystech.edu
Поступила в редакцию 25.03.2019
После доработки 25.05.2019
Принята к публикации 30.05.2019
Аннотация
Секурин позвоночных (PTTG1) является ингибитором сепаразы, регулятором репарации ДНК и транскрипции. Секурин экспрессируется преимущественно во второй половине S-фазы и на стадии G2 клеточного цикла. С наступлением анафазы секурин убиквитинируется комплексом APC/C и подвергается быстрой деградации. Повышенная экспрессия PTTG1 ассоциирована с усиленным ростом опухолевых клеток и метастазированием. Недавно мы обнаружили короткую изоформу секурина, лишенную основного сайта узнавания APC/C (D-бокс) и ДНК-связывающего домена, кодируемых экзонами 3 и 4. Уровень мРНК короткой изоформы в несинхронизированных клетках составляет 0.4‒2% от уровня полноразмерной мРНК PTTG1. Ранее мы сообщали о способности короткой изоформы PTTG1 активировать экспрессию части генов, контролируемых полноразмерным белком. В данной работе с помощью РНК-секвенирования определены группы генов, экспрессия которых меняется под действием короткой и полной изоформ секурина. Выявлены группы генов, уровень мРНК которых регулируется либо обеими изоформами белка, либо только одной из них. Влияние изоформ секурина на транскрипционную программу клеток изучено на примере гена NFYB, кодирующего субъединицу регулятора транскрипции NF-Y. Показано, что при сверхэкспрессии короткой изоформы уровень мРНК NFYB снижается в 2.4 ± 0.7 раза, при этом полная изоформа не влияла значимо на экспрессию NFYB. Подавление короткой изоформы секурина в 2.2 раза привело к росту уровня РНК NFYB в 2.7 ± 0.3 раза. Кроме того, в 2.7 ± 0.4 раза повысился уровень мРНК полноразмерного секурина. Поскольку NFYB связывается с промоторной областью гена PTTG1, мы предположили, что короткая изоформа может участвовать в регуляции экспрессии основной формы секурина за счет изменения уровня этого фактора транскрипции. NFYB и PTTG1 участвуют в развитии опухолей и формировании лекарственной устойчивости опухолевых клеток, поэтому мы предполагаем, что короткая изоформа секурина может играть важную роль в этих процессах. Таким образом, показана функциональная значимость минорной короткой изоформы секурина.
ВВЕДЕНИЕ
Доля генов, мРНК которых подвергаются альтернативному сплайсингу, растет с увеличением сложности организма [1]. Особенно важную роль альтернативный сплайсинг играет у млекопитающих [2], причем состав образующихся изоформ существенно отличается даже у эволюционно близких организмов. Например, полногеномное профилирование мРНК человека и шимпанзе [3] выявило значимые отличия в сплайсинге у 6‒8% из исследованных экзонов-ортологов. В процессе сплайсинга образуются не только основные, экспрессируемые на высоком уровне изоформы, но и минорные варианты, которые могут подвергаться деградации [4] или не играть существенной роли на фоне основных изоформ. Однако, если минорные изоформы обладают уникальной активностью или их экспрессия в некоторых условиях соизмерима с экспрессией высокоэкспрессируемых изоформ, то они могут выполнять определенные функции.
Секурин (PTTG1) – это регуляторный белок, играющий важную роль в контроле расхождения хромосом [5], сперматогенезе [6], репарации ДНК [7], эмбриогенезе [8], апоптозе [9] и пролиферации клеток [10‒12]. Секурин связывается с сепаразой, блокируя преждевременное разрезание когезина, который удерживает вместе сестринские хроматиды [13]. Высокий уровень PTTG1 наблюдается во второй половине S-фазы, на стадии G2 и в митозе до начала анафазы [14], во время которой секурин быстро деградирует посредством убиквитинирования комплексом APC/C [15]. Секурин связывается с промоторными областями 700 генов [16], а его повышенная экспрессия коррелирует с агрессивным ростом многих видов раковых клеток [17‒21] и метастазированием [20, 22, 23]. Секурин можно использовать в качестве прогностического маркера выживаемости [24‒29].
Ранее мы обнаружили короткую изоформу секурина, в которой отсутствуют сайт узнавания APC/C (D-бокс) и ДНК-связывающий домен, кодируемые экзонами 3 и 4 (рис. 1б). Уровень мРНК короткой изоформы в несинхронизированных клетках составляет 0.4‒2% от уровня мРНК полноразмерной формы. Ранее мы сообщали, что короткая изоформа PTTG1 способна воздействовать на экспрессию части генов, регулируемых полной изоформой [30]. В настоящей работе проведено полногеномное исследование влияния сверхэкспрессии изоформ секурина на транскрипцию. С использованием высокопроизводительного РНК-секвенирования выявлены различия в регуляции транскрипции разными изоформами PTTG1. Среди высокоактивных генов, уровень экспрессии которых при сверхэкспрессии короткой изоформы секурина изменился сильнее, чем при воздействии полной формы, для дальнейшего анализа была отобрана субъединица NFYB фактора транскрипции NF-Y. При сверхэкспрессии короткой изоформы уровень мРНК NFYB снизился в 2.4 ± 0.7 раза, при этом полная изоформа не влияла значимо на экспрессию NFYB.
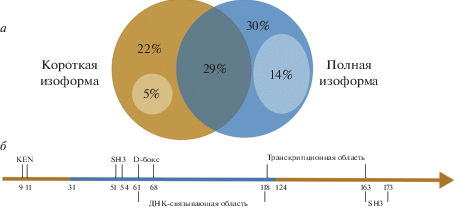
Рис. 1.
Диаграмма Венна с генами, регулируемыми полной и короткой изоформами PTTG1 (а), и схема функциональных участков PTTG1 (б). На диаграмме проценты рассчитаны от числа генов, уровень мРНК которых изменяется в 2 раза и более при сверхэкспрессии хотя бы одной изоформы секурина. Коричневым кругом обозначены гены, уровень мРНК которых изменился в 2 раза и более при сверхэкспрессии короткой изоформы. Синий круг означает гены, экспрессия которых изменилась в 2 раза и более под воздействием полной изоформы. В пересечении находятся гены, уровень мРНК которых изменился в 2 раза и более при сверхэкспрессии обеих изоформ. Светлыми участками выделены гены, экспрессия которых изменилась под воздействием только одной из изоформ (двоичный логарифм изменения экспрессии под воздействием другой изоформы был меньше 0.25 по модулю). б ‒ Под схемой приведены координаты (в аминокислотных остатках) функциональных участков PTTG1: SH3 ‒ область связывания SH3-доменов, D-бокс – сайт узнавания APC/C, KEN – дополнительный сайт деградации. Синим обозначен участок, присутствующий только в полной изоформе секурина.
Особый интерес представляет влияние изменения экспрессии короткой изоформы на физиологическом уровне. Для изучения такого влияния экспрессию данной изоформы снижали с помощью специфичной к ней малой интерферирующей РНК (siРНК). Показано, что подавление короткой изоформы секурина приводит к повышению экспрессии мРНК NFYB в 2.7 ± 0.3 раза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культивирование и транcфекция клеточной линии HEK293T векторами экспрессии. Нами использована клеточная линия HEK293T. Клетки культивировали в среде DMEM c добавлением 10%-ной эмбриональной сыворотки крупного рогатого скота, 2 мМ L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 1 мМ пирувата натрия. Получение экспрессионных векторов описано в [30]. Транcфекцию векторами, несущими последовательности, кодирующие изоформы секурина, или контрольным вектором, несущим ген GFP, проводили согласно [30]. Сверхэкспрессия изоформ секурина в клетках HEK293T подтверждена ранее с помощью количественной ПЦР и вестерн-блотинга [30].
Подавление экспрессии изоформ секурина. Для нокдауна изоформ секурина использовали siРНК. Последовательности siРНК для подавления обеих изоформ, только короткой изоформы и контрольнной sсRNA (scramble RNA) указаны в табл. 1S , см. Приложение на сайте http://www.molecbio.ru/downloads/2020/1/supp_Demin_rus.pdf. Трансфекцию клеток HEK293T осуществляли с использованием реагента RNAiMAX (“Thermo Fisher Scientific”, CША) согласно протоколу производителя.
Выделение РНК, синтез кДНК и количественная ПЦР в реальном времени. Суммарную РНК для высокопроизводительного секвенирования выделяли из клеток через 24 ч после трансфекции экспрессионными векторами, используя реагент ExtractRNA (“Eurogen”, Россия), в соответствии с инструкцией производителя. Библиотеки кДНК для последующего секвенирования получены с использованием набора Biooscientific NEXTflex Rapid Directional qRNA-Seq Library Prep kit (“Bio Scientific Corp.”, США) согласно протоколу производителя. Суммарную РНК для анализа влияния изоформ на экспрессию NFYB выделяли через 48 ч после трансфекции клеток экспрессионными векторами или siРНК. Реакцию обратной транскрипции проводили с помощью набора MMLV RT (“Eurogen”), используя 2 мкг РНК. Экспрессию NFYB и изоформ PTTG1 измеряли, используя количественную ПЦР в реальном времени, согласно [30]. Нуклеотидные последовательности праймеров для определения уровня мРНК NFYB приведены в табл. 1S дополнительных материалов. Уровень экспрессии измеряли по уровню мРНК β-актина. Уровень сверхэкспрессируемых мРНК полной и короткой изоформ был сходным и примерно в 6 раз превышал экспрессию β-актина. Полученные результаты нормировали на значения в контрольных образцах. Статистическую значимость изменений экспрессии оценивали с использованием t-теста Стьюдента.
Высокопроизводительное секвенирование РНК и обработка результатов. Библиотеки кДНК секвенировали с помощью прибора IlluminaNextSeq (“Illumina”, США). Использовали одиночные чтения длиной 75 п.н. Прочтения обрезали с использованием программы Trimmomatic [31]. Прочтения картировали на референсную последовательность генома человека (версия GRCh38) с использованием программы STAR [32]. Подсчет прочтений осуществляли с помощью программы FeatureCounts [33]. Расчеты проводили на оборудовании ЦКП “Геном” (http://www.eimb.ru/rus/ckp/ ccu_genome_c.php). Значения экспрессии нормировали с помощью программы DESeq2 [34]. Для дальнейшего анализа экспрессии использовали гены, имеющие хоть одно прочтение в каждом из образцов, как описано в [35]. P-значения рассчитанных корреляций не превышали 10–4. Кластеризацию генов проводили с использованием Metascape [36].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние сверхэкспрессии изоформ секурина на транскриптом клеток HEK293T
Для сравнения ролей изоформ секурина в регуляции транскрипции полную и короткую изоформы PTTG1 сверхэкспрессировали в клеточной линии HEK293T и проводили RNAseq-анализ (табл. 2S , см. Приложение на сайте http:// www.molecbio.ru/downloads/2020/1/supp_Demin_ rus.pdf). Корреляция нормированной экспрессии в контрольных клетках, несущих вектор с GFP, и в популяциях клеток, экспрессирующих полную и короткую изоформы секурина, составила 0.969 и 0.988 соответственно. Большее сходство уровней мРНК генов в клетках, экспрессирующих короткую изоформу, и в контрольных клетках соответствует данным [30] и может быть связано с отсутствием ДНК-связывающей области в короткой изоформе.
Cверхэкспрессия хотя бы одной изоформы секурина вызвала более чем двукратное изменение уровня экспрессии около 3700 генов. Экспрессия 73% из них под влиянием полной изоформы PTTG1 изменилась в 2 раза и более, а под воздействием короткой – на 56%. При сверхэкспрессии как полной, так и короткой изоформ экспрессия 29% затронутых генов изменилась в 2 раза и более (рис. 1а), у 25% генов эффект от обеих изоформ оказался сонаправленным. Сонаправленно регулируемые обеими изоформами гены связаны преимущественно с внеклеточным матриксом, межклеточной передачей сигнала, развитием гипофиза и миграцией клеток (рис. 2).
Рис. 2.
Кластеризация генов, сонаправленно регулируемых обеими изоформами секурина. Снизу отложены p-значения обогащения групп генов, полученные с помощью сервиса Metascape. Обогащение рассчитано с помощью генов, ассоциированных с функциональными группами.

Функциональные различия изоформ проявляются в генах, экспрессия которых регулируется одной из изоформ, но не меняется под действием другой. Такие гены были отобраны среди генов, уровень мРНК которых изменяется не менее чем в 2 раза при сверхэкспрессии одной изоформы, при условии, что изменение их экспрессии под воздействием другой изоформы было небольшим (двоичный логарифм меньше 0.25 по модулю). В результате из общего числа генов, уровень мРНК которых при сверхэкспрессии изоформ секурина изменился в 2 раза и более, 14% ответили только на полную изоформу и 5% ‒ только на короткую.
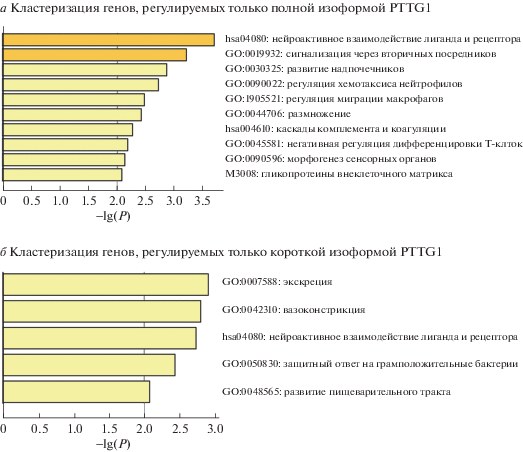
Кластеризация генов, регулируемых только короткой изоформой секурина, выявила большое число таких генов в группах, связанных с экскрецией, вазоконстрикцией, защитным ответом на грамположительные бактерии и развитием пищеварительного тракта (рис. 3). Группа генов, связанных с нейроактивным взаимодействием лиганда и рецептора, обогащена как генами, регулируемыми только полной изоформой, так и генами, управляемыми только короткой изоформой. Генами, регулируемыми только полной изоформой PTTG1, обогащены группы, ассоциированные с сигнализацией через вторичные посредники, развитием надпочечников, регуляцией хемотаксиса нейтрофилов и миграцией макрофагов, размножением, каскадами комплемента и коагуляции, негативной регуляцией дифференцировки T-клеток, морфогенезом сенсорных органов и гликопротеинами внеклеточного матрикса.
Рис. 3.
Кластеризация генов, регулируемых только одной из изоформ секурина. Снизу отложены p-значения обогащения групп генов, полученные с помощью сервиса Metascape. Обогащение рассчитано с помощью ассоциированных с функциональными группами генов.
Многие результаты кластеризации групп генов согласуются с ролями секурина, описанными во введении. Так, группы генов, ассоциированные с внеклеточным матриксом и миграцией, соотносятся с усиленной подвижностью клеток при повышенной экспрессии секурина [20, 22, 23]; группы, связанные с капацитацией спермы и размножением, соответствуют участию PTTG1 в сперматогенезе [6]. Группа генов, участвующих в синаптической передаче, обогащена не только генами, сонаправленно регулируемыми обеими изоформами, но и генами, уровень мРНК которых изменяется при сверхэкспрессии лишь одной из изоформ, что указывает на возможное влияние секурина на нейротрансмиссию. Для оценки статистической значимости изменений экспрессии конкретных генов необходимо проанализировать влияние сверхэкспрессии изоформ секурина в большем числе повторностей. Такое исследование методом количественной ПЦР проведено нами на гене NFYB.
Влияние короткой изоформы PTTG1 на экспрессию NFYB
Субъединица NFYB тримерного фактора транскрипции NF-Y была выбрана среди высокоэкспрессируемых (в среднем 500 прочтений) регуляторов транскрипции для более детального изучения. NF-Y экспрессируется на высоком уровне в большинстве тканей [37], где связывается с последовательностью CCAAT в промоторных областях широкого спектра генов [38, 39], поэтому воздействие изоформ секурина на экспрессию данного фактора влияет на многие биологические процессы.
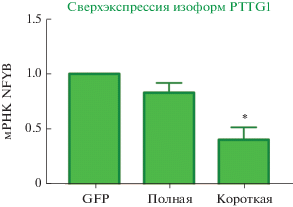
Методом количественной ПЦР мы показали, что сверхэкспрессия короткой изоформы секурина снижает экспрессию мРНК NFYB в 2.4 ± 0.7 раза, а при сверхэкспрессии полной изоформы уровень NFYB не подвергается значимым изменениям (рис. 4). Эти данные позволяют предположить, что короткая изоформа секурина сильнее влияет на транскрипцию гена NFYB, чем полноразмерный белок.
Рис. 4.
Влияние сверхэкспрессии изоформ секурина на уровень мРНК NFYB. Приведены средние значения и стандартная ошибка, вычисленные по трем независимым повторам. GFP – контрольный вектор, экспрессирующий GFP, Полная ‒ вектор, кодирующая полноразмерный PTTG1, Короткая – вектор, кодирующий короткую изоформу. *Изменение экспрессии относительно контроля, р < 0.01.
Для дальнейшего изучения влияния короткой изоформы PTTG1 на экспрессию NFYB мы разработали две siРНК: первая была комплементарна стыку второго и пятого экзонов и подавляла только короткую изоформу секурина; вторая снижала экспрессию мРНК обеих изоформ. Уровень полной изоформы снизился в 4.6 раза под воздействием siРНК, действующей на обе изоформы (рис. 5б). Обе siРНК привели к снижению экспрессии короткой изоформы секурина примерно в 2.2 раза (рис. 5в). Таким образом, получена система, позволяющая сравнить эффект от снижения экспрессии мРНК короткой изоформы и обеих изоформ одновременно.
Рис. 5.
Влияние подавления изоформ секурина на уровень мРНК NFYB. Приведены средние значения и стандартная ошибка, вычисленные по результатам трех независимых определений. Снизу указаны трансфицируемые малые интерферирующие РНК: Контроль ‒ scramble RNA; Обе ‒ РНК, подавляющая обе изоформы PTTG1, Короткая – РНК, снижающая уровень мРНК только короткой изоформы. * Изменения экспрессии относительно контроля р < 0.05.
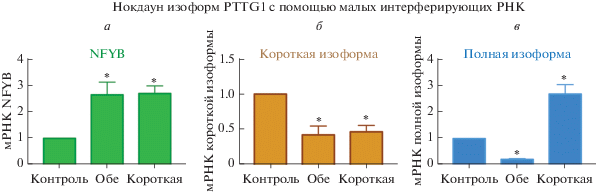
Подавление короткой изоформы PTTG1 вызвало значительное повышение уровня мРНК NFYB: экспрессия выросла в 2.7 ± 0.3 раза при использовании siРНК на короткую изоформу (рис. 5а). Снижение уровня короткой изоформы при трансфекции специфичной к ней siРНК сопровождалось повышением экспрессии полноразмерного PTTG1 в 2.7 ± 0.4 раза (рис. 5в). Поскольку в экспериментах по сверхэкспрессии полной формы секурина уровень мРНК NFYB не менялся, можно предположить, что повышение экспрессии NFYB связано с подавлением короткой изоформы, а не с увеличением количества полноразмерного PTTG1. Повышение экспрессии NFYB в 2.6 ± 0.5 раза выявлено также при использовании siРНК на обе изоформы (рис. 5а).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ влияния сверхэкспрессии изоформ PTTG1 выявил различия в наборах генов, регулируемых разными изоформами (рис. 1). Количество генов, регулируемых только полноразмерным секурином, почти в 3 раза превышает число генов, на которые влияет только короткая изоформа, что можно объяснить отсутствием ДНК-связывающей области в короткой изоформе PTTG1. Однако интерес представляет само существование генов, экспрессия которых регулируется только минорной изоформой секурина, поскольку указывает на возможную значимость малоизученных минорных изоформ белков.
Снижение уровня мРНК NFYB при сверхэкспрессии короткой изоформы секурина (рис. 4) и его повышение при подавлении короткой изоформы (рис. 5а) свидетельствует о негативной регуляции экспрессии NFYB короткой изоформой. При этом полная изоформа PTTG1 не оказывает значимого влияния на экспрессию NFYB. Таким образом, короткая изоформа секурина обладает функциональной активностью, несмотря на низкий уровень ее экспрессии по сравнению с полной формой и отсутствие последовательностей, которых нет в полноразмерном белке.
Тримерный транскрипционный фактор NF-Y связывается с последовательностью CCAAT в промоторных областях генов [38]. Показана важность NF-Y в регуляции транскрипции генов семейства ID в эмбриогенезе [40]. NF-Y контролирует de novo синтез липидов, полиаминов и пуринов, гликолиз, активирует пути глутамина и SOCG [39]. Описана роль β-субъединицы NF-Y при раке: снижение экспрессии NFYB повышает частоту апоптоза в клеточной линии U2OS [41], а высокий уровень NFYB активирует ген E2F1, связанный со снижением чувствительности клеток колоректального рака к оксалиплатину [42]. Можно предположить, что повышение уровня NFYB при подавлении экспрессии короткой изоформы PTTG1 приводит к усиленному развитию опухолей.
При избирательном подавлении экспрессии короткой изоформы секурина мы наблюдали значимое повышение экспрессии длинной формы (рис. 5в). Одним из объяснений такого результата может быть участие короткой изоформы PTTG1 в регуляции экспрессии полной изоформы. Согласно данным иммунопреципитации хроматина, представленным в базе GTRD [43, 44], NFYB связывается с промоторной областью PTTG1, что указывает на возможное участие короткой изоформы в механизме саморегуляции экспрессии секурина через регуляцию NFYB. Полученные ранее данные [30] показывают, что сверхэкспрессия короткой изоформы PTTG1 не оказывает значимого влияния на уровень эндогенной полной изоформы. Этот результат может означать, что короткая изоформа регулирует уровень мРНК полной изоформы при физиологических уровнях экспрессии.
Нарушение основного сайта связывания APC/C с секурином (D-бокс) приводит к замедлению деградации PTTG1 [5]. Короткая изоформа лишена D-бокса, поэтому она может деградировать медленнее. Обе изоформы содержат дополнительный сайт деградации KEN. Комплекс APC/C с кофактором CDC20, участвующим в убиквитинировании секурина, действует не только в митозе, но и в ранней G1-фазе [15]. Учитывая низкий уровень PTTG1 после митоза, можно предположить, что короткая изоформа наиболее важна в начале фазы G1 за счет ее большей устойчивости.
Данная работа показывает перспективность исследования минорных изоформ, которые могут служить терапевтическими мишенями при различных патологиях.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 18-34-00628 мол_а.
В исследовании не использованы биологические материалы, полученные от людей или животных.
Авторы заявляют об отсутствии конфликта интересов
Список литературы
Kalsotra A., Cooper T.A. (2011) Functional consequences of developmentally regulated alternative splicing. Nat. Rev. Genet. 12, 715‒729.
Kim E., Magen A., Ast G. (2007) Different levels of alternative splicing among eukaryotes. Nucl. Acids Res. 35, 125‒131.
Calarco J.A., Xing Y., Caceres M., Calarco J.P., Xiao X., Pan Q., Lee C., Preuss T.M., Blencowe B.J. (2007) Global analysis of alternative splicing differences between humans and chimpanzees. Gene Dev. 21, 2963‒2975.
Melamud E., Moult J. (2009) Stochastic noise in splicing machinery. Nucl. Acids Res. 37, 4873‒4886.
Zou H., McGarry T.J., Bernal T., Kirschner M.W. (1999). Identification of a vertebrate sister-chromatid separation inhibitor involved in transformation and tumorigenesis. Science. 285, 418‒422.
Roy Choudhury D., Small C., Wang Y., Mueller P.R., Rebel V.I., Griswold M.D., McCarrey J.R. (2010) Microarray-based analysis of cell-cycle gene expression during spermatogenesis in the mouse. Biol. Reproduction. 83, 663‒675.
Romero F., Multon M.C., Ramos-Morales F., Dominguez A., Bernal J.A., Pintor-Toro J.A., Tortolero M. (2001) Human securin, hPTTG, is associated with Ku heterodimer, the regulatory subunit of the DNA-dependent protein kinase. Nucl. Acids Res. 29, 1300‒1307.
Hatcher R.J., Dong J., Liu S., Bian G., Contreras A., Wang T., Hilsenbeck S.G., Li Y., Zhang P. (2014) Pttg1/securin is required for the branching morphogenesis of the mammary gland and suppresses mammary tumorigenesis. Proc. Natl. Acad. Sci. USA. 111, 1008‒1013.
Bernal J.A., Luna R., Espina A., Lazaro I., Ramos-Morales F., Romero F., Arias C., Silva A., Tortolero M., Pintor-Toro J.A. (2002) Human securin interacts with p53 and modulates p53-mediated transcriptional activity and apoptosis. Nat. Genet. 32, 306‒311.
Cho-Rok J., Yoo J., Jang Y.J., Kim S., Chu I.S., Yeom Y.I., Choi J.Y., Im D.S. (2006) Adenovirus-mediated transfer of siRNA against PTTG1 inhibits liver cancer cell growth in vitro and in vivo. Hepatology. 43, 1042‒1052.
Ishitsuka Y., Kawachi Y., Taguchi S., Maruyama H., Fujisawa Y., Furuta J., Nakamura Y., Otsuka F. (2012) Pituitary tumor-transforming gene 1 enhances proliferation and suppresses early differentiation of keratinocytes. J. Investigat. Dermatol. 132, 1775‒1784.
Li W.H., Chang L., Xia Y.X., Wang L., Liu Y.Y., Wang Y.H., Jiang Z., Xiao J., Wang Z.R. (2015) Knockdown of PTTG1 inhibits the growth and invasion of lung adenocarcinoma cells through regulation of TGFB1/SMAD3 signaling. Int. J. Immunopathol. Pharmacol. 28, 45‒52.
Waizenegger I., Gimenez-Abian J.F., Wernic D., Peters J.M. (2002) Regulation of human separase by securin binding and autocleavage. Curr. Biol.: CB. 12, 1368‒1378.
Ly T., Ahmad Y., Shlien A., Soroka D., Mills A., Emanuele M.J., Stratton M.R., Lamond A.I. (2014) A proteomic chronology of gene expression through the cell cycle in human myeloid leukemia cells. eLife. 3, e01630.
Fang G., Yu H., Kirschner M.W. (1998) Direct binding of CDC20 protein family members activates the anaphase-promoting complex in mitosis and G1. Mol. Cell. 2, 163‒171.
Tong Y., Tan Y., Zhou C., Melmed S. (2007) Pituitary tumor transforming gene interacts with Sp1 to modulate G1/S cell phase transition. Oncogene. 26, 5596‒5605.
Wondergem B., Zhang Z., Huang D., Ong C.K., Koeman J., Hof D.V., Petillo D., Ooi A., Anema J., Lane B., Kahnoski R.J., Furge K.A., Teh B.T. (2012) Expression of the PTTG1 oncogene is associated with aggressive clear cell renal cell carcinoma. Cancer Res. 72, 4361‒4371.
Huang J.L., Cao S.W., Ou Q.S., Yang B., Zheng S.H., Tang J., Chen J., Hu Y.W., Zheng L., Wang Q. (2018) The long non-coding RNA PTTG3P promotes cell growth and metastasis via up-regulating PTTG1 and activating PI3K/AKT signaling in hepatocellular carcinoma. Mol. Cancer. 17, 93.
Guo X.C., Li L., Gao Z.H., Zhou H.W., Li J., Wang Q.Q. (2019) The long non-coding RNA PTTG3P promotes growth and metastasis of cervical cancer through PTTG1. Aging. 11, 1333‒1341.
Xiang W., Wu X., Huang C., Wang M., Zhao X., Luo G., Li Y., Jiang G., Xiao X., Zeng F. (2017) PTTG1 regulated by miR-146a-3p promotes bladder cancer migration, invasion, metastasis and growth. Oncotarget. 8, 664‒678.
Huang S., Liao Q., Li L., Xin D. (2014) PTTG1 inhibits SMAD3 in prostate cancer cells to promote their proliferation. Tumour Biol.: J. Internat. Soc. Oncodevelopmental Biol. Med. 35, 6265‒6270.
Zheng Y., Guo J., Zhou J., Lu J., Chen Q., Zhang C., Qing C., Koeffler H.P., Tong Y. (2015) FoxM1 transactivates PTTG1 and promotes colorectal cancer cell migration and invasion. BMC Med. Genomics. 8, 49.
Lin Y.H., Tian Y., Wang J.S., Jiang Y.G., Luo Y., Chen Y.T. (2015) Pituitary tumor-transforming gene 1 regulates invasion of prostate cancer cells through MMP13. Tumour Biol. : J. Internat. Soc. Oncodevelopmental Biol. Med. 37, 15495–15500.
Genkai N., Homma J., Sano M., Tanaka R., Yamanaka R. (2006). Increased expression of pituitary tumor-transforming gene (PTTG)-1 is correlated with poor prognosis in glioma patients. Oncol. Repts. 15, 1569‒1574.
Fujii T., Nomoto S., Koshikawa K., Yatabe Y., Teshigawara O., Mori T., Inoue S., Takeda S., Nakao A. (2006). Overexpression of pituitary tumor transforming gene 1 in HCC is associated with angiogenesis and poor prognosis. Hepatology. 43, 1267–1275.
Feng Z.Z., Chen J.W., Yang Z.R., Lu G.Z., Cai Z.G. (2012) Expression of PTTG1 and PTEN in endometrial carcinoma: correlation with tumorigenesis and progression. Med. Oncol. 29, 304‒310.
Demeure M.J., Coan K.E., Grant C.S., Komorowski R.A., Stephan E., Sinari S., Mount D., Bussey K.J. (2013) PTTG1 overexpression in adrenocortical cancer is associated with poor survival and represents a potential therapeutic target. Surgery. 154, 1405‒1416; discussion 1416.
Wei C., Yang X., Xi J., Wu W., Yang Z., Wang W., Tang Z., Ying Q., Zhang Y. (2015) High expression of pituitary tumor-transforming gene-1 predicts poor prognosis in clear cell renal cell carcinoma. Mol. Clin. Oncol. 3, 387‒391.
Xu M.D., Dong L., Qi P., Weng W.W., Shen X.H., Ni S.J., Huang D., Tan C., Sheng W.Q., Zhou X.Y., Du X. (2016) Pituitary tumor-transforming gene-1 serves as an independent prognostic biomarker for gastric cancer. Gastric Cancer: Official J. Internat. Gastric Cancer Assoc. Jpn Gastric Cancer Assoc. 19, 107‒115.
Демин Д.Э., Боголюбова А.В., Зленко Д.В., Уварова А.Н., Дейкин А.В., Путляева Л.В., Белоусов П.В., Митькин Н.А., Корнеев К.В., Свиряева Е.Н., Кулаковский И.В., Татосян К.А., Купраш Д.В., Шварц А.М. (2018) Новая короткая форма секурина стимулирует экспрессию циклина D3 и ангиогенных факторов VEGFA и FGF2, но не влияет на экспрессию транскрипционного фактора MYC. Молекуляр. биология. 52, 508‒518.
Bolger A.M., Lohse M., Usadel B. (2014) Trimmomatic: a flexible trimmer for Illumina sequence data. Bioinformatics. 30, 2114‒2120.
Dobin A., Davis C.A., Schlesinger F., Drenkow J., Zaleski C., Jha S., Batut P., Chaisson M., Gingeras T.R. (2013) STAR: ultrafast universal RNA-seq aligner. Bioinformatics. 29, 15‒21.
Liao Y., Smyth G.K., Shi W. (2014) Feature counts: an efficient general purpose program for assigning sequence reads to genomic features. Bioinformatics. 30, 923‒930.
Love M.I., Huber W., Anders S. (2014) Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biol. 15, 550.
Chu C.P., Hokamp J.A., Cianciolo R.E., Dabney A.R., Brinkmeyer-Langford C., Lees G.E., Nabity M.B. (2017) RNA-seq of serial kidney biopsies obtained during progression of chronic kidney disease from dogs with X-linked hereditary nephropathy. Sci. Repts. 7, 16776.
Tripathi S., Pohl M.O., Zhou Y., Rodriguez-Frandsen A., Wang G., Stein D.A., Moulton H.M., DeJesus P., Che J., Mulder L.C., Yanguez E., Andenmatten D., Pache L., Manicassamy B., Albrecht R.A., Gonzalez M.G., Nguyen Q., Brass A., Elledge S., White M., Shapira S., Hacohen N., Karlas A., Meyer T.F., Shales M., Gatorano A., Johnson J.R., Jang G., Johnson T., Verschueren E., Sanders D., Krogan N., Shaw M., Konig R., Stertz S., Garcia-Sastre A., Chanda S.K. (2015) Meta- and orthogonal integration of influenza “OMICs” data defines a role for UBR4 in virus budding. Cell Host Microbe. 18, 723‒735.
Thul P.J., Akesson L., Wiking M., Mahdessian D., Geladaki A., Blal H.A., Alm T., Asplund A., Bjork L., Breckels L.M., Backstrom A., Danielsson F., Fagerberg L., Fall J., Gatto L., Gnann C., Hober S., Hjelmare M., Johansson F., Lee S., Lindskog C., Mulder J., Mulvey C.M., Nilsson P., Oksvold P., Rockberg J., Schutten R., Schwenk J.M., Sivertsson A., Sjostedt E., Skogs M., Stadler C., Sullivan D.P., Tegel H., Winsnes C., Zhang C., Zwahlen M., Mardinoglu A., Ponten F., von Feilitzen K., Lilley K.S., Uhlen M., Lundberg E. (2017) A subcellular map of the human proteome. Science. 356.
Li X.Y., Mantovani R., Vanhuijsduijnen R.H., Andre I., Benoist C., Mathis D. (1992) evolutionary variation of the CCAAT-binding transcription factor Nf-Y. Nucl. Acids Res. 20, 1087‒1091.
Benatti P., Chiaramonte M.L., Lorenzo M., Hartley J.A., Hochhauser D., Gnesutta N., Mantovani R., Imbriano C., Dolfini D. (2016) NF-Y activates genes of metabolic pathways altered in cancer cells. Oncotarget. 7, 1633–1650.
Moeinvaziri F., Shahhoseini M. (2015) Epigenetic role of CCAAT box-binding transcription factor NF-Y on ID gene family in human embryonic carcinoma cells. IUBMB Life. 67, 880‒887.
Jiang X., Nevins J.R., Shats I., Chi J.T. (2015) E2F1-mediated induction of NFYB attenuates apoptosis via joint regulation of a pro-survival transcriptional program. PloS One. 10, e0127951.
Fang Z., Gong C., Yu S., Zhou W., Hassan W., Li H., Wang X., Hu Y., Gu K., Chen X., Hong B., Bao Y., Chen X., Zhang X., Liu H. (2018) NFYB-induced high expression of E2F1 contributes to oxaliplatin resistance in colorectal cancer via the enhancement of CHK1 signaling. Cancer Lett. 415, 58‒72.
Yevshin I., Sharipov R., Valeev T., Kel A., Kolpakov F. (2017) GTRD: a database of transcription factor binding sites identified by ChIP-seq experiments. Nucl. Acids Res. 45, D61‒D67.
Yevshin I., Sharipov R., Kolmykov S., Kondrakhin Y., Kolpakov F. (2019) GTRD: a database on gene transcription regulation-2019 update. Nucl. Acids Res. 47, D100‒D105.
Дополнительные материалы
- скачать ESC1.xlsx
- Supplementary table 1. Small interfering RNA to suppress PTTG1 isoforms
- скачать ESC2.xlsx
- Supplementary table 2. Gene expression normalized using DESeq2 algorithm
Инструменты
Молекулярная биология


