Молекулярная биология, 2020, T. 54, № 1, стр. 60-68
Влияние полиморфного варианта С1473G в гене триптофангидроксилазы 2 и длины фотопериода на дофаминовую систему мозга мышей
Н. А. Синякова a, *, Е. Ю. Баженова a, Е. А. Куликова a, Д. В. Фурсенко a, А. В. Куликов a
a Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: sinyakova1985@gmail.com
Поступила в редакцию 02.04.2019
После доработки 11.06.2019
Принята к публикации 12.06.2019
Аннотация
Снижение освещенности в осенний и зимний периоды вызывает у чувствительных пациентов депрессивно-подобные сезонные аффективные расстройства (САР), в механизме которых участвуют серотониновая (5-HT) и дофаминовая (DA) медиаторные системы головного мозга. Взаимодействие 5-HT- и DA-систем головного мозга изучено нами на экспериментальной модели САР ‒ половозрелых самцах мышей конгенных линий B6-1473C и B6-1473G с высокой и низкой активностью триптофангидроксилазы 2 – ключевого фермента синтеза 5-HT в мозге. Мышей каждой линии, разбитых на две группы по восемь особей, содержали в течение 30 дней при стандартном (14 ч свет/10 ч темнота) и коротком (4 ч свет/20 ч темнота) световом дне. Наличие варианта C1473G в гене триптофангидроксилазы 2 не влияло на экспрессию ключевых генов DA-системы: Drd1, Drd2, Scl6a3, Th, Comt, кодирующих рецепторы D1 и D2, транспортер дофамина, тирозингидроксилазу и катехол-о-метилтрансферазу. У мышей B6-1473G выявлено снижение уровня DA в среднем мозге, а также его метаболита, 3,4-дигидроксифенилуксусной кислоты (DOPAC), в стриатуме. Содержание мышей при коротком световом дне не влияло на экспрессию генов Drd1 во всех структурах мозга, Slc6a3 и Th ‒ в среднем мозге. Экспрессия Drd2 увеличилась в среднем мозге и снизилась в гиппокампе, где повысилась экспрессия Comt. Выявлено увеличение уровня DA в среднем мозге и DOPAC в стриатуме мышей, содержащихся при коротком световом дне. Это свидетельствует об участии DA-системы головного мозга в реакции на снижение продолжительности светового дня. Статистически значимого влияния взаимодействия между наличием варианта C1473G и длиной светового дня на показатели актвности DA-системы не выявлено. Оснований для утверждения, что этот полиморфизм определяет наблюдаемую реакцию DA-системы мозга на содержание животных при коротком световом дне, не найдено.
ВВЕДЕНИЕ
Сезонное аффективное расстройство (САР) – это комплекс биологических и поведенческих нарушений, стабильно наблюдающихся у 1.5‒9% индивидов в осенний и зимний периоды. САР характеризуется пониженным настроением различной степени тяжести, апатией, трудностями с концентрацией, увеличением продолжительности сна, а также с перееданием [1‒4].
Получены доказательства участия медиатора мозга дофамина (DA) и серотонина (5-HT) в механизме САР [2, 5‒9]. Мутации в генах, кодирующих рецепторы 5-HT2A [10‒13] и D4 [14, 15], рассматриваются как факторы риска развития этого расстройства. Однако взаимодействие DA- и 5-HT-систем в механизме САР изучено недостаточно.
Удобной моделью для изучения взаимодействия 5-HT- и DA-систем служат мыши конгенных линий B6-1473C и B6-1473G. Эти линии, полученные в ИЦиГ СО РАН [16, 17], содержат разные полиморфные варианты C1473G в гене Tph2 [18, 19], кодирующем триптофангидроксилазу 2 (ТПГ-2) ‒ ключевой фермент синтеза 5-HT в головном мозге [20]. У мышей B6-1473G (несущих аллель G) активность ТПГ-2 и уровень метаболизма 5-HT в гиппокампе и среднем мозге ниже, чем у мышей B6-1473C (несущих аллель С) [21]. При этом влияние полиморфизма C1473G на DA-систему мозга еще не изучено.
Показано, что длительное (1 мес) содержание мышей линии C57BL/6 при коротком световом дне (4‒8 ч) приводит к возникновению депрессивно-подобного поведения [19, 22‒24]. Более того, при этом снижается уровень 5-HT в миндалине и DA в гипоталамусе [22, 23] и увеличивается уровень основного продукта разрушения 5-HT ‒ 5-гидроксииндолуксусной кислоты (5-HIAA) в гиппокампе и среднем мозге [21].
Цель данной работы состояла в изучении влияния длины светового дня (фотопериода) на DA-систему головного мозга мышей, несущих разные варианты полиморфизма C1473G гена Tph2. Определены концентрации DA и его основных метаболитов (3,4-дигидроксифенилуксусной (DOPAC) и гомованилиновой (HVA) кислот), а также уровни мРНК ключевых генов DA-системы: Drd1, Drd2, Slc6a3, Th, Comt, кодирующих D1- и D2-рецепторы, транспортер DA, ферменты синтеза (тирозингидроксилаза) и деградации (катехол-о-метилтрансфераза) DA в головном мозге мышей B6-1473C и B6-1473G, содержавшихся в условиях стандартного и короткого светового дня.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Животные и воздействия. Опыты проводили на половозрелых самцах мышей (возраст 11 недель, вес 26 ± 1 г) B6-1473C (n = 16) и B6-1473G (n = 16), имеющих статус SPF (specific pathogen free), на протяжении всего эксперимента. Создание линий описано ранее [17].
Мышей содержали по четыре особи в индивидуально вентилируемых клетках (Optimice, “Animal Care Systems, Inc.”, США) в течение 28 дней при температуре 24°С, влажности 45‒50% либо при стандартном для вивария фотопериоде (14 ч свет, 10 ч темнота, 14С/10Т), либо при коротком дне (4 ч свет, 20 ч темнота, 04С/20Т). Стерильный корм и воду животные получали без ограничения. Животные были разделены на четыре экспериментальные группы по восемь животных в каждой (B6-1473C 14С/10Т, B6-1473C 04С/20Т, B6-1473G 14С/10Т, B6-1473G 04С/20Т). Затем животных рассаживали по одному и содержали с сохранением описанных условий в течение 2 дней, чтобы исключить влияние группового эффекта. Животных усыпляли CO2 (1‒2 мин), декапитировали, извлекали головной мозг, выделяли гиппокамп, стриатум и средний мозг, замораживали их в жидком азоте и хранили при –80°С.
Гомогенизирование отделов мозга для молекулярных исследований. Отделы мозга гомогенизировали в пробирке Eppendorf (1.5 мл) с помощью гомогенизатора Z359971 (“Sigma-Aldrich”, США) с тефлоновым пестиком в 250 мкл (стриатум) или 300 мкл (гиппокамп и средний мозг) буфера, содержащего 50 мМ Трис-HCl, pH 7.6 (4°С).
Выделение РНК и ОТ-ПЦР. Аликвоту 60 мкл гомогената смешивали с 300 мкл Trizol (“Bio Rad”, США) и выделяли суммарную РНК согласно протоколу производителя. Осадок растворяли в 20 мкл обработанной DEPC воды. Примеси геномной ДНК удаляли с помощью ДНКазы (“Promega”, США) согласно протоколу производителя. Затем с помощью спектрофотометра Nanodrop (“Thermo Fisher”, США) измеряли оптическую плотность и разводили РНК водой, обработанной DEPC, до концентрации 0.125 мкг/мкл. Готовую РНК хранили при –80°С.
кДНК синтезировали c 1 мкг (8 мкл) РНК с помощью набора R01-250 (“Биолабмикс”, Новосибирск) со случайным гексапраймером согласно протоколу производителя. Синтезированную кДНК хранили при –20°С.
Концентрацию мРНК определяли с помощью количественной ОТ-ПЦР в реальном времени (CFX96, “Bio-Rad”, США), используя стандартный набор реактивов R-402 (“Синтол”, Москва) с красителем SYBR Green I в качестве флуорофора, а также специфические праймеры (табл. 1). В качестве внешних стандартов использовали набор различных концентраций геномной ДНК мыши (линия C57BL/6J) от 0.25 до 64 нг (50‒12800 копий), а в качестве внутреннего стандарта – уровень мРНК гена домашнего хозяйства РНК-полимеразы II (Polr2a). Экспрессию генов нормировали на 100 копий Polr2a [25].
Таблица 1.
Нуклеотидные последовательности праймеров, температура отжига и размер ампликонов
| Ген | Прямой праймер | Обратный праймер | Длина проду-кта, п.н. | Т отжига, °С |
|---|---|---|---|---|
| Comt | F5′-GACTTCCTGGCGTATGTGAG-3′ | R5′-AGAGTGAGTGTGTGTCATCG-3′ | 199 | 60 |
| Drd1 | F5′-GGAAACCCTGTCGAATGCTCTC-3′ | R5′-CCAGCCAAACCACACAAATACATCG-3′ | 222 | 64 |
| Drd2 | F5′-TCCGCCACTTCTTGACATACATTG-3′ | R5′-CCCATCCACAGCCTCCTCTAAG-3′ | 203 | 65 |
| Polr2a | 5′-TGTGACAACTCCATACAATGC-3′ | 5′-CTCTCTTAGTGAATTTGCGTACT-3′ | 194 | 61 |
| Slc6a3 | F5′-TTCACTGTCATCCTCATCTCTTTC | R5′-TCAAAATACTCAGCAGCGGGTG | 224 | 63 |
| Th | F5′-CCGTACACCCTGGCCATTGATG-3′ | R5′-ATGAAGGCCAGGAGGAATGCAGG-3′ | 320 | 64 |
Определение уровня DA, DOPAC, HVA. Для осаждения белка и экстракции DA, DOPAC и HVA 50 мкл гомогената смешивали с 150 мкл 0.6 М HClO4 и центрифугировали в течение 15 мин при 14 000 g (4°С). Супернатант разбавляли вдвое стерильной водой, чтобы снизить концентрацию HClO4 до 0.3 М, а осадок сохраняли для определения уровня белка. Уровни DA, DOPAC и HVA в супернатанте определяли с помощью высокоэффективной жидкостной хроматографии на приборе фирмы “Shimadzu Corp.” (США), включающем контролер CBM-20A, насос LC-20AD, проточный дегазатор DGU-20A5R, устройство автоматической подачи проб SIL-20A, электрохимический детектор (DECADE II™ Electrochemical Detector; “Antec”, Нидерланды) со стеклоуглеродной ячейкой (VT-03 ячейка 3 мм GC sb; “Antec”) при потенциале окисления +0.7 В. Колонка Luna С18(2) (размер частиц 5 мкм, L × I.D. 75 × 4.6 мм, “Penomenex”, США) содержала неподвижную фазу, тогда как подвижная фаза включала 6.53 г KH2PO4, 100 мкл 0.5 M Na2EDTA, 150 мг 1-октансульфоната натрия (“Sigma”) и метанол (13% объема; “Fisher Scientific”), pH 3.2 в 1 л. Площадь пика оценивали с помощью программы LabSolution LG/GC, версия 5.54 (“Shimadzu Corp”.). Калибровочную кривую для исследуемых соединений строили по стандартам 1, 2 и 3 нг [21]. Содержание биогенных аминов выражали в нг/мг общего белка, измеренного по Брэдфорду.
Определение концентрации белка по Брэдфорду. Осадок белка после обработки HClO4 растворяли в 1 мл 0.1 М NaOH, аликвоту 5 мкл добавляли к 150 мкл красителя (#500‒0006, “Bio-Rad”), разбавленного стерильной водой в 5 раз. Оптическую плотность измеряли при 595 нм на планшетном спектрофотометре Multiscan GO (“Thermo Fisher Instruments”, США). Количество белка в осадке оценивали по калибровочным стандартам, поставляемым вместе с красителем (“Bio-Rad”).
Статистика. Результаты представляли как среднее ± ошибка среднего и анализировали с помощью двухфакторного дисперсионного анализа ANOVA (факторы “генотип” и “фотопериод”). Сравнение групп проводили с помощью post hoc-анализа по Фишеру. Уровень значимости равен 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние длины фотопериода на уровень мРНК генов Drd1, Drd2 и Comt в гиппокампе, стриатуме и среднем мозге мышей B6-1473C и B6-1473G
Содержание при коротком световом дне увеличивало уровень мРНК Drd2 в среднем мозге мышей обеих линий (F128 = 13.99, p < 0.001). Уровень мРНК Drd2 снижался в гиппокампе мышей B6-1473C (F1.26 = 10.22, p < 0.05), а уровень мРНК Comt в гиппокампе мышей B6-1473G возрастал (F1.26 = 10.39, p < 0.01) (рис. 1). Не обнаружено влияния фактора “фотопериод” на уровень мРНК Drd1 (гиппокамп, F1.28 < 1; средний мозг, F1.28 < 1; стриатум, F1.28 = 2.88, p > 0.05) во всех исследованных структурах, а также на уровни мРНК Drd2 в стриатуме (F1.26 < 1) и Comt в стриатуме (F1.26 < 1) и среднем мозге (F1.26 < 1).
Рис. 1.
Уровень мРНК генов Drd1, Drd2 и Comt в гиппокампе, среднем мозге и стриатуме мышей B6-1473C (1, 2) и B6-1473G (3, 4), которых содержали течение 30 дней при нормальном (14 ч свет : 10 ч темнота) и коротком (4 ч свет : 20 ч темнота) световом дне соответственно. Уровень каждого гена представлен в виде числа копий нормированного на 100 копий Polr2a. *p < 0.05, **p < 0.01. Условные обозначения: 1 – B6-1473C 14С/10Т, 2 – B6-1473C 04С/20Т, 3 – B6-1473G 14С/10Т, 4 – B6-1473G 04С/20Т.
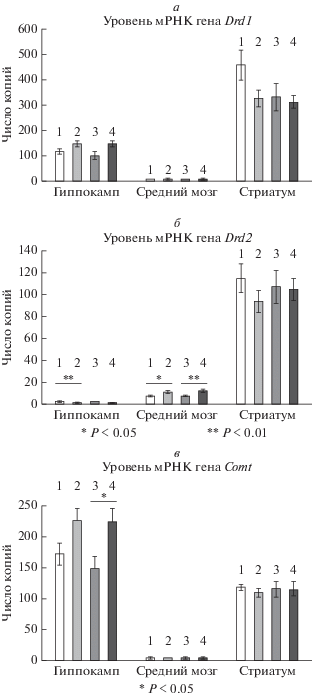
Не выявлено влияния фактора “генотип” на уровень мРНК Drd1 (гиппокамп, F1.28 = 1.72, p > > 0.05; средний мозг, F1.28 < 1; стриатум, F1.28 = 2.42, p > 0.05), Drd2 (для всех структур, F1.26 < 1) и Comt (для всех структур, F1.26 < 1) в гиппокампе, среднем мозге и стриатуме.
Более того, не обнаружено эффекта взаимодействия факторов “генотип” × “фотопериод” на уровень мРНК Drd1 (гиппокамп, F1,28 = 1.77, p > 0.05; среднего мозга, F1.28 < 1; стриатума F1.28 = 1.62, p > > 0.05), Drd2 (для всех структур, F1,26 < 1) и Comt (для всех структур, F1,26 < 1) в гиппокампе, среднем мозге и стриатуме.
Влияние фотопериода на уровень мРНК генов Slc6a3 и Th в среднем мозге мышей B6-1473C и B6-1473G
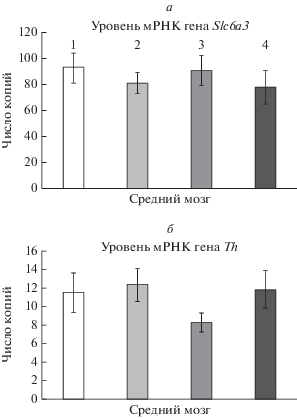
Тела всех DA нейронов расположены в среднем мозге, и только в этой структуре концентрации транскриптов генов Slc6a3 и Th были достаточными для надежного их определения.
Мы не обнаружили влияния факторов “генотип” (Slc6a3, F1.28 < 1; Th, F1.28 < 1), “фотопериод” (Slc6a3, F1.28 = 1.19, p > 0.05; Th, F1.28 = 1.51, p > 0.05), а также взаимодействия этих факторов (Slc6a3, F1.28 < 1; Th, F1.28 < 1) на уровень мРНК генов Slc6a3 и Th в среднем мозге (рис. 2).
Рис. 2.
Уровень мРНК генов Slc6a3 (а) и Th (б) в среднем мозге мышей B6-1473C (1, 2) и B6-1473G (3, 4), которых в течение 30 дней содержали при нормальном (14 ч свет : 10 ч темнота) и коротком (4 ч свет : 20 ч темнота) световом дне соответственно. Уровень каждого гена представлен в виде числа копий нормированного на 100 копий Polr2a. Условные обозначения: 1 ‒ В6-1473С 14С/10Т, 2 ‒ В6-1473С 04С/20Т, 3 ‒ В6-1473G 14С/10Т, 4 ‒ В6-1473G 04С/20Т.
Влияние фотопериода на уровень DA, DOPAC и HVA в среднем мозге и стриатуме мышей B6-1473C и B6-1473G
Поскольку концентрации DA, DOPAC и HVA в гиппокампе ниже порога чувствительности метода, мы определяли эти показатели только в среднем мозге и стриатуме. Следует указать, что синапсы дофаминергических рецепторов черной субстанции располагаются в стриатуме, где происходит активная трансмиссия DA, поэтому для этой структуры характерны наиболее высокие концентрации DA, DOPAC и HVA.
Обнаружено влияние варианта в гене Tph2 на уровень DA (F1.28 = 6.15, p < 0.05) в среднем мозге. У мышей линии B6-1473G уровень DA в этой структуре снижен по сравнению с линией B6-1473С (рис. 3). Более того, у мышей с генотипом B6-1473G уровень DA повышался при содержании при коротком световом дне (F1.28 = 9.29, p < 0.01) (рис. 3). Однако не обнаружено влияния ни генотипа (F1.28 < 1), ни содержания в условиях короткого светового дня на уровень DA в стриатуме (F1.28 = 3.803, p > 0.05). Не выявлено также влияния взаимодействия факторов “генотип” и “фотопериод” на уровень DA в исследованных структурах (F1.28 < 1).
Рис. 3.
Концентрация дофамина (DA), 3,4-дигидроксифенилуксусной кислоты (DOPAC) и гомованилиновой кислоты (HVA) в среднем мозге и стриатуме мышей B6-1473C (1, 2) и B6-1473G (3, 4), которых в течение 30 дней содержали при нормальном (14 ч свет : 10 ч темнота) и коротком (4 ч свет : 20 ч темнота) световом дне соответственно.*p < 0.05, **p < 0.01, ***p < < 0.001. 1 – B6-1473C 14С/10Т, 2 – B6-1473C 04С/20Т, 3 – B6-1473G 14С/10Т, 4 – B6-1473G 04С/20Т.
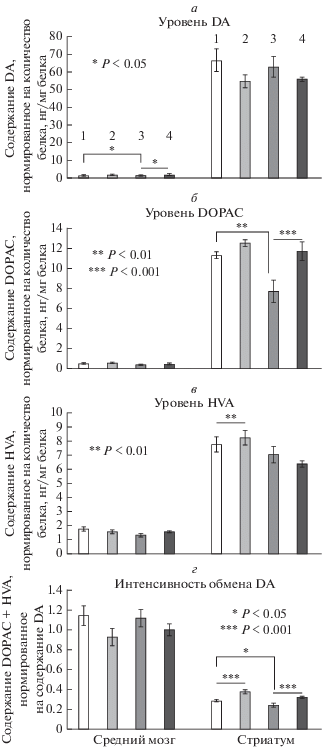
В условиях короткого светового дня уровень DOPAC в стриатуме мышей B6-1473G был ниже, чем у мышей B6-1473С (F1.28 = 8.74, p < 0.01) (рис. 3). В условиях нормального светового дня у мышей с данной нуклеотидной заменой в отличие от мышей B6-1473С наблюдалась тенденция к снижению уровня DOPAC (рис. 3). Более того, увеличение уровня DOPAC обнаружено в стриатуме мышей обеих линий, содержащихся при коротком световом дне (F1.28 = 11.9, p < 0.01), тогда как ни полиморфизм С1473G гена Tph2 (F1.28 = 1.25, p > 0.05), ни изменение светового дня не повлияли на уровень DOPAC (F1.28 = 2.54, p > 0.05) в среднем мозге. Нами также не выявлено статистически значимого эффекта взаимодействия факторов “генотип” × × “фотопериод” ни в одной из исследованных структур мозга (средний мозг, F1.28< 1; стриатум, F1.28= 3.33, p> 0.05) (рис. 3б).
Уровень HVA в стриатуме мышей линии B6-1473G был ниже, чем у мышей B6-1473С (F1.28 = 7.67, p < 0.01), а эффект фактора “генотип” в среднем мозге (F1.28 = 3.18, p > 0.05) отсутствовал (рис. 3). Не обнаружено также влияния фактора “фотопериод” (F1.28 < 1) и взаимодействия факторов “генотип” × “фотопериод” на уровень HVA ни в среднем мозге (F1.28 = 3.706, p > 0.05), ни в стриатуме (F1.28 = 1.45, p > 0.05).
Интенсивность обмена DA оценивали по соотношению суммы концентраций метаболитов и уровня DA ((DOPAC + HVA)/DA). Не выявлено различий в интенсивности обмена DA в среднем мозге мышей обеих линий (фактор “генотип” F1.28 < < 1), однако в стриатуме обмен DA у мышей с генотипом B6-1473G был cнижен по сравнению с мышами B6-1473С (фактор “генотип” F1.28= 12.62, p < 0.05). Нами также обнаружено влияние фактора “фотопериод” на отношение [(DOPAC + + HVA)/DA] в среднем мозге (F1.28 = 3.96, p = 0.056) и стриатуме (F1.28 = 34.803, p < 0.01) у мышей обеих линий. Так, содержание мышей при коротком световом дне уменьшало этот показатель в среднем мозге и увеличивало в стриатуме (рис. 3г). Не обнаружено влияния взаимодействия факторов “генотип” × “фотопериод” ни в одной из исследуемых структур (F1.28 < 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Фермент ТПГ-2 катализирует гидроксилирование L-триптофана до L-5-гидрокситриптофана ‒ первую и ключевую стадию синтеза 5-HT в мозге млекопитающих [20]. Нокаут генa, кодирующего ТПГ-2 (Tph2), снижает концентрацию 5-HT в мозге мыши на 96% [26, 27]. Полиморфизм C1473G в экзоне 11 гена mTph2 мыши приводит к замене P447R в молекуле ТПГ-2 [18], что снижает активность фермента в 2 раза как in vivo, так и in vitro [18, 19]. Мыши конгенной линии B6-1473G, характеризующиеся низкой активностью ТПГ-2 в мозге, получены переносом аллеля G от линии CC57BR в геном C57BL/6 с помощью 11 последовательных скрещиваний [17]. У мышей линии B6-1473G метаболизм 5-HT и уровень мРНК рецептора 5-HT2A в гиппокампе ниже, чем у животных B6-1473C, несущих аллель С полиморфизма C1473G [21].
Роль DA-системы в возникновении депрессивно-подобных состояний в условиях социального стресса у мышей [28‒30] и крыс [31] была показана ранее на крысах с генетической предрасположенностью к депрессивно-подобному поведению [32], а также при индуцированном цитокинами депрессивно-подобном “поведении больного” [33]. В настоящее время исследуется роль DA-системы в САР. Так, показано увеличение уровня DA у дневных грызунов под влиянием короткого светового дня ‒ бурундуков [23] и суданской травяной крысы [34]. Кроме того, у другого дневного грызуна ‒ нилотской травяной мыши, выявлено увеличение уровня мРНК Drd1 [35]. Работы, проведенные на ночных грызунах, малочисленны и показывают, напротив, уменьшение уровня DA под влиянием короткого фотопериода [23, 36].
Существенный интерес вызывает взаимодействие медиаторных систем, в частности 5-НТ и DA, в этиологии САР. Цель нашей работы состояла в проверке гипотезы о возможном влиянии полиморфного варианта С1473G в гене Tрh2 на реакцию DA-системы мозга на изменение длины светового дня. Нами оценена величина статистического взаимодействия факторов “генотип” (полиморфный вариант С1473G) и “фотопериод” (длина светового дня) на уровни мРНК генов основных DA-рецепторов, ферментов синтеза и катаболизма DA, транспортера этого медиатора, а также на уровни DA и его метаболитов в головном мозге мышей. Однако влияние статистического взаимодействия этих факторов на данные показатели DA-системы не было обнаружено. Таким образом, полиморфизм C1473G в гене Tph2, по-видимому, не влияет на чувствительность DA-системы к изменению фотопериода.
Тем не менее, нами впервые выявлено влияние полиморфизма C1473G в гене Tph2 на метаболизм DA в мозге мышей. Замена аллеля C полиморфизма C1473G на G приводит к подавлению активности ТПГ-2 в мозге, а также к снижению уровня DA в среднем мозге, уровней DOPAC, HVA и интенсивности метаболизма DA, оцененного по соотношению (DOPAC+HVA)/DA, в стриатуме. При этом полиморфизм не повлиял на экспрессию ключевых генов DA-системы ‒ Drd1, Drd2, Comt, Slc6a3 и Th в мозге мышей.
Интересным оказалось снижение уровня DA в среднем мозге. Действительно, как показано ранее, нарушение работы TPH-2 может приводить к изменению уровней тирозина и DA. Так показано, что у гетерозиготных мышей и мышей с полным нокаутом гена Tph2 уровень DA в гиппокампе снижен по сравнению с контрольными животными [37]. Кроме того, как индуцированное парахлорфенилаланином снижение активности ТПГ-2, так и генетический нокаут гена этого фермента приводит к снижению уровня тирозина – предшественника DA [38]. Не существует конкретных механизмов, объясняющих это влияние, однако можно предположить, что метаболиты НТ могут участвовать в регуляции синтеза DA. Эти данные соответствуют результатам, полученным нами в среднем мозге мышей с полиморфизмом C1473G Tph2.
Однако мы показали, что экспозиция мышей в течение почти 30 дней при коротком (04С/20Т) световом дне влияет на DA-систему среднего мозга и стриатума. Содержание при коротком световом дне статистически значимо увеличивало концентрацию DA в среднем мозге, тогда как в стриатуме наблюдалась тенденция к снижению. Содержание при коротком дне не влияло на уровень метаболита DA ‒ DOPAC, в среднем мозге, но привело к увеличению его концентрации в стриатуме. Таким образом, мы наблюдаем разнонаправленные изменения метаболизма DA в этих структурах: снижение в среднем мозге и увеличение в стриатуме. Однако изменение продолжительности светового дня не повлияло на уровень другого метаболита DA ‒ HVA, в данных структурах, за исключением увеличения в стриатуме мышей B6-1473C.
Различия в реакции DA-системы на содержание мышей при коротком фотопериоде гипотетически можно объяснить тем, что стриатум содержит огромное количество окончаний DA нейронов, тела которых расположены в substantia nigra среднего мозга. При коротком световом дне активируется окислительное дезаминирование DA в стриатуме, о чем свидетельствует увеличение концентрации DOPAC. Усиленный расход DA в стриатуме отчасти компенсируется его усиленным синтезом в среднем мозге, что обуславливает увеличение уровня DA в этой структуре.
Изменений в уровне DOPAC в стриатуме мышей, находившихся в условиях короткого фотопериода, ранее не наблюдали [23]. Однако показано, что содержание дневных грызунов ‒ бурундуков [23] и суданской травяной крысы [34], при коротком световом дне приводит к увеличению уровня DOPAC и интенсивности метаболизма DA в стриатуме. Это различие реакции DA-системы стриатума у мышей, бурундуков и травяных крыс интерпретировалось как связанное с ночным (мыши) или дневным (бурундуки и травяные крысы) образом жизни [23]. Более того, ночной образ жизни мышей является весомым аргументом против использования этих животных в качестве модели САР [39, 40]. Нами показано, что содержание мышей при коротком световом дне усиливает метаболизм DA в стриатуме, что согласуется с данными, полученными на дневных грызунах. Таким образом, полученные данные указывают на существование общих механизмов, контролирующих сезонную динамику DA-системы у ночных и дневных грызунов. Поэтому мышей можно считать адекватной моделью для изучения САР.
Изменение длины светового дня не повлияло на экспрессию генов Th, Slc6a3 в среднем мозге и Drd1 во всех исследованных структурах. Экспозиция при коротком световом дне приводила к увеличению уровня мРНК Comt в гиппокампе. Впервые установлено, что в условиях короткого дня экспрессия гена Drd2 увеличивалась в среднем мозге, но снижалась в гиппокампе. Отмечена также тенденция к снижению уровня мРНК гена Drd2 в стриатуме.
Изменения в экспрессии гена Drd2 свидетельствуют о возможном участии этого рецептора в механизме САР. Пресинаптические D2-рецепторы в среднем мозге регулируют секрецию DA из синаптических окончаний по механизму отрицательной обратной связи [41]. Таким образом, увеличение экспрессии Drd2 в среднем мозге при коротком световом дне логически согласуется с повышением уровня DA. Так, увеличение экспрессии этих рецепторов может привести к большей их плотности в DA-нейронах и по механизму отрицательной обратной связи снизить секрецию медиатора, что вызовет повышение уровня DA в этой структуре.
Ранее с помощью позитронной эмиссионной томографии обнаружили снижение плотности рецепторов D2/3 в головном мозге добровольцев при сниженной освещенности [42]. Более того, отмечена роль полиморфизма в гене D4-рецептора (близкого к D2-рецептору по роли в организме) в проявлении САР у женщин [14, 15].
Нами впервые обнаружено влияние полиморфизма C1473G в гене Tph2 на уровень DA и DOPAC в среднем мозге и стриатуме. Однако не выявлено статистически значимого влияния взаимодействия между факторами “генотип” (полиморфизм C1473G Tph2) и “фотопериод” (длина светового дня) на изменчивость показателей DA-системы.
Таким образом, нет основания утверждать, что полиморфизм C1473G гена Tph2 определяет реакцию DA-системы мозга на содержание животных при коротком световом дне.
Работа поддержана грантом Российского фонда фундаментальных исследований (№ 17-04-00266). Разведение и содержание животных поддержано проектами № 0259-2019-0002 и № RFMEFI62117X0015.
Содержание животных и использованные экспериментальные процедуры соответствовали правилам Совета Европейского Парламента (Директива 2010/63/EU от 22 сентября 2010 г) и были одобрены Комиссией по биоэтике ИЦиГ СО РАН (Протокол № 16-01-007).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Rosenthal E., Sack D.A., Gillin J.C., Lewy A.J., Goodwin F.K., Davenport Y., Mueller P.S., Newsome D.A., Wehr T.A. (1984) Seasonal affective disorder. A description of the syndrome and preliminary findings with light therapy. Arch. Gen. Psychiatry. 41, 72‒80.
Levitan R.D. (2007) The chronobiology and neurobiology of winter seasonal affective disorder. Dialogues Clin. Neurosci. 9, 315–324.
Melrose S. (2015) Seasonal affective disorder: An overview of assessment and treatment approaches. Depress. Res. Treat. 2015, 178564.
Wirz-Justice A. (2018) Seasonality in affective disorders. Gen. Comp. Endocrinol. 258, 244‒249.
Lam R.W., Levitan R.D. (2000) Pathophysiology of seasonal affective disorder: a review. J. Psychiatry Neurosci. 25, 469‒480.
Neumeister A., Konstantinidis A., Praschak-Rieder N., Willeit M., Hilger E., Stastny J., Kasper S. (2001) Monoaminergic function in the pathogenesis of seasonal affective disorder. Int. J. Neuropsychopharmacol. 4, 409‒420.
Cawley E.I., Park S., aan het Rot M., Sancton K., Benkelfat C., Young S.N., Boivin D.B., Leyton M. (2013) Dopamine and light: dissecting effects on mood and motivational states in women with subsyndromal seasonal affective disorder. J. Psychiatry Neurosci. 38, 388‒397.
Gupta A., Sharma P.K., Garg V.K., Singh A.K., Mondal S.C. (2013) Role of serotonin in seasonal affective disorder. Eur. Rev. Med. Pharmacol. Sci. 17, 49–55.
Kulikov A.V., Popova N.K. (2015) Tryptophan hydro-xylase 2 in seasonal affective disorder: Underestimated perspectives? Rev. Neurosci. 26, 679–690.
Enoch M.A., Goldman D., Barnett R., Sher L., Mazzanti C.M., Rosenthal N.E. (1999) Association between seasonal affective disorder and the 5-HT2A promoter polymorphism, –1438G/A. Mol. Psychiatry. 4, 89–92.
Arias B., Gutiérrez B., Pintor L., Gastó C., Fañanás L. (2001). Variability in the 5-HT(2A) receptor gene is associated with seasonal pattern in major depression. Mol. Psychiatry. 6, 239–242.
Lee H.J., Sung S.M., Lim S.W., Paik J.W., Kim Leen. (2006) Seasonality associated with the serotonin 2A receptor -1438 A/G polymorphism. J. Affect. Disord. 95, 145–148.
Molnar E., Lazary J., Benko A., Gonda X., Pap D., Mekli K., Juhasz G., Kovacs G., Kurimay T., Rihmer Z., Bagdy G. (2010) Seasonality and winter-type seasonal depression are associated with the rs731779 polymorphism of the serotonin-2A receptor gene. Eur. Neuropsychopharmacol. 20, 655–662.
Levitan R.D., Masellis M., Basile V.S., Lam R.W., Kaplan A.S., Davis C., Muglia P., Mackenzie B., Tharmalingam S., Kennedy S.H., Macciardi F., Kennedy J.L. (2004a) The dopamine-4 receptor gene associated with binge eating and weight gain in women with seasonal affective disorder: an evolutionary perspective. Biol. Psychiatry. 56, 665‒669.
Levitan R.D., Masellis M., Lam R.W., Muglia P., Basile V.S., Jain U., Kaplan A.S., Tharmalingam S., Kennedy S.H., Kennedy J.L. (2004b) Childhood inattention and dysphoria and adult obesity associated with the dopamine D4 receptor gene in overeating women with seasonal affective disorder. Neuropsychopharmacol. 29, 179‒186.
Osipova D.V., Kulikov A.V., Popova N.K. (2009) C1473G polymorphism in mouse Tph2 gene is linked to tryptophan hydroxylase-2 activity in the brain, intermale aggression, and depressive-like behavior in the forced swim test. J. Neurosci. Res. 87, 1168–1174.
Bazovkina D.V., Lichman D.V., Kulikov A.V. (2015) The C1473G polymorphism in the tryptophan hydroxylase-2 gene: Involvement in ethanol-related behavior in mice. Neurosci. Lett. 589, 79–82.
Zhang X., Beaulieu J.M., Sotnikova T.D., Gainetdinov R.R., Caron M.G. (2004). Tryptophan hydroxylase-2 controls brain synthesis. Science. 305, 217.
Kulikov A.V., Osipova D.V., Naumenko V.S., Popova N.K. (2005). Association between Tph2 gene polymorphism, brain tryptophan hydroxylase activity and aggressiveness in mouse strains. Genes Brain Behav., 4, 482–485.
Walther D.J., Peter J.U., Bashammakh S., Hörtnagl H., Voits M., Fink H., Bader M. (2003) Synthesis of serotonin by a second tryptophan hydroxylase isoform. Science. 299, 76.
Bazhenova E.Y., Fursenko D.V., Kulikova E.A., Khotskin N.V., Sinyakova N.A., Kulikov A.A. (2019) Effect of photoperiodic alterations on depression-like behavior and the brain serotonin system in mice genetically different in tryptophan hydroxylase 2 activity. Neurosci. Lett. 699, 91‒96.
Otsuka T., Kawai M., Togo Y., Goda R., Kawase T., Matsuo H., Iwamoto A., Nagasawa M., Furuse M., Yasuo S. (2014) Photoperiodic responses of depression-like behavior, the brain serotonergic system, and peripheral metabolism in laboratory mice. Psychoneuroendocrinol. 40, 37–47.
Goda R., Otsuka T., Iwamoto A., Kawai M., Shibata S., Furuse M., Yasuo S. (2015) Serotonin levels in the dorsal raphe nuclei of both chipmunks and mice are enhanced by long photoperiod, but brain dopamine level response to photoperiod is species-specific. Neurosci. Lett. 593, 95‒100.
Хоцкин Н.В., Баженова Е.Ю., Куликова Е.А., Сорокин И.Е., Куликов А.В. (2019) Влияние C1473G полиморфизма в гене триптофангидроксилазы 2 и длины светового дня на поведение мышей. Журн. Высшей Нервной Деят. им. И.П. Павлова. 69, 85‒94.
Popova N.K., Kulikov A.V., Kondaurova E.M., Tsybko A.S., Kulikova E.A., Krasnov I.B., Shenkman B.S., Bazhenova E.Y., Sinyakova N.A., Naumenko V.S. (2015) Risk neurogenes for long-term spaceflight: Dopamine and serotonin brain system. Mol. Neurobiol. 51, 1443–1451.
Savelieva K.V., Zhao S., Pogorelov V.M., Rajan I., Yang Q., Cullinan E., Lanthorn T.H. (2008) Genetic disruption of both tryptophan hydroxylase genes dramatically reduces serotonin and affects behavior in models sensitive to antidepressants. PLoS One. 3, 10.
Alenina N., Kikic D., Todiras M., Mosienko V., Qadri F., Plehm R., Boyé P., Vilianovitch L., Sohr R., Tenner K., Hörtnagl H., Bader M. (2009) Growth retardation and altered autonomic control in mice lacking brain serotonin. Proc. Natl. Acad. Sci. USA. 106, 10332‒10337.
Коваленко И.Л., Смагин Д.А., Галямина А.Г., Орлов Ю.Л., Кудрявцева Н.Н. (2016) Изменение экспрессии дофаминергических генов в структурах мозга самцов мышей под влиянием хронического социального стресса: данные RNA-seq. Молекуляр. биология. 50, 184‒187.
Кудрявцева Н.Н., Смагин Д.А., Коваленко И.Л., Галямина А.Г., Вишнивецкая Г.Б., Бабенко В.Н., Орлов Ю.Л. (2017) Серотонинергические гены в развитии тревожно/депрессивного расстройства и патологии агрессивного поведения у самцов мышей: данные RNA-seq. Молекуляр. биология. 51, 288‒300.
Галямина А.Г., Коваленко И.Л., Смагин Д.А., Кудрявцева Н.Н. (2017) Изменение экспрессии генов нейромедиаторных систем в вентральной тегментальной области депрессивных мышей: данные RNA-seq. Журн. Высш. Нервн. Деят. им. И.П. Павлова. 67, 113‒128.
Лосева Е.В., Саркисова К.Ю., Логинова Н.А., Кудрин В.С. (2015) Депрессивное поведение и содержание моноаминов в структурах мозга у крыс при хронической скученности. Бюлл. Эксп. Биол. Мед. 159, 304‒307.
Саркисова К.Ю., Куликов М.А., Кудрин В.С., Наркевич В.Б., Мидзяновская И.С., Бирюкова Л.М., Фоломкина А.А., Базян А.С. (2017) Нейрохимические механизмы депрессивноподобного поведения у крыс линии Wag/Rij. Журн. Высш. Нервн. Деят. им. И.П. Павлова. 63, 303‒315.
Лосева Е.В., Логинова Н.А., Саркисова К.Ю., Клодт П.М., Наркевич В.Б., Кудрин В.С. (2017) Поведенческие симптомы тревоги и депрессии и содержание моноаминов в мозге у крыс после хронического интраназального введения интерферона-альфа. Рос. Физиол. Журн. им. И.М. Сеченова. 103, 417‒431.
Itzhacki J., Clesse D., Goumon Y., Van Someren E.J., Mendoza J. (2018) Light rescues circadian behavior and brain dopamine abnormalities in diurnal rodents exposed to a winter-like photoperiod. Brain Struct. Funct. 223, 2641‒2652.
Lonstein J.S., Linning-Duffy K., Yan L. (2019) Low daytime light intensity disrupts male copulatory behavior, and upregulates medial preoptic area steroid hormone and dopamine receptor expression, in a diurnal rodent model of seasonal affective disorder. Front. Behav. Neurosci. 13, 72‒83.
Jackson C.R., Capozzi M., Dai H., McMahon D.G. (2014) Circadian perinatal photoperiod has enduring effects on retinal dopamine and visual function. J. Neurosci. 34, 4627‒4633.
Gutknecht L., Araragi N., Merker S., Waider J., Sommerlandt F.M., Mlinar B., Baccini G., Mayer U., Proft F., Hamon M., Schmitt A.G., Corradetti R., Lanfumey L., Lesch K.P. (2012) Impacts of brain serotonin deficiency following Tph2 inactivation on development and raphe neuron serotonergic specification. PLoS One. 2012. 7, e43157.
Weng R., Shen S., Tian Y., Burton C., Xu X., Liu Y., Chang C., Bai Y., Liu H. (2015) Metabolomics approach reveals integrated metabolic network associated with serotonin deficiency. Sci. Rep. 5, 11864.
Dulcis D., Jamshidi P., Leutgeb S., Spitzer N.C. (2013) Neurotransmitter switching in the adult brain regulates behavior. Science. 340, 449–453.
Young W., Cope Z.A., Romoli B., Schrurs E., Joosen A., Van Enkhuizen J., Sharp R.F., Dulcis D. (2018) Mice with reduced DAT levels recreate seasonal-induced switching between states in bipolar disorder. Neuropsychopharmacol. 43, 1721–1731.
Ford C.P. (2014) The role of D2-autoreceptors in regulating dopamine neuron activity and transmission. Neurosci. 282, 13‒22.
Tsai H.Y., Chen K.C., Yang Y.K., Chen P.S., Yeh T.L., Chiu N.T., Lee I.H. (2011) Sunshine-exposure variation of human striatal dopamine D(2)/D(3) receptor availability in healthy volunteers. Prog. Neuropsychopharmacal Biol. Psychiatry. 35, 107‒110.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


