Молекулярная биология, 2020, T. 54, № 1, стр. 114-127
Факторы, влияющие на мечение клеток NIH 3Т3 магнитными наночастицами
О. Ф. Кандараков a, А. М. Дёмин b, В. И. Попенко a, О. Г. Леонова a, Е. Е. Копанцева a, В. П. Краснов b, А. В. Белявский a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Институт органического синтеза им. И.Я. Постовского Уральского отделения Российской академии наук
620990 Екатеринбург, Россия
* E-mail: abelyavs@yahoo.com
Поступила в редакцию 13.11.2018
После доработки 14.06.2019
Принята к публикации 16.06.2019
Аннотация
Изучены факторы, влияющие на мечение линии NIH 3Т3 фибробластов мыши магнитными наночастицами (МНЧ) на основе Fe3O4. В работе использовали МНЧ, полученные газофазным методом и методом осаждения из раствора, а также МНЧ, поверхностно модифицированные 3-аминопропилсиланом или L-лизином. Показано, что способ получения, поверхностная модификация, концентрация частиц и их размер, а также состояние клеточной популяции и методы введения МНЧ могут существенно влиять на эффективность связывания МНЧ клетками. В частности, суспензии МНЧ в ДМСО могут содержать крупные кластеры, разрушение которых ультразвуком способствует увеличению доли клеток с МНЧ. Статическая инкубация суспензии клеток с МНЧ также дает более высокую долю клеток с МНЧ по сравнению с инкубацией с непрерывным перемешиванием. Прикрепленные к пластику клетки NIH 3Т3 способны метиться с большей эффективностью, чем в состоянии суспензии, но требуют значительно более длительной инкубации с МНЧ; при этом центрифугирование МНЧ на клеточные слои (магнетоспинокуляция) позволяет значительно повысить скорость и эффективность мечения. Стабильность магнетизации клеток также зависит от дозы МНЧ при мечении. Электронно-микроскопические исследования показали, что МНЧ после инкубации с клетками в течение 20 мин ассоциированы с поверхностью клеток, а через 4 ч находятся главным образом внутри клеток. Результаты работы могут быть полезны при создании и использовании магнетизированных клеточных препаратов.
ВВЕДЕНИЕ
Магнитные свойства наночастиц определяют свойства магнитных материалов, созданных на их основе. Широкий спектр методов получения всевозможных магнитных наночастиц (МНЧ) дает возможность удовлетворить спрос на магнитные материалы на их основе в различных областях науки и техники [1]. В частности, МНЧ широко применяют в биомедицине (см. обзоры [2, 3]). Одно из наиболее используемых приложений МНЧ – специфическое мечение клеток с помощью антител, конъюгированных с МНЧ, c целью последующего выделения клеточных субпопуляций в магнитных полях высокой интенсивности (так называемая магнитная сортировка) [4]. МНЧ применяют для отслеживания с помощью магнитно-резонансной томографии трансплантированных клеток в животных моделях различных патологий [5, 6], для специфической доставки лекарств [6, 7] и термоабляции раковых клеток [8, 9]. Отдельно можно отметить использование МНЧ для трансфекции клеток плазмидной ДНК или вирусными частицами [10]. Опубликованы весьма интересные результаты применения наночастиц для создания контролируемой ишемии участков мозга [11] у лабораторных животных.
Весьма многообразно применение МНЧ и других магнитных наноматериалов при культивировании клеток. В частности, магнитные клетки используют при 3D культивировании для формирования множественных слоев клеток в гомотипических [12] и гетеротипических [13] клеточных культурах, в том числе с использованием принципа магнитной левитации [14]. Весьма интересным представляется применение магнитных наноматериалов при совместном культивировании клеток для последующего выделения целевых клеток, хотя до последнего времени этот метод редко использовали [15]. Мы недавно применили МНЧ для магнетизации стромальных клеток в системе культивирования гемопоэтических клеток на стромальных слоях, что позволило получать репрезентативные клеточные популяции, обогащенные ранними клетками [16].
Учитывая многообразие применений МНЧ в клеточной биологии, нами проведен систематический анализ факторов, влияющих на магнетизацию клеток с помощью МНЧ. В ходе исследования выявлено значительное ускорение магнетизации прикрепленных клеток за счет центрифугирования МНЧ на них.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение МНЧ. МНЧ Fe3O4 со средним диаметром 20 нм (MNPs-1) синтезированы методом осаждения из газовой фазы в Институте физики металлов УрО РАН (г. Екатеринбург) [16‒18]. МНЧ Fe3O4 со средним диаметром 9 нм (MNPs-2) получали методом осаждения из водного раствора солей Fe3+ и Fe2+. Модификацию наночастиц 3-аминопропилсиланом (APS) [19, 20], N-защищенным производным L-лизина, с последующим удалением защитных групп проводили по аналогии с [16, 17].
Характеристика МНЧ. Спектры НПВО (нарушенного полного внутреннего отражения) записаны на инфракрасном Фурье-спектрометре Nicolet 6700 (“Thermo Electron Corp”, США) с приставкой Smart Orbit (с алмазным кристаллом). Элементный анализ (CHN) полученных материалов проводили с использованием автоматического CHN-анализатора РЕ 2400, серия II (“Perkin Elmer”, США). Термогравиметрический анализ (ТГА) проводили на термогравиметрическом анализаторе TGA/DSC1 (“Mettler Toledo”, США). Магнитные свойства изучены на вибромагнитометре с магнитным полем 2.2 MA/м.
Клеточная культура. Клетки NIH 3Т3 культивировали при 37°С и 5% СО2 в среде DMEM с добавлением 4 г/л глюкозы, 10%-ной эмбриональной сыворотки крупного рогатого скота, 2 мМ глутамина, 100 мкг/мл стрептомицина и 100 МЕ/мл пенициллина.
Мечение МНЧ клеток в суспензии. В экспериментах с клетками использовали суспензии, содержащие 5 мг МНЧ (MNPs-1–MNPs-5) в 1 мл диметилсульфоксида (ДМСО). Перед проведением экспериментов с клетками суспензии МНЧ обрабатывали ультразвуком (УЗ) в течение 30 мин при комнатной температуре в УЗ-бане Bransonic-2510. Захват МНЧ клетками изучали с использованием как суспензионных, так и прикрепленных клеток NIH 3Т3. Суспензии МНЧ и клетки фотографировали камерой микроскопа Olympus CKX41 (“Olympus”, Япония). Оптическую плотность суспензий с МНЧ определяли с помощью прибора GENESYS 10UV (CША), на длине волны 600 нм.
Клетки NIH 3Т3, выращенные в указанных условиях, снимали с поверхности пластика раствором TrypLE Express (“Gibco”, США) при 37°С в течение 2–3 мин с последующим добавлением к клеточной суспензии 1 мл среды DMEM, содержащей сыворотку. Полученную суспензию центрифугировали в течение 5 мин при 150 g, супернатант удаляли, а клетки суспендировали в бессывороточной среде DMEM или в фосфатно-солевом буфере (ФСБ). Весь объем суспензии с заданной концентрацией клеток разбивали на равные части, каждую из которых переносили в пробирку, объемом 15 мл. Объем суспензии доводили до 2 мл средой без сыворотки, добавляли МНЧ, смесь суспендировали и инкубировали в течение 20 мин в вертикальном положении. В некоторых экспериментах инкубацию проводили с перемешиванием (угловая скорость 0.5 рад/с, Thermo/Hybaid HS9360 Hybridization Oven (“Artisan Technology Group”, США)). Перед разделением клеток смесь вновь суспендировали и устанавливали на постоянный магнит (“Promega”, США) на 2 мин. После чего, не снимая пробирку с магнита, всю среду с клетками собирали в отдельную пробирку. Затем отделяли магнит от пробирки, к оставшимся клеткам с МНЧ добавляли 1 мл бессывороточной среды. Клетки каждой фракции считали отдельно с помощью гемоцитометра. В качестве контрольного варианта использовали клетки, к которым не добавляли МНЧ, но проводили все те же процедуры, что и с МНЧ.
Мечение МНЧ клеток в прикрепленном состоянии. Клетки NIH 3Т3 снимали с поверхности раствором TrypLE Express, переносили в лунки шестилуночного планшета, содержащие 300 мкл/см2 среды DMEM. Плотность посадки клеток при этом составляла 105/см2, что обеспечивало полную конфлюентность прикрепленных клеток. Через 24 ч после пересадки клеток среду удаляли и вносили в лунки по 2 мл бессывороточной среды с MNP-1, суспензию распределяли равномерно по всей поверхности и переносили планшет в инкубатор “Sanyo” (Япония) MCO-18AIC, если время инкубации превышало 60 мин. Затем среду с МНЧ удаляли, клеточный слой дважды промывали бессывороточной средой и 1 раз ФБС. Затем в каждую лунку добавляли 0.5 мл смеси Версена и TrypLE Express (1 : 1). Суспендированные клетки собирали в 15 мл пробирку и добавляли 1.5 мл среды, не содержащей сыворотки, если не оговорено иное. Клетки с МНЧ и без них разделяли, как описано ранее, для суспензионных клеток. Сравнивали эффективность введения МНЧ в адгезионные и суспензионные клетки. Клетки для суспензионного варианта выращивали в тех же условиях и в том же количестве, что и в адгезионном варианте.
Мечение МНЧ клеток методом магнетоспинокуляции. Прикрепленные клетки подготавливали, как описано выше. Среду удаляли, в лунки шестилуночного планшета вносили 2 мл бессывороточной среды с МНЧ. Планшет устанавливали в центрифугу Eppendorf 5810R и центрифугировали при комнатной температуре. После этого проводили все процедуры, описанные ранее для адгезионных клеток. Контрольные варианты не центрифугировали.
Анализ агрегации МНЧ в растворах. Оптическую плотность водных суспензий МНЧ регистрировали при длине волны 600 нм на спектрофотометре GENESYS 10UV (США). Оценивали влияние различных сред на скорость осаждения МНЧ под действием гравитации. С этой целью 30 мкл суспензии МНЧ в ДМСО разбавляли в 270 мкл ДМСО, воды, бессывороточной среды DMEM или ФБС. Полученные суспензии перемешивали и центрифугировали в течение 5 мин при 320 g. К 20 мкл супернатанта добавляли 180 мкл воды, перемешивали, инкубировали в УЗ-бане в течение 30 мин и измеряли оптическую плотность суспензий, как описано выше.
Скорость осаждения МНЧ под действием магнитного поля оценивали, разбавляя 15 мкл суспензии МНЧ в ДМСО в 2 мл ФСБ, бессывороточной среды DMEM, ДМСО или Н2О. Полученные суспензии перемешивали и устанавливали на постоянный магнит на 5 мин. Затем супернатант удаляли, не снимая пробирку с магнита, к осадку МНЧ добавляли 2 мл воды. Смесь перемешивали, инкубировали в УЗ-бане в течение 30 мин и измеряли оптическую плотность.
Электронная микроскопия. Клетки отмывали от среды ФСБ, фиксировали 2%-ным глутаровым альдегидом на 0.1 М фосфатном буфере (pH 7.4) в течение 1 ч при комнатной температуре, заключали в 2%-ный агар на 0.1 М фосфатном буфере (pH 7.4), дофиксировали 1%-ным OsO4 на 0.1 М фосфатном буфере (pH 7.4) в течение 1 ч при температуре 4°С, дегидратировали в серии спиртов возрастающей концентрации, заключали в смесь эпон-аралдит по стандартной методике. Ультратонкие срезы толщиной 50‒70 нм получали на ультратоме LKB-III (“LKB”, Швеция) и монтировали на бленды, покрытые угольно-формваровой пленкой-подложкой. Срезы контрастировали уранилацетатом и цитратом свинца по стандартной методике [21]. Препараты просматривали в электронном микроскопе JEM-100CX (“Jeol”, Япония) в ЦКП “Коллекция UNIQEM” ФИЦ Биотехнологии РАН (Москва).
Статистический анализ. Все эксперименты проводили не менее 3 раз по три повтора. Данные нормировали относительно контрольных вариантов, значения в которых приняты за единицу, и представляли как средние значения ± стандартное отклонение.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Синтез и свойства МНЧ
В работе использовали МНЧ на основе Fe3O4, полученные методом осаждения из газовой фазы (MNPs-1, 20 нм) [16‒18] и методом осаждения из водного раствора солей Fe3+ и Fe2+ (MNPs-2, 9 нм) [19, 20]. Поскольку интерес представляло также изучение поведения положительно заряженных наночастиц, предположительно более эффективно взаимодействующих с отрицательно заряженной клеточной поверхностью, дополнительно были получены наночастицы, химически модифицированные 3-аминопропилсиланом (MNPs-3), N-ди-Fmoc-L-лизином (MNPs-4) и L-лизином (MNPs-5) (рис. S1 , см. Приложение на сайте http://www.molecbio.ru/ downloads/2020/1/supp_Kandarakov_rus.pdf), по аналогии с [16, 17].
Согласно данным ИК-спектроскопии (рис. S2 ) поверхность наночастиц второго типа (MNPs-2) имеет заметно большую степень гидратированности, чем MNPs-1, о чем можно судить по отношению площадей (SO–H/SFe–O) под кривыми абсорбции в областях 3650‒2400 см–1 (SO–H) и 750‒460 см–1 (SFe–O), относящихся к валентным колебаниям О–Н в составе молекул H2O и ОН-групп на поверхности МНЧ и Fe–O наночастиц Fe3O4 соответственно. Так, значение SO–H/SFe–O составило 0.73 и 1.43 в образцах MNPs-1 и MNPs-2 (рис. S2 ). По данным ТГА (рис. S3 ) MNPs-1 и MNPs-2 содержали порядка 1.8% адсорбированной воды (30–380°С), а также 0.8 и 1.8 масс. % гидроксильных групп соответственно (по расчету потери массы образцов в области 160‒380°С, в которой происходит их удаление). Таким образом, согласно данным ИК-спектроскопии и ТГА (рис. S3 ), химически полученные МНЧ обладают более выраженными гидрофильными свойствами благодаря присутствию большего количества гидроксильных групп и адсорбированных молекул воды на их поверхности, чем МНЧ, полученные газофазным методом, что обуславливает легкость получения их водных суспензий.
Иммобилизация APS, L-лизина и его защищенного производного на МНЧ подтверждена данными ИК-спектроскопии. Для сопоставления результатов, полученных в in vitro экспериментах, с помощью элементного анализа (по масс. % С в образце) оценено количество органических молекул на поверхности MNPs-3–MNPs-5 (по аналогии с [20, 21]) и проведена ИК-спектроскопии [22]. Показано, что MNPs-3–MNPs-5 содержали 0.61, 0.14 и 0.12 ммоль APS, N-ди-Fmoc-L-лизина и L-лизина в расчете на 1 г наночастиц соответственно. По данным ТГА для MNPs-3–MNPs-5 общая потеря массы образца, обусловленная деструкцией и удалением органического покрытия, составила 7.6, 15.7 и 12.4% соответственно (рис. S3 ).
Магнитные свойства МНЧ на основе химически синтезированных наночастиц были несколько лучше, чем у наночастиц, синтезированных газофазным методом. Так, удельная намагниченность насыщения MNPs-1 составила 61 А м2/кг, MNPs-2 – 81 А м2/кг, модифицированных MNPs-3–MNPs-5 – порядка 73 А м2/кг.
Связывание МНЧ с клетками
В таблице 1 суммированы свойства МНЧ, использованных в данной работе.
Таблица 1.
Виды МНЧ, использованные в работе
| МНЧ | Способ получения | Формула |
|---|---|---|
| MNPs-1 | Газофазный метод без покрытия |  |
| MNPs-2 | Осаждение из водного раствора солей без покрытия |  |
| MNPs-3 | Осаждение из водного раствора солей. Модифицированы 3-аминопропилсиланом (содержит на поверхности аминогруппы) | 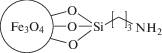 |
| MNPs-4 | Осаждение из водного раствора солей. ди-Fmoc-L-лизин-модифицированные МНЧ Fe3O4 (содержат на поверхности L-лизин с защищенными аминогруппами) | 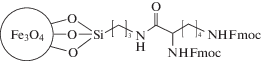 |
| MNPs-5 | Осаждение из водного раствора солей. Модифицированы L-лизином (содержат на поверхности молекулы L-лизина со свободными аминогруппами) |  |
Для выяснения возможных различий в эффективности связывания клетками разных типов МНЧ проведено сравнительное исследование, в котором по 30 мкл суспензии (0.15 мг) МНЧ каждого типа озвучивали в течение 30 мин и добавляли к клеткам NIH 3T3, снятым с пластика и находящимся в суспензионном состоянии (в дальнейшем ‒ суспензионные клетки). После инкубации в этих условиях более 95% клеток (независимо от способа получения и химических модификаций) удерживались на стенке пробирки магнитным полем постоянного магнита. Не выявлено значимых различий в связывании клеток разными типами МНЧ (рис. 1). В контроле (без МНЧ) менее 5% клеток оказались в месте локализации магнита, очевидно, в результате осаждения под действием гравитационного поля.
Рис. 1.
Доля клеток NIH 3T3 (N) на магните и в среде с 30 и 5 мкл суспензии МНЧ. К ‒ контроль, вариант без добавления МНЧ. Перед добавлением к клеткам МНЧ озвучивали в течение 30 мин.
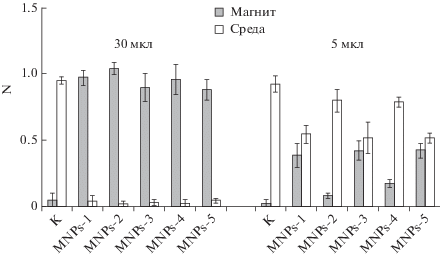
Мы предположили, что этот результат может быть следствием насыщающего количества добавленных к клеткам МНЧ, нивелирующего возможные различия между типами магнитных частиц. В связи с этим доза МНЧ была снижена до 5 мкл, т.е. в 6 раз (рис. 1). При таком количестве МНЧ (MNPs-1, MNPs-3 и MNPs-5) магнит удерживал не более 40% клеток. В случае MNPs-2 и MNPs-4, однако, доля клеток на магните оказалась еще меньше и не превышала 25%. Полученные данные показывают, что способ получения и химические модификации поверхности МНЧ влияют на эффективность магнетизации ими клеток. Так, эффект наночастиц MNPs-3 и MNPs-5 с большим положительным зарядом поверхности, обусловленным присутствием аминогрупп, был более выражен, чем у MNPs-4, содержащих гораздо меньше аминогрупп APS, не участвующих в связывании с молекулами N-ди-Fmoc-L-лизина. Сравнение немодифицированных МНЧ показывает, что частицы MNP-1, полученные газофазным методом, более эффективно включались в клетки, чем частицы MNPs-2, полученные осаждением из водного раствора.
Эффекты агломерации МНЧ
Микроскопический анализ суспензии МНЧ до обработки УЗ показал присутствие достаточно крупных частиц, размер которых может превышать 5 мкм (рис. 2). Исходный средний размер газофазных частиц МНЧ составляет порядка 20 нм, а у частиц, полученных осаждением ‒ 10 нм (рис. S1 , см. Приложение на сайте http://www.molecbio.ru/ downloads/2020/1/supp_Kandarakov_rus.pdf). Очевидно, что в световом микроскопе частицы такого размера не видны, т.е. мы наблюдали их агломераты. Размеры больших агломератов МНЧ и клеток сопоставимы, поэтому они не могут проникать в клетки, однако способны аккумулировать значительную массу частиц, снижая эффективную концентрацию МНЧ. Исходя из полученных результатов, можно предположить, что разрушение агломератов МНЧ будет способствовать увеличению доли клеток с МНЧ. Поэтому на примере MNPs-2 и MNPs-4 изучено включение клетками МНЧ в зависимости от продолжительности УЗ-обработки. С этой целью были приготовлены суспензии МНЧ для точного отсчета времени УЗ-обработки. В экспериментах, представленных на рис. 3, к суспензионным клеткам добавляли 5 мкл МНЧ.
Рис. 3.
Доля клеток NIH 3T3 (N) на магните и в среде при увеличении времени обработки суспензий MNPs-2 и MNPs-4 в ДМСО ультразвуком. К препаратам клеток добавляли по 5 мкл суспензии МНЧ. К – контроль, вариант без МНЧ.
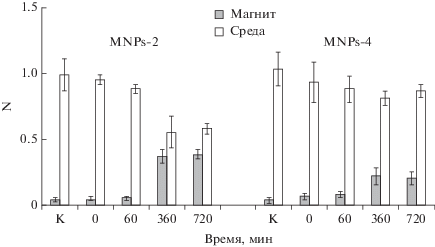
Обработка суспензий MNPs-2 и MNPs-4 в ДМСО УЗ в течение 6 ч приводила к увеличению доли клеток на магните как минимум в 2 раза. Однако дополнительное воздействие УЗ до 12 ч не приводило к дальнейшему увеличению доли клеток на магните, что, вероятно, связано с достижением предела диспергирования МНЧ в данных условиях (рис. 3).
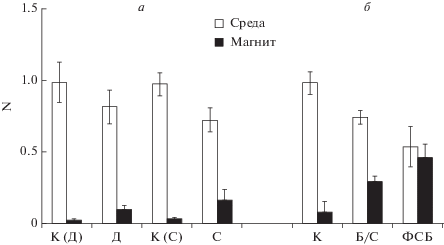
Полученные нами результаты показывают, что использование малых доз МНЧ позволяет лучше выявлять различия в эффективности их связывания клетками и исследовать факторы, влияющие на связывание. Этот подход применен нами для изучения других факторов, влияющих на связывание МНЧ (а именно MNPs-1) клетками (рис. 4). Показано, что постоянное перемешивание суспензии (динамическая инкубация) приводит к снижению магнетизации клеток по сравнению со статической инкубацией без перемешивания. В то же время, при инкубации клеток с МНЧ в ФСБ степень магнетизации была выше, чем при инкубации в среде без сыворотки.
Рис. 4.
Изменение доли клеток (N) в среде и на магните при инкубации 15 мкл MNPs-1 с суспензионными клетками NIH 3T3. а – Динамическая (Д) и статическая (С) инкубация клеток с МНЧ, б – Статическая инкубация клеток с МНЧ в бессывороточной среде DMEM (Б/С) и в фосфатном солевом буфере (ФСБ), К(Д), К(С), К ‒ соответствующие контрольные варианты без МНЧ. Данные нормированы относительно значений в контрольных вариантах, принятых за 1.
Магнетизация прикрепленных клеток
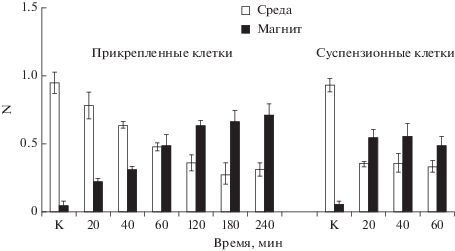
В проведенных нами опытах МНЧ инкубировали только с клетками в суспензионном состоянии. Преимущество этого подхода состоит в том, что эффективность связывания МНЧ с клетками можно определить сразу после окончания инкубации. Значительный интерес представляет также сравнение этого подхода с альтернативным, в котором МНЧ инкубировали с клетками, которые находятся в прикрепленном к пластику состоянии (далее – прикрепленные клетки). Для этого к прикрепленным клеткам добавляли суспензию МНЧ (MNPs-1) в среде без сыворотки и анализировали динамику связывания МНЧ через определенные промежутки времени, снимая клетки трипсином и измеряя долю клеток на постоянном магните и в среде. Как следует из рис. 5, время инкубации клеток с МНЧ имеет критическое значение. Доля магнетизированных клеток в прикрепленном варианте со временем увеличивается, достигая максимальных значений через 3‒4 ч, в суспензионном же варианте максимума наступает через 20‒40 мин. При одной и той же дозе МНЧ доля магнетизированных клеток в прикрепленном варианте выше, чем в суспензионном.
Рис. 5.
Изменение доли клеток (N) в среде и на магните при инкубации 15 мкл MNPs-1 с прикрепленными и суспензионными клетками NIH 3T3. К – контроль без добавления МНЧ.
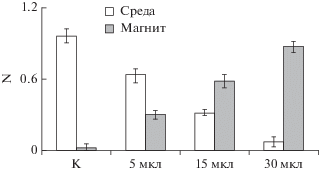
Как показано выше (рис. 1), для повышения доли суспензионных клеток, связавших МНЧ, достаточно увеличить количество МНЧ. Такая же тенденция наблюдается и в случае адгезионных клеток. Из рис. 6 видно, что увеличение количества MNPs-1 в 6 раз приводит к резкому увеличению доли клеток, осаждаемых на магните.
Рис. 6.
Изменение доли клеток (N) в среде и на магните при инкубации MNPs-1 с прикрепленными клетками NIH 3T3. Время инкубации ‒ 180 мин. К – контроль без добавления МНЧ.
Приведенные данные показывают, что эффективная магнетизация клеток в прикрепленном состоянии требует нескольких часов инкубации. Мы проверили, возможно ли ускорение этого процесса за счет принудительного осаждения МНЧ на клетки путем центрифугирования. На рис. 7 представлены результаты эксперимента, который показывает возможности данного подхода при введении MNPs-1 в клетки NIH 3T3. Как видно из рис. 7, низкоскоростного центрифугирования (500 об/мин) в течение 2 мин достаточно для увеличения доли магнетизированных клеток примерно до 50%, тогда как при простой инкубации тех же клеток с МНЧ эта доля не превышала 10%. Увеличение времени центрифугирования в 2 раза приводило к 65%-ной магнетизации клеток, однако дальнейшее центрифугирование не давало дополнительного эффекта. Магнетоспинокуляция суспензионных клеток также приводила к некоторому положительному эффекту, однако увеличение степени магнетизации клеток по сравнению с контрольными образцами без центрифугирования было небольшим (данные не приведены).
Рис. 7.
Изменение доли магнетизированных клеток NIH 3T3 (N) при центрифугировании (500 об/мин) прикрепленных клеток с 15 мкл MNPs-1. Ось абцисс: время (минуты). Обозначения: Ц – центрифугирование, К-контроль без центрифугирования.
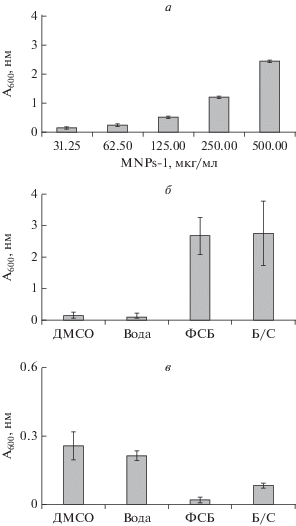
Замечено, что суспензия МНЧ в ДМСО до озвучивания способна достаточно быстро (в течение минут) осаждаться на магните, тогда как после УЗ-обработки МНЧ садятся на магнит крайне медленно. При этом клетки, магнетизированные такими МНЧ, могут быть собраны на магните весьма быстро, в течение 1‒2 мин. Чтобы объяснить этот парадокс, мы измеряли оптическое поглощение суспензий MNPs-1, которое, как показали предварительные эксперименты, в использованном диапазоне пропорционально концентрации МНЧ (рис. 8а). В следующем эксперименте аликвоты MNPs-1 добавили в ДМСО, воду, среду без сыворотки и ФСБ. После инкубации в течение 5 мин измерили оптическое поглощение МНЧ, осевших на магнит. Показано (рис. 8б), что количество МНЧ, осевших на магнит в среде или ФСБ, намного выше, чем в ДМСО или воде. Это говорит о том, что в средах с физиологической ионной силой (в отличие от воды) происходит быстрая агломерация МНЧ, приводящая к значительному ускорению их посадки на магнит. При центрифугировании в указанных растворах в отсутствие внешнего магнитного поля MNPs-1 медленнее всего осаждается в воде и ДМСО (рис. 8в), что также свидетельствует об их агрегации в средах с физиологической ионной силой.
Рис. 8.
Оптическая плотность возрастающих концентраций водных суспензий MNPs-1 (а), водных суспензий препаратов MNPs-1, осажденных из различных сред на магните (б), супернатантов после центрифугирования суспензий MNPs-1 в различных средах (в). ФСБ – фосфатно-солевой буфер, Б/С – среда DMEM без сыворотки.
Стабильность магнетизации клеток
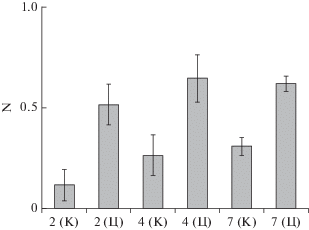
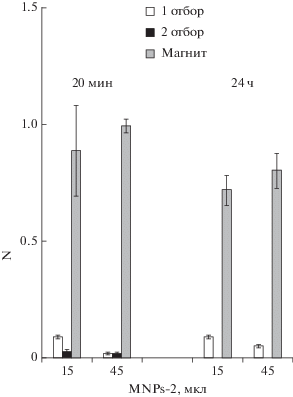
Во многих случаях важна не только эффективность связывания МНЧ клетками, но и стабильность магнитного мечения клеток. Для анализа этого аспекта магнитной модификации клеток проводили магнетизацию суспензионных клеток различающимися в 3 раза дозами MNPs-2, после чего 2 раза очищали клетки на магните. Магнетизированные клетки после второго раунда очистки обрабатывали митомицином для остановки пролиферации и культивировали в течение суток. Затем клетки повторно выделяли на магните. Представленные на рис. 9 данные показывают, что на втором раунде очистки доля клеток, не осаждающихся на магнит, весьма невелика. Однако после культивирования в течение суток процент клеток, переставших связываться с магнитом, заметно повысился. При этом доля таких клеток была значительно ниже при использовании для мечения более высокой дозы МНЧ. Таким образом, начальная магнетизация клеток, которая после двукратной очистки на магните должна быть близкой к 100%, не означает, что при дальнейшем культивировании все магнитные клетки остаются такими же; часть из них после культивирования перестает садиться на магнит.
Рис. 9.
Отбор магнетизированных клеток сразу после инкубации с МНЧ (20 мин) и после культивирования отобранных магнетизированных клеток в течение 24 ч (24 ч). По оси абсцисс показан объем добавленной суспензии MNPs-2 при инкубации клеток с МНЧ, по оси ординат ‒ доля клеток (N) на магните и в среде после двух последовательных отборов магнетизированных клеток, проведенных сразу после инкубации клеток с МНЧ (1 отбор и 2 отбора). В этом случае долю клеток на магните определяли после второго отбора. После культивирования магнетизированных клеток (24 ч) вновь проведен однократный отбор магнетизированных клеток.
Электронно-микроскопический анализ распределения МНЧ в клетках
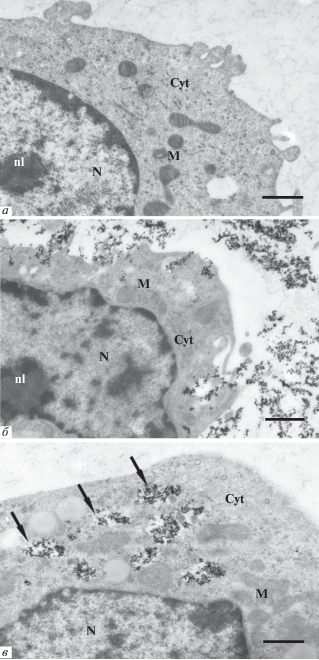
Локализацию МНЧ в клетках при магнетизации определяли с помощью электронной микроскопии. Показано, что в клетках NIH 3T3, инкубируемых в среде с MNPs-1, накапливаются магнитные частицы. Ультраструктура клеток при этом не меняется (рис. 10а–в). На ультратонких срезах видно, что магнитные частицы в среде агрегируют и имеют вид скоплений электронно-плотных гранул разного размера (рис. 10б, в). После 20 мин инкубации с клетками агрегаты магнитных частиц выявляются только в среде и на поверхности клеток (рис. 10б). Однако через 4 ч большое количество МНЧ обнаруживается внутри клеток, в цитоплазме (рис. 10в). Таким образом, после инкубации с клетками наблюдается довольно быстрая интернализация МНЧ.
Рис. 10.
Электронная микроскопия ультратонких срезов клеток NIH 3T3. а – Контрольные клетки до инкубации с магнитными частицами; б ‒ клетки после инкубации с магнитными частицами в течение 20 мин. Агрегаты электронно-плотных МНЧ располагаются вне клеток и на поверхности клеток; в – после инкубации в течение 4 ч МНЧ располагаются внутри клеток, в цитоплазме (обозначены стрелками). Обозначения субклеточных структур: Cyt – цитоплазма, M – митохондрии, N – ядро, nl – ядрышки. Масштаб 1 мкм.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты настоящего исследования показывают, что мечение МНЧ клеток NIH 3T3 в значительной степени зависит от композиции частиц и условий, в которых проходит магнетизация. Показано, в частности, что МНЧ с поверхностным положительным зарядом более эффективно магнетизируют клетки, что согласуется с ранее опубликованными результатами [23]. Кроме того, имеет значение и способ получения МНЧ.
В данном исследовании сравнили магнетизацию клеток, находящихся в суспензионном и прикрепленном к пластику состоянии. Время инкубации имеет большое значение при связывании МНЧ клетками как в прикрепленном, так и в суспензионном состоянии, причем если в первом случае для достижения эффективного мечения требуется несколько часов, то во втором случае оптимальное время мечения не превышает 20‒40 мин, после чего жизнеспособность клеток NIH 3T3 в суспензии падает.
Мы показали далее, что за счет непродолжительного центрифугирования (магнетоспинокуляции) время инкубации прикрепленных клеток с МНЧ можно сократить до минимума, сохранив при этом высокую эффективность магнетизации клеток. Магнетизация прикрепленных клеток с помощью магнетоспинокуляции представляет собой простой и эффективный метод, который, по всей вероятности, может использоваться при работе с другими клетками млекопитающих in vitro. Ранее Ocampo и соавт. [24] показали, что центрифугирование МНЧ с клетками глиомы U251 в суспензии значительно повышает эффективность интернализации МНЧ по сравнению с теми же клетками в прикрепленном состоянии. В наших экспериментах небольшое увеличение эффективности мечения клеток NIH 3T3 в супензии при центрифугировании объясняется тем, что в оптимальных условиях мечение этих клеток в суспензии было и без того эффективным. В то же время, Ocampo и соавт. [24] не сравнивали мечение суспензионных клеток с использованием центрифугирования или без него, поэтому их вывод о радикальном повышении эффективности мечения за счет центрифугирования не может считаться доказанным. Кроме того, не выявлено значительного ускорения мечения МНЧ прикрепленных клеток при центрифугировании, что отличает данные [24] от результатов, полученных нами.
Отметим также, что магнетоспинокуляция, разработанная нами для прикрепленных клеток, проще подхода, использованного в [24], поскольку не требует перевода клеток в суспензионное состояние для введения МНЧ. Сходный принцип может, по-видимому, использоваться и при работе с немагнитными частицами при условии, что они формируют агломераты достаточных размеров, а их плотность выше плотности среды.
Следует сказать, что в ряде работ, посвященных магнетизации клеток МНЧ, показано, что не все виды МНЧ эффективно метят клетки, а часть из них практически неспособна к этому [25]. Для введения МНЧ в клетки в таких случаях используют трансфекционные агенты [26, 27] или другие способы, такие как магнетофекция [28, 29] или сонопорация [30]. В то же время, в наших экспериментах МНЧ разного вида, отличающиеся способами получения, начальными размерами и поверхностными модификациями, вполне эффективно метили клетки без применения трансфекционных агентов, и различия между ними начинали выявляться только при значительном понижении дозы МНЧ во время мечения.
Для объяснения этого противоречия можно привлечь результаты, приведенные на рис. 8, которые показывают, что МНЧ после длительной обработки УЗ в ДМСО существуют в виде мелкодисперсной суспензии, крайне медленно садящейся на магнит в ДМСО или воде. Однако после попадания в среду с физиологической ионной силой (культуральная среда или ФСБ) МНЧ начинают собираться на магните или седиментировать под действием гравитации намного быстрее, что, по-видимому, объясняется их быстрой агломераций в солевых растворах. Это предположение подтверждается также успешным применением предложенного нами метода магнетоспинокуляции, поскольку мономерные наночастицы размером 10‒20 нм, в отличие от более крупных агломератов, не могли бы при низких оборотах седиментировать за несколько минут на поверхность клеток. Агломерацию МНЧ в солевых растворах наблюдали и ранее [31, 32]. Показано также [33], что размер агломератов растет с увеличением ионной силы среды, при этом дальнейшая агломерация, по-видимому, может происходить и внутри клеток. Скорее всего, агломерация МНЧ, в том числе и внутри клеток, играет принципиальную роль при магнетизации клеток.
Интернализация МНЧ клетками происходит за счет эндоцитоза [34, 35]. Процесс интернализации происходит, скорее всего, в две стадии ‒ сначала МНЧ и их агломераты взаимодействуют с клеточной поверхностью и, вероятно, обратимо иммобилизуются на ней, после чего следует само поглощение путем эндоцитоза [36]. Это предположение согласуется с результатами проведенных нами электронно-микроскопических исследований и, в целом, достаточно хорошо объясняет полученные нами результаты, в частности, снижение эффективности магнетизации клеток при динамической инкубации с постоянным перемешиванием. В этом случае движение жидкости может способствовать удалению с поверхности тех частиц или агломератов частиц, которые в данный момент слабо связаны с поверхностью клеток и не могут противостоять гидродинамическим силам, возникающим при перемешивании.
Если интернализация МНЧ происходит путем эндоцитоза, процесса, обладающего определенной специфичностью в отношении размера интернализуемых объектов, то можно предположить, что эффективному поглощению могут подвергаться лишь агломераты МНЧ определенных размеров. В этом случае доля “компетентных”, способных к поглощению, агломератов МНЧ будет зависеть от ряда параметров, прежде всего, от их агрегатного состояния на момент мечения, что, в конечном счете, будет определять эффективность магнетизации клеток при низких дозах МНЧ. При высоких дозах содержание “компетентных” агломератов, очевидно, становится достаточным для магнетизации большинства клеток независимо от доли таких агломератов в препарате МНЧ.
Наши данные также показывают, что следует отличать первичную магнетизацию клеток, часть которой может быть временной и сопровождается последующей потерей этой фракцией магнитной метки, от стабильной магнетизации, при которой потери клетками магнитной метки со временем относительно невелики. При первичной магнетизации часть магнитной метки может быть связана не с интернализацией МНЧ, а с квазистабильным закреплением на поверхности агломератов, не способных интернализоваться клеткой. При этом такие МНЧ со временем будут диссоциировать спонтанно. Некоторые виды клеток, такие как Jurkat, не подвергаются эндоцитозу МНЧ. В этом случае магнитное мечение клеток осуществляется практически исключительно за счет МНЧ, связанных с клеточной поверхностью [37].
Интересным и требующим дальнейшего изучения является обнаруженное нами увеличение доли стабильного мечения клеток при повышении дозы МНЧ. Ранее показали, что магнетизация неделящихся клеток МНЧ остается достаточно стабильной в течение дней [38, 39]. В последние годы, однако, обнаружили, что МНЧ на основе оксидов железа могут деградировать в лизосомах [40, 41], что приводит к потере их намагниченности. Потери атомов железа клетками при этом не происходит [41], однако не все согласны с этим утверждением [40]. В то же время, скорость деградации МНЧ сильно зависит от вида частиц и их покрытия [41]. Утверждается также, что клетки способны удалять интактные МНЧ за счет экзоцитоза [40]. МНЧ, использованные в нашей работе, защищены от предполагаемой деградации слоем оксида кремния, весьма устойчивого к химическим воздействиям и способного тормозить деградацию МНЧ в лизосомах. Тем не менее, при неполном покрытии поверхности МНЧ оксидом кремния их деградация представляется возможной.
В наших экспериментах несмотря на то, что клетки, меченные МНЧ, после двукратной очистки на магните должны иметь близкую к 100% степень магнитного мечения, независимо от начальной дозы МНЧ при инкубации, дальнейшее сохранение намагниченности зависело от этой дозы. При низких дозах МНЧ довольно существенное количество клеток (около 9%) через сутки теряло магнитную метку, в то время как при высоких дозах доля таких клеток не превышала 5%.
Мы предлагаем три возможных объяснения этих результатов. Во-первых, можно предположить, что использованные в работе МНЧ стабильно сохраняются в клетках после интернализации, а освобождение клеток от метки обусловлено квазистабильно связанной с поверхностью фракцией МНЧ, доля которой будет падать при увеличении дозы частиц при мечении за счет увеличения интернализации, как обсуждалось выше. Во-вторых, интернализованные МНЧ могут постепенно выбрасываться клеткой, но при больших количествах интернализованных МНЧ функционирование клеточного аппарата, отвечающего за экзоцитоз продуктов, которые не нужны клетке, может быть блокировано. В этом случае терять МНЧ будут только те клетки, первоначальная нагрузка которых интернализованными частицами была умеренной. В-третьих, интернализованные МНЧ могут постепенно подвергаться деградации в лизосомах; в таком случае доля клеток, сохранивших достаточное количество МНЧ на данный момент времени, будет возрастать при увеличении начальной нагрузки.
Какое из предлагаемых объяснений правильно позволят, очевидно, выяснить, дополнительные эксперименты.
Эксперименты, отображенные на рис. 1‒10, выполнены при поддержке Российского научного фонда (проект № 18-14-00300). Синтез и физико-химическая характеристика использованных в работе МНЧ (рис. S1‒S3 ) выполнены в рамках темы государственного задания АААА-А18-118020290116-5 с использованием оборудования Центра коллективного пользования “Спектроскопия и анализ органических соединений” (ЦКП “САОС”).
В статье не использованы люди и животные в качестве объектов исследования.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Губин С.П., Кокшаров Ю.А., Хомутов Г.Б., Юрков Г.Ю. (2005) Магнитные наночастицы: методы получения, строение и свойства. Успехи химии. 74, 539‒574.
Gupta A.K., Gupta M. (2005) Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications. Biomaterials. 26, 3995–4021.
Kudr J., Haddad Y., Richtera L., Heger Z., Cernak M., Adam V., Zitka O. (2017) Magnetic nanoparticles: from design and synthesis to real world applications. Nanomaterials. (Basel). 7, E243.
Miltenyi S., Müller W., Weichel W., Radbruch A. (1990) High gradient magnetic cell separation with MACS. Cytometry. 11, 231‒238.
Lewin M., Carlesso N., Tung C.H., Tang X.W., Cory D., Scadden D.T., Weissleder R. (2000) Tat peptide-derivatized magnetic nanoparticles allow in vivo tracking and recovery of progenitor cells. Nat. Biotechnol. 18, 410‒414.
Sun C., Lee J.S., Zhang M. (2008) Magnetic nanoparticles in MR imaging and drug delivery. Adv. Drug Deliv. Rev. 60, 1252‒1265.
Weissleder R., Kelly K., Sun E.Y., Shtatland T., Josephson L. (2005) Cell-specific targeting of nanoparticles by multivalent attachment of small molecules. Nat. Biotechnol. 23, 1418‒1423.
Merkle E.M., Boll D.T., Boaz T., Duerk J.L., Chung Y.C., Jacobs G.H., Varnes M.E., Lewin J.S. (1999) MRI-guided radiofrequency thermal ablation of implanted VX2 liver tumors in a rabbit model: demonstration of feasibility at 0.2 T. Magn. Reson. Med. 42, 141‒149.
Hilger I., Hiergeist R., Hergt R., Winnefeld K., Schubert H., Kaiser W.A. (2002) Thermal ablation of tumors using magnetic nanoparticles: an in vivo feasibility study. Invest. Radiol. 37, 580‒586.
Bertram J. (2006) MATra ‒ Magnet Assisted Transfection: combining nanotechnology and magnetic forces to improve intracellular delivery of nucleic acids. Curr. Pharm. Biotechnol. 7, 277‒285.
Jia J.M., Chowdary P.D., Gao X., Ci B., Li W., Mulgaonkar A., Plautz E.J., Hassan G., Kumar A., Stowe A.M., Yang S.H., Zhou W., Sun X., Cui B., Ge W.P. (2017) Control of cerebral ischemia with magnetic nanoparticles. Nat. Methods. 14, 160‒166.
Ito A., Hayashida M., Honda H., Hata K., Kagami H., Ueda M., Kobayashi T. (2004) Construction and harvest of multilayered keratinocyte sheets using magnetite nanoparticles and magnetic force. Tissue Eng. 10, 873‒880.
Ito A., Jitsunobu H., Kawabe Y., Kamihira M. (2007) Construction of heterotypic cell sheets by magnetic force-based 3-D coculture of HepG2 and NIH3T3 cells. J. Biosci. Bioeng. 104, 371‒378.
Daquinag A.C., Souza G.R., Kolonin M.G. (2013) Adipose tissue engineering in three-dimensional levitation tissue culture system based on magnetic nanoparticles. Tissue Eng. Part C Methods. 19, 336‒344
Ito A., Jitsunobu H., Kawabe Y., Ijima H., Kamihira M. (2009) Magnetic separation of cells in coculture systems using magnetite cationic liposomes. Tissue Eng. Part C Methods. 15, 413‒423.
Savvateeva M.V., Demin A.M., Krasnov V.P., Belyavsky A.V. (2016) Magnetic stromal layers for enhanced and unbiased recovery of co-cultured hematopoietic cells. Anal. Biochem. 509, 146‒155.
Demin A.M., Krasnov V.P., Charushin V.N. (2013) Covalent surface modification of Fe3O4 magnetic nanoparticles with alkoxysilanes and amino acids. Mendeleev Commun. 23, 14–16.
Дёмин А.М., Уймин М.А., Щеголева Н.Н., Ермаков А.Е., Краснов В.П. (2012) Поверхностная модификация магнитных наночастиц на основе Fe3O4 (S)-напроксеном. Российские нанотехнологии. 7, 66‒70.
Demin A.M., Pershina A.G., Ivanov V.V., Nevskaya K.V., Shevelev O.B., Minin A.S., Byzov I.V., Sazonov A.E., Krasnov V.P., Ogorodova L.M. (2016) 3-Aminopropylsilane-modified iron oxide nanoparticles for contrast-enhanced magnetic resonance imaging of liver lesions induced by Opisthorchis felineus. Inter. J. Nanomed. 11, 4451–4463.
Demin A.M., Pershina A.G., Nevskaya K.V., Efimova L.V., Shchegoleva N.N., Uimin M.A., Kuznet-sov D.K., ShurV. Ya., Krasnov V.P., Ogorodova L.M. (2016) pHLIP-modified magnetic nanoparticles for targeting acidic diseased tissue. RCS Advances. 6, 60196–60199.
Reynolds E.S. (1963) The use of lead citrate at high pH as electron-opaque stain in electron microscopy. J. Cell Biol. 17, 208‒212.
Demin A.M., Vigorov A.Y., Nizova I.A., Uimin M.A., Shchegoleva N.N., Ermakov A.E., Krasnov V.P., Charushin V.N. (2014) Functionalization of Fe3O4 magnetic nanoparticles with RGD peptide derivatives. Mendeleev Commun. 24, 20‒22.
Qiu B., Yang X. (2008) Molecular MRI of hematopoietic stem-progenitor cells: monitoring of gene therapy and atherosclerosis. Nat. Clin. Pract. Cardiovasc. Med. 5, 396–404.
Ocampo S.M., Rodriguez V., de la Cueva L., Salas G., Carrascosa J.L., Rodríguez M.J., García-Romero N., Cuñado J.L., Camarero J., Miranda R., Belda-Iniesta C., Ayuso-Sacido A. (2015) g-force induced giant efficiency of nanoparticles internalization into living cells. Sci. Rep. 5, 15160.
Дёмин А.М., Корякова О.В., Краснов В.П. (2014) Количественное определение 3-аминопропилсилана на поверхности модифицированных магнитных наночастиц Fе3O4 методом ИК спектроскопии НПВО. Журн. прикл. спектроск. 81, 510–514.
Frank J.A., Anderson S.A., Kalsih H., Jordan E.K., Lewis B.K., Yocum G.T., Arbab A.S. (2004) Methods for magnetically labeling stem and other cells for detection by in vivo magnetic resonance imaging. Cytotherapy. 6, 621‒625.
Arbab A.S., Yocum G.T., Kalish H., Jordan E.K., Anderson S.A., Khakoo A.Y., Read E.J., Frank J.A. (2004) Efficient magnetic cell labeling with protamine sulfate complexed to ferumoxides for cellular. MRI. Blood. 104, 1217‒1223.
Yang S.Y., Sun J.S., Liu C.H., Tsuang Y.H., Chen L.T., Hong C.Y., Yang H.C., Horng H.E. (2008) Ex vivo magnetofection with magnetic nanoparticles: a novel platform for nonviral tissue engineering. Artif. Organs. 32, 195‒204.
Prijic S., Scancar J., Romih R., Cemazar M., Bregar V.B., Znidarsic A., Sersa G. (2010) Increased cellular uptake of biocompatible superparamagnetic iron oxide nanoparticles into malignant cells by an external magnetic field. J. Membr. Biol. 236, 167‒179.
Wang Y.X., Leung K.C., Cheung W.H., Wang H.H., Shi L., Wang D.F., Qin L., Ahuja A.T. (2010) Low-intensity pulsed ultrasound increases cellular uptake of superparamagnetic iron oxide nanomaterial: results from human osteosarcoma cell line U2OS. J. Magn. Reson. Imaging. 31, 1508‒1513.
Wang H., Zhao X., Han X., Tang Z., Song F., Zhang S., Zhu Y., Guo W., He Z., Guo Q., Wu F., Meng X., Giesy J.P. (2018) Colloidal stability of Fe3O4 magnetic nanoparticles differentially impacted by dissolved organic matter and cations in synthetic and naturally-occurred environmental waters. Environ. Pollut. 241, 912‒921.
Wang H., Zhao X., Han X., Tang Z., Liu S., Guo W., Deng C., Guo Q., Wang H., Wu F., Meng X., Giesy J.P. (2017) Effects of monovalent and divalent metal cations on the aggregation and suspension of Fe3O4 magnetic nanoparticles in aqueous solution. Sci. Total. Environ. 586, 817‒826.
Jeon S., Hurley K.R., Bischof J.C., Haynes C.L., Hogan C.J. (2016) Quantifying intra- and extracellular aggregation of iron oxide nanoparticles and its influence on specific absorption rate. Nanoscale. 8, 16053‒16064.
Wilhelm C., Gazeau F., Bacri J.C. (2003) Rotational magnetic endosome microrheology: viscoelastic architecture inside living cells. Phys. Rev. E. Stat. Nonlin. Soft Matter. Phys. 67, 061908.
Kim J.S., Yoon T.J., Yu K.N., Noh M.S., Woo M., Kim B.G., Lee K.H., Sohn B.H., Park S.B., Lee J.K., Cho M.H. (2006) Cellular uptake of magnetic nanoparticle is mediated through energy-dependent endocytosis in A549 cells. J. Vet. Sci. 7, 321‒326.
Soenen S.J., De Smedt S.C., Braeckmans K. (2012) Limitations and caveats of magnetic cell labeling using transfection agent complexed iron oxide nanoparticles. Contrast Media Mol. Imaging. 7, 140‒152.
Fortes Brollo M.E., Hernández Flores P., Gutiérrez L., Johansson C., Barber D.F., Morales M.D.P. (2018) Magnetic properties of nanoparticles as a function of their spatial distribution on liposomes and cells. Phys. Chem. Chem. Phys. 20, 17829‒17838.
Jasmin, Torres A.L., Nunes H.M., Passipieri J.A., Jelicks L.A., Gasparetto E.L., Spray D.C., Campos de Carvalho A.C., Mendez-Otero R. (2011) Optimized labeling of bone marrow mesenchymal cells with superparamagnetic iron oxide nanoparticles and in vivo visualization by magnetic resonance imaging. J. Nanobiotechnol. 9, 4.
Cmiel V., Skopalik J., Polakova K., Solar J., Havrdova M., Milde D., Justan I., Magro M., Starcuk Z., Provaznik I. (2017) Rhodamine bound maghemite as a long-term dual imaging nanoprobe of adipose tissue-derived mesenchymal stromal cells. Eur. Biophys. J. 46, 433‒444.
Gu J., Xu H., Han Y., Dai W., Hao W., Wang C., Gu N., Xu H., Cao J. (2011) The internalization pathway, metabolic fate and biological effect of superparamagnetic iron oxide nanoparticles in the macrophage-like RAW264.7 cell. Sci. China Life Sci. 54, 793‒805.
Mazuel F., Espinosa A., Luciani N., Reffay M., Le Borgne R., Motte L., Desboeufs K., Michel A., Pellegrino T., Lalatonne Y., Wilhelm C. (2016) Massive intracellular biodegradation of iron oxide nanoparticles evidenced magnetically at single-endosome and tissue levels. ACS Nano. 10, 7627‒7638.
Дополнительные материалы
- скачать ESC1.docx
- Fig. S1. Scheme of synthesis and surface modification of MNPs.
Fig. S2. Attenuated total reflection (ATR) spectra of MNPs-1 – MNPs-5 (on the selected sections of spectra curves of MNPs-1 and MNPs-2 baselines were drawn relative to which integrated intensities of analytical bands of O–H and Fe–O vibrations were measured).
Fig. S3. Thermogravimetric analysis (TGA) data of MNPs-1 – MNPs-5 samples (the selected sections of MNPs-1 and MNPs-2 curves in the temperature range 160-380 °С correspond to weight loss of samples related to the removal of OH groups).
Инструменты
Молекулярная биология



