Молекулярная биология, 2020, T. 54, № 1, стр. 69-77
miR-455 подавляет пролиферацию и способствует апоптозу клеток HepG2, направленно воздействуя на экспрессию RhoC
S. L. Xie a, M. Wang a, X. H. Du a, Z. W. Zhao a, G. Y. Lv a, *
a Department of General Surgery, First Hospital of Jilin University
130021 Jilin Province, Changchun, China
* E-mail: lvguoyueydyy@163.com
Поступила в редакцию 07.07.2018
После доработки 12.01.2019
Принята к публикации 15.01.2019
Аннотация
Гепатоцеллюлярная карцинома (HCC) – одно из самых распространенных во всем мире злокачественных новообразований с плохим прогнозом и высокой смертностью. Нарушения и изменения в экспрессии различных микроРНК (miРНК) вносят вклад в развитие и прогрессирование онкологических заболеваний. Показано, что miR-455 играет регуляторную роль в развитии HCC. Используя методы МТТ и проточной цитометрии, мы проанализировали роль miR-455 в пролиферации и апоптозе клеток HepG2. Сайты связывания предсказаны с помощью средств биоинформатики, а люциферазный тест использован для подтверждения взаимосвязи между miR-455 и геном RHOC, кодирующим белок RhoC. Кроме того, влияние miR-455 на RHOC исследовано с помощью количественной ПЦР (qPCR) и иммуноблотинга. Вследствие того, что PTEN – ключевой опухолевый ген-супрессор при HCC, а Bcl-2 и каспаза-3 – важные маркеры апоптоза, в клетках с избыточной экспрессией RhoC проанализирована экспрессия белков PTEN, Bcl-2 и каспазы-3. Показано, что miR-455 способствует апоптозу клеток HepG2 и ингибирует их пролиферацию. Согласно результатам биоинформационных исследований и люциферазного анализа, miR-455 имеет специфические сайты распознавания в 3'-нетранслируемой области (3'-UTR) мРНК RhoC. По сравнению с контрольными клетками, активность люциферазы значительно ниже в клетках, совместно трансфицированных миметиком miR-455 и RhoC-WT (p < 0.01), а уровень мРНК RhoC значительно снижался после miR-455-трансфекции клеток HepG2. Из этого следует, что RHOC, действительно, служит геном-мишенью для miR-455. При избыточной экспрессии RhoС наблюдали активацию пролиферации и снижение скорости апоптоза клеток HCC (р < 0.01), снижение экспрессия PTEN и каспазы-3 (р < 0.01) и усиление экспрессии Bcl-2. Таким образом, miR-455 выполняет роль супрессора в развитии HCC, используя в качестве мишени мРНК RhoC.
Гепатоцеллюлярная карцинома (HCC), от которой ежегодно умирает почти 700 тыс. человек, стала третьей по значимости причиной смертности от онкологических заболеваний [1]. Развитие HCC связано с различными причинами, включая вирус гепатита В (HBV), вирус гепатита С (HCV), высокое потребление алкоголя и метаболический синдром [2]. В настоящее время хирургическая резекция по-прежнему остается лучшим и первым выбором для лечения HCC. Однако из-за того, что заболевание иногда диагностируют поздно, хирургическое лечение оказывается нецелесообразным. Кроме того, хирургическое вмешательство не исключает последующих рецидивов и появления метастазов, поэтому необходимость срочного поиска опухолевых маркеров для ранней диагностики и комбинированной терапии НСС очевидна.
Ген микроРНК-455 (miR-455, ген MIR455), который находится на хромосоме 9 (9q32), вовлечен в развитие различных видов злокачественных опухолей, включая колоректальный рак [1], рак поджелудочной железы [3] и рак легкого [4]. В образцах HCC уровень miR-455 обратно коррелирует с уровнями транскрипционного фактора 2 (RUNX2) [5]. Важно отметить, что низкая экспрессия miR-455 ассоциируется с низкой общей выживаемостью больных колоректальным раком [6]. В то же время при плоскоклеточном раке полости рта плохой прогноз коррелирует с повышенной экспрессией miR-455 [7]. Таким образом, уровни miR-455 можно рассматривать в качестве возможного биомаркера различных онкологических заболеваний.
RhoC – небольшой (21–25 кДа) G-белок из суперсемейства Ras-белков, обладающих активностью GTPаз [8]. Появляется все больше данных о том, что экспрессия RhoC ассоциирована с высокоагрессивными видами рака [9, 10]. При раке молочной железы избыточную экспрессию RhoC связывают с плохим прогнозом [11]. А в клеточных линиях рака молочной железы и колоректального рака RhoC вовлечен в регуляцию сигнальных путей p53 и Erk1/2 [12]. Кроме того, избыточная экспрессия HIF3A (кодирует индуцируемый гипоксией фактор 3, HIF-3α) способствует инвазии и метастазированию раковых клеток поджелудочной железы путем транскрипционной активации сигнального пути RhoC-ROCK1 [13].
В представленной работе проанализированы взаимодействия между miR-455 и мРНК RhoC как ее потенциальной мишени для выяснения детального механизма развития НСС, для чего использован биоинформационный анализ и люциферазный тест. По результатам биоинформационного анализа ранее установлено, что обе изоформы hsa-miR-455-3p имеют специфические сайты узнавания в районе 3'-нетраслируемой области (3'-UTR) мРНК RhoC. Это исследование проведено на каноническом варианте hsa-miR-455-3p.1. Влияние miR-455 на экспрессию RhoC оценивали с помощью количественной ПЦР и иммуноблотинга. Экспрессию белков PTEN, Bcl-2 и каспазы-3 анализировали в клетках со сверхэкспрессией RhoC. Влияние miR-455 на пролиферацию и апоптоз клеток HepG2 человека через сигнальный путь PTEN исследовали с помощью MTT, анализа включения BrdU и проточной цитометрии. Показано, что miR-455, таргетируя экспрессию RhoC, подавляет пролиферацию и ускоряет апоптоз клеток HepG2. Результаты этого исследования могут быть полезны для определения стратегии лечения и прогнозирования исходов онкологических заболеваний.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточная культура и трансфекция. Клетки HepG2 человека получали из клеточного репозитория ATCC (American Type Culture Collection, США). Синтезированные олигонуклеотиды получены от компании “Gene Pharma Company” (Китай):
для miR-455-миметика ‒ смысловой
5'-GCAGUCCAUGGGCAUAUACAC-3',
антисмысловой
5'-UUCGUCAGGUACCCGUAUAUG-3';
miR-455-ингибитор –
5'-GUGUAUAUGCCCAUGGACUGC-3';
miR-shNC – смысловой
5'-UUCUCCGAACGUGUCACGUTT-3',
антисмысловой:
5'-ACGUGACACGUUCGGAGAATT-3'.
Эти олигонуклеотиды использованы в экспериментах по исследованию воздействия miR-455 на ген-мишень и клетки НСС.
Для определения люциферазной активности использовали люциферазный вектор pmiR-RB-REPORT (“RiboBio”, Китай). 3′-UTR гена RHOC встраивали в сайт рестрикции NotI/XhoI. Фрагменты 3′-UTR RHOC дикого типа (RhoC-WT) со вставкой (5′-TGCCCAGGACTG-3′) по сайту NotI/XhoI и фрагменты с мутацией (RhoC-mut) с (5′-GATATCGACACT-3′) были синтезированы в компании “GENEWIZ” в Сучжоу (Китай). Продукты расщепляли с использованием рестриктаз NotI/ XhoI (“NEB”, США) и клонировали в составе плазмиды pmiR-RB-REPORT. Чтобы сконструировать экспрессионный вектор Peb-copGFP(T2A) PURO-RhoC, CDs-последовательности RHOC (582 п.н.) с сайтами рестрикции XbaI и SalI были синтезированы компанией “FITGENE” (Китай) и клонированы в составе простого вектора pMD-18T (“Takara”, Япония). Рекомбинантную плазмиду pMD-18T-RhoC и плазмиду на основе лентивирусного вектора Peb-copGFP(T2A) PURO (“FITGENE”, Китай) расщепляли с помощью соответственно XbaI и SalI (“NEB”, Китай) и присоединяли к конструкту Peb-copGFP(T2A) PURO-RhoC. Рекомбинантный Peb-copGFP (T2A) PURO-RhoC, упаковочная плазмидная смесь и липофектамин 2 000 совместно трансфицировали в клетки 293T (“ATCC”, США), которые культивировали в инкубаторе с 5% CO2 при 37°C в течение ночи. Затем проводили очистку вируса, и полученный продукт хранили при ‒80°C. Конструкты Peb-copGFP(T2A) PURO-RhoC и Peb-copGFP(T2A) PURO трансфицировали в клетки HepG2 для исследования ассоциаций между RhoC, с одной стороны, и PTEN, каспазой-3 и Bcl-2, с другой стороны.
Через 24 ч после трансфекции клетки высевали в количестве приблизительно 1 × 106 кл./лунку в 6-луночные культуральные планшеты со средой DMEM (“Gibco”, “ThermoFisher Scientific”, США), содержащей 10% эмбриональной сыворотки крупного рогатого скота (FBS; “PAA”, Австрия) и 1% пенициллин-стрептомицина, и инкубировали при 37°C в увлажненной атмосфере с 5% CO2. Среду DMEM заменяли бессывороточной средой Opti-MEM (“GIBCO”, США), когда конфлюентность клеток достигала 80%. Для определения активности люциферазы 150 мкл бессывороточной среды Opti-MEM смешивали с 5 мкл липофектамина 2000 (“Invitrogen”, США) и 1.25 мкл смеси, содержащей 20 мкмоль miR-455-миметика и 500 нг pmiR-RB-REPORT-RhoC векторов. Для определения экспрессии генов MIR455 и RHOC в клетках со сверхэкспрессией miR-455 150 мкл бессывороточной среды Opti-MEM смешивали с 5 мкл реагента липофектамина 2 000 и 1.25 мкл смеси, содержащей 20 мкмоль miR-455-миметика или отрицательный контроль. После этого смесь для трансфекции добавляли в каждую лунку, содержащую клетки в бессывороточной среде Opti-MEM после инкубации при комнатной температуре в течение 30 мин. Среду заменяли на обычную для культивирования клеток через 3–5 ч. Трансфицированные клетки использовали в дальнейшем для анализах или экстракции РНК/белка.
Анализ гена-мишени с помощью средств биоинформатики и репортерной системы на основе люциферазы. Для поиска и анализа сайтов связывания между 3′-UTR мРНК RhoC и miR-455-3p.1 были использованы онлайн-программы NCBI (https:// www.ncbi.nlm.nih.gov/), Ensemble 94 (https:// asia.ensembl.org/index.html), miRbase 22 (http:// www.mirbase.org/), Target Scan 7.2 (http://www.targetscan.org/vert_72/) и miRTarBase 2016 (http:// mirtarbase.mbc.nctu.edu.tw/php/index.php). На основе данных на этих сайтах были сконструированы и синтезированы RhoC-WT и RhoC-mut. Затем клетки HepG2 трансфицировали miR-455-миметиком одновременно с RhoC-WT, RhoC-mut или pmiR-RB-REPORT. Через 48 ч после транфекции определяли активность люциферазы, используя для этого коммерческий набор Luciferase Detection Kit (“Promega Corporation”, США).
Количественная ПЦР и иммуноблотинг. Тотальную РНК выделяли из клеточных линий с использованием реагентов Тризол (“Invitrogen”, США) в соответствии с инструкциями производителя. Количественную ПЦР выполняли с использованием наборов ReverTra Ace-α-Kit (“Toyobo”, Япония) и SYBR Green Realtime PCR Master Mix (“Toyobo”) при следующих условиях: 95°C в течение 1 мин; затем 40 циклов при 95°С в течение 5 с и 60°С в течение 30 с. Относительные уровни экспрессии мРНК целевых генов нормализовали по мРНК GAPDH, а ген RNU6A (кодирирует малую ядерную РНК U6) использовали в качестве референс-гена для анализа экспрессии miРНК. Последовательности праймеров для количественной ПЦР показаны в табл. 1.
Таблица 1.
Последовательности праймеров для ПЦР в реальном времени
| Генa | Праймерb | Последовательность 5' → 3' |
|---|---|---|
| MIR455 | RT-праймер F-праймер R-праймер |
CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGGTGTATAT ACACTCCAGCTGGGGCAGTCCATGGGCAT TGGTGTCGTGGAGTCG |
| RNU6A | RT-праймер F-праймер R-праймер |
AACGCTTCACGAATTTGCGT CTCGCTTCGGCAGCACA AACGCTTCACGAATTTGCGT |
| RHOC | F-праймер R-праймер |
GGAGGTCTACGTCCCTACTGT CGCAGTCGATCATAGTCTTCC |
| PTEN | F-праймер R-праймер |
TTTGAAGACCATAACCCACCAC ATTACACCAGTTCGTCCCTTTC |
| GAPDH | F-праймер R-праймер |
ACAACTTTGGTATCGTGGAAGG GCCATCACGCCACAGTTTC |
Белки извлекали из клеток с использованием буфера для лизиса с помощью радиоиммунопреципитационного анализа (“Nanjing KeyGen Biotech Co., Ltd.,” Китай). Концентрацию белка определяли количественно методом Бредфорда (Beyotime Institute of Biotechnology, Китай). Используя электрофорез в 10%-ном SDS-PAGE, проводили разделение белков в образцах, каждый из которых содержал 40 мкг общего белка, затем белки переносили на PVDF-мембрану (“Osmo-nics”, США) и инкубировали ее с антителами против RhoC, PTEN или Bcl2, взятыми в разведении 1 : 1000 (“Abcam”, Великобритания), а также против каспазы-3 или β-актина (1 : 1000, “Santa Cruz Biotechnology, Inc.”, США). Вторичные антитела были конъюгированы с пероксидазой хрена (HRP; “Santa Cruz Biotechnology, Inc”). Белковые полосы детектировали с использованием набора с усиленной хемилюминесценции (ECL; “Invitrogen”, США).
Анализ роста клеток. Клетки высевали в 96-луночные планшеты в концентрации 2000 клеток/лунку в трех сериях для каждого исследуемого параметра. Клетки HepG2 соответственно трансфицировали miR-455-миметиком, miR-455-ингибитором, miR-NC, Peb-copGFP(T2A) PURO-RhoC или Peb-copGFP(T2A) PURO. Содержание клеток определяли через 0, 12, 24, 36, 48 и 72 ч с использованием набора для определения роста клеток (Cell Growth Determination Kit; “Sigma-Aldrich”/“Millipore Sigma”, США) в соответствии с инструкциями производителя. Кристаллы формазана, образованные жизнеспособными клетками, растворяли в DMSO (“Sigma-Aldrich”); оптическую плотность при 490 нм измеряли на ридере для микропланшетов (“Perlong Medical”, Китай).
Анализ включения BrdU. 5-бром-2'-дезоксиуридин (BrdU) и набор для ИФА-детекции приобретены у “Roche Diagnostics” (Германия). Синтез ДНК оценивали по включению BrdU во вновь синтезированные цепи. Клетки HepG2, трансфицированные miR-455-миметиком, miR-455-ингибитором, miR-NC, PUR-copGFP(T2A) PURO-RhoC или Peb-copGFP(T2A) PURO, помещали в 96-луночные планшеты в концентрации 1 × 103 клеток/лунка. Через 24 ч после посева начинали мечение BrdU путем добавления в культуральную среду раствора с меткой до конечной концентрации 10 мкМ. После инкубации клеток в течение 6 ч мечение останавливали и измеряли поглощение BrdU в соответствии с протоколом производителя.
Анализ апоптоза методом проточной цитометрии. После 48-ч трансфекции miR-455-миметиком, miR-455-ингибитором, miR-NC, Peb-copGFP(T2A) PURO-RhoC или Peb-copGFP(T2A) PURO анализировали апоптоз клеток HepG2, используя набор для детекции апоптоза (Apoptosis Detection Kit; “Beyotime Biotechnology”, Китай), согласно протоколу производителя. Для детекции использовали проточный цитометр (“BD Biosciences”, США) с каналом для FITC.
Статистический анализ. Данные представлены в виде “среднее значение ± стандартное отклонение (SD)”. Для сравнения двух исследуемых групп выполнен статистический анализ с использованием t-критерия Стьюдента. Различия между тремя группами проанализированы методами двустороннего дисперсионного анализа (ANOVA) и наименьшей значимой разности Фишера с использованием SPSS 19.0 (“IBM Corp.”, США). Эксперименты повторяли не менее трех раз. Статистически значимыми считались значения при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
MiR-455 подавляет пролиферацию клеток HepG2 и способствует их апоптозу
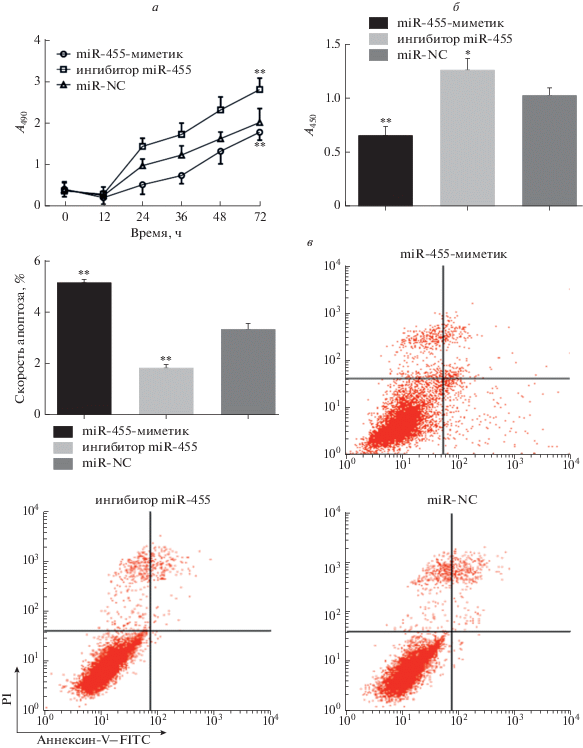
Пролиферацию клеток оценивали в клетках HepG2 после обработки их miR-455-миметиком, miR-455-ингибитором или miR-NC с помощью МТТ, анализа включения BrdU и проточной цитометрии. Результаты МТТ показали, что miR-455 ингибирует пролиферацию клеток (р < 0.01). Аналогичным образом, когда синтез ДНК измеряли по включению BrdU, обнаружено, что по сравнению с группой miR-NC miR-455-миметик существенно снижает инкорпорацию BrdU (p < 0.01), а ингибитор miR-455 в значительной степени способствовал этому процессу (p < 0.05). После трансфекции анализировали апоптоз клеток. Скорость апоптоза увеличивалась под действием miR-455-миметика (р < 0.01) (рис. 1).
Рис. 1.
Влияние miR-455 на пролиферацию и апоптоз клеток HepG2. а ‒ Пролиферацию клеток HepG2, обработанных miR-455-миметиком, miR-455-ингибитором или miR-NC, оценивали методом МТТ при длине волны 490 нм (A490) (**p < 0.01). б ‒ Влияние miR-455 на пролиферацию клеток, определенное по включению BrdU (*р < 0.05, **р < 0.01) при длине волны 450 нм (A450). в ‒ Апоптоз клеток HepG2 анализировали методом проточной цитометрии (**р < 0.01).
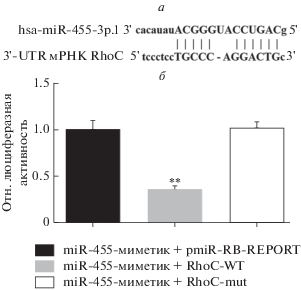
RhoC ‒ мишень miR-455
Взаимодействие между miR-455-3p.1 и мРНК RhoC анализировали методами биоинформатики и с помощью люциферазной репортерной системы. Выявлено, что miR-455-3p.1 может связываеться с 3'-UTR мРНК RhoC (рис. 2а). Люциферазная активность в клетках HepG2 человека, котрансфицированных miR-455-миметиком и вектором RhoC-WT (0.36 ± 0.004), была гораздо ниже, чем в контрольной группе (клетки, котрансфицированные miR-455-миметиком и pmiR-RB-REPORT, 1.00 ± 0.09) (р < 0.01). Однако не наблюдали достоверных различий между клетками, котрансфицированными миметиком miR-455 и RhoC-mut (1.02 ± 0.08), и контрольной группой (p > 0.05).
Рис. 2.
Анализ возможности взаимодействия между miR-455 и мРНК RhoC. а – Сайты-мишени для miR-455-3p.1, предсказанные в 3'-UTR мРНК RhoC биоинформационным анализом. б – Люциферазная активность в клетках, котрансфицированных указанными конструкциями (**р < 0.01). Результаты рассчитаны по данным 3 экспериментов.
Уровни экспрессии miR-455 и RHOC определяли после трансфекции клеток HepG2 miR-455-миметиком, miR-455-ингибитором или miR-shNC. Как показано на рис. 3а, результаты количественной ПЦР показали, что уровень miR-455 значительно повышен в клетках, трансфицированных miR-455-миметиком (5.47 ± 0.23), по сравнению с группой, трансфицированной miR-455-ингибитором (0.54 ± 0.01), и группой с miR-NC (1.00 ± ± 0.05) (р < 0.01). В то же время для экспрессии RHOC выявлена противоположная тенденция (группа miR-455-миметика 0.24 ± 0.02, группа miR-455-ингибитора 3.24 ± 0.15 и группа miR-NC 1.01 ± 0.12) (р < 0.01). Эти результаты подтверждают, что RHOC может быть мишенью miR-455.
Рис. 3.
Дифференциальная экспрессия miR-455 и генов RHOC и PTEN, BCL2, CASP3 в клетках HepG2. а – Уровни экспрессии miR-455 и RHOC в клетках, трансфицированных miR-455-миметиком, miR-455-ингибитором или miR-shNC (*p < 0.05, **p < 0.01). б – Относительная экспрессия RHOC и PTEN в клетках HepG2 после обработки Peb-copGFP(T2A) PURO-RhoC и Peb-copGFP(T2A) PURO (**p < 0.01). в – Экспрессия белков RhoC, PTEN, Bcl-2 и каспазы-3 в клетках, трансфицированных Peb-copGFP(T2A) PURO-RhoC и Peb-copGFP(T2A) PURO.
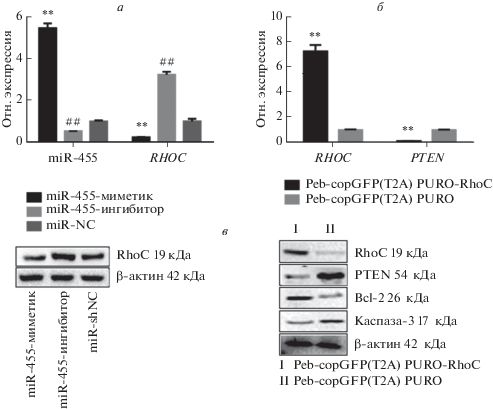
Влияние RhoC на уровни экспрессии PTEN, каспазы-3 и Bcl-2
Peb-copGFP(T2A) PURO-RhoC или Peb-copGFP(T2A) PURO были трансфицированы в клетки HepG2 и определены уровни экспрессии RHOC, PTEN, CASP3 и BCL2. Как показано на рисунках 3б и 3в, по сравнению с контрольной группой уровни мРНК RhoC (группа Peb-copGFP(T2A) PURO 1.00 ± 0.05 и группа Peb-copGFP(T2A) PURO-RhoC 7.29 ± 0.51 и) и белка в клетках HepG2 значительно повышаются после обработки PURO-RhoC Peb-copGFP(T2A) (p < 0.01). Дальнейшие эксперименты показали, что уровни мРНК PTEN (группа Peb-copGFP(T2A) PURO-RhoC 0.12 ± 0.01 и группа Peb-copGFP(T2A) PURO 1.00 ± 0.04) и уровни экспрессии белка подавлены при избыточной экспрессии RHOC. Кроме того, экспрессия каспазы-3 оказалась резко снижена, в то время как Bcl-2 значительно повышена в клетках, трансфицированных Peb-copGFP(T2A) PURO-RhoC (p < 0.01).
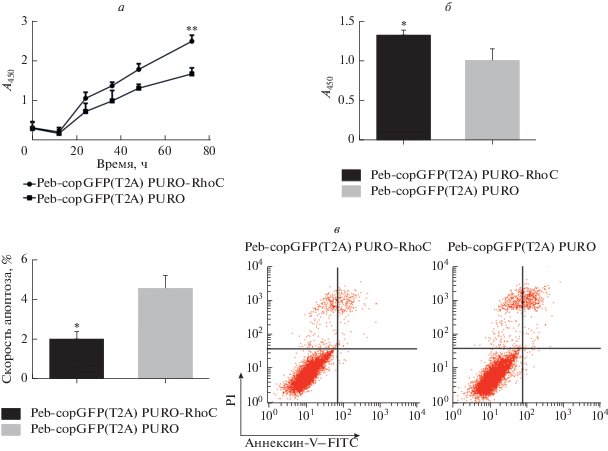
RhoC способствует пролиферации клеток HepG2 и подавляет апоптоз
Для изучения влияния RhoC на пролиферацию и апоптоз клеток HepG2 использовали МТТ, анализ включения BrdU и проточную цитометрию. Результаты представлены на рис. 4. Способность клеток к пролиферации и скорость апоптоза анализировали после избыточной экспрессии RHOC. Результаты МТТ показывают, что избыточная экспрессия RHOC способствует пролиферации клеток по сравнению с контрольной группой (р <0.01) (рис. 4а). Аналогичным образом, результаты включения BrdU показывают, что RhoC в значительной степени способствует инкорпорации BrdU, то есть сверхэкспрессия RHOC усиливает синтез ДНК в клетках HepG2 (p < 0.05) (рис. 4б). Кроме того, на основании результатов определения скорости апоптоза через 48 ч после трансфекции можно предположить, что RhoC ингибирует апоптоз клеток HepG2 (рис. 4в).
Рис. 4.
RhoC способствует пролиферации и ингибирует апоптоз клеток HepG2. а – Пролиферация клеток HepG2, обнаруженная с помощью МТТ после обработки PURO-RhoC Peb-copGFP(T2A) и PURO Peb-copGFP(T2A) при длине волны 490 нм (A490) (**p < 0.01). б – Влияние RhoC на пролиферацию клеток, определенное по включению BrdU (*p < 0.05). в – Апоптоз трансфицированных клеток HepG2 анализировали методом проточной цитометрии.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Недавно показано, что miR-455 участвует в прогрессировании таких злокачестыенных опухолей, как колоректальный рак, рак поджелудочной железы, рак легкого, гепатоцеллюлярная карцинома [4, 14–16]. В других исследованиях обнаружено, что miR-455 может действовать как опухолевый супрессор в различных раковых клетках, регулируя экспрессию генов-мишеней. Ген GATA6 (кодирует GATA-связывающий белок 6), экспрессию которого в клеточной линии CRC снижает miR-455 [6], валидирован как прямая мишень miR-455. Кроме того, miR-455-3p функционирует как опухолевый супрессор, непосредственно воздействуя на HOXB5 при прогрессировании немелкоклеточного рака легкого [15]. Вместе с тем получены данные, указывающие на то, что miR-455-3p играет роль опухолевого супрессора в случае плоскоклеточного рака пищевода путем подавления экспрессии гена FAM83F [17]. Нами показано, что miR-455 ингибирует пролиферацию и способствует апоптозу клеток HepG2. Сверхэкспрессия miR-455 снижает экспрессию RHOC, тогда как снижение уровня miR-455 приводило к усилению экспрессии RHOC. Обнаружена отрицательная корреляция между уровнями miR-455 и RhoC и еще раз доказано, что RHOC ‒ мишень miR-455. Используя последовательность miR-455-3p.1 и двойную люциферазную репортерную систему, мы показали, что эта микроРНК регулирует экспрессию генов RHOC и PTEN.
В последнее время появляется все больше исследований, где показано, что малые интерферирующие РНК (siРНК), направленные против RHOC, ингибируют пролиферацию и инвазивность клеток рака молочной железы [18]. Кроме того, miR-493 непосредственно нацеливается на RHOC, что приводит к заметному снижению экспрессии мРНК и белка RhoC. Этот эффект, в свою очередь, приводит к снижению способности к росту, инвазии и метастазированию клеток рака желудка [19]. Сверхэкспрессия miR-93-5p снижает пролиферацию, способствует остановке G1- или S-фазы и апоптозу путем нацеливания на RHOC [20]. Кроме того, PTEN представляет собой ген-супрессор опухолей, потеря функции которого, как установлено, происходит при различных новообразованиях, как доброкачественных, так и злокачественных. Во многих исследованиях подтверждено, что PTEN подавляет рост и инвазию HCC и эффективно регулирует уровни комплекса MTA1/HDAC1/NuRD, способствуя ацетилированию белка PTEN и апоптозу при HCC [21]. А повышенная экспрессия CKS2 связана с пролиферацией клеток HCC через подавление гена PTEN [22]. Однако ранее высказано предположение, что избыточная экспрессия LINC00657 подавляет пролиферацию, миграцию и инвазию клеток HCC, а также повышает содержание белка PTEN [23]. В исследованиях по каспазе-3 и Bcl-2 показано, что каспаза-3 опосредует апоптоз клеток HCC [24], а активация Bcl-2 стимулирует трансформацию клеток Bel-7402 [25]. Нами показано, что RhoC снижает экспрессию PTEN и каспазы-3 и повышает уровень Bcl-2 в клетках HepG2, а также способствует пролиферации, ингибирует апоптоз клеток HepG2, что согласуется с приведенными выше литературными данными.
Таким образом, miR-455 может воздействовать на RhoC как на мишень, тем самым подавляя пролиферацию и индуцируя апоптоз клеток HepG2 через сигнальный путь PTEN. Полученные результаты позволяют приблизиться к пониманию молекулярных механизмов прогрессирования HCC, а miR-455 рассматривать в качестве биомаркера течения этого заболевания и потенциального препарата для таргетной терапии.
Работа выполнена при финансовой поддержке фонда Программы научных исследований Комиссии здравоохранения провинции Цзилинь (Scientific Research Program of The Health Commission of Jilin Province, гранты 2015Z042, 3D5160923428 и 20150101123JC).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Mekonnen H.D., Sharma S., Shewaye A., Feld J., Lulu E. (2015) Major risk factors, clinical and laboratory characteristics of patients with hepatocellular carcinoma; a retrospective study at Tikur Anbassa hospital Addis Ababa University, Addis Ababa, Ethiopia. Ethiop. Med. J. 53(3), 127–132.
Chu Y.J., Yang H.I., Wu H.C., Lee M.H., Liu J., Wang L.Y., Lu S.N., Jen C.L., You S.L., Santella R.M., Chen C.J. (2018) Aflatoxin B1 exposure increases the risk of hepatocellular carcinoma associated with hepatitis C virus infection or alcohol consumption. Eur. J. Cancer. 94, 37–46.
Zhan T., Huang X., Tian X., Chen X., Ding Y., Luo H., Zhang Y.(2018) Downregulation of microRNA-455-3p links to proliferation and drug resistance of pancreatic cancer cells via targeting TAZ. Mol. Ther. Nucleic Acids. 10, 215–226.
Wang J., Wang Y., Sun D., Bu J., Ren F., Liu B., Zhang S., Xu Z., Pang S., Xu S. (2017) miR-455-5p promotes cell growth and invasion by targeting SOCO3 in non-small cell lung cancer. Oncotarget. 8(70), 114956–114965.
Qin L., Zhang Y., Lin J., Shentu Y., Xie X. (2016) MicroRNA-455 regulates migration and invasion of human hepatocellular carcinoma by targeting Runx2. Oncol. Rep. 36(6), 3325–3332.
Yunqi H., Fangrui Y., Yongyan Y., Yunjian J., Wenhui Z., Kun C., Min L., Xianfeng L., Caixia B. (2018) MiR-455 functions as a tumor suppressor through targeting GATA6 in colorectal cancer. Oncol. Res. https://doi.org/10.3727/096504018X15220579006875
Troiano G., Mastrangelo F., Caponio V.C.A., Laino L., Cirillo N., Lo Muzio L. (2018) Predictive prognostic value of tissue-based microRNA expression in oral squamous cell carcinoma: a systematic review and meta-analysis. J. Dental Res. 97(7), 759–766. https://doi.org/10.1177/0022034518762090
Bishop A.L., Hall A. (2000) Rho GTPases and their effector proteins. Biochem. J. 348(Pt. 2), 241–255.
Kleer C.G., van Golen K.L., Zhang Y., Wu Z.F., Rubin M.A., Merajver S.D. (2002) Characterization of RhoC expression in benign and malignant breast disease: a potential new marker for small breast carcinomas with metastatic ability. Am. J. Pathol. 160(2), 579–584.
Shikada Y., Yoshino I., Okamoto T., Fukuyama S., Kameyama T., Maehara Y. (2003) Higher expression of RhoC is related to invasiveness in non-small cell lung carcinoma. Clin. Cancer Res. 9(14), 5282–5286.
Lang S., Busch H., Boerries M., Brummer T., Timme S., Lassmann S., Aktories K., Schmidt G. (2017) Specific role of RhoC in tumor invasion and metastasis. Oncotarget. 8(50), 87364–87378.
Al-Asmari A.K., Riyasdeen A., Islam M. (2018) Scorpion Venom causes upregulation of p53 and downregulation of Bcl-xL and BID protein expression by modulating signaling proteins Erk(1/2) and STAT3, and DNA damage in breast and colorectal cancer cell lines. Integr. Cancer Ther. 17(2), 271–281. https://doi.org/10.1177/1534735417704949
Zhou X., Guo X., Chen M., Xie C., Jiang J. (2018) HIF-3alpha promotes metastatic phenotypes in pancreatic cancer by transcriptional regulation of the RhoC-ROCK1 signaling pathway. Mol. Cancer Res. 16(1), 124–134.
Chai J., Guo D., Ma W., Han D., Dong W., Guo H., Zhang Y. (2018) A feedback loop consisting of RUNX2/LncRNA-PVT1/miR-455 is involved in the progression of colorectal cancer. Am. J. Cancer Res. 8(3), 538–550.
Gao X., Zhao H., Diao C., Wang X., Xie Y., Liu Y., Han J., Zhang M. (2018) miR-455-3p serves as prognostic factor and regulates the proliferation and migration of non-small cell lung cancer through targeting HOXB5. Biochem. Biophys. Res. Commun. 495(1), 1074–1080.
Lan Y., Han J., Wang Y., Wang J., Yang G., Li K., Song R., Zheng T., Liang Y., Pan S., Liu X., Zhu M., Liu Y., Meng F., Mohsin M., Cui Y., Zhang B., Subash S., Liu L. (2018) STK17B promotes carcinogenesis and metastasis via AKT/GSK-3beta/Snail signaling in hepatocellular carcinoma. Cell Death Dis. 9(2), 236. https://doi.org/10.1038/s41419-018-0262-1
Yang H., Wei Y.N., Zhou J., Hao T.T., Liu X.L. (2017) MiR-455-3p acts as a prognostic marker and inhibits the proliferation and invasion of esophageal squamous cell carcinoma by targeting FAM83F. Eur. Rev. Med. Pharm. Sci. 21(14), 3200–3206.
Xu X.D., Shen H.B., Zhu L., Lu J.Q., Zhang L., Luo Z.Y., Zhang L., Luo Z.Y., Wu Y.Q. (2017) Anti-RhoC siRNAs inhibit the proliferation and invasiveness of breast cancer cells via modulating the KAI1, MMP9, and CXCR4 expression. Onco Targets Ther. 10, 1827–1834.
Zhou W., Zhang C., Jiang H., Zhang Z., Xie L., He X. (2015) MiR-493 suppresses the proliferation and invasion of gastric cancer cells by targeting RhoC. Iran. J. Basic Med. Sci. 18(10), 1027–1033.
Chen X., Chen S., Xiu Y.L., Sun K.X., Zong Z.H., Zhao Y. (2015) RhoC is a major target of microRNA-93-5P in epithelial ovarian carcinoma tumorigenesis and progression. Mol. Cancer. 14, 31.
Qian Y.Y., Liu Z.S., Yan H.J., Yuan Y.F., Levenson A.S., Li K. (2018) Pterostilbene inhibits MTA1/HDAC1 complex leading to PTEN acetylation in hepatocellular carcinoma. Biomed. Pharmacother. 101, 852–859.
Ji X., Xue Y., Wu Y., Feng F., Gao X. (2018) High-expressed CKS2 is associated with hepatocellular carcinoma cell proliferation through down-regulating PTEN. Pathol. Res. Pract. 214(3), 436–441.
Hu B., Cai H., Zheng R., Yang S., Zhou Z., Tu J. (2017) Long non-coding RNA 657 suppresses hepatocellular carcinoma cell growth by acting as a molecular sponge of miR-106a-5p to regulate PTEN expression. Int. J. Biochem. Cell Biol. 92, 34–42.
Liu D., Liu M., Wang W., Pang L., Wang Z., Yuan C., Liu K. (2018) Overexpression of apoptosis-inducing factor mitochondrion-associated 1 (AIFM1) induces apoptosis by promoting the transcription of caspase3 and DRAM in hepatoma cells. Biochem. Biophys. Res. Commun. 498(3), 453–457.
Zhang G., Zeng X., Zhang R., Liu J., Zhang W., Zhao Y., Zhang X., Wu Z., Tan Y., Wu Y., Du B. (2016) Dioscin suppresses hepatocellular carcinoma tumor growth by inducing apoptosis and regulation of TP53, BAX, BCL2 and cleaved CASP3. Phytomedicine. 23(12), 1329–1336.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


