Молекулярная биология, 2020, T. 54, № 2, стр. 285-292
Увеличение экспрессии мРНК и содержания актинсвязывающих белков профилина, фасцина и эзрина способствуют метастазированию немелкоклеточного рака легкого
Е. С. Колегова a, *, Г. В. Какурина a, Д. Н. Костромицкий b, А. Ю. Добродеев a, И. В. Кондакова a
a Томский национальный исследовательский медицинский центр Российской академии наук
634009 Томск, Россия
b Томский областной онкологический диспансер
634009 Томск, Россия
* E-mail: elenakolegowa@mail.ru
Поступила в редакцию 19.06.2019
После доработки 09.09.2019
Принята к публикации 17.09.2019
Аннотация
Изучено участие актинсвязывающих белков профилина, фасцина и эзрина в метастазировании немелкоклеточного рака легкого. В парных образцах опухолевой и прилежащей гистологически неизмененной ткани легкого, полученных от 46 больных, методами ПЦР в реальном времени и Вестерн-блотинга определены уровни мРНК PFN1, FSCN1 и EZR и соответствующих белков. Выявлено увеличение уровня экспрессии мРНК профилина, фасцина и эзрина при повышении содержания профилина и фасцина у больных с лимфогенными метастазами. При развитии отдаленных метастазов наблюдается повышение и уровня экспрессии мРНК, и содержания изучаемых белков. Предполагается, что эти молекулы могут служить дополнительными предикторами течения немелкоклеточного рака легкого.
ВВЕДЕНИЕ
Профилин, фасцин и эзрин входят в семейство актинсвязывающих белков, которое насчитывает около 100 членов и продолжает пополняться [1]. Эти белки специфически взаимодействуют с G- и F-актином, они регулируют структуру и динамику актинового цитоскелета, что приводит к активации клеточной подвижности ‒ нормального физиологического процесса, характерного для различных клеток, включая иммунокомпетентные и эндотелиальные клетки, фибробласты. Известно также, что клеточная подвижность играет важную роль в формировании патологических состояний, в том числе и злокачественных опухолей [2, 3]. Кроме того, актинсвязывающие белки выполняют и дополнительные функции, связанные с сигнальной трансдукцией и клеточным делением. Интересным представляется одновременное изучение актинсвязывающих белков разных функциональных групп, дополняющих работу друг друга в процессе ремоделирования цитоскелета. К таким белкам относятся профилин, фасцин и эзрин.
Профилин взаимодействует с молекулами, инициирующими полимеризацию актина, он вовлечен в каскад Rho/ROCK, регулирующий подвижность актинового цитоскелета [4]. Профилин участвует в выполнении многих важных функций, включая пролиферацию, выживаемость, эндоцитоз, сплайсинг мРНК и транскрипцию. Профилин может взаимодействовать с фактором роста сосудистого эндотелия (VEGF), что предполагает возможность его участия в ангиогенезе и опухолевом росте [5]. Однако роль профилина в канцерогенезе неоднозначна. Высокий уровень профилина может быть связан как с подавлением роста и метастазирования рака поджелудочной железы и печени [6, 7], так и с прогрессией почечноклеточного рака и плоскоклеточного рака гортани [8, 9].
Эзрин (цитовиллин, белок р81) входит в семейство эзрин–радиксин–моезин (ЭРМ), представители которого функционируют как линкеры между белками плазматической мембраны и актиновым цитоскелетом. Эзрин участвует в экспрессии мембранных белков на клеточной поверхности, мембранном транспорте и эндоцитозе [10], а также способствует метастазированию опухолей. Однако молекулярные механизмы действия эзрина до сих пор не изучены. Так, известно, что содержание эзрина повышается в ткани рака языка, поэтому этот белок рассматривается в качестве терапевтической мишени при этом виде рака [11]. На клеточных культурах рака прямой кишки показано участие эзрина в некоторых путях передачи сигнала [12, 13].
Еще один актинсвязывающий белок – фасцин, облегчает формирование пучков и ветвление F-актина [14]. Фасцин способствует нарушению межклеточных контактов и выходу опухолевых клеток во внеклеточный матрикс [15]. Уровень фасцина повышен в опухолях легкого [16], желудка [17], яичников [18]. В эксперименте на мышах показано, что ингибируя функцию фасцина, можно снизить миграцию опухолевых клеток и метастазирование [19]. Повышенный уровень фасцина рассматривается как возможный диагностический маркер тройного негативного рака молочной железы [20].
В настоящее время предпринимаются многочисленные попытки использования актинсвязывающих белков как прогностических маркеров онкологических заболеваний. Особенно актуально это для немелкоклеточного рака легкого (НМРЛ), одного из агрессивных типов рака. Пятилетняя выживаемость больных НМРЛ не превышает 55%, а наиболее частой причиной смерти оперированных больных являются гематогенные метастазы (60‒70%) [21]. Таким образом, изучение актинсвязывающих белков разной функциональной направленности позволит выявить новые механизмы, способствующие прогрессии рака легкого.
Цель нашей работы состояла в определении содержания актинсвязывающих белков (профилина, фасцина и эзрина) и экспрессии соответствующих мРНК в ткани опухоли при прогрессии НМРЛ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В исследование вошли 46 пациентов с морфологически верифицированным диагнозом НМРЛ, не получавших неоадъювантную химиотерапию. Анализировали ткань первичной опухоли и прилежащей к опухоли неизмененной ткани легкого. Весь материал проходил гистологическую верификацию и был охарактеризован в соответствии с TNM-классификацией седьмого пересмотра (версия 2009 года). Клинические характеристики образцов представлены в табл. 1. Образцы тканей замораживали в жидком азоте и хранили при –80°С (образцы, предназначенные для выделения нуклеиновых кислот, хранили в RNAlater (“Thermo Fisher Scientific”, США)). Определяли уровень экспрессии мРНК и содержание профилина, фасцина и эзрина в образцах.
Таблица 1.
Клинические характеристики образцов немелкоклеточного рака легкого
| Клинико-патологический параметр | Показатель | Число случаев (%) |
|---|---|---|
| Возраст | 50–59 лет | 14 (30.4) |
| 60–69 лет | 30 (65.2) | |
| 70‒79 лет | 2 (4.4) | |
| Пол | Мужчины | 33 (72.0) |
| Женщины | 13 (28.0) | |
| Размер опухоли (Т) | T2N0‒2M0 | 26 (56.5) |
| T3N0‒2M0 | 20 (43.5) | |
| Лимфогенные метастазы (N) | T2‒3N0M0 | 15 (32.6) |
| T2‒3N1‒2M0 | 31 (67.4) | |
| Гематогенные метастазы в отдаленные сроки | Есть | 13 (28.3) |
| Нет | 33 (71.7) | |
| Гистологический тип опухоли | Плоскоклеточный | 17 (37.0) |
| Аденокарцинома | 29 (63.0) |
Получение осветленных гомогенатов. Замороженную ткань (100 мг) гомогенизировали в ультразвуковом гомогенизаторе SONOPULS mini20 (“Bandelin”, ФРГ) в 300 мкл 50 мМ Трис-HCl-буфера (pH 7.5), содержащего 2 мМ АТР, 5 мМ хлорид магния, 1 мМ дитиотреитол, 1 мМ EDТА и 100 мМ хлорид натрия. Гомогенат центрифугировали в течение 60 мин при 10 000 g и 4°С. Содержание суммарного белка в надосадочной жидкости (осветленный гомогенат) определяли по методу Лоури [22].
Определение содержания актинсвязывающих белков. Уровень профилина, фасцина и эзрина оценивали методом Вестерн-блотинга. Образцы, содержащие по 20 мкг суммарного белка, разделяли с помощью электрофореза в вертикальном 10%-ном денатурирующем полиакриламидном геле в Трис-глициновом буфере при 200 В и 400 мА, а затем переносили на PVDF-мембрану (“Millipore”, США) в Трис-глициновом буфере, содержащем 10% этанола, при 100 В и 350 мА, в течение 1 ч. Продукцию белков анализировали с помощью первичных антител к профилину, фасцину, эзрину и β-актину (“Cell Signaling Technology”, США). В качестве вторичных антител использовали конъюгированные с пероксидазой хрена антитела козы против иммуноглобулинов мыши и антитела лошади против иммуноглобулинов кролика (“Cell Signaling Technology”). Для связывания антител и промывки мембран использовали полуавтоматизированный прибор iBind Western System (“Thermo Fisher Scientifiс”). Затем мембрану обрабатывали с помощью системы хемилюминесцентной детекции ECL (“GE Healthcare”, Великобритания). Иммунодетекцию проводили с помощью гель-документирующей системы ChemiDoc Touch Imaging System (“Bio-Rad”, США). Интенсивность полос оценивали с помощью компьютерной программы “Image Lab”. Данные нормировали по β-актину. Результаты выражали как соотношение содержания изучаемого белка в опухоли и неизмененной ткани.
Выделение мРНК и получение кДНК. РНК выделяли с использованием набора diaGene (“Qiagen”, США) согласно рекомендациям производителя. Концентрацию и чистоту РНК оценивали спектрофотометрически (NanoDrop-2000, “Thermo Fisher Scientific”). Концентрация РНК составила от 80 до 250 нг/мкл, А260/А280 = 1.95‒2.05; А260/А230 = 1.90‒2.31. кДНК получали с помощью набора РеалБест Мастер микс ОТ (“Вектор-Бест”, Новосибирск). Реакцию проводили в течение 30 мин при 42оС, затем инактивировали обратную транскриптазу при 95оС в течение 2 мин. Реакционную смесь, содержащую кДНК (3 мкл), сразу использовали в качестве матрицы для полимеразной цепной реакции (ПЦР).
Проведение ПЦР в реальном времени. Количественную ПЦР в режиме реального времени проводили на амплификаторе Rotor-Gene 6000 (“Corbett Research”, Австралия). Смесь для ПЦР (“Биолабмикс”, Новосибирск) имела конечный объем 25 мкл и содержала: БиоМастер HS-qPCR (100 мМ Трис-HCl ( рН 8.5), 100 мМ КCl, 0.4 мМ dNTP, 3 мМ MgCl2, 0.06 ед. акт./мкл Taq-ДНК-полимеразы, 0.025% Tween-20, стабилизаторы HS-Taq-ДНК-полимеразы, SYBR Green 1 и инертный краситель) 12.5 мкл, по 1 мкл прямого и обратного праймеров, 3 мкл кДНК-матрицы (≈20 нг/мкл) и 7.5 мкл деионизованной воды. В качестве контрольного гена использовали ген GAPDH (глицеральдегид-3-фосфат-дегидрогеназа). Уровень экспрессии каждого целевого гена нормировали по экспрессии гена GAPDH по методу Pfaffl [23]. Использовали следующий протокол ПЦР: предварительный прогрев при 95°С в течение 6 мин; затем 40 основных циклов ‒ денатурация при 95°С, 10 с; отжиг и элонгация ‒ 62°С, 35 с. Результаты выражали в условных единицах относительно экспрессии целевого гена в неизмененных тканях. Праймеры подбирали с помощью программы Vector NTI Advance 11.5 и базы данных NCBI:
PFN1 (F: 5′-TGGAGCAAACCCTACCCTT-3′; R: 5′-AGCCCAGACACCGAACTTT-3′);
FSCN1 (F: 5′-TCAGAGCTCTTCCTCATGAA- GCT-3′; R: 5′-GTCCAGTATTTGCCTGTGGA-GTC-3′);
EZR (F: 5′-CTTGATGTGATGTGGCAGGA-3′; R: 5′-GGAATGAGTGGGCGGAA-3′);
GAPDH (F: 5′-GGAAGTCAGGTGGAGCGA-3′; R: 5′-GCAACAATATCCACTTTACCAGA-3′).
Специфичность реакции для каждого образца и каждого гена контролировали после каждой ПЦР при помощи автоматического электрофореза на приборе 2200 TapeStation (“Agilent Technologies”, США) и набора R6K ScreenTape (“Agilent Technologies”). Использовали также отрицательный контроль: без матрицы + смесь для ПЦР + + праймеры; матрица + смесь для ПЦР без праймеров; РНК + ПЦР-смесь + праймеры. Качество РНК оценивали с помощью показателя RIN (RNA Integrity Number), варьирующего в исследованных образцах от четырех до шести. Эффективность реакции со всеми праймерами варьировала от 1.8 до 1.9.
Статистическая обработка. Данные обрабатывали с использованием компьютерной программы “IBM SPSS Statistics 20”. Значимость различий оценивали с помощью критерия Манна‒Уитни. Значимость показателей в развитии гематогенных метастазов проверяли с помощью ROC-анализа. Различия считали значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
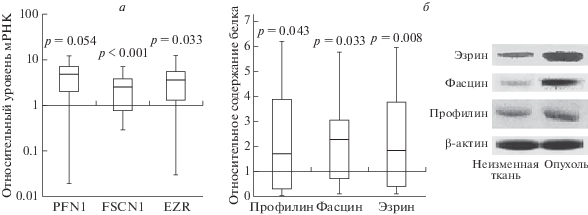
На первом этапе работы определен уровень экспрессии мРНК и содержание профилина, фасцина и эзрина в ткани НМРЛ и в неизмененной ткани легкого. Оказалось, что экспрессия мРНК и содержание профилина, фасцина и эзрина в опухоли были значимо выше, чем в неизмененных тканях легкого. Повышение уровня мРНК фасцина выявлено в 80% образцов НМРЛ, тогда как экспрессия мРНК профилина и фасцина была повышена в образцах НМРЛ, полученных от 60‒61% пациентов (рис. 1а). Увеличение содержания белковых продуктов изучаемых генов в опухоли по сравнению с неизмененной тканью подтверждено методом Вестерн-блотинга (рис. 1б).
Рис. 1.
Экспрессия мРНК (а) и содержание (б) профилина (PFN1), фасцина (FSCN1) и эзрина (EZR) в ткани первичной опухоли по сравнению с неизмененной тканью.
Исходя из предположения, что актинсвязывающие белки могут регулировать подвижность опухолевых клеток и, следовательно, участвовать в метастазировании, сначала оценили экспрессию мРНК и содержание профилина, фасцина и эзрина в ткани первичной опухоли при лимфогенном метастазировании НМРЛ. Обнаружено значимое повышение уровня мРНК генов PFN1, FSCN1 и EZR в 1.8, 2.3 и 4.5 раза соответственно в опухолях с поражением лимфатических узлов (Т2-3N1-2M0) по сравнению с опухолями без лимфогенных метастазов (Т2-3N0M0) (рис. 2а). При этом содержание профилина и фасцина также увеличивалось примерно в 2 раза, в то время как уровень эзрина оставался неизменным (рис. 2б, рис. 3а).
Рис. 2.
Относительный уровень мРНК (а) и содержание (б) профилина (PFN1), фасцина (FSCN1) и эзрина (EZR) в ткани первичной опухоли в зависимости от присутствия лимфогенных метастазов.
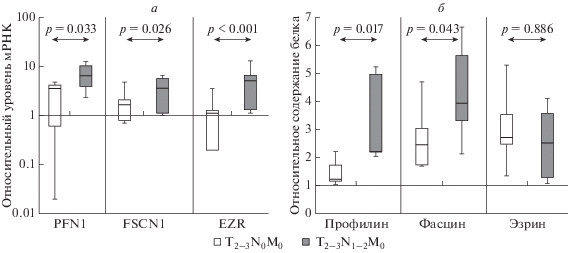
Рис. 3.
Вестерн-блот-анализ продукции профилина, фасцина и эзрина в ткани первичной опухоли в зависимости от наличия лимфогенных (а) и гематогенных (б) метастазов.

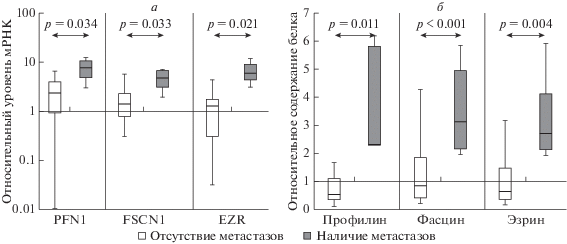
Далее мы оценили содержание и уровень мРНК актинсвязывающих белков при гематогенном метастазировании опухолей. Отмечено увеличение как содержания белков, так и экспрессии соответствующих мРНК в ткани первичной опухоли при удаленном метастазировании. Так, в ткани первичной опухоли пациентов, у которых в течение 2 лет после операции развились отдаленные метастазы, наблюдалось увеличение в 4.7 раза содержания профилина при росте экспрессии его мРНК в 3.3 раза. Содержание фасцина выросло в 3.8 раза при увеличении уровня его мРНК в 3.3 раза. Содержание эзрина и относительная экспрессия его мРНК увеличились в 4.5 раза по сравнению с пациентами без гематогенных метастазов. (рис. 3б, рис. 4б).
Рис. 4.
Относительные экспрессия мРНК (а) и содержание (б) профилина (PFN1), фасцина (FSCN1) и эзрина (EZR) в ткани первичной опухоли в зависимости от наличия гематогенных метастазов.
Значимость вклада данных белков и их мРНК в гематогенное метастазирование НМРЛ подтверждено с использованием ROC-анализа (табл. 2). Выявлена достаточно сильная связь всех переменных с развитием отдаленных метастазов (AUC > > 0.70, р < 0.05). Наибольшее влияние на развитие отдаленных метастазов при НМРЛ оказывал фасцин: как содержание этого белка, так и уровень его мРНК вносят наибольший вклад в гематогенное метастазирование (AUC = 0.89, р < 0.001 и AUC = 0.90, р < 0.001 соответственно). Чувствительность и специфичность использованных показателей также были достаточно высокими (более 80%).
Таблица 2.
Значимость уровня экспрессии мРНК и содержания профилина (PFN1), фасцина (FSCN1) и эзрина (EZR) в ткани первичной опухоли в развитии гематогенных метастазов
| Переменная | Площадь под кривой, AUC | Стандартная ошибка AUC | Значимость, р | 95%-ный доверительный интервал | |
|---|---|---|---|---|---|
| нижняя граница | верхняя граница | ||||
| мРНК PFN1 | 0.72 | 0.07 | 0.015 | 0.54 | 0.80 |
| Профилин | 0.73 | 0.10 | 0.031 | 0.53 | 0.92 |
| мРНК FSCN1 | 0.90 | 0.04 | <0.001 | 0.82 | 0.92 |
| Фасцин | 0.89 | 0.05 | <0.001 | 0.78 | 0.99 |
| мРНК EZR | 0.79 | 0.05 | <0.001 | 0.68 | 0.90 |
| Эзрин | 0.80 | 0.10 | 0.004 | 0.62 | 0.99 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Поиск информативных маркеров раннего выявления прогрессии НМРЛ – важная задача молекулярной онкологии. Изучено большое количество белков, в том числе и актинсвязывающих, потенциально ассоциированных с прогрессией рака легкого. В качестве возможного прогностического маркера НМРЛ ранее рассматривали достаточно хорошо изученный белок фасцин [16, 24]. На клеточных культурах рака легкого показана значимость уровня профилина для метастатического роста опухолей [25]. Опубликованы данные о корреляции уровня фосфорилированной формы эзрина с выживаемостью больных НМРЛ. Повышенная продукция этого белка на ранней стадии опухолевого процесса связана с низкой выживаемостью пациентов [26].
Нами одновременно определено содержание актинсвязывающих белков профилина, фасцина и эзрина и уровня экспрессия соответствующих мРНК в ткани НМРЛ, оценена их связь с лимфогенным и гематогенным метастазированием опухолей.
Наблюдаемое нами повышение уровня экспрессии мРНК и содержания соответствующих актинсвязывающих белков при прогрессии НМРЛ согласуется с опубликованными данными [27, 28]. Распространение клеток НМРЛ на регионарные лимфоузлы ассоциировано с высоким уровнем мРНК генов PFN1, FSCN1 и EZR на фоне высокого содержания белков профилина и фасцина, при этом содержание эзрина значимо не изменяется. По-видимому, в опухолевой клетке включаются механизмы, связанные с нарушением трансляции и посттрансляционной модификации эзрина, что приводит к снижению содержания этого белка. Например, на клеточных линиях остеосаркомы показано, что уровень эзрина может регулироваться микроРНК-96 с помощью РНК-интерференции [29]. Кроме того, эзрин, как и другие клеточные белки, может подвергаться деградации ферментами, входящими в состав системы контроля качества клеточного протеома [30–32].
Повышение и уровня экспрессии мРНК, и содержания профилина, фасцина и эзрина наблюдается при развитии отдаленных метастазов НМРЛ. Известно, что морфологические изменения злокачественных опухолей повышают миграционную способность опухолевых клеток и приводят к инвазии и метастазированию [1]. Логично, что гематогенное метастазирование злокачественных опухолей сопровождается значимыми изменениями в содержании и уровне экспрессии мРНК актинсвязывающих белков.
Стоит отметить, что с помощью ROC-анализа выявлена достаточно сильная связь между содержанием профилина, фасцина и эзрина и уровнем экспрессии их мРНК в опухолевой ткани и развитием отдаленных метастазов. Эти результаты указывают на возможность использования данных молекул в качестве предикторов течения НМРЛ. Нужно отметить, что фасцин уже предлагали в качестве прогностического маркера НМРЛ, причем можно использовать как экспрессию его мРНК [33], так и содержание самого белка, определенное с помощью иммуноферментного анализа [24].
Таким образом, нами изучено соотношение между экспрессией генов, кодирующих актинсвязывающие белки, и содержанием их белковых продуктов при лимфогенном и гематогенном метастазировании НМРЛ. Можно предположить, что изменение уровней мРНК и содержания актинсвязывающих белков профилина, фасцина и эзрина в определенной степени характеризуют особенности функционирования опухолевых клеток при раке легкого и указывают на их роль в метастазировании. Кроме того, полученные нами результаты обосновывают возможность использования актинсвязывающих белков профилина, фасцина и эзрина как прогностических маркеров НМРЛ.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований и администрации Томской области в рамках научного проекта № 18-415-703003 р_мол_а.
Работа проведена с соблюдением принципов добровольности и конфиденциальности в соответствии с “Основами законодательства РФ об охране здоровья граждан” (Указ Президента 39 РФ от 24.12.93 № 2288). Получено разрешение Этических комитетов Томского национального исследовательского медицинского центра РАН и Томского областного онкологического диспансера и информированное согласие каждого пациента.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Kohli P., Höhne M., Jüngst C., Bertsch S., Ebert L.K., Schauss A.C., Benzing T., Rinschen M.M., Schermer B. (2017) The ciliary membrane-associated proteome reveals actin-binding proteins as key components of cilia. EMBO Rep. 18(9), 1521–1535.
Бочкарева Н.В., Кондакова И.В., Коломиец Л.А. (2011) Роль актинсвязывающих белков в клеточном движении в норме и при опухолевом росте. Молекуляр. медицина. 6, 14–18.
Кондакова И.В., Юнусова Н.В., Спирина Л.В., Коломиец Л.А., Виллерт А.Б. (2014) Связь активности внутриклеточных протеиназ с содержанием локомоторных белков в тканях первичных опухолей и метастазах при раке яичников. Биоорган. химия. 40(6), 735–742.
Alkam D., Feldman E.Z., Singh A., Kiaei M. (2017) Profilin1 biology and its mutation, actin(g) in disease. Cell. Mol. Life Sci. 74(6), 967–981.
Pronto-Laborinho A.C., Pinto S., de Carvalho M. (2014) Roles of vascular endothelial growth factor in amyotrophic lateral sclerosis. Biomed. Res. Int. 947513.
Shen K., Xi Z., Xie J., Wang H., Xie C., Lee C.S., Fahey P., Dong Q., Xu H. (2016) Guttiferone K suppresses cell motility and metastasis of hepatocellular carcinoma by restoring aberrantly reduced profilin 1. Oncotarget. 7(35), 56650–56663.
Schoppmeyer R., Zhao R., Cheng H., Hamed M., Liu C., Zhou X., Schwarz E.C., Zhou Y., Knörck A., Schwär G., Ji S., Liu L., Long J., Helms V., Hoth M., Yu X., Qu B. (2017) Human profilin 1 is a negative regulator of CTL mediated cell-killing and migration. Eur. J. Immunol. 47(9), 1562–1572.
Karamchandani J.R., Gabril M.Y., Ibrahim R., Scorilas A., Filter E., Finelli A., Lee J.Y., Ordon M., Pasic M., Romaschin A.D., Yousef G.M. (2015) Profilin-1 expression is associated with high grade and stage and decreased disease-free survival in renal cell carcinoma. Hum. Pathol. 46(5), 673–680.
Li L., Zhang Z., Wang C., Miao L., Zhang J., Wang J., Jiao B., Zhao S. (2014) Quantitative proteomics approach to screening of potential diagnostic and therapeutic targets for laryngeal carcinoma. PLoS One. 9(2), e90181.
Kawaguchi K., Yoshida S., Hatano R., Asano S. (2017) Pathophysiological roles of ezrin/radixin/moesin proteins. Biol. Pharm. Bull. 40(4), 381–390.
Saito S., Yamamoto H., Mukaisho K., Sato S., Higo T., Hattori T., Yamamoto G., Sugihara H. (2013) Mechanisms underlying cancer progression caused by ezrin overexpression in tongue squamous cell carcinoma. PLoS One. 8(1), e54881.
Iessi E., Zischler L., Etringer A., Bergeret M., Morlé A., Jacquemin G., Morizot A., Shirley S., Lalaoui N., Elifio-Esposito S.L., Fais S., Garrido C., Solary E., Micheau O. (2015) Death receptor-induced apoptosis signalling regulation by ezrin is cell type dependent and occurs in a DISC-independent manner in colon cancer cells. PLoS One. 10(5), e0126526.
Haase G., Gavert N., Brabletz T., Ben-Ze’ev A. (2016) The Wnt target gene L1 in colon cancer invasion and metastasis. Cancers (Basel). 8(5), E48.
Papaspyrou K., Brochhausen C., Schmidtmann I., Fruth K., Gouveris H., Kirckpatrick J., Mann W., Brieger J. (2014) Fascin upregulation in primary head and neck squamous cell carcinoma is associated with lymphatic metastasis Oncol. Lett. 7(6), 2041–2046.
Karasavvidou F., Barbanis S., Pappa D., Moutzouris G., Tzortzis V., Melekos M.D., Koukoulis G. (2008) Fascin determination in urothelial carcinomas of the urinary bladder: a marker of invasiveness Arch. Pathol. Lab. Med. 132(12), 1912–1915.
Zhao W., Gao J., Wu J., Liu Q.H., Wang Z.G., Li H.L., Xing L.H. (2015) Expression of Fascin-1 on human lung cancer and paracarcinoma tissue and its relation to clinicopathological characteristics in patients with lung cancer. Onco Targets Ther. 8, 2571–2576.
Hashimoto Y., Shimada Y., Kawamura J., Yamasaki S., Imamura M. (2004) The prognostic relevance of fascin expression in human gastric carcinoma. Oncology. 67(3‒4), 262–270.
El-Balat A., Arsenic R., Sänger N., Karn T., Becker S., Holtrich U., Engels K. (2016) Fascin-1 expression as stratification marker in borderline epithelial tumours of the ovary. J. Clin. Pathol. 69(2), 142–148.
Han S., Huang J., Liu B., Xing B., Bordeleau F., Reinhart-King C.A., Li W., Zhang J.J., Huang X.Y. (2016) Improving fascin inhibitors to block tumor cell migration and metastasis. Mol. Oncol. 10(7), 966–980.
Wang C.Q., Tang C.H., Chang H.T., Li X.N., Zhao Y.M., Su C.M., Hu G.N., Zhang T., Sun X.X., Zeng Y., Du Z., Wang Y., Huang B.F. (2016) Fascin-1 as a novel diagnostic marker of triple-negative breast cancer. Cancer Med. 5(8), 1983–1988.
Каприн А.Д., Старинский В.В., Петрова П.А. (2018) Злокачественные новообразования в России в 2016 году (заболеваемость и смертность). М.: МНИОИ им. Герцена ‒ филиал ФГБУ “НМИРЦ” Минздрава России.
Lowry O.H., Rosenbrough N.J., Randall R.J. (1951) Protein measurement with the folin reagent. J. Biol. Chem. 193, 265‒275.
Pfaffl M.W. (2001) A new mathematical model for relative quantification in real-time RT-PCR. Nucl. Acids Res. 29(9), 45‒51.
Yang L., Teng Y., Han T.P., Li F.G., Yue W.T., Wang Z.T. (2017) Clinical significance of fascin-1 and laminin-5 in non-small cell lung cancer. Genet. Mol. Res. 16(2), gmr16029617.
Ali M., Heyob K., Jacob N.K., Rogers L.K. (2016) Alterative expression and localization of profilin 1/VASPpS157 and cofilin 1/VASPpS239 regulates metastatic growth and is modified by DHA supplementation. Mol. Cancer Ther. 15(9), 2220‒2231.
Jin T., Jin J., Li X., Zhang S., Choi Y.H., Piao Y., Shen X., Lin Z. (2014) Prognostic implications of ezrin and phosphorylated ezrin expression in non-small cell lung cancer. BMC Cancer. 14, 191.
Izdebska M., Zielińska W., Grzanka D., Gagat M. (2018) The role of actin dynamics and actin-binding proteins expression in epithelial-to-mesenchymal transition and its association with cancer progression and evaluation of possible therapeutic targets. Biomed. Res. Int. 4578373.
Clucas J., Valderrama F. (2014) ERM proteins in cancer progression. J. Cell Sci. 127(Pt 2), 267–275.
Yao Q., Pei Y., Zhang X., Xie B. (2018) MicroRNA-96 acts as a tumor suppressor gene in human osteosarcoma via target regulation of ezrin. Life Sci. 203, 1–11.
Колегова Е.С., Кондакова И.В., Завьялов А.А. (2016) Малые белки теплового шока и убиквитин-протеасомная система при злокачественных опухолях. Вопросы онкологии. 3, 401–405.
Ротанова Т.В., Мельников Э.Э. (2008) АТР-зависимые протеиназы и протеолитические комплексы внутриклеточной деградации белков. Биомед. химия. 54(5), 512–530.
McRobert E.A., Young A.N., Bach L.A. (2012) Advanced glycation end-products induce calpain-mediated degradation of ezrin. FEBS J. 279(17), 3240–3250.
Luo A., Yin Y., Li X., Xu H., Mei Q., Feng D. (2015) The clinical significance of FSCN1 in non-small cell lung cancer. Biomed. Pharmacother. 73, 75‒79.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


