Молекулярная биология, 2020, T. 54, № 2, стр. 293-299
Ингибирование нерецепторной тирозинкиназы JAK2 снижает рост клеток нейробластомы и усиливает действие доксорубицина
Т. Д. Лебедев a, Э. Р. Вагапова a, О. О. Асташкова a, П. В. Спирин a, В. С. Прасолов a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: prassolov45@mail.ru
Поступила в редакцию 12.09.2019
После доработки 12.09.2019
Принята к публикации 19.09.2019
Аннотация
Разработка новых подходов к противоопухолевой терапии, действенной при различных типах злокачественных заболеваний, является актуальной проблемой современной онкологии. В настоящей работе оценена эффективность подавления роста клеток нейробластомы, рака молочной железы, немелкоклеточного рака легкого и глиобластомы ингибиторами Янус-киназы 2 (Janus kinase 2, JAK2). Показано, что к действию AG490, ингибитора киназы JAK2, наиболее чувствительны клетки нейробластомы и глиобластомы. Эти данные подтверждены анализом представленных в базах данных результатов действия другого ингибитора киназы JAK2 (AZ-960) на различные линии злокачественных клеток. Определение уровней экспрессии рецепторов, которые могут активировать JAK2 в исследуемых клеточных линиях, показывает, что чувствительность клеток к действию AG490 может опосредоваться рецепторами IL6-R, IL11-R и CSF1-R. Применение AG490 усиливает действие доксорубицина на клетки нейробластомы. Полученные нами данные свидетельствуют о возможности использования ингибиторов JAK2 в терапии нейробластом, в том числе в сочетании с доксорубицином.
ВВЕДЕНИЕ
Факторы роста и цитокины, стимулирующие рост, миграцию и выживание злокачественных клеток, играют важную роль в прогрессии онкологических заболеваний. Сверхэкспрессия определенного набора рецепторов факторов роста и цитокинов характерна для различных злокачественных опухолей. Хотя действие многих таргетных противоопухолевых препаратов направлено на ингибирование таких рецепторов, в последнее время все больше внимания уделяется ингибиторам внутриклеточных киназ ‒ основных регуляторов передачи сигналов от поверхностных рецепторов. К таким киназам относятся белки, входящие в сигнальные каскады PI3K/AKT, MAPK/ERK, mTOR, SRC, JNK и JAK/STAT. Активность многих из этих киназ повышена в озлокачествленных клетках.
В отличие от таргетных препаратов, действующих на определенные клеточные рецепторы, ингибиторы внутриклеточных киназ могут воздействовать на более широкий спектр опухолей. Роль таких внутриклеточных киназ, как PI3K, AKT, MEK1/2, ERK1/2 и mTOR, в пролиферации и выживании злокачественных клеток различной природы изучена достаточно подробно [1]. Однако роль сигнального каскада JAK/STAT, участвующего в регуляции пролиферации и апоптоза, хорошо изучена только на модели гемопоэза [2]. Мутации в гене JAK2-киназы играют ключевую роль в развитии миелопролиферативных заболеваний, в то время как участие этой киназы в патогенезе солидных опухолей изучено недостаточно.
Известно, что ряд клеточных рецепторов, экспрессия которых повышена во многих опухолях, активируют преимущественно сигнальный путь JAK/STAT. Это рецепторы интерлейкинов 6 и 11 (IL6-R и IL11-R), эритропоэтина (Epo-R), тромбопоэтина (Mpl), макрофагального колониестимулирующего фактора (CSF1-R) и инсулиноподобного фактора роста 1 (IGF1-R) [3‒8].
Основная цель нашей работы состояла в выявлении типов солидных опухолей, потенциально чувствительных к подавлению активности киназы JAK2. Мы использовали панель злокачественных клеток, в которую вошли клетки нейробластомы и глиобластомы, рака молочной железы и легкого. Определили в них профиль экспрессии рецепторов, чувствительных к ингибированию JAK2, проанализировали уровень IL6-R, IL11-R, Epo-R, Mpl, CSF1-R и IFG1-R. Оценили также эффективность совместного применения AG490 ‒ ингибитора JAK2, и такого известного противоопухолевого препарата, как доксорубицин.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культуры клеток и противоопухолевые препараты. Перевиваемые клетки нейробластомы SH-SY5Y и LAN-1 культивировали в среде RPMI-1640 с добавлением 10% эмбриональной сыворотки крупного рогатого скота (FBS), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 1 мМ пирувата натрия, 2 мМ L-глутамина при 37°C и 5% CO2. Перевиваемые клетки рака молочной железы SK-BR-3 и MCF-7, глиобластомы LN-18 и немелкоклеточного рака легкого H1299 культивировали в среде DMEM с добавлением 10% FBS, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 1 мМ пирувата натрия, 2 мМ L-глутамина при 37°C и 5% CO2 (все реактивы производства “Gibco”, “Thermo Fisher Scientific”, США). Все клеточные линии подарены Heinrich-Pette Institute ‒ Leibniz Institute for Experimental Virology (Гамбург, Германия). Все линии клеток протестированы на контаминацию микоплазмой. Ингибитор киназы JAK2 (“Sigma-Aldrich”, США) AG490 растворяли в диметилсульфоксиде (ДМСО) и хранили при –20°C. Доксорубицин (“Sigma-Aldrich”) растворяли в воде и хранили при –20°C.
Измерение количества живых клеток и расчет IC50. В экспериментах по измерению скорости роста клеток в присутствии ингибитора JAK2 и доксорубицина клетки SH-SY5Y (15 × 103 клеток/см2), LAN-1 (5 × 103 клеток/см2), SK-BR-3 (1 × 104 клеток/см2), MCF-7 (1 × 104 клеток/см2) и LN18 (5 × × 103 клеток/см2) высевали на 48-луночные планшеты за день до добавления ингибиторов. Количество клеток, окрашенных трипановым синим, подсчитывали в камере Нойбауэра (“Thermo Fisher Scientific”). Клетки подсчитывали с помощью светового микроскопа согласно протоколу изготовителя счетной камеры. Мертвые клетки, окрашенные трипановым синим, не учитывали. Каждый эксперимент проводили минимум 2 раза по три повтора в каждом. Значения IC50 AG490 и доксорубицина рассчитывали по кривым доза‒эффект с помощью нелинейной регрессии в программе GraphPad Prism 8. Кривые доза‒эффект строили в логарифмической шкале (по концентрации препарата), а затем проводили аппроксимацию кривой с переменным наклоном (по четырем параметрам).
Количественная ПЦР в реальном времени. РНК выделяли из 500 000 клеток с использованием TRIzol (“Thermo Fisher Scientific”) в соответствии с протоколом производителя. Концентрацию и качество РНК определяли на спектрофотометре (NanoDrop). РНК (2‒3 мкг) использовали для синтеза кДНК с помощью набора для обратной транскрипции Revert Aid RT Reverse Transcription Kit (“Thermo Fisher Scientific”). ПЦР в реальном времени проводили в смеси с флуоресцентным красителем Maxima SYBR Green Supermix (“Thermo Fisher Scientific”) на амплификаторе CFX96 Real-Time System (“Bio-Rad”, США). Экспрессию целевых генов нормировали по экспрессии гена домашнего хозяйства GAPDH в каждой пробе. Число циклов Ct и относительный уровень экспрессии генов определяли с использованием программного обеспечения CFX Manager 3.1. Каждое измерение проводили не менее 2 раз в трех повторностях. Использовали следующие праймеры: GAPDH пр1 GAGCCCGCAGCCTCCCGCT; GAPDH пр2 GCGCCCAATACGACCAAATC; EPOR пр1 CATCCTGACGCTCTCCCTCA; EPOR пр2 GCCTTCAAACTCGCTCTCTG; IL6R пр1 TCACAACATGGATGGTCAAGGA; IL6R пр2 TGGATTCTGTCCAAGGCGTG; IL11RA пр1 TCCGTGAAGCTGTGTTGTCC; IL11RA пр2 GTTCATGCCCTAGCCCAGAG; MPL пр1 GCAGCAACAGGACCATGCTA; MPL пр2 TGACTTGAAGTGGCAGCGAG; CSF1R пр1 GGTGGCAGGAAGGTGATGTC; CSF1R пр2 ATTGCGAGCTTGGTGTTGTTG.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
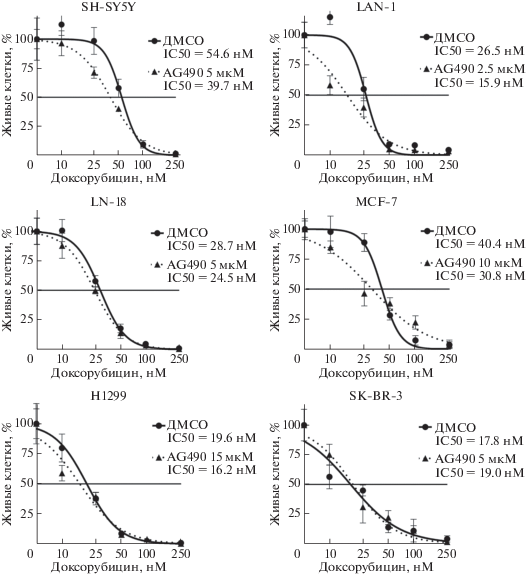
Типы злокачественных клеток, наиболее чувствительных к ингибированию киназы JAK2, определяли по величине IC50 препарата AG490 (специфичного ингибитора JAK2). Использовали шесть линий клеток различного происхождения: H1299 (немелкоклеточный рак легкого), LN-18 (глиобластома), MCF-7 и SK-BR-3 (рак молочной железы), SH-SY5Y и LAN-1 (нейробластома). IC50 AG490 для каждой клеточной линии рассчитывали, определяя зависимость количества живых клеток от концентрации добавленного препарата. Количество живых клеток подсчитывали через 96 ч после добавления к культивируемым клеткам AG490 в различных концентрациях (от 2.5 до 20 мкМ).
Рис. 1.
Зависимость количества живых клеток (в процентах) от концентрации AG490. За 100% принято количество живых клеток, обработанных только ДМСО.
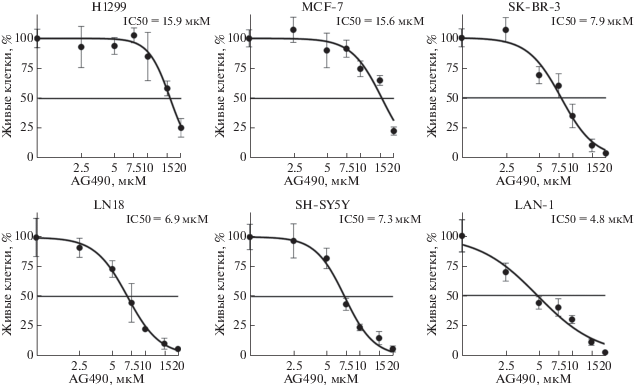
По чувствительности к AG490 клеточные линии можно разделить на две группы: более (IC50 < 8 мкМ) и менее (IC50 > 5 мкМ) чувствительные (pис. 1). К первой группе относятся клетки обеих линий нейробластомы (LAN-1 и SH-SY5Y), глиобластомы LN-18 и клетки одной из линий рака молочной железы SK-BR-3. Клетки немелкоклеточного рака легкого H1299, а также второй клеточной линии рака молочной железы MCF-7 оказались гораздо менее чувствительными к AG490. В целом, можно заключить, что злокачественные клетки нейрального происхождения (нейробластома и глиобластома) более чувствительны к ингбированию JAK2, чем клетки эпителиального происхождения. Анализ данных, депонированных в базу Genomics of Drug Sensitivity in Cancer (GDSC), также показал, что среди клеточных линий злокачественных солидных опухолей к ингибированию JAK2 наиболее чувствительны клетки нейробластом и глиобластом (рис. 2) [9].
Рис. 2.
Величина IC50 (натуральный логарифм) ингибитора JAK2 AZ-960 для клеточных линий различного происхождения согласно базе данных Genomics of Drug Sensitivity in Cancer. BRCA ‒ рак молочной железы, OV ‒ рак яичника, GBM ‒ глиобластома, NB ‒ нейробластома, NSCLC ‒ немелкоклеточный рак легкого, SCLC ‒ мелкоклеточный рак легкого, SKCM ‒ меланома, COREAD ‒ колоректальная аденокарцинома, LIHC ‒ рак печени, PAAD ‒ рак поджелудочной железы.
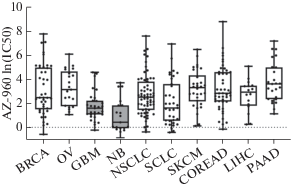
Связан ли уровень экспрессии рецепторов, которые могут активировать JAK2, с чувствительностью клеток к AG490? Чтобы установить это, мы измерили экспрессию генов, кодирующих IL6-R, EPO-R, IL11-RA, IGF1-R, CSF1-R и MPL, во всех клеточных линиях (рис. 3). Низкая экспрессия гена IL6R выявлена в клетках нейробластом, тогда как экспрессия остальных генов находилась примерно на том же уровне, что и в клеточных линиях другого происхождения. При этом клетки нейробластомы LAN-1 (более чувствительные к AG490, чем SH-SY5Y и LN-18) отличаются от клеток SH-SY5Y более высоким уровнем экспрессии генов CSF1R и более низким ‒ генов IL11RA и EPOR. В клетках SK-BR-3, которые в отличие от H1299 и MCF-7 ‒ двух линий эпителиального происхождения, оказались чувствительными к ингибированию JAK2, экспрессия генов IL6R, IL11RA и CSF1R была выше, чем в клетках H1299 и MCF-7. Во всех клеточных линиях, кроме H1299 немелкоклеточного рака легкого, выявлена высокая экспрессия гена IGF1R. При этом во всех клеточных линиях отмечена низкая экспрессия гена MPL, кодирующего рецептор тромбопоэтина.
Рис. 3.
Экспрессия генов IL6R, EPOR, IL11RA, IGF1R, CSF1R и MPL в клеточных линиях эпителиального происхождения H1299, MCF-7 и SK-BR-3 (выделены темно-серым) и в клеточных линиях нейрального происхождения LN18, LAN-1 и SH-SY5Y (выделены светло-серым). Экспрессия каждого гена нормирована по экспрессии гена GAPDH в этой линии и выражена в относительных единицах.
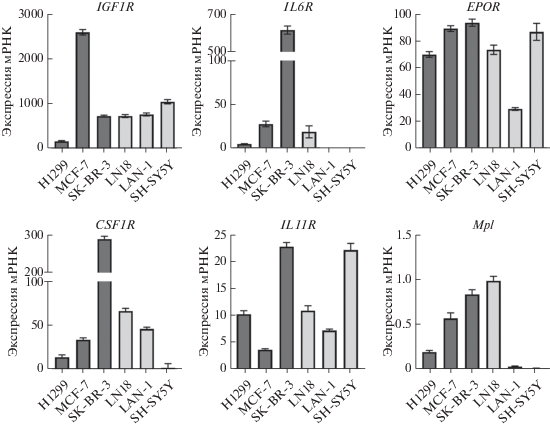
Чтобы оценить эффект ингибиторов JAK2 не только как индивидуальных противоопухолевых препаратов, но и в составе комбинированной терапии, мы проверили, как AG490 влияет на чувствительность клеток к доксорубицину. Для каждой клеточной линии мы выбрали концентрацию AG490, которая незначительно ингибирует рост этих клеток (меньше IC50). Далее мы добавили доксорубицин вместе с AG490 или ДМСО (контроль) и через 96 ч измерили зависимость количества живых клеток от концентрации доксорубицина. Доксорубицин, AG490 и ДМСО добавляли к клеткам в одно и то же время. Для определения совместного эффекта этих соединений рассчитывали величину IC50 доксорубицина в присутствии AG490 или ДМСО. Значительное снижение IC50 доксорубицина при добавлении AG490 отмечено у трех клеточных линий: двух линий нейробластомы SH-SY5Y (с 54.6 до 39.7 нМ) и LAN-1 (c 26.5 до 15.9 нМ), а также рака молочной железы MCF-7 (с 40.4 до 30.8 нМ) (рис. 4). Добавление AG490 не повлияло значительно на IC50 доксорубицина в остальных клеточных линиях.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ингибиторы JAK2 в настоящее время рассматриваются в качестве противоопухолевых средств и уже применяются при миелопролиферативных заболеваниях и лейкозах. При этих заболеваниях часто встречаются мутации в гене JAK2. Однако полагают, что и в клетках солидных опухолей JAK2 также действует как один из медиаторов передачи сигналов, позволяющих выживать злокачественным клеткам. Известно, что ингибиторы JAK2 блокируют рост клеток рака легкого с мутациями в гене K-RAS, а также клеток глиобластомы [10, 11]. Кроме того, ингибирование JAK2 приводит к эффективному подавлению роста клеток рака молочной железы, устойчивых к тамоксифену, который часто применяют при этом виде рака [12]. Также в опытах на мышах с ксенографтами глиобластом показано синергичное действие ингибитора JAK2 и темозоломида [13]. Однако возможный вклад JAK2 в выживание клеток нейробластомы изучен недостаточно. Роль сигнального пути JAK/STAT и самого JAK2 в нейробластомах связывают в основном с действием IL-6 [14, 15]. В нашей работе показано, что злокачественные клетки нейрального происхождения, в том числе клетки нейробластомы, более чувствительны (по сравнению с клетками немелкоклеточного рака легкого и рака молочной железы) к действию AG490 ‒ ингибитора JAK2. При этом клетки нейробластомы характеризуются наименьшим уровнем экспрессии гена, кодирующего рецептор IL-6. Таким образом, участие JAK2 в выживании клеток нейробластомы может быть связано не только с IL-6, но и с другими белками и их рецепторами, способными активировать JAK2. Одним из таких рецепторов может быть рецептор макрофагального фактора роста M-CSF. В клеточной линии нейробластомы LAN-1, наиболее чувствительной к ингибированию JAK2, экспрессия CSF1-R существенно выше, чем в менее чувствительных клетках SH-SY5Y.
Ингибирование JAK2 усиливает действие доксорубицина на клетки нейробластомы. Ранее мы показали, что при подавлении экспрессии протоонкогена KIT в клетках нейробластомы растет экспрессия генов INFGR1 и INFGR2, кодирующих рецепторы интерферона-γ [16]. Известно, что киназа JAK2 является одним из основных медиаторов передачи сигнала от этих рецепторов. Активация JAK2 интерфероном-γ приводит к увеличению экспрессии белка PD-L1, что делает злокачественные клетки менее чувствительными к действию NK-клеток иммунной системы [17]. Кроме того, амплификация гена MYCN в клетках нейробластомы считается крайне неблагоприятным прогностическим признаком, поскольку приводит к повышению активности сигнальных путей, связанных с белками STAT3 и STAT5 [18]. Оба этих белка могут активироваться JAK2. Стоит отметить, что ген MYCN амплифицирован в клетках нейробластомы LAN-1, наиболее чувствительных к ингибированию киназы JAK2.
Чувствительность клеток ненейрального происхождения к AG490 зависит, возможно, от экспрессии одного из рецепторов ‒ IL6-R, CSF1-R и IL11-R, или же от соотношения экспрессии этих рецепторов. Несмотря на достаточно высокую экспрессию рецепторов как эритропоэтина, так и инсулиноподобного фактора роста 1 во всех исследованных клеточных линиях, мы не обнаружили какой-либо корреляции между экспрессией этих рецепторов и чувствительностью клеток к AG490 .
Таким образом, нами показано, что клетки нейробластомы чувствительны к действию ингибитора JAK2, и это ингибирование усиливает действие доксорубицина. Эффективность ингибиторов JAK2 при злокачественных заболеваниях может зависеть от соотношения экспрессии рецепторов, активирующих сигнальный каскад JAK/STAT.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 17-04-01697.
Работа не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Орлова Н.Н., Лебедев Т.Д., Спирин П.В., Прасолов В.С. (2016) Ключевые молекулярные механизмы, ассоциированные со злокачественным перерождением клеток при остром миелоидном лейкозе. Молекуляр. биология. 50, 395‒405.
Perner F., Perner C., Ernst T., Heidel F.H. (2019) Roles of JAK2 in aging, inflammation, hematopoiesis and malignant transformation. Cells. 8(8), pii: E854. https://doi.org/10.3390/cells8080854
Sternberg C., Gruber W., Eberl M., Tesanovic S., Stadler M., Elmer D.P., Schlederer M., Grund S., Roos S., Wolff F., Kaur S., Mangelberger D., Lehrach H., Hache H., Wierling C., Laimer J., Lackner P., Wiederstein M., Kasper M., Risch A., Petzelbauer P., Moriggl R., Kenner L., Aberger F. (2018) Synergistic cross-talk of Hedgehog and interleukin-6 signaling drives growth of basal cell carcinoma. Internat. J. Cancer. 143, 2943–2954.
Zhou W., Sun W., Yung M.M.H., Dai S., Cai Y., Chen C.W., Meng Y., Lee J.B., Braisted J.C., Xu Y., Southall N.T., Shinn P., Huang X., Song Z., Chen X., Kai Y., Cai X., Li Z., Hao Q., Cheung A.N.Y., Ngan H.Y.S., Liu S.S., Barak S., Hao J., Dai Z., Tzatsos A., Peng W., Pei H., Han Z., Chan D.W., Zheng W., Zhu W. (2018) Autocrine activation of JAK2 by IL-11 promotes platinum drug resistance. Oncogene. 37, 3981‒3997.
Witthuhn B.A., Quelle F.W., Silvennoinen O., Yi T., Tang B., Miura O., Ihle J.N. (1993) JAK2 associates with the erythropoietin receptor and is tyrosine phosphorylated and activated following stimulation with erythropoietin. Cell. 74, 227‒236.
Gual P., Baron V., Lequoy V., Van Obberghen E. (1998) Interaction of Janus kinases JAK-1 and JAK-2 with the insulin receptor and the insulin-like growth factor-1 receptor. Endocrinology. 139, 884‒893.
Xu S., Zhang Z., Xia L.X., Huang J. (2016) Role of macrophage colony-stimulating factor (M-CSF) in human granulosa cells. Gynecol. Endocrinol.: Offic. J. Internat. Soc. Gynecol. Endocrinol. 32, 1005‒1008.
Plo I., Bellanne-Chantelot C., Mosca M., Mazzi S., Marty C., Vainchenker W. (2017) Genetic alterations of the thrombopoietin/MPL/JAK2 axis impacting megakaryopoiesis. Front. Endocrin. 8, 234.
Yang W., Soares J., Greninger P., Edelman E.J., Lightfoot H., Forbes S., Bindal N., Beare D., Smith J.A., Thompson I.R., Ramaswamy S., Futreal P.A., Ha-ber D.A., Stratton M.R., Benes C., McDermott U., Garnett M.J. (2013) Genomics of Drug Sensitivity in Cancer (GDSC): a resource for therapeutic biomarker discovery in cancer cells. Nucl. Acids Res. 41, D955‒961.
Baskin R., Park S.O., Keseru G.M., Bisht K.S., Wamsley H.L., Sayeski P.P. (2014) The Jak2 small molecule inhibitor, G6, reduces the tumorigenic potential of T98G glioblastoma cells in vitro and in vivo. PloS One. 9, e105568.
Mohrherr J., Haber M., Breitenecker K., Aigner P., Moritsch S., Voronin V., Eferl R., Moriggl R., Stoiber D., Gyorffy B., Brcic L., Laszlo V., Dome B., Moldvay J., Dezso K., Bilban M., Popper H., Moll H.P., Casanova E. (2019) JAK-STAT inhibition impairs K-RAS-driven lung adenocarcinoma progression. Internat. J. Cancer. 145(12), 3376–3388. https://doi.org/10.1002/ijc.32624
Kim J.W., Gautam J., Kim J.E., Kim J.A., Kang K.W. (2019) Inhibition of tumor growth and angiogenesis of tamoxifen-resistant breast cancer cells by ruxolitinib, a selective JAK2 inhibitor. Oncol. Lett. 17, 3981‒3989.
Jensen K.V., Cseh O., Aman A., Weiss S., Luchman H.A. (2017) The JAK2/STAT3 inhibitor pacritinib effectively inhibits patient-derived GBM brain tumor initiating cells in vitro and when used in combination with temozolomide increases survival in an orthotopic xenograft model. PloS One. 12, e0189670.
Yogev O., Almeida G.S., Barker K.T., George S.L., Kwok C., Campbell J., Zarowiecki M., Kleftogiannis D., Smith L.M., Hallsworth A., Berry P., Mocklinghoff T., Webber H.T., Danielson L.S., Buttery B., Calton E.A., da Costa B.M., Poon E., Jamin Y., Lise S., Veal G.J., Sebire N., Robinson S.P., Anderson J., Chesler L. (2019) In vivo modelling of chemo-resistant neuroblastoma provides new insights into chemo-refractory disease and metastasis. Cancer Res. 79(20), 5382–5393. https://doi.org/10.1158/0008-5472
Yang F., Jove V., Buettner R., Xin H., Wu J., Wang Y., Nam S., Xu Y., Ara T., DeClerck Y.A., Seeger R., Yu H., Jove R. (2012) Sorafenib inhibits endogenous and IL-6/S1P induced JAK2-STAT3 signaling in human neuroblastoma, associated with growth suppression and apoptosis. Cancer Biol. Ther. 13, 534‒541.
Лебедев Т.Д., Спирин П.В., Орлова Н.Н., Прокофьева М.М., Прасолов В.С. (2015) Сравнительный анализ экспрессии генов ‒ мишеней противоопухолевой терапии, в клеточных линиях нейробластомы. Молекуляр. биология. 49, 1052‒1055.
Bellucci R., Martin A., Bommarito D., Wang K., Hansen S.H., Freeman G.J., Ritz J. (2015) Interferon-gamma-induced activation of JAK1 and JAK2 suppresses tumor cell susceptibility to NK cells through upregulation of PD-L1 expression. Oncoimmunology. 4, e1008824.
Petrov I., Suntsova M., Ilnitskaya E., Roumiantsev S., Sorokin M., Garazha A., Spirin P., Lebedev T., Gaifullin N., Larin S., Kovalchuk O., Konovalov D., Prassolov V., Roumiantsev A., Buzdin A. (2017) Gene expression and molecular pathway activation signatures of MYCN-amplified neuroblastomas. Oncotarget. 8, 83768‒83780.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология