Молекулярная биология, 2020, T. 54, № 2, стр. 278-284
Рекомбинантный антиген ротавируса, полученный на основе белка оболочки вируса мозаики альтернантеры
Е. М. Рябчевская a, *, Е. А. Евтушенко a, М. В. Архипенко a, Е. К. Донченко a, Н. А. Никитин a, И. Г. Атабеков a, b, О. В. Карпова a
a Биологический факультет Московского государственного университета имени М.В. Ломоносова
119234 Москва, Россия
b Институт биоинженерии Федерального исследовательского центра
“Фундаментальные основы биотехнологии” Российской академии наук
117312 Москва, Россия
* E-mail: eryabchevskaya@gmail.com
Поступила в редакцию 17.07.2019
После доработки 30.08.2019
Принята к публикации 02.09.2019
Аннотация
Вирусы растений обладают иммуностимулирующими свойствами и безопасны для человека, в связи с этим использование их в качестве основы для создания вакцин может быть многообещающим подходом. Известно, что белок оболочки вируса мозаики альтернантеры способен in vitro образовывать вирусоподобные частицы, которые стабильны в физиологических условиях и обладают адъювантной активностью. Настоящая работа посвящена созданию рекомбинантного антигена ротавируса А человека на основе эпитопа структурного белка VP6 ротавируса и белка оболочки вируса мозаики альтернантеры в качестве носителя. Получен вектор для экспрессии, содержащий ген белка оболочки вируса мозаики альтернантеры (штамм MU), слитого с эпитопом ротавирусного белка VP6. Иммуноблот-анализ химерного белка показал, что белок эффективно узнается коммерческими антителами к ротавирусу А, а значит, может быть применен для создания прототипа вакцины. Изучена возможность образования рибонуклеопротеидов на основе химерного рекомбинантного белка. Продемонстрировано, что рибонуклеопротеиды, полученные в результате взаимодействия химерного рекомбинантного белка с нативными белком оболочки и РНК вируса мозаики альтернантеры, узнаются антителами к ротавирусу А.
ВВЕДЕНИЕ
Ротавирусная инфекция считается одной из главных причин острого гастроэнтерита у детей до пяти лет, причем ежегодно от этого заболевания погибает около 215 тыс. детей [1]. Кроме того, ротавирус представляет опасность и для других возрастных групп людей. Основные возбудители ротавирусной инфекции у человека – штаммы, относящиеся к группе А (более 90% всех инфекций) [2]. Большое серологическое разнообразие штаммов ротавируса А представляет серьезную проблему для разработки вакцин. Существующие в настоящие время вакцины против ротавирусной инфекции представляют собой живые аттенуированные вакцины для перорального введения. К их недостаткам относят потенциальную возможность реверсии препарата к патогенной форме, риск возникновения новых вакцин-ассоциированных реассортантов вируса и инвагинации кишечника (серьезное осложнение, вызванное пероральным введением вакцины) [3, 4]. В связи с этим создание рекомбинантной вакцины против ротавируса А с парентеральным путем введения – актуальная задача.
Структурные белки ротавируса образуют трехслойный капсид. Внутренний слой состоит из димеров белка VP2, промежуточный слой сложен из тримеров белка VP6, наружный слой представлен тримерами белка VP7 и тримерами белка VP4, которые образуют шипы. Для проникновения вируса в клетку необходим протеолиз VP4 с образованием фрагментов VP5* и VP8* [5]. Основные антигены ротавируса – VP6, VP7, VP5* и VP8*. Согласно литературным данным, структурный белок VP6 ротавируса высоко консервативен: 87% его аминокислотной последовательности сохраняется неизменной у штаммов группы A [6]. VP6 играет важную роль в развитии иммунного ответа: основные антитела, продуцируемые в ответ на естественную ротавирусную инфекцию, специфичны именно к белку VP6. Показано, что эпитоп белка VP6 (RLSFQLMRPPNMTP) способен активировать сильный протективный иммунный ответ, сравнимый с иммунным ответом, созданным при иммунизации белком VP6 [7]. Именно поэтому этот эпитоп можно рассматривать в качестве перспективного кандидата для включения в состав рекомбинантных вакцин против ротавируса.
Существуют различные стратегии разработки рекомбинантных вакцин. Основные подходы при создании таких вакцин против ротавируса – субъединичные рекомбинантные вакцины, содержащие отдельные белки ротавируса, и вакцины на основе вирусоподобных частиц (ВПЧ) из ротавирусных белков или на основе белков других вирусов [3]. В том числе перспективным представляется использовать для получения ВПЧ белки оболочки вирусов растений, которые безопасны для человека, обладают эффективными иммуностимулирующими свойствами, а их получение не требует больших финансовых затрат [8]. Один из растительных вирусов, обладающий иммуностимулирующими свойствами, – вирус мозаики альтернантеры (ВМАльт) [9]. ВМАльт относится к роду Potexvirus, семейство Alphaflexiviridae. Вирионы ВМАльт имеют нитевидную форму, ширину 13.5 нм и длину 570 нм [10]. Белок оболочки (БО) ВМАльт состоит из 207 аминокислотных остатков, имеет молекулярную массу 22 кДа и способен образовывать нитевидные ВПЧ in vitro в отсутствие РНК. Ранее нами показано [11], что, как и вирионы, ВПЧ ВМАльт обладают адъювантными свойствами. ВПЧ ВМАльт составляют 15.2 нм в диаметре, могут иметь длину от 60 до 2000 нм и стабильны в физиологических условиях [10, 12]. Таким образом, БО ВМАльт можно рассматривать как перспективный носитель чужеродных эпитопов (антигенных детерминант) для разработки рекомбинантных вакцин.
Цель работы – получение рекомбинантного антигена ротавируса А человека на основе эпитопа белка VP6 и БО ВМАльт в качестве носителя, а также изучение возможности его использования в качестве компонента кандидатной вакцины против ротавируса А.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выделение вируса, вирусной РНК и белка оболочки. Препарат ВМАльт (штамм MU) получали из зараженных растений табака (Nicotiana ben-thamiana) [10]. РНК выделяли методом фенольной депротеинизации, БО ВМАльт выделяли методом солевой депротеинизации с 2 M LiCl.
Получение БО ВМАльт, слитого с эпитопом ротавирусного белка VP6. Нуклеотидная последовательность, кодирующая рекомбинантный БО ВМАльт, слитый с эпитопом ротавирусного белка VP6, получена на матрице плазмиды, содержащей кДНК-копию генома ВМАльт, штамм MU (GenBank: FJ822136.1) [13]. В гене БО ВМАльт провели оптимизацию нуклеотидной последовательности для экспрессии в бактериальной системе, для чего кодоны, редко встречающиеся в клетках Escherichia coli, заменили на наиболее характерные для этих клеток (https://www.genscript.com/tools/ codon-frequency-table). Прямой праймер 5'-ATA-CTCATGAGTACTCCATTTCCTCAAGTCACCCA-GGAACAGATTGAC-3', содержащий сайт рестрикции PagI, и обратный праймер 5'-GTATGGATCCCGGCGTCATGTTCGGCGGGCGCATCAGT-TGGAATGACAAACGCTCCGGTGGTGGGAGGTATTG-3', содержащий нуклеотидную последовательность, кодирующую эпитоп ротавируса, и сайт рестрикции BamHI, использовали для получения нуклеотидной последовательности, кодирующей БО ВМАльт, на С-конце слитый с эпитопом ротавируса. Все генно-инженерные манипуляции с рекомбинантной ДНК проводили по стандартным методикам [14]. Рекомбинантную ДНК, кодирующую БО ВМАльт, слитый с эпитопом ротавирусного белка VP6, разрезали эндонуклеазами рестрикции PagI и BamHI (“Thermo Fisher Scientific”, США) по соответствующим сайтам и затем сшивали с вектором pQE-60 (QIAGEN) ДНК-лигазой Т4 (“Fermentas”, Литва). Полученной плазмидой трансформировали клетки E. сoli штамма SG[pREP4]. После индукции экспрессии рекомбинантный белок очищали с помощью аффинной хроматографии на Ni-NTA-агарозе (“Qiagen”, Германия) c использованием 6 М гуанидинхлорида и 8 M мочевины в соответствии с протоколом [15]. Полученный препатрат диализовали против деионизированной воды Milli-Q (“Merck Millipore”, США) в течение 4 ч со сменой воды каждый час.
Иммуноблот-анализ. После электрофореза в градиентном 8–20%-ном полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ) белки из геля переносили на мембрану Hybond-P из поливинилиденфторида (“Amersham”, США) с помощью системы электропереноса Pierce Power Blotter (“Thermo Scientific”, США). При анализе рибонуклеопротеиновых комплексов (РНП) электрофорез проводили в 1%-ном агарозном геле, после чего материал переносили на мембрану Hybond-P с помощью влажного переноса в эксикаторе в течение ночи при комнатной температуре. В обоих случаях после переноса мембрану обрабатывали первичными козьими поликлональными антителами к ротавирусу А (ab31435, “Abcam”, Великобритания) в разведении 1 : 1500 и затем вторичными антителами против IgG козы, конъюгированными с пероксидазой хрена (“Promega”, США), в разведении 1 : 10 000. Мембрану обрабатывали ECL-субстратом (“Amersham”, США) и детектировали хемилюминесцентный сигнал с помощью системы гель-документирования ChemiDoc XRS+ (“Bio-Rad”, CША).
Инкубация РНК с белками. Инкубацию РНК с белками проводили в 0.01 М цитратном буфере (pH 4.0), оптимальном для полимеризации БО ВМАльт [12], в объеме 20 мкл в массовом соотношении 1 : 7 или 1 : 14 при комнатной температуре в течение 20 мин.
Электронная микроскопия. Исследуемые препараты наносили на медные сетки для электронной микроскопии, покрытые коллодиевой пленкой с углеродным напылением, как описано ранее [16]. Наблюдения проводили с помощью просвечивающего электронного микроскопа JEOL JEM-1400 (“JEOL”, Япония) при напряжении 80 кВ с цифровой фотокамерой Olympus Quemesa, используя программное обеспечение iTEM (“Olympus Soft Imaging Solutions GmbH”, Германия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Рекомбинантый БО ВМАльт, слитый с эпитопом ротавируса А
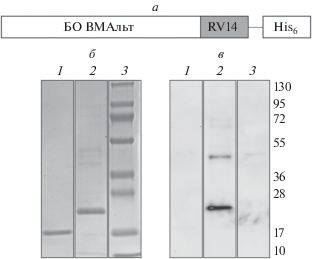
Получен рекомбинантный БО ВМАльт (штамм MU), содержащий на С-конце последовательность RV14 эпитопа белка VP6 ротавируса А (289–302 а.о., RLSFQLMRPPNMTP). Этот рекомбинантный белок получил название ER6 (Epitope of Rotavirus protein VP6). Cхема строения ER6 представлена на рис. 1a. Электрофоретический анализ выделенного ER6 выявил полосу, которая по своей электрофоретической подвижности соответствует молекулярной массе 25 кДа (рис. 1б, дорожка 2), что согласуется с расчетным значением, полученным с использованием программы ProtParam (http://www.expasy.org). Наличие в составе полученного белка участков аминокислотной последовательности, распознаваемых антителами к ротавирусу А, подтверждено иммуноблот-анализом (рис. 1в, дорожка 2). Примеси белка с более высокой молекулярной массой в пробе с ER6 также взаимодействовали с антителами, а значит, с большой вероятностью, представляют собой мультимерную форму белка ER6.
Рис. 1.
ER6 – рекомбинантный белок, содержащий эпитоп ротавируса А. a – Схема строения рекомбинантного белка ER6: RV14 – эпитоп белка VP6 ротавируса А (RLSFQLMRPPNMTP), His6 – последовательность из шести гистидинов. б – Электрофоретический анализ ER6 в 8–20%-ном ДСН-ПААГ. Гель окрашен Кумасси G-250. в – Иммуноблот-анализ рекомбинантного белка ER6 с антителами к ротавирусу А. б, в: 1 – ВТМ (отрицательный контроль), 2 – ER6, 3 – маркеры молекулярной массы (“Thermo scientific”), значения молекулярных масс указаны в кДа. Первичные антитела – коммерческие поликлональные антитела к ротавирусу А. Вторичные антитела – антивидовые антитела, конъюгированные с пероксидазой хрена.
РНП с белком ER6 и БО ВМАльт
Смесь РНК ВМАльт с белками инкубировали в соотношении 1 : 7 или 1 : 14, подобно схемам в сходных эспериментах с другим представителем семейства Potexvirus: Х-вирусом картофеля [17, 18]. Инкубацию белков и вирусной РНК проводи в следующих вариантах: 1 мкг РНК с 7 мкг нативного БО ВМАльт, выделенного из вируса, (рис. 2, дорожка 2); 1 мкг РНК со смесью 7 мкг нативного БО ВМАльт и 7 мкг рекомбинантного ER6 (рис. 2, дорожка 3); 1 мкг РНК с 7 мкг рекомбинантного ER6 (рис. 2, дорожка 4). В качестве контроля на гель наносили 1 мкг проинкубированной в тех же условиях РНК без белка (рис. 3, дорожка 1).
Рис. 2.
Анализ РНП методом торможения в геле. 1 – РНК ВМАльт (контроль); 2 – РНК + БО ВМАльт (1 : 7); 3 – РНК ВМАльт + БО ВМАльт + ER6 (1 : 7 : 7); 4 – РНК ВМАльт + ER6 (1 : 7). Электрофорез в 1%-ном агарозном геле. Окрашивание бромистым этидием. В скобках указано соотношение вирусной РНК и белка (БО ВМАльт и/или ER6).

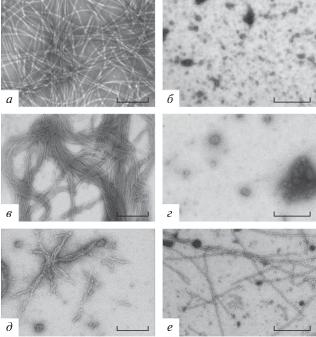
Рис. 3.
Анализ продуктов инкубации ER6 и БО ВМАльт c вирусной РНК. а – БО ВМАльт; б – ER6; в – РНК ВМАльт + БО ВМАльт (1 : 7); г, д – РНК ВМАльт + ER6 (1 : 7); е – РНК ВМАльт + БО ВМАльт + + ER6 (1 : 7 : 7). Просвечивающая электронная микроскопия. Контрастирование 2%-ным уранилацетатом. В скобках указано соотношение вирусной РНК и белка (БО ВМАльт и/или ER6). Размер масштабной метки: а, в, д – 200 нм; б – 600 нм; г, е – 400 нм.
Методом торможения в геле показано, что в случае, когда РНК инкубировали одновременно с двумя белками, БО ВМАльт и рекомбинантным ER6, наблюдали классическую картину образования РНП: полоса в геле, соответствующая свободной РНК, исчезает, а вместо нее появляются продукты с большей молекулярной массой, которые соответствуют РНП различного размера (рис. 2, дорожка 3). Следует отметить, что в этом случае детектировали также РНК, задержавшуюся на уровне старта. В препаратах, содержащих только один белок – нативный БО ВМАльт (рис. 2, дорожка 2) или рекомбинантным ER6 (рис. 2, дорожка 4), – вся РНК оставалась на старте.
Изучение морфологии полученных РНП
Методом просвечивающей электронной микроскопии проанализированы продукты взаимодействия РНК ВМАльт с БО ВМАльт (рис. 3в) и ER6 (рис. 3г, д) по отдельности и со смесью БО ВМАльт и ER6 (рис. 3е). В качестве контролей использовали препараты БО ВМАльт (рис. 3а) и ER6 (рис. 3б), проинкубированные в условиях образования РНП (0.01 М цитратный буфер, pH 4.0) в отсутствие РНК. Показано, что БО ВМАльт в этих условиях образует нитевидные ВПЧ, превышающие по длине вирионы ВМАльт [10] (рис. 3а). Морфология таких ВПЧ не изменялась при добавлении РНК (рис. 3в).
Напротив, как свободный (рис. 3б), так и проинкубированный с РНК (рис. 3г) белок ER6 образовывал агрегаты. Однако в случае инкубации РНК с ER6 редко встречались агрегаты, по морфологии напоминающие скопление частиц (рис. 3д).
При исследовании препарата, в котором РНК ВМАльт инкубировали со смесью БО ВМАльт и белка ER6, наблюдали другую картину сборки РНП: присутствовали частицы различной длины, визуально сходные по морфологии с вирионами ВМАльт (рис. 3е). Эти данные, наряду с результатами, полученными методом торможения в геле, позволили нам предположить, что в этом случае происходит мозаичная сборка РНП, в которой принимает участие не только нативный БО ВМАльт, но и белок ER6.
ER6 в составе РНП сохраняет антигенную специфичность ротавируса А
Оценку антигенной специфичности белка ER6 в составе РНП, полученных при взаимодействии ER6 и БО ВМАльт с вирусной РНК, проводили методом иммуноблот-анализа. Для этого РНП после электрофореза в агарозном геле переносили на мембрану методом влажного переноса. РНП, образованные при инкубации РНК со смесью белков ER6 и нативного БО ВМАльт, специфически узнавались поликлональными антителами к ротавирусу А (рис. 4, дорожка 1), что демонстрирует сохранение белком ER6 антигенной специфичности ротавируса в составе РНП. При анализе препаратов, полученных в результате инкубации РНК только с ER6, антителами также детектировались продукты их взаимодействия (рис. 4, дорожка 3). Однако электрофоретическая подвижность этих продуктов была больше, чем РНП, полученных при взаимодействии РНК со смесью двух белков. Не обнаружено взаимодействия антител к ротавирусу А с материалом, нанесенным на дорожку 2 (БО ВМАльт + РНК ВМАльт).
Рис. 4.
ER6 в составе РНП сохраняет антигенную специфичность ротавируса А. 1 – РНК ВМАльт + БО ВМАльт + ER6 (1 : 7 : 7); 2 – РНК ВМАльт + БО ВМАльт (1 : 7) (отрицательный контроль); 3 – РНК ВМАльт + ER6 (1 : 7). Иммуноблот-анализ. Первичные антитела – коммерческие поликлональные антитела к ротавирусу А. Вторичные антитела – антивидовые антитела, конъюгированные с пероксидазой хрена. В скобках указано соотношение вирусной РНК и белка (БО ВМАльт и/или ER6).

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами изучена возможность создания антигена ротавируса на основе БО растительного вируса ВМАльт и эпитопа RV14 белка VP6 ротавируса А (289–302 а.о., RLSFQLMRPPNMTP). Согласно литературным данным, этот эпитоп индуцировал сильный протективный иммунный ответ у мышей, сравнимый с таковым при иммунизации полноразмерным белком VP6 [7]. Данный участок консервативен для ряда штаммов группы A [6] и может рассматриваться как многообещающая антигенная детерминанта для разработки вакцин против ротавирусной инфекции.
В качестве носителя для усиления иммуногенных свойств этого эпитопа мы выбрали белок оболочки растительного вируса – ВМАльт (штамм MU). Согласно нашим предыдущим данным, как вирионы, так и ВПЧ ВМАльт, обладают адъювантными свойствами [9], что позволяет надеяться, что БО ВМАльт, формируя ВПЧ или РНП, будет эффективно усиливать иммунный ответ на эпитоп белка VP6 ротавируса А. Основываясь на работе Tremblay с соавт. [19], в которой показано, что C-конец БО близкородственного вируса – вируса мозаики папайи, – собранного в ВПЧ, экспонирован наружу, мы предположили, что при образовании ВПЧ или РНП из БО ВМАльт его С-конец будет тоже экспонирован. Следовательно, эпитоп ротавируса будет доступен для распознавания иммунной системой.
В результате работы создана генетическая конструкция, кодирующая химерный рекомбинантный белок оболочки ВМАльт, слитый с эпитопом ротавирусного белка VP6. Продемонстрировано, что полученный рекомбинантный белок ER6 специфически узнается коммерческими поликлональными антителами к ротавирусу А и, следовательно, его можно использовать как рекомбинантный антиген ротавируса А.
Изучена возможность формирования РНП с белком ER6. Для этого РНК ВМАльт инкубировали с нативным БО ВМАльт (контроль), ER6 или в присутствии обоих белков. Для получения РНП мы использовали соотношения белка (БО ВМАльт и/или ER6) и РНК, отработанные ранее в нашей лаборатории для получения РНП другого потексвируса – Х-вируса картофеля [17, 18]. Используя для анализа метод торможения в геле, мы обнаружили формирование РНП разной молекулярной массы в препарате РНК + БО ВМАльт + ER6. Последующий анализ методом электронной микроскопии подтвердил наличие частиц различной длины, схожих по морфологии с вирионами ВМАльт. При анализе инкубационной смеси вирусной РНК с каждым из белков в отдельности методом торможения в геле детектировали задержку материала в геле на уровне старта. Данные, полученные ранее в нашей лаборатории, свидетельствуют о том, что наличие гистидиновых остатков может приводить к неспецифической агрегации рекомбинантного белка с РНК [20]. Этот факт может объяснить наблюдавшуюся задержку РНК в геле на уровне старта в пробе с рекомбинантным белком ER6. БО ВМАльт в условиях формирования РНП, по данным электронной микроскопии, образовывал длинные нитевидные ВПЧ, что согласуется с ранее опубликованными данными [12]. Добавление РНК в выбранных условиях не повлияло на степень полимеризации БО ВМАльт. Можно предположить, что длинные нитевидные ВПЧ механически препятствовали продвижению РНК в геле. Однако в препарате ER6 с РНК, наряду с агрегатами, изредка регистрировали появление структур, напоминающих по морфологии скопления частиц (рис. 3д), которые отсутствовали в образце ER6 без РНК. На основании этих результатов можно предположить, что эти структуры представляют собой продукты специфического взаимодействия рекомбинантного белка ER6 c вирусной РНК. Следовательно, можно сделать вывод, что ER6 взаимодействует с вирусной РНК, но это взаимодействие не приводит к образованию РНП. В то же время инкубация вирусной РНК одновременно с двумя белками (ER6 и БО ВМАльт) приводит к образованию РНП различной длины, сходных по морфологии с вирионами ВМАльт, которые, предположительно, представляют собой результат мозаичной сборки. Интересно отметить, что добавление белка ER6 к РНК и БО ВМАльт препятствовало образованию протяженных по длине ВПЧ ВМАльт. Результат иммуноблот-анализа РНП, полученных при совместной инкубации ER6, БО ВМАльт и вирусной РНК, с поликлональными антителами к ротавирусу А подтверждает, что образовавшиеся РНП содержат химерный белок ER6, который сохраняет свою антигенную специфичность в составе РНП. Агрегаты ER6 с РНК также взаимодействовали с поликлональными антителами к ротавирусу А. Ранее нами показано, что эффективным иммуностимулирующим потенциалом обладают ВМАльт и ВПЧ ВМАльт, сопоставимые по размерам с вирионами [11]. Следовательно, наибольший интерес для разработки кандидатной вакцины представляют именно РНП, полученные в результате взаимодействия РНК с БО ВМАльт и ER6 одновременно.
Таким образом, в ходе работы получены РНП, состоящие из вирусной РНК, нативного БО ВМАльт и рекомбинантного ER6. Показано, что ER6 сохраняет свою антигенную специфичность в составе полученных РНП. Данный результат обнадеживает, и позволяет предположить, что в дальнейшем полученные с участием ER6 и других антигенных детерминант ротавируса РНП станут основой для создания безопасной кандидатной рекомбинантной вакцины против ротавирусной инфекции.
Работа выполнена при поддержке Россий-ского фонда фундаментальных исследований (грант № 18-34-00006мол_а) и Программы Президиума РАН.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Tate J.E. Burton A.H., Boschi-Pinto C., Parashar U.D. (2016) Global, regional, and national estimates of rotavirus mortality in children <5 years of age, 2000–2013. Clin. Infect. Dis. 62(Suppl. 2), S96–S105
Desselberger U., Wolleswinkel-van den Bosch J., Mrukowicz J., Rodrigo C., Giaquinto C., Vesikari T. (2006) Rotavirus types in Europe and their significance for vaccination. Pediatr. Infect. Dis. 25(1), S30–S41.
Кондакова О.А., Никитин Н.А., Трифонова Е.А., Атабеков И.Г., Карпова О.В. (2017) Вакцины против ротавируса: новые стратегии и разработки. Вестн. Моск. ун-та. Сер. 16. Биология. 72(4), 199–208.
Jiang B., Genstch J.R., Glass R.I. (2008) Inactivated rotavirus vaccines: a priority for accelerated vaccine development. Vaccine. 26(52), 6754–6758.
Estes M.K., Greenberg H.B. (2013) Rotaviruses. In: Fields Virology. Eds Knipe D.M., Howley P. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, pp. 1347–1395.
Parbhoo N., Dewar J.B., Gildenhuys S. (2016) Sequence analysis and structural implications of rotavirus capsid proteins. Acta Virol. 60(3), 260–270.
Choi A.H.C., Basu M., McNeal M.M., Flint J., VanCott J.L., Clements J.D., Ward R.L. (2000) Functional mapping of protective domains and epitopes in the rotavirus VP6 protein. J. Virol. 74(24), 11574–11580.
Trifonova E.A., Zenin V.A., Nikitin N.A., Yurkova M.S., Ryabchevskaya E.M., Putlyaev E.V., Donchenko E.K., Kondakova O.A., Fedorov A.N., Atabekov J.G., Karpova O.V. (2017) Study of rubella candidate vaccine based on a structurally modified plant virus. Antiviral Res. 144(C), 27–33.
Donchenko E.K., Trifonova E.A., Nikitin N.A., Atabekov J.G., Karpova O.V. (2018) Alternanthera mosaic potexvirus: several features, properties, and application. Adv. Virol. 2018, 1973705. https://doi.org/10.1155/2018/1973705
Donchenko E.K., Pechnikova E.V., Mishyna M.Yu., Manukhova T.I., Sokolova O.S., Nikitin N.A., Atabekov J.G., Karpova O.V. (2017) Structure and properties of virions and virus-like particles derived from the coat protein of Alternanthera mosaic virus. PLoS One. 12(8), e0183824.
Petrova E.K., Trifonova E.A., Nikitin N.A., Karpova O.V. (2015) Adjuvant properties of Alternanthera mosaic virus virions and virus-like particles. FEBS J. 282(Suppl. 1), 134.
Mukhamedzhanova A.A., Smirnov A.A., Arkhipenko M.V., Ivanov P.A., Chirkov S.N., Rodionova N.P., Karpova O.V., Atabekov J.G. (2011) Characterization of Alternanthera mosaic virus and its coat protein. Open Virol. J. 5, 136–140.
Ivanov P.A., Mukhamedzhanova A.A., Smirnov A.A., Rodionova N.P., Karpova O.V., Atabekov J.G. (2011) The complete nucleotide sequence of Alternanthera mosaic virus infecting Portulaca grandiflora represents a new strain distinct from phlox isolates. Virus Genes. 42(2), 268–271.
Sambrook J., Fritsch E.F., Maniatis T. (1989) Molecular cloning: a laboratory manual. 2nd edition, Cold Spring Harbor, New York: Cold Spring Harbor Lab. Press.
(2003) The QIAexpressionist: a handbook for high-level expression and purification of 6×His-tagged proteins, 5th ed. Qiagen, Valencia.
Никитин Н.А., Малинин А.С., Рахнянская А.А., Трифонова Е.А., Карпова О.В., Ярославов А.А., Атабеков И.Г. (2011) Использование поликатионного спейсера для нековалентной иммобилизации альбумина на термически модифицированных вирусных частицах. Высокомолекулярные соединения. Сер. А. 53(11), 1885–1891.
Karpova O.V., Zayakina O.V., Arkhipenko M.V., Sheval E.V., Kiselyova O.I., Poljakov V.Yu., Yaminsky I.V., Rodionova N.P., Atabekov J.G. (2006) Potato virus X RNA-mediated assembly of single‑tailed ternary ‘coat protein–RNA–movement protein’ complexes. J. Gen. Virol. 87, 2731–2740.
Карпова О.В., Архипенко М.В., Заякина О.В., Никитин Н.А., Киселева О.И., Козловский С.В., Родионова Н.П., Атабеков И.Г. (2006) Регуляция трансляции РНК в комплексах с белком оболочки X-вируса картофеля: ключевая роль N-концевого пептида белка. Молекуляр. биология. 40(4), 703–710.
Tremblay M.H., Majeau N., Gagné M.E.L., Lecours K., Morin H., Jean-Baptiste Duvignaud J.B., Bolduc M., Chouinard N., Paré C., Gagné S., Leclerc D. (2006) Effect of mutations K97A and E128A on RNA binding and self assembly of papaya mosaic potexvirus coat protein. FEBS J. 273(1), 14–25.
Zayakina O., Arkhipenko M., Smirnov A., Rodionova N., Karpova O., Atabekov J. (2009) Restoration of potato virus X coat protein capacity for assembly with RNA after His-tag removal. Arch. Virol. 154(2), 337–341.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


