Молекулярная биология, 2020, T. 54, № 2, стр. 267-277
Противоопухолевое, иммуностимулирующее и гепатотоксическое действие иммуностимулирущей РНК при сочетанном применении с цитостатиком дакарбазином на модели меланомы мыши
А. В. Сенькова a, *, И. А. Савин a, Т. О. Кабилова a, М. А. Зенкова a, Е. Л. Черноловская a
a Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: alsenko@mail.ru
Поступила в редакцию 08.07.2019
После доработки 08.07.2019
Принята к публикации 29.07.2019
Аннотация
Меланома ‒ одна из самых агрессивных опухолей, развитие которой сопровождается индукцией как местного, так и системного воспалительного ответа. В связи с этим при меланомах широко применяют химиотерапевтические агенты в сочетании с иммунотерапией. На модели меланомы В16 нами изучено противоопухолевое, иммуностимулирующее и гепатотоксическое действие иммуностимулирующей РНК (исРНК), представляющей собой короткую двухцепочечную РНК с 3'-выступающими концами, и цитостатика дакарбазина как в режиме монотерапии, так и при их сочетанном применении. Показано, что эти соединения эффективно подавляют рост опухоли, проявляя при этом синергичное действие. При гистологическом и иммуногистохимическом исследовании опухолевых узлов обнаружено, что сочетанное применение исРНК и дакарбазина вызывает снижение митотической активности и более эффективно индуцирует апоптоз в ткани опухоли, чем монотерапия каждым из препаратов. Независимо от схемы лечения в селезенке обнаружены признаки активации иммунной системы: увеличение числа и диаметра лимфоидных фолликулов, увеличение объемной плотности белой пульпы. В печени нелеченных животных с меланомой В16 выявлены деструктивные изменения. Введение исРНК в сочетании с дакарбазином не приводило к дополнительному повреждению и стимулировало регенеративные процессы в печени животных-опухоленосителей.
ВВЕДЕНИЕ
Меланома – злокачественная опухоль нейроэктодермального происхождения, исходящая из меланоцитов (пигментных клеток), ‒ одна из самых агрессивных опухолей с высоким метастатическим потенциалом. Меланома диагностируется примерно в 75% случаев всех злокачественных новообразований кожи [1]. Несмотря на активную вторичную профилактику и раннюю диагностику, заболеваемость и смертность от меланомы продолжают расти [2, 3]. Общая заболеваемость меланомой в мире составляет приблизительно 160 000 случаев в год, а смертность – 48 000 случаев в год [4].
В настоящее время в основе большинства подходов к лечению меланомы лежит химиотерапия [5, 6]. При этом основным препаратом является цитостатик дакарбазин, который относится к алкилирующим соединениям и подвергается биотрансформации в печени с образованием токсических метаболитов [7].
Развитие меланомы сопровождается индукцией системного воспалительного ответа, аутоиммунных реакций, а также токсическим поражением печени [8‒10]. В связи с этим при меланоме широко применяют так называемую биохимиотерапию, т.е. химиотерапию в сочетании с иммунотерапией, и разрабатывают стратегии усиления иммунного ответа организма [5, 6, 11]. Клинические испытания показали повышение эффективности и улучшение ответа на терапию у пациентов, получавших цитостатическую терапию в сочетании с иммунотерапией интерфероном-альфа и интерлейкином-2 [5, 12]. Однако сочетанное действие дакарбазина и индукторов эндогенного интерферона ранее не изучали.
Ранее нами была открыта короткая (19 п.н.) двухцепочечная РНК уникальной последовательности, которая имеет тринуклеотидные выступающие 3'-концы и обладает выраженной иммуностимулирующей активностью (далее исРНК) [13]. Показано, что исРНК активирует синтез интерферона-альфа, в значительно меньшей степени интерлейкина-6 и фактора некроза опухоли-альфа мононуклеарными клетками периферической крови человека [13]. В экспериментах с использованием перевиваемых опухолей показано, что исРНК индуцирует повышение уровня интерферона-альфа в сыворотке крови животных-опухоленосителей, а также обладает выраженным противоопухолевым и антиметастатическим действием в отношении меланомы В16 и гепатоцеллюлярной карциномы G29 [14, 15].
В данной работе на модели меланомы В16 нами изучено противоопухолевое, иммуностимулирующее и гепатотоксическое действие исРНК в режиме монотерапии и в сочетании с цитостатиком дакарбазином. Показано, что исРНК и дакарбазин эффективно подавляют рост опухолевого узла и проявляют умеренный синергизм при сочетанном применении.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Лабораторные животные и опухолевые модели. В работе использовали 10–14-недельных мышей-самок линии C57Bl/6J развода вивария ИХБФМ СО РАН (Новосибирск, Россия). Животных содержали по 10 особей в клетке при хорошем освещении и свободном доступе к корму и воде. Все эксперименты на животных одобрены Комиссией по биоэтике Федерального исследовательского центра “Институт цитологии и генетики СО РАН” (Новосибирск, Россия) (протокол № 22.11 от 30.05.2014 г).
Клетки меланомы мыши В16-F10 (далее меланома B16) получены из банка клеточных культур Национального медицинского исследовательского центра онкологии им. Н.Н. Блохина (Москва, Россия). Клетки культивировали в среде DMEM/ IMDM, содержащей 10% эмбриональной сыворотки крупного рогатого скота и 1% раствора антибиотиков и антимикотика (100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 0.25 мкг/мл амфотерицина), в атмосфере с 5% СО2 при 37°С (далее стандартные условия), и регулярно пассировали для поддержания экспоненциального роста.
Иммуностимулирующая РНК (исРНК). Олигорибонуклеотиды (цепь 1: 5'-GUGUCAGGCUUUCAGAUUUUUU-3', цепь 2: 5'-AAAUCUGAAAGCCUGACACUUA-3') были синтезированы на автоматическом ДНК/РНК-синтезаторе ASM-800 (“Биоссет”, Россия) с использованием рибо-β-цианэтилфосфитамидов (“Glen Research”, США). После полного деблокирования стандартными методами целевые продукты выделяли с помощью гель-электрофореза в 12%-ном полиакриламидном геле (ПААГ) в денатурирующих условиях и осаждали этанолом в присутствии ацетата натрия (pH 5.2). Олигорибонуклеотиды охарактеризованы с помощью MALDI-TOF на приборе REFLEX III (“Bruker Daltonics”, Германия). Для получения дуплекса два комплементарных олигорибонуклеотида (в концентрации 50 мкМ каждый) инкубировали в 15 мМ НЕРЕS-KOH (рН 7.4), содержащем 50 мМ ацетат калия и 1 мМ ацетат магния. Образование дуплекса проверяли с помощью гель-электрофореза в 15%-ном нативном ПААГ.
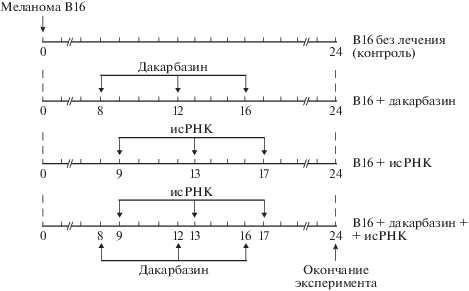
Исследование противоопухолевого действия исРНК, цитостатика дакарбазина и их комбинации in vivo. Для формирования первичного опухолевого узла суспензию клеток меланомы В16 (2 × × 106 клеток/мл) в 0.1 мл 0.9%-ного раствора хлорида натрия вводили подкожно в холку мышей. Животных распределяли на четыре группы по 10 особей в каждой в соответствии со схемой эксперимента. На 8-е сутки после трансплантации опухоли начинали лечение мышей (схема 1 ).
Схема 1.
Исследование противоопухолевого действия исРНК, цитостатика дакарбазина и их комбинации на модели меланомы мыши. Мышам линии C57Bl6J подкожно в холку вводили клетки меланомы В16 (2 × 106 клеток/мл). Дакарбазин вводили внутрибрюшинно в дозе 80 мг/кг на 8, 12 и 16 сутки после трансплантации опухоли; исРНК вводили перитуморально на 9, 13 и 17 сутки в дозе 10 мкг на мышь.
Для доставки исРНК в клетки-мишени использовали катионные липосомы 2X3-DOPE, предоставленные М.А. Масловым (Институт тонких химических технологий им. М.В. Ломоносова, МИРЭА – Российский технологический университет, Москва, Россия) [15, 16]. Комплексы исРНК/2X3-DOPE формировали в бессывороточной среде OptiMEM (“Invitrogen”, США), смешивая равные объемы раствора липосом (конечная концентрация 150 мкМ) и исРНК (конечная концентрация 3.5 мкМ) с последующей инкубацией в течение 20 мин при комнатной температуре. Соотношение азот/фосфат (N/P) в комплексах исРНК/2Х3-DOPE составляло 4/1. Комплексы (10 мкг исРНК на мышь) вводили перитуморально в 200 мкл OptiMEM на 9, 13 и 17 сутки роста опухоли. Дакарбазин (“Sigma-Aldrich”, США) вводили мышам внутрибрюшинно в дозе 80 мг/кг в 200 мкл воды для инъекций на 8, 12 и 16 сутки роста опухоли.
В течение эксперимента измеряли опухолевые узлы в трех взаимно перпендикулярных размерах. Объем опухоли вычисляли по следующей формуле: V = (длина × ширина × высота) × π/6. Время удвоения опухоли (DT, doubling time) вычисляли как DT = (t ‒ t0) × ln2/(lnV ‒ lnV0), где (t ‒ t0) ‒ промежуток времени между двумя измерениями опухолевого узла, V0 – объем опухоли в момент t0, V – объем опухоли в конечной точке исследуемого промежутка времени [17]. В данном случае величину DT оценивали на линейном участке кривой роста опухоли (15‒17 сутки).
Индекс торможения роста опухоли (ТРО), который отражает динамику роста опухоли и противоопухолевую активность исследуемых соединений, рассчитывали по следующей формуле: ТРО = (Vконтроль ‒ Vэксперимент)/Vконтроль × × 100%, где Vконтроль ‒ средний объем опухоли в контрольной группе, а Vэксперимент ‒ средний объем опухоли в экспериментальной группе.
На 24-е сутки мышей выводили из эксперимента путем дислокации шейных позвонков. Производили забор материала (опухолевые узлы, селезенка, печень) для последующего гистологического исследования.
Оценка синергического, аддитивного или антагонистического эффекта соединений при их комбинировании. Взаимодействие препаратов оценивали с помощью метода Чоу‒Талалая [18] с последующим расчетом индекса комбинирования (combination index – CI) с помощью программы CompuSyn v.1.0. (“ComboSyn, Inc.”, США), исходя из данных эксперимента. Значения CI интерпретировали следующим образом: CI < 0.1 – очень сильный синергизм; 0.1‒0.7 – сильный синергизм; 0.7‒0.85 – умеренный синергизм; 0.85‒0.9 – слабый синергизм; 0.9‒1.1 – аддитивный эффект; 1.1‒1.2 – слабый антагонизм; 1.2‒1.45 – умеренный антагонизм; 1.45‒3.3 – антагонизм; 3.3‒10 – сильный антагонизм; >10 – очень сильный антагонизм.
Гистология и иммуногистохимия. Органы и ткани фиксировали в 10%-ном нейтральном формалине (“BioVitrum”, Россия), затем образцы обезвоживали в спиртах возрастающей концентрации, просветляли ксилолом и заключали в парафин HISTOMIX (“BioVitrum”). Парафиновые срезы толщиной до 5 мкм окрашивали гематоксилином и эозином.
Перед иммуногистохимическим окрашиванием проводили депарафинизацию и регидратацию срезов, а также демаскировку антигенов путем обработки в микроволновой печи мощностью 700 Вт. Срезы инкубировали с первичными антителами к каспазе-3 (ab2302, “Abcam”, Великобритания) в соответствии с инструкцией фирмы-производителя. Далее срезы инкубировали с вторичными антителами, конъюгированными с пероксидазой хрена (“Spring Bioscience Detection System”, CША), и проявляли в комплексе ДАБ-хромоген. Ядра клеток докрашивали гематоксилином Майера.
Гистологические срезы анализировали на микроскопе Axiostar plus, оснащенном камерой Axiocam MRc5 (“Carl Zeiss”, Германия).
Морфометрическое исследование опухолевых узлов, селезенки и печени. Морфометрический анализ гистологических срезов опухоли, селезенки и печени проводили с использованием закрытой тестовой системы из 100 точек площадью 3.2 × 106 мкм2 при увеличении микроскопа ×100 и ×400, накладывая сетку случайным образом и подсчитывая 10‒15 полей зрения в каждом образце, как описано ранее [19, 20].
При проведении морфометрического исследования опухолевых узлов подсчитывали объемные плотности (Vv, %) неизмененной опухолевой ткани, лимфоидной инфильтрации и некрозов в ткани опухоли, а также численную плотность (Nv) клеток в состоянии митоза, и клеток, позитивных по каспазе-3, в ткани опухоли. Морфометрическое исследование печени включало оценку объемных плотностей нормальных и дистрофически измененных гепатоцитов, некрозов паренхимы печени и численной плотности двуядерных гепатоцитов, отражающих регенеративный потенциал печени. При морфометрическом исследовании селезенки подсчитывали объемные плотности белой и красной пульпы, а также диаметр лимфоидных фолликулов (мкм).
Объемную плотность гистологической структуры подсчитывали по формуле: Vv = = (Pструктура/Pтест) × 100%, где Pструктура ‒ количество точек, которые приходятся на структуру, а Pтест ‒ общее количество тестовых точек, в данном случае 100. Численную плотность гистологической структуры определяли путем подсчета количества структур в пределах тестового поля определенной площади, в данном случае 3.2 × 106 мкм2.
Статистический анализ. Статистическую значимость результатов определяли с использованием t-критерия Стьюдента. Различия сравниваемых величин считали статистически значимыми при р ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Противоопухолевое действие различных химически синтезированных и природных соединений часто изучают на мышиных опухолевых моделях, которые могут быть сингенными и ксенографтными [21]. В сингенных моделях используют линии опухолевых клеток мышей, трансплантируемые животным с нормальным иммунитетом. В ксенографтных моделях используют мышей с иммунодефицитом, что дает возможность работать с перевитыми клетками опухолей человека. Поскольку исРНК обладает иммуностимулирующим действием, нами была выбрана сингенная опухолевая модель – меланома мыши В16. Эта опухоль развивается в мышах с нормальным иммунитетом, что позволяет оценить взаимодействие как самой опухоли, так и исРНК с иммунной системой, а также реализовать действие самой исРНК в пределах организма.
Для формирования первичного опухолевого узла суспензию опухолевых клеток вводили мышам подкожно в холку. На 8-е сутки после трансплантации, когда опухолевые узлы начинали пальпироваться, из эксперимента исключали животных, у которых опухоль не развилась, оставшихся распределяли по следующим группам: 1) меланома В16 без лечения (контроль); 2) меланома В16 + дакарбазин; 3) меланома В16 + исРНК; 4) меланома В16 + дакарбазин + исРНК (схема 1 ).
Использовали адаптированную для лабораторных животных схему введения дакарбазина и исРНК мышам с меланомой В16, разработанную в соответствии с дозировкой, кратностью и схемой введения цитостатических препаратов в сочетании с иммунотерапией, применяемой в клинической практике [5, 22, 23]. Дакарбазин вводили внутрибрюшинно, поскольку этот способ обеспечивает хорошую биодоступность препарата, делает возможными многократные инъекции и хорошо переносится животными. Схема введения исРНК определялась динамикой иммунного ответа под действием индукторов интерферона. Ранее мы показали, что максимальное повышение уровня интерферона-альфа в крови животных достигается через 6 ч после внутривенного введения исРНК, за которым следует период рефрактерности, когда организм становится нечувствительным к иммуностимулирующим воздействиям. Доказано, что повторную инъекцию исРНК можно проводить не ранее чем через 96 ч, когда наступает период восстановления способности синтезировать интерферон в ответ на исРНК [15]. Способ введения исРНК был выбран в соответствии с результатами сравнения эффективности внутривенного и перитуморального введения исРНК мышам-опухоленосителям. Оказалось, что перитуморальное введение исРНК более эффективно при меланоме В16, перевитой подкожно [15].
В ходе эксперимента измеряли опухолевые узлы, рассчитывали время удвоения опухоли (DT) и индекс торможения роста опухоли (ТРО). На основании этих данных оценивали синергический, аддитивный или антагонистический эффекты соединений при их совместном применении. Животных выводили из эксперимента по достижении этического лимита по размерам опухолей в контрольной группе (10 мм, хотя бы у одного из трех взаимно перпендикулярных размеров). По окончании эксперимента производили забор материала (опухолевые узлы, селезенка, печень) для последующего гистологического и морфометрического исследования.
Противоопухолевое действие исРНК, дакарбазина и их комбинации на модели меланомы В16
При подкожной трансплантации меланома В16 развивается в виде первичного опухолевого узла и не метастазирует. В ходе эксперимента объем опухоли в контрольной группе мышей быстро увеличивался: DT = 1 ± 0.02 суток. В группах мышей, получавших дакарбазин и исРНК в режиме монотерапии, данный показатель составил 1.5 ± 0.01 и 3.8 ± 0.03 суток соответственно. У мышей, получавших сочетанную терапию этими препаратами, DT = 9.9 ± 0.5 суток (рис. 1а).
Рис. 1.
Влияние исРНК и цитостатика дакарбазина в режиме монотерапии и при их сочетанном применении на рост первичного опухолевого узла меланомы В16, перевитой подкожно. Динамика роста (а) и индекс торможения роста опухоли (ТРО, %) (б) у мышей с меланомой В16 без лечения и после введения исРНК, дакарбазина и их комбинации. DT – время удвоения опухоли (сутки). CI – индекс комбинирования.
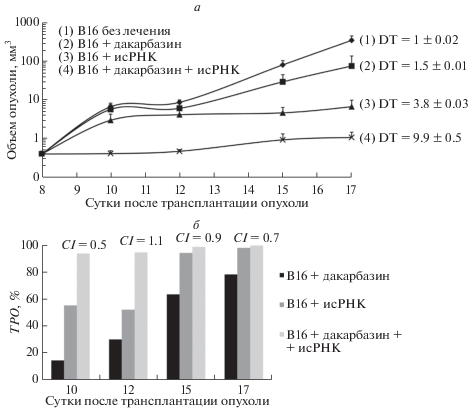
Ингибирующее действие соединений на опухоль оценивали с помощью индекса ТРО. При применении дакарбазина, исРНК и их комбинации на 10-е сутки после трансплантации опухоли этот показатель составил 14.5, 55.3 и 93.8% соответственно (рис. 1б). Далее индекс ТРО продолжал повышаться во всех группах и на 17-е сутки составил 78.3, 98.1 и 99.7% соответственно. Таким образом, монотерапия исРНК и сочетанная терапия исРНК с дакарбазином приводила к существенному подавлению роста меланомы В16 по сравнению с контролем. Дакарбазин подавляет рост опухоли в заметно меньшей степени, чем монотерапия исРНК и сочетанная терапия. Напротив, на поздних сроках эффективность исРНК приближалась к эффективности сочетанной терапии. Таким образом, ведущая роль в реализации противоопухолевого действия исРНК и дакарбазина при их совместном применении принадлежит стимуляции иммунного ответа.
Возможный синергический или антагонистический эффект взаимодействия препаратов оценили с учетом противоопухолевого действия исРНК, дакарбазина и их комбинации. Взаимодействие оценивали с помощью метода Чоу–Талалая с последующим расчетом индекса комбинирования (CI), поскольку при исследовании препаратов с цитотоксическим или антипролиферативным действием невозможно определить тип взаимодействия путем простого сравнения эффектов отдельных препаратов и их комбинаций. Величина индекса CI, подсчитанная в программе CompuSyn, составила 0.5 на 10-е сутки после трансплантации опухоли, что свидетельствует о синергизме исследуемой комбинации, 1.1 на 12-е сутки – указывает на аддитивное действие, 0.9 на 15-е и 0.7 на 17-е сутки – выявляет умеренный синергизм и синергизм соответственно (рис. 1б). Другими словами, в начале терапии и на поздних сроках развития опухоли наблюдается синергическое действие препаратов, а в середине терапии (12–15-е сутки), когда рост опухоли выходит на плато, разница между действием соединений сокращается, и эффективность их сочетания уменьшается, что может быть связано с динамикой иммунного ответа при развитии опухоли и применении средств, обладающих иммуностимулирующей активностью.
Таким образом, исРНК и дакарбазин, используемые в режиме сочетанной терапии, вызывают практически полное подавление (99.7%) роста первичного опухолевого узла меланомы В16, обладают синергическим типом взаимодействия, а эффект от совместного воздействия превышает сумму эффектов каждого препарата по отдельности. Следует отметить, что вклад исРНК в противоопухолевое действие сочетанной терапии больше, чем вклад дакарбазина, что может быть связано с важностью активации иммунной системы в терапии меланомы В16.
Влияние исРНК, дакарбазина и их комбинации на структурную организацию и индукцию апоптоза в ткани меланомы В16 у мышей
Важную роль в формировании иммунного ответа и эффективности иммунотерапии злокачественной меланомы играют Т-лимфоциты, которые формируют микроокружение меланомы, инфильтрируя саму опухолевую ткань и активно взаимодействуя с клетками опухоли [24, 25]. С целью изучения влияния исРНК, дакарбазина и их комбинации на структурную организацию ткани меланомы В16 проведен морфометрический анализ срезов опухолевых узлов с оценкой выраженности лимфоидной инфильтрации, деструктивных изменений, а также митотической активности в ткани опухоли.
Кроме того, представлялось интересным выяснить, индуцируют ли исследуемые соединения апоптоз в клетках опухоли. Для этого проводили иммуногистохимическое окрашивание срезов моноклональными антителами к каспазе-3, поскольку известно, что противоопухолевый эффект дакарбазина связан не только с метилированием нуклеиновых кислот и прямым повреждением ДНК, но и с индукцией апоптоза в опухолевых клетках [26, 27].
Меланома В16 гистологически представлена атипичными клетками преимущественно веретенообразной формы, содержащими коричневый пигмент меланин, она имеет типичное строение – неизмененная опухолевая ткань находится ближе к периферии, а области некроза располагаются в центре опухолевых узлов.
На границе между неизмененной и некротизированной тканью опухоли наблюдается лимфоидная инфильтрация, представленная преимущественно лимфоцитами с незначительной примесью макрофагов и нейтрофилов (рис. 2, верхняя панель). Ранее мы показали, что лимфоидная инфильтрация меланомы В16 представлена преимущественно CD4 и CD8 лимфоцитами, а введение исРНК мышам-опухоленосителям стимулирует дополнительную миграцию CD8 лимфоцитов в опухолевые узлы [15].
Рис. 2.
Гистологические срезы (верхняя панель) и иммуногистохимическое окрашивание (нижняя панель) опухолевых узлов мышей с меланомой В16 без лечения и после введения исРНК, дакарбазина и их комбинации. Черные стрелки указывают на клетки опухоли в состоянии митоза, зеленые ‒ опухолевая ткань в состоянии некроза, синие стрелки – лимфоидная инфильтрация, красные стрелки – позитивные по каспазе-3 опухолевые клетки.
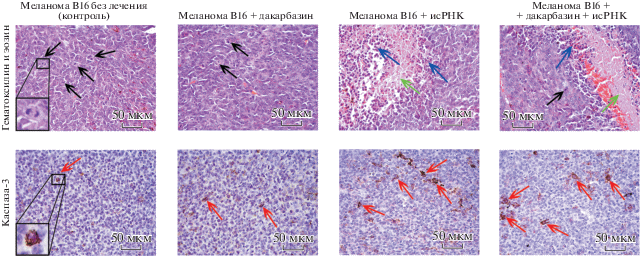
В группе нелеченных мышей (контроль) неизмененная опухолевая ткань занимала 62.5 ± 1.9%, лимфоидная инфильтрация – 16.6 ± 1.3%, а область некроза – 20.7 ± 2.4% от всей ткани опухоли (табл. 1). Численная плотность митозов в ткани опухоли мышей, не получавших лечение, составляла 4.1 ± 0.4, а клеток, вступивших в апоптоз – 1.9 ± 0.4 (табл. 1, рис. 2). При введении дакарбазина ткань опухоли не изменялась значительно, имелась лишь тенденция к снижению объемной плотности некрозов и численной плотности клеток в состоянии митоза, а также увеличение численной плотности позитивных по каспазе-3 клеток в 1.6 раза по сравнению с контролем (табл. 1, рис. 2). При введении исРНК и исРНК в сочетании с дакарбазином наблюдали незначительный рост деструктивных изменений в ткани опухоли (некроз). Кроме того, при монотерапии исРНК наблюдалась тенденция к увеличению лимфоидной инфильтрации опухолевой ткани. В группах “исРНК” и “исРНК + дакарбазин” выявлено значительное снижение численной плотности митозов в 4.6 и 2.9 раза, соответственно, и увеличение численной плотности позитивных по каспазе-3 клеток в 2.8 и 3.3 раза, соответственно, по сравнению с контролем (табл. 1, рис. 2).
Таблица 1.
Структурная организация ткани опухоли у мышей с меланомой B16 без лечения и после введения исРНК, цитостатика дакарбазина и их комбинации
| Морфологические параметры опухоли | Меланома B16 без лечения (контроль) | Меланома B16 + дакарбазин | Меланома B16 + исРНК | Меланома B16 + + дакарбазин + + исРНК |
|---|---|---|---|---|
| Неизмененная ткань, Vv, % | 62.5 ± 1.9 | 68.8 ± 9 | 55.5 ± 11.1 | 60.7 ± 1 |
| Лимфоидная инфильтрация, Vv, % | 16.6 ± 1.3 | 16.8 ± 4.4 | 19.5 ± 4.8 | 16.6 ± 1.1 |
| Ткань в состоянии некроза, Vv, % | 20.7 ± 2.4 | 14.3 ± 4.8 | 24.7 ± 6.5 | 23.2 ± 0.6 |
| Клетки в состоянии митоза, Nv | 4.1 ± 0.4 | 2.9 ± 0.7 | 0.9 ± 0.2# | 1.4 ± 0.5# |
| Каспаза-3-позитивные клетки, Nv | 1.9 ± 0.4 | 3.1 ± 0.5# | 5.3 ± 0.8# | 6.2 ± 0.8# |
Таким образом, введение исРНК в режиме монотерапии, а также в сочетании с цитостатиком дакарбазином мышам с меланомой В16 вызывает значительное снижение митотической активности и индуцирует апоптоз в клетках опухоли.
Морфофункциональное состояние селезенки и печени мышей с меланомой В16 без лечения и после введения исРНК, дакарбазина и их комбинации
Противоопухолевый препарат дакарбазин не только оказывает цитотоксическое воздействие на клетки опухоли, но и обладает иммуномодулирующей активностью: вызывает сверхэкспрессию генов, отвечающих за синтез и секрецию интерферона-гамма, а также повышение содержания самого интерферона-гамма в сыворотке крови пациентов с меланомой [28]. Ранее нами было показано, что исРНК вызывает повышение уровня интерферона-альфа в сыворотке крови, а также ремоделирование селезенки у животных с меланомой В16 [15]. Таким образом, оба соединения влияют не только на саму опухоль, но и на организм в целом, вызывая ряд морфологических изменений во внутренних органах.
С целью оценки влияния исРНК, дакарбазина, а также сочетанной терапии двумя препаратами на морфофункциональное состояние селезенки – органа, морфологические изменения которого отражают активацию иммунной системы, проведено морфометрическое изучение срезов селезенки.
Показано, что селезенка мышей контрольной группы с меланомой В16 имела типичное строение, сравнимое со структурой данного органа у здоровых мышей: белая пульпа была умеренно развита и представлена лимфоидными фолликулами, большая часть которых лежала изолированно. Объемная плотность белой пульпы в группе контроля составила 53 ± 2.2%, а диаметр лимфоидных фолликулов 288.1 ± 24 мкм (табл. 2). После применения как исРНК, так и дакарбазина в режиме монотерапии в селезенке мышей-опухоленосителей обнаружены признаки активации иммунной системы: увеличение размеров и числа фолликулов, их слияние между собой, появление в фолликулах светлых центров. Морфометрическое исследование показало, что признаки иммуностимуляции выражены в равной степени во всех трех экспериментальных группах. Введение мышам-опухоленосителям как исРНК, так и дакарбазина, а также комбинации этих препаратов приводило к увеличению объемной плотности белой пульпы селезенки в 1.4 раза по сравнению с контрольной группой и здоровыми животными (табл. 2). Кроме того, выявлено увеличение диаметра лимфоидных фолликулов в 1.5 раза после введения дакарбазина и дакарбазина в сочетании с исРНК и в 1.7 раза после введения исРНК в режиме монотерапии (табл. 2). Таким образом, морфофункциональные изменения селезенки свидетельствуют об активации иммунной системы под действием исследуемых препаратов.
Таблица 2.
Структурная организация селезенки здоровых мышей, мышей с меланомой B16 без лечения и мышей, получавших исРНК, цитостатик дакарбазин и их комбинацию
| Морфологические параметры селезенки | Здоровые мыши | Меланома В16 без лечения (контроль) | Меланома В16 + дакарбазин | Меланома В16 + исРНК | Меланома В16 + + дакарбазин + + исРНК |
|---|---|---|---|---|---|
| Объемная плотность белой пульпы, Vv, % | 52.6 ± 2.3 | 53 ± 2.2 | 72.9 ± 3.1*# | 71.4 ± 1.4*# | 72.7 ± 1.2*# |
| Объемная плотность красной пульпы, Vv, % | 47.3 ±2.3 | 47 ± 2.2 | 27.3 ± 3*# | 28.5 ± 1.4*# | 27.2 ± 1.2*# |
| Диаметр фолликулов, мкм | 279.9 ± 1 4.3 | 288.1 ± 24 | 434.7 ± 16.7*# | 484.9 ± 34.8*# | 443.7 ± 29.4*# |
Известно, что дакарбазин метаболизируется системой микросомальных монооксигеназ печени с образованием промежуточного метаболита 5-аминоимидазол-4-карбоксамида, вызывающего повреждение гепатоцитов [5, 29]. Кроме того, ранее нами было показано, что комплексы исРНК/катионные липосомы 2X3-DOPE оказывают определенное токсическое воздействие на ткань печени [15]. Для оценки влияния исРНК, дакарбазина и их комбинации на печень, в которой метаболизируется дакарбазин, и состояние которой отражает токсическое воздействие на организм как самой опухоли, так и проводимой терапии, использовали морфометрический анализ.
При гистологическом исследовании в печени контрольных животных (меланома В16 без лечения) выявлены деструктивные изменения, затронувшие 27.9 ± 1.7% всей паренхимы и представленные дистрофически измененными гепатоцитами (17.1 ± 0.7%) и гепатоцитами в состоянии некроза (10.8 ± 1.5%) (табл. 3). Введение как исРНК, так и дакарбазина в режиме монотерапии приводило к снижению уровня дистрофических изменений в 1.2 и 1.3 раза соответственно (табл. 3). Сочетанное применение исРНК и дакарбазина не вызывало улучшения морфофункционального состояния печени по сравнению с контролем, однако стимулировало регенеративную активность в печени животных-опухоленосителей: численная плотность двуядерных гепатоцитов в данной группе увеличилась в 3.1 раза по сравнению со здоровыми животными и в 1.6 раза по сравнению с контролем (животные с меланомой В16 без лечения) (табл. 3). Таким образом, деструктивные изменения в печени, развивающиеся после введения исРНК в сочетании с цитостатиком дакарбазином мышам-опухоленосителям, носят потенциально обратимый характер, поскольку не сопровождаются нарушением регенерации.
Таблица 3.
Структурная организация печени здоровых мышей, мышей с меланомой В16 без лечения и мышей, получавших исРНК, цитостатик дакарбазин и их комбинацию
| Морфологические параметры печени | Здоровые мыши | Меланома B16 без лечения (контроль) | Меланома В16 + дакарбазин | Меланома В16 + исРНК | Меланома В16 + + дакарбазин + + исРНК |
|---|---|---|---|---|---|
| Нормальная паренхима, Vv, % | 84.6 ± 0.6 | 72 ± 1.7* | 77.2 ± 1.2*# | 77.3 ± 1*# | 72 ± 1.5* |
| Дистрофические изменения, Vv, % | 4.7 ± 0.5 | 17.1 ± 0.7* | 14.3 ± 1*# | 12.7 ± 0.3*# | 16.1 ± 1.1* |
| Некротические изменения, Vv, % | 6.2 ± 0.7 | 10.8 ± 1.5* | 8.4 ± 0.6* | 9.5 ± 0.7* | 11.8 ± 0.5* |
| Суммарные деструктивные изменения, Vv, % | 10.9 ± 1.2 | 27.9 ± 1.7* | 22.7 ± 1.2*# | 22.3 ± 0.9*# | 27.9 ± 1.5* |
| Двуядерные гепатоциты, Nv | 2 ± 0.4 | 3.9 ± 0.6* | 5.7 ± 0.5*# | 5.2 ± 0.2* | 6.2 ± 0.7*# |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Методы лечения меланомы – одной из самых агрессивных опухолей человека – многообразны и включают стандартную химиотерапию, иммунотерапию, таргетную и топическую терапию, а также комбинации этих методов с оперативным вмешательством и лучевой терапией [30, 31]. До сих пор “золотым стандартом”, применяемым на поздних стадиях меланомы, остается химиотерапия цитостатиком дакарбазином в сочетании с иммунотерапией препаратами интерферона-альфа и интерлейкина-2 (биохимиотерапия). Меланома является иммуногенной опухолью, поэтому использование только цитостатических препаратов не позволяет задействовать все механизмы борьбы против данного вида опухоли, а биохимиотерапия значительно улучшает выживаемость пациентов и прогноз [12, 32]. Однако применение подобных химиотерапевтических схем сопровождается рядом побочных эффектов, таких как тошнота, рвота и миелосупрессия [33]. Кроме того, препараты интерферона сами обладают высокой токсичностью и могут вызывать аутоиммунные реакции [34]. Таким образом, использование индукторов эндогенного интерферона представляется более безопасным и эффективным в составе сочетанной терапии опухолей. Противоопухолевый потенциал цитостатика дакарбазина, наиболее часто используемого в качестве химиотерапевтического агента, и препаратов, обладающих иммуностимулирующим действием, ранее не изучали.
Ранее мы показали, что выраженное противоопухолевое и антиметастатическое действие использованной нами исРНК обусловлено ее способностью активировать иммунную систему и индуцировать синтез эндогенного интерферона [13‒15]. Для доставки исРНК в клетки-мишени мы использовали катионные липосомы 2X3-DOPE, хорошо зарекомендовавшие себя в предыдущих исследованиях [14, 15].
В данной работе противоопухолевое, иммуностимулирующее и гепатотоксическое действие исРНК как в режиме монотерапии, так и при сочетанном применении со стандартным цитостатиком дакарбазином оценено на модели меланомы В16. Показана высокая эффективность терапии, включающей исРНК и дакарбазин. Выявлено торможение роста опухолевого узла до 99% по сравнению с контролем без лечения. Более того, эти препараты действовали синергично, т.е. эффект от совместного воздействия препаратов был более сильным, чем сумма эффектов каждого препарата. Это подтверждено и при морфометрическом исследовании опухолевых узлов. Сочетанное применение исРНК и дакарбазина вызывает более значительное снижение митотической активности, а также более выраженную индукцию апоптоза в клетках опухоли по сравнению с контролем без лечения и монотерапией. Эти результаты хорошо согласуются с опубликованными данными, согласно которым дакарбазин вызывает индукцию апоптоза клеток меланомы и действует синергично с другими соединениями, индуцирующими апоптоз [26, 27, 35, 36].
Признаки активации иммунной системы обнаружены в селезенке животных всех опытных групп, в том числе в группе дакарбазина, который наряду с противоопухолевым действием вызывает и иммуномодулирующие эффекты [37]. Однако признаки иммуностимуляции были более выражены при введении исРНК в режиме монотерапии, хотя наблюдаемая разница не была статистически значимой. Эта тенденция может говорить о способности дакарбазина в определенной степени мешать реализации иммуностимулирующей активности исРНК, что, в свою очередь, не влияет на ее противоопухолевое действие. Это подтверждается данными морфометрической оценки лимфоидной инфильтрации опухолевых узлов, несколько более выраженной в группе “исРНК” и такой же, как в контроле, в группах “дакарбазин” и “дакарбазин + исРНК”. Это говорит о необходимости очень осторожного подхода к сочетанию цитостатиков с иммунотерапией и о соблюдении баланса между противоопухолевым действием цитостатика и иммуностимулирующей активностью иммунопрепарата с учетом динамики иммунного ответа и периода рефрактерности к действию индукторов эндогенного интерферона.
Серьезными побочными эффектами многокомпонентных схем терапии, включающих препараты интерферона-альфа и интерлейкина-2, являются тошнота, рвота и другие признаки интоксикации. Использование исРНК и дакарбазина как по отдельности, так и в составе сочетанной терапии не вызывало у лабораторных животных таких признаков токсичного поражения, как потеря веса, повышение температуры тела, изменение внешнего вида.
Как рост самой опухоли, так и применение химиотерапии оказывают повреждающее воздействие на органы и ткани. Морфофункциональное состояние печени является показателем токсического влияния этих процессов на внутренние органы и отражает состояние организма в целом. При проведении сочетанной терапии деструктивные изменения в печени были выражены несколько сильнее, чем при использовании исРНК и дакарбазина по отдельности, однако были такими же, как в контроле без лечения. Кроме того, как при развитии опухоли без лечения, так и при введении исследуемых соединений наблюдали увеличение численной плотности двуядерных гепатоцитов, что отражает регенеративный потенциал печени, может рассматриваться в качестве компенсаторного механизма при повреждении печени и свидетельствует о потенциальной обратимости деструктивных изменений.
Таким образом, сочетанное применение исРНК и цитостатика дакарбазина эффективно подавляет рост меланомы В16, вызывает снижение агрессивности опухолевого процесса за счет снижения митотической активности и индукции апоптоза в опухоли, а также эффективно активирует иммунную систему, стимулирует регенерацию и не вызывает дополнительного повреждения печени.
Коллектив авторов выражает благодарность М.И. Мещаниновой и А.Г. Веньяминовой (ИХБФМ СО РАН) за синтез исРНК.
Работа выполнена при финансовой поддержке Российского научного фонда (№ 19-74-30011) и проекта базового бюджетного финансирования ПФНИ ГАН 2013-2020 (№ АААА-А17-117020210024-8).
Эксперименты с животными проводили согласно директиве Европейского Парламента и Совета ЕС 2010/63/EU от 22 сентября 2010 г (European Communities Council Directive 2010/63/EU).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Miller K.D., Nogueira L., Mariotto A.B., Rowland J.H., Yabroff K.R., Alfano C.M., Jemal A., Kramer J.L., Siegel R.L. (2019) Cancer treatment and survivorship statistics, 2019. CA Cancer J. Clin. 69(5), 363–385. https://doi.org/10.3322/caac.21565
Tromme I., Legrand C., Devleesschauwer B., Leiter U., Suciu S., Eggermont A., Francart J., Calay F., Haagsma J.A., Baurain J.F., Thomas L., Beutels P., Speybroeck N. (2016) Melanoma burden by melanoma stage: assessment through a disease transition model. Eur. J. Cancer. 53, 33–41.
Wu Y.P., Aspinwall L.G., Conn B.M., Stump T., Grahmann B., Leachman S.A. (2016) A systematic review of interventions to improve adherence to melanoma preventive behaviors for individuals at elevated risk. Prev. Med. 788, 153–167.
Eggermont A.M., Spatz A., Robert C. (2014) Cutaneous melanoma. Lancet. 383(9919), 816–827.
Wilson M.A., Schuchter L.M. (2016) Chemotherapy for melanoma. Cancer Treat. Res. 167, 209–229.
Luo C., Shen J. (2017) Research progress in advanced melanoma. Cancer Lett. 397, 120–126.
Al-Badr A.A., Alodhaib M.M. (2016) Dacarbazine. Profiles Drug Subst. Excip. Relat. Methodol. 41, 323–377.
Hölzel M., Tüting T. (2016) Inflammation-induced plasticity in melanoma therapy and metastasis. Trends Immunol. 37(6), 364–374.
Neagu M., Constantin C., Caruntu C., Dumitru C., Surcel M., Zurac S. (2019) Inflammation: a key process in skin tumorigenesis. Oncol. Lett. 17(5), 4068–4084.
Eggert T., Medina-Echeverz J., Kapanadze T., Kruhlak M.J., Korangy F., Greten T.F. (2014) Tumor induced hepatic myeloid derived suppressor cells can cause moderate liver damage. PLoS One. 29(11), e112717. https://doi.org/10.1371/journal.pone.0112717
Rodríguez-Cerdeira C., Carnero Gregorio M., López-Barcenas A., Sánchez-Blanco E., Sánchez-Blanco B., Fabbrocini G., Bardhi B., Sinani A., Guzman R.A. (2017) Advances in immunotherapy for melanoma: a comprehensive review. Mediators Inflamm. 2017, 3264217. https://doi.org/10.1155/2017/3264217
Franklin C., Livingstone E., Roesch A., Schilling B., Schadendorf D. (2017) Immunotherapy in melanoma: recent advances and future directions. Eur. J. Surg. Oncol. 43(3), 604–611.
Kabilova T.O., Meschaninova M.I., Venyaminova A.G., Nikolin V.P., Zenkova M.A., Vlassov V.V., Chernolovskaya E.L. (2012) Short double-stranded RNA with immunostimulatory activity: sequence dependence. Nucl. Acids Ther. 22(3), 196–204.
Kabilova T.O., Kovtonyuk L.V., Zonov E.V., Ryabchikova E.I., Popova N.A., Nikolin V.P., Kaledin V.I., Zenkova M.A., Vlassov V.V., Chernolovskaya E.L. (2014) Immunotherapy of hepatocellular carcinoma with small double-stranded RNA. BMC Cancer. 14, 338. https://doi.org/10.1186/1471-2407-14-338
Kabilova T.O., Sen’kova A.V., Nikolin V.P., Popova N.A., Zenkova M.A., Vlassov V.V., Chernolovskaya E.L. (2016) Antitumor and antimetastatic effect of small immunostimulatory RNA against B16 melanoma in mice. PLoS One. 11(3), e0150751. https://doi.org/10.1371/journal.pone.0150751
Maslov M.A., Kabilova T.O., Petukhov I.A., Morozova N.G., Serebrennikova G.A., Vlassov V.V., Zenkova M.A. (2012) Novel cholesterol spermine conjugates provide efficient cellular delivery of plasmid DNA and small interfering RNA. J. Control. Release. 160, 182–193.
Patutina O.A., Mironova N.L., Ryabchikova E.I., Popova N.A., Nikolin V.P., Kaledin V.I., Vlassov V.V., Zenkova M.A. (2011) Inhibition of metastasis development by daily administration of ultralow doses of RNase A and DNase I. Biochimie. 93(4), 689–696.
Chou T.C. (2006) Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacol. Rev. 58(3), 621–681.
Sen’kova A.V., Mironova N.L., Patutina O.A., Ageeva T.A., Zenkova M.A. (2012) The toxic effects of polychemotherapy onto the liver are accelerated by the upregulated MDR of lymphosarcoma. ISRN Oncology. 2012, 721612. https://doi.org/10.5402/2012/721612
Sen’kova A.V., Mironova N.L., Patutina O.A., Mitke-vich V.A., Markov O.V., Petrushanko I.Y., Burnysheva K.M., Zenkova M.A., Makarov A.A. (2014) Ribonuclease binase decreases destructive changes of the liver and restores its regeneration potential in mouse lung carcinoma model. Biochimie. 101, 256–259.
Teicher B.A. (2006) Tumor models for efficacy determination. Mol. Cancer Ther. 5(10), 2435–2443.
Garbe C., Eigentler T.K., Keilholz U., Hauschild A., Kirkwood J.M. (2011) Systematic review of medical treatment in melanoma: current status and future prospects. Oncologist. 16(1), 5–24.
Mocellin S., Pasquali S., Rossi C.R., Nitti D. (2010) Interferon alpha adjuvant therapy in patients with high-risk melanoma: a systematic review and meta-analysis. J. Natl. Cancer Inst. 102(7), 493–501.
Yan Y., Leontovich A.A., Gerdes M.J., Desai K., Dong J., Sood A., Santamaria-Pang A., Mansfield A.S., Chadwick C., Zhang R., Nevala W.K., Flotte T.J., Ginty F., Markovic S.N. (2019) Understanding heterogeneous tumor microenvironment in metastatic melanoma. PLoS One. 14(6), e0216485. https://doi.org/10.1371/journal.pone.0216485
Domingues B., Lopes J.M., Soares P., Pópulo H. (2018) Melanoma treatment in review. Immunotargets Ther. 7, 35–49.
Baharara J., Amini E., Nikdel N., Salek-Abdollahi F. (2016) The cytotoxicity of dacarbazine potentiated by sea cucumber saponin in resistant B16F10 melanoma cells through apoptosis induction. Avicenna J. Med. Biotechnol. 8(3), 112–129.
Jin J.L., Gong J., Yin T.J., Lu Y.J., Xia J.J., Xie Y.Y., Di Y., He L., Guo J.L., Sun J., Noteborn M.H., Qu S. (2011) PTD4-apoptin protein and dacarbazine show a synergistic antitumor effect on B16-F1 melanoma in vitro and in vivo. Eur. J. Pharmacol. 654(1), 17–25.
Urosevic-Maiwald M., Barysch M.J., Cheng P.F., Karpova M.B., Steinert H., Okoniewski M.J., Dummer R. (2015) In vivo profiling reveals immunomodulatory effects of sorafenib and dacarbazine on melanoma. Oncoimmunology. 4(2), e988458.
Al-Badr A.A., Alodhaib M.M. (2016) Dacarbazine. Profiles Drug Subst. Excip. Relat. Methodol. 41, 323–377.
Mishra H., Mishra P.K., Ekielski A., Jaggi M., Iqbal Z., Talegaonkar S. (2018) Melanoma treatment: from conventional to nanotechnology. J. Cancer. Res. Clin. Oncol. 144(12), 2283–2302.
George D.D., Armenio V.A., Katz S.C. (2017) Combinatorial immunotherapy for melanoma. Cancer Gene Ther. 24(3), 141–147.
Rodríguez-Cerdeira C., Carnero Gregorio M., López-Barcenas A., Sánchez-Blanco E., Sánchez-Blanco B., Fabbrocini G., Bardhi B., Sinani A., Guzman R.A. (2017) Advances in immunotherapy for melanoma: a comprehensive review. Mediators Inflamm. 2017, 3264217. https://doi.org/10.1155/2017/3264217
Jiang G., Li R.H., Sun C., Liu Y.Q., Zheng J.N. (2014) Dacarbazine combined targeted therapy versus dacarbazine alone in patients with malignant melanoma: a meta-analysis. PLoS One. 9(12), e111920. https://doi.org/10.1371/journal.pone.0111920
Sasse A.D., Sasse E.C., Clark L.G., Ulloa L., Clark O.A. (2007) Chemoimmunotherapy versus chemotherapy for metastatic malignant melanoma. Cochrane Database Syst. Rev. (1), CD005413.
Yang C., Cao H., Liu N., Xu K., Ding M., Mao L.J. (2016) Oncolytic adenovirus expressing interleukin-18 improves antitumor activity of dacarbazine for malignant melanoma. Drug Des. Devel. Ther. 10, 3755–3761.
Zhang X.H., Qiao E.Q., Gao Z., Yuan H.Q., Cai P.F., Li X.M., Gu Y.H. (2013) Efficacy of combined axitinib with dacarbazine in a B16F1 melanoma xenograft model. Oncol. Lett. 6(1), 69–74.
Urosevic-Maiwald M., Barysch M.J., Cheng P.F., Karpova M.B., Steinert H., Okoniewski M.J., Dummer R. (2015) In vivo profiling reveals immunomodulatory effects of sorafenib and dacarbazine on melanoma. Oncoimmunology. 4(2), e988458.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


