Молекулярная биология, 2020, T. 54, № 2, стр. 333-340
Зависимость торсионных углов между осями α-спиралей от их длины в белках
Д. А. Тихонов a, b, Л. И. Куликова a, А. В. Ефимов c, *
a Институт математических проблем биологии Российской академии наук – филиал Федерального исследовательского центра “Институт прикладной математики им. М.В. Келдыша” Российской академии наук
142290 Московская обл., Пущино, Россия
b Институт теоретической и экспериментальной биофизики Российской академии наук
142290 Московская обл., Пущино, Россия
c Институт белка Российской академии наук
142290 Московская обл., Пущино, Россия
* E-mail: efimov@protres.ru
Поступила в редакцию 09.07.2019
После доработки 12.09.2019
Принята к публикации 02.10.2019
Аннотация
Взаимное расположение или упаковка α-спиралей в белках зависит от нескольких факторов, но главными из них являются принцип плотной упаковки и химическая природа полипептидной цепи. В настоящей работе впервые рассмотрен еще один фактор, от которого зависит упаковка α-спиралей, – это их длина. Создана база данных, в которую отобраны пары связанных перетяжками соседних по цепи спиралей четырех типов: 1) обе спирали длинные (10 474); 2) первая спираль длинная, вторая – короткая (3665); 3) первая спираль короткая, вторая – длинная (3648); 4) обе спирали короткие (1895). Показано, что пары длинных α-спиралей в большинстве случаев образуют α-шпильки, в которых торсионный угол Ω между их осями равен ≈20°. Большинство спиральных пар, в которых одна спираль короткая, а другая – длинная или обе спирали короткие, образуют αα-уголки с ортогональной (Ω ≈ –70°…90°) или скошенной (Ω ≈ –50°) упаковкой спиралей. Также рассмотрены возможные причины такой взаимосвязи. Полученные результаты имеют очень большое значение для определения взаимной ориентации α-спиралей при моделировании и предсказании структуры белков.
ВВЕДЕНИЕ
Многочисленными исследованиями показано, что большинство α-спиралей в белках упаковано при трех дискретных значениях торсионных углов Ω между их осями: это так называемые параллельная или антипараллельная, ортогональная и скошенная упаковки α-спиралей (см., например, [1–4]). Такая дискретность определена прежде всего принципом плотной упаковки, в соответствии с которым взаимодействующие α-спирали должны быть упакованы так, чтобы выступы на поверхности одной α-спирали входили во впадины на поверхности другой и наоборот. Впервые модель плотной упаковки α-спиралей, основанная на комплементарном объединении их поверхностей, предложена Криком в 1953 г. [5]. По этой модели боковая цепь одной α-спирали попадает в углубление между четырьмя боковыми цепями на другой и наоборот. Таким образом, плотной упаковки α-спиралей можно достичь при Ω, равных 20° и –70°. Эта модель, получившая название “knobs-into-holes” (бугорки в ямки), актуальна до сих пор. Согласно другой широко известной модели, получившей название “ridges-into-grooves” (хребты в желобки), ряд боковых цепей на поверхности одной α-спирали попадает в углубление между рядами на другой спирали и наоборот [1, 2]. Плотную упаковку α-спиралей характеризуют три значения углов Ω, равные –105°, –52° и +23°. Детальный анализ этих моделей и экспериментальных данных привел авторов работы [3], Walther и соавт., к выводу, что модель Крика [5] лучше описывает упаковку α-спиралей и их боковых цепей в белках, чем модель “хребты в желобки” [2]. Однако взаимное расположение α-спиралей в белках определяет не только принцип плотной упаковки, но и химическая природа боковых цепей [6–8]. Как правило, α-спирали в белках амфифильны и расположены так, что их гидрофобные поверхности погружены в гидрофобное ядро, а гидрофильные боковые цепи и свободные полярные группы основной цепи доступны молекулам воды или взаимодействуют между собой или с кофакторами [9–11]. Принимая во внимание эти факторы, одним из нас разработана модель, в которой возможные способы упаковки α-спиралей разделены на два типа: это так называемые упаковки “лоб-в-лоб” (face-to-face) и “бок-о-бок” (side-by-side) [6–8]. В первом случае две α-спирали упакованы так, что гидрофобные боковые цепи образуют двойной слой между их остовами. Во втором случае гидрофобные боковые цепи формируют единый слой на поверхности двуспиральной структуры, а гидрофильные боковые цепи на противоположной стороне могут взаимодействовать между собой или с молекулами воды. Согласно этой модели, взаимная ориентацию α-спиралей определяет принцип плотной упаковки и распределение гидрофобных и гидрофильных боковых цепей на их поверхностях (т.е. геометрия гидрофобных кластеров). Кроме того, взаимное расположение α-спиралей зависит также от длины и конформации перетяжек между ними [12, 13].
В представленной работе мы рассматриваем еще один фактор, от которого зависит взаимное расположение α-спиралей в белках – это их длина. С помощью статистического анализа мы подтвердили известный факт − две длинные, связанные перетяжкой α-спирали, как правило, образуют шпильки, в которых они упакованы антипараллельно. Мы также показали, что если в парах связанных α-спиралей одна спираль длинная, а другая короткая, то будет ортогональная или скошенная упаковка. В работе представлены многочисленные данные, подтверждающие эти наблюдения, и рассмотрены возможные причины этой взаимосвязи.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Мы отобрали из банка белковых данных (PDB) 19 186 белков, идентичность последовательностей которых не превышала 30%, как это определено в самой базе [14]. Далее из нее выделили все спиральные пары, образованные соседними по цепи α-спиралями, связанными перетяжками. Чтобы распознать и отобрать спиральные пары, использовали метод, разработанный нами ранее [15–17]. Вторичную структуру белков определяли методом DSSP Кабша и Сандера [18]. Визуальный анализ структур проводили с помощью программы молекулярной графики RasMol [19]. При описании взаимного расположения α‑спиралей использовали два основных параметра – это расстояние d и угол Ω между осями спиралей. Чтобы вычислить эти параметры, использовали так называемую точечную модель, разработанную нами ранее [16, 17]. В основу этой модели положен известный факт − через две непересекающиеся прямые (в нашем случае они совпадают с осями спиралей) можно единственным образом построить две параллельные плоскости, кратчайшее расстояние между которыми обозначим как параметр d. В том случае, когда оси спиралей не пересекаются, а их проекции на одну из плоскостей пересекаются, то расстояние d − также минимальное расстояние между осями спиралей. При вращении осей спиралей вокруг отрезка d, который соединяет их ближайшие точки, изменяется взаимное расположение спиралей, что однозначно описывает торсионный угол Ω между осями спиралей, это угол между проекциями осей спиралей на плоскость, перпендикулярную отрезку d. Отметим, что это один и возможных способов измерения торсионного угла Ω, который по существу совпадает с определением торсионного угла Ω, данным в работах [1–5].
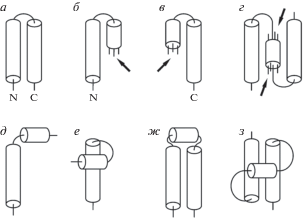
При определении понятий “короткая” и “длинная” спираль мы исходили из геометрических и стереохимических параметров α-спирали: шаг спирали равен 5.4 Å; на один виток спирали приходится 3.6 остатка; проекция одного остатка на ось составляет 1.5 Å; диаметр спирали может изменяться от 7−8 Å до 10−12 Å, но иногда достигает 15 Å в зависимости от размера боковых цепей. Из общих соображений понятно, что короткая α-спираль не может состоять меньше чем из 4−5 остатков (один виток). Чтобы при крестообразной упаковке двух спиралей CO- и NH-группы остова были доступны молекулам воды, длина короткой спирали должна быть сопоставима с диаметром второй спирали (см. рис.1е и описание нашей модели ниже). Так, например, если диаметр второй спирали около 12 Å, то короткая спираль должна состоять из 8−9 остатков. Таким образом, в исходной модели короткими считали α-спирали, состоящие из 5−8 остатков. В соответствии с моделью (см. рис 1б, в, г и их описание в тексте ниже), длинная спираль должна быть на 1.5−2 витка (и более) длиннее короткой, т.е. состоять в среднем из 12−14 остатков и более.
Рис. 1.
Схематическое изображение спиральных структур, в которых α-спирали упакованы в одном слое (а–д, ж) и в двух слоях (е, з). N и C ‒ обозначение концов спиралей.
Всего отобрано 336 640 пар связанных перетяжкой спиралей. На первом этапе в соответствии с критериями, описанными выше, полученное множество спиральных пар разбили на четыре группы пар: 1) образованные двумя длинными спиралями (LL, Long–Long); 2) первая спираль длинная, вторая – короткая (LS, Long–Short); 3) первая спираль короткая, вторая – длинная (SL, Short–Long); 4) две короткие спирали (SS, Short –Short). Проведенный нами анализ распределения частот встречаемости пар в зависимости от длины спиралей показал следующее. Длина спиралей в парах типа LL изменяется от 12–14 до 20–22 остатков, и наиболее часто обе спирали состоят из 14–15 остатков. В парах типа LS первая спираль чаще всего состоит из 12–13, а вторая из 9 остатков. В парах типа SL первая спираль чаще всего состоит из 8, вторая из 14 остатков. В парах типа SS чаще всего обе спирали состоят из 4–5 остатков. Таким образом, в настоящей работе длинными считали α-спирали, состоящие из 12–14 остатков и более, короткими – спирали из 4–8 остатков.
Далее отобрали только те пары, в которых α‑спирали взаимодействовали своими боковыми поверхностями и их оси не пересекались (примеры таких пар представлены на рис. 1а–в, е). L–образные пары, в которых спирали взаимодействуют торцами (рис. 1д) и не взаимодействуют боковыми поверхностями, не рассматривали. В таких L-структурах обе спирали лежат приблизительно в одной плоскости, расстояние d стремится к нулю, и их оси пересекаются под неким углом. Таким образом, определение торсионного угла Ω для таких пар теряет смысл.
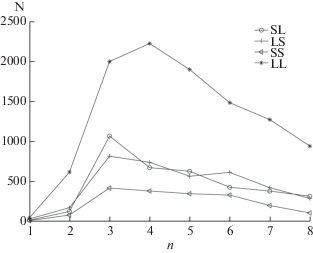
На рис. 2 представлено распределение частоты встречаемости спиральных пар четырех типов в зависимости от длины перетяжек между спиралями. Принимая во внимание то, что большинство спиральных пар имеет длину перетяжек из 3–5 остатков, а число найденных пар слабо зависит от дальнейшего увеличения длины перетяжек, в данной работе мы не рассматривали пары, в которых перетяжки состояли более чем из 8 остатков. Таким образом, для анализа расстояний d и торсионных углов Ω между осями α-спиралей отобрали пары типа LL (10 474), LS (3665), SL (3648) и SS (1895).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Как отмечено выше, α-спирали в белках упакованы так, что их гидрофобные поверхности погружены в гидрофобное ядро, а гидрофильные боковые цепи и полярные группы основной цепи взаимодействуют между собой или с молекулами воды. Во внутренних витках α-спирали NH- и CO-группы основной цепи образуют насыщенную систему водородных связей, однако три NH-группы на N-конце и три CO-группы на C-конце α-спирали свободны и должны быть доступны молекулам воды или иметь других партнеров для образования водородных связей. Их полное или частичное погружение в гидрофобное окружение без образования водородных связей энергетически крайне невыгодно.
Если обе α-спирали в паре длинные и имеют приблизительно одинаковую длину (рис. 1а), то чаще всего они упакованы антипараллельно под углом Ω ≈ 20° (рис. 3), и свободные NH- и CO-группы на их концах доступны молекулам воды. Стереохимический анализ показывает, что, если α-спирали в парах типа LS упакованы антипараллельно в одном слое (рис. 1б), то одна или две CO-группы на C-конце короткой спирали (показано стрелкой) могут быть полностью или частично погружены в гидрофобное окружение, образуемое остовом длинной спирали, ее гидрофобными боковыми цепями и гидрофобными ножками гидрофильных боковых цепей, что энергетически невыгодно. Аналогично, в парах типа SL одна или две NH-группы короткой спирали (показано стрелкой на рис. 1в) могут быть также погружены в гидрофобное окружение. Чтобы избежать этого, в белках α-спирали в парах типа LS и SL образуют αα-уголки [12, 20] с ортогональной (Ω ≈ –70°…–90°)) или скошенной (Ω ≈ –50°) упаковкой α-спиралей (рис. 1е) или L-образные структуры (рис. 1д, см. также рис. 1ж). В таких структурах NH- и CO-группы на концах спиралей полностью доступны молекулам воды. На рис. 1г показана гипотетическая структура, в которой короткая α-спираль упакована между двумя длинными α-спиралями в одном слое, и которая в белках практически не встречается. Она может быть преобразована, например, в структуру, показанную на рис. 1з, в которой концы спиралей доступны молекулам воды.
Рис. 3.
Число найденных в базе данных спиральных пар типа LL (N) в зависимости от расстояния d (а) и от углов Ω (б) при длинах перетяжек n = 1‒8.
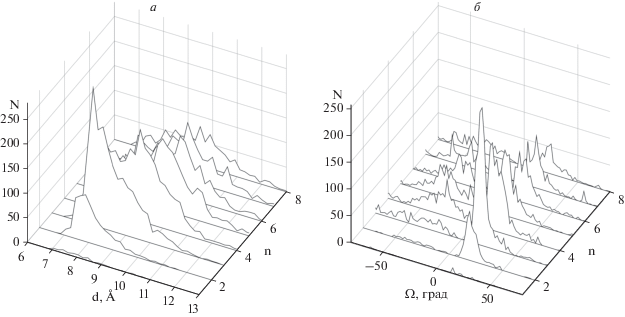
На рис. 3 представлено число найденных спиральных пар типа LL в зависимости от расстояния d и углов Ω между осями спиралей и длины перетяжек n (всего 10 474 пары). Как видно, большинство пар имеют расстояния d между осями спиралей в пределах 7–12 Å. Это указывает на то, что спирали в отобранных парах упакованы плотно. Большинство α-спиралей в этих парах упакованы антипараллельно под углами Ω, равными 20°–30°, с максимумом распределения при Ω ≈ 20°. Часть спиралей в парах типа LL образуют скошенную упаковку с углами Ω ≈ –40°…–50° (это свойственно многоспиральным структурам, таким как глобины, колицин А, альбумин и др.).
В спиральных парах типа LS α-спирали также упакованы достаточно плотно при расстояниях d между их осями от 7 до 12 Å (рис. 4а). Большинство α-спиралей в этих парах образуют скошенную или ортогональную упаковку с максимумами распределения при Ω ≈ –50° и Ω ≈ –70°…–90° (см. рис. 4б). Особо необходимо отметить, что в парах типа LS практически отсутствуют антипараллельные упаковки спиралей с углами Ω от –20° до +20°. Очень похожая картина наблюдается в парах типа SL. Большинство α-спиралей в них также образует скошенную или ортогональную упаковку с пиками распределения при углах Ω ≈ –40°…–50° и Ω ≈ –70°…–90°, и практически полностью отсутствует антипараллельная упаковка (рис. 5). Заметная часть α-спиралей в парах типа SS упакована при расстояниях d между их осями более 12 Å (рис. 6а).
Рис. 4.
Число спиральных пар типа LS (N) в зависимости от расстояния d между осями спиралей (а) и от углов Ω (б) при длинах перетяжек n от 1 до 8.
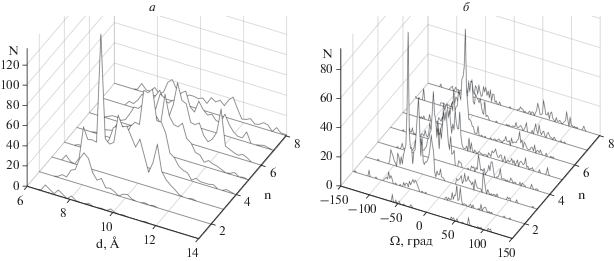
Рис. 5.
Число (N) спиральных пар типа SL в зависимости от расстояния d между осями спиралей (а) и от углов Ω (б) при длинах перетяжек n от 1до 8.
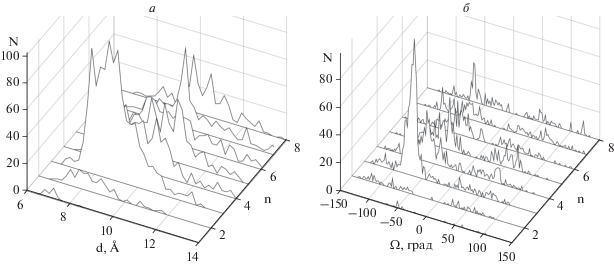
Рис. 6.
Число спиральных пар типа SS (N) в зависимости от расстояния d между осями спиралей (а) и от углов Ω (б) при длинах перетяжек n от 1 до 8.
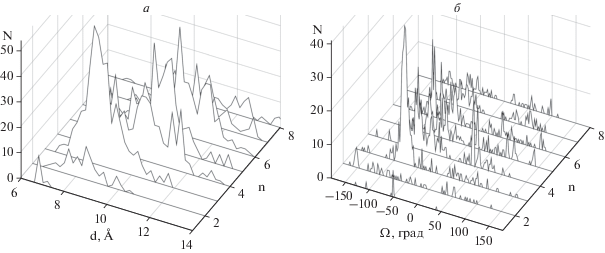
Это может быть связано, например, с увеличенным содержанием массивных ароматических боковых цепей или с наличием кофакторов в меж-спиральных областях. Большая часть α-спиралей в парах типа SS образует ортогональную или скошенную упаковку. Основные пики наблюдаются при углах Ω ≈ –70°…–80° и Ω ≈ –50° (рис. 6б). В отличие от пар типа LS и SL, спирали в парах типа SS образуют антипараллельную упаковку при углах Ω ≈ 20°. Небольшая, но заметная часть спиралей упакована при углах Ω = 40°–50°.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Из описанного выше следует, что взаимное расположение α-спиралей в белках зависит от нескольких факторов. Во всех известных моделях принцип плотной упаковки рассматривают как один из основных факторов, определяющих упаковку α-спиралей в белках. Необходимо отметить, что этот фактор учитывают не в полной мере, поскольку в моделях все боковые цепи, независимо от формы и размеров, представлены в виде шаров с одинаковым радиусом (см. [1–3, 5–8]). Однако, как это видно из распределения межспиральных расстояний d (см. рис. 3–7), в белках это не так, и расстояние d между осями спиралей не постоянная величина, а варьирует от 7–8 Å (например, когда между остовами спиралей находятся маленькие боковые цепи Ala, Gly) до 11–12 Å и более (когда между остовами упакованы массивные гидрофобные и ароматические боковые цепи). По-видимому, в этом состоит одна из основных причин того, что реальное распределение углов Ω в белках отлично от идеальных значений, которые предсказывают модели. Здесь необходимо также отметить, что расстояние d между осями спиралей коррелирует с диаметрами спиралей.
Рис. 7.
Число найденных в базе данных спиральных пар типа LL, LS, SL и SS (N) в зависимости от расстояния d между осями спиралей (а) и от угла Ω (б).
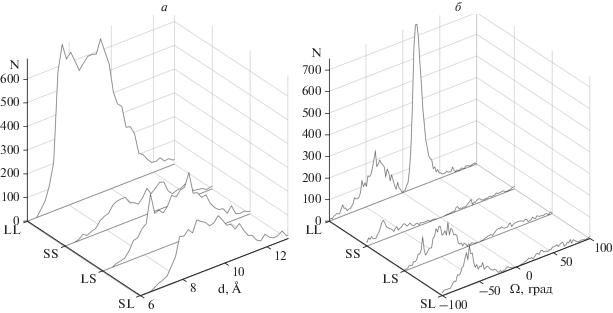
Взаимное расположение α-спиралей зависит от другого важного фактора ‒ химической природы боковых цепей. С одной стороны, в зависимости от способа объединения гидрофобных кластеров α-спиралей можно получить два типа упаковки: “лоб-в-лоб” или “бок-о-бок” [6–8]. С другой стороны, от геометрии гидрофобных кластеров (т.е. от расположения в цепи гидрофобных и гидрофильных остатков) непосредственно зависят углы Ω между осями спиралей. Так, если обе α-спирали имеют гидрофобные кластеры, образованные остатками в позиция 1-4-8-11-15… (это так называемые семичленные, или гептадные, повторы), то их комплементарное объединение происходит при Ω ≈ 20° (параллельно или антипараллельно). Если кластеры обеих спиралей образованы гидрофобными остатками в позициях 1-4-8-12-15-19… (это так называемые одиннадцатичленные повторы), то их комплементарное объединение происходит при и Ω ≈ 0°…–10°, а кластеры типа 1-5-9-13… объединяются при углах Ω ≈ –30°…–40° (подробнее описано в работе [8]). Как можно видеть, лучше всего эта зависимость прослеживается на примере пар из длинных спиралей типа LL (рис. 3б и рис. 7).
Взаимное расположение α-спиралей в парах типа LS и SL также зависит от химической природы полипептидной цепи, причем в большей степени от расположения в спиральных парах полярных групп основной цепи. Чтобы избежать погружения свободных полярных NH- и CO-групп на концах коротких спиралей в гидрофобное окружение, спиральные пары типа LS и SL образуют αα-уголки (рис. 1е) с ортогональной (Ω ≈ –70°…–90°) или скошенной (Ω ≈ –40°…–50°) упаковкой спиралей или L-образные структуры (рис. 1д). Как видно на рис. 4, 5 и 7, большинство пар этих типов образуют именно такие структуры. Большая часть спиральных пар типа SS также образует такие структуры (рис. 6, 7), хотя в распределении этих пар обнаружены небольшие пики при Ω = 20°–30° и Ω = = 40°–50°.
Другими словами, можно сделать вывод, что взаимное расположение α-спиралей в белках зависит от их длины: пары длинных спиралей (тип LL) упаковываются преимущественно антипараллельно; пары спиралей, в которых одна спираль длинная, другая – короткая (типы LS и SL), а также пары из коротких спиралей (тип SS) преимущественно образуют αα-уголки с ортогональной или скошенной упаковкой. Полученные результаты имеют очень большое значение для определения взаимной ориентации α-спиралей при моделировании и предсказании структуры белков.
Написание настоящей статьи не потребовало специального финансирования.
Работа не содержит каких-либо исследований, выполненных с использованием биологических материалов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Chothia C. Levitt M., Richardson D. (1977) Structure of proteins: packing of α-helices and pleated sheets. Proc. Natl. Acad. Sci. USA. 74, 4130–4134.
Chothia C., Levitt M. and Richardson D. (1981) Helix to helix packing in proteins. J. Mol. Biol. 145, 215–250.
Walther D., Eisenhaber F. Argos P. (1996) Principles of helix-helix packing in proteins: the helical lattice superposition model. J. Mol. Biol. 255, 536–553.
Trovato A., Seno F. (2004) A new perspective on ana-lysis of helix-helix packing preferences in globular proteins. Proteins. 55, 1014–1022.
Crick F.H.C. (1953) The packing of α-helices: simple coiled-coils. Acta Crystallogr. 6, 689–697.
Ефимов A.B. (1977) Стереохимия упаковок α-спиралей и β-структуры в компактной глобуле. Докл. АН СССР. 235, 699–702.
Efimov A.V. (1979) Packing of α-helices in globular proteins. Layer-structure of globin hydrophobic cores. J. Mol. Biol. 134, 23–40.
Efimov A.V. (1999) Complementary packing of α-helices in proteins. FEBS Lett. 463, 3–6.
Perutz M.F., Kendrew J.C. and Watson H.C. (1965) Structure and function of haemoglobin. II. Some relations between polypeptide chain configuration and amino acid sequence. J. Mol. Biol. 13, 669–678.
Schiffer M., Edmundson A.B. (1968) Use of helical wheels to represent the structures of proteins and to identify segments with helical potential. Biophys. J. 7, 121–135.
Lim V.I. (1974) Structural principles of the globular organization of protein chains. A stereochemical theory of globular protein secondary structure. J. Mol. Biol. 88, 857–872.
Efimov A.V. (1984) A novel super-secondary structure of proteins and the relation between the structure and the amino acid sequence. FEBS Lett. 166, 33−38.
Efimov A.V. (1991) Structure of α-α-hairpins with short connections. Protein Eng. 4, 245−250.
Berman H.M., Westbrook J., Feng Z., Gilliland G., Bhat T.N., Weissig H., Shindyalov I.N., Bourne P.E. (2000) The protein data bank. Nucleic Acids Res. 28, 235–242.
Тихонов Д.А., Куликова Л.И., Ефимов А.В. (2016) Статистический анализ внутренних расстояний спиральных пар в белковых молекулах. Математическая биология и биоинформатика. 11, 170–190.
Тихонов Д.А., Куликова Л.И., Ефимов А.В. (2017) Исследование межспиральных углов в структурных мотивах, образованных двумя спиралями. Математическая биология и биоинформатика. 12, 83–101.
Тихонов Д.А., Куликова Л.И., Ефимов А.В. (2017) Анализ торсионных углов между осями спиралей в спиральных парах белковых молекул. Математическая биология и биоинформатика. 12, 398–410.
Kabsch W., Sander C. (1983) Dictionary of protein se-condary structure: pattern recognition of hydrogen-bonded and geometrical features. Biopolymers. 22, 2577–2637.
Sayle R.A., Milner-White E.J. (1995) RASMOL: biomolecular graphics for all. Trends Biochem. Sci. 20, 374–376.
Ефимов А.В. (1984) Новая супервторичная структура белков: αα-уголок. Молекуляр. биология. 18, 1524–1537.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология