Молекулярная биология, 2020, T. 54, № 3, стр. 457-468
pH-Чувствительный калиевый канал TASK-1 ‒ хемосенсор центральной регуляции дыхания у крыс
Q. Q. Li a, K. X. Wan a, M. S. Xu b, L. M. Wang b, Y. Y. Zhang b, C. T. Wang a, F. X. Mao a, J. L. Zhu a, Z. M. Pan a, R. Gao a, *
a Department of Basic Medical Sciences, School of Medical, Shihezi University
832000 Shihezi, China
b State Key Laboratory of Sheep Genetic Improvement and Healthy Production, Xinjiang Academy of Agricultural
and Reclamation Sciences
832000 Shihezi, China
* E-mail: gaorui_shz@sina.com
Поступила в редакцию 11.09.2019
После доработки 30.10.2019
Принята к публикации 30.10.2019
Аннотация
Связанный с TWIK кислоточувствительный калиевый канал-1 (TASK-1) представляет собой калиевый канал утечки, чувствительный к внеклеточным протонам. TASK-1 способствует поддержанию потенциала покоя в нейронах млекопитающих. Каналы TASK-1 активно экспрессируются в нейронах центральной нервной системы, отвечающих за регуляцию дыхания. При ингибировании TASK-1 внеклеточным ацидозом может происходить деполяризация и повышение возбудимости этих клеток. Нами проанализировано распределение TASK-1 в стволе мозга крысы и показано, что мРНК TASK-1 присутствует в дыхательных ядрах вентральной поверхности продолговатого мозга, которые, как предполагают, выполняют роль нейрональных субстратов центральной хеморецепции у крыс. После вдыхания 8% CO2 в течение 30 и 60 мин уровень мРНК TASK-1 в TASK-1-экспрессирующих нейронах значительно повышался. Инъекция блокатора TASK-1 анандамида (AEA) в боковой желудочек головного мозга крысы приводила к существенной стимуляции дыхания через 10 мин после введения: заметно уменьшалась продолжительность вдоха и выдоха и повышалась частота дыхания. Мы предполагаем, что канал TASK-1 может служить хемосенсором в дыхательном центре и участвовать в регуляции дыхания, связанной с изменением рН. Канал TASK-1 может быть использован как индикатор H+/CO2 в некоторых дыхательных ядрах ствола мозга. Вполне вероятно, что TASK-1 участвует в химической регуляции рН-чувствительности дыхательного центра при физиологических и патологических состояниях.
ВВЕДЕНИЕ
Дыхательные движения ‒ это результат координированной ритмической активности нейронов, регулируемой дыхательным центром. Центральные хеморецепторы дыхания (CRC) рассредоточены по продолговатому мозгу и, будучи чувствительны к изменениям pH и концентрации CO2 в мозге, могут влиять на возбудимость нейронов, расположенных в дыхательном центре ствола мозга [1], тем самым играя важную роль в поддержании кислотно-щелочного баланса и гомеостаза in vivo. CO2 относится к широко распространенным химическим соединениям и действует как эффективный стимулятор в регуляции дыхания. В мозге происходит гидратация CO2, в результате чего образуются карбонат-ионы, гидролизующиеся в растворе с высвобождением протонов. Таким образом, повышенный уровень CO2 приводит к увеличению концентрации протонов в мозге с последующим воздействием на респираторную систему. Повышенные уровни протонов в мозге распознаются CRC, которые повышают возбудимость дыхательных нейронов и стимулируют дыхание, тем самым поддерживая газовый гомеостаз крови [2].
Кислоточувствительные ионные каналы пока охарактеризованы плохо, хотя показано, что они задействованы в рН-чувствительности CRC в области комплекса пре-Бëтцингера (pre-Bötzinger complex; PBC) и вентральной группы дыхательных нейронов (VRG) [3]. Ионные каналы, которые влияют и определяют возбудимость нейронов, становятся явными кандидатами на мощные рН-чувствительные молекулярные мишени. Недавно идентифицировано новое семейство калиевых каналов ‒ с двупоровым доменом. Эти каналы активны при или вблизи мембранного потенциала покоя и регулируют мембранный потенциал и входное сопротивление как ключевые детерминанты возбудимости нейронов [4]. Среди таких каналов TWIK-связанный кислоточувствительный калиевый канал-1 (TWIK-related acid-sensitive potassium channel-1; TASK-1) широко экспрессирован в дыхательных нейронах и динамически регулируется внеклеточными протонами в пределах физиологического диапазона pH [5, 6]. Каналы генерируют потенциалнезависимые токи, I‒V зависимость которых проявляет слабое выпрямление при асимметричном распределении калия [7]. Канал TASK-1 регулируется многими нейротрансмиттерами и летучими анестетиками, такими как серотонин, норадреналин, вещество P, тиролиберин и галотан [5, 7‒10]. Современные исследования показали, что TASK-1, в отличие от двух других калиевых каналов с двупоровыми доменами, блокируется непосредственно субмикромолярными концентрациями эндоканнабиноида, анандамида (AEA) [11]. К характерным особенностям TASK-1 относится его ингибирование при незначительном снижении внеклеточного pH с pK ингибирования канала протонами в пределах или вблизи физиологического диапазона (pK ~7.4) [7‒9]. Канал активируется путем повышения внеклеточного рН, что усиливает отток калия и возбудимость дыхательных нейронов, в то время как в противоположных условиях возбудимость нейронов снижается. Таким образом, в мембраны нейронов в дыхательном центре и/или CRC могут быть интегрированы каналы TASK-1, которые способны реагировать на изменения уровней H+ или CO2 во внеклеточной жидкости и, повышая возбудимость нейронов, усиливать дыхание.
В этой работе нами исследована экспрессия мРНК TASK-1 в нейронах, связанных с дыханием в стволе мозга, и возможные регуляторные механизмы TASK-1 в центральной хеморегуляции дыхания у крыс. Полученные результаты расширяют наше понимание возможной функции каналов TASK-1 в дыхательном центре.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Животные и распределение по группам. Самки и самцы крыс Sprague-Dawley (n = 60, возраст 8–9 недель, вес 250–300 г) были предоставлены Центром экспериментальных животных Синьцзянского медицинского университета (the Experimental Animal Center of Xinjiang Medical University, Китай). Животных разделили на две группы: для исследования экспрессии мРНК TASK-1 (n = 24) и наблюдения за каналом TASK-1 в процессе дыхания (n = 36).
Крыс в группе по экспрессии мРНК TASK-1 случайным образом распределяли по 3 подгруппам (n = 8 особей в каждой): группа вдыхаемого воздуха (A); группа, вдыхавшая воздух с повышенной концентрацией CO2 (8% CO2 + 21% O2 + + 71% N2) в течение 30 мин (B), и группа, вдыхавшая воздух с повышенной концентрацией CO2 (как указано выше) в течение 60 мин (С).
Крыс в группе мониторинга дыхания распределяли по 3 подгруппам (n = 12 ocoбей в каждой): контрольной группе NS вводили физиологический раствор, контрольной группе ETHON вводили этиловый спирт (этанол ≥ 99.9%) и экспериментальной группе AEA вводили ингибитор TASK-1 AEA, растворенный в этиловом спирте. Эксперименты проводили в соответствии с Руководством по этике для экспериментов на животных в Первой больнице Медицинского колледжа университета Шихэцзы, провинция Синьцзян (the Ethics Guidelines for Animal Experiments of the First Affiliated Hospital of Shihezi University Medical College, Xinjiang Province), Китай.
Обработка образцов. Анестезию крыс (n = 24) проводили этилкарбаматом (150 мг/кг; внутрибрюшинная инъекция). После медиального разреза шеи передние шейные мышцы резко отделяли, трахею высвобождали и интубировали. Двусторонние блуждающие и синусовые нервы разрезали. Температура заднего прохода поддерживалась на уровне около 37°C. Крысы в группе А получали нормальную ингаляцию воздуха, а крыс в группах В и С интубировали газообразным СО2 (как описано выше) в течение 30 и 60 мин соответственно. По истечении времени проводили трансаортальную перфузию нормальным солевым раствором (250 мл), а затем фиксатором Замбони (250 мл): 4% параформальдегида, 0.5% пикриновой кислоты в 0.1 М фосфатном буфере (рН 7.4). Ствол мозга удаляли и фиксировали с использованием того же раствора для фиксации в течение 30 мин. Ткани пропитывали 0.1 М фосфатно-солевым буфером (PBS; pH 7.4) и погружали в парафин. Серийные корональные срезы толщиной 7 мкм готовили из срезов области от задней части продолговатого мозга до передней части моста, при этом брали два соседних среза из каждых восьми. Один набор срезов анализировали по окрашиванию нейтральным красным в соответствии с картой Паксиноса и Уотсона, а другой использовали для гибридизации in situ. Срезы размораживали на стеклянных предметных стеклах, покрытых полилизином, а затем обезвоживали с использованием серийных разведений этанола и ксилола.
Окрашивание нейтральным красным. Парафиновые срезы депарафинировали стандартными способами и помещали в ксилол на 8 мин и в 100-, 95- и 70%-ный этанол (на 3 мин в каждый раствор) с последующей инкубацией в дистиллированной воде в течение 2 мин. Срезы мозга окрашивали 1%-ным раствором нейтрального красного в течение 6 мин, промывали дистиллированной водой в течение 30 с, дегидратировали, используя серийные разведения этанола и время инкубации 3 мин для каждого разведения, очищали в ксилоле и герметизировали нейтральной камедью.
Гибридизация in situ. На основе кДНК c мРНК TASK-1 крысы была подобрана олигонуклеотидная последовательность, не имеющая гомологии с какой-либо другой кДНК в GenBank (NM_03376.1):
P1 ‒ 5'-ATGCGGCACGCCGAGGTGTCCATGGCCAACATGGT-3';
P2 ‒ 5'-TCTCCTACTATGAGCGCTGGACTTT-CTTCCAGGAA-3';
P3 ‒ 5'-CGATTCATGACCATGAACGCCGAGGACGAGAAGCG-3' (“Boster”, Китай). На 3'-концах зондов была введена метка дигоксигенина (DIG). Предметные стекла обрабатывали 3%-ной перекисью водорода при комнатной температуре в течение 10 мин и промывали PBS, а затем инкубировали с протеиназой K (1 мкг/мл) в буфере, содержащем 100 мМ Трис-HCl, 50 мМ EDTA, 1 мМ диэтилпирокарбонат (pH 8.0), при 37°С в течение 8 мин. После промывания 0.02 М PBS срезы инкубировали в буфере для предварительной гибридизации: 50% деионизированный формамид, 2× физиологический раствор с цитратом натрия (SSC), 50× раствор Денхардта, 0.5% SDS, 10% декстрансульфат, 100 мкг/мл денатурированной ДНК спермы лосося ‒ в течение 3 ч при 37°С, а затем гибридизовали в 20 мкл гибридизационного буфера, содержащего 2.5 мкг/мл DIG-меченого олигонуклеотидного зонда, в течение 12 ч при 37°С. По окончанию этапа гибридизации срезы дважды погружали в 2× SSC и дважды в 0.2× SSC ‒ каждый раз на 15 мин при 37°С; после чего последовательно инкубировали с меченными биотином антителами против DIG и конъюгированным с пероксидазой хрена стрептавидином ‒ каждую процедуру проводили при 37°С в течение 20 мин. Срезы промывали PBS, проявляли, используя в качестве субстрата диаминобензидин, и окрашенные препараты дегидратировали с помощью серийных разведений этанола, после чего заключали в контейнер из нейтральной смолы для длительного хранения.
Подсчет и количественное определение нейронов, содержащих мРНК TASK-1. Среднее количество TASK-1 мРНК-положительных нейронов в ядре лицевого нерва подсчитывали, используя систему анализа медицинских изображений BI-2000 (“Chengdu TME Technology Co., Ltd”, Китай). Изменения среднего уровня яркости (gray value) положительных нейронов определяли количественно с использованием программного обеспечения MISA (http://www.pgrc.ipk-gatersleben.de/misa).
Положительные нейроны подсчитывали следующим образом. Область ядра лицевого нерва каждого среза разделяли на несколько непересекающихся полей зрения, и сумму числа положительных нейронов в каждом поле зрения брали за число положительных нейронов на этом срезе. Число TASK-1-позитивных нейронов в ядре лицевого нерва в каждом образце рассчитывали путем деления общего числа позитивных нейронов во всех срезах на число срезов. Уровень яркости измеряли следующим образом. Десять полей зрения на срезе использовали для определения уровня яркости, представляющего положительные нейроны, а сумму уровня яркости делили на 10, чтобы получить значение для положительных нейронов ядра лицевого нерва на данном срезе. Уровень яркости был обратно пропорционален интенсивности экспрессии мРНК TASK-1, то есть чем ниже уровень яркости, тем выше уровень мРНК TASK-1, и наоборот.
Электромиография диафрагмы и интрацеребровентрикулярное введение. Тридцать шесть взрослых крыс подвергали хирургическим процедурам, проводимым под анестезией этилкарбаматом. Блуждающие и синусовые нервы удаляли, а трахею интубировали. Биполярные проволочные электроды вставляли в диафрагму под контролем электромиографии. Температуру прямой кишки, частоту и амплитуду дыхания контролировали, как описано ранее [12]. Канюлю для интрацеребровентрикулярной инъекции имплантировали в боковой желудочек головного мозга на 1.0 мм сзади и на 1.5 мм латерально от брегмы и на 3.5 мм ниже поверхности коры. Крыс случайным образом отбирали для внутрицеребровентрикулярной инъекции 5 мкл физиологического раствора (n = 12), этилового спирта (n = 12) или 0.6 М AEA (“Sigma”, США) в этаноле (n = 12). Миоэлектрическую активность усиливали и интегрировали с использованием полиграфии (RM-6000; “Kohden”, Япония) и записывали с использованием системы сбора и анализа биологических сигналов PowerLab (ML-500; “AD Instruments”, Австралия) для последующего воспроизведения и анализа. Для каждой крысы запись проводили во временном интервале, начиная с 5 мин до инъекции и заканчивая 35 мин после инъекции. Изменения продолжительности вдоха (TI), продолжительности выдоха (TE), частоты дыхания (RF) и амплитуды вдоха (Amp) сравнивали с помощью дисперсионного анализа. Скорость изменения наблюдаемого индекса в каждой группе также рассчитывали для каждой временной точки по формуле: A% = = [(X ‒ Y)/Y] × 100%, где X ‒ наблюдаемое значение в данный момент времени, а Y ‒ контрольное значение.
Статистический анализ. Данные электрофизиологии, полученные от каждой крысы, усредняли для каждой экспериментальной группы, и рассчитывали стандартное отклонение (SD). Различия между двумя группами оценивали с помощью дисперсионного анализа, а различия внутри групп сравнивали с использованием t-критерия Стьюдента. Значение p ≤ 0.05 считалось статистически значимым.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Экспрессия мРНК TASK-1 в вентролатеральном мозговом веществе
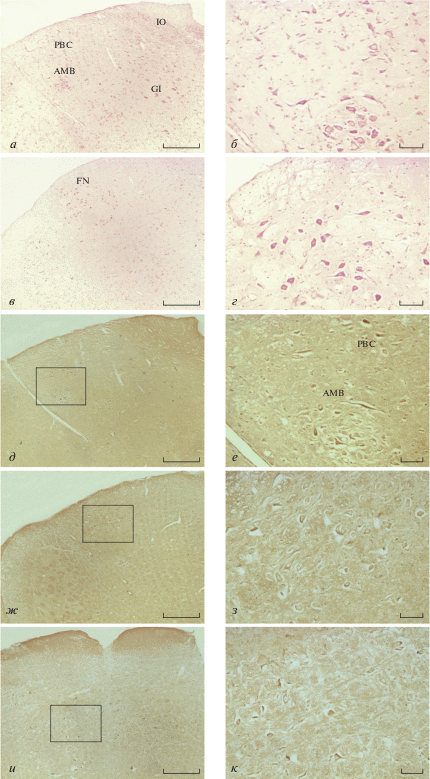
Цитохимическое окрашивание нейронов нейтральным красным показало, что розовые нейроны были распределены в стволе мозга, в двойном ядре (AMB), нижнем ядре оливы (IO), комплексе пре-Бëтцингера (PBC), гигантоклеточном ретикулярном ядре (GI) и ядре лицевого нерва (FN) (рис. 1а‒г). Ткани ствола мозга исследовали с помощью гибридизации in situ с использованием DIG-меченых олигонуклеотидных зондов, специфичных для TASK-1 млекопитающих. Как и ожидалось, TASK-1 активно экспрессировался в группе VRG. В TASK-1-положительных нейронах выявлена преимущественно цитоплазматическая локализация зонда с диффузным распределением окраски по ядру. Обнаружена экспрессия TASK-1 в лицевых нейронах и в двойном ядре (рис. 1д‒з), умеренные уровни транскриптов TASK-1 детектировали в нейронах гигантоклеточного ретикулярного ядра (рис. 1и, к). мРНК TASK-1 также присутствовала во всем пребëтцингеровском комплексе (рис. 1д, е).
Рис. 1.
Экспрессия мРНК TASK-1 в вентролатеральном отделе продолговатого мозга. а‒г ‒ Расположение двойного ядра (AMB), комплекса пре-Бëтцингера (PBC), нижнего ядра оливы (IO), ядра лицевого нерва (FN) и гигантоклеточного ретикулярного ядра (GI) с окрашиванием нейтральным красным в корональных срезах ствола мозга. д, е ‒ TASK-1 мРНК-позитивные нейроны в ядре PBC и AMB. (ж, з) ‒ TASK-1 мРНК-позитивные нейроны в FN. и, к ‒ TASK-1 мРНК-позитивные нейроны в GI. Правый столбик (е, з, к) — это увеличенные изображения левого столбика (д, ж, и). Шкала: 300 мкм (левый столбик), 50 мкм (правый столбик).
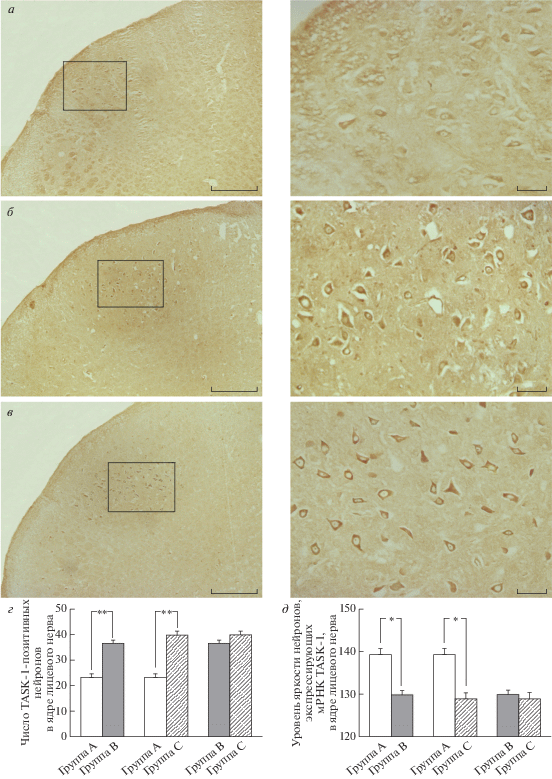
Влияние повышенного уровня CO2 на экспрессию мРНК TASK-1 в нейронах ядра лицевого нерва
Экспрессия TASK-1 была слабоположительной в ядре лицевого нерва у крыс из группы животных, вдыхавших воздух (группа А) (рис. 2а), и сильно повышена в группах B и C (рис. 2б и в). Так, по сравнению с крысами, вдыхавшими воздух (группа А), в группах В и С, вдыхавших 8%-ный CO2 в течение соответственно 30 и 60 мин, число нейронов, положительных по TASK-1, увеличилось с 23.24 до 36.46 (р < 0.01) в группе В (рис. 2г) и до 39.81 (р < 0.01) в группе С (рис. 2д), а уровень яркости значимо снижался с 139.25 до 129.86 (р < < 0.05) в группе В и до 128.9 (р < 0.05) в группе С. При сравнении образцов ядра лицевого нерва в группах крыс, вдыхавших 8%-ный CO2 в течение 30 (В) и 60 мин (С), выявлена тенденция к увеличению числа нейронов с 36.46 до 39.81 и снижению уровня яркости с 129.86 до 128.9, однако эти различия не были статистически значимыми (р > 0.05).
Рис. 2.
Влияние высокой концентрации CO2 на экспрессию мРНК TASK-1 в нейронах ядра лицевого нерва: в группе A, вдыхавшей воздух (а); в группе В, вдыхавшей CO2 в течение 30 мин (б), и в группе С, вдыхавшей CO2 в течение 60 мин (в). Правый столбик ‒ это увеличенные изображения левого столбика. Шкала: 300 мкм (левый столбик), 50 мкм (правый столбик). г ‒ Число TASK-1-положительных нейронов (среднее значение ± SD) в ядрах лицевого нерва у крыс в трех группах. **p < 0.01 по сравнению с группой A. д ‒ Уровень яркости TASK-1 мРНК-положительных нейронов (среднее значение ± SD) в ядрах лицевого нерва у крыс в трех группах. *p < 0.05 по сравнению с группой A.
Влияние канала TASK-1 на регуляцию активности дыхательного центра
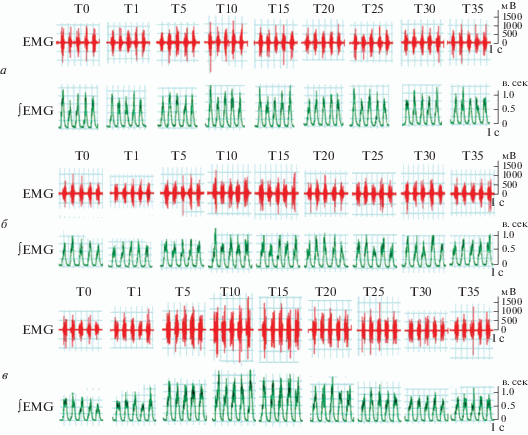
Учитывая, что мРНК TASK-1 преимущественно выявлена в области вентральной дыхательной группы нейронов, мы определили, участвует ли этот канал в регуляции активности дыхательного центра. При сравнении респираторных индексов мы не выявили заметных отличий в интервале: перед инъекцией до 35 мин после инъекции – в контрольной группе и группе с инъекцией этилового спирта (р > 0.05; рис. 3а, б). Напротив, по сравнению с состоянием до инъекции, через 10 и 15 мин после введения AEA, блокирующего TASK-1, дыхание значительно усиливалось и характеризовалось значительным снижением продолжительности вдоха (TI) и выдоха (TE) (р < < 0.01), а также увеличением частоты дыхания (RF) (p < 0.01); при этом амплитуда вдоха (Amp) увеличилась через 5 мин после инъекции, хотя это различие не было статистически достоверным (р > 0.05) (рис. 3в).
Рис. 3.
Эффект различных веществ на дыхательные движения крыс: нормального физиологического раствора (а), этанола (б) и анандамида (в). EMG ‒ необработанная электромиограмма диафрагмы; ∫EMG ‒ интегрированная электромиограмма диафрагмы. Т ‒ время после инъекции: 0, 1, 5, 10, 15, 20, 25, 30 и 35 мин соответственно.
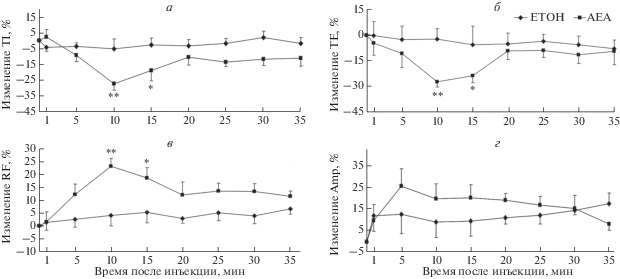
Продолжительность TI и TE (рис. 4а, б) была значительно снижена, а RF значимо увеличена (рис. 4в) в группе животных, которым вводили ингибитор через 10 и 15 мин, по сравнению с контрольными крысами, которым вводили этиловый спирт; при этом наблюдали повышение величины Amp, хотя разница не была значимой (рис. 4г).
Рис. 4.
Влияние селективного блокатора каналов TASK-1 анандамида (AEA) и этилового спирта (ETOH) на параметры дыхания у крыс: продолжительность вдоха (TI) (а); продолжительность выдоха (TE) (б); частоту дыхания (RF) (в); амплитуду вдоха (Amp) (г). *р < 0.05, **р < 0.01 против группы ETOH. Результаты представлены как среднее ± SD.
В течение 35 мин после инъекции изотонического физиологического раствора в боковой желудочек мозга крыс не наблюдали значимых различий в параметрах дыхания животных (р > 0.05). После инъекции этанола в боковой желудочек показатели дыхания контролировали и сравнивали до и на протяжении 35 мин после инъекции. Значительной разницы в значениях TI, TE, AMP или RF до и после инъекции этанола (р > 0.05) не выявлено (рис. 3а, б).
После введения ингибитора каналов TASK-1 в боковой желудочек зарегистрировано значительное укорочение продолжительности вдоха ‒ с 0.61 с до инъекции до 0.44 с (р < 0.01) в точке T10 и до 0.48 с (р < 0.05) в T15 после инъекции. Продолжительность выдоха также была укорочена ‒ с 0.90 с до инъекции до 0.65 с (р < 0.01) в Т10 и 0.67 с (р < 0.05) в Т15. В течение этого периода частота дыхания была значительно повышена ‒ с 41 раз/мин до инъекции до 50 раз/мин в точке Т10 и до 48 раз/мин в точке Т15 после инъекции (р < < 0.01). У животных, которым вводили ингибитор, выявлена тенденция к увеличению амплитуды вдоха через 5 мин, хотя различия не были статистически достоверными (р > 0.05) (рис. 3в).
Инъекция ингибитора увеличивала степень укорочения продолжительности вдоха в Т10 и Т15 ‒ на 5.06 и 2.69 до 26.98% и 18.68% соответственно (р < < 0.01 и р < 0.05 соответственно) (рис. 4а). Степень укорочения продолжительности выдоха значительно увеличилась на Т10 ‒ с 2.21 до 27.11% (р < 0.01) (рис. 4б), ‒ а затем значительно снижалась на Т15 до 23.04% (р < 0.05) (рис. 4б). Степень увеличения частоты дыхания значительно возрастала в точках Т10 и Т15 с 4.0 и 5.22% до 23.09 и 18.53% соответственно (р < 0.01 и р < 0.05 соответственно) (рис. 4в). Под действием ингибитора амплитуда вдоха начала увеличиваться, начиная с Т5, с 12.71 до 25.63%, однако различие не было статистически достоверным (р > 0.05) (рис. 4г).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В результате проведенных экспериментов выявлены отличающиеся профили экспрессии мРНК калиевого канала TASK-1 в продолговатом мозге крысы, в том числе в двойном ядре, гигантоклеточном ретикулярном ядре, в ядре лицевого нерва и пребëтцингерском комплексе. Эти результаты в основном согласуются с ранее опубликованными данными [5, 13].
Первичный нейрональный центр, ответственный за генерацию ритма у млекопитающих, недавно был локализован в пребëтцингерском комплексе в вентролатеральной части продолговатого мозга [14]. Модель генерации дыхательного ритма, предложенная Butera-Smith [14], предполагает, что пейсмекерная активность нервных клеток (пейсмекерная активность нервных клеток дыхательного центра формирует ритм дыхания – прим. ред.) пребëтцингерского комплекса обусловлена комбинацией двух факторов: калиевой проводимостью по каналам утечки и натриевым током [15‒18]. Согласно этой модели, синхронизированная деполяризация нейронов пейсмекерного типа и последующая дыхательная активность инициируются, когда небольшое число пейсмекеров достигает порогового потенциала посредством активации собственной проводимости [13]. Нами показано, что мРНК TASK-1 активно экспрессируется в пребëтцингерском комплексе. Эти результаты в сочетании со свойствами канала TASK-1 дают нам возможность предположить, что эти каналы могут вносить вклад в фоновую проводимость нейронов-пейсмекеров в комплексе пре-Бëтцингера [19].
Muzerelle и др. [20] обнаружили, что дыхательные нейроны в пребëтцингерском комплексе также имеют обширные связи с нейронами в других ядрах, включая ядро Кёлликера‒Фюзе, гигантоклеточное ретикулярное ядро, ядро лицевого нерва и ядро одиночного пути, и предположили, что многие области в стволе мозга могут участвовать в управлении основным дыхательным ритмом с помощью нейронов вентральной дыхательной группы во время передачи основного дыхательного ритма от пребëтцингерского комплекса к спинному мозгу. Таким образом, каналы TASK-1 в этих ядрах могут играть важную роль в регуляции возбудимости дыхательных нейронов в ответ на изменения внеклеточного pH, тогда как эти изменения могут регулировать дыхательные движения посредством обширных связей между нейронами и комплексом пре-Бётцингера.
На основании вышесказанного можно предполагать, что двойное ядро, ядро лицевого нерва и гигантоклеточное ретикулярное ядро участвуют непосредственно в дыхательных ритмах путем стимуляции спонтанных дыхательных нейронов и/или посредством формирования локальных нейронных цепей с нейронами в области пре-Бётцингера или другими связанными с дыханием нейронами, таким образом регулируя основной дыхательный ритм путем регуляции возбудимости нейронов пребëтцингерского комплекса. В этой связи мы дополнительно сравнили уровни экспрессии мРНК TASK-1 в ядре лицевого нерва крыс, вдыхавших воздух с повышенной концентрацией СО2 и не обогащенный СО2 воздух, и показали, что через 30 или 60 мин ингаляции число нейронов, экспрессирующих мРНК TASK-1, у животных экспериментальной группы было значительно выше, чем у крыс из контрольной группы (p < 0.01). Это подтверждено и уменьшением уровня яркости, хотя значимой разницы в числе положительных нейронов между двумя группами животных, вдыхавших CO2, не обнаружено.
В физиологических условиях CO2 относится к наиболее эффективным природным химическим стимулам, участвующим в регуляции дыхания [21]. Однако в настоящее время считается, что центральные хеморецепторы чувствительны только к катионам H+ и, таким образом, CO2 действует на центральные хеморецепторы главным образом через изменение концентрации ионов H+ [22]. CO2 ‒ жирорастворимый газ, который легко диффундирует через гематоэнцефалический барьер и достигает нейронов в поверхностной части вентральной области продолговатого мозга или диффундирует непосредственно во внеклеточную жидкость через капилляры и достигает поверхности центральных хеморецепторов [23]. CO2 реагирует с H2O с образованием HCO3‒ и H+ при катализе карбоангидразой. Катионы Н+ плохо нейтрализуются, так как в спинномозговой жидкости и внеклеточной жидкости отсутствуют анионы, и поэтому накапливающиеся ионы Н+ могут взаимодействовать с этими рецепторами и впоследствии стимулировать дыхательные нейроны через определенные нервные связи, вызывая усиление дыхательных движений. Следовательно, даже после разрушения периферических хеморецепторов или перерезания афферентного нерва вдыхание CO2 показывает, что животное все еще может выполнять дыхательные движения для усиления реакции, причем изменение концентраций CO2 и H+ в спинномозговой жидкости вызовет аналогичный эффект.
Экспериментально показано, что инфузия высоких концентраций газообразного CO2 в изолированные срезы головного мозга и вдыхание высоких концентраций CO2 могут вызывать у животных изменения мембранного потенциала, внутриклеточной концентрации анионов Cl‒ и дыхательного ритма [24, 25]. Однако вдыхание высоких концентраций СО2 может привести к его накоплению и вызвать респираторный ацидоз.
Небольшая гиперкапния стимулирует дыхательный центр, в то время как сильная гиперкапния может ингибировать его и даже вызвать паралич. Мы предположили, что в случае небольшой гиперкапнии увеличение концентрации СО2, проходящего через гематоэнцефалический барьер, приводит к повышению уровня катионов H+ в спинномозговой жидкости, а произошедшее снижение рН индуцирует повышенную экспрессию гена Task1, которая чувствительна к изменениям рН в физиологических условиях [26]. Этот рН-чувствительный калиевый канал может снижать отток ионов К+ из дыхательных нейронов и/или центральных хеморецепторов после кислотной стимуляции. Индуцируя деполяризацию клеток и потенциалы действия, это возбуждение далее передается в дыхательный центр для усиления дыхательного движения, тем самым дополнительно участвуя в процессе дыхательной регуляции.
В случае сильной гиперкапнии, хотя рН спинномозговой жидкости повышается, экспрессия канала TASK-1 в дальнейшем не усиливается [27] и активность анионного транспортера AE3 в мозге ограничивается. При снижении рН внутриклеточная концентрация ионов Cl‒ увеличивается, а возбуждающее влияние повышенных уровней H+ на дыхание в конечном итоге не в состоянии компенсировать ингибирующее действие Cl‒ на возбудимость дыхательных нейронов, что приводит к угнетению дыхания [28, 29].
Наши результаты подтвердили, что стимуляция высокой концентрацией CO2 может повышать экспрессию мРНК TASK-1. Это указывает на то, что TASK-1 может быть вовлечен в процесс сенсорного контроля уровней H+/CO2 в центральной нервной системе и в регуляцию дыхательных процессов. Кроме того, экспрессия TASK-1 стимулируется изменениями кислотности и щелочности спинномозговой жидкости, что отражает его регуляторную роль в дыхательных движениях при различных состояниях.
Ранее показано [13, 30], что одновременное ингибирование TASK-канала в глутаматергических премоторных нейронах, моторных нейронах и задающих ритм глутаматергических клетках пребëтцингерской области в результате снижения внеклеточного рН может увеличивать как частоту, так и амплитуду дыхательных движений. Такой эффект можно ожидать при активации механизмов центральной хеморецепции. Для исследования роли канала TASK-1 в регуляции центрального дыхания in vivo мы провели мониторинг электромиограмм диафрагмы при ингибировании каналов TASK-1.
Анандамид, AEA, ‒ это этаноламид арахидоновой кислоты (N-арахидоноилэтаноламин). Недавно показано, что AEA в концентрации 3 мкМ напрямую блокирует канал TASK-1, но не оказывает ингибирующего действия на других членов семейства калиевых каналов со слабым выпрямлением: TWIK-1, TWIK-2, TREK-1, TREK-2 и ТRААK [11]. Этот эффект не имитировался несколькими высокоаффинными синтетическими и природными агонистами рецепторов CB1/CB2. Кроме того, TASK-1 не был чувствителен к специфическому антагонисту рецептора CB1. При использовании метода локальной фиксации потенциала в конфигурации excised patch было показано, что блокирование каналов не зависит от сайтов фосфорилирования TASK-1, внутриклеточной концентрации кальция и G-белков [11]. Эти результаты позволяют предположить, что AEA блокирует TASK-1 напрямую, без участия рецепторов CB1/CB2. Учитывая это свойство AEA, мы использовали его как селективный блокатор каналов TASK-1.
Мы контролировали влияние механической стимуляции областей мозга, а также наличия дополнительного объема жидкости, вызванного инъекцией лекарственного средства в боковой желудочек мозга крысы, на респираторный индекс, включив в исследование группу животных, которым вводили физиологический раствор. Кроме того, поскольку AEA, блокатор каналов TASK-1, можно растворить только в этиловом спирте, мы включили в исследование контрольную группу, которой вводили равный объем этилового спирта, ‒ чтобы наблюдать его влияние на различные показатели процесса дыхания. Введение АЕА в боковой желудочек головного мозга приводило к значительному возбуждению дыхания. Длительность как вдоха, так и выдоха была значительно снижена, а частота дыхания увеличилась после инъекции АЕА, при этом не было значительного различия между дыханием до и после введения у крыс, которым вводили физиологический раствор или этиловый спирт (р > 0.05). Известно, что алкоголь избирательно снижает дыхательную двигательную активность верхних дыхательных путей и значительно снижает активность подъязычного и рецидивного гортанного нерва при низких дозах, не влияя на прохождение потенциала действия по диафрагмальному нерву [31]. Однако отсутствие дыхательных реакций в группах, которым вводили физиологический раствор и этиловый спирт, исключало влияние механической стимуляции или давления при инъекции, а также влияние алкоголя.
В этом исследовании AEA вводили в боковой желудочек, минуя любое влияние гематоэнцефалического барьера. AEA напрямую блокировал циркуляцию спинномозговой жидкости во многих частях центральной нервной системы [32] и через 10 и 15 минут после введения значимо изменял параметры TI, TE и RF. Кроме того, спектр функций AEA был довольно широким, поэтому это соединение эффективно блокировало каналы TASK-1 в дыхательных и центральных хеморецепторах, тем самым, возможно, усиливая дыхательные движения по двум путям. С одной стороны, блокирование каналов TASK-1 в дыхательном центре ингибировало фоновый ток калия в нейронах вдоха комплекса пре-Бëтцингера, вызывая деполяризацию передних инспираторных нейронов и генерирование потенциалов действия, непосредственно возбуждая инспираторные нейроны и одновременно ингибируя активность нейронов, отвечающих за выдох [33, 34], сокращение времени вдоха и выдоха и увеличение частоты дыхания. С другой стороны, снижение оттока K+ из-за блокирования каналов TASK-1 в нервах в центральных хеморецепторах (AMB, FN и т.д.) способствовало деполяризации нейронов и индуцировало потенциалы действия. Далее возбуждение передавалось в дыхательный центр через связи с широким спектром нейронных цепей, которые усиливали дыхательное движение. Таким образом, положительное влияние блокады TASK-1 на дыхательную активность позволяет предположить, что TASK-1 играет важную роль в регуляции активности дыхательных движений, особенно в отношении регуляции частоты дыхания. В заключение следует отметить, что калиевые каналы TASK-1 в стволе мозга, вероятно, способствуют наблюдаемой чувствительности нейронов ствола мозга к внеклеточному подкислению. Чувствительность тока калия через TASK-1 к изменениям внеклеточного pH в пределах физиологического диапазона [35‒37] позволяет предположить, что pH-чувствительные каналы TASK-1 могут выступать в качестве молекулярного субстрата для дыхательной хеморецепции [38]. Внеклеточное подкисление в области центральной хеморецепции может ингибировать отток калия и увеличивать возбудимость дыхательных нейронов, координируемых и интегрированных через дыхательный центр в спинной мозг, что влияет на скорость прохождения потенциала действия по диафрагмальному нерву. Соответственно каналы TASK-1 могут опосредовать pH-зависимое усиление возбудимости дыхательных нейронов, которые в конечном итоге передают активность дыхательного центра дыхательным мышцам. Согласно приведенному выше анализу, TASK-1 может участвовать в регуляции дыхательных движений при физиологических и патологических состояниях в качестве генетически кодируемого индикатора для чувствительных к химическому возбуждению жизненно важных молекул, а также рассматриваться как потенциальная терапевтическая мишень при лечении гипопноэ, вызванного гиперкапнией.
Исследование поддержано грантами Фонда естественных наук Китая (the Natural Science Foundation of China, Nos 31560269, 31601030, 30960173) и Фонда талантливых специалистов высокого уровня Университета Шихэцзи (the Foundation for High-level Talents of Shihezi University, No RCZX201448).
Вклад авторов: RG и QL разработали исследование; JZ и ZP провели эксперименты; LW, YZ, CW и FM проанализировали данные; KW и MX написали статью.
Все процедуры, проведенные с участием животных, соответствовали этическим стандартам учреждений или принятой практике таких исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Laouafa S., Perrin-Terrin A.S., Jeton F., Elliot-Portal E., Tam R., Bodineau L., Voituron N., Soliz J. (2017) Pharmacological, but not genetic, alteration of neural Epo modifies the CO2/H+ central chemosensitivity in postnatal mice. Respir. Physiol. Neurobiol. 242, 73‒79.
Feldman J.L., Mitchell G.S., Nattie E.E. (2003) Breathing: rhythmicity, plasticity, chemosensitivity. Annu. Rev. Neurosci. 26, 239‒266.
Koizumi H., Smerin S.E., Yamanishi T., Moorjani B.R., Zhang R., Smith J.C. (2010) TASK channels contribute to the K+-dominated leak current regulating respiratory rhythm generation in vitro. J. Neurosci. 30, 4273‒4284.
Goldstein S.A., Wang K., Ilan N., Pausch M.H. (1998) Sequence and function of the two P domain potassium channels: implications of an emerging superfamily. J. Mol. Med. 76, 13‒20.
Talley E.M., Lei Q., Sirois J.E., Bayliss D.A. (2000) TASK-1, a two-pore domain K+ channel, is modulated by multiple neurotransmitters in motoneurons. Neuron. 25, 399‒410.
Sirois J.E., Lei Q., Talley E.M., Bayliss D.A. (2000) The TASK-1 two-pore domain K+ channel is a mole-cular substrate for neuronal effects of inhalation anesthetics. J. Neurosci. 20, 6347–6354.
Goldstein S.A., Bockenhauer D., O’Kelly I., Zilberberg N. (2001) Potassium leak channels and the KCNK family of two-P-domain subunits. Nat. Rev. Neurosci. 2, 175‒184.
Patel A.J., and Honore E. (2001) Properties and mo-dulation of mammalian 2P domain K+ channels. Trends Neurosci. 24, 339‒346.
Lesage F. (2003) Pharmacology of neuronal background potassium channels. Neuropharmacology. 44, 1‒7.
Czirjak G., Fischer T., Spat A., Lesage F., Enyedi P. (2000) TASK (TWIK-related acid-sensitive K+ channel) is expressed in glomerulosa cells of rat adrenal cortex and inhibited by angiotensin II. Mol. Endocrinol. 14, 863‒874.
Maingret F., Patel A.J., Lazdunski M., Honore E. (2001) The endocannabinoid anandamide is a direct and selective blocker of the background K+ channel TASK-1. EMBO J. 20, 47‒54.
St John W.M., Wang S. (1977) Response of medullary respiratory neurons to hypercapnia and isocapnic hypoxia. J. Appl. Physiol. 43, 812‒821.
Washburn C.P., Bayliss D.A., Guyenet P.G. (2003) Cardiorespiratory neurons of the rat ventrolateral medulla contain TASK-1 and TASK-3 channel mRNA. Respir. Physiol. Neurobiol. 138, 19‒35.
Smith J.C., Ellenberger H.H., Ballanyi K., Richter D.W., Feldman J.L. (1991) Pre-Bötzinger complex: a brain-stem region that may generate respiratory rhythm in mammals. Science. 254, 726‒729.
Marchenko V., Koizumi H., Mosher B., Loshiya N., Tariq M.F., Bezdudnaya T.G., Zhang R.L., Molkov Y.I., Rybak I.A., Smith J.C. (2016) Perturbations of respiratory rhythm and pattern by disrupting synaptic inhibition within pre-Bötzinger and Bötzinger complexes. eNeuro. 3(2), pii: ENEURO.0011-16.2016. https://doi.org/10.1523/ENEURO.0011?16.2016
Glass L. (2001) Synchronization and rhythmic processes in physiology. Nature. 410, 277.
Pace R.W., Mackay D.D., Feldman J.L., Del Negro C.A. (2007) Role of persistent sodium current in mouse preBötzinger complex neurons and respiratory rhythm generation. J. Physiol. 580, 485‒496.
Del Negro C.A., Koshiya N., Butera R.J, Smith J.C. (2002) Persistent sodium current, membrane properties and bursting behavior of pre-Bötzinger complex inspiratory neurons in vitro. J. Neurophysiol. 88, 2242‒2250.
Smith J.C., Butera R.J., Jr Koshiya N., Del Negro C., Wilson C.G., Johnson S.M. (2000) Respiratory rhythm generation in neonatal and adult mammals: the hybrid pacemaker-network model. Respir. Physiol. 122(2‒3), 131‒147.
Muzerelle A., Scotto-Lomassese S., Bernard J.F., Soiza-Reilly M., Gaspar P. (2016) Conditional anterograde tracing reveals distinct targeting of individual serotonin cell groups (B5–B9) to the forebrain and brainstem. Brain Struct. Funct. 221, 535‒561.
Sowerby A., Ball A.S., Gray T.R.G., Newton P.C.D., Clark H. (2000) Elevated atmospheric [CO2] from a natural soda spring affects the initial mineralization rates of naturally senesced C3 and C4 leaf litter. Soil Biol. Biochem. 32, 1323‒1327.
Takakura A.C., Colombari E., Menani J.V., Moreira T.S. (2011) Ventrolateral medulla mechanisms involved in cardiorespiratory responses to central chemoreceptor activation in rats. Am. J. Physiol. Regul. Integr. Comp. Physiol. 300, R501‒R510.
Strauss K.I., Barbe M.F., Marshall R.M. Raghupathi R., Mehta S., Narayan R.K. (2000) Prolonged cyclooxygenase-2 induction in neurons and glia following traumatic brain injury in the rat. J. Neurotraum. 17, 695‒711.
Dean J.B., Lawing W.L., Millhorn D.E. (1987) CO2 degreases membrane conductance and depolarized neurons in the nucleus tractus solitarii. Exp. Brain Res. 176, 656‒661.
Sanna E., Cuccheddu T., Serra M., Concas A., Biggio G. (1992) Carbon dioxide inhalation reduces the function of GABAA receptor in the rat brain. Eur. J. Pharmacol. 216, 457–458.
Bayliss D.A., Barhanin J., Gestreau C., Guyenet P.G. (2015) The role of pH-sensitive TASK channels in central respiratory chemoreception. Pflügers Arch. 467, 917‒929.
Mulkey D.K., Talley E.M., Stornetta R.L., Siegel A.R., West G.H., Chen X., Sen N., Mistry A.M., Guyenet P.G., Bayliss D.A. (2007) TASK channels determine pH sensitivity in select respiratory neurons but do not contribute to central respiratory chemosensitivity. J. Neurosci. 27, 14049‒14058.
Davidson T.L., Sullivan M.P., Swanson K.E., Adams J.M. (1993) Cl-replacement alters the ventilatory response to central chemoreceptor simulation. J. Appl. Physiol. 74, 280‒285.
Erlichman J.S., Cook A., Schwab M.C., Budd T.W., Leiter J.C. (2004) Heterogeneous patterns of pH regulation in glial cells in the dorsal and ventral medulla. Am. J. Physiol. Regul. Integr. Comp. Physiol. 286, R289‒302.
Stornetta R.L., Sevigny C.P., Guyenet P.G. (2003) Inspiratory augmenting bulbospinal neurons express both glutamatergic and enkaphalinergic phenotypes. J. Comp. Neurol. 455, 113‒124.
Inoue T., Nakayama K., Ihara Y., Tachikawa S., Nakamura S., Mochizuki A., Takahashi K., Lijima T. (2017) Coordinated control of the tongue during suckling-like activity and respiration. J. Oral Sci. 59, 183‒188.
Wang X., Guan R., Zhao X., Zhu D., Song N., Shen L. (2018) TASK1 and TASK3 are coexpressed with ASIC1 in the ventrolateral medulla and contribute to central chemoreception in rats. Front. Cell. Neurosci. 12, 285.
Zuperku E.J., Stucke A.G., Krolikowski J.G., Tomlinson J., Hopp F.A., Stuth E.A. (2019) Inputs to medullary respiratory neurons from a pontine subregion that controls breathing frequency. Resp. Physiol. Neurobiol. 265, 127‒140.
Schwarzacher S.W., Smith J.C., Richter D.W. (1995) Pre-Bötzinger complex in the cat. J. Neurophysiol. 73, 1452‒1461.
Enyedi P., Czirják G. (2010) Molecular background of leak K+ currents: two-pore domain potassium channels. Physiol. Rev. 90, 559‒605.
Buckler K.J., Williams B.A., Honore E. (2000) An oxygen-, acid- and anaesthetic-sensitive TASK-like background potassium channel in rat arterial chemoreceptor cells. J. Physiol. 525, 135‒142.
Venglovecz V., Rakonczay Jr Z., Gray M.A., Hegyi P. (2015) Potassium channels in pancreatic duct epithelial cells: their role, function and pathophysiological relevance. Pflügers Arch. 467, 625‒640.
Bayliss D.A., Talley E.M., Sirois J.E., Lei Q. (2001) TASK-1 is a highly modulated pH-sensitive ‘leak’ K+ channel expressed in brainstem respiratory neurons. Respir. Physiol. 129, 159‒174.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


