Молекулярная биология, 2020, T. 54, № 3, стр. 480-486
Модификация 5'-конца лидерной последовательности мРНК приводит к изменению набора факторов, требуемых для инициации трансляции
П. А. Сахаров a, Е. А. Согорин a, С. Ч. Агаларов a, В. А. Колб a, *
a Институт белка Российской академии наук
142290 Московская обл., Пущино, Россия
* E-mail: kolb@vega.protres.ru
Поступила в редакцию 07.11.2019
После доработки 29.11.2019
Принята к публикации 03.12.2019
Аннотация
Распространенность неканонических механизмов эукариотической инициации трансляции указывает на их значение в регуляции синтеза белков, вовлеченных в ключевые события жизни клетки. Один из известных примеров неканонического кеп-независимого процесса ‒ инициация трансляции мРНК с 5'-нетранслируемой (лидерной) областью матрицы, кодирующей фотобелок обелин (“обелиновый лидер”). В настоящей работе мРНК с обелиновым лидером была модифицирована добавлением к ее 5'-концу 45 дезоксицитидиловых нуклеотидов и флуоресцентной метки. Образование рибосомных 48S инициаторных комплексов на стартовом кодоне такой модифицированной мРНК исследовали с помощью метода ингибирования удлинения праймера (тоу-принтинг). Оказалось, что, в отличие от мРНК с неизмененной лидерной последовательностью, инициация на мРНК с модифицированным лидером может происходить в отсутствие фактора eIF4F, хотя и с меньшей эффективностью. Обнаруженное явление указывает на неизученную функцию фактора eIF4F, проявляемую на начальном этапе узнавания мРНК инициирующей рибосомной субчастицей.
Инициация трансляции у эукариот является ключевым этапом биосинтеза белка: эффективность этого процесса определяет общую скорость трансляции и продуктивность синтеза белка. На этой стадии осуществляются основные механизмы регуляции белкового синтеза. Инициация трансляции большинства клеточных мРНК происходит по так называемому механизму сканирования [1]. Сначала 40S рибосомная субъединица связывается с тройственным комплексом eIF2 · GTP · Met · тРНКiMet и факторами инициации eIF3, eIF1 и eIF1A, образуя 43S преинициаторный комплекс. Этот комплекс далее связывается с кеп-структурой, расположенной на 5'-конце мРНК, образуя 48S комплекс. Связыванию 43S комплекса с кеп-структурой содействуют факторы инициации eIF4A, eIF4B и eIF4F. Последний состоит из трех субъединиц, и его состав описывается формулой eIF4E · eIF4G · eIF4A. После связывания преинициаторный рибосомный комплекс начинает ATP-зависимое движение (сканирование) в направлении от 5'-конца к 3'-концу вдоль цепи мРНК до достижения стартового кодона [2]. Как показано недавно, сканирование кепированных мРНК не содержит “слепых зон” (“blind spot”), и поиск инициаторного кодона начинается с самого первого нуклеотида [3].
Для успешного достижения 48S инициаторным комплексом стартового AUG кодона в случае природной кепированной мРНК β-глобина строго необходимы все факторы инициации так называемой четвертой группы ‒ eIF4F, eIF4A и eIF4B, а также ATP, а отсутствие кепа на синтетической лидерной последовательности глобиновой мРНК резко снижает эффективность образования 48S комплексов [4]. Однако удаление кеп-структуры не всегда приводит к столь фатальным последствиям для инициации трансляции: часто природные кепированные лидерные последовательности мРНК могут осуществлять успешную инициацию при использовании их в качестве некепированных конструкций. Для такой кеп-независимой инициации не требуется весь набор факторов инициации четвертой группы. Так, ни один из этих факторов (eIF4F, eIF4A, eIF4B) не требуется для инициации трансляции на мРНК с синтетическим (CAA)n-лидером [4], поли(A)-лидером мРНК вируса оспы [5] и омега-лидером РНК вируса табачной мозаики [6]. Другие некепированные лидеры, и в их числе лидерная последовательность мРНК, кодирующей обелин – светоизлучающий белок гидроидного полипа Obelia longissima, выявили несколько иную зависимость от факторов инициации. Для кеп-независимой инициации на мРНК с “обелиновым лидером” строго необходим фактор инициации eIF4F, тогда как присутствие свободного eIF4A и eIF4B необязательно [7]. В настоящей работе исследовали инициацию на мРНК с “обелиновым лидером”, 5'‑конец которого модифицирован добавлением участка, состоящего из 45 дезоксицитидиловых и 10 уридиловых нуклеотидов. 5'-Концевой нуклеотид мРНК был мечен флуорофором FAM, что позволяло следить за трансляцией такой мРНК в бесклеточной системе по возникновению флуоресцентных полирибосом. Таким образом, предшествующий “обелиновому лидеру” 5'-концевой участок мРНК имел следующую последовательность: 5'FАМ-dC45-U10. Введение дезоксирибонуклеотидов в начало “лидерного” участка имело целью функционально заблокировать свободный 5'-конец лидера мРНК – исключить его сканирование. Используя этот подход, мы исходили из общепринятого предположения о неспособности преинициаторного рибосомного комплекса сканировать участки ДНК. Дополнительные 10 уридиловых нуклеотидов на 3'-конце служили субстратом для РНК-лигазной реакции, с помощью которой проводилась модификация. Оказалось, что инициация на мРНК с таким модифицированным лидером может происходить в отсутствие фактора eIF4F, хотя и с меньшей эффективностью.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Плазмида. РНК, содержащую лидерную последовательность мРНК обелина и кодирующую люциферазу светлячка Photinus pyralis, получали с использованием конструкции pObeLucTMV [8].
Компоненты для сборки инициаторных 48S комплексов. Нативные факторы eIF2, eIF3, eIF4F, а также рибосомные 40S субъединицы выделяли из лизата ретикулоцитов кролика. Подробное описание процедуры выделения описано в работе [5]. Рекомбинантные факторы инициации трансляции eIF1, eIF1A, eIF4A и eIF4B получены по протоколу, представленному там же [5].
Транскрипция in vitro. Транскрипцию проводили по методике, описанной ранее [6]. Инкубационная смесь содержала 80 мМ Трис-OAc (рН 7.5), 10 мМ KCl, 10 мМ DTT (дитиотреитол), 2 мМ спермидина, 0.01% Тритона Х-100, по 4 мМ ATP, GTP, UTP и CTP, 22 мМ Mg(OAc)2, 1 ед./мкл ингибитора РНКазы Ribolock RNase Inhibitor (“Thermo Fisher Scientific”, США), 12 ед/мкл ДНК-зависимой-РНК-полимеразы фага Т7 и 100 нг/мкл ДНК-матрицы. Реакцию проводили при 37°C в течение 2 ч. Чистоту полученных полирибонуклеотидов проверяли методом электрофореза в 6%-ном поли-акриламидном геле (ПААГ), содержавшем 7% мочевины.
Бесклеточная система трансляции. Трансляцию проводили в бесклеточной системе на основе экстракта из зародышей пшеницы, как описано ранее [6].
Получение модифицированной флуоресцентно меченной мРНК. мРНК, содержащую “обелиновый лидер” и 172 нуклеотида кодирующей последовательности люциферазы светлячка, получали с помощью транскрипции in vitro. Продукт транскрипции содержал на 5'-конце трифосфат, поэтому для последующего лигирования его подвергали сначала дефосфорилированию с помощью щелочной фосфатазы (NEB), а затем фосфорилировали Т4-полинуклеотидкиназой (“Thermo Fisher Scientific”) по протоколам фирм-производителей. Конечный продукт содержал на 5'-конце монофосфат, что позволяло провести реакцию лигирования фрагмента мРНК с химически синтезированным (компания “СИНТОЛ”, Москва) олигонуклеотидом 5'FAM-dC45-U10. Реакцию проводили в объеме 50 мкл в фирменном буфере для лигирования Т4-РНК-лигазы (“Thermo Fisher Scientific”), содержавшем 0.2 ед./мкл Т4-РНК-лигазы и 25% ПЭГ-6000. В реакцию брали 500 пмоль (8.3 мкг) олигонуклеотида 5'FAM-dC(45)-U(10) и 170 пмоль (13 мкг) фрагмента РНК UTRobelin-Luc1723', состоящего из “обелинового лидера” и 172-нуклеотидного участка, кодирующего N-концевую область люциферазы светлячка. Реакционную смесь инкубировали в течение 15 ч при 25°С. Продукт реакции лигирования очищали с помощью электрофореза, как описано ранее [6].
Ингибирование удлинения праймера (тоу-принтинг). Формирование рибосомных инициаторных комплексов и анализ продуктов реакции ингибирования удлинения праймера осуществляли согласно [6, 9]. Рибосомные 48S инициаторные комплексы собирали из отдельных очищенных компонентов аппарата трансляции: 40S рибосомных субъединиц, мРНК, Met-тРНКi, факторов инициации eIF1, eIF2, eIF3, eIF4A, eIF4B и eIF4F, а также ATP и негидролизуемого аналога GTP ‒ GMP-PNP (последний был добавлен для того, чтобы блокировать трансляцию по достижении инициаторным комплексом стартового кодона); смесь инкубировали при 37°С в течение 15 мин. Реакцию удлинения праймера проводили с использованием ДНК-праймера с флуоресцентной меткой. Образовавшиеся в ходе реакции кДНК анализировали с помощью капиллярного гель-электрофореза. Собранные данные обрабатывали с помощью программного обеспечения GeneMarker 1.5 (SoftGenetics). Для определения количества продуктов обратной транскрипции измеряли интенсивность флуоресценции, соответствующую каждому пику кДНК.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение мРНК с “обелиновым лидером”, модифицированным по 5'-концу
Особенности инициации трансляции на “обелиновом лидере” изучали с использовием химерной мРНК, состоящей из химически синтезированного олигодезоксинуклеотида и рекомбинантной мРНК с “обелиновым лидером”, кодирующей N-концевой фрагмент люциферазы светлячка (172 нуклеотида кодирующей фермент последовательности). 45-Членный олигодезоксицитидиловый полимер, меченный по 5'-концевому цитидину производным флуоресцеина (FAM), был дополнен 3'-концевым 10-нуклеотидным олигоуридиловым спейсером. Всю последовательность, обозначаемую 5'FAM-dC45-U10, ковалентно присоединяли к 5'-концу мРНК в реакции лигирования с помощью РНК-лигазы. Полученную конструкцию очищали от непрореагировавших субстратов реакции с помощью электрофореза в денатурирующих условиях с последующей элюцией продукта реакции из ПААГ (рис. 1). Как видно из рис. 1а, выход продукта после реакции лигирования был невысоким, тем не менее, оказалось возможным получить препарат очищенной модифицированной мРНК в количестве, достаточном для дальнейших опытов (рис. 2б). Таким образом, получена химерная конструкция мРНК 5'FAM-dC45-U10-UTRobelin-Luc1723'.
Рис. 1.
Получение модифицированной мРНК 5'FAM-dC45-U10-UTRobelin-Luc1723'. На электрофореграмме а на дорожку 1 нанесен маркер длин мРНК; дорожка 2 – мРНК с “обелиновым лидером” до реакции лигирования (исходная); дорожка 3 – смесь компонентов лигирования после проведения реакции: верхняя полоса (с минимальной интенсивностью окрашивания) соответствует ожидаемому продукту лигирования – 5'FAM-dC45-U10-UTRobelin-Luc1723', вторая сверху полоса соответствует мРНК с “обелиновым лидером”, не вступившей в реакцию, третья сверху – непрореагировавший олигонуклеотид. Самая нижняя полоса ‒ лидирующий краситель бромфеноловый синий. На электрофореграмме б на дорожку 4 нанесен элюированный из геля препарат очищенной и сконцентрированной мРНК 5'FAM-dC45-U10-UTRobelin-Luc1723', на дорожку 5 – контрольная мРНК с “обелиновым лидером”. Гели окрашивали толуидиновым синим.
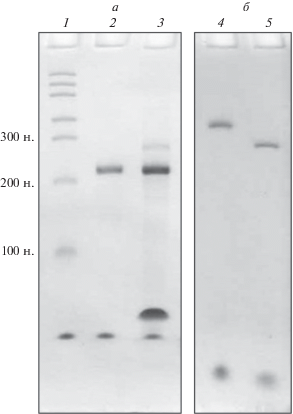
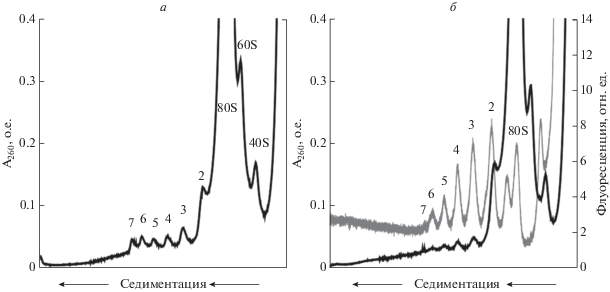
Рис. 2.
Формирование полирибосом при трансляции мРНК с “обелиновым лидером”, выявленное седиментацией в сахарозном градиенте (градиент 15‒45%, ротор SW-41, 37 000 об./мин, 2 ч, 4°C). Распределение оптической плотности (А260, черная кривая) и флуоресценции (серая кривая, флуорофором метили 5'-конец мРНК) во фракциях градиента сахарозы. Трансляция в бесклеточной системе немодифицированной мРНК (а) и мРНК, модифицированной олигонуклеотидом 5'FAM-dC45-U10 (б), продолжалась в течение 15 мин. Цифрами над пиками полирибосом обозначено количество 80S рибосом, входящих в их состав.
Трансляция модифицированной мРНК с “обелиновым лидером” в бесклеточной системе синтеза белка
Первым этапом нашего исследования стала проверка трансляционной активности такой модифицированной мРНК. Проверку проводили в бесклеточной системе трансляции на основе экстракта зародышей пшеницы. Трансляцию запускали добавлением исходной или модифицированной мРНК, и после 15 мин инкубации трансляционную смесь подвергали седиментационному анализу в сахарозном градиенте. Профиль седиментации детектировали как по оптической плотности в УФ, так и по флуоресценции (рис. 2). По распределению оптической плотности видно, что за 15 мин инкубации в трансляционной смеси образуются полирибосомы разного размера в случае как исходной (рис. 2а), так и модифицированной (рис. 2б) мРНК. Кроме того, на рис. 2б можно заметить хорошее совпадение пиков УФ-поглощения (черная кривая) и флуоресценции (серая кривая). Это однозначно свидетельствует о вовлечении модифицированной мРНК, содержащей 5'FAM, в трансляцию.
Таким образом, полученная модифицированная химерная мРНК с “обелиновым лидером” – 5'FAM-dC45-U10-UTRobelin-Luc1723' – способна успешно транслироваться в бесклеточной системе синтеза белка.
Формирование 48S инициаторных комплексов на мРНК с модифицированным “обелиновым лидером”
Белковые факторы, вовлеченные в инициацию на модифицированном “обелиновом лидере”, выявляли в системе для сборки 48S инициаторных комплексов, состоящей из индивидуальных компонентов инициации трансляции [5]. По формированию 48S комплекса на инициаторном кодоне можно судить об эффективности процесса сканирования. Образование 48S комплексов на стартовом кодоне изучали с помощью метода ингибирования удлинения праймера, или тоу-принтинга [10], в котором вместо радиоактивно меченного олигодезоксирибонуклеотида используют его флуоресцентно меченный аналог, а фрагменты кДНК визуализируют с помощью капиллярного электрофореза с детекцией флуоресценции [11].
На рис. 3 показаны результаты тоу-принтинга сформированных 48S инициаторных комплексов на АUG кодоне мРНК с модифицированным лидером. Из верхнего графика (pис. 3, верхний график) видно, что в присутствии полного набора факторов инициации на АUG кодоне модифицированной мРНК успешно формируется инициаторный комплекс, о чем свидетельствует наличие характерных пиков, соответствующих стартовому кодону. Исключение из системы фактора eIF2 (в таких условиях невозможно сканирование) приводило к полному отсутствию соответствующих пиков на электрофореграмме (pис. 3, нижний график), что свидетельствует о специфичности образования инициаторного комплекса в присутствии всех факторов.
Рис. 3.
Электрофореграммы тоу-принтинга на модифицированной мРНК с “обелиновым лидером”. a – Формирование 48S комплекса в присутствии полного набора факторов инициации. б – Из системы исключен eIF2. Над электрофореграммой приведена последовательность РНК-участка 5'-нетранслируемой области показано соответствие последовательности профилю флуоресценции.
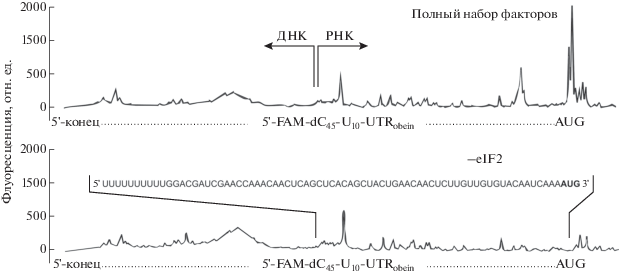
Этот результат дополняет эксперименты по трансляции на такой матрице, свидетельствуя о том, что на модифицированном по 5'-концу лидере происходит эффективная инициация трансляции. В этом случае инициация, на наш взгляд, может происходить по двум сценариям: либо рибосома способна распознавать модифицированный 5'-конец мРНК и независимо от того, какой далее следует нуклеотидный контекст, сканировать 5'-нетранслируемую область, в том числе и последовательность из 45 dC. Полностью исключить такую возможность нельзя, хотя она и представляется маловероятной. Скорее всего, из-за отсутствия “интактного” 5'-конца рибосома не связывается с концевой группой атомов, а осуществляет посадку где-нибудь внутри лидерной последовательности, после чего происходит сканирование.
Для дальнейшего изучения механизма инициации на модифицированной мРНК 5'FAM-dC45-U10-UTRobelin-Luc1723' из системы для формирования 48S комплексов был исключен фактор инициации eIF4F. Как показано ранее [7, 12], инициация трансляции на мРНК с “обелиновым лидером” происходит строго eIF4F-зависимо. На рис. 4а приведены результаты контрольных экспериментов на мРНК с немодифицированным “обелиновым лидером”, которые полностью подтверждают полученные ранее данные: в отсутствие фактора eIF4F на этом лидере не происходит формирование 48S комплексов на стартовом кодоне (рис. 4а, нижняя панель).
Рис. 4.
Электрофореграммы тоу-принтинга на мРНК с интактным (а) и модифицированным по 5'-концу (б) “обелиновым лидером”. Верхние электрофореграммы – формирование 48S комплекса в присутствии полного набора факторов инициации; нижние – из системы исключен eIF4F.
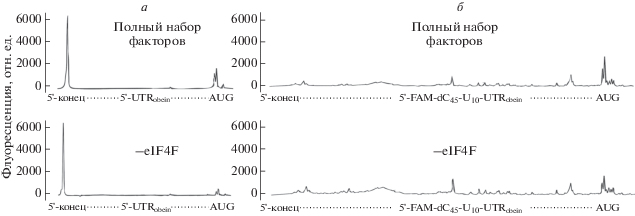
Однако в отличие от исходного лидера обелиновой мРНК, его модифицированная форма, содержащая 5'FAM-dC45-U10, достаточно неожиданно изменила зависимость образования 48S комплексов от eIF4F. Как видно из рис. 4б (нижняя панель), исключение из системы eIF4F не приводит к полному ингибированию образования 48S комплекса на АUG кодоне, снижая, однако, выход этого процесса. Следовательно, инициация на модифицированном “обелиновом лидере” может происходить и в отсутствие фактора eIF4F, хотя и с меньшей эффективностью. Таким образом, модификация 5'-конца “обелинового лидера” привела к появлению у него нового свойства ‒ принципиальной способности независимо инициировать eIF4F. Этот результат указывает на то, что сканирование такого лидера происходит неканоническим способом. Вероятнее всего, связывание рибосомы не зависит от 5'-конца мРНК, т.е. осуществляется путем посадки непосредственно на внутренний участок лидерного полинуклеотида.
Модификация 5'-конца мРНК в описанных опытах состоит в существенном изменении его химической идентичности и пространственной структуры: эта часть молекулы получила флуоресцеиниловый остаток и протяженный 45-членный участок ДНК. Удивительно, что столь искусственный, неприродный заместитель привел к таким же функциональным последствиям (см. рис. 4), как и наличие в реакционной смеси высокоспецифичного многосубъединичного белка, отобранного эволюцией – фактора eIF4F. Очевидно, что белковый фактор и 5'-концевой добавочный сегмент мРНК не могут обладать одинаковой биологической активностью. Следовательно, простое присутствие этого сегмента в молекуле привело к такому же результату, как и работа фактора eIF4F. Связывание eIF4F с 5'-концом обычных мРНК предполагает разворачивание третичной и вторичной структур полинуклеотида – об этом свидетельствуют и классические опыты по сканированию [13], и новые данные о структуре эукариотической рибосомы [14]. Представляется маловероятным, что добавленный сегмент смог разрушить структуру “обелинового лидера” без формирования альтернативного набора элементов вторичной структуры.
Можно предположить, что среди функций eIF4F, помимо узнавания и связывания кепа, обеспечения направленности сканирования, имеются и другие, пока не описанные: например, специфическое взаимодействие с 40S субчастицей рибосомы и мРНК, позволяющее разместить ее в канале для мРНК. Такая функция, если предположить ее наличие, должна быть сопряжена с разворачиванием пространственной структуры мРНК вблизи 5'-конца (но не полностью сводиться к нему), поскольку канал для матричной молекулы довольно тесен [14]. Скорее всего, отсутствие фактора eIF4F оказывается фатальным для образования 48S комплекса на интактном “обелиновом лидере” (рис. 4а) по причине его структурированности, мешающей попаданию лидера в канал для мРНК. Возможно, что наличие модифицирующего сегмента позволяет мРНК занять правильное положение на инициирующей субчастице, в то время как тепловые флуктуации, расплетая локальные участки вторичной структуры, разрешают бесфазное блуждание субчастицы вдоль последовательности лидера. Поскольку длина “обелинового лидера” невелика, такое блуждание делает инициацию возможной, хотя и проходящей со сниженной скоростью и эффективностью (рис. 4б).
Полученное в настоящей работе указание на дополнительную функцию фактора eIF4F требует дополнительной проверки. Скорее всего, разворачивание структуры мРНК и передача развернутого участка в канал для мРНК на малой субчастице рибосомы требует присутствия макроэргического кофактора (АТР). По крайней мере, с нашими данными согласуется наблюдение, сделанное в лаборатории W.C. Merrick [15], подтверждающее необходимость АТР для начального этапа инициации трансляции у эукариот.
Работа выполнена в Институте белка РАН, Пущино. Налаживание методики обнаружения РНК-рибосомных комплексов с помощью флуоресцентно меченной РНК проведено при поддержке Российского научного фонда (грант № 19-74-20186).
В работе не использованы биологические материалы, полученные от людей и животных.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Kozak M. (1989) The scanning model for translation: an update. J. Cell. Biol. 108, 229–241.
Jackson R.J., Hellen C.U.T., Pestova T.V. (2010) The mechanism of eukaryotic translation initiation and principles of its regulation. Nat. Rev. Mol. Cell Biol. 11, 113–127.
Kumar P., Hellen C.U., Pestova T.V. (2016) Toward the mechanism of eIF4F-mediated ribosomal attachment to mammalian capped mRNAs. Genes Dev. 30, 1573‒1588.
Pestova T.V., Kolupaeva V.G. (2002) The roles of individual eukaryotic translation initiation factors in ribosomal scanning and initiation codon selection. Genes. Dev. 16, 2906–2922.
Shirokikh N.E., Spirin A.S. (2008) Poly(A) leader of eukaryotic mRNA bypasses the dependence of translation on initiation factors. Proc. Natl. Acad. Sci. USA. 2105, 10738–10743.
Agalarov S.Ch., Sakharov P.A., Fattakhova D.Kh., Sogorin E.A., Spirin A.S. (2014) Internal translation initiation and eIF4F/ATP-independent scanning of mRNA by eukaryotic ribosomal particles. Sci. Rep. 4, 4438.https://doi.org/10.1038/srep04438
Сахаров П.А., Агаларов С.Ч. (2017) Инициация трансляции на некепированных мРНК может происходить без участия свободных факторов инициации eIF4A и eIF4B. Биохимия. 82(1), 43–50.
Kopeina G.S., Afonina Z.A., Gromova K.V., Shirokov V.A., Vasiliev V.D., Spirin A.S. (2008) Stepwise formation of eukaryotic double-row polyribosomes and circular translation of polysomal mRNA. Nucl. Acids Res. 36, 2476–2478.
Сахаров П.А., Соколов А.С., Агаларов С.Ч. (2015) Негидролизуемый аналог АТР – 5'-аденилимидодифосфат (AMP-PNP) – не ингибирует АТР-зависимое сканирование лидерной последовательности мРНК. Биохимия. 80(1), 59–64.
Hartz D., McPheeters D.S., Traut R., Gold L. (2007) Extension inhibition analysis of translation initiation complexes. Methods. Enzymol. 164, 419–425.
Gould P.S., Bird H., Easton A.J. (2005) Translation toeprinting assays using fluorescently labeled primers and capillary electrophoresis. Biotechniques. 38, 397‒400.
Сахаров П.А., Агаларов С.Ч. (2017) Мутантный фактор инициации eIF4A (R362Q) не подавляет сборку 48S преинициаторного комплекса на мРНК с лидирующей последовательностью мРНК, кодирующей обелин. Молекуляр. биология. 52, 24–28.
Kozak M. (1986) Influences of mRNA secondary structure on initiation by eukaryotic ribosomes. Proc. Natl. Acad. Sci. USA. 83, 2850‒2854.
Yusupova G., Yusupov M. (2017) Crystal structure of eukaryotic ribosome and its complexes with inhibitors. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 372(1716), pii: 20160184. https://doi.org/10.1098/rstb.2016.0184
Abramson R.D., Dever T.E., Lawson T.G., Ray B.K., Thach R.E., Merrick W.C. (1987) The ATP-dependent interaction of eukaryotic initiation factors with mRNA. J. Biol. Chem. 262, 3826–3832.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


