Молекулярная биология, 2020, T. 54, № 3, стр. 362-373
Перспективы использования однодоменных антител в биомедицине
С. В. Тиллиб *
Институт биологии гена Российской академии наук
119334 Москва, Россия
* E-mail: tillib@genebiology.ru
Поступила в редакцию 25.03.2019
После доработки 30.12.2019
Принята к публикации 30.12.2019
Аннотация
Методы, основанные на использовании высокоспецифичных антител, антиидиотипических антител и разнообразных генно-инженерных молекул со свойствами антител, а также методы иммунокоррекции и иммунопрофилактики с помощью вакцин остаются очень актуальными и активно разрабатываемыми подходами в области биомедицины. В последние годы особые надежды связывают с технологиями генерирования особых однодоменных рекомбинантных антител (нанотел) и их производных. В представленном обзоре рассмотрены недавно опубликованные данные об использовании нанотел в фундаментальных исследованиях, а также для диагностики и разработки новых иммунотерапевтических средств. Обсуждаются перспективы использования нанотел в качестве адресных молекул компонентов микробиоты, антиидиотипических нанотел, а также поиска перспективных мишеней для ранней диагностики с помощью нанотел.
ВВЕДЕНИЕ
Особые надежды в области биотехнологии и биомедицины связаны с прогрессом, достигнутым за последние годы в иммунологии ‒ с созданием новых методов исследования, накоплением больших массивов данных, а также с попытками системного интегративного подхода к иммунной системе человека. Новый системный взгляд на функционирование иммунной системы потенциально приведет к разработке более эффективных подходов как к диагностике, так и к иммунопрофилактике и терапии. Наряду с новыми технологическими возможностями геномики, протеомики, глобального секвенирования гипервариабельных областей всего репертуара антител и Т-клеточных рецепторов, а также с появлением интегративных подходов к системной биологии, разработки молекул, специфически связывающих заданную антигенную структуру, и методов иммунокоррекции с помощью вакцинации, остаются очень актуальными подходами, применяемыми в области биомедицины. Надежды исследователей связаны, в частности, с особыми однодоменными моноклональными антителами и их производными, cовременные перспективные направления применения которых рассмотрены в представленном обзоре. Этот обзор в какой-то мере можно считать продолжением опубликованной нами 9 лет назад статьи о “верблюжьих нанотелах” [1].
ОДНОДОМЕННЫЕ АНТИТЕЛА (НАНОТЕЛА) ‒ ПЕРСПЕКТИВНЫЕ ИНСТРУМЕНТЫ ДЛЯ ИССЛЕДОВАНИЙ, ДИАГНОСТИКИ И ИММУНОТЕРАПИИ
В дополнение к классическим моноклональным антителам в последние годы все большее внимание уделяется инженерии рекомбинантных фрагментов антител, а также других антигенсвязывающих молекул. Однако из всех новых технологий мы хотим выделить именно технологию получения рекомбинантных производных однодоменных антигенсвязывающих фрагментов (VHH) особых неканонических антител (HCAb, Heavy-Chain only antibodies). HCAb состоят из димера укороченной тяжелой цепи при полном отсутствии легких цепей (рис. 1). В норме HCAb присутствуют в крови представителей семейства Camelidae и у некоторых видов хрящевых рыб в дополнение к классическим типам иммуноглобулинов [2, 3]. Получаемые рекомбинантные мини-антитела называют однодоменными антителами, или “нанотелами”. Основными особенностями нанотел являются их небольшие размеры (12‒15 кДа, 4 × 2.5 нм), высокие растворимость и стабильность, способность к быстрой ренатурации, а также простота всевозможных модификаций методами генной инженерии и возможность использования чрезвычайно эффективного метода фагового дисплея для селекции оптимальных вариантов нанотел.
Рис. 1.
Схема структур (слева направо) классического антитела, особого неканонического антитела HCAb, состоящего из димера только тяжелой цепи иммуноглобулина, и рекомбинантного производного антигенсвязывающего домена HCAb –однодоменного антитела, или нанотела.
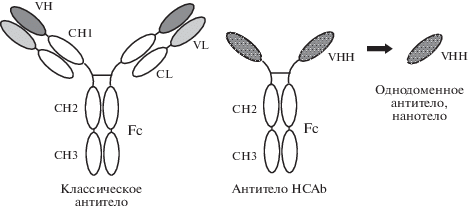
Нанотела способны формировать необычные паратопы и узнавать необычные для классических антител уникальные нативные эпитопы (преимущественно конформационные эпитопы, небольшие углубления, активные центры ферментов). Каркасные участки “верблюжьих” нанотел (VHH) имеют высокую гомологию (заметно выше, чем у VH мыши) с каркасными участками вариабельных VH-доменов иммуноглобулинов человека (подкласса IgG3) и могут относительно легко гуманизироваться без потери функциональности. Кроме того, производство нанотел в бактериях или любых иных системах экспрессии очень рентабельно, а нанотела относительно просто использовать в качестве строительных блоков для многодоменных конструкций. Нанотела ‒ это очень удобный инструмент для исследований и разработки новых иммунобиотехнологических подходов, когда нужно понять, диагностировать, визуализировать и лечить различные патологии, в том числе рак и другие социально значимые заболевания [4‒7].
Использование зондов на основе нанотел в исследованиях по молекулярной визуализации имеет существенное преимущество, благодаря быстрому, однородному накоплению нанотел в опухоли и быстрому удалению (через почки) из крови, что позволяет получить ранее недостижимую быструю визуализацию опухоли [8‒10]. В качестве примера можно привести результаты испытаний визуализирующего зонда для позитронной эмиссионной томографии на основе меченного изотопом галлия-68 анти-HER2-нанотела 2Rs15d. Доклиническая оценка выявила хороший токсикологический профиль и низкую радиационную нагрузку, что позволило конструкции войти в фазу I клинических испытаний. Эта конструкция показала хорошие результаты с точки зрения эффективности, накопления индикаторов и безопасности, так как не было обнаружено никаких побочных эффектов или антител против введенных нанотел, что делает эту конструкцию подходящей для вступления в фазу II клинических испытаний [11].
Мы совместно с немецкими и бельгийскими коллегами еще в 2006 году показали, что нанотела и гибридные белки (нанотело‒флуоресцентный белок) можно экспрессировать в функциональном виде в разных компартментах транзиторно экспрессированных клеток, что делает их удобными инструментами для сопоставления структурных или динамических характеристик, наблюдаемых in vitro (с помощью биофизических измерений), с функциональными наблюдениями на живых клетках и организмах in vivo [12]. Зонды на основе гибридного белка (нанотело и флуоресцентный белок, транскрибируемые в одной общей рамке считывания) могут экспрессироваться in vivo c дополнительного гена, не нарушая экспрессию никаких других генов. Нанотела удалось подобрать с подходящей аффинностью так, чтобы они специфично детектировали заданный антиген и при этом, по возможности, не мешали никаким биологическим процессам [12]. В настоящее время мы продолжаем подобные исследования, получая соответствующие модельные трансгенные линии мух дрозофил. Получено и проанализировано несколько линий мух, в которых с помощью внутриклеточного зонда (‘intrabody’) можно детектировать трансген, экспрессирующийся с индуцибельного или тканеспецифического промотора, и следить in vivo за эндогенным белком (ламином) в развивающемся эмбрионе. При этом мы не наблюдали заметного влияния трансгена на выживаемость трансгенных мух (не опубликовано).
Нанотела перспективны также в качестве инструментов для стабилизации дискретных конформаций важных регуляторных белков (показано на примере рецепторов, сопряженных с G-белком, GPCR) и в качестве шаперонов для получения кристаллов. Так, нанотела применяли в качестве биосенсоров для мониторинга конформационных изменений GPCR в живых клетках [13, 14]. С этой целью использовали специально генерированные нанотела, с помощью которых удалось зафиксировать GPCR в определенной конформации (активной или неактивной), что позволило получить принципиально важные данные о структурных и функциональных особенностях GPCR-зависимой системы передачи сигналов [13, 14]. Такие нанотела могут служить конформационными биосенсорами, а также использоваться для селективного модулирования функции GPCR определенного типа и связанного с ним G-белка, что может быть полезным при разработке новых лекарств. Активную структуру GPCR, связанного с лигандом-агонистом, стабилизированную in vitro cпециально полученным нанотелом, удалось кристаллизовать и определить с высоким разрешением с помощью рентгеноструктурного анализа [13, 14].
Нанотела имеют значительный терапевтический потенциал в качестве ингибиторов пар лиганд‒рецептор и направленных доставщиков лекарственных средств или заряженных лекарственными средствами наночастиц к опухолям. Биспецифические конструкции нанотел способствуют соединению цитотоксических клеток иммунной системы с раковыми клетками, а также позволяют тканеспецифически блокировать цитокины [15‒17].
Разработаны эффективные методы генно-инженерной модификации исходно отбираемых для заданных антигенов одновалентных однодоменных антител (последовательностей ДНК, кодирующих нанотела) с целью их адаптации для конкретного использования. Создаваемые на их основе более сложные молекулы, мультивалентные [18‒22], биспецифичные [16‒18] и иные [23, 24] конструкции могут приобретать заметно более высокую специфичность и эффективность связывания, существенно более высокую биологическую активность, а также применяться для получения новых биологических инструментов/материалов с улучшенными свойствами, например, для борьбы с вирусными или иными инфекциями [19‒21, 24]. Нанотела рассматриваются в качестве возможных лигандов при создании новых высокоспецифичных иммуносорбентов [25‒27].
Многочисленные биологические препараты на основе нанотел показали противоопухолевую эффективность в доклинических исследованиях in vivo (конкретные примеры подробно рассмотрены в обзоре Р. Bannas и соавт. [28]).
Нанотела могут противодействовать рецепторам факторов роста [29], блокировать ионные каналы [30] и эктоферменты [31, 32] в микроокружении опухоли.
Слияние одного или нескольких нанотел с шарнирными и Fc-доменами иммуноглобулина человека позволяет конструировать высокорастворимые антитела из тяжелых цепей (HCAb). HCAb примерно в 2 раза меньше обычных антител, поэтому они могут лучше проникать в ткани, чем обычные моноклональные антитела, сохраняя при этом способность рекрутировать систему комплемента, NK-клетки и макрофаги [33].
Генетическое слияние нанотел с пептидными метками открывает путь к маркировке опухолевых клеток для атаки специфичными к метке T‑клетками или NK-клетками, трансдуцированными химерным рецептором (CAR), специфичным для метки, или цитотоксическими антителами, специфичными для метки [34].
Небольшие модификации (введение дополнительных аминокислотных остатков или остатков цистеина в определенных положениях каркаса) позволяют проводить сайт-специфическую конъюгацию нанотела практически с любым химическим фрагментом, включая хелаторы радионуклидов, полиэтиленгликоль, липосомы и наночастицы [35, 36].
Результаты предварительных исследований указывают на целесообразность изучения способов использования противоопухолевых нанотел (Nb) для эффективного нацеливания на опухолевые клетки таких разрабатываемых лекарственных препаратов, как цитотоксические Т‑клетки, экспрессирующие сконструированные на основе нанотел химерные рецепторы Nb-CAR, и NK-клетки [37‒39], а также вирусные частицы, кодирующие противоопухолевые нанотела [40].
Образованная в 2001 году бельгийская фармакологическая компания “Ablynx” (www.ablynx.com) долгие годы была основным разработчиком биомедицинских препаратов на основе VHH-доменов особых антител верблюда и ламы. Термин ‘nanobody’ (нанотело) для рекомбинантных версий VHH-доменов является торговой маркой этой компании. Компания “Ablynx” в сентябре 2018 года довела клинические испытания одной из своих исторически первых разработок на основе нанотел ‒ димеризованного гуманизированного нанотела к мультимерному комплексу фактора Виллебранда (Caplacizumab, ALX-0681, Cablivi™), до получения первого (для этого нового типа лекарств) глобального разрешения на использование в Европейском Союзе для комбинированного лечения приобретенной тромботической тромбоцитопенической пурпуры в сочетании с заменой плазмы и иммуносупрессией [41]. Препарат Caplacizumab действует на А1-домен мультимеризованного комплекса фактора Виллебранда, предотвращая его связывание с рецептором гликопротеина Ib-IX-V тромбоцитов и ингибируя взаимодействие между фактором Виллебранда и тромбоцитами, а тем самым адгезию тромбоцитов [42, 43].
Можно упомянуть ряд недавно успешно завершившихся клинических испытаний 1-й и 2-й фазы различных препаратов на основе нанотел [44]. Так, успешно закончены испытания фазы 1 нанотела (ALX-0171) против большой панели изолятов респираторно-синцитиального вируса (RSV) человека для лечения инфекций нижних дыхательных путей. Следует отметить, что это препарат не для системного, а для ингаляционного введения, что дает ему преимущество перед другими аналогами [45]. Анти-RANKL-нанотела (ALX-0141) испытаны при нарушениях, связанных с потерей костной ткани, анти-IL17-A/F-нанотела (MSB0010841) ‒ для лечения псориаза. Испытано также биспецифическое нанотело для таргетирования фактора роста эндотелия сосудов и ангиопоэтина-2 (BI836880) [44].
Благодаря способности нанотел связывать необычные эпитопы, удалось идентифицировать нанотела против хемокиновых рецепторов (одно из важных подсемейств GPCR): нанотела против CXCR4 подавляют хемотаксис, репликацию ВИЧ-1 и мобилизуют стволовые клетки [46], нанотела против CXCR7 способствуют уменьшению роста раковых клеток головы и шеи in vivo [47]. Антитела канонической структуры против этих рецепторов ранее получить не удавалось [48]. Производные этих нанотел находятся в начальной фазе клинических испытаний.
Успешно завершена 2-я фаза испытаний нанотела против ротавируса (VHH 203027). Пероральный прием этого нанотела снижал тяжесть и продолжительность ротавирусной диареи у мальчиков [44].
Препарат ALX-006, представляющий собой гетеродимер нанотела к рецептору интерлейкина-6 (IL-6R) и нанотела против сывороточного альбумина (для увеличения времени полужизни препарата in vivo), в настоящее время проходит фазу 2 клинических испытаний в качестве средства от артрита и системной красной волчанки [49].
Препарат Ozoralizumab (ATN-103) ‒ тривалентная конструкция, состоящая из двух нанотел против провоспалительного цитокина TNFα и одного нанотела против сывороточного альбумина, успешно проявил себя во второй фазе испытаний в качестве средства против ревматоидного артрита [44].
С целью таргетной терапии опухолей начаты испытания необычной гибридной биспецифической молекулы, состоящей из нанотела против рецептора EGFR1 и антигенсвязывающего домена иной природы (affibody) против рецептора HER2 [50].
НАНОТЕЛА КАК АДРЕСНЫЕ МОЛЕКУЛЫ КОМПОНЕНТОВ МИКРОБИОТЫ
Организм человека все чаще начинают рассматривать как суперорганизм, в котором в тесном симбиозе сосуществуют собственно организм человека и многие микроорганизмы, обозначаемые в совокупности как микробиом и колонизирующие в частности, желудочно-кишечный тракт, слизистые оболочки и кожу человека.
Изменения микробиома и микробного метаболома (совокупность продуктов обмена веществ микробиома), их взаимодействие с иммунной, эндокринной и нервной системами коррелируют с широким спектром заболеваний: от воспалительных заболеваний кишечника, рака, аллергии, кардиометаболических, сахарного диабета, ожирения, артрита, до серьезных депрессивных расстройств и аутизма. Микробиомный дисбиоз (микробиологический дисбаланс в организме), особенно в желудочно-кишечном тракте, все больше связывают с разнообразными нарушениями, которые отягощают течение многих заболеваний [51‒53].
Основная цель терапии дисбиоза – обеспечить экологический импульс для восстановления экофизиологического разнообразия микробиоты и функциональной согласованности органометаболической сети, необходимых для здорового состояния индивида. Применение естественной микробиоты в качестве терапевтического агента (трансплантация фекальной микробиоты), несмотря на его доказанную эффективность, сопряжено с рядом проблем, таких как безопасность, воспроизводимость, стандартизация и контроль качества агента [54]. Одним из перспективных способов восстановления “здорового” микробиома считается использование синтетических консорциумов микробиоты. Основную проблему при создании таких консорциумов представляет трудность воспроизведения их внутренней физической и функциональной взаимосвязи и, как следствие, неопределенность их экологической судьбы в месте введения. Так, возможная быстрая потеря одного или нескольких членов консорциума из-за низкой конкурентоспособности в динамических условиях окружающей среды (например, в желудочно-кишечном тракте) с последующей потерей полезных функций данного администрируемого консорциума может помешать эффективности терапевтического вмешательства. Противостоять возможной потере необходимой согласованности и взаимосвязанности синтетического консорциума микробиоты предложено путем физического связывания партнеров консорциума с помощью “специфического клея” из экспонируемых на поверхности бактериальных клеток рекомбинантных однодоменных антител (нанотел) с заданной специфичностью [54, 55].
Для получения дисплея нанотел на бактериальной поверхности предложено слить их генно-инженерным путем с N-фрагментом белка интимина, локализующегося на внешней мембране клеток грамотрицательных бактерий. Якорный фрагмент интимина очень устойчив к сильным денатурирующим агентам и протеазам, он позволяет экспонировать нанотела с высокой плотностью на поверхности бактерии (E. coli), проводить эффективную селекцию методом клеточного дисплея других нанотел из VHH-библиотек [56] и создавать бактериальные клетки, специфически связывающие за счет экспонированных нанотел определенные антигены на клетках-мишенях [57]. Нанотела можно использовать для контролируемого формирования комбинаций разных производных E. coli в предопределенных архитектурах [58]. Показана принципиальная возможность создания синтетического консорциума микробиоты на основе инициирующего штамма (затравки), экспрессирующего нанотела, которые стабильно связывают один или несколько целевых штаммов, несущих соответствующие натуральные или генно-инженерные антигены на поверхности. В случае терапии с использованием микробиоты такой затравочный бактериальный штамм или один из штаммов-мишеней должен быть “хорошим колонизатором” целевого органа организма хозяина, чтобы синтетический консорциум сохранялся в течение достаточно продолжительного периода времени, необходимого для достижения терапевтического эффекта. Позволяя создавать согласно намеченному модульному дизайну синтетические, физически связанные консорциумы хорошо охарактеризованных микробов, платформа бактериального поверхностного дисплея нанотел обеспечивает функциональную согласованность, необходимую для интервенций с позиций точной персонализованной медицины, базирующейся на синтетической микробиологии, и таким образом открывает область новых подходов к лечению дисбиозов микробиоты [57, 59].
АНТИИДИОТИПИЧЕСКИЕ НАНОТЕЛА
Взгляд на иммунную систему, как на единую сложную сетевую организацию, подобную, например, предлагаемой N.K. Jerne. в его теории идиотипической сети, был совсем непопулярен в предыдущие примерно два десятка лет. Однако ряд современных иммунологов считает, что вопрос идиотипических сетей остается недоисследованным, и с помощью новых современных технологий и инструментов (скрининговых методик, глобального секвенирования, глобального протеомного анализа и других) можно вернуться к этой проблеме на новом уровне. Одним из таких перспективных инструментов могут быть однодоменные антитела (нанотела) и скрининговые методики на основе фагового дисплея нанотел.
Концепция идиотипов возникла в 50‒60-е годы прошлого века. Идиотип ‒ это индивидуальная антигенная детерминанта изолированного антитела или конкретного типа рецепторов Т- или В-лимфоцитов [60]. Согласно современной терминологии, впервые предложенной в 1960 году N.K. Jerne [61], эпитопы являются детерминантами антигенов, которые распознаются с помощью специфического сайта связывания антител – паратопа. Идиотип представляет собой структуру, образованную ассоциацией вариабельных областей тяжелых и легких цепей антитела. Каждый идиотип способен стимулировать продукцию комплементарных антиидиотипических антител, антигенузнающий участок которых может быть конформационно схожим с исходной антигенной детерминантой (конкретным эпитопом антигена). Таким образом, активные центры антител, образующихся в ответ на внедрение антигена, в свою очередь выступают в роли антигенов. Потенциальная регуляторная роль идиотипических/ антиидиотипических взаимодействий в иммунной системе стала центром многих исследований, начиная с 1974 года, когда предположили, что иммунный ответ может регулироваться посредством взаимодействий идиотипов и антиидиотипов [62]. Антиидиотипические антитела предположительно могут стимулировать или супрессировать функции Т- и В-лимфоцитов, будучи тем самым регуляторным звеном в иммунной системе.
Ранее в работах многих исследователей было показано, что антиидиотипические моноклональные антитела имеют терапевтический потенциал для использования в качестве заменителей (миметиков) антигенов (причем как белковой, так и небелковой или смешанной природы) в вакцинах против бактериальных, вирусных и онкологических заболеваний. Антиидиотипические антитела применяют в тех случаях, когда сложно приготовить и применить собственно препарат антигена, в котором сохранен нужный эпитоп в нативной конформации. Препарат антигена может быть токсичным, нестабильным, вызывать недостаточно сфокусированный иммунный ответ. Наконец, нативная структура антигена может быть плохо изучена, при том что уже получены антитела (идиотипы), специфически узнающие его in vivo. Очевидно, что нужны дополнительные исследования и более тщательный отбор конкретных вариантов антиидиотипических антител, которые при взаимодействии с идиотипом могут эффективно конкурировать за связывание с заданным нативным эпитопом целевого антигена-мишени [63‒65].
Отталкиваясь от упомянутых теоретических представлений о сетевой организации иммунной системы, любопытно взглянуть на весьма особую ситуацию у представителей сем. Верблюдовые, где обнаружено необычное сочетание двух типов антител/рецепторов В-клеток, заметно различающихся по свойствам. Репертуары возможных паратопов антигенсвязывающих структур антитела НСАb и классических антител, по-видимому, могут заметно отличаться. Эти два типа антител сосуществуют в одном организме, поэтому можно предполагать, что они не конкурируют, а взаимно дополняют друг друга. Действительно, не раз отмечалось, что оба типа антител могут возникать параллельно (взаимоисключающе или в разных соотношениях) к разным эпитопам/антигенам многокомпонентного антигенного материала, используемого при иммунизации одного и того же животного. При Вестерн-блот-анализе мы часто наблюдали дифференциальный характер узнавания фракционированных антигенов этими двумя типами антител, выделенными из одной иммунной сыворотки [1]. В известном учебнике А.А. Ярилина “Иммунология” высказано сомнение по поводу возможности адекватной антигенной мимикрии, как правило, выпуклого эпитопа антигена с помощью классических (пусть и антиидиотипических) антител, активные центры которых обычно имеют вогнутую структуру [66]. Однако такая выступающая структура вполне реальна в случае неканонических антител НСАb (и их производных нанотел), у которых более удлиненный третий гипервариабельный участок (CDR3) образует именно выступающие структуры [6, 67‒69]. Таким образом, в арсенале Верблюдовых есть потенциальная возможность создания “более комплементарных” взаимодействий внутри сети идиотипов‒антиидиотипов. На наш взгляд, именно особенности структуры VHH-доменов делают нанотела потенциально уникальным инструментом для создания антиидиотипов, мимикрирующих (в плане специфического узнавания/связывания) определенные структурные (конформационные) эпитопы различных антигенов-мишеней (рис. 2).
Рис. 2.
Схематическое изображение предполагаемых этапов идиотипической цепи с участием однодоменных антител (VHH). Сначала в организме образуются первичные антитела/идиотипы (Ab1) к определенным эпитопам антигенов (Ag) К ним, предположительно, могут быть получены антиидиотипические нанотела (VHH) и из них отобраны Ab2β-варианты, сходные с антигенными эпитопами исходного антигена. Эти Ab2β-подобные VHH теоретически могут мимикрировать заданный эпитоп целевого антигена и при вакцинации потенциально способны вызывать образование Ab3, по специфичности узнавания подобных Аb1, Ab1'. Внизу показаны многочисленные побочные возможные варианты Ab2 и Ab3. Эти “нежелательные варианты” следует отбрасывать при отборе (Ab2) и стремиться минимизировать их образование (Ab3).
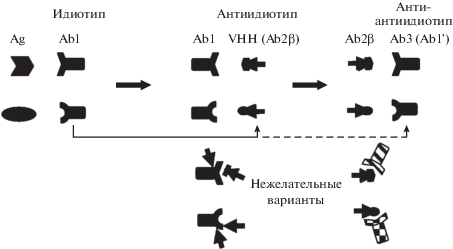
В организме человека и других млекопитающих (мыши, кролика, овцы и др.) не выявлено неканонических антител, подобных верблюжьим HCAb и, соответственно, способных образовывать идиотипы, как у нанотел. Однако этот пока еще отсутствующий инструмент может быть потенциально привнесен извне и использован как в исследовательских целях, так и для специфического воздействия на иммунную систему с целью специфической иммуномодуляции и иммунокоррекции.
Ниже будут приведены некоторые примеры использования антиидиотипических нанотел, пока еще редкие, но показывающие большой потенциал подобных подходов.
Благодаря небольшому размеру молекулы и длинному гипервариабельному участку CDR3, способствующему образованию выступающих структур, нанотела, в отличие от классических антител, очень удобны для создания ингибиторов ферментов (посредством связывания с их активными сайтами). Используя этот факт и процедуру последующего генерирования антиидиотипических нанотел, показана возможность двухэтапного генерирования таких нанотел, обладающих энзиматической (аллииназной) активностью, подобной исходному антигену-ферменту. Таким образом, антиидиотипические нанотела могут быть эффективными миметиками природных ферментов [70].
Предложен эффективный способ использования процедуры генерирования антиидиотипических нанотел для создания мимотопов (пептидов, мимикрирующих структуру заданного антигенного эпитопа) для иммуноанализа (ИА, или ИФА). Этот способ был применен недавно в ряде работ [71‒73]. Так, традиционно используемый в диагностике антиген афлатоксин B1-BSA был заменен на антиидиотипическое нанотело к антигенузнающему участку классического моноклонального антитела mAb 1C11 к афлатоксину. Это антиидиотипическое нанотело полностью имитировало реакцию афлатоксина в ИФА, т.е. оно может служить суррогатом для афлатоксиновых гаптенов в качестве иммобилизуемых антигенов и конкурента для тестируемого токсина. Конкурентный ИФА имел хорошую чувствительность и может использоваться для обнаружения афлатоксинов B1 в сельскохозяйственных продуктах. Эти результаты показывают, что антиидиотипические нанотела являются отличным инструментом для разработки экологически более чистых методов иммуноанализа [71]. Подобные разработки использовали и для диагностики других токсинов, микотоксина цитринина [72] и вомитоксина дезоксиниваленола [73].
Показано, что антиидиотипические нанотела могут быть прекрасным инструментом для изучения и использования молекулярной мимикрии. Антиидиотипические нанотела отобраны методом фагового дисплея из иммунной VHH-библиотеки ламы, иммунизированной мышиным моноклональным антителом, связывающим ДНК. Получены варианты антиидиотипических нанотел, которые конкурировали за связывание данного анти-ДНК-антитела с ДНК, т.е. в отношении специфичности связывания обладали мимикрией с ДНК. Указаны преимущества использования антиидиотипических нанотел для молекулярной мимикрии по сравнению с классическими анти-идиотипическими антителами. Антиидиотипические нанотела проще генерировать, они лучше подходят для имитации мелких лигандов и последующего конструирования пептидных миметиков для разработки лекарств [74].
Антиидиотипические нанотела в принципе могут быть основой антиидиотипических активных вакцин, способных вызывать специфический иммунный ответ и формировать иммунную память в отношении терапевтической мишени, которую мимикрирует тщательно отобранное антиидиотипическое нанотело. Антиидиотипическое нанотело 1НЕ против идиотипа гуманизированного моноклонального антитела трастузумаба [75] хорошо мимикрировало соответствующий эпитоп сверхэкспрессированного на ряде опухолевых клеток рецептора HER2 ‒ мишени трастузумаба. 1НЕ с высокой аффинностью связывалось с трастузумабом и селективно ингибировало связывание трастузумаба с HER2. Антиидиотипическое нанотело 1НЕ индуцировало устойчивый иммунный ответ у мышей без какой-либо токсичности и стимулировало продукцию собственных мышиных антител, обладающих эквивалентными иммунологическими и биологическими свойствами трастузумаба [75].
Наши предварительные экспериментальные данные по получению и использованию антиидио-типических нанотел для разработки новых вакцин пока выглядят весьма обнадеживающими, но указывают на необходимость очень тщательной селекции и функциональных проверок отбираемых на первом этапе нанотел к модельным терапевтическим антителам или их аналогам.
НАНОТЕЛА И ПОИСК ПЕРСПЕКТИВНЫХ МИШЕНЕЙ ДЛЯ РАННЕЙ ДИАГНОСТИКИ
Из большого массива опубликованных данных можно сделать вывод о значительном потенциале использования нанотел для получения новых инструментов и разработки новых подходов и самых различных биомедицинских приложений. Однако еще только предстоит выявить диагностические мишени и создать иммунокорректирующие вакцины для превентивной медицины. Очень продуктивными могут быть технологии получения, отбора и адаптации нанотел. Ниже перечислен ряд перспективных мишеней для генерирования нанотел с целью ранней диагностики потенциальных патологических процессов.
Среди потенциальных ранних маркеров патологического процесса, например связанного с формированием злокачественной опухоли, могут быть аутоантитела к опухолеассоциированным антигенам. Такие аутоантитела обнаружены на ранней стадии ряда опухолевых заболеваний, еще до появления клинических симптомов [76].
Еще один интересный объект для ранних диагностических исследований ‒ циркулирующие иммунные комплексы (IC) ‒ макромолекулярные структуры, сформированные в результате специфического взаимодействия антигенов с антителами в биологических жидкостях. IC могут содержать большое количество различных компонентов, включая антигены, иммуноглобулины, липопротеины, белки системы комплемента, белки коагуляции, адгезии. Содержание IC увеличивается в сыворотке крови и других биологических жидкостях при различных системных расстройствах, включая ревматические и аутоиммунные заболевания, вирусные, бактериальные и паразитарные инфекции, злокачественные новообразования и острые аллергические реакции [77, 78]. Для детекции и изучения состава таких комплексов подходят технологии, базирующиеся на получении и использовании нанотел. Нанотела, имеющие небольшой размер, могут лучше проникать внутрь больших комплексов и узнавать особые антигенные эпитопы, что может пригодиться для детекции антигенов в составе комплекса с антителами классической структуры.
Еще один перспективный сложный многокомпонентный объект для ранней диагностики, в том числе с помощью нанотел, ‒ внеклеточные везикулы. Они участвуют в разных физиологических процессах и патологических состояниях, включая свертывание крови, воспаление, реэкспансию стволовых клеток, коммуникацию нейронов и развитие опухолей [79]. Внеклеточные везикулы переносят, например, молекулы, связанные с опухолью и с формированием преметастатической ниши [80, 81]. Опухолевые экзосомы можно обнаружить во многих биологических жидкостях, включая кровь. Экзосомы биохимически стабильны, их состав определяет возможность проведения комплексного анализа. За последние несколько лет доказана перспективность разработки методов ранней диагностики онкологических заболеваний на основе анализа циркулирующих экзосом, хотя многие существенные вопросы остаются пока открытыми [82].
В связи с важностью изучения компонентов сложных белковых комплексов следует упомянуть недавно разработанный эффективный метод параллельного и последовательного поэтапного генерирования однодоменных антител к различным белкам сложного протеома (даже при отсутствии очищенных антигенов) на примере плазмы крови человека [27].
При поиске диагностических мишеней, отражающих патологический процесс, одновременно выявляют и потенциальные мишени (те же) для иммунокоррекционной терапии. На основе диагностических нанотел (или антигенсвязывающих молекул иного формата) мы получаем и инструмент для генерирования соответствующих антиидиотипических нанотел, потенциально способных мимикрировать мишень (для диагностики и терапии). Эти нанотела могут быть основой комбинированных-вакцин, направленных на предотвращение развития предполагаемых (исходя из данных ранней доклинической диагностики) патологических процессов в организме индивида.
Мы предполагаем, что библиотеки нанотел (в том числе антиидиотипических) и подобные им синтетические библиотеки на основе иных базовых структурных элементов (скаффолдов) как в формате фагового дисплея (экспонированные в составе поверхностного белка бактериофага), так и в виде сложной смеси экспрессированных белковых молекул, потенциально могут использоваться для системного “комплементарного отражения”, запечатления “комплементарного образа” одновременно многих компонентов иммунной системы конкретного индивида.
Таким образом, нанотела являются весьма полезным и эффективным инструментом для исследований, диагностики и иммунотерапии в дополнение к моноклональным антителам и их производным, другим типам антигенсвязывающих молекул. Нанотела, наряду со многими другими методами современной системной биологии, могут быть полезным инструментом для исследования изменений в иммунной системе на разных стадиях патологического процесса.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 19-015-00487).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Автор заявляет об отсутствии конфликта интересов.
Список литературы
Тиллиб С.В. (2011) “Верблюжьи наноантитела” ‒ эффективный инструмент для исследований, диагностики и терапии. Молекуляр. биология. 45, 77‒85.
Hamers-Casterman C., Atarhouch T., Muyldermans S., Robinson G., Hamers C., Songa E.B., Bendahman N., Hamers R. (1993) Naturally occurring antibodies devoid of light chains. Nature. 363, 446–448.
Flajnik M.F., Kasahara M. (2010) Origin and evolution of the adaptive immune system: genetic events and selective pressures. Nat. Rev. Genet. 11, 47–59.
Harmsen M.M., De Haard H.J. (2007) Properties, production, and applications of camelid single-domain antibody fragments. Appl. Microbiol. Biotechnol. 77, 13–22.
Muyldermans S., Baral T.N., Retamozzo V.C., De Baetselier P., De Genst E., Kinne J., Leonhardt H., Magez S., Nguyen V.K., Revets H., Rothbauer U., Stijlemans B., Tillib S., Wernery U., Wyns L., Hassanzadeh-Ghassabeh G., Saerens D. (2009) Camelid immunoglobulins and nanobody technology. Vet. Immunol. Immunopathol. 128, 178–183.
Muyldermans S. (2013) Nanobodies: natural single-domain antibodies. Annu. Rev. Biochem. 82, 775–797.
Горшкова Е.Н., Василенко Е.А., Тиллиб С.В., Астраханцева И.В. (2016) Однодоменные антитела и биоинженерные препараты на их основе: новые возможности для диагностики и терапии. Мед. иммунол. 18, 505‒520.
Steeland S., Vandenbroucke R.E., Libert C. (2016) Nanobodies as therapeutics: big opportunities for small antibodies. Drug Discov. Today. 21, 1076‒1113.
Van Audenhove I., Gettemans J. (2016) Nanobodies as versatile tools to understand, diagnose, visualize and treat cancer. EBioMed. 8, 40‒48.
Iezzi M.E., Policastro L., Werbajh S., Podhajcer O., Canziani G.A. (2018) Single-domain antibodies and the promise of modular targeting in cancer imaging and treatment. Front. Immunol. 9, 273.
Keyaerts M., Xavier C., Heemskerk J., Devoogdt N., Everaert H., Ackaert C., Vanhoeij M., Duhoux F.P., Gevaert T., Simon P., Schallier D., Fontaine C., Vaneycken I., Vanhove C., De Greve J., Lamote J., Caveliers V., Lahoutte T., (2015) Phase I study of 68Ga-HER2-nanobody for PET/CT assessment of HER2-expression in breast carcinoma. J. Nucl. Med. 57(1), 27‒33.
Rothbauer U., Zolghadr K., Tillib S., Nowak D., Schermelleh L., Gahl A., Backmann N., Conrath K., Muyldermans S., Cardoso M.C., Leonhardt H. (2006) Targeting and tracing antigens in live cells with fluorescent nanobodies. Nat. Methods. 3, 887‒889.
Irannejad R., Tomshine J.C., Tomshine J.R., Chevalier M., Mahoney J.P., Steyaert J., Rasmussen S.G., Sunahara R.K., El-Samad H., Huang B., von Zastrow M. (2013) Conformational biosensors reveal GPCR signalling from endosomes. Nature. 495, 534–538.
Manglik A., Kobilka B.K., Steyaert J. (2017) Nanobodies to study G protein-coupled receptor structure and function. Annu. Rev. Pharmacol. Toxicol. 57, 19‒37.
Hu Y., Liu C., Muyldermans S. (2017) Nanobody-based delivery systems for diagnosis and targeted tumor therapy. Front. Immunol. 8, 1442.
Efimov G.A., Kruglov A.A., Khlopchatnikova Z.V., Rozov F.N., Mokhonov V.V., Rose-John S., Scheller J., Gordon S., Stacey M., Drutskaya M.S., Tillib S.V., Nedospasov S.A. (2016) Cell type-restricted anti-cytokine therapy: TNF inhibition from one pathogenic source. Proc. Natl. Acad. Sci. USA. 113, 3006‒3011.
Nosenko M.A., Atretkhany K.N., Mokhonov V.V., Efimov G.A., Kruglov A.A., Tillib S.V., Drutskaya M.S., Nedospasov S.A. (2017) VHH-based bispecific antibodies targeting cytokine production. Front. Immunol. 8, 1073.
Stone E., Hirama T., Tanha J., Tong-Sevinc H., Li S., MacKenzie C.R., Zhang J. (2007) The assembly of single domain antibodies into bispecific decavalent molecules. J. Immunol. Methods. 318, 88‒94.
Hultberg A., Temperton N.J., Rosseels V., Koenders M., Gonzalez-Pajuelo M., Schepens B., Ibañez L.I., Vanlandschoot P., Schillemans J., Saunders M., Weiss R.A., Saelens X., Melero J.A., Verrips C.T., Van Gucht S., de Haard H.J. (2011) Llama-derived single domain antibodies to build multivalent, superpotent and broadened neutralizing anti-viral molecules. PLoS One. 6, e17665.
Tillib S., Ivanova T.I., Vasilev L.A., Rutovskaya M.V., Saakyan S.A., Gribova I.Y., Tutykhina I.L., Sedova E.S., Lysenko A.A., Shmarov M.M., Logunov D.Y., Naroditsky B.S., Gintsburg A.L. (2013) Formatted single-domain antibodies can protect mice against infection with influenza virus (H5N2). Antiviral Res. 97, 245‒254.
Tutykhina I., Sedova E., Gribova I., Ivanova T.I., Vasilev L.A., Rutovskaya M.V., Lysenko A., Shmarov M., Logunov D., Naroditsky B., Tillib S., Gintsburg A. (2013) Passive immunization with a recombinant adenovirus expressing an HA (H5)-specific single-domain antibody protects mice from lethal influenza infection. Antiviral Res. 97, 717‒720.
Huet H.A., Growney J.D., Johnson J.A., Li J., Bilic S., Ostrom L., Zafari M., Kowal C., Yang G., Royo A., Jensen M., Dombrecht B., Meerschaert K.R., Kolkman J.A., Cromie K.D., Mosher R., Gao H., Schuller A., Isaacs R., Sellers W.R., Ettenberg S.A.(2014) Multivalent nanobodies targeting death receptor 5 elicit superior tumor cell killing through efficient caspase induction. mAbs. 6, 1560‒1570.
Гарас М.Н., Тиллиб С.В., Зубкова О.В., Рогожин В.Н., Иванова Т.И., Васильев Л.А., Логунов Д.Ю., Шмаров М.М., Тутыхина И.Л., Есмагамбетов И.Б., Грибова И.Ю., Банделюк А.С., Народицкий Б.С., Гинцбург А.Л. (2014) Конструирование аденовектора с модифицированным pIX, способного эффективно связываться с наноантителами, для мишень-специфической доставки генов. Acta Naturae. 6, 102‒113.
Burmistrova D.A., Tillib S.V., Shcheblyakov D.V., Dolzhikova I.V., Shcherbinin D.N., Zubkova O.V., Ivanova T.I., Tukhvatulin A.I., Shmarov M.M., Logunov D.Y., Naroditsky B.S., Gintsburg A.L. (2016) Genetic passive immunization with adenoviral vector expressing chimeric nanobody-Fc molecules as therapy for genital infection caused by Mycoplasma hominis. PLoS One. 11, e0150958.
Hussack G., Luo Y., Veldhuis L., Hall J.C., Tanha J., Mackenzie R. (2009) Multivalent anchoring and oriented display of single-domain antibodies on cellulose. Sensors (Basel). 9, 5351‒5367.
Tillib S.V., Privezentseva M.E., Ivanova T.I., Vasilev L.F., Efimov G.A., Gurskiy Ya.G., Georgiev G.P., Goldman I.L., Sadchikova E.R. (2014) Single-domain antibody-based ligands for immunoaffinity separation of recombinant human lactoferrin from the goat lactoferrin of trasgenic goat milk. J. Chromatography B. 949‒950, 48‒57.
Горяйнова О.С., Иванова Т.И., Рутовская М.В., Тиллиб С.В. (2017) Метод параллельного и последовательного генерирования однодоменных антител для протеомного анализа плазмы крови человека. Молекуляр. биология. 51, 985–996.
Bannas P., Hambach J., Koch-Nolte F. (2017) Nanobodies and nanobody-based human heavy chain antibodies as antitumor therapeutics. Front. Immunol. 8, 1603.
Kijanka M., Dorresteijn B., Oliveira S., van Bergen en Henegouwen P.M. (2015) Nanobody-based cancer therapy of solid tumors. Nanomedicine (Lond.). 10(1), 161–174.
Danquah W., Meyer-Schwesinger C., Rissiek B., Pinto C., Serracant-Prat A.,Amadi M., Iacenda D., Knop J.H., Hammel A., Bergmann P., Schwarz N., Assunção J., Rotthier W., Haag F., Tolosa E., Bannas P., Boué-Grabot E., Magnus T., Laeremans T., Stortelers C., Koch-Nolte F. (2016) Nanobodies that block gating of the P2X7 ion channel ameliorate inflammation. Sci. Transl. Med. 8(366), 366ra162.
Koch-Nolte F., Reyelt J., Schossow B., Schwarz N., Scheuplein F., Rothenburg S., Haag F., Alzogaray V., Cauerhff A., Goldbaum F.A. (2007) Single domain antibodies from llama effectively and specifically block T cell ecto-ADP-ribosyltransferase ART2.2 in vivo. FASEB J. 21(13), 3490–3498.
Araste F., Ebrahimizadeh W., Rasooli I., Rajabibazl M., Mousavi Gargari S.L. (2014) A novel VHH nanobody against the active site (the CA domain) of tumor-associated, carbonic anhydrase isoform IX and its usefulness for cancer diagnosis. Biotechnol. Lett. 36(1), 21–28.
Qasemi M., Behdani M., Shokrgozar M.A., Molla-Kazemiha V., Mohseni-Kuchesfahani H., Habibi-Anbouhi M. (2016) Construction and expression of an anti-VEGFR2 nanobody-Fc fusionbody in NS0 host cell. Protein Expr. Purif. 123, 19–25.
Albert S., Arndt C., Feldmann A., Bergmann R., Bachmann D., Koristka S., Ludwig F., Ziller-Walter P., Kegler A., Gärtner S., Schmitz M., Ehninger A., Cartellieri M., Ehninger G., Pietzsch H.J., Pietzsch J., Steinbach J., Bachmann M. (2017) A novel nanobody-based target module for retargeting of T lymphocytes to EGFR-expressing cancer cells via the modular UniCAR platform. Oncoimmunology. 6(4), e1287246.
Massa S., Xavier C., De Vos J., Caveliers V., Lahoutte T., Muyldermans S., Devoogdt N. (2014) Site-specific labeling of cysteine-tagged camelid single-domain antibody-fragments for use in molecular imaging. Bioconjug. Chem. 25(5), 979–988.
van Lith S.A., van Duijnhoven S.M., Navis A.C., Leenders W.P., Dolk E., Wennink J.W., van Nostrum C.F., van Hest J.C. (2017) Legomedicine – a versatile chemo-enzymatic approach for the preparation of targeted dual-labeled llama antibody-nanoparticle conjugates. Bioconjug. Chem. 28(2), 539–548.
Bakhtiari S.H., Rahbarizadeh F., Hasannia S., Ahmadvand D., Iri-Sofla F.J., Rasaee M.J. (2009) Anti-MUC1 nanobody can redirect T-body cytotoxic effector function. Hybridoma (Larchmt.). 28(2), 85–92.
Khaleghi S., Rahbarizadeh F., Ahmadvand D., Rasaee M.J., Pognonec P. (2012) A caspase 8-based suicide switch induces apoptosis in nanobody-directed chimeric receptor expressing T cells. Int. J. Hematol. 95(4), 434–444.
Jamnani F.R., Rahbarizadeh F., Shokrgozar M.A., Mahboudi F., Ahmadvand D., Sharifzadeh Z., Parhamifar L., Moghimi S.M. (2014) T cells expressing VHH-directed oligoclonal chimeric HER2 antigen receptors: towards tumor-directed oligoclonal T cell therapy. Biochim. Biophys. Acta. 1840(1), 378–386.
Verhelle A., Nair N., Everaert I., Van Overbeke W., Supply L., Zwaenepoel O., Peleman C., Van Dorpe J., Lahoutte T., Devoogdt N., Derave W., Chuah M.K., Van den Driessche T., Gettemans J. (2017) AAV9 delivered bispecific nanobody attenuates amyloid burden in the gelsolin amyloidosis mouse model. Hum. Mol. Genet. 26(7), 1353–1364.
Duggan S. (2018) Caplacizumab: first global approval. Drugs. 78, 1639–1642.
Callewaert F., Roodt J., Ulrichts H., Stohr T., van Rensburg W.J., Lamprecht S., Rossenu S., Priem S., Willems W., Holz J.B. (2012) Evaluation of efficacy and safety of the anti-VWF nanobody ALX-0681 in a preclinical baboon model of acquired thrombotic thrombocytopenic purpura. Blood. 120, 3603–3610.
Ulrichts H., Silence K., Schoolmeester A., de Jaegere P., Rossenu S., Roodt J., Priem S., Lauwereys M., Casteels P., Van Bockstaele F., Verschueren K., Stanssens P., Baumeister J., Holz J.B. (2011) Antithrombotic drug candidate ALX-0081 shows superior preclinical efficacy and safety compared with currently marketed antiplatelet drugs. Blood. 118, 757–765.
Könning D., Zielonka S., Grzeschik J., Empting M., Valldorf B., Krah S., Schröter C., Sellmann C., Hock B., Kolmar H. (2017) Camelid and shark single domain antibodies: structural features and therapeutic potential. Curr. Opin. Struct. Biol. 45, 10‒16.
Detalle L., Stohr T., Palomo C., Piedra P.A., Gilbert B.E., Mas V., Millar A., Power U.F., Stortelers C., Allo-sery K., Melero J.A., Depla E. (2015) Generation and characterization of ALX-0171, a potent novel therapeutic nanobody for the treatment of respiratory syncytial virus infection. Antimicrob. Agents Chemother. 60, 6‒13.
Jahnichen S., Blanchetot C., Maussang D., Gonzalez-Pajuelo M., Chow K.Y., Bosch L., De Vrieze S., Serruys B., Ulrichts H., Vandevelde W., Saunders M., De Haard H.J., Schols D., Leurs R., Vanlandschoot P., Verrips T., Smit M.J. (2010) CXCR4 nanobodies (VHH-based single variable domains) potently inhibit chemotaxis and HIV-1 replication and mobilize stem cells. Proc. Natl. Acad. Sci. USA. 107, 20565‒20570.
Maussang D., Mujić-Delić A., Descamps F.J., Storte-lers C., Vanlandschoot P., Stigter-van Walsum M., Vischer H.F., van Roy M., Vosjan M., Gonzalez-Pajuelo M., van Dongen G.A., Merchiers P., van Rompaey P., Smit M.J. (2013) Llama-derived single variable domains (nanobodies) directed against chemokine receptor CXCR7 reduce head and neck cancer cell growth in vivo. J. Biol. Chem. 288, 29562‒29572.
Mujić-Delić A., de Wit R.H., Verkaar F., Smit M.J. (2014) GPCR-targeting nanobodies: attractive research tools, diagnostics, and therapeutics. Trends Pharmacol. Sci. 35, 247‒255.
Van Roy M., Ververken C., Beirnaert E., Hoefman S., Kolkman J., Vierboom M., Breedveld E., ‘t Hart B., Poelmans S., Bontinck L., Hemeryck A., Jacobs S., Baumeister J., Ulrichts H. (2015) The preclinical pharmacology of the high affinity anti-IL-6R Nanobody W ALX-0061 supports its clinical development in rheumatoid arthritis. Arthritis Res. Ther. 17, 135.
Ding L., Tian C., Feng S., Fida G., Zhang C., Ma Y., Ai G., Achilefu S., Gu Y. (2015) Small sized EGFR1 and HER2 specific bifunctional antibody for targeted cancer therapy. Theranostics. 5, 378‒398.
Gilbert J.A., Blaser M.J., Caporaso J.G., Jansson J.K., Lynch S.V., Knight R. (2018) Current understanding of the human microbiome. Nat. Med. 24, 392‒400.
Ситкин С.И., Вахитов Т.Я., Демьянова Е.В. (2018) Микробиом, дисбиоз толстой кишки и воспалительные заболевания кишечника: когда функция важнее таксономии. Альманах клинической медицины. 46, 396–425.
Brüssow H. (2016) Biome engineering-2020. Microb. Biotechnol. 9, 553–563.
Timmis K., Timmis J.K., Brüssow H., Fernández L.A. (2018) Synthetic consortia of nanobody-coupled and formatted bacteria for prophylaxis and therapy interventions targeting microbiome dysbiosis-associated diseases and co-morbidities. Microb. Biotechnol. 12, 58‒65.
de Lorenzo V. (2008) Systems biology approaches to bioremediation. Curr. Opin. Biotechnol. 19, 579–589.
Salema V., Fernandez L.A. (2017) Escherichia coli surface display for the selection of nanobodies. Microb. Biotechnol. 10, 1468–1484.
Pinero-Lambea C., Ruano-Gallego D., Fernandez L.A. (2015) Engineered bacteria as therapeutic agents. Curr. Opin. Biotechnol. 35, 94–102.
Glass D.S., Riedel-Kruse I.H. (2018) A synthetic bacterial cell-cell adhesion toolbox for programming multicellular morphologies and patterns. Cell. 174, 649–658.
Bermudez-Humaran L.G., Langella P. (2018) Live bacterial biotherapeutics in the clinic. Nat. Biotechnol. 36, 816–818.
Abu-Shakra M., Shoenfeld Y. (2014) Idiotypes and anti-idiotypes. In: ‘Autoantibodies’. Eds Shoenfeld Y., Meroni P.L., Gershwin M.E. 3 ed, Elsevier.
Jerne N.K. (1960) Immunological speculations. Annu. Rev. Microbiol. 14, 341–358.
Jerne N.K. (1974) Towards a network theory of the immune system. Ann. Immunol. 125, 373–389.
Bona C.A. (1998) Idiotype vaccines: forgotten but not gone. Nat. Med. 4, 668‒669.
López-Díaz de Cerio A., Zabalegui N., Rodríguez-Calvillo M., Inogés S., Bendandi M. (2007) Anti-idiotype antibodies in cancer treatment. Oncogene. 26, 3594–3602.
Naveed A., Rahman S.U., Arshad M.I., Aslam B. (2018) Recapitulation of the anti-idiotype antibodies as vaccine candidate. Transl. Med. Commun. 3, 1.
Ярилин А.А. (2010) Иммунология. Москва: ГЭОТАР-Медиа, 752 с.
Wesolowski J., Alzogaray V., Reyelt J., Unger M., Juarez K., Urrutia M., Cauerhff A., Danquah W, Rissiek B., Scheuplein F., Schwarz N., Adriouch S., Boyer O., Seman M., Licea A., Serreze D.V., Goldbaum F.A., Haag F., Koch-Nolte F. (2009) Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med. Microbiol. Immunol. 198, 157–174.
Тиллиб С.В., Вятчанин А.С., Муилдерманс С. (2014) Молекулярный анализ структуры особых антител Сamelus bactrianus, состоящих только из тяжелых цепей. Биохимия. 79, 1687–1697.
Henry K.A., MacKenzie C.R. (2018) Antigen recognition by single-domain antibodies: structural latitudes and constraints. MAbs. 10, 815‒826.
Li J.W., Xia L., Su Y., Liu H., Xia X., Lu Q., Yang C., Reheman K. (2012) Molecular imprint of enzyme active site by camel nanobodies: rapid and efficient approach to produce abzymes with alliinase activity. J. Biol. Chem. 287, 13713‒13721.
Wang Y., Li P., Majkova Z., Bever C.R., Kim H.J., Zhang Q., Dechant J.E., Gee S.J., Hammock B.D. (2013) Isolation of alpaca anti-idiotypic heavy-chain single-domain antibody for the aflatoxin immunoassay. Anal. Chem. 85, 8298‒8303.
Xu Y., Xiong L., Li Y., Xiong Y., Tu Z., Fu J., Chen B. (2015) Anti-idiotypic nanobody as citrinin mimotope from a naive alpaca heavy chain single domain antibody library anti-idiotypic nanobody as citrinin mimotope from a naive alpaca heavy chain single domain antibody library. Anal. Bioanal. Chem. 407, 5333‒5341.
Qiu Y.L., He Q.H., Xu Y., Bhunia A.K., Tu Z., Chen B., Liu Y.Y. (2015) Deoxynivalenol-mimic nanobody isolated from a naïve phage display nanobody library and its application in immunoassay. Anal. Chim. Acta. 887, 201‒208.
Zarebski L.M., Urrutia M., Goldbaum F.A. (2005) Llama single domain antibodies as a tool for molecular mimicry. J. Mol. Biol. 349, 814‒824.
Alvarez-Rueda N., Ladjemi M.Z., Béhar G., Corgnac S., Pugnière M, Roquet F., Bascoul-Mollevi C., Baty D., Pèlegrin A., Navarro-Teulon I. (2009) A llama single domain anti-idiotypic antibody mimicking HER2 as a vaccine: Immunogenicity and efficacy. Vaccine. 27, 4826‒4833.
Macdonald I.K., Parsy-Kowalska C.B., Chapman C.J. (2017) Autoantibodies: opportunities for early cancer detection. Trends Cancer. 3, 198‒213.
Ohyama K., Kuroda N. (2013) Immune complexome analysis. Adv. Clin. Chem. 60, 129.
Aibara N., Kamohara C., Chauhan A.K., Kishikawa N., Miyata Y., Nakashima M., Kuroda N., Ohyama K. (2018) Selective, sensitive and comprehensive detection of immune complex antigens by immune complexome analysis with papain-digestion and elution. J. Immunol. Methods. 461, 85‒90.
van Niel G., D’Angelo G., Raposo G. (2018) Shedding light on the cell biology of extracellular vesicles. Nat. Rev. Mol. Cell. Biol. 19, 213‒228.
Hoshino A., Costa-Silva B., Shen T.L., Rodrigues G., Hashimoto A., Mark M.T., Molina H., Kohsaka S., Giannatale A.D., Ceder S., Singh S., Williams C., Soplop N., Uryu K., Pharmer L., King T., Bojmar L., Davies A.E., Ararso Y., Zhang T., Zhang H., Hernandez J., Weiss J.M., Dumont-Cole V.D., Kramer K., Wexler L.H., Narendran A., Schwartz G.K., Healey J.H., Sandstrom P., Labori K.J., Kure E.H., Grandgenett P.M., Hollingsworth M.A., Sousa M., Kaur S., Jain M., Mallya K., Batra S.K., Jarnagin W.R., Brady M.S., Fodstad O., Muller V., Pantel K., Minn A.J., Bissell M.J., Garcia B.A., Kang Y., Rajasekhar V.K., Ghajar C.M., Matei I., Peinado H., Bromberg J., Lyden D. (2015) Tumour exosome integrins determine organotropic metastasis. Nature. 527, 329‒335.
Peinado H., Zhang H., Matei I.R., Costa-Silva B., Hoshino A, Rodrigues G., Psaila B., Kaplan R.N., Bromberg J.F., Kang Y., Bissell M.J., Cox T.R., Giaccia A.J., Erler J.T., Hiratsuka S., Ghajar C.M., Lyden D. (2017) Pre-metastatic niches: organ-specific homes for metastases. Nat. Rev. Cancer. 17, 302‒317.
Малек А.В., Самсонов Р.Б., Кьези А. (2015) Перспективы разработки методов диагностики и мониторинга онкологических заболеваний на основе анализа экзосом, секретируемых опухолевыми клетками. Рос. биотерапевт. журн. 14, 9‒18.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


