Молекулярная биология, 2020, T. 54, № 4, стр. 616-625
Возрастная динамика длины теломерной ДНК у эндемичных планарий озера Байкал
А. Г. Королева a, *, Е. В. Евтушенко b, А. В. Вершинин b, Е. П. Зайцева a, О. А. Тимошкин a, С. В. Кирильчик a
a Лимнологический институт Сибирского отделения Российской академии наук
664033 Иркутск, Россия
b Институт молекулярной и клеточной биологии Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: ankor-2015@yandex.ru
Поступила в редакцию 10.12.2019
После доработки 04.02.2020
Принята к публикации 05.02.2020
Аннотация
Возрастные изменения длины теломер в соматических тканях не ограничиваются только укорочением. Известно немало организмов, у которых динамика длины теломер имеет иной характер. Такая видовая специфичность указывает на сложность механизмов, участвующих в регуляции длины теломер. Байкальские планарии благодаря морфофизиологическим и экологическим особенностям, отличающим их от видов, обитающих вне Байкала, представляют интерес для изучения динамики длины теломерной ДНК и влияющих на нее факторов. В настоящей работе изучена активность теломеразы и возрастные изменения длины теломерной ДНК у трех эндемичных видов планарий сем. Dendrocoelidae – двух глубоководных гигантов (7–12 см, Sorocelis hepatizon и Rimacephalus arecepta) и прибрежного мелкого вида (1 см, Baikalobia guttata). Кроме того, мы определили длину теломер у планарий, относящихся к другому сибирскому мелкому виду (Phagocata sibirica, сем. Planariidae, длина 2 см), который в Байкале не встречается. Длину теломерной ДНК и активность теломеразы определяли с помощью ПЦР в реальном времени и метода TRAP. Обнаружены три типа возрастной динамики длины теломерной ДНК при активной теломеразе: укорочение на ювенильной стадии развития с последующим поддержанием постоянного размера (R. arecepta, Ph. sibirica); постепенное укорочение в течение онтогенеза (S. hepatizon); циклическая динамика длины теломер (B. guttata). Таким образом, изменение длины теломерной ДНК у исследованных видов планарий не имеет очевидной связи с размером тела, глубиной обитания, степенью филогенетического родства и, вероятно, обусловлено видовыми особенностями регуляции работы теломеразы.
ВВЕДЕНИЕ
Теломеры – концевые структуры хромосом, выполняют ряд важных функций, препятствуя слиянию хромосом друг с другом и защищая их от деградации [1]. Эти функции не зависят от типа теломерной ДНК (тДНК), ее размера и способа поддержания длины [2]. Известно несколько механизмов, регулирующих длину теломер. У большинства животных поддержание и удлинение тДНК осуществляет специальный фермент теломераза [3]. У некоторых видов, например у двукрылых насекомых, длина тДНК регулируется посредством ретротранспозиции [4]. В основе еще одного способа поддержания длины тДНК, так называемого альтернативного удлинения теломер (alternative lengthening of telomeres, ALT), лежит гомологичная рекомбинация [5]. Недавно был описан еще один механизм, названный триммингом. Этот механизм, в отличие от первых трех, обеспечивает регулируемое укорочение теломерных районов, которые оказываются слишком длинными [6]. Некоторые механизмы поддержания длины тДНК могут существовать параллельно, например альтернативное удлинение теломер в присутствии активной теломеразы или тримминг при любом другом механизме [6, 7], что затрудняет изучение возрастной динамики длины тДНК и факторов, приводящих к ее изменениям.
Когда в клетке отключены все способы поддержания длины теломер, каждое клеточное деление приводит к постепенному ее укорочению из-за концевой недорепликации [8]. Однако наряду с подобной динамикой встречаются и другие варианты – длина теломер может изменяться сразу после рождения, например, уменьшение теломерных районов у птиц [9] или их удлинение у змей [10]. Размер тДНК может меняться на любом другом этапе онтогенеза – в конце жизни у Danio rerio [11] или в листьях гинкго в осенний период [12]. Характер динамики длины теломер может быть связан с полом, продолжительностью жизни, условиями обитания, образом жизни и другими факторами [13]. На планариях Schmidtea mediterranea и Dugesia ryukyuensis, обладающих высокой способностью к регенерации, размножающихся бесполым и половым путем, показано, что линии червей, размножающиеся делением тела на две части, поддерживают длину тДНК при регенерации. Линии червей того же вида, но с половым процессом, теряют тДНК при регенерации [14, 15]. При нормальном онтогенезе (без стимулирования регенерации) у обеих линий наблюдается укорочение теломерных районов, несмотря на присутствие активной теломеразы [14]. Зависимость динамики длины тДНК от способа размножения обусловлена механизмом, в котором участвуют альтернативно сплайсированные формы теломеразы, обнаруженные у некоторых видов планарий [16]. Наименьшее количество этих форм выявлено у видов с наименьшей регенеративной способностью, что указывает на связь сплайсинга с регенерацией [16].
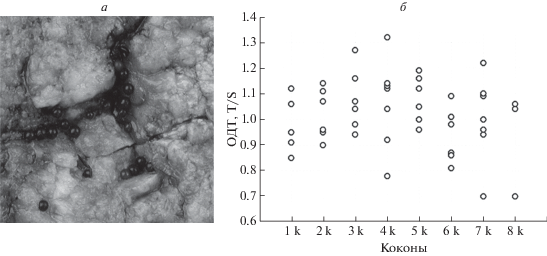
Рис. 1.
Относительная длина теломер (ОДТ) у планарий B. guttata, вышедших из коконов. a – Коконы in vivo (фото Зайцевой Е.П.); б – значения ОДТ у особей каждого кокона.
Настоящая работа посвящена исследованию возрастной динамики длины теломер и активности теломеразы у трех видов эндемичных байкальских планарий (сем. Dendrocoelidae) и одного вида сем. Planariidae, который не встречается в Байкале. У байкальских планарий до сих пор наблюдали только половое размножение, случаи бесполого процесса у них не известны. Стоит отметить, что у планарий более распространены линии, размножающиеся половым путем, чем линии с разными способами размножения, однако нет никаких сведений о том, как меняется длина тДНК в ходе онтогенеза. Мы попытались восполнить этот пробел в изучении теломер у плоских червей. Кроме того, байкальские планарии обладают рядом уникальных особенностей, которые могут влиять на механизмы поддержания теломерных районов. К ним относятся феномен гигантизма и глубоководность, которую можно рассматривать как узкую адаптацию к условиям окружающей среды. Если типичные пресноводные виды планарий имеют размер 1–2 см и, как правило, обитают на небольших глубинах, то в Байкале распространены не только небольшие планарии, но и гигантские, размером 7–12 см, обитающие на глубине в несколько сотен метров [17, 18]. Понять, как влияют эти факторы на изменения длины теломер байкальских эндемичных планарий – главная задача нашей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Характеристика видов и сбор материала. Мы анализировали три вида байкальских планарий, представителей эндемичного семейства Dendrocoelidae – Rimacephalus arecepta Porfirieva 1969, Sorocelis hepatizon Grube 1872 и Baikalobia guttata Gerstfeldt 1858, и один сибирский вид из семейства Planariidae – Phagocata sibirica Sabussow 1903. R. arecepta и S. hepatizon – это эврибатные виды, представленные крупными особями, обитающими на глубине от нескольких десятков до нескольких сотен метров. Вид R. arecepta имеет два подвида: R. arecepta arecepta (с пигментированной дорсальной стороной тела) и R. arecepta depigmentata (полностью депигментированный). Мы использовали особей первого подвида. Максимальная длина тела фиксированных особей R. arecepta и S. hepatizon составляла 12.5 и 6 см соответственно. Вид B. guttata представлен животными небольшого размера, которые встречаются на каменистых грунтах в прибрежной зоне озера. Представители Ph. sibirica также имеют небольшой размер и встречаются на небольших глубинах в сибирских водоемах за пределами Байкала. Максимальная длина фиксированных представителей B. guttata и Ph. sibirica составляла 1.0 и 1.8 см соответственно. Место и дата сбора червей, а также количество особей, проанализированных разными методами, приведены в табл. 1.
Таблица 1.
Количество, место и дата сбора планарий
| Вид | Место сбора | Глубина, м | Дата сбора | Количество особей | |
|---|---|---|---|---|---|
| ПЦР-РВ | TRAP | ||||
| R. arecepta | Селенгинское мелководье | 150–260 | Июль 2010, июль 2013 |
75 | 5 |
| S. hepatizon | Бухта Фролиха, Селенгинское мелководье, Чивыркуйский залив, пролив Малое море |
20–400 | Август 2008, июль 2010, июль 2012, июль 2013, июль 2016 |
46 | 7 |
| B. guttata | Залив Лиственничный | 0.3–1 | Июль 2011, июль 2012 |
154 | 5 |
| Ph. sibirica | Ручей Жилище (Большие Коты) | 0.1–0.3 | Июль 2012 | 117 | 7 |
В качестве меры возраста плоских червей использовали размер тела (сумма длины и ширины), исходя из данных [19], согласно которым размер тела B. guttata увеличивается с возрастом. Известно, что размер планарий может значительно колебаться и даже уменьшаться при нехватке пищи [20]. Однако мы полагали, что скорость роста байкальских планарий не испытывает значительных колебаний в силу относительной стабильности температуры воды и обилия кормовых ресурсов.
Выделение ДНК и количественная ПЦР. ДНК гигантских планарий (R. arecepta, S. hepatizon) выделяли из тканей глотки или переднего конца тела, ДНК планарий небольшого размера (B. guttata, Ph. sibirica) выделяли из переднего конца тела или из всей особи. Экспериментально показано, что длина тДНК одинакова в разных частях тела червей (Приложение, рис. 1S). ДНК выделяли с использованием метода стандартной фенол-хлороформной экстракции с некоторыми модификациями, как описано в [21]. Концентрацию ДНК измеряли на приборе Rotor-Gene Q 6000 (“QIAGEN”, Нидерланды) с использованием набора Qubit® dsDNA HS Assay Kit (“Invitrogen”, США).
Праймеры к референсному гену β-актина планарий подбирали на сайте Integrated DNA Technologies (http://eu.idtdna.com) по известной последовательности фрагментов этого гена, представленной в [21]. Праймеры к гену β-актина байкальских видов имеют структуру TGCTCCACCAACAATGAAAA (aSF) и TTGGAAGGTTGAAAGCGAAG (aSR) с длиной ампликона 100 п.н.; к общесибирскому виду – TCCAGCCATGTATGTCGCAAT (aBF) и GTCACACCATCTCCTGAATCCA (aBR) с длиной продукта 92 п.н. Специфичность этих праймеров показана в Приложении, рис. 2S. Структура праймеров на теломерные районы Tel1 и Tel2 представлена в [22]. Количественную ПЦР проводили на приборе Rotor-Gene Q 6000 с использованием стандартных кривых для обоих участков, согласно [22] с некоторыми модификациями. Реакцию проводили в 1× Snp-буфере в присутствии 0.25 мМ каждого dNTP, 0.2 ед. акт. Snp-полимеразы (“Евроген”, Россия), 0.1–0.4 нг суммарной ДНК, 0.5× SYBR Green (“Lumiprobe”, США), 0.5 пмоль прямого и обратного праймеров к гену β-актина. В случае теломерных участков в реакционную смесь добавляли 0.17 пмоль праймера Tel1 и 0.5 пмоль праймера Tel2. Условия амплификации теломерных участков и референсного гена были разными. В случае тДНК проводили 35–40 циклов, состоящих из двух стадий (95°С, 15 с и 54°С, 2 мин). В случае гена β-актина использовали ступенчатую ПЦР, в которой температура отжига праймеров постепенно уменьшалась с 64 до 58°С за первые семь циклов. Затем проводили 35–40 циклов (95°С, 10 с; 58°С, 15 с и 72°С, 15 с).
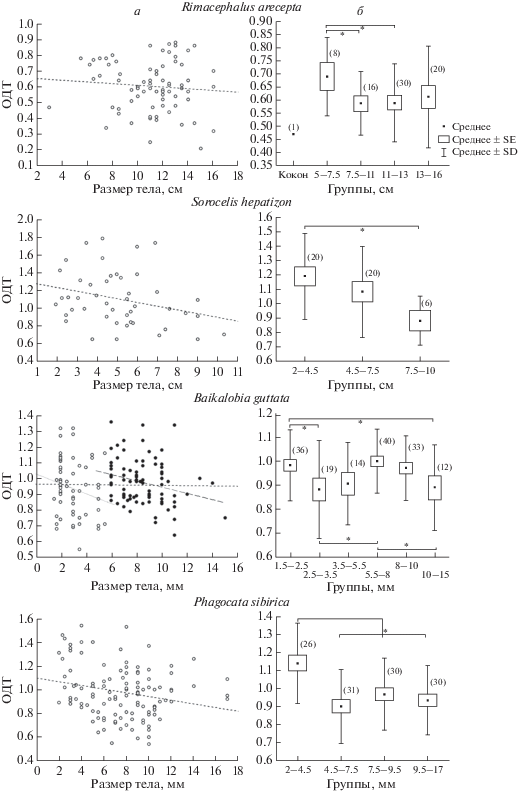
Рис. 2.
Динамика относительной длины теломер (ОДТ) в процессе роста тела планарий (возрастная динамика ОДТ). а – Диаграммы рассеяния значений ОДТ в зависимости от размера тела (длина + ширина). б – Сравнение размерных групп. В скобках указан размер выборки. Значимые различия между группами (p < 0.05) отмечены символом *. Величины ОДТ сравнивали с помощью U-теста Манна–Уитни. SE – стандартная ошибка среднего; SD – стандартное отклонение от среднего. В выборке B. guttata значения ОДТ в образцах размером 6–15 мм отмечены черными кругами.
Стандартные кривые получали в каждом эксперименте, разбавляя один и тот же образец ДНК от 1.5 до 0.01 нг. Качество и воспроизводимость стандартных кривых оценивали по величине стандартных отклонений от среднего Ct каждого разбавления образца: для теломерной стандартной кривой эта величина составила 4%; для актиновой – 2.5%. Реакции на каждый район каждого образца ДНК проводили в двух или трех повторах. В случае образцов, которые использовали для построения стандартных кривых, реакции всегда повторяли 3 или 5 раз. Значения относительной длины теломерных районов (ОДТ) получали, используя данные о концентрации тДНК и ДНК референсного гена целевого образца, рассчитанные относительно соответствующих стандартных кривых: значение концентрации тДНК (T) делили на значение концентрации ДНК референсного гена β-актина (S). Такой подход равнозначен вычислению ОДТ с использованием разницы между значениями пороговых циклов для тДНК и референсного гена (ΔCt).
Для 40–50% выборки каждого вида эксперимент повторяли дважды (Приложение, рис. 3S).
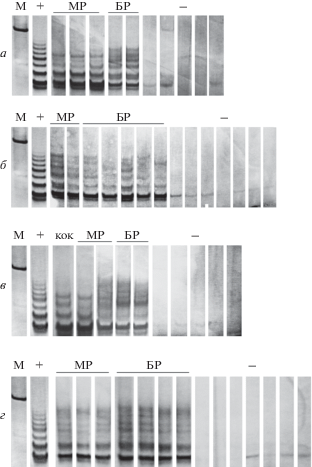
Рис. 3.
Теломеразная активность планарий R. arecepta (а), S. hepatizon (б), B. guttata (в) и Ph. sibirica (г). M – маркер молекулярных масс (100 п.н.), плюс (+) – положительный контроль (раковые клетки); кок – кокон, МР – особи маленького размера; БР – особи большого размера; минус (–) – те же образцы, инактивированные при 95°С в течение 30 мин.
Определение активности теломеразы. Экстракт, содержащий белки и РНК (далее просто экстракт), получали из глотки и боковой части тела гигантских планарий и всего тела небольших планарий согласно протоколу для набора TRAPeze RT (“Chemicon”, США). Концентрацию белка измеряли по методу Брэдфорда [23] с использованием серии разбавлений альбумина (от 5 до 25 мкг/мл) и красителя кумасси G-250 (“Синтол”, Россия).
Активность теломеразы определяли методом TRAP с праймерами TS и ACX, структура которых предложена в [24, 25]. В качестве положительного контроля использовали экстракт из раковых клеток человека (имеющийся в наборе TRAPeze RT). В качестве отрицательного контроля – экстракт, инактивированный при 95°С в течение 30 мин, а также реакционную смесь без добавления какого-либо экстракта. Реакционная смесь содержала 1× буфер, 300 нг нативного или инактивированного белка, 0.2 мМ каждого dNTP, 1 пмоль TS-праймера, 0.5 пмоль ACX-праймера и 1× Encyclo-полимеразу (“Евроген”, Россия). Реакционную смесь для планарий выдерживали в течение 30 мин на льду (чтобы приблизить условия функционирования теломеразы этих червей к естественным, так как они обитают в воде при температуре 4–15°С), для раковых клеток использовали комнатную температуру, при которой работала теломераза, далее прогревали при 94°С в течение 3 мин, после чего проводили 30 циклов – 94°С 30 с; 58°С 30 с и 72°С 1 мин. Реакцию проводили на T100 Thermal Cycler (“Bio-Rad”, США).
Продукты, полученные в ПЦР, разделяли в 12.5%-ном полиакриламидном геле (толщина 1.5 мм, 17 × 12.5 см) в течение 2.5 ч при напряжении 130–150 В и силе тока 36 мА в 0.5× ТВЕ-буфере. Гели окрашивали согласно [26].
Статистический анализ. Для проверки гипотезы о нормальности распределения полученных значений использовали критерий Шапиро–Уилка. Наличие выбросов анализировали с помощью теста Граббса (Grubbs test). Связь между ОДТ, размерами тела и возрастом определяли с помощью регрессионного анализа, рассчитывали коэффициент корреляции Спирмена. Для определения статистически значимых различий между размерными группами, на которые были разделены образцы каждого вида, использовали непараметрический U-критерий Манна–Уитни. Воспроизводимость результатов оценивали с помощью T-теста для зависимых выборок и корреляционного анализа. Различия считали статистически значимыми, если нулевая гипотеза отвергалась при уровне значимости (p) менее 0.05. Величины ОДТ представлены как среднее значение ± стандартное отклонение (SD).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Вариации количества тДНК у отдельных ювенильных особей B. guttata мы оценили с помощью ПЦР в реальном времени и выявили значительные различия в значениях ОДТ (рис. 1). Всего проанализировано восемь коконов, из которых вылупились 49 планарий (3–9 в каждом коконе). Коэффициент вариации ОДТ между особями, вышедшими из одного кокона, составил 8.2–21.7%, а во всей выборке вылупившихся червей – 13.2%. Минимальная величина ОДТ 0.7–0.96, средняя – 0.93–1.07, максимальная – 1.06–1.32 в зависимости от кокона. Стандартное отклонение во всей выборке составило 13.4%, у отдельных коконов – 10–20%.
На рис. 2a приведены диаграммы рассеяния ОДТ в зависимости от размера тела исследованных видов планарий. Среднее значение ОДТ составило 0.6 ± 0.16 у R. arecepta, 1.1 ± 0.3 – у S. hepatizon, 0.96 ± 0.16 у B. guttata и 0.98 ± 0.22 у Ph. sibirica. Значения ОДТ варьировали в выборках всех видов (коэффициент вариации Cv равен 16–28%, табл. 2): например, разброс значений ОДТ у особей R. arecepta размером 8 см составил 0.43–0.8 (N = 7), 11 см – 0.25–0.86 (N = 15). У B. guttata разброс значений ОДТ между особями размером 6 мм составил 0.84–1.36 (N = 14), между особями размером 10 мм – 0.8–1.18 (N = 15). Значения ОДТ в пределах одной размерной группы могли отличаться в два или три раза. Остальные минимальные и максимальные значения ОДТ, а также средние значения для разных размерных групп планарий представлены в Приложении, табл. 1S.
Таблица 2.
Статистический анализ ОДТ у четырех видов планарий
| Rimacephalus arecepta, Cv = 26.1% | ||||||
| R = –0.05, p = 0.7016 |
Группы, см | 7.5–11 | 11–13 | 13–16 | ||
| 5–7.5 | 0.0402 | 0.0489 | 0.3214 | |||
| 7.5–11 | 0.9011 | 0.5038 | ||||
| 11–13 | 0.8148 | |||||
| Sorocelis hepatizon, Cv = 27.7% | ||||||
| R = –0.3, p = 0.0456 |
Группы, см | 4.5–7.5 | 7.5–10 | |||
| 2–4.5 | 0.2036 | 0.0207 | ||||
| 4.5–7.5 | 0.1907 | |||||
| Baikalobia guttata, Cv = 16.5% | ||||||
| R = –0.03, p = 0.745 R(м) = –0.18, p = 0.151 R(б) = –0.25, p = 0.021 |
Группы, мм | 2.5–3.5 | 3.5–5.5 | 5.5–8 | 8–10 | 10–15 |
| 1.5–2.5 | 0.0269 | 0.2024 | 0.7788 | 0.593 | 0.0406 | |
| 2.5–3.5 | 0.56 | 0.007 | 0.0318 | 0.7303 | ||
| 3.5–5.5 | 0.0635 | 0.2049 | 0.8774 | |||
| 5.5–8 | 0.409 | 0.0125 | ||||
| 8–10 | 0.0575 | |||||
| Phagocata sibirica, Cv = 22.5% | ||||||
| R = –0.22, p = 0.017 |
Группы, мм | 4.5–7.5 | 7.5–9.5 | 9.5–17 | ||
| 2–4.5 | 0.0004 | 0.0094 | 0.0015 | |||
| 4.5–7.5 | 0.1574 | 0.4109 | ||||
| 7.5–9.5 | 0.5298 | |||||
Примечание. Жирным выделены статистически значимые различия между размерными группами. R – коэффициент корреляции Спирмена для всей выборки, R(м) и R(б) – коэффициенты корреляции Спирмена для маленьких (1.5–5.5 мм) и больших (6–15 мм) особей той же популяции, Cv – коэффициент вариации во всей выборке.
С помощью корреляционного анализа зависимость количества тДНК от размера (возраста) выявлена у двух видов планарий: байкальского гиганта S. hepatizon и Ph. sibirica – общесибирского вида небольшого размера (рис. 2а, табл. 2). Последующее сравнение размерных групп этих видов показало, что количество тДНК у S. hepatizon снижается постепенно в течение онтогенеза, а статистически значимые отличия в ОДТ обнаружены только между группами 2–4.5 и 7.5–10 см, т.е. между молодыми и старыми особями (рис. 2б, табл. 2). При этом ОДТ снижалась на 26%. У Ph. sibirica количество тДНК уменьшалось на 20% только в ювенильный период онтогенеза: выявлены отличия в ОДТ между самой молодой размерной группой (2–5 мм) и всеми остальными группами (5–7.5, 7.5–10 и 10–17 мм). Не выявлено статистически значимых отличий между последними размерными группами Ph. sibirica, т.е. количество теломерных повторов в течение дальнейшего роста не изменялось (рис. 2б, табл. 2). У другого глубоководного гиганта R. arecepta особи размером 5–7.5 см имели примерно на 14% больше тДНК, чем особи, входящие в группы 7.5–11 и 11–13 см (рис. 2б, табл. 2). У вышедших из коконов особей размером 1.5–2.5 мм литорального вида B. guttata количество тДНК было на 10% больше, чем у особей размером 2.5–3.5 мм. В размерных группах 3.5–5.5 и 5.5–8 мм наблюдается увеличение ОДТ и ее восстановление до уровня у особей, вышедших из коконов. При последующем росте количество тДНК снова начинает уменьшаться, и уже группы 5.5–8 и 10–15 мм имеют разницу в ОДТ 10% (рис. 2, табл. 2). Корреляционный анализ всей выборки B. guttata не выявил зависимости ОДТ от размера червей. Однако при разделении всей выборки на две группы (1.5–5.5 и 6–15 мм) появляются тенденции, указывающие на существование отрицательной корреляции между ОДТ и размером тела (рис. 2, табл. 2), что согласуется с результатами сравнения разных размерных групп B. guttata (рис. 2б).
Как молодые (мелкие), так и взрослые (большие) особи всех четырех видов планарий содержат активную теломеразу, что установлено методом TRAP (рис. 3). Кроме того, у B. guttata активная теломераза обнаружена в коконах (рис. 3в). На присутствие теломеразной активности указывают лестницы продуктов с шагом 6 н., полученные в результате положительной теломеразной реакции, когда анализировали экстракты, содержащие белки и РНК гигантских видов планарий (рис. 3а, б) и видов небольшого размера (рис. 3в, г).
Таким образом, определение длины тДНК и ее количества в геноме планарий показало, во-первых, значительную вариабельность ОДТ (SD = = 13–28%), причем эта вариабельность наблюдается сразу после выхода червей из кокона. Во-вторых, обнаружено три типа возрастной динамики ОДТ у четырех видов в присутствии активной теломеразы: 1. укорочение тДНК на ювенильной стадии развития и последующее поддержание постоянного размера (R. arecepta, Ph. sibirica); 2. постепенное укорочение тДНК в течение онтогенеза (S. hepatizon); и 3. укорочение тДНК на ювенильной стадии, ее последующее восстановление и снова укорочение (циклический) (B. guttata).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Размер теломер, под которым обычно подразумевают длину тДНК, привлек пристальное внимание ученых после обнаружения укорочения тДНК в процессе старения человека [27]. Многочисленные исследования не выявили универсальных закономерностей в характере изменений длины теломер у различных видов и в разнообразных условиях обитания [28]. Гетерогенность длины тДНК и количества теломерных повторов у особей одного вида существенно затрудняет изучение возрастной динамики тДНК. Гетерогенность количества теломерных повторов выявляется у планарий сразу после вылупления из коконов (рис. 1). По-видимому, определенный размер тДНК в хромосомах планарий формируется в течение ранних этапов онтогенеза, как и у зародышей человека [29]. Установлено, что специфический теломерный профиль хромосом образуется уже на стадии зиготы [30]. На размер теломер в это время может влиять механизм альтернативного удлинения теломер, который функционирует в ядре в течение первых клеточных делений [31]. В результате размер теломер приобретает свою индивидуальную характеристику.
Укорочение теломерных районов хромосом в процессе старения, несмотря на значительную вариабельность размера тДНК, выявлено у многих организмов, в том числе у беспозвоночных [14, 32]. Однако имеются данные, указывающие на отсутствие у некоторых организмов возрастной потери тДНК или на существование особого характера изменений размера теломер в процессе онтогенеза [33–35]. У изученных нами видов планарий обнаружены разные варианты динамики ОДТ (укорочение с поддержанием, постепенное укорочение и циклическая динамика) (рис. 2). Различия в характере изменений количества тДНК трудно объяснить какими-либо физиологическими, морфологическими характеристиками или различиями в условиях обитания планарий (табл. 3). Так, у байкальского гиганта S. hepatizon наблюдается постепенная потеря теломерных повторов (рис. 2), тогда как у родственной ему гигантской планарии R. arecepta потеря тДНК выявлена только на ювенильной стадии развития (на 14%), после чего ОДТ не изменялась (рис. 2б). У B. guttata, байкальского мелкого эндемика, длина тДНК после вылупления из коконов сначала уменьшается на 10%, потом увеличивается, а затем снова происходит потеря тДНК (рис. 2б). Такой циклический характер динамики ДТ может быть связан с особенностями жизненного цикла B. guttata. Обитая в литоральной зоне озера, этот вид подвергается сезонным колебаниям температуры и уровня воды, что побуждает к периодическим миграциям червей от берега вглубь озера и наоборот. Влияние сезонных изменений на ДТ наблюдали у разных организмов (приматов [37], грызунов [38], растений [12]). Миграции также отражаются на ДТ – приводят к ее увеличению у птиц [39]. Вероятно, у B. guttata существуют похожие механизмы регуляции ДТ.
Таблица 3.
Длина теломер, ее динамика и активность теломеразы у планарий в сравнении с некоторыми особенностями экологии и биологии
| Характеристика | Эндемики Байкала | Реофил | ||
|---|---|---|---|---|
| R. arecepta | S. hepatizon | B. guttata | Ph. sibirica | |
| Динамика ДТ |  |
 |
 |
 |
| ТА | + | + | + | + |
| ДТ, Q-ПЦР, T/S | 0.6 ± 0.16 | 1.1 ± 0.3 | 0.96 ± 0.16 | 0.98 ± 0.22 |
| ДТ, TRF, т.п.н. | 6.4 ± 0.42 | 8.1 ± 0.85 | 8.6 ± 1.6 | 8.2 ± 0.97 |
| Длина тела, см | 12 | 7 | 1 | 2 |
| Глубина обитания, м | 50–877 | 20–525 | 0.1–20 | 0.1– 0.3 |
| ПО2, мг О2/сут | ? | ? | 0.04 | 0.09 |
| МКО2, мг/л | ? | ? | 0.78 | 0.56 |
Примечание. ДТ – длина теломерной ДНК, ТА — теломеразная активность, ПО2 – потребление кислорода, МКО2 – минимальная концентрация кислорода в воде. Значения абсолютной длины теломер (т.п.н.) приведены согласно [21], размер тела, особенности экологии и потребление кислорода взяты из монографии Н.А. Порфирьевой [17], из работ Е.П. Зайцевой и соавт. [19, 40] и Д.И. Стома и соавт. [36].
У Ph. sibirica, сибирского небольшого вида, обнаружен такой же характер изменений в количестве тДНК, как у R. arecepta, но с более значительной потерей теломерных повторов (20%) (рис. 2б). Возможно, такие потери связаны с более интенсивным потреблением Ph. sibirica кислорода на единицу массы, чем у байкальских планарий (табл. 3) [40]. Представители рода Phagocata способны размножаться бесполым путем, делясь на несколько частей, и образовывать цисты при неблагоприятных условиях [41, 42]. В цистах происходит регенерация, и в благоприятный период из них выходят полностью сформированные маленькие черви, которые потом вырастают до нормального размера. Половое размножение у Phagocata происходит редко и, как правило, в зимний период. Ph. sibirica обитает в горных реках, где на протяжении года температурный режим практически не меняется [43]. Относительная стабильность условий может способствовать поддержанию длины теломер у взрослых особей, но нельзя исключать вклада других факторов в регуляцию длины тДНК (например, способа размножения, что показано для других планарий с двумя типами репродукции [14, 15]). К сожалению, в популяции Ph. sibirica соотношение особей, появившихся в результате полового или бесполого размножения, неизвестно, и вопрос о его вкладе в регуляцию ДТ остается открытым.
Укорочение тДНК в начале постнатального периода, наблюдаемое у всех исследованных планарий (рис. 2б), может быть связано с интенсивным ростом и высоким обменом веществ [44, 45]. Подобный характер динамики тДНК выявлен у человека (на 24% в первые четыре года жизни [46]), баклана (на 25% в первые 2 года жизни [47]) и ряда других организмов. Параллельно с быстрым клеточным делением активность теломеразы может также уменьшаться, как, например, у муравьев [48]. Альянс концевой недорепликации тДНК с недостаточной теломеразной активностью может быть причиной быстрого укорочения тДНК не только на начальных этапах развития, но и в любой другой период онтогенеза. Вероятно, активность теломеразы, обнаруженная нами у молодых и взрослых особей всех исследуемых видов планарий (рис. 3), также может колебаться в процессе развития червей и вызывать колебания в динамике тДНК. Потеря тДНК на фоне активной теломеразы характерна не только для изученных нами видов планарий in vivo, но и для планарии Schmidtea mediterranea в лабораторных условиях [14]. Возможно, у плоских червей этот фермент выполняет дополнительные функции, не связанные с поддержанием теломер, и регуляция его активности зависит от стадии онтогенеза.
Таким образом, возрастная динамика тДНК у исследованных видов планарий, с одной стороны, имеет некоторые общие тенденции (укорочение в ювенильный период) (табл. 3). С другой стороны, у одних видов мы наблюдаем поддержание длины теломер, у других – потерю тДНК и способность восстанавливать ее длину. Филогенетическое родство, размеры тела, условия обитания не имеют очевидного влияния на характер динамики тДНК, так как виды, принадлежащие к разным семействам с отличной морфологией и физиологией, обитающие в разных условиях, могут иметь схожую динамику тДНК (R. arecepta, Ph. sibirica), а у филогенетически близких видов из одного биотопа динамика тДНК может различаться (R. arecepta, S. hepatizon). Разнообразие динамики тДНК в пределах одной группы организмов указывает на многокомпонентную регуляцию размера теломер и его важную роль в жизнедеятельности клетки и организма в целом.
Работа выполнена при финансовой поддержке грантов Российского фонда фундаментальных исследований (№ 12-04-32052 и № 13-04-01270), интеграционных проектов СО РАН № 45, 37 и 51, а также бюджетных тем 0345-2019-0002 (АААА-А16-116122110066-1) “Молекулярная экология и эволюция живых систем Центральной Азии в условиях глобальных экологических изменений” и 0345-2019-0009 (АААА-А16-116122110067-8) “Крупномасштабные изменения в экологии и биоразнообразии сообществ прибрежной зоны озера Байкал: междисциплинарное исследование, выявление причин, прогноз развития”.
Настоящая статья не содержит каких-либо исследований с участием людей.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Zakian V.A. (1995) Telomeres: beginning to understand the end. Science. 270, 1601–1605.
Louis E., Vershinin A. (2005) Chromosome ends: different sequences may provide conserved functions. BioEssays. 27, 685–697.
Gomes N.M., Ryder O.A., Houck M.L., Charter S.J., Walker W., Forsyth N.R., Austad S.N., Venditti C., Pagel M., Shay J.W., Wright W.E. (2011) Comparative biology of mammalian telomeres: hypotheses on ancestral states and the roles of telomeres in longevity determination. Aging Cell. 10, 761–768.
Servant G., Deininger P. (2016) Insertion of retrotransposons at chromosome ends: adaptive response to chromosome maintenance. Front. Genet. 6, 358.
Cesare A., Reddel R. (2010) Alternative lengthening of telomeres: models, mechanisms and implications. Nat. Rev. Genet. 11(5), 319–330.
Pickett H.A., Reddel R.R. (2012) The role of telomere trimming in normal telomere length dynamics. Cell Cycle. 11(7), 1309–1315.
Apte M., Cooper J. (2017) Life and cancer without telomerase: ALT and other strategies for making sure ends (don’t) meet. Crit. Rev. Biochem. Mol. Biol. 52(1), 57–73.
Allsopp R., Vaziri H., Patterson C., Goldsteint S., Younglai E.V., Futcher B., Greider C.W., Harley C.B. (1992) Telomere length predicts replicative capacity of human fibroblasts. Proc. Natl. Acad. Sci. USA. 89, 10114–10118.
Hall M., Nasir L., Daunt F., Gault E., Croxall J., Wanless S., Monaghan P. (2004) Telomere loss in relation to age and early environment in long-lived birds. Proc. R. Soc. Lond. B. 271, 1571–1576.
Ujvari B., Madsen T. (2009) Short telomeres in hatchling snakes: erythrocyte telomere dynamics and longevity in tropical pythons. PLoS One. 4(10), e7493.
Anchelin M., Murcia L., Alcaraz-Perez F., Garcia-Navarro E.M., Cayuela M.L. (2011) Behaviour of telomere and telomerase during aging and regeneration in zebrafish. PLoS One. 6(2), e16955.
Song H., Liu D., Chen X., Ying Z., Zhang B., Li F., Lu H. (2010) Change of season-specific telomere lengths in Ginkgo biloba L. Mol. Biol. Rep. 37, 819–824.
Olsson M., Wapstra E., Friesen C.R. (2018) Evolutionary ecology of telomeres: a review. Ann. N.Y. Acad. Sci. 1422(1), 5–28.
Tan T., Rahman R., Jaber-Hijazi F., Felix D.A., Chen C., Louis E.J., Aboobaker A. (2012) Telomere maintenance and telomerase activity are differentially regulated in asexual and sexual worms. Proc. Natl. Acad. Sci. USA. 109(11), 4209–4214.
Tasaka K., Yokoyama N., Nodono H., Hoshi M., Matsumoto M. (2013) Innate sexuality determines the mechanisms of telomere maintenance. Int. J. Dev. Biol. 57, 69–72.
Lai A.G., Pouchkina-Stantcheva N., Donfrancesco A., Kildisiute G., Sahu S., Aboobaker A. (2017) The protein subunit of telomerase displays patterns of dynamic evolution and conservation across different metazoan taxa. BMC Evol. Biol. 17(1), 107.
Порфирьева Н.А. (1977) Планарии озера Байкал. Новосибирск: Наука.
Sluys R., Timoshkin O., Kawakatsu M. (1998) A new species of giant planarian from Lake Baikal, with some remarks on character states in the Dendrocoelidae (Platyhelminthes, Tricladida, Paludicola). Hydrobiologia. 383, 69–75.
Zaytseva E.P., Mizandrontsev I.B., Timoshkin O.A. (2006) Postembryonic development and growth dynamics of Baikalobia guttata (Gerstfeldt, 1858) (Plathelminthes): first report on the life history of endemic Tricladida from Lake Baikal. Hydrobiologia. 568, 239–245.
Takeda H., Nishimura K., Agata K. (2009) Planarians maintain a constant ratio of different cell types during changes in body size by using the stem cell system. Zool. Science. 26(12), 805–813.
Королева А.Г., Евтушенко Е.В., Тимошкин О.А., Вершинин А.В., Кирильчик С.В. (2013) Длина теломерной ДНК и филогения байкальских и сибирских планарий (Turbellaria, Tricladida). Цитология. 55(4), 247–252.
Cawthon R. (2002) Telomere measurement by quantitative PCR. Nucl. Acids Res. 30, e47.
Bradford M. (1976) A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analyt. Biochem. 72, 248–254.
Kim N.W., Piatyszek M.A., Prowse K.R., Harley C.B., West M.D., Ho P.L.C., Coviello G.M., Wright W.E., Weinrich S.L., Shay J.W. (1994) Specific association of human telomerase activity with immortal cells and cancer. Science. 266, 2011–2015.
Kim N., Wu F. (1997) Advances in quantification and characterization of telomerase activity by the telomeric repeat amplification protocol (TRAP). Nucl. Acids Res. 25, 2595–2597.
Dalla Torre C.A., Maciel R.M.B., Pinheiro N.A., Andrade N.J.A.D., de Toledo S.R.C., Villa L.L., Cerutti J.M. (2002) TRAP-silver staining, a highly sensitive assay for measuring telomerase activity in tumor tissue and cell lines. Brazilian J. Med. Biol. Res. 35, 65–68.
Harley C.B., Futcher A.B., Greider C.W. (1990) Telomeres shorten during ageing of human fibroblasts. Nature. 345(6274), 458–460.
Louzon M., Coeurdassier M., Gimbert F., Pauget B., de Vaufleury A. (2019) Telomere dynamic in humans and animals: review and perspectives in environmental toxicology. Environ. Int. 131, 105025.
Youngren K., Jeanclos E., Aviv H., Kimura M., Stock J., Hanna M., Skurnick J., Bardeguez A., Aviv A. (1998) Synchrony in telomere length of the human fetus. Hum. Genet. 102(6), 640–643.
Graakjaer J., Pascoe L., Der-Sarkissian H., Thomas G., Kolvra S., Christensen K., Londono-Vallejo J. (2004) The relative lengths of individual telomeres are defined in the zygote and strictly maintained during life. Aging Cell. 3, 97–102.
Kalmbach K., Robinson L.G. Jr., Wang F., Liu L., Keefe D. (2014) Telomere length reprogramming in embryos and stem cells. Biomed. Res. Int. 2014, 925121.
Maximova N., Koroleva A., Sitnikova T., Khanaev I., Bukin Yu., Kirilchik S. (2017) Age dynamics of telomere length of Baikal gastropods is sex specific and multidirectional. Folia Biologica (Krakow). 65(4), 187–197.
Gruber H., Schaible R., Ridgway I.D., Chow T.T., Held C., Philipp E.E. (2014) Telomere-independent ageing in the longest-lived non-colonial animal, Arctica islandica. Exp. Gerontol. 51, 38–45.
Danzer B., Fletcher Q. (2015) Telomeres shorten more slowly in slow-aging wild animals than in fast-aging ones. Exp. Gerontol. 71, 38–47.
Hatakeyama H., Yamazaki H., Nakamura K., Izumiyama-Shimomura N., Aida J., Suzuki H., Tsuchida S., Matsuura M., Takubo K., Ishikawa N. (2016) Telomere attrition and restoration in the normal teleost Oryzias latipes are linked to growth rate and telomerase activity at each life stage. Aging (Albany NY). 8(1), 62–76.
Стом Д.И., Ключевская А.А., Колесова У.О. (2006) Некоторые экологические особенности байкальских и общесибирских турбеллярий. Сибирский экологический журнал. 13(6), 761–766.
Beaulieu M., Benoit L., Abaga S., Kappeler P.M., Charpentier M.J.E. (2017) Mind the cell: seasonal variation in telomere length mirrors changes in leucocyte profile. Mol. Ecol. 26(20), 5603–5613.
Turbill C., Smith S., Deimel C., Ruf T. (2012) Daily torpor is associated with telomere length change over winter in Djungarian hamsters. Biol. Lett. 8(2), 304–307.
Schultner J., Moe B., Chastel O., Bech C., Kitaysky A. (2014) Migration and stress during reproduction govern telomere dynamics in a seabird. Biol. Lett. 10(1), 20130889.
Зайцева Е.П., Мизандронцев И.Б., Юма М., Тимошкин О.А. (2008) Особенности потребления кислорода массовыми видами мелководных планарий (Turbellaria, Tricladida) озера Байкал и водоемов Прибайкалья. Зоологический журнал. 87(7), 771–778.
Рупперт Э.Э., Фокс Р.С., Варне Р.Д. (2008) Зоология беспозвоночных: функциональные и эволюционные аспекты. М.: Академия.
Smith D.G. (2001) Pennak’s freshwater invertebrates of the United States: Porifera to Crustacea. Canada: Jonh Willey and Sons, Inc.
Стом Д.И., Ключевская А.А., Стом А.Д. (2005) К вопросу о причинах несмешиваемости байкальской и общесибирской фаун. Бюл. ВСНЦ СО РАМН. 6(44), 169–172.
Baerlocher G.M., Rice K., Vulto I., Lansdorp P.M. (2007) Longitudinal data on telomere length in leukocytes from newborn baboons support a marked drop in stem cell turnover around 1 year of age. Aging Cell. 6(1), 121–123.
Salomons H.M., Mulder G.A., van de Zande L., Haussmann M.F., Linskens M.H.K., Verhulst S. (2009) Telomere shortening and survival in free-living corvids. Proc. R. Soc. B. 276, 3157–3165.
Frenck R., Blackburn E., Shannon K. (1998) The rate of telomere sequence loss in human leukocytes varies with age. Proc. Natl. Acad. Sci. USA. 95, 5607–5610.
Hall M., Nasir L., Daunt F., Gault E., Croxall J., Wanless S., Monaghan P. (2004) Telomere loss in relation to age and early environment in long-lived birds. Proc. Biol. Sci. 271(1548), 1571–1576.
Jemielity S., Kimura M., Parker K.M., Parker J.D., Cao X., Aviv A., Keller L. (2007) Short telomeres in short-lived males: what are the molecular and evolutionary causes? Aging Cell. 6(2), 225–233.
Дополнительные материалы
- скачать ESM.doc
- Additional materials. Fig. 1S - Fig. 3S. Table 1S.
Инструменты
Молекулярная биология


