Молекулярная биология, 2020, T. 54, № 4, стр. 634-642
Состояние сигнального пути JAK/STAT влияет на чувствительность опухолевых клеток к онколитическим энтеровирусам
Т. Х. Ле a, b, А. В. Липатова a, М. А. Вольская a, О. А. Тихонова a, П. М. Чумаков a, c, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Московский физико-технический институт
141701 Долгопрудный, Россия
c Федеральный научный центр исследований и разработки иммунобиологических
препаратов им. М.П. Чумакова Российской академии наук
108819 Москва, Россия
* E-mail: chumakovpm@yahoo.com
Поступила в редакцию 10.02.2020
После доработки 19.02.2020
Принята к публикации 19.02.2020
Аннотация
Изучение чувствительности семи линий клеток рака толстого кишечника к 12 непатогенным энтеровирусам человека выявило существенные различия в способности опухолевых клеток инфицироваться и реплицировать различные вирусные штаммы. На чувствительность клеток к вирусам может влиять состояние механизмов противовирусной защиты, связанных с реакцией клеток на обработку интерфероном первого типа. На примере двух линий клеток рака толстого кишечника (CaCo2 и LIM1215) выявлены существенные различия в способности клеток защищаться от заражения вирусами после 16-часовой обработки интерфероном-α (1000 ед./мл). Влияние состояния системы ответа на интерферон, представленной сигнальным путем Jak/STAT, на чувствительность клеток к разным штаммам энтеровирусов изучали на линии клеток НЕК293Т, способной поддерживать репликацию каждого из испытуемых энтеровирусов, а также сохранившей способность защищаться от вирусной инфекции после обработки интерфероном. С помощью системы CRISPR/Cas9 получены сублинии HEK293T с нокаутом генов IFNAR1 и STAT2. Проведен анализ чувствительности контрольных клеток и клеток с нокаутом этих генов к заражению пятью штаммами энтеровирусов и вирусом везикулярного стоматита. Отмечено, что сублинии с нокаутом генов IFNAR1 и STAT2 обладали повышенной чувствительностью ко всем испытуемым вирусам. В клетках с нокаутом уровни репродукции вакцинного штамма полиовируса типа 1, эховирусов 7, 30, вирусов Коксаки B5 и A7, также были существенно увеличены в сравнении с контрольной линией клеток НЕК293Т. Таким образом, нарушения сигнального пути Jak/STAT в опухолевых клетках приводят к общему повышению чувствительности к действию онколитических вирусов.
ВВЕДЕНИЕ
Онколитические вирусы, благодаря их способности избирательно инфицировать и разрушать клетки опухоли, представляют перспективный класс противоопухолевых агентов. В последние годы в качестве кандидатов для противоопухолевой терапии рассматриваются представители многих семейств как ДНК-, так и РНК-содержащих вирусов [1–6]. Особенный интерес представляют непатогенные штаммы энтеровирусов человека, поскольку обширное семейство этих вирусов использует несколько альтернативных клеточных рецепторов для проникновения в клетку, что частично может определять их способность заражать опухолевые клетки, на которых в достаточном количестве экспрессируется соответствующий рецептор [7]. Непатогенные энтеровирусы человека включают вакцинные штаммы полиовирусов, а также ряд штаммов энтеровирусов групп А, В, С и D, выделяемых из фекалий здоровых детей. Как и другие представители семейства пикорнавирусов, энтеровирусы имеют одноцепочечный РНК-геном положительной полярности размером приблизительно 7.5 т.н., который содержит единственную открытую рамку считывания, кодирующую полипротеин-предшественник всех структурных и неструктурных вирусных белков, образующихся в результате каскадного протеолиза [8]. Защита клеток от вирусной инфекции обеспечивается врожденным механизмом, при котором первичный контакт с вирусом сопровождается индукцией синтеза и секреции противовирусных белков – интерферонов типа I, которые сообщают окружающим клеткам об опасности вирусной инвазии и индуцируют в них состояние невосприимчивости к вирусной инфекции [9, 10]. В злокачественных образованиях по мере их прогрессии накапливаются генетические изменения, способствующие повреждению интерфероновой системы, осуществляющей противовирусную защиту. В результате раковые клетки теряют способность индуцировать продукцию интерферона, а также утрачивают способность реагировать на обработку интерферонами типа I индукцией противовирусного состояния [11–16]. Нарушения в интерфероновой системе являются одной из особенностей опухолевых клеток, обуславливающей их большую чувствительность к вирусной инфекции. Этим объясняется феномен вирусного онколиза и использование определенных штаммов вирусов (онколитических) в терапии рака [16]. В нормальных клетках вирусная инфекция детектируется с помощью специальных рецепторов, распознающих чужеродные компоненты вируса, так называемые молекулярные автографы патогена (PAMP – pathogen-associated molecular patterns) [17]. Этот сигнал инициирует процесс индукции интерферонов типа I, которые, выйдя за пределы зараженной клетки, связываются с поверхностными рецепторами интерферона – IFNAR1 и IFNAR2 [18], запуская каскад сигнального пути Jak–STAT [19]. Активированные белки STAT1 и STAT2 образуют гетеродимеры и связываются с регуляторным фактором IFN9 для образования фактора транскрипции ISGF3 [20]. ISGF3 транслоцируется в ядро и связывается с элементом ISRE, расположенным в контрольных участках генов, регулируемых интерфероном (ISG). Продукты этих генов участвуют во множестве разнообразных регуляторных процессов, обеспечивающих приобретение клетками состояния относительной невосприимчивости к вирусной инфекции, ограничивающего вирусную репликацию и дальнейшее распространение в организме [21, 22]. Однако восприимчивость опухолевых клеток к вирусам обуславлена не только дефектами в интерфероновых механизмах. Очевидно, что определенные клеточные факторы, такие как рецепторы для проникновения в клетку, особенности метаболизма и контроля клеточного цикла, играют определенную роль в вирусной инфекции.
Цель данной работы состояла в определении вклада интерфероновой системы в восприимчивость опухолевых клеток к онколитическим энтеровирусам и к их способности реплицироваться в зараженных клетках.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Линии клеток человека. Линии трансформированных клеток почек эмбриона человека HEK293Т, рабдомиосаркомы RD, линии клеток рака толстого кишечника RKO, HCT116, SW480, HT29, CaCo2 получены из Американской коллекции культур клеток АТСС. Линия клеток рака толстого кишечника LIM1215 получена от авторов [23]. Клетки культивировали в среде DMEM, содержащей по 100 мкг/мл пенициллина/стрептомицина и 10% фетальной сыворотки крупного рогатого скота (FBS), в атмосфере 5% СО2 при 37°С.
Вирусные штаммы. Вирус везикулярного стоматита (VSV, штамм Indiana), вакцинный штамм полиовируса типа I (штамм Сэбина), непатогенные энтеровирусы человека, выделенные от здоровых детей – эховирусы типа 1, 6, 7, 11, 12, 25 и 30; вирусы Коксаки группы A: А7, A21; вирусы Коксаки группы B: В3, В5 из коллекции лаборатории, получены путем инфицирования чувствительных клеток RD и сбора супернатанта культуры через 48 ч. Титры вирусов определяли с помощью стандартного метода Рида и Менча [24].
Получение линии клеток с нокаутом генов IFNAR1 и STAT2. Линии клеток с нокаутом генов IFNAR1 и STAT2 получали с помощью технологии CRISPR/ Cas9. Плазмидные конструкции на основе pCas-Guide-2A-RFP, экспрессирующие гидовые РНК, специфичные к участкам генов IFNAR1 и STAT2, получали клонированием олигонуклеотидных вставок. С этой целью использовали синтетические олигонуклеотиды:
STAT2D-5'-phospho-GATCGttcgacagtacttggctgtcG;
STAT2R-5'-phospho-AAAACgacagccaagtactgtcgaaC;
IFNAR1D-5'-phospho-GATCGaacaggagcgatgagtctgtG;
IFNAR1R-5'-phospho-AAAACacagactcatcgctcctgttC.
Каждую пару олигонуклеотидов отжигали и лигировали по сайтам рестрикции. Смесь олигонуклеотидов, способных образовывать двухцепочечные дуплексы, лигировали по сайтам рестрикции BamHI и BsmBI в область гидовой РНК плазмиды pCas-Guide-2A-RFP. Полученная конструкция также содержала ген красного флуоресцентного белка для облегчения детекции клеток, получивших плазмиду в результате трансфекции. Трансфекцию плазмид в клетки HEK293Т проводили с помощью реагента Lipofectamine 3000 (“Thermo Fisher Scientific”, США) согласно рекомендациям производителя. После добавления смеси ДНК и реагента для трансфекции клетки инкубировали в течение 5 ч при 37°С и 5% СО2, затем заменяли среду роста и культивировали в течение еще 18 ч, после чего контролировали эффективность трансфекции путем оценки флуоресценции.
Получение моноклональных культур клеток с инактивированными генами IFNAR1 и STAT2. Через 72 ч после трансфекции клетки рассевали на 96‑луночные планшеты и культивировали до образования единичных клонов. Планшеты просматривали ежедневно на флуоресцентном микроскопе и отмечали лунки, содержащие единичные клоны с красным свечением. По мере увеличения размера клонов свечение постепенно прекращалось по причине разбавления введенной, но реплицирующейся генетической конструкции при последующих делениях клеток. Несколько клонов далее наращивали и анализировали для определения делеции в генах IFNAR1 или STAT2, а также прекращения их экспрессии.
Антитела. Моноклональные антитела мыши к IFNAR1 (sc-7391) получены от “Santa Cruz Biotechnology” (США), моноклональные антитела кролика к STAT2 (#72604) – от “Cell Signaling Technology” (США).
Иммуноблотинг. Клетки собирали, промывали 1 раз ледяным изотоническим фосфатным буферным раствором (PBS) и лизировали буфером PBS, содержащим 0.5% NP-40, коктейль ингибитора протеаз и ингибиторы фосфатазы (“Roche”, Швейцария) в течение 5 мин на льду. После центрифугирования (14 000 об./мин) в течение 10 мин при 4°С белки клеточного лизата фракционировали методом гель-электрофореза в денатурирующих условиях в полиакриламидном геле (SDS-PAGE), переносили из геля на мембрану PVDF, инкубировали в течение 1 ч при комнатной температуре с 5% обезжиренного молока в Трис-буферном солевом растворе (ТБС), содержащем 0.1% Твин-20, и впоследствии инкубировали последовательно со специфическими первичными антителами и вторичными антителами, конъюгированными с пероксидазой хрена (HRP). С целью визуализации на мембрану наносили раствор хемилюминесцентного реагента (в соответствии с инструкциями производителя) и экспонировали с помощью прибора GelDoc (“BioRad”, США).
ПЦР. Геномную ДНК (1–2 мкг) выделяли из клеток с нокаутом генов STAT2 и IFNAR1 с помощью реагента Trizol согласно рекомендациям производителя (www.thermofisher.com). ПЦР проводили с использованием Taq-полимеразы (“Genemed”, США) со следующими праймерами:
IFNAR1-DIR-5'-TCAGGGATGTGAGGGATAGAA,
IFNAR1-REV-5'-TGCTTCAACACCCAAAGATGT,
STAT2-DIR-5'-TATCACCCAGGTTCACAGCT,
STAT2-REV5'-TTGCTGCCAGTCTTGAGGAT.
Определение чувствительности клеток к вирусам. Клетки высевали на 96-луночные планшеты и заражали 10-кратными серийными разведениями энтеровирусных препаратов. На третьи сутки с помощью микроскопии оценивали цитопатический эффект, отбирали супернатант, для определения титра вируса чувствительные клетки RD инфицировали 10-кратными разведениями вируса. Через 3 дня рассчитывали величину TCID50 (50%-ная тканевая цитопатическая доза) методом Рида и Менча [24]. Чувствительность клеток оценивали по минимальной множественности заражения (MOI), необходимой для гибели основной массы клеток. Статистическую обработку результатов проводили с помощью U-критерия Манна–Уитни. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Линии клеток рака толстого кишечника человека существенно различаются по способности реплицировать онколитические штаммы энтеровирусов
Один из основных механизмов вирусного онколиза – прямое цитолитическое действие вируса, при котором гибель клеток обусловлена инфицированием клеток и репликацией вируса с образованием инфекционных вирусных частиц. Поэтому вирусы, способные инфицировать и хорошо реплицироваться в культуре опухолевых клеток данного типа, могут оказаться и более эффективными онколитическими средствами. Однако геном опухолевых клеток содержит множество повреждений, поэтому в каждом отдельном случае чувствительность опухолевых клеток к тому или иному штамму онколитических вирусов может различаться. Установление причин устойчивости опухолевых клеток к действию онколитических вирусов поможет выявить предсказательные биомаркеры, по которым можно проводить персонифицированный подбор терапевтических штаммов. Для исследования спектра цитолитического действия 12 штаммов онколитических вирусов была протестирована панель из шести линий клеток рака толстого кишечника: RKO, HCT116, HT29, CaCo2, SW480 и LIM1215. Клетки инфицировали десятикратными серийными разведениями вирусов и определяли минимальную множественность инфекции (число инфекционных единиц на одну клетку, или MOI), при которой цитопатическое действие вируса проявлялось за 72 ч. Результаты, приведенные в табл. 1, указывают на существенные различия в чувствительности клеток к разным штаммам вирусов. Некоторые культуры клеток оказались полностью устойчивыми к заражению даже при высоких значениях MOI отдельных вирусных штаммов, хотя эти же культуры сохраняли высокую чувствительность к некоторым другим вирусам.
Таблица 1.
Чувствительность шести линий клеток рака толстого кишечника к 12 штаммам энтеровирусов
| Вирус | Линия опухолевых клеток | |||||
|---|---|---|---|---|---|---|
| RKO | HCT116 | CaCo2 | HT29 | SW480 | LIM1215 | |
| PVS-1 | 0.00001 | 0.01 | 0.00001 | 0.0001 | 0.0001 | 0.00001 |
| Коксаки B3 | – | 0.01 | 0.001 | 0.01 | 0.01 | 0.01 |
| Коксаки B5 | – | 0.001 | 0.001 | 0.0001 | 0.001 | 0.001 |
| Коксаки A7 | 0.00001 | 0.01 | 0.001 | 0.00001 | 0.0001 | 0.0001 |
| Коксаки A21 | 0.0001 | – | 0.01 | 0.001 | 0.0001 | 0.001 |
| ECHO1 | 0.0001 | – | 0.00001 | 0.001 | 0.001 | 0.001 |
| ECHO6 | – | – | 0.01 | – | – | 0.01 |
| ECHO7 | – | – | 0.001 | – | 1 | 0.001 |
| ECHO11 | 0.0001 | 0.00001 | – | – | 0.01 | 0.0001 |
| ECHO12 | – | – | 0.0001 | – | 0.1 | 0.001 |
| ECHO25 | – | – | 0.1 | – | – | 0.01 |
| ECHO30 | – | – | 0.1 | – | – | 0.01 |
Примечание. Для каждой линии клеток указаны значения минимальной множественности инфекции (MOI), необходимой для заражения лунок с клетками, растущими в 96-луночных планшетах. Меньшее значение MOI означает большую чувствительность культуры к заражению вирусом. Прочерк – отсутствие чувствительности клеток к соответствующему штамму вируса.
Наиболее важный параметр, характеризующий чувствительность клеток к вирусу, – способность эффективно реплицироваться и продуцировать инфекционные вирусные частицы. Эффективность репликации энтеровирусов в культурах клеток оценивали по величине инфекционного титра новообразованного вируса, определенного титрованием методом конечных 10-кратных разведений на чувствительных линиях клеток RD или Vero (рис. 1).
Рис. 1.
Титры энтеровирусов, продуцируемых в линиях клеток рака толстого кишечника, определенные титрованием инфекционности серийных 10-кратных разведений на культурах чувствительных клеток RD или Vero.

Среди штаммов энтеровируса наиболее широким тропизмом в отношении линий опухолевых клеток толстого кишечника обладали вакцинный штамм полиовируса первого типа, вирусы Коксаки А7, Коксаки A21 и эховирус 1. По результатам анализа линии клеток были разделены на четыре группы в соответствии с их восприимчивостью к данным штаммам энтеровируса: нечувствительные линии, линии с малой и средней чувствительностью и высокочувствительные линии.
Линии клеток рака толстого кишечника могут существенно различаться по чувствительности к противовирусному действию интерферона типа I
Различия в способности опухолевых клеток инфицироваться онколитическими вирусами и поддерживать их репликацию могут определяться многими факторами, такими как уровень экспрессии на поверхности опухолевых клеток рецепторов для проникновения вирусов в клетку, состояние систем везикулярного транспорта, активность эндоцитоза, факторы, способствующие своевременному выходу вирусных компонентов из эндосом, и инициация процессов трансляции и репликации вирусных РНК. Однако важным фактором, от которого зависит успешность заражения вирусом, является состояние систем противовирусной защиты и способность клеток реагировать на обработку интерферонами типа I. В опухолевых клетках эти системы, как правило, повреждены, однако степень их подавления может различаться. Мы измерили способность семи штаммов онколитических энтеровирусов оказывать цитопатическое действие на две линии клеток рака толстого кишечника (CaCo2 и LIM1215) через 16 ч после обработки интерфероном-α по сравнению с контрольными необработанными клетками. Результаты представлены в табл. 2.
Таблица 2.
Чувствительность двух линий клеток рака толстого кишечника, контрольных и обработанных интерфероном-α (1000 ед./мл, 16 ч), к действию семи штаммов энтеровирусов
| Вирус | Линия опухолевых клеток | |||
|---|---|---|---|---|
| CaCo2 | LIM1215 | |||
| Интерферон-α, 16 ч | Контроль | Интерферон-α, 16 ч | Контроль | |
| PVS1 | 0.0001 | 0.00001 | 0.1 | 0.00001 |
| ECHO1 | 0.0001 | 0.00001 | 1 | 0.001 |
| ECHO7 | 0.001 | 0.001 | 1 | 0.001 |
| ECHO12 | 0.001 | 0.0001 | 1 | 0.001 |
| Коксаки А7 | 0.001 | 0.001 | 0.1 | 0.0001 |
| Коксаки А21 | 0.01 | 0.01 | 10 | 0.001 |
| Коксаки В5 | 0.001 | 0.001 | 10 | 0.001 |
Выявлены значительные различия в способности клеток этих линий защищаться от вирусной инфекции после обработки интерфероном-α. Если клетки LIM1215 проявляли высокую чувствительность к интерферону, приводящую к существенному увеличению значений MOI, необходимых для оказания цитопатического действия, то клетки CaCo2 оставались высокочувствительными к заражению вирусами, что указывает на значительное подавление их реакции на обработку интерфероном.
Получение линии клеток с нокаутом генов IFNAR1 и STAT2 с помощью системы CRISPR/Cas9
Повреждение сигнального пути индукции генов, регулируемых интерфероном, предотвращает подавление вирусной инфекции, вызываемое обработкой интерфероном. Могут ли повреждения ключевых компонентов сигнального пути, инициируемого обработкой интерферонами типа I, влиять на репликацию вирусов даже без действия экзогенного интерферона? Чтобы выяснить это, мы получили сублинии клеток HEK293T с делецией каждого из двух наиболее значимых звеньев сигнального пути Jak/STAT. Ген IFNAR1 кодирует субъединицу рецептора интерферонов типа I. Белок STAT2 образует активный димерный комплекс с белком STAT1, обеспечивая специфический сигнал от рецептора интерферонов типа I. Нокаут каждого из этих двух генов должен приводить к утрате реакции клеток на обработку интерферонами типа I.
Выбор клеток HEK293T обусловлен тем, что в отличие от злокачественных клеток опухоли, прошедших селекцию в организме больного и утративших компоненты интерфероновой системы, эти клетки получены с помощью трансформации in vitro под действием вирусных онкогенов. Эти клетки сохраняют способность к защите от вирусной инфекции после обработки интерферонами типа I.
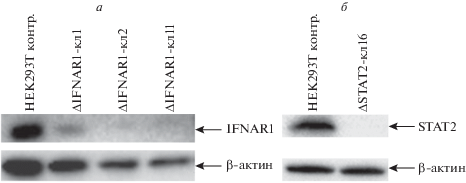
В клонах клеток с нокаутом и в контрольных клетках с помощью Вестерн-блотинга проведен сравнительный анализ уровней белков IFNAR1 и STAT2 (рис. 2). В клонах 2 и 11 клеток HEK293T-ΔIFNAR1 отмечен лишь остаточный уровень экспрессии гена IFNAR1, что можно объяснить сравнительно большим временем жизни этого белка. В клоне клеток HEK293T-ΔSTAT2 экспрессия продукта гена STAT2 полностью отсутствовала.
Рис. 2.
Выявление белков IFNAR1 (а) и STAT2 (б) методом Вестерн-блотинга в клонах клеток HEK293T с нокаутом генов IFNAR1 и STAT2.
Мы также тестировали появление структурных изменений генома в области таргетирования генов IFNAR1 и STAT2 с помощью секвенирования соответствующих фрагментов ДНК, полученных методом ПЦР (рис. 3).
Рис. 3.
Результаты секвенирования участков генома клеток HEK293T с нокаутом генов IFNAR1 и STAT2. Бледным шрифтом показана область PAM, вблизи которой ожидалось появление структурных изменений в геноме.

В клонах HEK293T-ΔIFNAR1 и HEK293T-ΔSTAT2 обнаружены делеции одного и двух нуклеотидов, соответственно, приводящие к сдвигу рамки трансляции и обрыву растущей цепочки белка. Таким образом получены сублинии клеток, имеющие гомозиготные делеции участков каждого из таргетируемых генов.
Влияние обработки клеток НЕК293Т с нокаутом генов IFNAR1 и STAT2 интерфероном-α на литическую активность онколитических энтеровирусов
Отобранные моноклональные сублинии наращивали после формирования колоний и проводили тест на обработку интерфероном. Мы проверили формирование противовирусного ответа на обработку интерфероном в контрольных клетках НЕК293Т и в клетках с нокаутом генов IFNAR1 и STAT2. С этой целью клетки инкубировали с интерфероном-α (1000 ед./мл, 16 ч), после чего инфицировали несколькими штаммами энтеровирусов и VSV, модельного в подобных экспериментах, который обладает исключительно высокой чувствительностью к действию интерферонов типа I. Величина MOI составляла 0.1 и.е./кл. у энтеровирусов и 0.01 и.е./кл. – у VSV. Через 24 ч после заражения с помощью МТТ-теста определяли выживаемость клеток. Результаты представлены на рис. 4.
Рис. 4.
Жизнеспособность контрольных клеток НЕК293Т (белые столбики) и НЕК293Т с нокаутом генов IFNAR1 (серые столбики) и STAT2 (черные столбики), предварительно обработанных интерфероном-α (1000 ед./мл) и инфицированных вирусами: VSV, полиовирусом типа 1 (PVS1), Коксаки B5 (CVB5), Коксаки А7 (CVA7), эховирусом 7 (ECHO7) и эховирусом 30 (ECHO30) через 24 ч после заражения. Звездочкой (*) отмечены статистически значимые различия (р ≤ 0.05) согласно U-критерию Манна–Уитни.
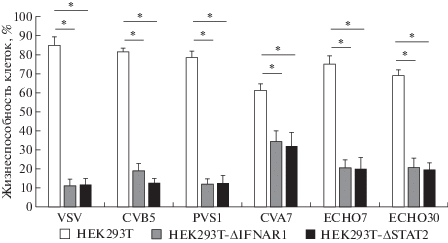
По результатам определения чувствительности клеток к заражению вирусами (рис. 4) установлено, что в то время как контрольные клетки HEK293T после инкубации с интерфероном-α эффективно защищались от цитопатического действия вирусов, наблюдалась гибель обеих культур с нокаутом этих генов. Относительно меньший уровень гибели клеток с нокаутом под действием вируса Коксаки А7 объясняется лишь более длительным инфекционным циклом данного вируса. К 48 ч после заражения отмечена практически 100%-ная гибель всех культур с нокаутом, в то время как контрольные клетки оставались жизнеспособными (результат не показан). Таким образом, нормальное функционирование как гена IFNAR1, так и STAT2 абсолютно необходимо для защиты обработанных интерфероном-α клеток от вирусов.
Влияние состояния системы врожденного противовирусного иммунитета на чувствительность клеток к действию онколитических энтеровирусов
Поскольку рецептор интерферона типа I и факторы транскрипции STAT1 и STAT2 являются ключевыми звеньями сигнального пути формирования противовирусного состояния под действием интерферонов типа I, нарушения экспрессии или целостности генов IFNAR1 и STAT2 в опухолевых клетках могут влиять на их чувствительность к вирусам и в определенной степени определять часто наблюдаемые различия в способности опухолевых клеток реплицировать некоторые вирусы. Для определения зависимости онколитической активности непатогенных штаммов энтеровирусов человека от состояния сигнальных путей интерферонового ответа в заражаемых клетках мы инфицировали полученные клоны клеток с нокаутом генов IFNAR1 и STAT2 набором штаммов энтеровирусов и VSV и сравнивали уровень репродукции этих вирусов в этих и в контрольных клетках HEK293T. Результаты, представленные на рис. 5, указывают на то, что нокаут каждого из генов (IFNAR1 и STAT2) в клетках HEK293T делает эти клетки более чувствительными к вирусам, что выражается в среднем в десятикратном повышении титров продуцируемых вирусных инфекционных частиц даже без предварительной обработки клеток интерфероном.
Рис. 5.
Репродукция вируса везикулярного стоматита (VSV) и энтеровирусных штаммов: полиовируса типа 1 (PVS1), вирусов Коксаки B5 (CVB5) и Коксаки А7 (CVA7), эховируса 7 (ECHO7) и эховируса 30 (ECHO30) в контрольных клетках НЕК293Т (белые столбики) и в клетках с нокаутом генов IFNAR1 (серые столбики) и STAT2 (черные столбики), через 24 ч после заражения вирусами. Клетки заражали с множественностью MOI 5 и.е./кл. Инфекционный титр вируса определяли методом Рида и Менча. Звездочкой (*) отмечены статистически значимые различия (р ≤ 0.05) согласно U-критерию Манна–Уитни.

Следует отметить, что при инфицировании клеток с MOI 5 и.е. репликация вируса осуществляется в течение одного цикла, и за это время влияние интерферона, продуцируемого в ответ на первичное заражение небольшого числа клеток, практически исключено. Поэтому полученные результаты указывают на важную роль сигнального пути Jak/STAT в сдерживании вирусной инфекции даже в отсутствие интерферона. Это дает основание для предположения о возможном участии повреждений сигнального пути Jak/STAT, часто наблюдаемых в опухолевых клетках, в определении различий в чувствительности клеток к действию онколитических вирусов. Однако эти данные не могут объяснить значительных различий в чувствительности опухолевых клеток к тому или иному вирусному штамму, вплоть до полной их устойчивости, при том что те же клетки способны эффективно заражаться и реплицировать другой штамм онколитического вируса (табл. 1 и рис. 1). Очевидно, дифференциальная чувствительность опухолевых клеток к вирусным штаммам определяется множеством факторов, идентификация которых позволит предсказать чувствительность опухоли данного пациента к терапевтическому действию онколитических вирусов.
Работа поддержана Российским фондом фундаментальных исследований (грант № 18-29-01059) и Центром стратегического планирования и оценки медико-биологических рисков здоровью Министерства здравоохранения России (грант № 1.1597).
В работе не использованы материалы, полученные от людей.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Lemay C.G., Keller B.A., Edge R.E., Abei M., Bell J.C. (2018) Oncolytic viruses: the best is yet to come. Curr. Cancer Drug Targets. 18, 109–123.
Lawler S.E., Speranza M.C., Cho C.F., Chiocca E.A. (2017) Oncolytic viruses in cancer treatment: a review. JAMA Oncol. 3, 841–849.
Fountzilas C., Patel S., Mahalingam D. (2017) Review: oncolytic virotherapy, updates and future directions. Oncotarget. 8, 102617–102639.
Breitbach C.J., Lichty B.D., Bell J.C. (2016) Oncolytic viruses: therapeutics with an identity crisis. EBioMedicine. 9, 31–36.
Matveeva O.V., Guo Z.-S., Shabalina S.V., Chumakov P.M. (2015) Oncolysis by paramyxoviruses: multiple mechanisms contribute to therapeutic efficacy. Mol. Ther. Oncolyt. 2, 15011.
Bell J.C., McFadden G. (2015) Editorial overview: oncolytic viruses-replicating virus therapeutics for the treatment of cancer. Curr. Opin. Virol. 13, viii-ix.
Чумаков П.М., Морозова В.В., Бабкин И.В., Байков И.К., Нетесов С.В., Тикунова Н.В. (2012) Онколитические энтеровирусы. Молекуляр. биология. 46, 712–725.
Pallansch M., Roos R. (2007) Enteroviruses: polioviruses, coxsackieviruses, echoviruses, and newer enteroviruses. In: Fields Virology. Eds Knipe D.M., Howley P.M. Philadelphia: Lippincott Williams and Wilkins, 840–893.
Stark G.R., Darnell J.E., Jr. (2012) The JAK-STAT pathway at twenty. Immunity. 36, 503–514.
Borden E.C., Sen G.C., Uze G., Silverman R.H., Ransohoff R.M., Foster G.R., Stark G.R. (2007) Interferons at age 50: past, current and future impact on biomedicine. Nat. Rev. Drug Discov. 6, 975–990.
Groner B., von Manstein V. (2017) Jak Stat signaling and cancer: opportunities, benefits and side effects of targeted inhibition. Mol. Cell. Endocrinol. 451, 1–14.
Matveeva O.V., Chumakov P.M. (2018) Defects in interferon pathways as potential biomarkers of sensitivity to oncolytic viruses. Rev. Med. Virol. e2008.
Pikor L.A., Bell J.C., Diallo J.-S. (2015) Oncolytic viruses: exploiting cancer’s deal with the Devil. Trends Cancer. 1, 266–277.
Heiber J.F., Barber G.N. (2012) Evaluation of innate immune signaling pathways in transformed cells. Meth. Mol. Biol. 797, 217–238.
Naik S., Russell S.J. (2009) Engineering oncolytic viruses to exploit tumor specific defects in innate immune signaling pathways. Exp. Opin. Biol. Ther. 9, 1163–1176.
Stojdl D.F., Lichty B., Knowles S., Marius R., Atkins H., Sonenberg N., Bell J.C. (2000) Exploiting tumor-specific defects in the interferon pathway with a previously unknown oncolytic virus. Nat. Med. 6, 821–825.
Yoneyama M., Kikuchi M., Matsumoto K., Imaizumi T., Miyagishi M., Taira K., Foy E., Loo Y.M., Gale M., Jr., Akira S., Yonehara S., Kato A., Fujita T. (2005) Shared and unique functions of the DExD/H-box helicases RIG-I, MDA5, and LGP2 in antiviral innate immunity. J. Immunol. 175, 2851–2858.
Novick D., Cohen B., Rubinstein M. (1994) The human interferon alpha/beta receptor: characterization and molecular cloning. Cell. 77, 391–400.
Heim M.H. (1999) The Jak-STAT pathway: cytokine signalling from the receptor to the nucleus. J. Receptor Signal Transduct. Res. 19, 75–120.
Fu X.Y., Kessler D.S., Veals S.A., Levy D.E., Darnell J.E., Jr. (1990) ISGF3, the transcriptional activator induced by interferon alpha, consists of multiple interacting polypeptide chains. Proc. Natl. Acad. Sci. USA. 87, 8555–8559.
Kessler D.S., Levy D.E., Darnell J.E., Jr. (1988) Two interferon-induced nuclear factors bind a single promoter element in interferon-stimulated genes. Proc. Natl. Acad. Sci. USA. 85, 8521–8525.
de Veer M.J., Holko M., Frevel M., Walker E., Der S., Paranjape J.M., Silverman R.H., Williams B.R. (2001) Functional classification of interferon-stimulated genes identified using microarrays. J. Leukoc. Biol. 69, 912–920.
Whithead R.H., Nice E.C., Lloyd C.J., James R., Burgess A.W. (1990) Detection of colonic growth factors using a human colonic carcinoma cell line (LIM1215). Int. J. Cancer. 46, 858–863.
Reed L.J., Muench H. (1938) A simple method of estimating fifty per cent endpoints. Am. J. Hygiene. 27, 493–497.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


