Молекулярная биология, 2020, T. 54, № 5, стр. 849-857
Альтернативные варианты фактора транскрипции PAX4 человека: сравнение транскрипционной активности
А. И. Мельникова a, b, Т. С. Краснова a, Н. А. Зубкова c, А. Н. Тюльпаков c, П. М. Рубцов a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Московский физико-технический институт (Национальный исследовательский университет)
141701 Московская область, Долгопрудный, Россия
c Национальный медицинский исследовательский центр эндокринологии Министерства здравоохранения
Российской Федерации
117036 Москва, Россия
* E-mail: rubtsov@eimb.ru
Поступила в редакцию 21.04.2020
После доработки 21.04.2020
Принята к публикации 27.04.2020
Аннотация
Сахарный диабет типа MODY – генетически и клинически гетерогенная группа заболеваний, характеризующихся аутосомно-доминантным типом наследования и обусловленных мутациями, приводящими к дисфункции β-клеток поджелудочной железы. В зависимости от гена, мутации в котором вызывают заболевание, выделяют 13 подтипов MODY. Подтип MODY9 – очень редкая форма, вызываемая мутациями в гене фактора транскрипции PAX4, участвующего в дифференцировке β-клеток поджелудочной железы. PAX4 содержит два ДНК-связывающих домена – парный (Paired) и гомео (Homeo). Экспрессия гена PAX4 отличается тканевой специфичностью. При экспрессии образуются альтернативно сплайсированные варианты мРНК, кодирующие изоформы белка, отличающиеся структурой N- и C-концевой области. В настоящей работе определена транскрипционная активность как известных ранее, так и новых вариантов РАХ4 человека. Установлено, что полная форма PAX4, содержащая интактные ДНК-связывающие домены, проявляет максимальную активность в системе временной экспрессии репортерного гена люциферазы под контролем промотора гена инсулина в клетках HEK293. Выявлено статистически значимое снижение транскрипционной активности вариантов с укороченной на восемь аминокислотных остатков N‑концевой последовательностью и/или с укороченным с С-конца гомеодоменом. Сходные результаты получены при использовании репортерной системы с промотором гена глюкагона человека. Показано также, что аберрантные варианты PAX4 сохраняют стабильность и способность к ядерной локализации.
ВВЕДЕНИЕ
Фактор транскрипции PAX4 играет важную роль в органогенезе поджелудочной железы в ходе эмбрионального развития, в регуляции пролиферации и миграции клеток-предшественников и координации программ их дифференцировки, а также в обеспечении устойчивости инсулинпродуцирующих клеток к стрессовым воздействиям. В линиях α- и β-клеток поджелудочной железы мыши PAX4 связывается с регуляторными элементами в промоторных областях генов основных островковых гормонов: глюкагона [1, 2], грелина [3] и инсулина [4]. Мутации в гене PAX4 человека выявляются у больных одной из форм моногенного диабета MODY (Maturity Onset Diabetes of Young) [5] – MODY9 [6]. В зрелой поджелудочной железе PAX4 участвует в процессах адаптации к неблагоприятным условиям. PAX4 содержит два ДНК-связывающих домена – парный (Paired) и гомео-(Homeo), которые расположены в N-концевой области и в центральной части молекулы соответственно [7]. Важная роль ДНК-связывающих доменов в функционировании PAX4 подтверждается тем, что большая часть миссенс-мутаций, выявленных у больных разными формами диабета, ведет к заменам аминокислот в этих доменах [8–10]. В С‑концевой области расположен трансактиваторный домен, активность которого зависит от типа клеток, в которых экспрессируется белок, и часто ассоциирована с активностью E1A-подобных белков [11]. При экспрессии гена могут синтезироваться альтернативно сплайсированные варианты мРНК, кодирующие изоформы белка, отличающиеся структурой N- и C-концевой области, что может сильно влиять на их взаимодействие с регуляторными областями генов и белками-партнерами. Ранее такие изоформы были идентифицированы в инсулиномах грызунов и человека [12, 13]. Цель настоящей работы состояла в сравнении транскрипционной активности уже известных и новых альтернативных природных изоформ фактора транскрипции PAX4 в трансфицированных клетках НЕК293 человека.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Наборы реагентов. кДНК синтезировали с использованием набора реагентов ImProm II Reverse Transcription System (“Promega”, США). Фрагменты геномной ДНК амплифицировали с помощью ПЦР, используя набор High-fidelity DNA polymerase фирмы “Thermo Fisher Scientific” (США). Фрагменты ДНК для субклонирования получали с помощью ПЦР с реагентами из набора Tersus Plus PCR kit (“Евроген”, Россия).
В работе использовали рестриктазы EcoRI, BglII, SalI, XhoI, BamHI, SmaI, NotI, KpnI, полинуклеотидкиназу фага Т4, щелочную фосфатазу из кишечника теленка (CIAP) и ДНК-лигазу фага Т4 (“Thermo Fisher Scientific”).
Продукты ПЦР клонировали с использованием вектора pGEM-T Easy (“Promega”). Для создания генетических конструкций использовали векторы pcDNA3.1(+) (“Invitrogen”. США), pGL4.10[luc2] (“Promega”), pEGFP-C3 (“Clontech”, США). Для нормирования результатов определения люциферазной активности использовали плазмиду pRL-tk (“Promega”),
Плазмидные ДНК выделяли с помощью наборов Plasmid Miniprep, фрагменты ДНК из агарозных гелей и реакционных смесей – с помощью наборов Cleanup Miniprep (“Евроген”).
Олигонуклеотиды. Для ПЦР-амплификации и секвенирования ДНК использовали олигонуклеотидные праймеры (табл. 1), синтезированные фирмой “Синтол” (Россия).
Секвенирование. Секвенирование нуклеотидных последовательностей проводили в Центре коллективного пользования “Геном” ИМБ РАН на автоматическом секвенаторе ABI PRISM Model 3100 (“Applied Biosystems”, США). Данные обрабатывали с помощью программы Chromas.
Культивирование клеток человека. Клетки линии HEK293 (эпителиоподобные клетки почки эмбриона человека) культивировали в среде DMEM, содержащей 1 г/л глюкозы, L-глутамин, феноловый красный, бикарбонат натрия и пируват натрия, 10%-ную инактивированную (50°С, 30 мин) фетальную сыворотку крупного рогатого скота (FBS) и гентамицин (10 мг/мл). Клетки выращивали в термостате при температуре 37°С в атмосфере с 5% CO2.
Трансфекция клеток. За день до трансфекции клетки высевали на 24-луночный планшет (по 75000 на лунку) в среде без антибиотика. В лунку вносили по 500 нг плазмидной ДНК, кодирующей один из вариантов PAX4, 100 нг плазмиды pGL4 с геном люциферазы светлячка под контролем промотора инсулина или глюкагона человека и 30 нг плазмиды pRL-tk, содержащей репортерный ген люциферазы Renilla под контролем промотора тимидинкиназы вируса простого герпеса (“Promega”). Трансфекцию проводили с помощью реагента TurboFect согласно рекомендациям производителя (“Thermo Scientific”). Клетки выращивали в термостате при 37°С в атмосфере с 5% углекислого газа в течение 48 ч.
Определение активности люциферазы. Через 48 ч после трансфекции из лунок с клетками HEK293 отбирали культуральную среду, промывали 1 мл фосфатно-солевого буфера (PBS), добавляли 100 мкл лизирующего буфера (Passive Lysis buffer, “Promega”) и инкубировали в течение 10 мин при комнатной температуре. Затем лизаты собирали в 1.5 мл пробирки и центрифугировали при 13 200 об./мин в течение 1 мин при комнатной температуре. Далее вносили по 60 мкл лизата в лунку 96-луночного планшета. К образцам добавляли по 40 мкл субстрата люциферазы светлячка из набора Dual-Glo Luciferase Assay System (“Promega”), инкубировали в течение 10 мин при комнатной температуре и измеряли люминесценцию на ридере Chameleon VI Multilabel detection platform (HIDEX). Затем в лунки добавляли 40 мкл раствора Dual-Glo® Stop & Glo® Substrate в буфере Dual-Glo® Stop & Glo® Buffer, инкубировали в течение 10 мин при комнатной температуре и измеряли люминесценцию люциферазы Renilla. Полученные значения активности люциферазы светлячка нормировали по активности люциферазы Renilla, чтобы учесть различия в эффективности трансфекции и обработки проб.
Иммуноблотинг. Через 48 ч после трансфекции клеток HEK293 плазмидами, кодирующими слитые белки EGFP-PAX4, (1 мкг на лунку 24-луночного планшета), отбирали культуральную среду, промывали ячейки 1 мл PBS, добавляли 100 мкл лизирующего буфера (1 М Tрис-HCl pH 8.0, 5 M NaCl, 1% Тритона Х100, 100× PMSF, ингибитор протеазы) и инкубировали в течение 10 мин при температуре 4°C. Лизаты переносили в 1.5 мл пробирки, инкубировали в течение 30 мин на льду при постоянном покачивании и центрифугировали (12000 g, 10 мин) при 4°С. Концентрацию белка в супернатантах измеряли методом Бредфорда.
Для разделения белков в полиакриламидном геле к аликвотам лизатов, содержащим 20 мг белка, добавляли 5× раствор для нанесения на гель (312 мМ Трис-HCl pH 6.8, 50%-ный глицерин, 25%-ный β-меркаптоэтанол, 10%-ный SDS, 0.01%-ный бромфеноловый синий). Образцы кипятили в течение 5 мин и наносили на полиакриламидный гель (5%-ный концентрирующий гель, 12%-ный разделяющий гель). Электрофорез проводили в буфере 25 мМ Трис pH 8.3, 192 мМ глицин, 1%-ный SDS при токе 20 мА, 140 В, 3 Вт. После электрофореза гель помещали на 15 мин в буфер для переноса (25 мМ Трис pH 8.3, 192 мМ глицин, 20%-ный этанол). Нитроцеллюлозную мембрану несколько минут вымачивали в том же буфере. Перенос белков проводили в течение 1 ч при 50 В, 130 мА, 8 Вт. Далее мембрану блокировали в буфере TBST (140 мМ NaCl, 1 M Трис-HCl pH 7.5, 0.1% Tween 20, 10% сухого обезжиренного молока) и оставляли на ночь при температуре 4°С. Затем мембрану отмывали в TBST и инкубировали при перемешивании и комнатной температуре в течение 1 ч с первичными антителами против зеленого флуоресцирующего белка (GFP, “Sigma”, CША), разведенными в TBST с блокирующим агентом. Далее мембрану отмывали в 75 мл TBST и добавляли коньюгат вторичных антител (anti-IgG кролика) с пероксидазой хрена (“GE-Health Care”, США), разведенных в TBST с блокирующим агентом. Затем мембрану снова отмывали в TBST и обрабатывали реагентом SuperSignal™ West Femto Maximum Sensitivity Substrate (“Thermo Fisher Scientific”). Полосы белков, взаимодействующих с антителами, визуализировали, используя прибор Chemidoc MP (“Bio-Rad.com”, США)
Статистическая обработка данных. Статистическую обработку данных проводили с использованием однофакторного теста ANOVA и программы GraphPad Prism6.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Клонирование кДНК, кодирующих альтернативные варианты PAX4 человека, и конструирование векторов для их экспрессии в клетках человека
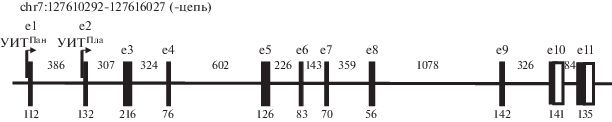
Упрощенная схема организации гена PAX4 человека, локализованного в хромосоме 7 (https:// www.ucsc.edu/), показана на рис. 1. Ген состоит из 11 экзонов и 10 интронов, занимает участок chr7:127610292-127616027 и имеет ограниченную клеточную и тканевую специфичность экспрессии. мРНК PAX4 присутствует в дифференцирующихся и зрелых β-клетках поджелудочной железы, а также в клетках плаценты [14], кишечника и некоторых других тканей [15]. Ген РАХ4 содержит по меньшей мере два промотора, расположенных перед первым и вторым кодирующими экзонами, с которых инициируется транскрипция в β-клетках и плаценте соответственно (рис. 1).
Рис. 1.
Схема экзон-интронной структуры гена PAX4 человека (https://genome.ucsc.edu/). Экзоны изображены прямоугольниками. Размеры экзонов (п.н.) показаны снизу, а размеры интронов сверху. УИТПан, УИТПла – участки инициации транскрипции с панкреатического и плацентарного промоторов.
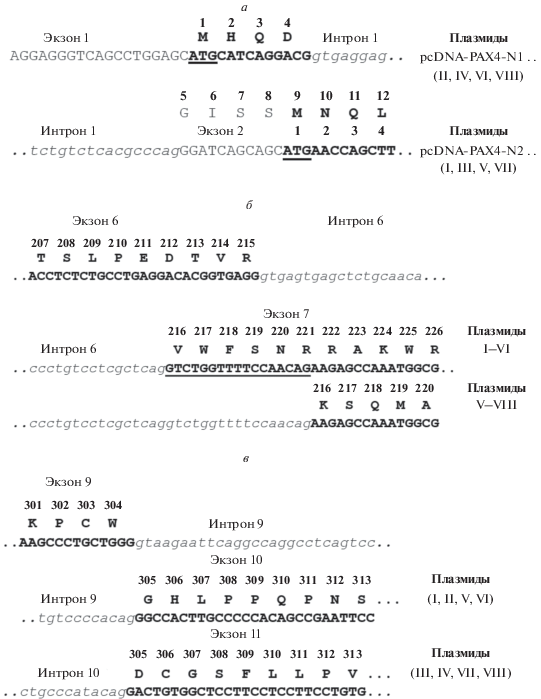
Исходные варианты кДНК PAX4 получили путем обратной транскрипции на суммарной РНК из плаценты человека и ПЦР-амплификации с использованием праймеров PAX4-2f и PAX4-10r. Продукты ПЦР клонировали с использованием вектора pGEM-T-Easy. При секвенировании индивидуальных клонов идентифицировали варианты кДНК, соответствующие изоформам альтернативных вариантов PAX4, отличающихся наличием длинной (70 п.н.) или короткой (53 п.н.) формы экзона 7 и строением С-концевой области. Следующим этапом была реконструкция полных кодирующих последовательностей известных вариантов PAX4, представленных в NCBI Genome Bank (NM_001366110 и NM_001366111). С этой целью у всех полученных вариантов с использованием праймера PAX4-5′ была достроена N-концевая последовательность, кодируемая экзоном 1. Кроме того, с использованием праймеров PAX4e10-f и PAX4e11-r был амплифицирован фрагмент, соответствующий С-концевой части экзона 11. Все различия в структуре реконструированных кодирующих последовательностей вариантов PAX4, исследованных в настоящей работе, суммированы на рис. 2. На следующем этапе на основе вектора pcDNA3.1(+) сконструировали плазмиды, предназначенные для экспрессии вариантов PAX4 в клетках человека. В результате получили восемь рекомбинантных плазмид (I–VIII), обеспечивающих конститутивную экспрессию вариантов PAX4 в клетках человека под контролем промотора цитомегаловируса (CMV). В табл. 2 и на рис. 2 приведены особенности структуры этих плазмид.
Рис. 2.
Различия в первичных структурах альтернативных вариантов PAX4. Нуклеотидные последовательности экзонов показаны прописными буквами, интронов – курсивом. a – N-концевые области вариантов PAX4, кодируемые экзонами 1 и 2. Инициирующие ATG-кодоны подчеркнуты. б – Различия в структуре области, кодируемой полным и укороченным вариантом экзона 7. в – Различия в структуре С-концевых областей, кодируемых экзонами 10 и 11.
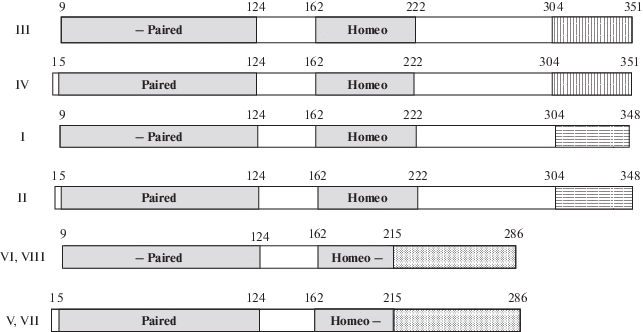
На рис. 3 схематически изображены альтернативные варианты PАХ4, кодируемые полученными плазмидами. Плазмида II кодирует известный вариант PAX4 (NM_001366111), который состоит из 348 аминокислотных остатков и содержит интактные домены Paired (аминокислоты 5–124) и Homeo (аминокислоты 162–222), a плазмида I – это отличающийся от него отсутствием восьми N-концевых остатков вариант с укороченным Paired-доменом (рис. 2а, рис. 3). Плазмида IV кодирует еще один описанный ранее вариант PAX4 (NM_001366110). Он содержит 351 аминокислотный остаток и отличается от продукта плазмиды I структурой С-концевой области, вследствие альтернативного сплайсинга (включения в зрелую мРНК экзона 11 вместо экзона 10) (рис. 2в, рис. 3). Вариант, кодируемый плазмидой III, как и продукт плазмиды I, укорочен с N-конца. Наконец, нуклеотидные последовательности в плазмидах V–VIII характеризуются делецией 17 н. экзона 7 (рис. 2б). Эта делеция образуется вследствие использования альтернативного акцепторного сайта сплайсинга в экзоне 7 и ведет к сдвигу рамки считывания. В результате белковые продукты экспрессии имеют меньшую длину (278 или 286 аминокислот) и отличаются от продуктов плазмид I–IV наличием Homeo-домена, укороченного на семь аминокислотных остатков с С-конца, за которым следует “бессмысленная” последовательность.
Рис. 3.
Схематическое изображение доменной структуры альтернативных вариантов PAX4. Затенены интактные (Paired, Homeo) и укороченные (-Paired, Homeo-) ДНК-связывающие домены. Различающиеся у разных вариантов С-концевые области выделены разной штриховкой. Римские цифры слева обозначают плазмиды, кодирующие соответствующие варианты PAX4 (табл. 2).
Клонирование промоторных фрагментов генов инсулина и глюкагона человека и конструирование репортерных плазмид
Для сравнительного анализа транскрипционной активности вариантов PAX4 сконструировали репортерные плазмиды с геном люциферазы светлячка под контролем промоторов генов инсулина и глюкагона человека. PAX4, как установлено [16], связывается с последовательностью 5'‑gccagacctgtccctgctcacagct-3' в промоторе гена инсулина. Промоторный фрагмент гена инсулина амплифицировали с использованием праймеров InsPr-f1 и InsPr-r (табл. 1), и получили фрагмент размером 518 п.н. (chr11:2161063-2161580), который содержит сайт связывания PAX4. Промоторный фрагмент гена глюкагона амплифицировали с праймерами GCG-Pr-Kp-f и GCG-Pr-Bg-r (табл. 1) и получили фрагмент размером 1726 п.н. (chr2:162152135-162153860). Фрагменты промоторных областей клонировали в векторе pGEM-T-Easy. После подтверждения нуклеотидных последовательностей их встроили в вектор pGL4.10[luc2] перед геном люциферазы светлячка.
Таблица 1.
Олигонуклеотиды, использованные в работе
| Название | Нуклеотидная последовательность, 5' → 3' | Длина, н. |
|---|---|---|
| PAX4-2f | cagggatcagcagcatgaac# | 20 |
| PAX4-10r | acacaggagggagcaatcac | 20 |
| PAX4-5' | tggagcatgcatcaggacgggatcagcagcatgaaccag# | 39 |
| PAX4e10-f | cctgtgattgctccctcctgtgt | 23 |
| PAX4e11-r | cttttattactgctgagtggagg | 23 |
| PAX4-Bg-f | agatctctcgagcagcatgaaccagc#, * | 26 |
| PAX4-Sa-r | ctgcagtcgaccctgcctcattccaag* | 27 |
| InsPr-f1 | tctggggacagcagcgcaaa | 20 |
| InsPr-r | tgcttcacgagcccagccac | 20 |
| GCG-Pr-Kp-f | cacggtacctctagaccgacctaaggctt* | 29 |
| GCG-Pr-Bg-r | gatagatcttacaattttataatcatcttaccttc* | 35 |
Таблица 2.
Особенности структуры плазмид для экспрессии вариантов PAX4
| Вектор экспрессии | Начало кодирующей области PAX4 | Экзон 7, вариант, длина п.н. | Конец кодирующей области PAX4 | Кодируемый белок. Длина (а.о.)/ мол. масса (кДа) | NCBI Acc. no |
|---|---|---|---|---|---|
| pcDNA-PAX4-N2-10 (I) | Экзон 2 | 70 | Экзон 10 | 340/36.70 | |
| pcDNA-PAX4-N1-10 (II) | Экзон 1 | 70 | Экзон 10 | 348/37.56 | NM_001366111 |
| pcDNA-PAX4-N2-11 (III) | Экзон 2 | 70 | Экзон 11 | 343/37.07 | |
| pcDNA-PAX4-N1-11 (IV) | Экзон 1 | 70 | Экзон 11 | 351/37.92 | NM_001366110 |
| pcDNA-PAX4-N2-d7-10 (V) | Экзон 2 | 53 | Экзон 10 | 278/29.65 | |
| pcDNA-PAX4-N1-d7-10 (VI) | Экзон 1 | 53 | Экзон 10 | 286/30.50 | |
| pcDNA-PAX4-N2-d7-11 (VII) | Экзон 2 | 53 | Экзон 11 | 278/29.65 | |
| pcDNA-PAX4-N1-d7-11 (VIII) | Экзон 1 | 53 | Экзон 11 | 286/30.50 |
Определение транскрипционной активности альтернативных вариантов PAX4 в трансфицированных клетках HEK293 человека
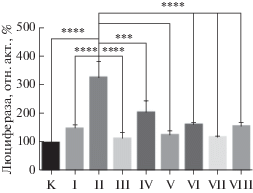
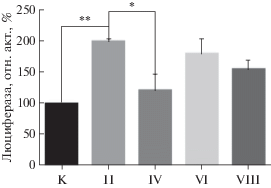
Трансактиваторную активность вариантов PAX4 по отношению к промотору гена инсулина человека определяли в системе временной экспрессии после трансфекции клеток HEK293 человека. Результаты представлены на рис. 4. Как видно из рис. 4, максимальную трансактиваторную активность проявляет канонический вариант PAX4, кодируемый плазмидой II (NM_001366111) и содержащий интактные ДНК-связывающие домены Paired и Homeo. Уровень люциферазной активности в клетках, трансфицированных этой плазмидой, превышает активность в клетках, трансфицированных исходным вектором pcDNA3.1(+), более чем в 3 раза. Трансактиваторная активность другого описанного ранее варианта (NM_001366110), кодируемого плазмидой IV, у которого вследствие альтернативного сплайсинга сильно изменена С-концевая область, снижена почти в 1.5 раза. Варианты с усеченными с N-конца Paired-доменами (продукты экспрессии плазмид I и III) примерно в 2 раза менее активны, чем их аналоги с полными Paired-доменами. Наконец, короткие варианты PAX4 (продукты экспрессии с плазмид V–VIII) в использованной системе детекции практически неактивны. Это связано с тем, что у них сильно перестроены С-концевые области и, вероятно, утрачены последовательности предполагаемого трансактиваторного домена [7].
Рис. 4.
Сравнительная трансактиваторная активность альтернативных изоформ фактора транскрипции PAX4 человека по отношению к промотору гена инсулина человека. Клетки HEK293 трансфицировали плазмидами pcDNA3.1(+) (K) или плазмидами I–VIII, кодирующими разные изоформы белка PAX4 человека (табл. 2), совместно с плазмидой, содержащей ген люциферазы светлячка под контролем промотора гена инсулина человека, и плазмидой pRL-tk, содержащей ген люциферазы Renilla под контролем промотора гена тимидинкиназы вируса простого герпеса. Результаты определения активности люциферазы светлячка нормированы по активности люциферазы Renilla. Представлены средние значения ± стандартные отклонения трех независимых опытов (***P < 0.001, ****P < 0.0001).
Сходные закономерности обнаружены и с использованием репортерной системы на основе промотора гена глюкагона человека (pис. 5). Кодируемый плазмидой II вариант PAX4, содержащий интактные ДНК-связывающие домены, имеет максимальную активность по отношению к промотору гена глюкагона. Альтернативный вариант, отличающийся от него структурой C-концевой области, почти в 2 раза менее активен, как и варианты с укороченным c C-конца гомеодоменом (pис. 5).
Рис. 5.
Трансактиваторная активность альтернативных изоформ фактора транскрипции PAX4 человека по отношению к промотору гена глюкагона. Клетки HEK293 трансфицировали плазмидами pcDNA3.1(+) (K) или плазмидами II, IV, VI, VIII, кодирующими разные изоформы белка PAX4 человека (табл. 2), совместно с плазмидой, содержащей ген люциферазы светлячка под контролем промотора гена глюкагона человека, и плазмидой pRL-tk, содержащей ген люциферазы Renilla под контролем промотора гена тимидинкиназы вируса простого герпеса. Приведены результаты определения активности люциферазы светлячка, нормированные по активности люциферазы Renilla. Представлены средние значения ± стандартные отклонения трех независимых опытов (*P < 0.05, **P < 0.01).
Локализация альтернативных вариантов PAX4 в трансфицированных клетках HEK 293
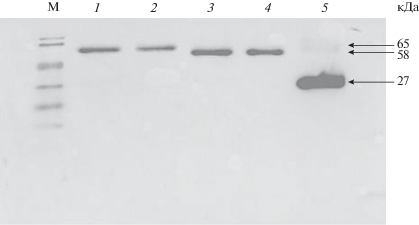
Причиной низкой активности альтернативных вариантов PAX4 может быть нарушение стабильности аберрантных белков или изменение их локализации в клетке. Для проверки этих возможностей мы сконструировали плазмиды, экспрессирующие слитые белки на основе зеленого флуоресцирующего белка EGFP. Фрагменты ДНК, кодирующие варианты PAX4, амплифицировали на плазмидах I–VIII, используя праймеры PAX4-Bg-f и PAX4-Sa-r (табл. 1), и клонировали в векторе pEGFP-C3 с образованием слитых генов EGFP-PAX4. Сохранение рамки считывания подтвердили секвенированием. После трансфекции полученными плазмидами клеток HEK293 получали лизаты клеток и анализировали продукцию слитых белков с помощью иммуноблотинга с антителами против GFP. На рис. 6 приведены результаты иммуноблотинга. В лизатах клеток, трансфицированных плазмидами pEGFP-PAX4-N1-10 и pEGFP-PAX4-N1-11, антитела против GFP детектируют белки с мол. массой примерно 65 кДа, что соответствует ожидаемой мол. массе соответствующих слитых белков. Плазмиды pEGFP-PAX4-N1-d7-10 и pEGFP-PAX4-N1-d7-11, как и можно было ожидать, направляют синтез более коротких, содержащих EGFP, белков с мол. массой примерно 58 кДа. На иммуноблоте отсутствуют более короткие реагирующие с антителами продукты, что указывает на стабильность синтезируемых белков. Наличие и локализацию белков в клетках, трансфицированных этими плазмидами, анализировали также с помощью флуоресцентной микроскопии. Во всех случаях выявлена флуоресценция в ядрах клеток (результаты не показаны). Таким образом, изученные нами варианты PAX4 не различаются по стабильности и внутриклеточной локализации.
Рис. 6.
Иммуноблотинг слитых белков EGFP-PAX4, синтезируемых в клетках HEK293. М – маркеры мол. массы. 1–4 – Лизаты клеток, трансфицированных плазмидами pEGFP-PAX4-N1-10, pEGFP-PAX4-N1-11, pEGFP-PAX4-N1-d7-10 и pEGFP-PAX4-N1-d7-11 соответственно; 5 – лизат клеток, трансфицированных контрольной плазмидой pEGFP-С3.
Суммируя полученные данные, можно заключить, что изоформы фактора транскрипции PAX4 человека с интактными ДНК-связывающими доменами действуют как активаторы транскрипции в системе котрансфекции клеток HEK293 плазмидами на основе промоторов генов инсулина и глюкагона человека. Трансактиваторная активность альтернативных вариантов PAX4 c усеченным с N-конца доменом Paired или укороченным с С-конца доменом Homeo статистически значимо снижена. Новые варианты PAX4 с полностью измененной С-концевой областью, образующиеся в результате исключения из зрелой мРНК части экзона 7, практически лишены активности на промоторе гена инсулина, что может быть связано с отсутствием трансактиваторного домена. Эти варианты PAX4 могут проявлять доминантно-негативное действие, подобно описанным ранее формам, идентифицированным в клетках инсулином [12, 13].
В последние годы повышается интерес к PAX4, как к фактору выживания β-клеток. Известно, что сверхэкспрессия PAX4 в клеточной линии инсулиномы, а также в изолированных островках Лангерганса крыс повышает экспрессию антиапоптотического фактора Bcl-xL [17]. Подавление РAX4 снижает уровень экспрессии Bcl-xL, что коррелирует с развитием спонтанного апоптоза и повышением чувствительности к индуцируемому цитокинами апоптозу. Обработка клеток инсулиномы мыши рекомбинантным белком PAX4 защищает их от апоптоза, индуцированного фактором некроза опухоли TNF-α, и сопровождается увеличением экспрессии Bcl-xL [18]. Сверхэкспрессия мутантного варианта PAX4 не повышает уровень экспрессии Bcl-2 и не защищает островковые β-клетки мыши от апоптоза, вызванного цитокинами, а сверхэкспрессия PAX4 дикого типа в β-клетках зрелых панкреатических островков мыши предотвращает индуцируемую стрессом гипергликемию [19]. Показано также, что PAX4 может участвовать в компенсаторном ответе β-клеток на метаболический стресс [20]. В связи с этим обсуждаются возможности терапевтического воздействия на пути, регулируемые при участии PAX4, при диабете [21]. В исследованиях механизмов этих процессов следует учитывать возможную гетерогенность синтезируемых в клетках вариантов PAX4, в том числе появление альтернативных вариантов с негативно-доминантным действием.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (№ 17-29-06028 и № 18-04-01271).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Petersen H.V., Jørgensen M.C., Andersen F.G., Jensen J., F-Nielsen T., Jørgensen R., Madsen O.D., Serup P. (2000) Pax4 represses pancreatic glucagon gene expression. Mol. Cell Biol. Res. Commun. 3, 249–254.
Estreicher A., Gauthier B.R., Mamin A., Edlund H., Philippe J. (2002) The pancreatic beta-cell-specific transcription factor Pax4 inhibits glucagon gene expression through Pax 6. Diabetologia. 45, 97–107.
Wang Q., Elghazi L., Martin S., Martins I., Srinivasan R.S., Geng X., Sleeman M., Houghton J.,Sosa-Pineda B. (2008) Ghrelin is a novel target of Pax4 in endocrine progenitors of the pancreas and duodenum. Dev. Dyn. 237, 51–61.
Campbell S.C., Cragg H., Elrick L.J., Macfarlane W.M., Shennan K.I.J., Docherty K. (1999) Inhibitory effect of Pax4 on the human insulin and islet amyloid polypeptide (IAPP) promoters. FEBS Lett. 463, 53–57.
Vaxillaire M., Froguel P. (2008) Monogenic diabetes in the young, pharmacogenetics and relevance to multifactorial form of type 2 diabetes. Endocr. Rev. 29, 254–264.
Biason-Lauber A., Boehm B., Lang-Muritano M., Gauthier B.R., Brun T., Wollheim C.B., Schoenle E.J. (2005) Association of childhood type 1 diabetes mellitus with a variant of PAX4: Possible link to beta cell regenerative capacity. Diabetologia. 48, 900–905.
Smith S.B., Ee H.C., Conners J.R., German M.S. (1999) Paired-homeodomain transcriptional repressor in early pancreatic development. Mol. Cell. Biol. 8, 8272–8280.
Plengvidhya N., Kooptiwut S., Songtawee N., Doi A., Furuta H., Nishi M., Banchuin N. (2017) PAX4 mutations in thais with maturity onset diabetes of the young. J. Clin. Endocrinol. Metab. 92, 2821–2826.
Martin-Montalvo A., Lorenzo P.I., Lopez-Noriega L., Gauthier B.R. (2016) Targeting pancreatic expressed PAX genes for the treatment of diabetes mellitus and pancreatic neuroendocrine tumors. Expert. Opin. Ther. Targets. 21, 77–89.
Sujjitjoon J., Kooptiwut S., Chongjaroen N., Tangjittipokin W., Plengvidhya N., Yenchitsomanus P.T. (2016) Aberrant mRNA splicing of paired box 4 (PAX4) IVS7–1G> A mutation causing maturity-onset diabetes of the young, type 9. Acta Diabetol. 53, 205–216.
Fujitani Y., Kajimoto Y., Yasuda T., Matsuoka T.A., Kaneto H., Umayahara Y., Fujita N., Watada H., Miyazaki J.I., Yamasaki Y., Hori M. (1999) Identification of a portable repression domain and an E1A-responsive activation domain in Pax4: A possible role of Pax4 as a transcriptional repressor in the pancreas. Mol. Cell.Biol. 19, 8281–8291.
Tokuyama Y., Yagui K., Sakurai K., Hashimoto N., Saito Y., Kanatsuka A. (1998) Molecular cloning of rat Pax4: identification of four isoforms in rat insulinoma cells. Biochem. Biophys. Res. Commun. 248, 153–156.
Miyamoto T., Kakizawa T., Ichikawa K., Nishio S., Kajikawa S., Hashizume K. (2001) Expression of dominant negative form of PAX4 in human insulinoma. Biochem. Biophys. Res. Commun. 282, 34–40.
Lorenzo P.I., Ju F., Cobo-Vuilleumier N., Garc M., Gauthier B.R. (2017) The diabetes-linked transcription factor PAX4 : from gene to functional consequences. Genes. 8, 101. https://doi.org/10.3390/genes8030101
https://www.proteinatlas.org/
Brink C., Chowdhury K., Gruss P. (2001) Pax4 regulatory elements mediate beta cell specific expression in the pancreas. Mech. Devel. 100, 37–43.
Brun T., Duhamel D.L., He K.H.H., Wollheim C.B., Gauthier B.R. (2007) The transcription factor PAX4 acts as a survival gene in INS-1E insulinoma cells. Oncogene. 26, 4261–4271.
Lu J., Li G., Lan M. S., Zhang S., Fan W., Wang H., Lu D. (2007) Pax4 paired domain mediates direct protein transduction into mammalian cells. Endocrinology. 148, 5558–5565.
Hui K., He H., Lorenzo P.I., Brun T., Moreno C.M.J., Aeberhard D., Gauthier B.R. (2011) In vivo conditional Pax4 overexpression in mature islet β-cells prevents stress-induced hyperglycemia in mice. Diabetes. 60, 1705–1715.
Lee G., Jang H., Kim Y.Y., Choe S.S., Kong J., Hwang I., Park J., Im S.-S., Kim J.B. (2019) SREBP1c-PAX4 axis mediates pancreatic β-cell compensatory responses upon metabolic stress. Diabetes. 68, 81–94.
Lorenzo P.I., Cobo-Vuilleumier N., Gauthier B.R. (2018) Therapeutic potential of pancreatic PAX4-regulated pathways in treating diabetes mellitus. Curr. Opin. Pharmacol. 43, 1–10.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


