Молекулярная биология, 2020, T. 54, № 5, стр. 813-825
CbCYP716A261 ‒ новая β-амирин-28-гидроксилаза, вовлеченная в биосинтез конизасапонинов в Conyza blinii
R. Sun a, b, J. L. Gao b, H. Chen a, *, S. Liu b, Z. Z. Tang a
a College of Life Science, Sichuan Agricultural University
625014 Sichuan, Ya’an, China
b College of Biological and Chemical Engineering, Panzhihua University
617000 Sichuan, Panzhihua, China
* E-mail: chenhui@163.com
Поступила в редакцию 08.02.2020
После доработки 08.02.2020
Принята к публикации 13.03.2020
Аннотация
Конизасапонины, продуцируемые лекарственным растением Conyza blinii, используемым в традиционной китайской медицине, относятся к сапонинам олеананового типа с широким спектром биологической активности. Из последовательностей транскриптов Conyza blinii были отобраны 10 предполагаемых полноразмерных последовательностей генов цитохромов P450 (CYP). Продукт гена CbCYP716A261 идентифицировали как предполагаемую β-амирин-28-гидроксилазу, исходя из результатов филогенетического анализа и исследования транскрипционной активности в листьях растения Conyza blini, обработанного метилжасмонатом. Исследование ферментативной активности продукта гена CbCYP716A261 проведено в системах in vitro и in vivo. Результаты ВЭЖХ подтвердили, что белок CbCYP716A261 катализирует гидроксилирование β-амирина по атому углерода C-28 с образованием олеаноловой кислоты. Таким образом, идентифицирован ген CbCYP716A261, кодирующий β-амирин-28-гидроксилазу при биосинтезе конизасапонинов в растении Conyza blinii. В рамках проведенного исследования получена новая информация о пути биосинтеза конизасапонинов и расширен список известных β-амирин-28-гидроксилаз.
ВВЕДЕНИЕ
Сапонины представляют собой группу гликозидных соединений растений. В зависимости от сапогенина сапонины делятся на стероидные и тритерпеновые. Стероидные сапонины в основном представлены в семействах Scrophulariaceae, Dioscoreaceae, Liliaceae и др. Тритерпеновые сапонины можно найти у представителей семейств Leguminosae, Araliaceae, Polygalaceae, Compositae и др. У разных видов растений сапонины отличаются по структуре и спектру биологической активности [1, 2]. Сапонины состоят из 30 атомов углерода, сгруппированных в кольца по 4‒5 атомов и обрамленных функциональными группами, от которых зависит разнообразие структур. Разнообразная биологическая активность сапонинов включает в себя антибактериальную, противоопухолевую, инсектицидную, моллюскоцидную и антифидантную; кроме того, они проявляют иммуностимулирующие и гепатопротекторные свойства [3‒5]. Таким образом, сапонины представляют коммерческую ценность и используются в фармацевтике [6‒8].
Растение Conyza blinii используется в традиционной китайской медицине, как самостоятельно, так и в комбинации с другими ингредиентами, для лечения бронхита и других воспалительных состояний [9]. Конизасапонины, принадлежащие к классу тритерпеновых сапонинов, представляют собой основной фармакологически активный компонент растения и составляют около 3% сухого веса всего растения [10‒12]. К настоящему времени все 17 конизасапонинов, выделенных из спиртовых экстрактов C. blinii, относятся к олеанановым пентациклическим тритерпенам [13‒15].
Первый этап в биосинтезе тритерпеновых сапонинов ‒ это циклизация 2,3-оксидосквалена, которую катализируют оксидоскваленциклазы, приводящая к образованию множества типов углеродных скелетов, включая олеанановый, лупановый, урсановый и даммарановый. Из них всех β-амиринсинтаза (βAS) контролирует формирование производных олеанана. Олеанановый углеродный скелет модифицируется с образованием конизасапонина в основном путем гидроксилирования цитохром P450-зависимыми (CYP) монооксигеназами и гликозилирования гликозил-трансферазами [1] (рис. 1).
Рис. 1.
Предполагаемый путь биосинтеза конизасапонинов в Conyza blinii. Скваленэпоксидаза превращает сквален в 2,3-оксидосквален. Затем β-амиринсинтаза циклизует предшественник 2,3-оксидосквален с образованием скелета конизасапонина (β-амирин). β-амирин последовательно претерпевает окисление с образованием олеаноловой кислоты. На последних стадиях олеаноловая кислота превращается в конизосапонины путем окисления и гликозилирования.

Как гены CYP, так и гликозилтрансфераз обнаружены в геномах суперсемейств растений, при этом первые вносят модификации перед гликозилированием [16]. К настоящему времени идентифицированы тритерпенмодифицирующие CYP, которые могут использовать в качестве субстрата β-амирин, α-амирин, лупеол и даммарандиол-II. Seki и соавт. [17] и Sudo и др. [18] идентифицировали цитохром CYP88D6 как β-амирин-11-оксидазу, вовлеченную в биосинтез глицирризина в Glycyrrhiza uralensis. Цитохромы CYP93E1, CYP93E2 и CYP93E3 проявляют β-амирин-24-гидроксилазную активность соответственно в сое [19], Medicago truncatula [20] и G. uralensis [17]. Carelli и соавт. [21] охарактеризовали цитохром CYP716A12 как многофункциональный фермент, проявляющий активность в качестве β-амирин-28-гидроксилазы, α-амирин-28-гидроксилазы и лупеол-28-гидроксилазы. Идентифицированы цитохромы CYP716A53v2 [22] и CYP716A47 [23] из Panax ginseng, способные окислять остов даммарандиола-II по атомам углерода С-6 и С-12 соответственно. Обнаружена лупеол-20-гидроксилаза из Lotus japonicus [24]. Но до сих пор не охарактеризованы CYPs, участвующие в биосинтезе конизасапонинов в C. blinii.
По результатам биоинформатического анализа транскриптов C. blinii и транскрипционных активности в клетках C. blinii, обработанных метилжасмонатом, ген CbCYP716A261 C. blinii был исследован как возможный ген CYP, участвующего в биосинтезе конизасапонинов. Эктопическая экспрессия CbCYP716A261 и коэкспрессия CbβAS и CbCYP716A261 в дрожжах в обоих случаях приводила к образованию олеаноловой кислоты. Эти результаты подтверждают, что CbCYP716A261 кодирует β-амирин-28-гидроксилазу.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растительный материал и реактивы. Растения Conyza blinii выращены в лаборатории. Суммарную РНК выделяли из листьев с использованием набора TaKaRa MiniBEST Plant RNA extraction kit (“TaKaRa Bio”, Япония) согласно инструкции производителя. Одноцепочечную кДНК синтезировали, используя набор PrimeScript 1st Strand cDNA synthesis kit (“TaKaRa Bio”). Обработку растений C. blinii метилжасмонатом проводили, как описано ранее [25].
В качестве штамма для клонирования использовали Escherichia coli DH5α (лабораторный штамм), в качестве вектора для клонирования использовали pMD19-T Simple (“TaKaRa Bio”). Штамм Saccharomyces cerevisiae INVSc1 (предоставлен Meng-gen Ma, Sichuan Agricultural University, Китай) использовали в качестве экспрессионного штамма в паре с экспрессионным вектором pESC-URA (“Agilent Technologies”, США) для одновременного синтеза двух генов. β-Амирин и олеаноловая кислота ‒ производства “Sigma-Aldrich” (США), NADPH ‒ производства “Roche” (Швейцария).
Филогенетический анализ. Поиск кандидатных генов CYP проводили на основании текстового поиска названий генов и функциональных аннотаций уникальных аннотированных генов в библиотеке аннотаций транскриптома C. blinii [26]. Повторяющиеся записи из разных баз данных удаляли вручную. Для анализа филогенетического родства кандидатных CYPs соответствующие аминокислотные последовательности брали из базы данных NCBI. Для множественного выравнивания последовательностей использовали программу CLUSTALW (http://clustalw.ddbj.nig.ac.jp). Филогенетическое древо построено в программе MEGA 5.05 с использованием метода объединения ближайших соседей и бутстреп-индекса в 1000 репликаций [27].
Количественная ПЦР в реальном времени. Анализ транскрипции генов обработанного метилжасмонатом растения C. blinii проводили, как ранее описано Sun и др. [25]. В качестве внутреннего контроля использовали ген глицеральдегид-3-фосфатдегидрогеназы (GAPDH) C. blinii (GenBank No: KF027475). Последовательности праймеров приведены в табл. 1.
Таблица 1.
Праймеры, использованные в работе
| Праймер | Последовательность (5' → 3') | Праймер | Последовательность (5'→3') |
|---|---|---|---|
| Праймеры для количественной ПЦР в реальном времени | |||
| GAPDHqF | CGGGATGGCTTTCCGTGTA | GAPDHqR | TTGCCTTCTGATTCCTCCTTGA |
| HMGRqF | TCCCGCCCAGAATGTTGAG | HMGRqR | TGCTTGCACCTTTGACACCTAA |
| FPPSqF | CAAGGTTGGTATGATTGCTGCA | FPPSqR | TGAACAGGTCCACTAAATCCA |
| SQSqF | GTTGCGGGACTTGTTGGATTA | SQSqR | AACATGCGTGACTTGGGTATCT |
| SQEqF | TCAGGACGATGCCCAATAGAA | SQEqR | ACAGTCATTCCTCCACCAGTCAG |
| βASqF | TTGGCAGTCAAGAGTGGGATG | βASqR | GGAAGGATTGTCTTTGACCTGTGA |
| CYP13793qF | GAGCAGGTTGGGATGGAGTTC | CYP13793qR | GCAGGACCACAAAGCACAGC |
| CYP81240qF | TCTTGGATTGTTGATTGGTGGC | CYP81240qR | GACAAATCCTCCCAGTTCAGCA |
| Праймеры для клонирования | |||
| CYP716A261F | ATGGATATGTTTTATGTTTATCTC | CYP716A261R | TCACTTGCTAGAGACATGATGAG |
| Праймеры для эксперимента по определению ферментативной активности in vitro | |||
| CPRseF | GCGGCCGCAATGCAATCAAACTCAATAAAA | CPRseR | AGATCTTTACCAAACATCGCGAAGATA |
| CYP716A261eF | GTCGACATGGATATGTTTTATGTTTATCTC | CYP716A261eR | GGTACCTCACTTGCTAGAGACATGATGAG |
| Праймеры для эксперимента по коэкспрессии | |||
| βASVaZF | AACCCTCACTAAAGGgcggccgcAATGTGGAG AATGAATATAGCAAAAGG | βASVaZR | GTTAATTAAGAGCTCagatctCTAGATGCGTTTG AGCTTTGGC |
| βCPa | ATTTCCGAAGAAGACctcgagATGCAATCAAA CTCAATAAAAATATCG | βCPb | GAAATTAGGCTCCATACCACCGGAGCCACC GAGCCACCGCTCCAAACATCGCGAAG |
| βCPc | CTTCGCGATGTTTGGAGCGGTGGCTCTGGT GGCTCCGGTGGTATGGAGCCTAATTTC | βCPd | ATCTTAGCTAGCCGCggatccTTAAGCTTTGTGT GGATAAAGGCGAA |
Клонирование гена и биоинформационный анализ. Для выбранной последовательности подбирали специфичные праймеры (табл. 1). Для амплификации полноразмерной последовательности с кДНК использовали PrimeSTAR Max DNA Polymerase (“TaKaRa Bio”). После секвенирования молекулярные характеристики последовательности анализировали при помощи инструментов биоинформатики на сайте NCBI и с использованием программ DNAMAN, ProtParam, TMHMM и SOPMA.
Экспрессия гена CbCYP716A261 в дрожжах и анализ ферментативной активности in vitro. Каталитическая реакции с участием CYP требует участия NADPH-CYP-редуктазы (CPR) для обеспечения реакции электронами. Таким образом, для проверки активности фермента CbCYP716A261 необходимо было использовать редуктазу. Кодирующий фрагмент CPR C. blinii (CbCPR) амплифицировали и клонировали по сайтам NotI и BgII в вектор pESC-URA. Также фрагмент кодирующей области CbCYP716A261 последовательно клонировали по сайтам SalI и BamHI в вектор pESC-URA с геном CbCPR. Полученную плазмиду CbCPR-pESCURA-CbCYP716A261 и контрольный пустой вектор pESCURA трансформировали в дрожжевой штамм INVSc1 с использованием набора Frozen-EZ Yeast Transformation II (“Zymo Research”, США). На 2‒4 сутки после трансформации положительные колонии отбирали по результатам ПЦР с колоний. Отдельные положительные клоны инокулировали в 15 мл синтетической ростовой среды без урацила ‒ SC-U, содержащей 2% глюкозы, ‒ и выращивали при 30°C в течение ночи при покачивании, после чего определяли оптическую плотность культуры при 600 нм (OD600). Клетки отмывали и пересевали в 50 мл среды SC-U с 2% галактозы таким образом, чтобы начальная плотность культуры составляла 0.4 OD600.
Для определения ферментативной активности CbCYP716A261 in vitro из клеток экстрагировали микросомальную белковую фракцию по протоколу, описанному Olsen и др. [28]. Реакционная смесь объемом 500 мкл содержала 50 мкл 100 мМ калий-фосфатного буфера (pH 7.4), 50 мкл 1 мМ NADPH, 20 мкг β-амирина и 1 мг микросомальной белковой фракции, а также бидистиллированную воду (ddH2O). После инкубации в течение 2 ч при 30°C продукты реакции экстрагировали двукратным объемом этилацетата. Органическую фазу отбирали, испаряли и перерастворяли в метаноле для ВЭЖХ-анализа.
ВЭЖХ проводили на колонке (150 мм × 4.5 мм × × 5 мкм) с сорбентом С18 (“Agilent Techlogies”). Элюцию проводили по программе: 50% воды и 50% ацетонитрила в точке 0 мин, 0% воды и 100% ацетонитрила в точке 8 мин и 0% воды и 100% ацетонитрила в точке 10 мин; время прогона составляло 15 мин; скорость подачи элюента ‒ 1 мл/мин; объем нанесения ‒ 20 млк; температура колонки была 30°C; детектор был настроен на длину волны 210 нм.
Коэкспрессия генов CbβAS, CbCPR и CbCYP716A261 в дрожжах. Праймеры для амплификации генов CbβAS (GenBank No: KJ155788), CbCPR (GenBank No: MF276991) и CbCYP716A261 подбирали так, чтобы полученные продукты имели перекрывающиеся области для двухстадийной ПЦР (табл. 1). Праймер βCPa состоял из 27 нуклеотидов и содержал часть, комплементарную началу гена CbCPR, сайт XhoI из вектора pESC-URA и 15 нуклеотидов выше этого сайта. Праймер βCPb содержал 15 нуклеотидов после стартового кодона гена CbCYP716A261, последовательность, кодирующую линкер (SerGlyGlySerGlyGlySerGlyGly), и 15 нуклеотидов, комплементарных концу гена CbCPR без стоп-кодона. Праймер βCPc представлял последовательность, обратно комплементарную праймеру βCPb. Праймер βCPd состоял из 27 н. и содержал последовательность, комплементарную концу гена CbCYP716A261, сайт KpnI вектора pESC-URA и 15 н. после этого сайта.
На первой стадии ген CbCPR амплифицировали с праймерами βCPa и βCPb, а ген CbCYP716A261 ‒ с праймерами βCPc и βCPd. Затем оба ПЦР-продукта очищали, смешивали и использовали в качестве матрицы во втором раунде ПЦР с праймерами βCPa и βCPd для того, чтобы амплифицировать гибридный ген CbCPR-linker-CbCYP716A261. Полученный продукт вставляли по сайтам XhoI и KpnI в вектор pESC-URA под контроль промотора GAL1 с использованием набора ClonExpress II One Step cloning kit (“Vazyme”, Китай). Параллельно ген CbβAS клонировали по сайтам NotI и BglII в вектор pESC-URA под контроль промотора GAL10. Финальную плазмиду CbβAS-pESCURA-CbCPR-linker-CbCYP716A261 трансформировали в дрожжевой штамм INVSc1 и индуцировали экспрессию генов. После галактозной индукции в течение 60 ч 10 мл дрожжевой культуры встряхивали 5 мин с 1 мл метанола и 100 мг кварцевого песка и затем проводили 30-минутную обработку ультразвуком. Клеточный экстракт центрифугировали 5 мин при 10 000 об/мин и органическую фазу переносили в новую пробирку. Процедуру повторяли дважды. Экстракты объединяли и анализировали методом ВЭЖХ. В качестве контролей использовали штаммы TS1 (содержащий пустой вектор pESC-URA), TS2 (экспрессирующий CbCPR и CbCYP716A261), TS3 (экспрессирующий CbβAS и CbCYP716A261) и TS4 (экспрессирующий CbβAS и CbCPR). Соответствующие плазмиды для попарной экспрессии были получены рестрикцией первой плазмиды.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Выбор кандидатных генов CYP
С развитием методов секвенирования последнего поколения технология секвенирования транскриптомов зарекомендовала себя как эффективный инструмент для поиска новых генов (в частности их суперсемейств) в немодельных растениях [29‒31]. Согласно предыдущим исследованиям, цитохромы P450, принадлежащие кланам CYP71, CYP72 или CYP85, участвуют в модификациях тритерпенового углеродного скелета в процессе биосинтеза тритерпеновых сапонинов [32]. Основываясь на этих сведениях, из последовательностей транскриптов C. blinii мы выбрали 10 полногеномных последовательностей кандидатных генов CYP (табл. 2).
Таблица 2.
Метки, соответствующие генам CYP, и их аннотации
| Gene ID | Аннотация Swissprot | Nr-аннотация |
|---|---|---|
| c32744 | Cytochrome P450 71A9 GN = CYP71A9 OS = Glycine max (Soybean) PE = 2 SV = 1 |
Цитохром P450-зависимая монооксигеназа [Artemisia annua] |
| c22011 | Cytochrome P450 716B2 GN = CYP716B2 OS = Picea sitchensis (Sitka spruce) PE = 2 SV = 1 |
Предполагаемая цитохром P450-зависимая таксан-13-альфа-гидроксилаза [Artemisia annua] |
| c28536 | Cytochrome P450 CYP72A219 OS = Panax ginseng (Korean ginseng) PE = 2 SV = 1 |
RecName: Full = Цитохром P450 CYP72A219; AltName: Full = Цитохром P450 CYP72A129 [Panax ginseng] |
| c30927 | Cytochrome P450 71A1 GN = CYP71A1 OS = Persea americana (Avocado) PE = 1 SV = 2 |
Партенолидсинтаза [Tanacetum parthenium] |
| c40756 | Cytochrome P450 71A1 GN = CYP71A1 OS = Persea americana (Avocado) PE = 1 SV = 2 |
Цитохром P450-зависимая монооксигеназа [Artemisia annua] |
| c39514 | Cytochrome P450 CYP72A219 OS = Panax ginseng (Korean ginseng) PE = 2 SV = 1 |
Цитохром P450-зависимая монооксигеназа [Artemisia annua] |
| c44164 | Cytochrome P450 71A8 GN = CYP71A8 OS = Mentha piperita (Peppermint) PE = 3 SV = 1 |
PREDICTED: цитохром P450 71A25 [Vitis vinifera] |
| c13793 | Beta-amyrin 28-oxidase OS = Panax ginseng (Korean ginseng) PE = 2 SV = 1 |
CYP716D22 [Artemisia annua] |
| c81240 | Beta-amyrin 28-oxidase OS = Panax ginseng (Korean ginseng) PE = 2 SV = 1 |
Подобен бета-амирин 28-оксидазе [Helianthus annuus] |
| c84658 | Cytochrome P450 716B1 GN = CYP716B1 OS = Picea sitchensis (Sitka spruce) PE = 2 SV = 1 |
Предполагаемый цитохром P450, частичная последовательность [Aralia elata] |
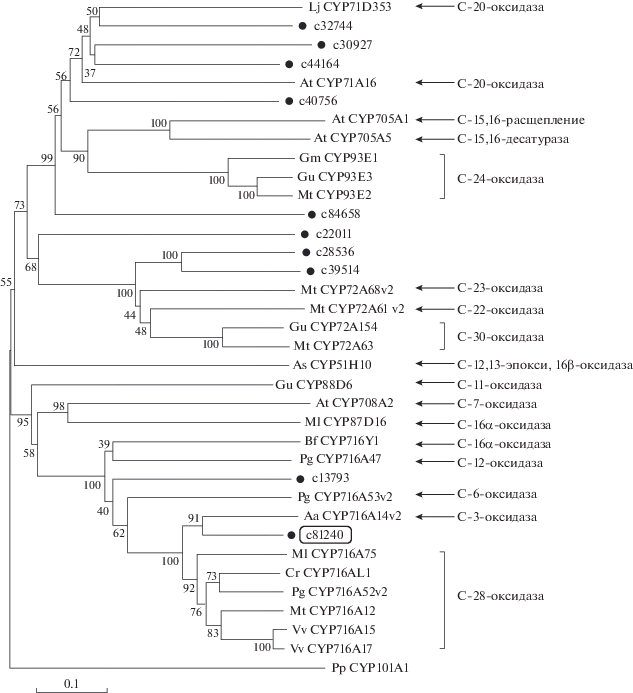
С целью сузить список кандидатных генов мы провели филогенетический анализ между выбранными записями и белками CYP, участвующими в биосинтезе тритерпеновых сапонинов. Согласно предшествующим исследованиям, цитохромы клана CYP71 в основном участвуют в модификациях атомов углерода C-15, C-16, C-20 и C-24 [19, 24, 33], цитохромы клана CYP72 участвуют в модификациях атомов углерода C-22, C-23 и C-30 [34], наконец, цитохромы клана CYP85 участвуют в модификациях атомов углерода C-6, C-7, C-11, C-12, C-16α и C-28 [17, 22, 23, 35, 36]. Результаты филогенетического анализа показали, что пять последовательностей (c30927, c32744, c40756, c44164 и c84658) принадлежат к клану CYP71, три последовательности (c22011, c28536 и c39514) ‒ к клану CYP72 и две последовательности (c13793 и c81240) ‒ к клану CYP85. Олеаноловая кислота принадлежит к группе конизасапонинов с тритерпеновым скелетом; ее синтез осуществляется путем модификации β-амирина в позиции C-28. Таким образом, в списке кандидатов мы оставили последовательности c13793 и c81240 (рис. 2).
Рис. 2.
Филогенетические взаимосвязи генов CYP C. blinii и генов CYP из других растений. Гены CYP C. blinii помечены кружком. Последовательность c81240 (ген CbCYP716A261) взята в рамку. Дерево построено методом объединения ближайших соседей (Neighbor‒Joining). Шкала соответствует 0.1 аминокислотной замене/сайт. Ферментативная активность CYP показана справа. Бактериальный цитохром CYP101A1 включен в качестве внешней группы. Обозначения: Lj ‒ Lotus japonicas, At ‒ Arabidopsis thaliana, Gm ‒ Glycine max, Gu ‒ Glycyrrhiza uralensis, Mt ‒ Medicago truncatula, As ‒ Avena strigose, Ml ‒ Maesa lanceolate, Bf ‒ Bupleurum falcatum, Pg ‒ Panax ginseng, Aa ‒ Artemisia annua, Cr ‒ Catharanthus roseus, Vv ‒ Vitis vinifera, Pp ‒ Pseudomonas putida.
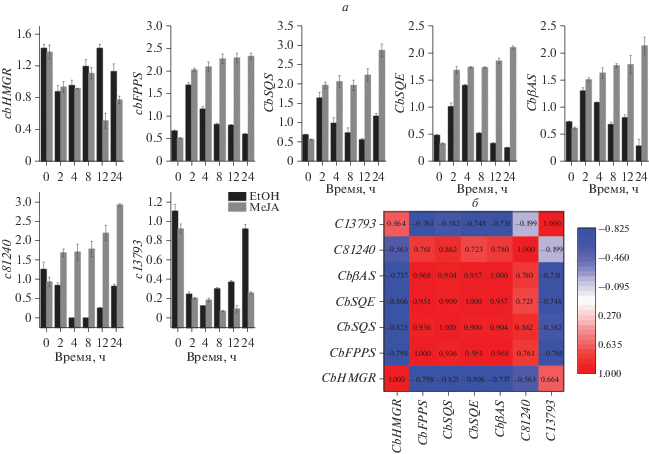
Паттерны экспрессии генов, участвующих в одних и тех же биологических процессах, строго коррелируют друг с другом [37]. Метилжасмонат используется в качестве внешнего стимулятора, который может увеличивать как содержание вторичных метаболитов, таких как сапонины [38, 39], так и уровни транскрипции генов, участвующих в биосинтезе сапонинов [23, 35]. Для дальнейшей идентификации CYP, вовлеченных в биосинтез конизасапонинов, мы провели анализ генной экспрессии в листьях обработанного метилжасмонатом растения C. blinii. Исследовали транскрипционную активность двух кандидатных последовательностей CYP, а также генов, участвующих в ранних стадиях синтеза, кодирующих фарнезилпирофосфатсинтазу, скваленсинтазу и β-амиринсинтазу. В результате показано, что ген, соответствующий записи c81240, регулируется совместно с этими генами. Таким образом, последовательность c81240 была выбрана для дальнейшего исследования (рис. 3).
Рис. 3.
Экспрессионный анализ генов CYP и других ферментов биосинтеза тритерпеновых сапонинов в листьях C. blinii, обработанных этанолом и метилжасмонатом. a ‒ Относительные уровни транскриптов в точках 0, 2, 4, 8, 12 и 24 ч, определенные при помощи количественной ПЦР в реальном времени. Разброс данных рассчитан для трех измерений. б ‒ Корреляция между экспрессией генов CYP и других ферментов биосинтеза тритерпеновых сапонинов. Красный ‒ положительная корреляция; синий ‒ отрицательная корреляция.
Генетические характеристики CbCYP716A261
Мы клонировали кДНК, соответствующую последовательности c81240, и согласно номенклатуре Нельсона дали гену название CbCYP716A261 (http://drnelson.uthsc.edu/cytochromeP450.html). Полноразмерная ДНК CbCYP716A261 состоит из 1446 п.н. (GenBank No: MF996505) и кодирует белок размером 55.0 кДа. Результаты анализа в BlastP показали, что аминокислотная последовательность CbCYP716A261 на 82% идентична β‑амирин-28-гидроксилазе из Helianthus annuus. Зрелый белок содержит консервативные мотивы, характерные для цитохромов P450, например, гемсвязывающий мотив (FGGGPRMCPG), пролинбогатый домен (PPGRKGWP) и другие консервативные домены (FDPSRF, EVLR и GGHDTA). Вторичную структуру белка предсказали при помощи метода SOPMA и обнаружили, что белок обогащен α-спиралями (40.12%), содержит 33.89% неупорядоченных последовательностей, 17.46% протяженных участков и 8.52% β-слоев. Результат анализа в TMHMM предсказал в аминокислотной последовательности CbCYP716A261 один трансмембранный домен ‒ между аминокислотными остатками 5‒27.
Ферментативная активность белка CbCYP716A261 in vitro
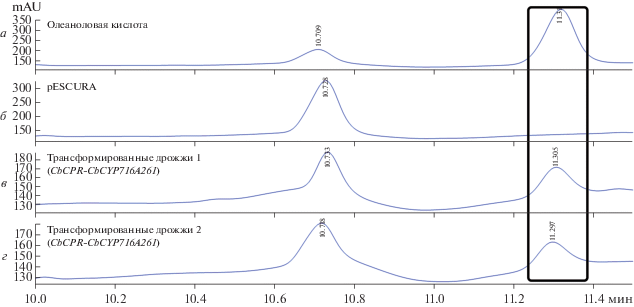
Для оценки активности β-амирин-28-оксидазы CbCYP716A261 в продукции конизасапонинов микросомальную фракцию дрожжевой культуры штамма INVSc1, экспрессирующего CbCYP716A261 и CbCPR, инкубировали с β-амирином в течение 2 ч при 30°C. Продукты реакции экстрагировали двукратным объемом этилацетата и анализировали ВЭЖХ. На хроматограммах в точке 11.30 мин детектировали уникальный пик для дрожжей, экспрессирующих CbCPR-CbCYP716A261, но не для контрольного штамма, трансформированного пустым вектором. Время удержания совпало с таковым для олеаноловой кислоты, которую использовали в качестве стандарта. На основании полученных результатов можно говорить о том, что фермент CbCYP716A261 катализирует конверсию β-амирина в олеаноловую кислоту (рис. 4).
Рис. 4.
Активность CbCYP716A261 Conyza blinii по отношению к β-амирину in vitro. Представлены результаты ВЭЖХ стандарта – олеаноловой кислоты (а), продуктов реакции микросомальной фракции контрольных дрожжей с β-амирином (б), продуктов реакции микросомальной фракции дрожжей, трансформированных CbCPR-pESCURA-CbCYP716A261 с β-амирином (в, г). Пик олеаноловой кислоты в точке 11.30 мин выделен рамкой.
Ферментативная активность белка CbCYP716A261 in vivo
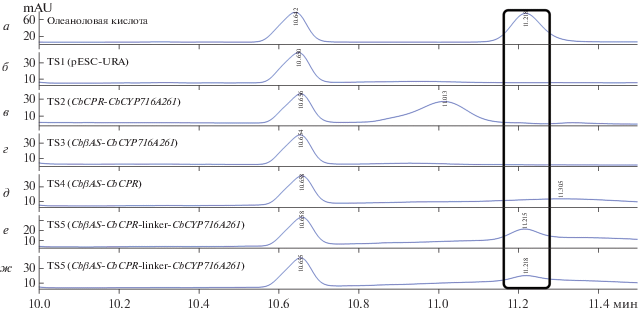
Для определения ферментативной активности CbCYP716A261 in vivo получили штамм Saccharomyces cerevisiae, который одновременно экспрессировал гены CbβAS, CbCPR и CbCYP716A261, и проанализировали в нем продукцию олеаноловой кислоты. На первом этапе, используя двухстадийную ПЦР с перекрывающимися праймерами, мы получили гибридный ген CbCPR-linker-CbCYP716A261, который затем клонировали в дрожжевой вектор pESC-URA в один из двух участков для множественного клонирования (MCS2), а ген CbβAS клонировали в участок pESC-URA MCS1. Метанольные экстракты клеток анализировали ВЭЖХ. Согласно результатам хроматографии, в точке 11.21 мин экстракт дрожжей, трансформированных CbβAS-pESCURA-CbCPR-linker-CbCYP716A261 (TS5), и стандарт олеаноловой кислоты дают сходные пики, в то время как в экстрактах контрольных штаммов (TS1, TS2, TS3 и TS4) таких пиков нет (рис. 5).
Рис. 5.
Продукция олеаноловой кислоты in vivo трансгенным штаммом дрожжей, содержащим CbβAS, CbCPR и CbCYP716A261. Результаты ВЭЖХ стандарта ‒ олеаноловой кислоты (а); контрольных дрожжевых экстрактов, содержащих пустой вектор (б); экстракта трансгенных дрожжей, экспрессирующих гены CbCPR и CbCYP716A261 (в); экстракта трансгенных дрожжей, экспрессирующих гены CbβAS и CbCYP716A261 (г); экстракта трансгенных дрожжей, экспрессирующих гены CbβAS и CbCPR (д); и экстракта трансгенных дрожжей, коэкспрессирующих гены CbβAS, CbCPR и CbCYP716A261 (е, ж). Пик олеаноловой кислоты выделен рамкой.
По результатам исследования фермент CbCYP716A261 был охарактеризован как β-амирин-28-гидроксилаза, которая модифицирует β‑амирин с образованием олеаноловой кислоты и участвует в пути биосинтеза конизасапонинов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Конизасапонины составляют большую часть вторичных метаболитов C. blinii и проявляют различную биологическую активность, включая противоспалительную, противоязвенную, антибактериальную и противоопухолевую [12, 40]. Предшественником конизасапонинов служит олеаноловая кислота, которая образуется путем окисления β‑амирина по положению С-28. Оксидазы, которые осуществляют эту реакцию, по большей части относятся к CYP. К примеру, ферменты CYP716A12 [21] и CYP716A15 [36] из M. truncatula катализируют синтез олеаноловой кислоты, используя β‑амирин в качестве субстрата. CYP716A75 катализирует окисление по атому углерода C-28 β-амирина в пути биосинтеза сапонина в кустарнике Maesa lanceolata [41]. В проведенном нами исследовании белок CbCYP716A261 идентифицирован как фермент, принадлежащий к подсемейству CYP716A, который транскрипционно корегулируется с известными генами биосинтеза тритерпеновых сапонинов и катализирует гидроксилирование атома C-28 β-амирина с образованием олеаноловой кислоты.
Метилжасмонат – важный гормон и сигнальная молекула растений. Он играет существенную роль в защите растений от биотического и абиотического стрессов. Во многих исследованиях показано, что метилжасмонат может индуцировать биосинтез многих вторичных метаболитов, в том числе сапонинов [42, 43], и повышать уровни транскрипции генов, вовлеченных в биосинтез сапонинов [38, 44]. По этой причине исследователи часто ищут новые гены, относящиеся к биосинтезу сапонинов в экспериментах, включающих обработку растительного материала метилжасмонатом. Путем транскриптомного профайлинга обработанных метилжасмонатом корней Bupleurum falcatum Moses и соавт. [35] идентифицировали C-16α-гидроксилазу (CYP716Y1), которая транскрипционно корегулировалась с известными генами биосинтеза тритерпеновых сапонинов и проявляла каталитическую активность, которая до того не была выявлена ни для одного фермента из царства растений. Han и др. [23] обнаружили кандидатные гены цитохромов, потенциально участвующих в биосинтезе гинзенозидов, в корнях обработанного метилжасмонатом Panax ginseng. Sui и соавт. [30] использовали обработанные метилжасмонатом придаточные корни Bupleurum chinense для изучения экспрессии βAS и поиска предполагаемых CYP и гликозилтрансфераз, вовлеченных в биосинтез сайкосапонинов. Мы также предположили, что гены CYP, участвующие в биосинтезе конизасапонинов, должны корегулироваться с известными генами биосинтеза тритерпеновых сапонинов под действием метилжасмоната. По результатам филогенетического анализа последовательности c13793 и c81240 были выбраны в качестве кандидатных генов CYP. Однако в транскриптомном профайлинге листьев обработанных метилжасмонатом растений C. blinii наличие корегуляции подтвердилось только для c81240. Таким образом, последовательность c81240 (CbCYP716A261) была отобрана в качестве самого перспективного кандидатного CYP, потенциально участвующего в биосинтезе конизасапонинов.
Для определения функциональной активности CbCYP716A261 использована экспрессионная система Saccharomyces cerevisiae (штамм INVSc). INVSc1 представляет собой штамм ауксотрофных дрожжей, хорошо подходящий для экспрессионного анализа. Так, Yasumoto и соавт. [45] использовали экспрессионную систему INVSc1 для того, чтобы охарактеризовать функции генов CYP716A1 и CYP716A2 Arabidopsis thaliana и шести генов CYP716 томата. В данной работе микросомальные фракции дрожжевой культуры штамма INVSc1, экспрессирующего CbCPR-CbCYP716A261, продуцировали олеаноловую кислоту из β-амирина после двухчасовой инкубации. Одновременная экспрессия генов CbβAS, CbCPR и CbCYP716A261 в штамме INVSc1 приводила к образованию олеаноловой кислоты в отсутствие β-амирина, хотя выход олеаноловой кислоты был низким. Возможная причина низкого выхода заключается в том, что в дрожжевом штамме был реконструирован только исходный путь биосинтеза. Если рассматривать способы увеличения выхода олеаноловой кислоты в используемой системе, то можно применить технологии метаболической инженерии, например, путем сверхэкспрессии генов ферментов, вышестоящих в сигнальном каскаде биосинтеза олеаноловой кислоты, ‒ для повышения уровня эндогенного предшественника 2,3-оксидосквалена. С биосинтезом олеаноловой кислоты в клетках дрожжей конкурирует путь биосинтеза стеролов, так что снижение оттока предшественников в этом направлении также может повысить выход продукта. К альтернативным способам можно отнести замену собственного промотора на искусственный ‒ для усиления транскрипционной активности.
Таким образом, в результате проведенного исследования клонирован и охарактеризован новый ген CYP, CbCYP716A261, кодирующий β-амирин-28-гидроксилазу, которая вовлечена в биосинтез конизасапонинов.
Исследование поддержано грантом Университета Паньчжихуа (The Panzihua University; 035200167) и Департаментом науки и технологии провинции Сычуань (Department of Science and Technology of Sichuan Province; 2018HH0074).
Данная статья не содержит экспериментов, включающих животных или людей.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Augustin J.M., Kuzina V., Andersen S.B., Bak S. (2011) Molecular activities, biosynthesis and evolution of tri-terpenoid saponins. Phytochemistry. 72, 435‒457.
Osbourn A., Goss R.J., Field R.A. (2004) The saponins: polar isoprenoids with important and diverse biological activities. Nat. Prod. Rep. 28, 1261‒1268.
Sparg S.G., Light M.E., Staden J.V. (2004) Biological activities and distribution of plant saponins. J. Ethnopharmacol. 94, 219‒243.
Salvador J.A., Moreira V.M., Goncalves B.M., Leal A.S., Jing Y. (2012) Ursane-type pentacyclic triterpenoids as useful platforms to discover anticancer drugs. Nat. Prod. Rep. 29, 1463‒1479.
Wang Z.Y., Cheng Y., Wang N., Wang D.M., Li Y.W., Han F., Shen J.G., Yang D.P., Guan X.Y., Chen J.P. (2012) Dioscin induces cancer cell apoptosis through elevated oxidative stress mediated by downregulation of peroxiredoxins. Cancer Biol. Ther. 13, 138‒147.
Hostettmann K.A. Marston A. (1995) Saponins: Chemistry and Pharmacology of Natural Products. Cambridge: Cambridge University.
Vogler B.K., Pittler M.H., Ernst E. (1999) The efficacy of ginseng. A systematic review of randomised clinical trials. Eur. J. Clin. Pharmacol. 55, 567‒575.
Roberts S.C. (2007) Production and engineering of terpenoids in plant cell culture. Nat. Chem. Biol. 3, 387‒395.
Chinese Pharmacopoeia Commission. (2010) Pharmacopoeia of the People’s Republic of China: Jinglongdancao. Beijing: People’s Medical Publishing House Press.
Qi Y.Q., Xu X.C., He H.W., Wang S.K., Yang C.Y. (1983) Preliminary experimental study on total saponins of Conyza blinii. Chin. Tradit. Pat Med. 6, 36.
Li L.X. (1980) Comparison of Conyza blinii saponin tablets with doxycycline tablets in treating 310 cases of chronic tuberculosis. J. Chengdu Univ. Tradit. Chin. Med. 6, 29‒34.
Ma L., Liu H.Y., Qin P., Hu C.X., Man S.L., Li Y.Y., Liu Z., Liu Z.X., Diao A.P. (2017) Saponin fraction isolated from Conyza blinii H.Lév. demonstrates strong anti-cancer activity that is due to its NF-κB inhibition. Biochem. Biophys. Res. Commun. 483, 779‒785.
Su Y.F., Guo D.A., Guo H.Z., Liu J.S., Zheng J.H., Koike K., Nikaido T. (2001) Four new triterpenoid saponins from Conyza blinii. J. Nat. Prod. 64, 32.
Su Y.F., Koike K., Guo D.A., Satou T., Liu J.S., Zheng J.H., Nikaido T. (2001) New apiose-containing triterpenoid saponins from Conyza blinii. Tetrahedron. 57, 6721‒6726.
Su Y.F., Koike K., Nikaido T., Liu J.S., Zheng J.H., Guo D.A. (2003) Conyzasaponins I-Q, nine new triterpenoid daponins from Conyza blinii. J. Nat. Prod. 66, 1593‒1599.
Buchanan B., Gruissem R., Jones J. (2000) Biochemistry and Molecular Biology of Plants: Natural products, secondary metabolites. Rockville: American Society of Plant Physiologists.
Seki H., Ohyama K., Sawai S., Mizutani M., Ohnishi T., Sudo H., Akashi T., Aoki T., Saito K., Muranaka T. (2008) Licorice beta-amyrin 11-oxidase, a cytochrome P450 with a key role in the biosynthesis of the triterpene sweetener glycyrrhizin. Proc. Natl. Acad. Sci. USA. 105, 14204‒14209.
Sudo H., Seki H., Sakurai N., Suzuki H., Shibata D., Toyoda A., Totoki Y., Sakaki Y., Iida O., Shibata T., Kojoma M., Muranaka T., Saito K. (2009) Expressed sequence tags from rhizomes of Glycyrrhiza uralensis. Plant Biotechnol. 26, 105‒108.
Shibuya M., Hoshino M., Katsube Y., Hayashi H., Kushiro T., Ebizuka Y. (2006) Identification of beta-amyrin and sophoradiol 24-hydroxylase by expressed sequence tag mining and functional expression assay. FEBS J. 273, 948‒959.
Li L.Y., Cheng H., Gai J.Y., Yu D.Y. (2007) Genome-wide identification and characterization of putative cytochrome P450 genes in the model legume Medicago truncatula. Planta. 226, 109‒123.
Carelli M., Biazzi E., Panara F., Tava A., Scaramelli L., Porceddu A., Graham N., Odoardi M., Piano E., Arcioni S., May S., Scotti C., Calderini O. (2011) Medicago truncatula CYP716A12 is a multifunctional oxidase involved in the biosynthesis of hemolytic saponins. Plant Cell. 23, 3070‒3081.
Han J.Y., Hwang H.S., Choi S.W., Kim H.J., Choi Y.E. (2012) Cytochrome P450 CYP716A53v2 catalyzes the formation of protopanaxatriol from protopanaxadiol during ginsenoside biosynthesis in Panax ginseng. Plant Cell Physiol. 53, 1535‒1545.
Han J.Y., Kim H.J., Kwon Y.S., Choi Y.E. (2011) The Cyt P450 enzyme CYP716A47 catalyzes the formation of protopanaxadiol from dammarenediol-II during ginsenoside biosynthesis in Panax ginseng. Plant Cell Physiol. 52, 2062‒2073.
Krokida A., Delis C., Geisler K., Garagounis C., Tsikou D., Peña-Rodríguez L.M., Katsarou D., Field B., Osbourn A.E., Papadopoulou K.K. (2013) A metabolic gene cluster in Lotus japonicus discloses novel enzyme functions and products in triterpene biosynthesis. New Phytol. 200, 675‒690.
Sun R., Liu S., Tang Z.Z., Zheng T.R., Wang T., Chen H., Li C.L., Wu Q. (2017) β-Amyrin synthase from Conyza blinii expressed in Saccharomyces cerevisiae. FEBS Open Bio. 7, 1575‒1585.
Sun R., Liu S., Tang Z.Z., Jin H.J., Li C.L., Chen H. (2015) Study on transcriptome characteristic of genuine traditional Chinese medicine Conyza blinii H.Lév leaves of Sichuan. Mol. Plant Breed. 13, 2754‒2760.
Tamura K., Peterson D., Peterson N., Stecher G., Nei M., Kumar S. (2011) MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol. Biol. Evol. 28, 2731–2739.
Olsen K.M., Hehn A., Jugdé H., Slimestad R., Larbat R., Bourgaud F., Lillo C. (2010) Identification and characterisation of CYP75A31, a new flavonoid 3'5'-hydroxylase, isolated from Solanum lycopersicum. BMC Plant Biol. 10, 21.
Luo H.M., Sun C., Sun Y.Z., Wu Q., Li Y., Song J.Y., Niu Y.Y., Cheng X.L., Xu H.X., Li C.Y., Liu J.Y., Steinmetz A., Chen S.L. (2011) Analysis of the transcriptome of Panax notoginseng root uncovers putative triterpene saponin-biosynthetic genes and genetic markers. BMC Genomics. 12, S5.
Sui C., Zhang J., Wei J.H., Chen S.L., Li Y., Xu J.S., Jin J., Xie C.X., Gao Z.H., Chen H.J., Yang C.M., Zhang Z., Xu Y.H. (2011) Transcriptome analysis of Bupleurum chinense focusing on genes involved in the biosynthesis of saikosaponins. BMC Genomics. 12, 539.
Rai A., Yamazaki M., Takahashi H., Nakamura M., Kojoma M., Suzuki H., Saito K. (2016) RNA-seq transcriptome analysis of Panax japonicus, and its comparison with other Panax species to identify potential genes involved in the saponins biosynthesis. Front. Plant Sci. 7, 481.
Tanaka Y. Brugliera F. (2014) Fifty Years of Cytochrome P450 Research: Plant Cytochrome P450s in triterpenoid biosynthesis, diversity and application to combinatorial biosynthesis. Japan: Springer.
Zapata L., Ding J., Willing E.M., Hartwig B., Bezdan D., Jiao W.B., Patel V., James G.V., Koornneef M., Ossowski S., Schneeberger K. (2016) Chromosome-level assembly of Arabidopsis thaliana Ler reveals the extent of translocation and inversion polymorphisms. Proc. Natl. Acad. Sci. USA. 113, E4052–E4060.
Seki H., Sawai S., Ohyama K., Mizutani M., Ohnishi T., Sudo H., Fukushima E.O., Akashi T., Aoki T., Saito K., Muranaka T. (2011) Triterpene functional genomics in licorice for identification of CYP72A154 involved in the biosynthesis of glycyrrhizin. Plant Cell. 23, 4112‒4123.
Moses T., Pollier J., Almagro L., Buyst D., Montagu M.V., Pedreño M.A., Martins J.C., Thevelein J.M., Goossens A. (2014) Combinatorial biosynthesis of sapogenins and saponins in Saccharomyces cerevisiae using a C‑16α hydroxylase from Bupleurum falcatum. Proc. Natl. Acad. Sci. USA. 111, 1634‒1639.
Fukushima E.O., Seki H., Ohyama K., Ono E., Umemoto N., Mizutani M., Saito K., Muranaka T. (2011) CYP716A subfamily members are multifunctional oxidases in triterpenoid biosynthesis. Plant Cell Physiol. 52, 2050‒2061.
Naoumkina M.A., Modolo L.V., Huhman D.V., Urbanczyk-Wochniak, E., Tang Y.H., Sumner L.W., Dixon R.A. (2010) Genomic and coexpression analyses predict multiple genes involved in triterpene saponin biosynthesis in Medicago truncatula. Plant Cell. 22, 850‒866.
Hayashi H., Huang P., Inoue K. (2003) Up-regulation of soyasaponin biosynthesis by methyl jasmonate in cultured cells of Glycyrrhiza glabra. Plant Cell Physiol. 44, 404‒411.
Lee M.H., Jeong J.H., Seo J.W., Shin C.G., Kim Y.S., In J.G., Yang D.C., Yi J.S., Choi Y.E. (2004) Enhanced triterpene and phytosterol biosynthesis in Panax ginseng overexpressing squalene synthase gene. Plant Cell Physiol. 45, 976‒984.
Ma L. Liu J.G. (2014) The protective activity of Conyza blinii saponin against acute gastric ulcer induced by ethanol. J. Ethnopharmacol. 158, 358‒363.
Moses T., Pollier J., Faizal A., Apers S., Pieters L., Thevelein J.M., Geelen D. (2015) Unraveling the triterpenoid saponin biosynthesis of the African shrub Maesa lanceolata. Mol. Plant. 8, 122‒135.
Lu M.B., Wong H., Teng W.L. (2001) Effects of elicitation on the production of saponin in cell culture of Panax ginseng. Plant Cell Rep. 20, 674‒677.
Yu K.W., Gao W.Y., Hahn E.J., Paek K.Y. (2002) Jasmonic acid improves ginsenoside accumulation in adventitious root culture of Panax ginseng C.A. Meyer. Biochem. Eng. J. 11, 211‒215.
Liu Y.L., Cai Y.F., Zhao Z.J., Wang J.F., Li J., Xin W., Xia G.G., Xiang F.N. (2009) Cloning and functional analysis of a β-amyrin synthase gene associated with oleanolic acid biosynthesis in Gentiana straminea MAXIM. Biol. Pharm. Bull. 32, 818‒824.
Yasumoto S., Fukushima E.O., Seki H., Muranaka T. (2016) Novel triterpene oxidizing activity of Arabidopsis thaliana CYP716A subfamily enzymes. FEBS Lett. 590, 533‒540.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


