Молекулярная биология, 2021, T. 55, № 2, стр. 312-317
Противоопухолевая активность комбинации топотекана и ингибитора тирозил-ДНК-фосфодиэстеразы 1 на модели асцитной карциномы Кребс-2 мыши
Н. С. Дырхеева a, А. Л. Захаренко a, Е. С. Новоселова a, А. А. Чепанова a, b, Н. А. Попова b, c, В. П. Николин c, О. А. Лузина d, Н. Ф. Салахутдинов d, Е. И. Рябчикова a, b, О. И. Лаврик a, b, *
a Институт химической биологии и фундаментальной медицины Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
b Новосибирский государственный университет
630090 Новосибирск, Россия
c Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
d Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
* E-mail: lavrik@niboch.nsc.ru
Поступила в редакцию 31.08.2020
После доработки 08.09.2020
Принята к публикации 08.09.2020
Аннотация
Топотекан – цитостатический препарат из группы камптотецинов, действующий как ингибитор активности топоизомеразы 1 (TOP1). Тирозил-ДНК-фосфодиэстераза 1 (TDP1) – фермент репарации, удаляющий заместители с 3'-конца ДНК. TDP1 препятствует действию ингибиторов TOP1, снижая их терапевтическую эффективность, поэтому подавление активности TDP1 может усилить эффект топотекана. Нами изучено действие как самого противоопухолевого препарата топотекан, так и его комбинации с ингибитором TDP1 (гидразинотиазольным производным усниновой кислоты) на асцитную опухоль мышей Кребс-2. Ранее мы установили, что это производное усниновой кислоты является эффективным ингибитором TDP1. В настоящей работе показано, что внутрибрюшинное введение как топотекана, так и ингибитора TDP1 по отдельности оказывает противоопухолевое действие, которое оценивали по весу асцитной опухоли и по количеству клеток в асцитической жидкости. Совместное введение топотекана и исследуемого ингибитора TDP1 аддитивно снижало оба показателя. Также показано, что комбинированное введение этих двух препаратов приводит к развитию деструктивных процессов в опухоли, выражающихся в появлении клеток, в которых липидные капли занимали почти всю цитоплазму, повышенном накоплении клеточного детрита, отсутствовавшего в образцах, полученных от мышей, которым препараты вводили по отдельности.
ВВЕДЕНИЕ
Противоопухолевое действие многих химиотерапевтических агентов и радиотерапии напрямую связано с их способностью вызывать повреждения ДНК. Однако влияние этих агентов нивелируется способностью раковых клеток репарировать индуцированные повреждения ДНК, что приводит к снижению эффективности терапии и развитию лекарственной резистентности. Поэтому поиск новых соединений, подавляющих активность ферментов репарации ДНК, можно рассматривать в качестве стратегии для потенцирования цитотоксичности уже применяемых лекарственных препаратов, которые действуют как повреждающие ДНК агенты. Топотекан – полусинтетический водорастворимый аналог камптотецина, ингибирующий топоизомеразу 1 (TOP1). TOP1 регулирует степень локального скручивания спирали ДНК, в ходе реакции образуется ковалентный комплекс ДНК–TOP1 [1]. На сегодняшний день ингибиторы TOP1 – аналоги камптотецина, топотекан и иринотекан [1, 2], применяют при широком спектре опухолей: при раке легкого, толстой кишки, шейки матки, яичников и др. Действие камптотецинов приводит к стабилизации ковалентного комплекса TOP1–ДНК на ДНК, что предотвращает восстановление цепи ДНК. Таким образом в ДНК сохраняются повреждения в виде ковалентных аддуктов и одноцепочечных разрывов, что в конечном итоге приводит к остановке клеточного цикла и гибели клетки [1]. Тирозил-ДНК-фосфодиэстераза 1 (TDP1) катализирует удаление с 3'‑конца ДНК ковалентно присоединенного пептида – остатка ковалентного аддукта TOP1, возникающего в процессе протеасомной деградации [3–5], нивелируя таким образом эффект ингибиторов TOP1. Подавление активности TDP1 может усиливать действие ингибиторов ТOP1, например топотекана. Таким образом, совместное использование ингибиторов TDP1 и TOP1 может заметно повысить эффективность химиотерапии [3, 6, 7].
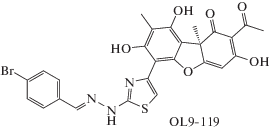
Известные ингибиторы TDP1 действуют в диапазоне 0.01–100 мкМ [6–12]. Проведенные нами комплексные исследования в системах in vitro и in vivo позволили найти целый ряд эффективных ингибиторов TDP1, которые способны усилить противоопухолевый эффект химиотерапевтических препаратов [6]. Среди широкого спектра известных ингибиторов TDP1 – синтетических аналогов природных веществ, одними из наиболее перспективных считаются производные усниновой кислоты [6, 9, 10, 13]. Усниновая кислота – широко распространенное и доступное природное соединение, вторичный метаболит лишайников. Ее синтетические аналоги могут быть получены путем направленных химических модификаций в фенольном или трикетоновом фрагментах [12, 13]. Нами показан синергический эффект различных производных усниновой кислоты с камптотецином или топотеканом на клеточных линиях in vitro, а также с топотеканом in vivo [9, 10, 14–17]. Гидразинотиазольное производное усниновой кислоты 20d [14] (лабораторный код OL9-119, рис. 1) является эффективным ингибитором TDP1 c IC50 (концентрация полумаксимального ингибирования) 26 нМ. Это соединение усиливало действие топотекана как in vitro, так и in vivo, а также противоопухолевый и антиметастатический эффект топотекана на модели карциномы легкого Льюис [14]. В настоящей работе изучено действие одного топотекана и топотекана в комбинации с ингибитором TDP1 OL9-119 на развитие асцитной опухоли Кребс-2 у мышей. Согласно полученным данным, и топотекан, и ингибитор TDP1 OL9-119 обладали противоопухолевым действием, а их комбинация аддитивно повышала противоопухолевую активность и приводила к развитию деструктивных процессов в опухоли. Таким образом, гидразинотиазольное производное усниновой кислоты – ингибитор TDP1, можно считать перспективным для разработки комбинированной противоопухолевой терапии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. В работе использованы следующие соединения: топотекан (“USP”, США), ингибитор TDP1 (лабораторный код OL9-119), синтезированный в Новосибирском институте органической химии им. Н.Н. Ворожцова СО РАН (Новосибирск, Россия) согласно [14], а также органические растворители и другие реактивы отечественного производства квалификации х.ч. и ч.д.а.
Лабораторные животные и модельная опухоль. В исследовании использовали мышей линии C57BL/6 3–4-месячного возраста из вивария конвенциональных животных Института цитологии и генетики СО РАН. Животных (35 особей) содержали на подстилке из опилок в пластиковых клетках (по семь мышей в каждой) со свободным доступом к корму (“Лабораторкорм”, Москва, Россия) и воде. Все эксперименты проведены в соответствии с протоколами, одобренными межинститутской комиссией по биоэтике ИЦиГ СО РАН и директивой 2010/63/EU.
Экспериментальной моделью служила опухоль Кребс-2, которую мышам прививали внутрибрюшинно (по 0.2 млн. клеток). Экспериментальные группы мышей (пять групп) формировали случайным образом. Группа 1 – контрольная – мышам этой группы однократно внутрибрюшинно вводили опухолевые клетки, но химиотерапию не проводили. Группа 2 (контроль действия растворителя) – мышам двукратно (через 2 и 4 дня после прививки опухоли) внутрибрюшинно вводили 15% ДМСО (“Sigma”, США) и 10% Твин-80 (“Panreac AppliChem”, Германия). Группа 3 – топотекан в разовой дозе 2 мг/кг. Группа 4 – мыши этой группы получали ингибитор TDP1 в разовой дозе 100 мг/кг в виде суспензии в ДМСО/Твин-80 в воде (0.2 мл суспензии на мышь). Группа 5 – мышам вводили одновременно топотекан и ингибитор TDP1.
Действие препаратов на опухоль оценивали в конце эксперимента на 10-й день по весу асцитной опухоли (разница в весе мыши до и после удаления опухоли), а также по числу опухолевых клеток в асците, определенному с помощью счетчика клеток (“Logos Biosystems”, Южная Корея). Для приготовления препаратов для микроскопического исследования 1 мл опухоли от каждой мыши смешивали с 10 мл 10%-ного раствора забуференного формалина (“Биовитрум”, Россия). Статистическую обработку данных проводили в программе Microsoft Office Excel 2013, результаты приведены как значение ± стандартное отклонение.
Микроскопическое исследование. Для светооптического исследования образцы асцитической жидкости опухоли Кребс-2, а также опухоли после обработки растворителем (ДМСО/Твин-80), топотеканом, препаратом-ингибитором TDP1, комбинацией топотекан + ингибитор TDP1 фиксировали в растворе 10%-ного формалина через 10 сут после первого введения препаратов. Далее клетки обрабатывали 1%-ным раствором осмиевой кислоты (“EMS”, США), обезвоживали в растворах этилового спирта возрастающей концентрации и ацетоне, заливали в смесь эпон-аралдита (“EMS”). Полутонкие срезы готовили на ультрамикротоме EM UC7 (“Leica”, Германия) и окрашивали 1%-ным раствором азура-2 (“EMS”) на 1%-ном растворе буры (“EMS”).
Полутонкие срезы клеток асцитной формы опухоли Кребс-2 изучали с помощью светового микроскопа DM2500 (“Leica”), фотосъемку проводили с помощью цифровой камеры MC 170 HD (“Leica”).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
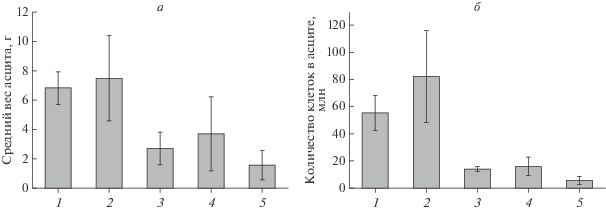
Перед первым введением препаратов мышей разделили на пять групп, по семь мышей в каждой. Действие топотекана и ингибитора TDP1 OL9-119 (рис. 1) по отдельности и совместно на асцитную форму опухоли оценивали на 10-й день по весу опухоли, а также по числу опухолевых клеток в асците. Индивидуальное введение как топотекана, так и ингибитора TDP1 приводило к снижению веса опухоли и числа опухолевых клеток в асците (рис. 2) по сравнению с контрольной группой 1 и с группой 2, которой вводили ДМСО. Следует отметить, что ДМСО не влияет на эти два показателя, т.е. снижение веса опухоли при введении ингибитора TDP1, растворенного в ДМСО, обусловлено действием самого ингибитора. Комбинированное введение топотекана и ингибитора TDP1 аддитивно снизило оба показателя (рис. 2).
Рис. 2.
Средний вес асцитной опухоли (разница в весе мыши с опухолью в брюшной полости и после удаления опухоли) (a), и количество опухолевых клеток в асците (б). 1 – Контрольная группа. 2–5 – Группы мышей, которым вводили ДМСО, топотекан ингибитор TDP1, совместно топотекан и ингибитор TDP1 соответственно.
Ранее мы сообщали о сенсибилизации карциномы Льюис мышей к действию топотекана препаратом этого же ингибитора TDP1 при внутрижелудочном введении [14]. Введение только данного препарата (OL9-119) не оказывало ни противоопухолевого, ни антиметастатического эффекта, но при комбинированном применении значительно усиливало действие топотекана. В настоящем исследовании препарат OL9-119 вводили внутрибрюшинно, чтобы обеспечить его прямой доступ к опухолевым клеткам, и наблюдали его “собственный” противоопухолевый эффект. Мы предполагаем, что различия в воздействии соединения OL9-119 – ингибитора TDP1, на карциному Льюис и карциному Кребс-2 могут быть обусловлены как разной чувствительностью модельных опухолей, так и разными способами введения препарата.
Мы провели светооптическое исследование клеток асцитной опухоли Кребс-2, полученных от мышей всех пяти групп. Опухолевые клетки мышей контрольной группы (рис. 3a, б) на полутонких срезах имели округлую форму и диаметр около 15 мкм, цитоплазма клеток была окрашена в ярко-синий цвет и вакуолизирована. Около половины опухолевых клеток содержали в цитоплазме по две–три липидные капли (рис. 3б). Присутствие липидных капель в цитоплазме клеток опухоли Кребс-2 описано ранее [18]. На поверхности всех клеток наблюдались небольшие выросты цитоплазмы. Ядра содержали преимущественно эухроматин, на срезах некоторых клеток выявлялись ядрышки. В образцах отмечены единичные макрофаги со светло-голубой цитоплазмой, вдвое превышающие по размеру опухолевые клетки. Значимых морфологических отличий между опухолевыми клетками мышей контрольной группы и мышей, которым вводили ДМСО, не наблюдалось (снимки не приведены).
Рис. 3.
Клетки асцитной формы опухоли Кребс-2. a, б – Контрольная группа. Стрелками показаны липидные капли в цитоплазме клеток, на поверхности клеток видны выросты цитоплазмы. в – Клетки Кребс-2 после обработки топотеканом, стрелкой показана гигантская клетка. г–е – Клетки после введения топотекана в сочетании с ингибитором TDP1, пространство между клетками заполнено клеточным детритом. Стрелками показаны липидные капли в цитоплазме; на врезке клетка, заполненная липидными каплями. Окраска азуром-2. Длина масштабной линейки в а, г соответствует 50 мкм и 20 мкм в б, в, д, е.
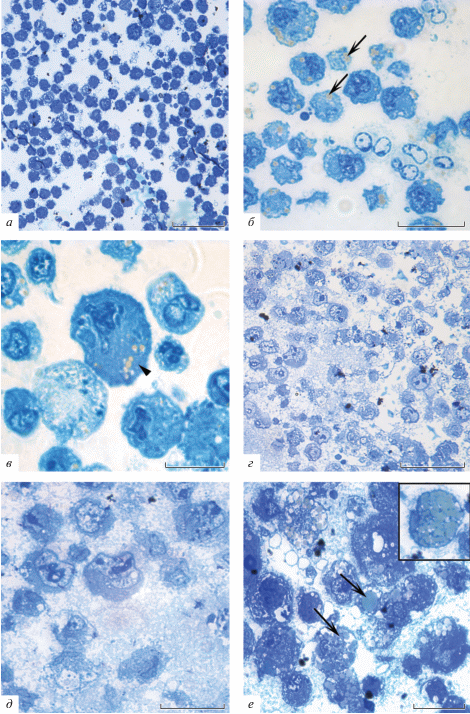
Действие топотекана на опухоль приводило к появлению гигантских клеток (рис. 3в), доля которых составила почти 25% всех клеток в образцах. Диаметр таких клеток достигал 30 мкм, вдвое превышая размер опухолевых клеток контрольной группы. Цитоплазма гигантских клеток окрашена в ярко-синий цвет, вакуолизирована, содержит липидные капли. Ядра крупные, неправильной формы, занимают около трети объема клетки.
Введение мышам ингибитора TDP1 OL9-119, а также топотекана в сочетании с этим ингибитором приводило к разрушению большого количества опухолевых клеток, препараты содержали клеточный детрит, встречались гигантские клетки. При введении комбинации этих двух препаратов (рис. 3г–е) в образцах выявлены клетки, в которых липидные капли занимали практически всю цитоплазму, при 400-кратном увеличении наблюдались две–три таких клетки в поле зрения. Вместе с тем, общее количество клеток с липидными каплями заметно не менялось. Интересно, что введение только OL9-119 не приводило к накоплению липидов в клетках опухоли.
Таким образом, комбинированное введение топотекана и исследуемого ингибитора TDP1 приводило к развитию деструктивных процессов в опухоли, которые выражались в повышенном накоплении клеточного детрита, отсутствовавшего в образцах после введения каждого из препаратов по отдельности.
В научной литературе не опубликовано результатов морфологического изучения асцитной опухоли Кребс-2 при воздействии противоопухолевых препаратов, поэтому мы не можем сопоставить полученные нами данные с результатами других исследователей. Таким образом, нами впервые показаны морфологические изменения клеток Кребс-2, вызванные воздействием только топотекана и топотекана в комбинации с ингибитором TDP1.
Представленные результаты изучения влияния внутрибрюшинного введения in vivo топотекана и ингибитора TDP1 OL9-119 на асцитную форму карциномы Кребс-2 мыши подтверждают ранее полученные нами данные in vitro, которые показывают усиление цитотоксического действия топотекана в комбинации с данным ингибитором TDP1 [14]. Следует подчеркнуть, что наиболее выраженный терапевтический эффект мы наблюдали при совместном применении топотекана с OL9-119. Полученные результаты подтверждают, что соединение OL9-119 – ингибитор TDP1, гидразинотиазольное производное усниновой кислоты – можно считать перспективным для разработки комбинированных противоопухолевых препаратов.
Работа проведена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 17-00-00097 КОМФИ) и Базового проекта ПФНИ ГАН на 2017–2020 гг. (№ АААА-А17-117020210022-4) “Механизмы функционирования систем репарации, транскрипции и трансляции. Патологические процессы, связанные с этими системами” (рук. проекта О.И. Лаврик).
Все эксперименты проведены в соответствии с протоколами, одобренными межинститутской комиссией по биоэтике ИЦиГ СО РАН и директивой 2010/63/EU.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Pommier Y., Leo E., Zhang H.L., Marchand C. (2010) DNA topoisomerases and their poisoning by anticancer and antibacterial drugs. Chem. Biol. 17, 421–433.
Pommier Y. (2006) Topoisomerase I inhibitors: camptothecins and beyond. Nat. Rev. Cancer. 6, 789–802.
Yang S.W., Burgin Jr. A.B., Huizenga B.N., Robertson C.A., Yao K.C., Nash H.A. (1996) A eukaryotic enzyme that can disjoin dead end covalent complexes between DNA and type I topoisomerases. Proc. Natl. Acad. Sci. USA. 93, 11534–11539.
Interthal H., Pouliot J.J., Champoux J.J. (2001) The tyrosyl-DNA phosphodiesterase Tdp1 is a member of the phospholipase D superfamily. Proc. Natl. Acad. Sci. USA. 98, 12009–12014.
Beretta G.L., Cossa G., Gatti L., Zunino F., Perego P. (2010) Tyrosyl-DNA phosphodiesterase 1 targeting for modulation of camptothecin-based treatment. Curr. Med. Chem. 17, 1500–1508.
Zakharenko A., Dyrkheeva N., Lavrik O. (2019) Dual DNA topoisomerase 1 and tyrosyl-DNA phosphodiesterase 1 inhibition for improved anticancer activity. Med. Res. Rev. 39, 1427–1441.
Brettrager E.J., van Waardenburg R.C. (2019) Targeting tyrosyl-DNA phosphodiesterase I to enhance toxicity of phosphodiester linked DNA-adducts. Cancer Drug Resist. 2, 1153–1163.
Comeaux E.Q., van Waardenburg R.C. (2014) Tyrosyl-DNA phosphodiesterase I resolves both naturally and chemically induced DNA adducts and its potential as a therapeutic target. Drug Metab. Rev. 46, 494–507.
Filimonov A.S., Chepanova A.A., Luzina O.A., Zakharenko A.L., Zakharova O.D., Ilina E.S., Dyrkheeva N.S., Kuprushkin M.S., Kolotaev A.V., Khachatryan D.S., Patel J., Leung I.K.H., Chand R., Ayine-Tora D.M., Reynisson J., Volcho K.P., Salakhutdinov N.F., Lavrik O.I. (2019) New hydrazinothiazole derivatives of usnic acid as potent Tdp1 inhibitors. Molecules. 24, 3711.
Luzina O., Filimonov A., Zakharenko A., Chepanova A., Zakharova O., Ilina E., Dyrkheeva N., Likhatskaya G., Salakhutdinov N., Lavrik O. (2020) Usnic acid conjugates with monoterpenoids as potent tyrosyl-DNA phosphodiesterase 1 inhibitors. J. Nat. Prod. 83, 2320–2329.
Salomatina O.V., Popadyuk I.I., Zakharenko A.L., Zakharova O.D., Fadeev D.S., Komarova N.I., Reynisson J., Arabshahi H.J., Chand R., Volcho K.P., Salakhutdinov N.F., Lavrik O.I. (2018) Novel semisynthetic derivatives of bile acids as effective tyrosyl-DNA phosphodiesterase 1 inhibitors. Molecules. 23, 679.
Li-Zhulanov N.S., Zakharenko A.L., Chepanova A.A., Patel J., Zafar A., Volcho K.P., Salakhutdinov N.F., Reynisson J., Leung I.K.H., Lavrik O.I. (2018) A novel class of tyrosyl-DNA phosphodiesterase 1 inhibitors that contains the octahydro-2H-chromen-4-ol scaffold. Molecules. 23, 2468.
Luzina O.A, Salakhutdinov N.F. (2018) Usnic acid and its derivatives for pharmaceutical use: a patent review (2000–2017). Expert. Opin. Ther. Pat. 28, 477–491.
Zakharenko A.L., Luzina O.A., Sokolov D.N., Kaledin V.I., Nikolin V.P., Popova N.A., Patel J., Zakharova O.D., Chepanova A.A., Zafar A., Reynisson J., Leung E., Leung I.K.H., Volcho K.P., Salakhutdinov N.F., Lavrik O.I. (2019) Novel tyrosyl-DNA phosphodiesterase 1 inhibitors enhance the therapeutic impact of topotecan on in vivo tumor models. Eur. J. Med. Chem. 161, 581–593.
Zakharenko A., Luzina O., Koval O., Nilov D., Gushchina I., Dyrkheeva N., Švedas V., Salakhutdinov N., Lavrik O. (2016) Tyrosyl-DNA phosphodiesterase 1 inhibitors: usnic acid enamines enhance the cytotoxic effect of camptothecin. J. Nat. Prod. 79, 2961–2967
Zakharova O., Luzina O., Zakharenko A., Sokolov D., Filimonov A., Dyrkheeva N., Chepanova A., Ilina E., Ilyina A., Klabenkova K., Chelobanov B., Stetsenko D., Zafar A., Eurtivong C., Reynisson J., Volcho K., Salakhutdinov N., Lavrik O. (2018) Synthesis and evaluation of aryliden- and hetarylidenfuranone derivatives of usnic acid as highly potent Tdp1 inhibitors. Bioorg. Med. Chem. 26, 4470–4480.
Колдышева Е.В., Меньщикова А.П., Лушникова Е.Л., Попова Н.А., Каледин В.И., Николин В.П., Захаренко А.Л., Лузина О.А., Салахутдинов Н.Ф., Лаврик О.И. (2018) Антиметастатическая активность комбинации топотекана и ингибитора тирозил-ДНК-фосфодиэстеразы 1 на модели карциномы легкого Льюис. Бюлл. Эксп. Биол. Мед. 166, 609–615.
Kirikovich S.S., Taranov O.S., Omigov V.V., Potter E.A., Dolgova E.V., Proskurina A.S., Efremov Y.R., Bogachev S.S. (2019) Ultrastructural analysis of the Krebs-2 ascites cancer cells treated with extracellular double-stranded DNA preparation. Ultrastruct. Pathol. 43, 56–65.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология