Молекулярная биология, 2021, T. 55, № 3, стр. 392-401
Паттерны экспрессии p53 и Ki-67 при HBV-ассоциированной гепатоцеллюлярной карциноме: количественная ПЦР в реальном времени и иммуногистохимическое исследование
Z. Heidari a, b, B. Moudi a, b, *, H. Mahmoudzadeh-Sagheb a, b
a Infectious Diseases and Tropical Medicine Research Center, Resistant Tuberculosis Institute,
Zahedan University of Medical Sciences
9816743111 Zahedan, Iran
b Department of Histology, School of Medicine, Zahedan University of Medical Sciences
9816743463 Zahedan, Iran
* E-mail: bita.moudi@yahoo.com
Поступила в редакцию 02.05.2020
После доработки 27.07.2020
Принята к публикации 05.08.2020
Аннотация
Гепатоцеллюлярная карцинома (ГЦК), развивающаяся на фоне хронической инфекции вируса гепатита B (HBV), ‒ широко распространенное в мире злокачественное заболевание печени, имеющее неблагоприятный прогноз. Для успешного лечения ГЦК необходима точная диагностика. Целью исследования была оценка взаимосвязи между уровнями экспрессии определенных молекулярных маркеров и диагнозом ГЦК в образцах ткани больных из Ирана. Проанализированы уровни экспрессии генов и белков p53 и Ki-67 в тканях печени 121 пациента с ГЦК и/или HBV, а также 30 здоровых доноров. Для этого использованы методы количественной ПЦР в реальном времени и иммуногистохимии. Выявлены повышенные уровни экспрессии как p53, так и Ki-67 у пациентов с ГЦК на фоне хронической HBV-инфекции по сравнению с пациентами только с HBV, что указывает на наличие связи между уровнями экспрессии p53 и Ki-67 и диагнозом ГЦК. Показано, что как прогностический маркер для диагностики ГЦК уровень экспрессии р53 ‒ более достоверный и чувствительный параметр, чем Ki-67 (чувствительность и специфичность составили для p53 77.3 и 76.4% и для Ki-67 51.0 и 97.9%). Диагностическая панель с двумя позитивными маркерами имела более высокую специфичность и сопоставимую чувствительность с панелями, оценивающими экспрессию только из этих маркеров (чувствительность и специфичность соответствовали 94.8 и 97.9% для двух положительных маркеров и 96.5 и 86.4% для одного положительного маркера). В целом, комбинированный анализ экспрессии p53 и Ki-67 позволяет повысить специфичность и чувствительность диагностики HBV-ассоциированной ГЦК до приемлемого уровня.
ВВЕДЕНИЕ
Гепатоцеллюлярная карцинома (ГЦК) широко распространена в мире и является злокачественным новообразованием печени с неблагоприятным прогнозом [1]. Это онкологическое заболевание обычно диагностируют поздно ‒ когда ответ пациента на лечение и шансы на выживание низкие.
Хронические заболевания печени считаются основными причинами развития ГЦК и одной из важнейших причин смерти от рака [1]. Хронические вирусные инфекции, такие как вирус гепатита B (HBV) и C (HCV), могут провоцировать развитие ГЦК через многоступенчатые механизмы канцерогенеза. ДНК HBV может интегрироваться в геном хозяина и вызывать хромосомные перестройки и мутации [2]. Также при ГЦК воспалительные клетки вызывают окислительный стресс и хроническое повреждение печени, что приводит к образованию опухолей и канцерогенезу в гепатоцитах [3‒5]. HBV-инфекция имеет две формы: острую и хроническую [6]. Хроническая форма может привести к развитию тяжелых заболеваний, таких как цирроз печени и ГЦК [7]. По меньшей мере 200 млн. человек в мире страдает хронической HBV-инфекцией и почти две трети из них проживает в Азии. Двадцать пять процентов этих пациентов обычно умирает от HBV-ассоциированного онкологического заболевания [8, 9].
На процесс канцерогенеза сильно влияет пролиферация клеток [10]. Экспрессия гена TP53, кодирующего белок р53, как онкосупрессора гепатоканцерогенеза достаточно хорошо изучена [11]. Белок р53 контролирует репарацию ДНК, пролиферацию клеток и апоптоз [12], а его мутации могут приводить к образованию и прогрессии опухоли [13]. Действительно, p53 дикого типа (wt) ‒ онкосупрессор, тогда как у мутированной формы доминируют онкогенные свойства. Белок wt-p53 характеризуется низким уровнем экспрессии и имеет короткий период полужизни, что затрудняет его детекцию иммуногистохимическими методами в нормальных условиях [14]. Ряд стрессовых факторов может повышать продукцию и стабильность wt-p53 или синтез мутантной формы p53 с более длительным периодом полужизни. В этих условиях облегчается детекция белка методом иммуноокрашивания [15]. Мутации в гене TP53 обнаружены в тканях ГЦК человека [16]. Частота выявления этих мутаций коррелирует с определенными факторами, такими как географические, а также гистологическим классом и размером опухоли [16]. В тоже время повышенная продукция белка р53 у пациентов с ГЦК не всегда связана с наличием мутаций [17]. Однако рак, связанный с дефицитом р53, чрезвычайно агрессивен и летален и, к сожалению, не поддается химиотерапии [18].
Белок Ki-67 представляет собой ядерный антиген и молекулярный маркер пролиферации раковых клеток. Этот белок детектируют на всех фазах клеточного цикла [19]. Его экспрессию (ген MKI67) исследуют при изучении пролиферации злокачественных опухолевых клеток и используют как прогностический маркер при раке простаты, молочной железы, легкого [20] и колоректальной аденокарциноме [10, 11]. Однако уровень экспрессии Ki-67 не имеет прогностического значения при раке шейки матки [20] и раке поджелудочной железы [21]. Обнаружено, что экспрессия Ki-67 при ГЦК и раннем рецидиве заболевания коррелирует со скоростью роста опухоли [22, 23]. Следовательно, он может быть ценным маркером при изучении регенерации печени, процессов канцерогенеза и естественного течения ГЦК.
Целью исследования была оценка взаимосвязи между паттернами экспрессии молекулярных маркеров p53 и Ki-67 и наличием HBV-ассоциированной гепатоцеллюлярной карциномы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пациенты. Свежие биоптаты печени были получены от 121 пациента из Ирана, в том числе 40 пациентов только с хронической HBV-инфекцией, 41 пациент с ГЦК на ранних стадиях в отсутствие HBV-инфекции (единичная опухоль <5 см без сосудистой инвазии), 40 пациентов с ГЦК на фоне HBV-инфекции и 30 здоровых волонтеров с нормальным уровнем АЛТ и отсутствием в анамнезе ГЦК, HBV- и HCV-инфекции. Образцы ткани печени были собраны в двух больницах Ирана (Namazi Hospital и Shaheed Labbafinezhad Hospital) в период с сентября 2015 г. по май 2016 г. Каждый образец делили на две части. Одну часть образца замораживали при ‒80°C для проведения молекулярно-генетического исследования, а другую хранили в растворе формалина для проведения иммуногистохимического анализа. Гистологический диагноз ГЦК был поставлен в соответствии с международными критериями [24]. У всех пациентов с HBV был выявлен HBsAg. Исследование проведено в Захеданском университете медицинских наук (Zahedan University of Medical Sciences; ZAUMS) после получения информированного согласия от всех участников. Комитет по этике ZAUMS одобрил исследование (№ 7262).
Количественная ОТ-ПЦР. Выделение РНК проводили по методике, описанной нами ранее [25]. Экстрагированную РНК замораживали при ‒80°C для дальнейшего молекулярного анализа. После количественной и качественной оценки препарат выделенной РНК использовали для синтеза кДНК с помощью набора для двухэтапной ОТ-ПЦР (“Vivantis Technologies”, Малайзия), как описано ранее [25]. В табл. 1 приведены последовательности праймеров, использованных для оценки уровней экспрессии генов-мишеней (TP53 и MKI67) и контрольного гена (GAPDH). Метод ${{2}^{{ - {{{\text{C}}}_{{\text{T}}}}}}}$ [26] использовали для определения относительного количества копий и подсчета экспрессии гена по сравнению с контролем. Каждую реакцию проводили в двух технических повторах, и для каждого образца рассчитывали значение ∆∆CT.
Таблица 1.
Олигонуклеотиды, использованные в работе
| Ген | Последовательностьа, 5' → 3' | Размер ампликона, п.о. |
|---|---|---|
| MKI67 | F: TGAACCTGCGGAAGAGCTGAA | 102 |
| R: GAGCGCAGGGATATTCCCTTA | ||
| P: GACATGAAAACCAACAAAGAGGAAC | ||
| TP53 | F: TGTAACAGTTCCTGCATGGGC | 121 |
| R: GACAGGCACAAACACGCACC | ||
| P: CGGAGGCCCATCCTCACCATC | ||
| GAPDH (внутренний контроль) | F: CATGAGAAGTATGACAACAGCC | 70 |
| R: GGGGTGCTAAGCAGTTGGTG | ||
| P: CATCAGCAATGCCTCCTGCACC |
Иммуногистохимическое исследование. Депарафинизированные срезы гидратировали в серии градиентных растворов этанола. Раствор H2O2 использовали для дезактивации эндогенной пероксидазы. Для демаскировки антигена использовали автоклавирование и обработку Na-цитратным буфером (10 мM) при 120°C в течение 20 мин. Иммуноокрашивание проводили моноклональными антителами к p53 и Ki-67 (NCL-L-p53-DO7 и NCL-L-Ki-67-MM1; “Leica Biosystems”, США), как описано ранее [25, 27]. Образцы рака толстой кишки и ткань аппендикса использовали в качестве положительного контроля экспрессии p53 и Ki-67 соответственно. Предметные стекла были закодированы. Рассчитывали интенсивность окрашивания, процент положительных клеток и затем уровни экспрессии биомаркеров. Двумя экспертами-гистологами на основе интенсивности окрашивания и процента положительных клеток на слайдах были получены индексы биомаркеров (biomarker labeling indices). При этом на каждом срезе случайным образом выбирали 10 полей (в среднем 500 гепатоцитов). Картина окрашивания для p53 и Ki-67 свидетельствовала о ядерной локализации белков. В серию срезов всегда включали внешние положительные контроли. Положительные клетки подсчитывали в последовательных полях с большим увеличением (×400) и результаты выражали как среднее число положительных клеток на площадь поверхности. Плотность окрашивания оценивали следующим образом: отсутствие окрашивания или менее 5% окрашенных клеток, слабое окрашивание (менее 5‒25%), умеренное (25‒75%) и сильное (более 75%) [28]. Интенсивность окрашивания оценивали от 0 до 3 (0 ‒ отсутствие, 1 ‒ слабое, 2 ‒ умеренное и 3 ‒ сильное).
Статистический анализ. В исследовании использовали программный пакет SPSS 20. Расчеты выполняли с помощью непараметрических методов Манна‒Уитни, точного теста Фишера, однофакторного дисперсионного анализа, апостериорных критериев Бонферрони и критерия χ2 с учетом P < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследуемая группа состояла из 30 здоровых индивидов (контрольная группа, C) и 121 пациента (только инфекция HBV – 40, только ГЦК – 41, ГЦК на фоне HBV – 40). Демографические и клинические данные 4 групп представлены в табл. 2. Значительные различия между четырьмя группами по возрасту и полу отсутствовали (P > 0.05).
Таблица 2.
Демографические и клинические данные
| Параметры | C, N (%)a | HBV, N (%) | ГЦК, N (%) | HBV+ГЦК, N (%) |
P/Fb |
|---|---|---|---|---|---|
| Возраст (лет) | |||||
| Средний возраст | 33.00 ± 6.22 | 53.85 ± 9.58 | 55.44 ± 10.31 | 57.13 ± 9.82 | 0.161/1.740 |
| Диапазон возрастов | 37‒61 | 31‒71 | 30‒72 | 37‒72 | |
| (медиана) | (51.50) | (58) | (56) | (59) | |
| Пол | |||||
| М | 24 (80.0) | 28 (70.0) | 32 (78.0) | 29 (72.5) | 0.738/0.413 |
| Ж | 6 (20.0) | 12 (30.0) | 9 (22.0) | 11 (27.5) | |
| Гепатоцеллюлярная карцинома | |||||
| Высоко- или умереннодифференцированная | ‒ | ‒ | 37 (90.2) | 35 (87.5) | |
| Низкодифференцированная | 4 (9.8) | 5 (12.5) | |||
| Гистологическая степень злокачественности ГЦК: | |||||
| Ранняя | ‒ | ‒ | 39 (95.1) | 38 (95.0) | |
| G1 | 1 (2.4) | 2(5.0) | |||
| G2‒G3 | 1 (2.4) | 0 | |||
| Билирубин (мкМ) | 15.43 ± 5.65 | 18.76 ± 6.75 | 28.45 ± 12.24 | 33.10 ± 11.77 | |
| АЛТ (U/л) | 26.23 ± 10.90 | 45.76 ± 32.03 | 88.25 ± 95.32 | 117.76 ± 102.54 | |
| α-Фетопротеин (нг/мл) | 2.12 ± 1.14 | 3.12 ± 2.79 | 421.21 ± 104.33 | 534.54 ± 420.76 | |
| Уровень ДНК HBV в сыворотке (cреднее, lg(IU/мл) (1SD)c | ‒ | 7.6 ± 0.8 | ‒ | 7.8 ± 0.1 | |
| HBsAg-позитивные | ‒ | 40 (100.0) | ‒ | 40 (100.0) | |
| HBeAg-позитивные | ‒ | 12 (30.0) | ‒ | 15 (37.5) |
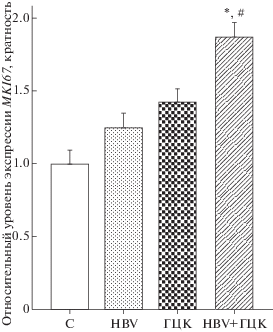
С целью определить взаимосвязь между биомаркерами p53 и Ki-67 и ГЦК мы изучили их экспрессию в четырех группах пациентов. Между группами наблюдались значительные различия (рис. 1 и 2). У пациентов с HBV, ГЦК и ГЦК на фоне HBV (HBV+ГЦК) выявлены более высокие уровни относительной экспрессии гена TP53 по сравнению с контрольной группой (4.50 ± 1.24, 6.10 ± 1.34, 11.00 ± 1.42, 1.00 ± 1.22 соответственно; P < 0.001). В частности, пациенты с ГЦК на фоне HBV имели повышенные уровни экспрессии TP53 по сравнению с пациентами с хронической инфекцией HBV (P < 0.001). Более того, у пациентов с HBV, ГЦК и ГЦК на фоне HBV зарегистрированы повышенные относительные уровни экспрессии гена MKI67 по сравнению с контрольной группой (1.26 ± 0.34, 1.42 ± 0.63, 1.87 ± 0.94, 1.00 ± ± 0.32 соответственно; P < 0.001). Кроме того, у пациентов с ГЦК на фоне HBV выявлены более высокие уровни экспрессии гена MKI67 чем у пациентов, инфицированных HBV (P < 0.001).
Рис. 1.
Относительная экспрессия мРНК р53. Между группами наблюдались существенные различия. У пациентов с ГЦК на фоне HBV-инфекции (HBV+ГЦК) уровень экспрессии TP53 повышен по сравнению с HBV-инфицированными пациентами и контрольной группой (С). Уровень экспрессии TP53 в контрольной группе принят за единицу. #P < 0.001 по сравнению с контрольной группой; *P < 0.001 по сравнению с группой HBV.
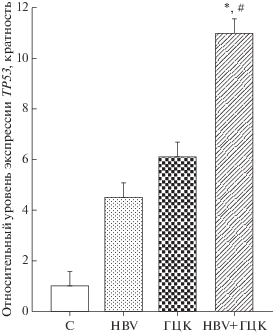
Рис. 2.
Относительная экспрессия мРНК Ki-67. Между группами наблюдались значительные различия. У пациентов с HBV+ГЦК повышен уровень экспрессии MKI67 по сравнению с HBV-инфицированными пациентами и контрольной группой (C). Уровень экспрессии MKI67 в контрольной группе принят за единицу. #P < 0.001 по сравнению с контрольной группой; *P < 0.001 по сравнению с группой HBV.
Результаты иммуногистохимического исследования экспрессии биомаркеров в четырех группах приведены в табл. 3. В этом исследовании положительными считали образцы, где была выявлена ядерная локализация р53 и Ki-67. У пациентов с HBV+ГЦК экспрессия p53 и Ki-67 была значительно выше, чем у пациентов, инфицированных HBV, или больных ГЦК другой этиологии.
Таблица 3.
Результаты иммуногистохимического окрашивания срезов ткани печени пациентов антителами к биомаркерам
| Группа | Число образцов | p53-положительные клетки (среднее ± SEM) |
P a | Ki-67-положительные клетки (среднее ± SEM) |
P a |
|---|---|---|---|---|---|
| C | 30 | 1.43 ± 0.62 | <0.001 | 9.26 ± 2.06 | <0.001 |
| HBV | 40 | 3.75 ± 1.23 | 10.85 ± 1.90 | ||
| ГЦК | 41 | 5.07 ± 1.48 | 12.21 ± 1.86 | ||
| HBV + ГЦК | 40 | 8.20 ± 2.54a | 16.02 ± 1.87a |
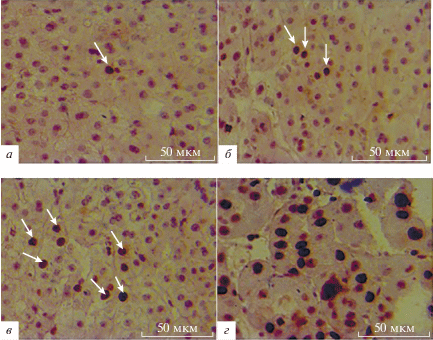
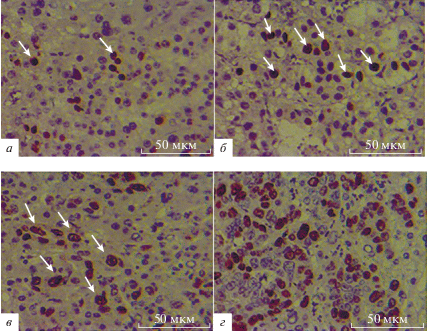
На рисунках 3а‒3г и 4а‒4г показаны результаты иммуногистохимического исследования. У пациентов с HBV+ГЦК экспрессия биомаркеров (как p53, так и Ki-67) была значительно выше, чем у пациентов, инфицированных HBV, или больных ГЦК, образовавшейся в отсутствие вирусной инфекции.
Рис. 3.
Экспрессия p53 в тканях печени пациентов из групп C (а), HBV (б), ГЦК (в), HBV+ГЦК (г) (окрашивание иммунопероксидазой, увеличение ×400). Локализация р53 в ядрах гепатоцитов показана стрелками.
Результаты по специфичности и чувствительности обнаружения ГЦК с использованием комбинации двух положительных биомаркеров приведены в табл. 4. Когда хотя бы один маркер был положительным, независимо от того, какой именно, чувствительность, специфичность, а также положительное и отрицательное прогностические значения составляли 96.5, 86.4, 90.0 и 94.5% соответственно. Когда оба маркера были положительными, эти показателя соответствовали 94.8, 97.9, 96.3 и 56.9%. Таким образом, специфичность и положительное прогностическое значение этой комбинации были заметно выше. Это значит, что комбинация из двух маркеров способствует более точной диагностике ГЦК на ранней стадии по сравнению с панелью для анализа только одного маркера.
Таблица 4.
Чувствительность, специфичность, а также положительные и отрицательные прогностические значения, полученные при использовании для диагностики ГЦК панелей с одним или двумя биомаркерамиа
| Панель | Чувствитель-ность, % | Специ-фичность, % | PPV, % | NPV, % | LR+ | LR‒ |
|---|---|---|---|---|---|---|
| Один маркер: | ||||||
| p53 | 77.3 | 76.4 | 82.5 | 75.8 | 4.21 | 0.30 |
| Ki-67 | 51.0 | 97.9 | 98.4 | 63.7 | 47.2 | 0.70 |
| Два маркера: | ||||||
| Как минимум один положительный маркер | 96.5 | 86.4 | 90.0 | 94.5 | 6.8 | 0.04 |
| Оба маркера положительные | 94.8 | 97.9 | 96.3 | 56.9 | 31.20 | 0.71 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хронические заболевания печени, в особенности хронический гепатит и цирроз, считаются основными причинами развития ГЦК. По этой причине прогрессирование этих заболеваний необходимо предотвращать до возникновения ГЦК, что до сих пор остается проблемой глобального масштаба. Учитывая, что существует взаимосвязь между инфекцией вирусами гепатита и ГЦК, исследования хронических заболеваний печени имеют первостепенное значение. Наиболее эффективный способ снизить заболеваемость раком ‒ это ранняя диагностика. Гистологические изменения, вызванные развитием ГЦК, различаются у разных пациентов, что создает значительные сложности при диагностике. Следовательно, необходимы точные методы выявления ГЦК на ранней стадии.
В проведенном нами исследовании показано, что у пациентов с HBV+ГЦК повышена экспрессия p53 и Ki-67 по сравнению с пациентами, инфицированными HBV. Следовательно, эти биомаркеры могут быть использованы для выявления HBV-ассоциированной ГЦК на ранних стадиях. Данные по экспрессии генов TP53 и MKI67, по-видимому, могут указывать на риск развития рака у людей, инфицированных HBV, так как уровни экспрессии этих генов коррелируют со стадиями процесса канцерогенеза и значительно повышены у пациентов с HBV+ГЦК. Следует отметить, что Ki-67 как маркер оказался более специфичным и менее чувствительным, чем р53. В тоже время одновременное тестирование на оба биомаркера позволяет повысить специфичность и чувствительность диагностики ГЦК до приемлемых уровней. Важно отметить, что использование комбинации p53 и Ki-67 вместо одного из этих биомаркеров позволит повысит точность диагностики ГЦК и тем самым оптимизировать схему терапии.
В этом исследовании, проанализировав экспрессию двух онкомаркеров: p53 и Ki-67, ‒ мы оценили риск развития ГЦК у пациентов, инфицированных HBV. Ранее показано, что более чем в половине известных случаев рака белок р53 детектируется в следовых количествах [29]. Генетические мутации, а также структурные или функциональные изменения белка p53 считаются основными причинами рака печени [30]. Заболеваемость ГЦК варьирует в разных географических регионах от 10 до 60%. В опухолях высокой степени злокачественности выявляют повышенный уровень p53 [31]. Иммуногистохимия ‒ один из лучших способов определения уровня p53 при ГЦК, что, вероятно, связано с присутствием мутантного белка p53 [32].
Выявленные в данной работе уровни экспрессии p53 в группах HBV+ГЦК и ГЦК, в целом, согласуются с данными других авторов [33]. В образцах от пациентов из группы HBV+ГЦК зарегистрированы более высокие уровни экспрессии p53, чем в группах HBV и ГЦК. Обнаружена статистически значимая разница между пациентами с HBV-ассоциированной ГЦК на ранних стадиях и больными хронической HBV-инфекцией. На основании этих данных можно сделать вывод, что p53 может быть использован для идентификации HBV-инфицированных пациентов с предрасположенностью к развитию ГЦК. Эти результаты согласуются с данными Chen Ban и др. [34], полученными в Китае, Waleed и др. [28] и Zekri и др. [35], полученными в Египте, и Koskinas и др. [36], полученными в Греции. Однако наши результаты отличаются от данных исследования Boix-Ferroro и соав. [37], выполненного на населении Испании, где в HBV-ассоциированных гепатокарциномах были выявлены пониженные уровни экспрессии р53. Расхождения в результатах могут быть обусловлены различными факторами, в том числе различной чувствительностью используемых в иммуногистохимическом анализе моноклональных антител; маскированием распознаваемых антителами эпитопов p53, различными пороговыми значениями при проведении количественной ПЦР, мутациями и однонуклеотидными полиморфизмами в TP53, а также использованием различных канцерогенов [31, 38]. Любой из этих факторов может быть причиной несовпадения результатов при оценке экспрессии p53 разными группами исследователей.
Нами показано, что у пациентов с HBV+ГЦК и только с ГЦК повышены уровни экспрессии гена и белка Ki-67 по сравнению с HBV-инфицированными пациентами без ГЦК, а также здоровыми волонтерами из контрольной группы. Ранее сообщалось, что экспрессия Ki-67 значительно повышена в метастазах в печени, и был сделан вывод, что этот белок может быть использован для изучения естественного течения онкологического заболевания на поздних стадиях [39]. Нами обнаружено, что экспрессия Ki-67 постепенно увеличивается с прогрессированием заболевания печени до ГЦК. Выявлена статистически значимая разница в экспрессии Ki-67 между образцами от больных гепатитом B и HBV-ассоциированной ГЦК. Более того, в образцах, взятых от пациентов из обеих групп с ГЦК (HBV+ГЦК и ГЦК), детектировали повышенный уровень Ki-67 по сравнению с образцами от больных из группы HBV. На основании этих результатов можно сделать вывод, что Ki-67 следует рассматривать как возможный биомаркер для выявления естественного течения ГЦК у пациентов с хронической HBV-инфекцией.
Рис. 4.
Экспрессия Ki-67 в тканях печени пациентов из групп C (а), HBV (б), ГЦК (в), HBV+ГЦК (г) (окрашивание иммунопероксидазой, увеличение ×400). Локализация Ki-67 в ядрах гепатоцитов показана стрелками.
Нами показано, что экспрессия p53 и Ki-67 выше в образцах больных HBV+ГЦК по сравнению с больными ГЦК без HBV-инфекции в анамнезе. Ранее сообщалось, что использование комбинаций различных биомаркеров позволяет повысить точность диагностики [40]. Это подтверждено нами на примере двух биомаркеров: p53 и Ki-67. Нами показано, что экспрессия p53 и Ki-67 выше в образцах больных HBV+ГЦК по сравнению с больными ГЦК без HBV-инфекции в анамнезе. Их одновременное определение позволило повысить специфичность и чувствительность выявления ГЦК и довести точность диагностики ГЦК до приемлемого уровня. В том случае, когда экспрессия обоих маркеров по данным иммуногистохимического исследования была положительной (++), чувствительность и специфичность составляли 94.8 и 97.9% соответственно. Следует заметить, что на панели с одним положительным маркером (+) показатели чувствительности были лучше (96.5%), а специфичности – хуже. Это указывает на то, что наличие как минимум двух положительных маркеров может повысить надежность диагностики ГЦК. Кроме того, правильная комбинация маркеров (p53 и Ki-67) на панели с двумя (++) и одним (+ –) положительным маркером, по-видимому, позволит улучшить как специфичность, так и чувствительность диагностики ГЦК по сравнению с тестированием на один маркер.
Учитывая, что образцы, использованные в этом исследовании, взяты у больных на ранних стадиях онкологического процесса, можно надеяться, что панель пригодна для диагностики трудноизлечимых и дифференцированных поражений у пациентов, инфицированных HBV.
Применимость результатов исследования может быть ограничена из-за размера выборки. Использование выборки бóльшего размера в когортном исследовании, проведенном несколькими научными центрами, позволит уточнить роль p53 и Ki-67 в канцерогенезе.
ЗАКЛЮЧЕНИЕ
На основании полученных результатов можно говорить о наличии корреляции между экспрессией p53 и Ki-67 и развитием HBV-ассоциированной ГЦК. Эти два биомаркера могут быть использованы для выявления ГЦК на ранних стадиях, в особенности у HBV-инфицированных индивидов. Одновременное применение этих биомаркеров позволит сделать правильный выбор схемы терапии для лечения злокачественных новообразований печени на разных стадиях. Из-за высокой распространенности гепатитов и ГЦК в различных популяциях необходимы дополнительные исследования для оценки эффективности предложенной модели на других этнических группах.
Авторы благодарят Elizabeth McConchie за редактирование статьи на английском языке. Авторы выражают благодарность всем участникам исследования (№7262, IR.ZAUMS.REC.1394.211).
Исследование поддержано диссертационным грантом (№ 7262) от заместителя декана по научной работе Zahedan University of Medical Sciences.
Работа одобрена Комитетом по этике Zahedan University of Medical Sciences (№7262, IR.ZAUMS.REC.1394.211), в рамках которого проводилась работа, и соответствует положениям Хельсинкской декларации. Информированное согласие получено от всех участников.
Все авторы участвовали в разработке концепции и дизайна исследования, подготовке материалов, сборе и анализе данных, а также в написании рукописи. Все авторы прочитали, отредактировали и одобрили окончательную рукопись.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Ferenci P., Fried M., Labrecque D., Bruix J., Sherman M., Omata M., Heathcote J., Piratsivuth T., Kew M., Oteg-bayo J.A., Zheng S.S., Sarin S., Hamid S., Modawi S.B., Fleig W., Fedail S., Thomson A., Khan A., Malfertheiner P., Lau G., Carillo F.J., Krabshuis J., Le Mair A. (2010) World Gastroenterology Organisation Guideline. Hepatocellular carcinoma (HCC): a global perspective. J. Gastrointestin. Liver Dis. 19(3), 311–317.
Matsubara K., Tokino T. (1990) Integration of hepatitis B virus DNA and its implications for hepatocarcinogenesis. Mol. Biol. Med. 7(3), 243–260.
Maeda S., Kamata H., Luo J.L., Leffert H., Karin M. (2005) IKKbeta couples hepatocyte death to cytokine-driven compensatory proliferation that promotes chemical hepatocarcinogenesis. Cell. 121(7), 977‒990.
Moudi B., Heidari Z., Mahmoudzadeh-Sagheb H. (2019) Meta-analysis and systematic review of prognostic significance of Glypican-3 in patients with hepatitis B-related hepatocellular carcinoma. Virus Dis. 30(2), 193‒200.
Moudi B., Heidari Z., Mahmoudzadeh-Sagheb H. (2018) Study of liver in HBV-related hepatocellular carcinoma: stereology shows quantitative differences in liver structure. Eur. J. Histochem. 62(3), 238‒246.
Heidari Z., Moudi B., Mahmoudzadeh-Sagheb H., Hashemi M. (2016) The correlation between interferon lambda 3 gene polymorphisms and susceptibility to hepatitis B virus infection. Hepat. Mon. 16(3), e34266. https://doi.org/10.5812/hepatmon.34266
Moudi B., Heidari Z., Mahmoudzadeh-Sagheb H., Hashemi M. (2016) Gene polymorphisms of macrophage migration inhibitory factor affect susceptibility to chronic hepatitis B virus infection in an Iranian cohort. Microbiol. Immunol. 60(6), 390‒396.
Moudi B., Heidari Z., Mahmoudzadeh-Sagheb H. (2016) Impact of host gene polymorphisms on susceptibility to chronic hepatitis B virus infection. Infect. Genet. Evol. 44, 94‒105.
Alavian S.M., Haghbin H. (2016) Relative importance of hepatitis B and C viruses in hepatocellular carcinoma in EMRO Countries and the Middle East: a systematic review. Hepat. Mon. 16(3), e35106. https://doi.org/10.5812/hepatmon.35106
Heidari Z., Mahmoudzadeh-Sagheb H., Charkhat Gorgich E.A. (2017) Immunohistochemical expression of P16ink4a in colorectal adenocarcinoma compared to adenomatous and normal tissue samples: a study on Southeast Iranian samples. Iran Red Crescent Med. J. 19(6), e15174. https://doi.org/10.5812/ircmj.15174
Mahmoudzadeh Sagheb H., Heidari Z., Jahantigh M., Narouei M. (2016) Immunohistochemical expression of p53 and Ki-67 genes in gastric cancer and precance-rous lesions in the patients with Helicobacter pylori infection. Gene Cell Tissue. 3(4), e41341. https://doi.org/10.17795/gct-41341
Yang H.W., Chung M., Kudo T., Meyer T. (2017) Competing memories of mitogen and p53 signalling control cell-cycle entry. Nature. 549(7672), 404‒408.
Cox L.S., Lane D.P. (1995) Tumour suppressors, kinases and clamps: how p53 regulates the cell cycle in response to DNA damage. Bioessays. 17(6), 501‒508.
Porter P.L., Gown A.M., Kramp S.G., Coltrera M.D. (1992) Widespread p53 overexpression in human malignant tumors. An immunohistochemical study using methacarn-fixed, embedded tissue. Am. J. Pathol. 140(1), 145‒153.
Attallah A.M., Shiha G.E., Ismail H., Mansy S.E., El-Sherbiny R., El-Dosoky I. (2009) Expression of p53 protein in liver and sera of patients with liver fibrosis, liver cirrhosis or hepatocellular carcinoma associated with chronic HCV infection. Clin. Biochem. 42(6), 455‒461.
Tannapfel A., Wasner M., Krause K., Geissler F., Katalinic A., Hauss J., Mossner J., Engeland K., Wittekind C. (1999) Expression of p73 and its relation to histopathology and prognosis in hepatocellular carcinoma. J. Natl. Cancer Inst. 91(13), 1154‒1158.
Kang Y.K., Kim C.J., Kim W.H., Kim H.O., Kang G.H., Kim Y.I. (1998) p53 mutation and overexpression in hepatocellular carcinoma and dysplastic nodules in the liver. Virchows Arch. 432(1), 27‒32.
Li J.Q., Zhang C.Q., Zhang Y.Q., Yuan Y.F., Chen M.S., Li G.H. (1996) Immunohistochemical study of PCNA and p53 in primary liver cancer ‒ an implication for prognosis and treatment. J. Exp. Clin. Cancer Res. 15, 77‒80.
Guzman G., Alagiozian-Angelova V., Layden-Almer J.E., Layden T.J., Testa G., Benedetti E., Kajdacsy-Balla A., Cotler S.J. (2005) p53, Ki-67, and serum alpha feto-protein as predictors of hepatocellular carcinoma recurrence in liver transplant patients. Mod. Pathol. 18(11), 1498‒1503.
Graflund M., Sorbe B., Karlsson M. (2002) MIB-1, p53, bcl-2, and WAF-1 expression in pelvic lymph nodes and primary tumors in early stage cervical carcinomas: correlation with clinical outcome. Int. J. Oncol. 20(5), 1041‒1047.
Stanton K.J., Sidner R.A., Miller G.A., Cummings O.W., Schmidt C.M., Howard T.J., Wiebke E.A. (2003) Ana-lysis of Ki-67 antigen expression, DNA proliferative fraction, and survival in resected cancer of the pancreas. Am. J. Surg. 186(5), 486‒492.
Stroescu C., Dragnea A., Ivanov B., Pechianu C., Herlea V., Sgarbura O., Popescu A., Popescu I. (2008) Expression of p53, Bcl-2, VEGF, Ki67 and PCNA and prognostic significance in hepatocellular carcinoma. J. Gastrointestin. Liver Dis. 17(4), 411‒417.
Nakanishi K., Sakamoto M., Yamasaki S., Todo S., Hirohashi S. (2005) Akt phosphorylation is a risk factor for early disease recurrence and poor prognosis in hepatocellular carcinoma. Cancer. 103(2), 307‒312.
Gibson J.B., Sobin L.H. (1978) Histological typing of tumors of the liver, biliary tract and pancreas. Series: International histological classification of tumors number, no. 20. Geneva: World Health Organization, 12‒30.
Moudi B., Heidari Z., Mahmoudzadeh-Sagheb H., Alavian S.M., Lankarani K.B., Farrokh P., Randel Nyengaard J. (2018) Concomitant use of heat-shock protein 70, glutamine synthetase and glypican-3 is useful in diagnosis of HBV-related hepatocellular carcinoma with higher specificity and sensitivity. Eur. J. Histochem. 62(1), 42‒50.
Yuan J.S., Reed A., Chen F., Stewart C.N. (2006) Statistical analysis of real-time PCR data. BMC Bioinformatics. 7, 85. https://doi.org/10.1186/1471-2105-7-85
Heidari Z., Mahmoudzade Sagheb H., Asemi Rad A., Keikhaee M.A. (2015) Immunocytochemical study of p53 protein in exfoliated cells of oral mucosa in patients with type 2 diabetes. Gene Cell Tissue. 2(1), e24881.
Mohamed W.S., Omar M.M., Khayri T.M., Fakhr I.M. (2008) Assessment of the proliferative marker Ki-67 and p53 protein expression in HBV- and HCV-related hepatocellular carcinoma cases in Egypt. Int. J. Health Sci. (Qassim). 2(1), 27‒34.
Marcel V., Catez F., Diaz J.J. (2015) p53, a translational regulator: contribution to its tumour-suppressor activity. Oncogene. 34(44), 5513‒5523.
Meng X., Franklin D.A., Dong J., Zhang Y. (2014) MDM2-p53 pathway in hepatocellular carcinoma. Cancer Res. 74(24), 7161‒7167.
Lee S.N., Park C.K., Sung C.O., Choi J.S., Oh Y.L., Cho J.W., Yoo B.C. (2002) Correlation of mutation and immunohistochemistry of p53 in hepatocellular carcinomas in Korean people. J. Korean Med. Sci. 17(6), 801‒805.
Mitsumoto Y., Nakajima T., Marutani M., Kashiwazaki H., Moriguchi M., Kimura H., Okanoue T., Kagawa K., Tada M. (2004) Loss of p53 transcriptional activity in hepatocellular carcinoma evaluated by yeast-based functional assay: comparison with p53 immunohistochemistry. Hum. Pathol. 35(3), 350‒356.
Wang Z., Gou W., Liu M., Sang W., Chu H., Zhang W. (2015) Expression of P53 and HSP70 in chronic hepatitis, liver cirrhosis, and early and advanced hepatocellular carcinoma tissues and their diagnostic value in hepatocellular carcinoma: an immunohistochemical study. Med. Sci. Monit. 21, 3209‒3215.
Chen Ban K., Singh H., Krishnan R., Fong Seow H. (2004) Comparison of the expression of beta-catenin in hepatocellular carcinoma in areas with high and low levels of exposure to aflatoxin B1. J. Surg. Oncol. 86(3), 157‒163.
Zekri A.R., Bahnassy A.A., Madbouly M.S., Asaad N.Y., El-Shehaby A.M., Alam El Din H.M. (2006) p53 mutation in HCV-genotype-4 associated hepatocellular carcinoma in Egyptian patients. J. Egypt. Natl. Cancer Inst. 18(1), 17‒29.
Koskinas J., Petraki K., Kavantzas N., Rapti I., Kountouras D., Hadziyannis S. (2005) Hepatic expression of the proliferative marker Ki-67 and p53 protein in HBV or HCV cirrhosis in relation to dysplastic liver cell changes and hepatocellular carcinoma. J. Viral Hepat. 12(6), 635‒641.
Boix-Ferrero J., Pellin A., Blesa R., Adrados M., Llombart-Bosch A. (1999) Absence of p53 gene mutations in hepatocarcinomas from a Mediterranean area of Spain. A study of 129 archival tumour samples. Virchows Arch. 434(6), 497‒501.
Otsuka M., Kato N., Lan K., Yoshida H., Kato J., Goto T., Shiratori Y., Omata M. (2000) Hepatitis C virus core protein enhances p53 function through augmentation of DNA binding affinity and transcriptional ability. J. Biol. Chem. 275(44), 34122‒34130.
King K.L., Hwang J.J., Chau G.Y., Tsay S.H., Chi C.W., Lee T.G., Wu L.H., Wu C.W., Lui W.Y. (1998) Ki-67 expression as a prognostic marker in patients with hepatocellular carcinoma. J. Gastroenterol. Hepatol. 13(3), 273‒279.
Tremosini S., Forner A., Boix L., Vilana R., Bianchi L., Reig M., Rimola J., Rodriguez-Lope C., Ayuso C., Sole M., Bruix J. (2012) Prospective validation of an immunohistochemical panel (glypican 3, heat shock protein 70 and glutamine synthetase) in liver biopsies for diagnosis of very early hepatocellular carcinoma. Gut. 61(10), 1481‒1487.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


