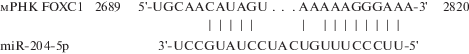Молекулярная биология, 2021, T. 55, № 4, стр. 667-675
FOXC1-опосредованное влияние микроРНК miR-204-5p на пролиферацию клеток меланомы
И. Ю. Дубовцева a, М. Б. Аксененко a, Е. Д. Николаева a, А. С. Аверчук a, А. В. Мошев c, А. А. Савченко c, С. В. Маркова b, Т. Г. Рукша a, *
a Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого Министерства здравоохранения России
660022 Красноярск, Россия
b Институт биофизики Сибирского отделения Российской академии наук, обособленное подразделение Федерального исследовательского центра “Красноярский научный центр Сибирского отделения Российской академии наук”
660022 Красноярск, Россия
c Научно-исследовательский институт медицинских проблем Севера
660022 Красноярск, Россия
* E-mail: tatyana_ruksha@mail.ru
Поступила в редакцию 17.08.2020
После доработки 24.10.2020
Принята к публикации 11.11.2020
Аннотация
МикроРНК эпигенетически регулируют физиологические и патологические процессы. Ранее нами выявлено, что микроРНК miR-204-5p низко экспрессирована в клетках меланомы, а повышение ее уровня приводит к изменению пролиферации, миграции и инвазии этих раковых клеток. Теперь с помощью биоинформатического анализа показано, что мишень miR-204-5p – мРНК, кодирующая транскрипционный фактор FOXC1, играющий важную роль в канцерогенезе. С помощью люциферазной репортерной системы обнаружено, что miR-204-5p подавляет экспрессию гена FOXC1 посредством связывания с его 3'-некодирующей областью. Трансфекция малой интерферирующей РНК (siРНК), нацеленной на FOXC1, в клетки меланомы вызывала снижение уровня miR-204-5p, что согласуется с общепринятыми представлениями о регуляции экспрессии микроРНК генами-мишенями по принципу обратной связи. По результатам MTT-теста и флуоресцентной микроскопии, уровень пролиферации клеток меланомы под действием siРНК к FOXC1 снижался через 72 ч после трансфекции. Методом проточной цитометрии проанализированы изменения в соотношении клеток по фазам клеточного цикла. Выявлены регуляторные взаимосвязи между FOXC1 и miR-204-5p, а также ингибирующий эффект нокдауна FOXC1 на пролиферацию клеток меланомы. На основании полученных результатов можно предположить, что miR-204-5p регулирует пролиферацию клеток меланомы через воздействие на экспрессию FOXC1.
Резистентность опухолей к терапевтическим средствам относится к одной из важнейших проблем современной онкологии. Это обусловлено многими факторами, в том числе гетерогенностью опухолевой ткани и возможным наличием в ней пула дормантных (спящих, G0) клеток в пределах одной опухоли. Неизвестно, на каком этапе канцерогенеза формируются дормантные клетки [1], однако они способны сохраняться в организме после проведения противооопухолевой терапии, циркулировать с кровотоком и оседать в других органах и тканях, принимая участие в развитии метастазирования [2]. Молекулярные механизмы активации (трансформации в пролиферирующие опухолевые клетки) дормантных клеток, перехода из G0 в G1, не поняты до конца. Предполагается, что в этом процессе принимают участие компоненты системы иммунного надзора, опухолевого микроокружения, а также эпигенетические регуляторы, в том числе микроРНК.
МикроРНК представляют собой короткие (20‒24 н.) некодирующие РНК, которые вовлечены в посттранскрипционную регуляцию генной экспрессии. МикроРНК, транскрибируемые с геномной ДНК и подвергающиеся дальнейшему процессингу и экспорту в цитоплазму [3, 4], играют важную роль в регуляции многих физиологических и патологических процессов [5]. Ранее нами показано, что микроРНК miR-204-5p – одна из низкоэкспрессируемых микроРНК в клетках меланомы, но не в меланоцитарных невусах [6]. Выявлено, что восстановление уровня miR-204-5p в опухолевых клетках приводит к изменению скорости их пролиферации, миграции и инвазии [7]. Кроме того, недавно Díaz-Martínez и соавт. [8] обнаружили, что восстановление экспрессии miR-204-5p в клетках меланомы вызывает потерю резистентности к противоопухолевому таргетному препарату вемурафенибу. Авторы предложили разные возможные механизмы этого явления, в том числе воздействие miR-204-5p на регуляторы клеточного цикла и апоптоза. Мы предположили, что miR-204-5p не только напрямую участвует в регуляции хода клеточного цикла, но влияет и на переход клеток в покоящееся состояние, G0. Дело в том, что одна из причин резистентности клеток к противоопухолевым средствам связана именно с опухолевыми клетками, находящимися в фазе G0 и поэтому не чувствительными к действию агентов, подавляющих пролиферацию.
Нами исследованы механизмы регуляции пролиферации клеток меланомы под действием микроРНК miR-204-5p.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культивирование клеток меланомы. Эксперименты проводили на клетках меланомы человека BRO (предоставлена ФГБНУ “НИИ фундаментальной и клинической иммунологии”, Новосибирск, Россия) и SK-MEL-2 (“Биолот”, Россия). Клетки культивировали в среде RPMI-1640 с L-глутамином (“ПанЭко”, Россия) с 10%-ной фетальной сывороткой крупного рогатого скота (FBS; “Gibco, Thermo Fisher Scientific”, США) при 37°C и 5% CO2 в CO2-инкубаторе Sanyo MSO-5AC (“Sanyo Electric Co., Ltd.”, Япония).
Биоинформатический анализ. Поиск и анализ генов-мишеней miR-204-5p проведен с использованием четырех баз данных и программ TargetScan (версия 7.0; http://www.targetscan.org), miRDB (версия 5.0; http://mirdb.org/miRDB), miRWalk 2.0 (http://zmf.umm.uni-heidelberg.de/apps/zmf/ mirwalk2/) и miRTarBase (версия 4.5; http://mirtarbase.mbc.nctu.edu.tw/). Рассматривали гены-мишени miR-204-5p, которые встречались во всех четырех базах данных. На следующем этапе были выделены гены-мишени, значения TargetScore (вероятность, выведенная из распределения генов-мишеней микроРНК при помощи логарифмической модели Байеса–Гаусса) которых в базе miRDB были не ниже 80. Это связанно с тем, что все гены-мишени распределены особым алгоритмом по баллам прогноза от 50 до 100. Для оценки роли miR-204-5p в регуляции внутренней сигнализации с помощью программы PANTHER v10.0 (www.pantherdb.org) проведен анализ изменяемых в клетках метаболических и сигнальных каскадов.
Проектирование siРНК для нокдауна FOXC1. Подбор последовательностей siРНК и скремблированных РНК для отрицательного контроля проводили с использованием программы siDirect 2 (http://sidirect2.rnai.jp); siРНК подбирали c помощью программы Wizard Software v.3.1. (“Invitrogen, Thermo Fisher Scientific”, США).
Критериями для отбора были следующие параметры: содержание G/C нуклеотидов 35‒55%, последовательность размером 20–25 н., отсутствие транскриптов других генов, совпадающих с последовательностями выбранных siРНК, по результатам анализа с помощью системы BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi). Отобранные последовательности не содержали более трех одинаковых нуклеотидов подряд и нуклеотидных повторов. Для оценки специфичности нокдауна в клетках в качестве отрицательного контроля использовали скремблированные siРНК.
Синтез смысловых скремблированных siРНК проведен компанией ООО “Синтол” (Россия):
FOXC1_sense siРНК: 5′-GGGAAUAGUAGCUGUCAAATTdTdT-3′;
FOXC1_scramble siРНК: 5′-GGAATGGTAGCGACATATATT-3′.
Трансфекцию siРНК в клетки меланомы BRO и SK-MEL-2 выполняли при достижении клетками плотности 70%.
Оценка жизнеспособности клеток меланомы. Для оценки пролиферации клеток меланомы BRO и SK-MEL-2 использовали МТТ-тест. Клетки культивировали в 96-луночном планшете без вмешательств 24 ч и по достижении концентрации 1 × 104 клеток в 100 мкл питательной среды их трансфицировали siРНК к FOXC1. Трансфекцию проводили при помощи Lipofectamine 3000 (“Thermo Fisher Scientific”) согласно инструкции производителя. Через 24 ч питательную среду удаляли, в каждую лунку добавляли раствор 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2H-тетразолия бромида (МТТ) (“Invitrogen, ThermoFisher Scientific”) в концентрации 5 мг/мл, в количестве 15 мкл МТТ на 135 мкл питательной среды. Клетки с раствором МТТ инкубировали 4 ч при 37°С и 5% CO2 в CO2-инкубаторе. По интенсивности накопления формазана оценивали метаболическую активность клеток, соответствующую интенсивности пролиферации, через сутки, двое и трое суток после трансфекции. Измерения проводили на спектрофотометре Efos-9305 (“Shvabe Photosystems”, Россия) при длине волны 560 нм. В качестве отрицательного контроля использовали клетки, трансфицированные скремблированной siРНК. Эксперимент проводили в трех технологических повторах. Данные нормировали на соответствующие значения в контроле и выражали в процентах.
Флуоресцентная микроскопия. Для проведения флуоресцентной микроскопии клетки BRO и SK-MEL-2, трансфицированные siРНК в концентрации 5 × 104 клеток/мл, рассевали в 96-луночный планшет и инкубировали 24 ч при 37°C и 5% CO2. Через 24, 48 и 72 ч клетки окрашивали с использованием набора реагентов CyQUANT Direct Cell Proliferation Assay (“Thermo Fisher Scientific”), в состав которого входит зеленый флуоресцентный краситель, напрямую связывающийся с ДНК. После 30-минутной инкубации при комнатной температуре проводили флуоресцентную микроскопию с использованием системы визуализации клеток Floid® Cell Imaging Station (Floid Software, версия 22809; “Thermo Fisher Scientific”) при увеличении ×460. Подсчет клеток проводили в 10 полях зрения. Ядра пролиферирующих клеток окрашивались в зеленый цвет, ядра живых непролифирирующих клеток оставались неокрашенными. Эксперимент проводили в трех технологических повторах.
Люциферазная репортерная система для оценки воздействия микроРНК. Для подтверждения FOXC1 как функционально значимого гена-мишени miR-204-5p в клетках меланомы использовали люциферазную репортерную систему Ambion® pMIR-REPORT Luciferase miRNA Expression Reporter Vector System (“Invitrogen™, Applied Biosystems”, США). Прежде всего была синтезирована нуклеотидная последовательность 3′-некодирующей области (3′-UTR) гена FOXC1, содержащая предсказанный сайт-мишень для miR-204-5p. Затем синтезированный фрагмент ДНК клонировали в 3′-UTR гена люциферазы светлячка (Rluc) в репортерной плазмиде pMIR-REPORT согласно инструкции производителя. Корректность полученной конструкции подтверждена секвенированием. В полученной плазмиде экспрессия люциферазного репортера подвергается регуляции, которая имитирует регуляцию FOXC1 через анализируемую область с сайтом-мишенью микроРНК. Вторую нормировочную плазмиду системы pMIR-REPORT-β-gal, содержащую ген β-галактозидазы (GALB), использовали как внутренний стандарт для нормирования сигнала с целью устранения возможных различий в трансфекционной эффективности отдельных образцов. Плазмиду pMIR-REPORT-β-gal добавляли при трансфекции в соотношении 1 : 10. Трансфекцию полученной конструкции осуществляли в клетки меланомы линии BRO и SK-MEL-2 при помощи Lipofectamine 3000 (“Thermo Fisher Scientific”). Отрицательными контролями служили нетрансфицированные клетки меланомы BRO и SK-MEL-2, не содержащая последовательность 3′-UTR гена FOXC1 плазмидная ДНК, трансфицированные только синтетическим аналогом (миметиком) miR-204-5p, mirVana®miRNA (“Ambion”, “Thermo Fisher Scientific”), клетки с конечным содержанием миметика 30 нM.
Эффективность трансфекции оценивали прямым подсчетом флуоресцирующих клеток под микроскопом после трансфекции контрольной плазмидой pcDNA3m3-cgreGFP2 (несущей ген gfp Clytia gregaria, мутированный для созревания при 37°С) в концентрации, равной таковой для исследуемой плазмиды (GFP-вектор предоставлен лабораторией фотобиологии Института биофизики СО РАН, обособленного подразделения ФИЦ КНЦ СО РАН, Красноярск, Россия).
Люциферазную активность клеток меланомы анализировали через 24 ч после трансфекции с использованием набора Dual-Light® Systems (“Applied Biosystems”). Клетки лизировали и, согласно инструкции производителя, добавляли в лизат буфер А, субстрат β-галактозидазы Galacton-Plus® в разведении 1 : 100 в буфере B, в состав которого входил субстрат люциферазы люциферин. Ферментативную активность люциферазы и β-галактозидазы измеряли на планшетном люминометре Mithras LB 940 Multimode Reader (“Berthold Technologies GmbH&Co”, Германия) при длине волны 560 нм для люциферазы и 420 нм для β-галактозидазы. Относительную люциферазную активность, отражающую уровень экспрессии FOXC1, рассчитывали по соотношению интенсивности люминесценции продукта люциферазной реакции к таковой для продукта реакции β-галактозидазы в каждой лунке.
Оценка эффекта вемурафениба на пролиферацию клеток меланомы. Концентрацию 50%-ного ингибирования (IC50) пролиферации клеток меланомы определяли при помощи МТТ-теста. Клетки меланомы BRO и SK-MEL-2 культивировали в 96-луночном планшете 24 ч до достижения концентрации 2 × 105 клеток в 500 мкл питательной среды RPMI-1640 с L-глутамином и 10% FBS, после чего в лунки вносили вемурафениб (“Сarbosynth Ltd”, Англия), растворенный в DMSO (“Panreac quimica SA”, Испания), в конечной концентрации 0.75, 1.25, 2.5, 5.0 и 10.0 мкМ. В качестве контроля использованы клетки с DMSO в концентрации, соответствующей таковой в 5.0 мкМ вемурафенибе. Клетки культивировали в течение 72 ч, после чего питательную среду удаляли и вносили в каждую лунку 135 мкл свежей питательной среды и 15 мкл раствора МТТ с концентрацией 5 мг/мл. Планшет помещали в CO2-инкубатор на 4 ч при 37°C и 5% CO2. Метаболическую активность клеток оценивали спектрофотометрически и рассчитывали по формуле: (ODs/ODm) × 100%, – где значения ODs и ODm соответствуют оптической плотности клеток экспериментального и контрольного образца при длине волны 560 нм. Оптическую плотность определяли на спектрофотометре Anthos 2010 ELISA (“Biochrom Ltd”, Англия). Значение IC50 рассчитывали с использованием программного обеспечения Graphpad PRISM 8.0. Эксперимент проводили в трех технологических повторах.
Дормантные клетки выделяли по методу, описанному ранее [9], с применением противоопухолевого агента вемурафениба в концентрации 10 IC50. Клетки культивировали 3 суток, заменяли питательную среду на свежую и культивировали еще 48 ч, после чего, используя Lipofectamine 3000, проводили трансфекцию siРНК для подавления экспрессии FOXC1.
Определение доли клеток, находящихся в фазе G0, методом проточной цитометрии. После инкубации с вемурафенибом клетки меланомы BRO и SK-MEL-2 в концентрации 3 × 105 клеток/лунка снимали с 6-луночного планшета буфером трипсин-EDTA (“ПанЭко”), центрифугировали при 10000 × g на центрифуге miniSpin (“Ependorf”, Германия) в течение 5 мин и удаляли надосадочную жидкость. Клеточную суспензию фиксировали метиловым спиртом (70–100%). Для этого 0.5 мл метилового спирта добавляли к полученному осадку и инкубировали в течение 30 мин. Для пермеабилизации фиксированных клеток использовали обработку тритоном X-100 в течение 15 мин. После каждого этапа клетки промывали дважды фосфатно-солевым буфером (PBS). Клетки окрашивали анти-Ki-67-моноклональными антителами, конъюгированными с FITC (#11-5698-82, “eBioscienceTM”, “Thermo Fisher Scientific”) в разведении 1 : 200 в FBS. По завершении процедуры окрашивания в образцы вносился ДНК-связывающий краситель – йодистый пропидий (PI) (“Thermo Fisher Scientific, Inc.”, Нидерланды) ‒ до концентрации 100 мкг/мл и инкубировали в течение 15 мин.
Анализ окрашенных клеток проводили на проточном цитофлуориметре Navios (“Beckman Coulter, Inc.”, США) Центра коллективного пользования КНЦ СО РАН с использованием синего лазера (488 нм) и детекторных фильтров. Полоса пропускания для FITC составляла 530/30 нм, а для PI – 610/20 нм.
Результаты анализировали с использованием программы Navios Software v. 1.2 и Kaluza v. 2.1.1 (“Beckman Coulter, Inc.”); при этом в каждом образце исследовали не менее 50 000 клеток. Гейтирование клеток, находящихся на разных стадиях клеточного цикла, выполняли в логарифмическом режиме. Для клеток, находящихся в фазе G0, характерна Ki-67-негативность и низкие уровни PI-сигнала. В этой связи гейтирование клеток в G0-фазе оценивали в диапазоне до 10 по шкале флуоресценции Ki-67-FITC (отрицательный результат) и в диапазоне 0.7–1.3 относительных единиц флуоресценции по PI.
Определение уровня экспрессии miR-204-5p в клетках меланомы. Реакцию обратной транскрипции проводили с применением набора реагентов MMLV RT kit (“Евроген”, Россия). Для синтеза кДНК использовали набор случайных праймеров из MMLV RT kit (“Евроген”) и специфичные праймеры для микроРНК TaqMan Assays hsa-miR-204-5p (No A25576, “Applied BiosystemsTM”, “Thermo Fisher Scientific”).
Уровень экспрессии miR-204-5p определяли методом ПЦР в реальном времени, используя амплификатор StepOneTM Real-Time PCR System (“Applied Biosystems”, “Thermo Fisher Scientific”), с 40 циклами амплификации. В качестве эндогенных контролей использовали малые ядерные РНК (snРНК) RNU6A и RNU6B (“Applied Biosystems”). Эксперимент проводили в трех повторах. Для анализа данных использовали метод ∆∆CТ.
Статистическая обработка. Статистическую значимость полученных различий рассчитывали с использованием критерия Стьюдента и U-теста Манна‒Уитни в программном пакете для статистического анализа Statistica 12.0 (“StatSoft”, Россия). Результаты считались значимыми при p < 0.05. Данные представлены в виде среднего и стандартного отклонения (SD).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Идентификация FOXC1 как возможной мишени miR-204-5p
В результате проведенного биоинформатического анализа для miR-204-5p выявлено 235 генов-мишеней. По четырем примененным базам данных выявлено 36 общих генов, из которых 13 участвует в регуляции пролиферации клеток. Последующий анализ генных онтологий биологических процессов и молекулярных функций при помощи системы PANTHER v10.0 позволил из 13 вышеуказанных генов идентифицировать те, биологические функции которых связаны с процессом клеточной пролиферации: SIRT1 (sirtuin 1), FOXC1 (forkheadbox C1), TGFBR1 (transforming growth factor beta receptor 1) и USP47 (ubi-quitin specific peptidase 47).
Анализ последовательности FOXC1 человека (NM_001453) показал, что 3′-UTR его мРНК содержит участки с высокой степенью комплементарности нуклеотидов к последовательности miR-204-5p. На основании этих данных можно было предположить, что идентифицированная последовательность в составе мРНК FOXC1 представляет собой сайт связывания miR-204-5p, причем с сильным регуляторным эффектом (рис. 1).
Исследование FOXC1 как прямой мишени miR-204-5p
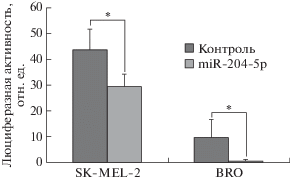
Для подтверждения FOXC1 как функционально значимого гена-мишени miR-204-5p мы оценили регуляторную активность этой микроРНК, используя люциферазную репортерную конструкцию, содержащую 3′-UTR гена FOXC1 с сайтом-мишенью для miR-204-5p. Обнаружено, что miR-204-5p ингибировала люциферазную активность репортерной системы на 72% в клетках меланомы линии BRO и на 34% в клетках меланомы линии SK-MEL-2 (рис. 2). Из этого можно сделать вывод, что miR-204-5p действительно подавляет экспрессию FOXC1.
Рис. 2.
Относительная люциферазная активность в клетках меланомы SK-MEL-2 и BRO через 48 ч после трансфекции миметика miR-204-5p. *р = 0.005.
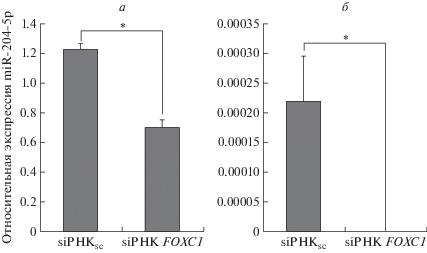
Кроме того, нами исследовано влияние siРНК к FOXC1, трансфицированной в клетки меланомы, на экспрессию miR-204-5p. Обнаружено, что в этом случае уровень miR-204-5p снижался в клетках BRO до 0, а в клетках SK-MEL-2 с 1.23 до 0.64 (рис. 3).
Снижение уровня FOXC1 в клетках меланомы сопровождается снижением пролиферативной активности
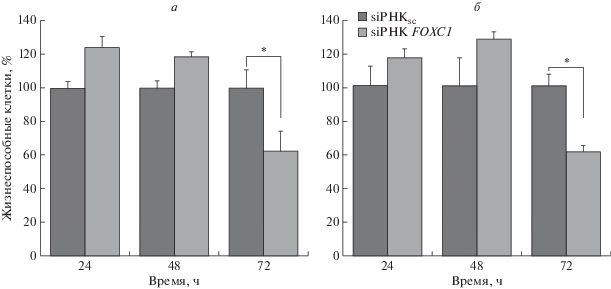
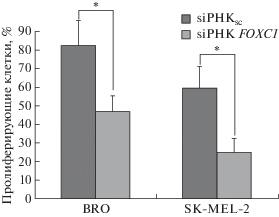
Нами исследовано влияние трансфекции siРНК FOXC1 в клетки меланомы на уровень их пролиферации. По данным МТТ-теста, через 72 ч после трансфекции жизнеспособность клеток BRO и SK-MEL-2 снижалась на 39 и 40% соответственно по сравнению с контрольными клетками, трансфицированными скремблированной siРНК (рис. 4).
Рис. 4.
Жизнеспособность клеток меланомы BRO (а) и SK-MEL-2 (б) через 24, 48 и 72 ч после трансфекции siРНК FOXC1. Жизнеспособность клеток определяли в МТТ-тесте; за 100% принята пролиферативная активность контрольных клеток.
Аналогичные данные получены и методом иммунофлуоресцентной микроскопии: через 72 ч после трансфекции пролиферация клеток BRO и SK-MEL-2 снижалась соответственно в 2.7 и 1.5 раза (рис. 5). Таким образом, логично предположить, что ген FOXC1 – мишень miR-204-5p, а индуцируемое этим взаимодействием снижение уровня транскрипционного фактора FOXC1 приводит к изменению скорости пролиферации клеток меланомы.
Рис. 5.
Пролиферативная активность клеток меланомы BRO и SK-MEL-2 через 72 ч после трансфекции siРНК FOXC1 по результатам флуоресцентной микроскопии на основе визуализации живых, пролиферирующих, неповрежденных клеток с помощью ДНК-связывающего красителя по технологии CyQUANT Direct Cell Proliferation Assay.
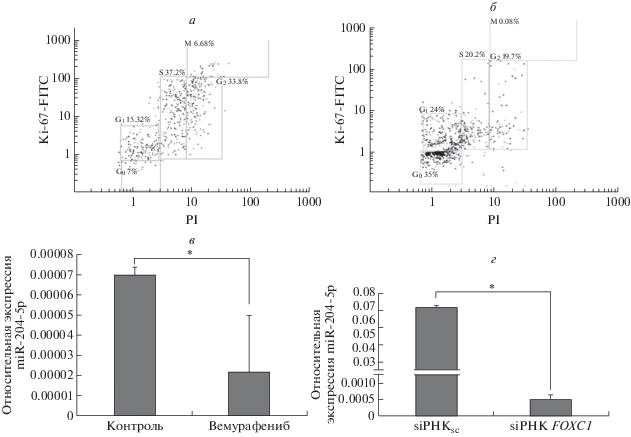
Влияние вемурафениба и siРНК к FOXC1 на экспрессию miR-204-5p
Нами проанализировано влияние на пролиферацию клеток меланомы противоопухолевого средства вемурафениб. Это соединение относится к группе таргетных препаратов, нацеленных на мутантный белок BRAF – компонент сигнального каскада МАРК [10]. Известно, что опухолевые клетки в пределах одной опухоли могут быть гетерогенны по мутационному статусу. Индуцируя апоптоз в BRAF-позитивных клетках, BRAF-негативные клетки могут сохранять жизнеспособность, в том числе находясь или переходя в состояние покоя – фазу G0. Показано, что применение цитостатических средств может способствовать переходу опухолевых клеток в фазу G0 [11]. Учитывая эти данные, мы проанализировали действие BRAF-ингибитора вемурафениба (в концентрации 10 IC50) на клетки SK-MEL-2. Методом проточной цитометрии установлено, что при обработке вемурафенибом доля Ki-67-негативных клеток увеличивается с 7 до 35%, в то время как уровень miR-204-5p снижается на 65%. Как видно из данных, приведенных на рис. 6, трансфекция siРНК FOXC1 в эти клетки не предотвращала снижения уровня miR-204-5p (рис. 6), а через 72 ч после ее трансфекции регистрировали снижение пролиферативной активности клеток (табл. 1).
Рис. 6.
Уровень G0-положительных клеток SK-MEL-2 до (а) и после (б) обработки вемурафенибом: пожительные клетки локализованы в нижнем квадрате диаграмм. Уровень miR-204-5p в клетках SK-MEL-2 после обработки вемурафенибом (в) и трансфекции siРНК к FOXC1 (г).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее показано, что при меланоме, по сравнению с доброкачественными меланоцитарными невусами, сильно снижена экспрессия микроРНК miR-204-5p [5, 12]. Опираясь на данные по участию miR-204-5p в регуляции пролиферации клеток плоскоклеточного рака, рака молочной железы [13, 14], мы предположили, что эта микроРНК участвует и в регуляции пролиферации клеток меланомы.
В результате проведенного биоинформатического анализа идентифицированы возможные гены-мишени miR-204-5p, вовлеченные в регуляцию пролиферации клеток. Один из таких генов – FOXC1. Кодируемый этим геном белок FOXC1 – транскрипционный фактор, участвующий в развитии тканей и органов, включая кожу. Измененная экспрессия FOXC1 описана для клеток рака молочной железы [14], эндометрия [15], поджелудочной железы [16]. FOXC1 входит в семейство транскрипционных факторов forkhead box (FOX), представляющее собой группу эволюционно консервативных регуляторов транскрипции, имеющих общий ДНК-связывающий домен [17]. Члены этого семейства играют важную роль как в физиологических процессах, так и при канцерогенезе, влияя на метаболизм, развитие, дифференцировку, пролиферацию, апоптоз, миграцию и инвазию опухолевых клеток [18]. Также показано, что в клетках меланомы сигнальный каскад MST1R/PI3K/AKT активируется посредством избыточной экспрессии FOXC1, что приводит к усилению их пролиферации, миграции, инвазии [19]. Более того, известно, что FOXC1 регулирует формирование мезенхимальных ниш для гемопоэтических стволовых клеток [20].
Для доказательства функционирования FOXC1 в качестве регуляторной мишени miR-204-5p нами создана генетическая конструкция со встроенным фрагментом гена FOXC1. По результатам анализа люциферазной активности клеток, экспрессирующих ген-репортер и miR-204-5p, выявлено, что под действием miR-204-5p экспрессия белка-репортера снижается. Следовательно, miR-204-5p регулирует экспрессию FOXC1, по-видимому, связываясь с комплементарной последовательностью мРНК FOXC1. Следует заметить, что снижение люциферазной активности различалось в двух исследуемых типах клеток меланомы, но достоверно было не ниже 25%, на основании чего можно говорить о специфичности действия miR-204-5p. Таким образом, ген FOXC1 может быть мишенью и регулироваться miR-204-5p. Этот вывод подтвержден и результатами проведенного нами анализа влияния siРНК к FOXC1 на экспрессию miR-204-5p. Показано, что при трансфекции клеток меланомы siРНК к FOXC1 уровень miR-204-5p снижался, что может быть обусловлено присущей генам-мишеням способностью регулировать уровень экспрессии микроРНК по принципу обратной связи [21]. Таким образом, FOXC1 регулирует пролиферацию клеток меланомы, будучи, в свою очередь, функциональной мишенью miR-204-5p. Известно, что FOXC1, воздействуя на циклины CDK1, CDK2, CDK4 и CDK6, влияет на сигнальный каскад PI3K/AKT и тем самым на прохождение клеточного цикла [22].
Установлено, что снижение уровня FOXC1 вызывает угнетение пролиферации, а эктопическая экспрессия FOXC1 в опухолевых клетках индуцирует арест перехода из фазы G0 в G1 [23]. Для повышения доли клеток, находящихся в фазе G0, мы использовали BRAF-негативные клетки, обработанные вемурафенибом. Показано, что вемурафениб индуцировал увеличение доли клеток, находящихся в состоянии покоя, что сопровождалось снижением экспрессии miR-204-5p. Этот результат согласуется с данными Vitiello и др. [24] о влиянии вемурафениба на экспрессию miR-204-5p. Авторы показали, что обработка вемурафенибом BRAF-негативных клеточных линий MeWo и SK-Mel-197 не приводила к повышению экспрессии miR-204-5p.
Следует сказать, что при сочетанном воздействии на клетки меланомы вемурафениба и siРНК к FOXC1 снижался как уровень miR-204-5p, так и пролиферативная активность клеток. Это косвенно подтверждает наличие регуляторной взаимосвязи между микроРНК miR-204-5p и ее мишенью – FOXC1. Возможно, что при меланоме кожи miR-204-5p, воздействуя через экспрессию FOXC1 на сигнальный каскад PI3K/AKT, модулирует активность циклинов и прохождение клеточного цикла, вовлечена в функционирование клеток, находящихся в состоянии покоя, препятствуя эффективному ответу на действие противоопухолевого препарата.
Исследование выполнено при поддержке Российского научного фонда (проект № 19-15-00110).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Schardt J.A., Meyer M., Hartmann C.H., Schubert F., Schmidt-Kittler O., Fuhrmann C., Polzer B., Petronio M., Eils R., Klein C.A. (2005) Genomic analysis of single cytokeratin-positive cells from bone marrow reveals early mutational events in breast cancer. Cancer Cell. 8, 227–239.
Lim P.K., Bliss S.A., Patel S.A., Taborga M., Dave M.A., Gregory L.A., Greco S.J., Bryan M., Patel P.S., Rameshwar P. (2011) Gap junction-mediated import of microRNA from bone marrow stromal cells can elicit cell cycle quiescence in breast cancer cells. Cancer Res. 71, 1550–1560.
Wang Z. (2010) MicroRNA: a matter of life or death. World J. Biol. Chem. 1, 41–54.
Chen Z., Li Z., Soutto M., Wang W., Piazuelo M.B., Zhu S., Guo Y., Maturana M.J., Corvalan A.H., Chen X., Xu Z., El-Rifai W. (2018) Integrated analysis of mouse and human gastric neoplasms identifies conserved microRNA networks in gastric carcinogenesis. Gastroenterology. 28, 46–52.
Аушев В.Н. (2015) МикроРНК: малые молекулы с большим значением. Клин. онкогематол. 8, 1‒12.
Palkina N., Komina A., Aksenenko M., Moshev A., Savchenko A., Ruksha T. (2018) MiR-204 and miR-3065 exert antitumor effect on melanoma cells. Oncol. Lett. 15, 8269–8828.
Toda H., Kurozumi S., Kijima Y., Idichi T., Shinden Y., Yamada Y., Arai T., Maemura K., Fujii T., Horiguchi J., Natsugoe S., Seki N. (2018) Molecular pathogenesis of triple-negative breast cancer based on microRNA expression signatures: antitumor miR-204-5p targets AP1S3. Eur. J. Hum. Genet. 63, 1197–1210.
Díaz-Martínez M., Benito-Jardón L., Alonso L., Koetz-Ploch L., Hernando E., Teixidó J. (2018) miR-204-5p and miR-211-5p contribute to BRAF inhibitor resistance in melanoma. Cancer Res. 78, 1017–1030.
Li S., Kennedy M., Payne S., Kennedy K., Seewaldt V., Pizzo S., Bachelder E. (2014) Model of tumor dormancy/recurrence after short-term chemotherapy. PLoS One. 9(5), e98021.
Ravnan M.C., Matalka M.S. (2012) Vemurafenib in patients with BRAF V600E mutation-positive advanced melanoma. Clin. Ther. 34(7), 1474–1486.
Кудрявцев И.В., Хайдуков С.В., Зурочка А.В., Черешнев В.А. (2012) Проточная цитометрия в экспериментальной биологии. Екатеринбург: УрО РАН. 192 с.
Shellman M., Shellman Y. (2020) Human against machine? Machine learning identifies microRNA ratios as biomarkers for melanoma. J. Invest. Dermatol. 140, 18–20.
Tang J., Li Z., Zhu Q., Wen W., Wang J., Xu J., Wu W., Zhu Y., Xu H., Chen L. (2020) miR-204-5p regulates cell proliferation, invasion, and apoptosis by targeting IL-11 in esophageal squamous cell carcinoma. J. Cell. Physiol. 235, 3043–3055.
Hong B.S., Ryu H.S., Kim N., Kim J., Lee E., Moon H., Kim K.H., Jin M.S., Kwon N.H., Kim S., Kim D., Chung D.H., Jeong K., Kim K., Kim K.Y., Lee H.B., Han W., Yun J., Kim J.I., Noh D.Y., Moon H.G. (2019) Tumor suppressor miRNA-204-5p regulates growth, metastasis, and immune microenvironment remodeling in breast cancer. Cancer Res. 79, 1520–1534.
Chung T., Lau T., Cheung T., Yim S., Lo K., Siu N., Chan L., Yu M., Kwong J., Doran G., Barroilhet L., Ng A.S., Wong R., Wang V., Mok S., Smith D., Berko-witz R., Wong Y. (2012) Dysregulation of microRNA-204 mediates migration and invasion of endometrial cancer by regulating FOXC1. Int. J. Cancer. 130, 1036–1045.
Subramani R., Camacho F., Levin C., Flores K., Clift F., Galvez A., Terres M., Rivera S., Kolli S., Dodderer J., Miranda M., Rodriguez A., Pedroza D., Chatterjee A., Lakshmanaswamy R. (2018) FOXC1 plays a crucial role in the growth of pancreatic cancer. Oncogenesis. 7, 52–63.
Myatt S.S., Lam E.W. (2007) The emerging roles of forkhead box (Fox) proteins in cancer. Nat. Rev. Cancer. 7, 847–859.
Lai E., Prezioso V.R., Smith E., Litvin O., Costa R.H., Darnell J.E. (1990) HNF-3A, a hepatocyte-enriched transcription factor of novel structure is regulated transcriptionally. Genes Dev. 4, 1427‒1436.
Wang J., Li L., Liu S., Zhao Y., Wang L., Du G. (2016) FOXC1 promotes melanoma by activating MST1R/PI3K/AKT pathway and is associated with poor prognosis in melanoma. Oncotarget. 7, 375‒387.
Omatsu Y., Seike M., Sugiyama T., Kume T., Nagasawa T. (2014) Foxc1 is a critical regulator of haematopoietic stem/progenitor cell niche formation. Nature. 508, 536–540.
Gulyaeva L.F., Kushlinskiy N.E. (2016) Regulatory mechanisms of microRNA expression. J. Transl. Med. 14, 143.
Liu Y., Miao Y., Gao X., Wang Y.Y., Wang H., Zheng Y.W., Zhao Z.Y. (2018) MicroRNA-200a affects the proli-feration of airway smooth muscle cells and airway remodeling by targeting FOXC1 via the PI3K/AKT signaling pathway in ovalbumin-induced asthmatic mice. Cell. Physiol. Biochem. 50, 2365–2389.
Zhou Y., Kato H., Asanoma K., Kondo H., Arima T., Kato K., Matsuda T., Wake N. (2002) Identification of FOXC1 as a TGF-β1 responsive gene and its involvement in negative regulation of cell growth. Genomics. 80, 465–472.
Vitiello M., Tuccoli A., D’Aurizio R., Sarti S., Giannecchini L., Lubrano S., Marranci A., Evangelista M., Peppicelli S., Ippolito C., Barravecchia I., Guzzolino E., Montagnani V., Gowen M., Mercoledi E., Mercatanti A., Comelli L., Gurrieri S., Wu L.W., Ope O., Flaherty K., Boland G.M., Hammond M.R., Kwong L., Chiariello M., Stecca B., Zhang G., Salvetti A., Angeloni D., Pitto L., Calorini L., Chiorino G., Pellegrini M., Herlyn M., Osman I., Poliseno L. (2017) Context-dependent miR-204 and miR-211 affect the biological properties of amelanotic and melanotic melanoma cells. Oncotarget. 8, 25395–25417.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология