Молекулярная биология, 2021, T. 55, № 4, стр. 660-666
Снижение активности стриатумспецифичной протеин-тирозин-фосфатазы (STEP) в головном мозге Danio rerio под воздействием п-хлорфенилаланина и паргилина
Е. А. Куликова a, *, **, Д. В. Фурсенко a, Е. Ю. Баженова a, А. В. Куликов a
a Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: lisa_kulikova@ngs.ru
** E-mail: kulikova@bionet.nsc.ru
Поступила в редакцию 03.07.2020
После доработки 18.09.2020
Принята к публикации 01.10.2020
Аннотация
Фундаментальные нейрофизиологические процессы часто изучают с использованием рыбы Danio rerio в качестве модели. Ранее было показано, что селективный ингибитор стриатумспецифичной протеин-тирозин-фосфатазы (striatal-enriched protein tyrosine phosphatase, STEP) снижает метаболизм серотонина в головном мозге D. rerio. Как STEP, так и серотонин участвуют в развитии нейродегенеративных нарушений поведения. Снижение или повышение уровня серотонина в головном мозге мышей, вызванное введением п-хлорфенилаланина или паргилина, соответственно, приводит к снижению в стриатуме уровня мРНК гена рtpn5, кодирующего STEP. Однако не установлено, наблюдается ли это и у других организмов. Нами изучено влияние ингибиторов синтеза (п-хлорфенилаланин) и деградации (паргилин) серотонина на экспрессию гена ptpn5 и активность STEP в головном мозге D. rerio. Рыбок помещали на 72 ч в воду, содержащую п-хлорфенилаланин (2 мг/л) или паргилин (0.5 мг/л), контрольные особи находились в аквариумной воде. Обработка п-хлорфенилаланином снижала уровень серотонина в мозгу в 4 раза, тогда как паргилин увеличивал уровень этого медиатора в 6 раз. Как п-хлорфенилаланин, так и паргилин снижают активность STEP в головном мозге D. rerio, не влияя при этом на уровень мРНК гена рtpn5. Таким образом, взаимодействие между STEP и серотониновой системой наблюдается не только у млекопитающих, но и у рыб, что указывает на сходство процесса регуляции у позвоночных.
ВВЕДЕНИЕ
Аквариумная рыбка Danio rerio (D. rerio) служит удобной моделью для изучения процессов, протекающих в мозге [1, 2]. Морфология центральной нервной системы у рыб и млекопитающих, в том числе и человека, сходна, поэтому D. rerio активно используют при исследовании молекулярных процессов, лежащих в основе развития нейродегенеративных заболеваний.
Белки, регулирующие передачу сигналов в клетке, включая стриатумспецифичную протеин-тирозин-фосфатазу (STriatal-Enriched protein tyrosine Phosphatase, STEP), принимают участие в патологических процессах в головном мозге. Фермент STEP дефосфорилирует остатки тирозина, регулируя таким образом активность киназ ERK 1/2, p38 [3], Fyn [4], Pyk2 [5], а также субъединиц рецепторов NMDA и AMPA, участвующих в важных сигнальных каскадах в клетке [6]. STEP экспрессируется преимущественно в нейронах. Изменения активности этого фермента наблюдаются при целом ряде нейродегенеративных заболеваний [3]. У рыб белок STEP кодируется геном рtpn5, расположенным на хромосоме 7. Обработка D. rerio гидрохлоридом 8-трифторметил-1,2,3,4,5-бензопентатиепин-6-амина (TC-2153), который селективно ингибирует STEP, приводит к снижению метаболизма серотонина в мозге [7]. Более того, показано взаимодействие STEP и серотониновой системы в мозге млекопитающих [8–10].
Серотонин (5-гидрокситриптамин, 5-HT) – один из ключевых нейромедиаторов головного мозга, изменение уровня которого, как и STEP, ассоциировано с развитием многих психопатологий [11, 12]. В мозге млекопитающих 5-HT синтезируется из L-триптофана с участием триптофангидроксилазы 2 (ТПГ2) [13–15]. Известно, что ингибитор ТПГ2 – п-хлорфенилаланин, снижает уровень 5-HT в мозге [16]. Главную роль в катаболизме 5-HT млекопитающих играют моноаминоксидазы (МАО) А и Б, локализованные на внешней мембране митохондрий [17]. Введение ингибитора МАО, паргилина, приводит к увеличению уровня 5-HT в мозге [18, 19].
Как показано ранее и снижение, и повышение уровня 5-HT, вызванное введением п-хлорфенилаланина и паргилина, соответственно, снижает уровень мРНК гена ptpn5 в стриатуме мышей [20]. Однако не установлено, сохраняется ли это взаимодействие и у других позвоночных.
Мы исследовали влияние фармакологического снижения и повышения концентрации 5-HT на уровень мРНК гена рtpn5 и активность белка STEP в головном мозге D. rerio.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Животные и воздействия. Исследование проведено на взрослых (3–4 мес.) самцах и самках леопардовых D. rerio, взятых в соотношении 1 : 1 (всего 81 особь). Рыбы получены в Секторе генетических коллекций нейропатологий ИЦиГ СО РАН и с возраста 1 мес. содержались в аквариуме (200 л, 27°С) при непрерывной фильтрации, аэрации и фотопериоде 14 ч свет и 10 ч темнота. Рыб кормили 2 раза в день сухим кормом Tetramin Tropical Flakes (“Tetra”, США) и 2 раза в неделю замороженными Chironomus plumosus. Исследование проведено согласно руководству по работе с D. rerio Национального института здоровья США (NIH) от 12 апреля 2013 года. Протокол исследования одобрен Комитетом по биоэтике ИЦиГ СО РАН.
Рыбы были разделены на три группы: контроль, п-хлорфенилаланин и паргилин (по 27 особей в каждой) и в течение 72 ч содержались в 9 аквариумах объемом 4 л по 9 особей каждой группы. Контрольных животных содержали в чистой аквариумной воде, экспериментальные группы находились в воде с добавлением 2 мг/л п-хлорфенилаланина или 0.5 мг/л паргилина. Воду и препараты меняли 1 раз в сутки. Дозы препаратов подобраны в предварительных экспериментах. Для уменьшения стресса, связанного с отловом, рыб за 20 мин до забоя помещали в пластиковые емкости объемом 0.5 л, содержащие растворы соответствующих препаратов. Эвтаназию проводили, помещая рыб в холодную воду (+2°С), выделяли головной мозг, замораживали его в жидком азоте и хранили при –80°С до проведения молекулярно-биохимических исследований. Образцы мозга (27 от каждой группы) разделяли произвольным образом на три партии по 9 образцов в каждой для определения уровня 5-HT, экспрессии гена рtpn5 и активности STEP.
Определение уровня 5-HT. Головной мозг одной особи гомогенизировали в 150 мкл 0.6 М HClO4 и центрифугировали в течение 20 мин при 12 700 об./мин (+4°С). Полученный супернатант использовали для определения уровня 5-HT с помощью жидкостного хроматографа (“Shimadzu Corporation”, США) с электрохимическим детектором DECADE II™ (“Antec”, Нидерланды) согласно [21], a осадок использовали для определения концентрации общего белка в пробе по Брэдфорду (“BioRad”, США) согласно протоколу производителя. Концентрацию 5-НТ в пробе определяли по площади пика с помощью программы LabSolution LG/GC (“Shimadzu Corporation”) и нормировали по калибровочной кривой, полученной с использованием стандартов 1, 2 и 3 нг для 5-HT [21]. Содержание 5-HT выражали в нг/мг белка.
Выделение РНК и проведение ОТ-ПЦР. Мозг рыбы гомогенизировали в 300 мкл Trizol Reagent (“Ambion, Life Technologies”, США), суммарную РНК выделяли согласно протоколу производителя. Следы геномной ДНК удаляли, используя ДНКазу, свободную от РНКазы (“Promega”, США). кДНК синтезировали с помощью набора R01-250 (“Биолабмикс”, Россия) согласно протоколу производителя. Концентрацию мРНК искомых генов определяли методом количественной ОТ-ПЦР с помощью наборов R-402 (“Синтол”, Россия) и специфически подобранных праймеров (табл. 1), согласно следующему протоколу: 95°C, 4 мин, затем 40 циклов 95°C, 15 с; 57°C, 30 с; 72°C, 20 с. Уровень экспрессии оценивали с использованием калибровочной кривой, построенной по геномной ДНК известной концентрации [22], выделенной из мышц хвоста D. rerio, и нормировали на 100 копий гена домашнего хозяйства polr2e.
Таблица 1.
Характеристика праймеров, использованных в количественной ОТ ПЦР в реальном времени
| Ген | Праймер | Тпл | Длина ампликона, п.н. | Эффективность |
|---|---|---|---|---|
| ptpn5 | F 5′-ATGTGTCTCTGACGTTGGACAT-3′ | 57 | 116 | 1.747 ± 0.036 |
| R 5′-CAGCAGGTTGGATGCGTTCT-3′ | ||||
| polr2e | F 5′-GTGACGCAGGATGAATTGGA-3′ | 57 | 105 | 1.946 ± 0.063 |
| R 5′-CACCAGGACTGTCAGGTCATTT-3′ |
Определение общей фосфатазной активности и STEP в головном мозге D. rerio. Выделенный мозг гомогенизировали в 150 мкл 50 мМ MES (2-(N-морфолино)-этансульфоновая кислота) буфере pH 7.0 и центрифугировали в течение 20 мин при 12700 об./мин (+4°С). Общее количество белка в супернатанте определяли по методу Брэдфорда (“BioRad”) согласно протоколу производителя. Реакцию дефосфорилирования п-нитрофенилфосфата с образованием окрашенного 4-нитрофенола проводили в аналитическом планшете Costar при 25°С на спектрофотометре Multiscan GO (“ThermoFisher”) и длине волны 405 нм. Реакционная смесь для определения общей фосфатазной активности состояла из супернатанта, разведенного в 50 мМ MES-буфере pH 7.0 до концентрации белка 0.5–1.5 мкг/мкл, и раствора п-нитрофенилфосфата в MES. Активность STEP вычисляли с использованием разработанной нами методики [20], основанной на упомянутой ферментативной реакции и регулируемой с помощью селективного ингибитора белка STEP – вещества ТС-2153 (НИОХ СО РАН, Россия). В качестве стандартов для построения калибровочной кривой использовали растворы 4-нитрофенола известной концентрации. Активность выражали в нмолях 4-нитрофенола на миллиграмм общего белка в минуту (нмоль/мг/мин) [20].
Статистика. Результаты представляли как среднее ± ошибка среднего и анализировали с помощью однофакторного метода ANOVA. Сравнение post hoc проводили по Фишеру. Уровень значимости принят равным 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
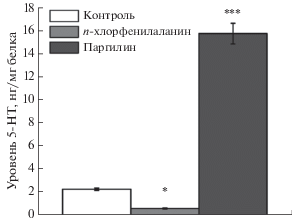
Влияние п-хлорфенилаланина и паргилина на уровень 5-HT в головном мозге рыб D. rerio
Нами выявлены значимые эффекты препаратов на уровень 5-HT (F2,24 = 252.5, p < 0.001) в мозге D. rerio. Выдерживание D. rerio в течение 72 ч в воде, содержащей 2 мг/л ингибитора ТПГ2 (п-хлорфенилаланина) значительно снизило уровень 5-HT в мозге (до 26% от значений в контроле, p = 0.034). Тогда как содержание в течение 72 ч в воде с 0.5 мг/л ингибитора МАО (паргилина) значительно повысило уровень 5-НТ (696% по сравнению с контролем, p < 0.001) (рис. 1). Таким образом, выбранные нами концентрации препаратов и способ обработки животных существенно изменяют уровень 5-HT в мозге D. rerio.
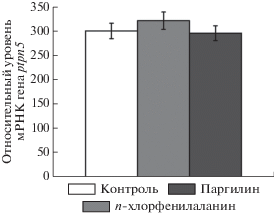
Влияние п-хлорфенилаланина и паргилина на уровень мРНК гена ptpn5 в головном мозге D. rerio
Содержание рыб в течение 72 ч в воде с 2 мг/л п-хлорфенилаланина или 0.5 мг/л паргилина не привело к изменению уровня мРНК гена ptpn5 в мозге по сравнению с контролем (F2,24 < 1) (рис. 2).
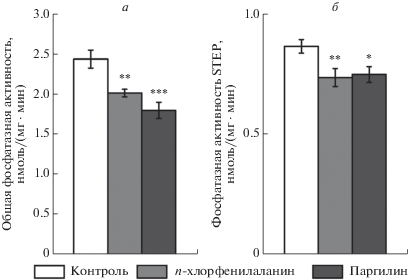
Влияние п-хлорфенилаланина и паргилина на общую активность фосфатаз и отдельно STEP в головном мозге D. rerio
Выявлено значимое влияние обоих препаратов на общую активность всех фосфатаз (F2,24 = 12.6, p < < 0.001) и на активность STEP (F2,24 = 4.72, p < 0.05) в мозге рыб. Содержание рыб в течение 72 ч в воде как с 2 мг/л п-хлорфенилаланина, так и с 0.5 мг/л паргилина, приводило к снижению общей активности фосфатаз на 17% (п-хлорфенилаланин, p < 0.01) и на 26% (паргилин, p < 0.001)) (рис. 3а), а также активности STEP – на 15% (п-хлорфенилаланин, p < 0.01) и на 13.5% (паргилин, p < 0.05)) (рис. 3б) в мозге рыб по сравнению с контролем. Показаны высокие коэффициенты корреляции между общей активностью всех фосфатаз и активностью STEP (r = 0.86, n = 27, p < 0.01). В то же время, активность STEP не коррелировала с уровнем мРНК гена ptpn5 в головном мозге рыб (r = 0.02, n = 27, p > 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами изучено влияние п-хлорфенилаланина и паргилина на активность белка STEP и экспрессию гена ptpn5 в головном мозге D. rerio. Эти препараты применяют для снижения и повышения уровня 5-HT в мозге. В предварительных экспериментах мы подобрали оптимальные дозы препаратов и показали, что у рыб, которые в течение 72 ч находились в воде, содержащей 2 мг/л п-хлорфенилаланина или 0.5 мг/л паргилина, уровень 5-HT снизился в 4 раза или повысился в 6 раз, соответственно, по сравнению с нормой.
Впервые показано, что длительное введение как п-хлорфенилаланина, так и паргилина снизило общую фосфатазную активность и активность STEP в целом мозге D. rerio. Учитывая значительные изменения в уровне 5-HT, вызванные введением этих препаратов, можно предполагать, что снижение активности STEP ассоциировано именно со снижением и увеличением уровня 5-HT. Важно отметить, что при этом не выявлено изменений в уровне мРНК гена ptpn5. Следовательно, можно предположить, что длительное воздействие п-хлорфенилаланина и паргилина влияет на посттрансляционные механизмы регуляции активности STEP в мозге рыб.
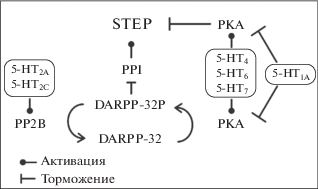
Описано несколько пострансляционных механизмов, способных снижать активность белка STEP: это фосфорилирование, убиквитинирование, димеризация молекул фермента [3]. Наиболее хорошо изучено обратимое фосфорилирование – эффективный и быстрый механизм посттрансляционной регуляции активности фермента. Показано, что фосфорилирование сАМР-зависимой протеинкиназой А снижает активность STEP [23]. Известно, что 5-HT способен увеличивать уровень сАМР через свои Gs-связанные рецепторы – 5-HT4, 5-HT6 и 5-HT7, и снижать его через Gi-связанные рецепторы – 5-HT1A–5-HT1F [24, 25]. Обнаружена высокая гомология системы 5-HT мышей и рыб D. rerio [26, 27]. Все это позволяет предположить, что ингибирование STEP, наблюдаемое при избытке 5-HT в мозге, вызвано, скорее всего, активацией рецепторов 5-HT4, 5-HT6 и 5-HT7 (рис. 4). Тогда как ингибирование STEP при недостатке 5-HT обусловлено, возможно, дисбалансом различных типов рецепторов 5-НТ в мозге или действием компенсаторных механизмов, вызванных резким снижением медиатора. Однако тот факт, что и избыток, и недостаток 5-HT существенно влияют на активность STEP, свидетельствует о ключевой роли 5-HT-системы в посттрансляционной регуляции активности STEP в мозге D. rerio.
Рис. 4.
Схема регуляции белка STEP через рецепторы 5-НТ. 5-HT через рецепторы 5-HT4, 5-HT6, 5-HT7 активирует, а через рецепторы 5-HT1A ингибирует сАМР-зависимую протеинкиназу А (PKA), которая фосфорилирует и инактивирует STEP прямо или посредством фосфорилирования белка DARPP-32 и блокады протеинфосфатазы 1 (PP1). С другой стороны, 5-HT через рецепторы 5-HT2A и 5-HT2C активирует протеинфосфатазу 2B (PP2B, кальцинейрин), которая дефосфорилирует и активирует STEP через дефосфорилирование белка DARPP-32P и активацию протеинфосфатазы 1 (PP1).
Недавно мы показали, что трехкратное введение п-хлорфенилаланина и паргилина снижает экспрессию гена рtpn5 в стриатуме мышей, но не влияет на экспрессию этого гена в коре и гиппокампе, а также на активность STEP в стриатуме, гиппокампе и коре [20]. В настоящей работе с использованием в качестве модели D. rerio нами впервые выявлено участие 5-HT в регуляции активности STEP. Однако следует подчеркнуть, что в экспериментах на рыбах, где п-хлорфенилаланин и паргилин добавляют непосредственно в воду, изменения уровня 5-HT в мозге были более выраженными, чем при внутрибрюшинном введении этих препаратов мышам. Можно предположить, что значительное снижение и увеличение уровней 5-HT позволило увидеть изменения в активности STEP в мозге рыб, тогда как отсутствие изменений в экспрессии гена ptpn5 у D. rerio может быть связано с использованием целого мозга, а не его отдельных структур.
В последние годы для изучения процессов, происходящих в организме, а также механизмов действия фармакологических препаратов все более активно используют лабораторных рыб. Серотониновая система участвует в регуляции депрессивно-подобного и тревожного поведения. Ингибитор МАО паргилин является классическим антидепрессантом, который снижает проявление депрессивно-подобного поведения у грызунов [28]. Ингибиторы МАО оказывают анксиолитический эффект на D. rerio [29], тогда как влияние п-хлорфенилаланина на тревожно-подобное поведение D. rerio зависит от используемого теста [30]. Поскольку мы обнаружили изменения в активности белка STEP как при увеличении, так и при снижении уровня 5-НТ в мозге, можно предположить, что у рыб 5-НТ влияет на активность белка STEP и участвует в регуляции поведения.
Таким образом, результаты нашей работы указывают на существование взаимосвязи между серотониновой системой и белком STEP в мозге рыб, что подтверждает данные, полученные ранее на грызунах [8–10, 20].
ЗАКЛЮЧЕНИЕ
В работе впервые установлено, что п-хлорфенилаланин и паргилин снижают активность STEP в головном мозге D. rerio. В то же время ни п-хлорфенилаланин. ни паргилин не влияли на экспрессию гена рtpn5, кодирующего белок STEP, в исследованной модели. Показано, что D. rerio можно использовать в качестве модели для изучения связи белка STEP с серотониновой системой.
Авторы благодарны сотрудникам лаборатории физиологически активных веществ Новосибирского института органической химии им. Н.Н. Ворожцова СО РАН за любезно предоставленное вещество TC-2153.
Исследование поддержано Бюджетным проектом 0259-2021-0015.
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Kalueff A.V., Stewart A.M., Gerlai R. (2014) Zebrafish as an emerging model for studying complex brain disorders. Trends Pharmacol. Sci. 35, 63–75.
Stewart A.M., Braubach O., Spitsbergen J., Gerlai R., Kalueff A.V. (2014) Zebrafish models for translational neuroscience research: from tank to bedside. Trends Neurosci. 37, 264–278.
Goebel-Goody S.M., Baum M., Paspalas C.D., Fernandez S.M., Carty N.C., Kurup P., Lombroso P.J. (2012) Therapeutic implications for striatal-enriched protein tyrosine phosphatase (STEP) in neuropsychiatric disorders. Pharmacol. Rev. 64, 65–87.
Nguyen T.H., Liu J., Lombroso P.J. (2002) Striatal enriched phosphatase 61 dephosphorylates Fyn at phosphotyrosine 420. J. Biol. Chem. 277, 24274–24279.
Xu J., Kurup P., Bartos J.A., Patriarchi T., Hell J.W., Lombroso P.J. (2012) Striatal-enriched protein-tyrosine phosphatase (STEP) regulates Pyk2 kinase activity. J. Biol. Chem. 287, 20942–20956.
Kurup P., Zhang Y., Xu J., Venkitaramani D.V., Haroutunian V., Greengard P., Nairn A.C., Lombroso P.J. (2010) A beta-mediated NMDA receptor endocytosis in Alzheimer’s disease involves ubiquitination of the tyrosine phosphatase STEP61. J. Neurosci. 30, 5948–5957.
Синякова Н.А., Куликова Е.А., Енглевский Н.А., Куликов А.В. (2017) Эффекты флуоксетина и потенциального антидепрессанта гидрохлорида 8-трифторметил-1,2,3,4,5-бензопентатиепин-6-амина (TC-2153) на поведение в тесте “новый резервуар”, биогенные амины и их метаболиты в мозге рыбок Danio rerio. Бюлл. Эксп. Биол. Мед. 164, 573–576.
Kulikova E.A., Bazhenova E.Y., Popova N.K., Khomenko T.M., Volcho K.P., Salakhutdinov N.F., Kulikov A.V. (2015) Effect of acute administration of 8‑(trifluoromethyl)-1,2,3,4,5-benzopentathiepin-6-amine hydrochloride (TC-2153) on biogenic amines metabolism in mouse brain. Lett. Drug Design Discov. 12, 833–836.
Куликов А.В., Тихонова М.А., Куликова Е.А., Хоменко Т.М., Корчагина Д.В., Волчо К.П., Салахутдинов Н.Ф., Попова Н.К. (2011) Влияние нового потенциального психотропного препарата гидрохлорида 8-(трифторметил)-1,2,3,4,5-бензопентариепин-6-амина на экспрессию генов, вовлеченных в метаболизм и рецепцию медиатора серотонина, в головном мозге мышей. Молекуляр. биология. 45, 282–288.
Kulikova E.A., Khotskin N.V., Illarionova N.B., Sorokin I.E., Bazhenova E.Y., Kondaurova E.M., Volcho K.P., Khomenko T.M., Salakhutdinov N.F., Ponimaskin E., Naumenko V.S., Kulikov A.V. (2018) Inhibitor of striatal-enriched protein tyrosine phosphatase, 8-(trifluoromethyl)-1,2,3,4,5-benzopentathiepin-6-amine hydrochloride (TC-2153), produces antidepressant-like effect and decreases functional activity and protein level of 5-HT(2A) receptor in the brain. Neuroscience. 394, 220–231.
Kulikov A.V., Gainetdinov R.R., Ponimaskin E., Kalueff A.V., Naumenko V.S., Popova N.K. (2018) Interplay between the key proteins of serotonin system in SSRI antidepressants efficacy. Expert Opin. Ther. Targets. 22, 319–330.
Popova N.K., Naumenko V.S. (2019) Neuronal and behavioral plasticity: the role of serotonin and BDNF systems tandem. Expert Opin. Ther. Targets. 22, 227–239.
Walther D.J., Peter J.U., Bashammakh S., Hörtnagl H., Voits M., Fink H., Bader M. (2003) Synthesis of serotonin by a second tryptophan hydroxylase isoform. Science. 299, 76.
Popova N.K., Kulikov A.V. (2010) Targeting tryptophan hydroxylase 2 in affective disorder. Expert Opin. Ther. Targets. 14, 1259–1271.
Kulikov A.V., Popova N.K. (2015) Tryptophan hydroxylase 2 in seasonal affective disorder: underestimated perspectives? Rev. Neurosci. 26, 679–690.
Kulikova E.A., Kulikov A.V. (2019) Tryptophan hydroxylase 2 as a therapeutic target for psychiatric disorders: focus on animal models. Expert Opin. Ther. Targets. 23, 655–667.
Shih J.C., Thompson R.F. (1999) Monoamine oxidase in neuropsychiatry and behavior. Am. J. Hum. Genet. 65, 593–598.
Allen D.L., Renner K.J., Luine V.N. (1993) Pargyline-induced increase in serotonin levels: correlation with inhibition of lordosis in rats. Pharmacol. Biochem. Behav. 45, 837–841.
Edmondson D.E., Mattevi A., Binda C., Li M., Hubálek F. (2004) Structure and mechanism of monoamine oxidase. Curr. Med. Chem. 11, 1983–1993.
Куликова Е.А., Фурсенко Д.В., Баженова Е.Ю., Куликов А.В. (2020) Паргилин и п-хлорфенилаланин снижают экспрессию гена Ptpn5, кодирующего стриатумспецифичную протеинтирозинфосфатазу (STEP), в стриатуме мышей. Молекуляр. биология. 54, 313–320.
Khotskin N.V., Plyusnina A.V., Kulikova E.A., Bazhenova E.Y., Fursenko D.V., Sorokin I.E., Kolotygin I., Mormede P., Terenina E.E., Shevelev O.B., Kulikov A.V. (2019) On association of the lethal yellow (AY) mutation in the agouti gene with the alterations in mouse brain and behavior. Behav. Brain Res. 359, 446–456.
Kulikov A.V., Naumenko V.S., Voronova I.P., Tikho-nova M.A., Popova N.K. (2005) Quantitative RT-PCR assay of 5-HT1A and 5-HT2A serotonin receptor mRNAs using genomic DNA as an external standard. J. Neurosci. Methods. 141, 97‒101.
Paul S., Snyder G.L., Yokakura H., Picciotto M.R., Nairn A.C., Lombroso P.J. (2000) The Dopamine/D1 receptor mediates the phosphorylation and inactivation of the protein tyrosine phosphatase STEP via a PKA-dependent pathway. J. Neurosci. 20, 5630–5638.
Barnes N.M., Sharp T. (1999) A review of central 5-HT receptors and their function. Neuropharmacology. 38, 1083–1152.
Pytliak M., Vargova V., Mechirova V., Felsoci M. (2011) Serotonin receptors – from molecular biology to clinical applications. Physiol. Res. 60, 15–25.
Panula P., Chen Y.C., Priyadarshini M., Kudo H., Semenova S., Sundvik M., Sallinen V. (2010) The comparative neuroanatomy and neurochemistry of zebra-fish CNS systems of relevance to human neuropsychiatric diseases. Neurobiol. Dis. 40, 46–57.
Gaspar P., Lillesaar C. (2012) Probing the diversity of serotonin neurons. Philos. Trans R. Soc. Lond. B Biol. Sci. 67, 2382–2394.
Borsini F. (1995) Role of the serotonergic system in the forced swimming test. Neurosci. Biobehav. Rev. 19, 377‒395.
Stewart A.M., Cachat J., Gaikwad S., Robinson K.S., Gebhardt M., Kalueff A.V. (2013) Perspectives on experimental models of serotonin syndrome in zebrafish. Neurochem. Int. 62, 893–902.
Maximino C., Puty B., Benzecry R., Araújo J., Lima M.G., de Jesus Oliveira Batista E., Renata de Matos Oliveira K., Crespo-Lopez M.E., Herculano A.M. (2013) Role of serotonin in zebrafish (Danio rerio) anxiety: relationship with serotonin levels and effect of buspirone, WAY 100635, SB 224289, fluoxetine and para-chlorophenylalanine (pCPA) in two behavioral models. Neuropharmacology. 71, 83–97.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология