Молекулярная биология, 2021, T. 55, № 4, стр. 643-659
Мезенхимальные стволовые клетки, культивируемые в 3D системе, подавляют рост клеток немелкоклеточного рака легкого за счет зависимой от IL-24 регуляции сигнальных путей p38 MAPK и CXCR4/AKT
F. Suo a, M. Pan a, Y. Li a, Q. Yan a, H. Hu, L. Hou a, *
a College of Life Sciences and Bioengineering, Beijing Jiaotong University
100044 Beijing, PR China
* E-mail: llhou@bjtu.edu.cn
Поступила в редакцию 07.06.2020
После доработки 17.08.2020
Принята к публикации 15.09.2020
Аннотация
Немелкоклеточный рак легкого (НМРЛ) широко распространен во всем мире и характеризуется высоким уровнем смертности. Несмотря на то, что мезенхимальные стволовые клетки (МСК) рассматривают в качестве возможного средства для терапии онкологических заболеваний, данные по их влиянию на клетки НМРЛ противоречивы, что связано, прежде всего, с использованием двумерной (2D) культуральной системы. В то же время трехмерные (3D) условия культивирования воспроизводят тканевую организацию in vivo. Проведено детальное исследование противоопухолевых свойств МСК в 3D-условиях культивирования клеток (3D-МСК) НМРЛ. Подтверждено более эффективное супрессорное действие 3D-МСК на пролиферацию и миграцию клеток НМРЛ по сравнению с МСК, культивируемыми в 2D-условиях. В 3D-МСК избыточно экспрессирован интерлейкин-24 (IL-24), который относится к ключевым факторам, усиливающим противоопухолевое действие МСК. В этих клетках IL-24 влияет на сигнальные пути p38 MAPK и CXCR4/AKT. Таким образом, в проведенном исследовании подтверждена эффективность использования МСК в терапии опухолей.
Рак легких характеризуется высокой смертностью во всем мире. Более 85% случаев рака легкого относится к его немелкоклеточному подтипу (НМРЛ) [1]. Традиционные методы лечения НМРЛ, такие как хирургия, химио- и лучевая терапия, обладают серьезными ограничениями. На ранней стадии НМРЛ чрезвычайно трудно обнаружить, что приводит к снижению выживаемости больных. Терапия стволовыми клетками набирает популярность как новая стратегия лечения онкологических заболеваний. Мезенхимальные стволовые клетки (МСК) характеризуются высокой дифференцировочной активностью, способностью мигрировать к месту опухоли и секретировать биологически активные вещества [2], что позволяет считать их подходящими кандидатами для противоопухолевой терапии [3, 4]. Некоторые секретируемые МСК факторы ингибируют рост клеточных линий НМРЛ при совместном культивировании [5, 6]. Так, ранее нами показано, что МСК супрессируют рост клеток НМРЛ паракринным способом ‒ как in vitro, так и in vivo [7]. Кроме того, МСК пригодны для использования в качестве клеток-киллеров, нацеленных на раковые клетки легких или на стволовые клетки опухоли рака легкого [8, 9]. Однако целесообразность использования МСК для лечения НМРЛ пока не подтверждена. Так, по некоторым данным [10‒13], МСК могут способствовать развитию рака легкого, а не останавливать его.
Одна из причин противоречий в результатах может быть связана с использованием двумерных (2D) моделей культивирования, которые не воспроизводят условия, наблюдаемые в тканях человека. В последнее время интерес к трехмерным (3D) системам культивирования клеток возрос, так как они моделируют микроокружение ткани [14, 15]. Во многих 3D-системах культивирования клеток используют матриксы из коллагена I типа, которые подходят для этого благодаря их пластичности и низкой стоимости [16, 17]. Системы 3D-культивирования, полученные на основе коллагена I типа и матригеля [18] или гидрогеля внеклеточного матрикса [19], стимулируют пролиферацию МСК и повышают их секреторную активность. Ранее нами показано, что уровень интерлейкина-24 (IL-24) в МСК, культивируемых в 3D-системе (3D-МСК), примерно в 20 раз выше, чем в 2D-культуре [18]. Цитокин IL-24 относится к опухолевым супрессорам и вызывает гибель ряда различных видов опухолевых клеток [20‒22]. Однако детальный механизм ингибирующего действия IL-24, секретируемого 3D-МСК, на клетки НМРЛ до сих пор не выяснен. Нами исследовано ингибирующее действие 3D-МСК на клеточные линии NCI-H460: H460 и SK-MES-1: MES in vitro и проанализированы задействованные в этом процессе сигнальные механизмы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные линии. МСК костного мозга человека приобретены у компании “Cyagen” (США). Клеточная линия НМРЛ человека NCI-H460 (крупноклеточная карцинома) любезно предоставлена Dr. Jiang, работающим в нашей лаборатории. Линия НМРЛ человека SK-MES-1 (плоскоклеточная карцинома) приобретена в Китайской инфраструктуре клеточных линий (China infrastructure of cell line resources, Китай). Все клеточные линии идентифицированы методом генотипирования STR (“Micro-read Gene Biotechnology”, Китай). МСК культивировали в полной среде HBMMSC, которая содержала 10% эмбриональной сыворотки крупного рогатого скота (FBS) и 1% глутамина (“Gibco”, США). Клетки H460 и MES культивировали в среде DMEM (“Gibco”), содержащей 10% FBS и 1% глутамина. Все клетки инкубировали в клеточном инкубаторе при температуре 37°C и 5% CO2.
3D-культивирование. Для приготовления форм для матриксов в лунки 12-луночного планшета добавляли по 1 мл 2%-ного стерильного жидкого агара, дожидались его застывания при комнатной температуре и затем в каждую лунку по углам агара вставляли 4 стерильных капилляра. Коллаген I типа из хвоста крысы (“BD”, США) смешивали с 2× DMEM в соотношении 1 : 1 (v/v), добавляли 10% матригеля (“Corning”, США) и 1 × 106 клеток/мл МСК. Полученную смесь быстро перемешивали и хранили на льду. В каждую стерильную лунку агара добавляли по 1 мл полученной смеси и планшет помещали в клеточный инкубатор на 20 мин. После полимеризации в каждую лунку планшета вносили 1 мл полной среды.
Конструирование плазмиды pIRES2-EGFP-IL-24 для сверхэкспрессии IL24 и плазмиды pGPH1-GFP-IL-24 с короткой шпилечной РНК (shРНК) для сайленсинга IL24. Плазмида pGPH1-GFP-IL-24 была разработана и сконструирована компанией “GenePharma Pharmaceutical Technology Co., Ltd.” (Китай).
Процесс конструирования плазмиды pIRES2-EGFP-IL-24 состоял из нескольких стадий. Тотальную РНК выделяли из МСК с помощью реагента TRIzol (“Cwbiotech”, Китай). кДНК синтезировали, используя систему обратной транскрипции GoScript (“Promega”, США), и амплифицировали методом ПЦР с парами праймеров к гену IL24 (табл. 1). Амплифицированный продукт и экспрессионный вектор pIRES2-EGFP обрабатывали рестриктазами XhoI и BamHI. Для встраивания фрагмента в экспрессионный вектор использовали ДНК-лигазу T4. Полученную рекомбинантную плазмиду трансформировали в DH5α-компетентные клетки Escherichia coli, которые культивировали на агаровой чашке, содержащей канамицин, в течение 16 ч. Рекомбинантную плазмиду pIRES2-EGFP-IL-24 экстрагировали с помощью мини-набора E.Z.N.A.® Plasmid Mini Kit I (“Omega Biotek”, Китай). Структуру рекомбинантных плазмид подтверждали, используя расщепление рестриктазами, ПЦР и секвенирование, проведенное в компании “BGI” (Китай).
Таблица 1.
Последовательности праймеров для ПЦР
| Белок | Ген | Праймерыа, 5' → 3' | Длина, п.н. | Тпл, °C | Число циклов |
|---|---|---|---|---|---|
| IL-24 | IL24 | F: ccgctcgaggccaccatgaattttcaacagagg R: cgggatccgagcttgtagaatttctg |
621 | 55 | 30 |
| IL-22R1 | IL22RA1 | F: ctgtccgagatcacctacttagg R: gcacatttgggtcagatgttctgtc |
481 | 55 | 30 |
| IL-20R1 | IL20RA | F: gctcagccttctgagaagcagtg R: cgcacaaatgtcagtggttctgac |
552 | 55 | 30 |
| IL-20R2 | IL20RB | F: gctggtgctcactcactgaaggt R: tctgtctggctgaaggcgctgta |
406 | 55 | 30 |
Получение МСК, модифицированных плазмидами pIRES2-EGFP-IL-24 (МСК-О) и pGPH1-GFP-IL-24 (МСК-S). В 6-луночные планшеты высевали МСК (1.25 × 105 клеток/лунка) и трансфицировали pIRES2-EGFP-IL-24 или pGPH1-GFP-IL-24 с помощью Lipofectamine Stem Transfection Reagent (“Thermo Fisher Scientific”, США). Через 48 ч трансфицированные МСК культивировали в присутствии 150 мкг/мл G418 (Geneticin; “Amresco”, США), а затем в среде, содержащей 80 мкг/мл G-418, пока доля клеток с зеленой флуоресценцией не достигала ~50%. В среду вносили 500 нг/мл гидрокортизона (“PeproTech”, США), 10 нг/мл инсулиноподобного фактора роста I (IGF-1; “PeproTech”) и 10 нг/мл эпидермального фактора роста (EGF; “PeproTech”). Культуральную среду заменяли на свежую каждые двое суток. Через 14 суток МСК со сверхэкспрессией или подавлением IL24 культивировали в 3D-условиях, как описано выше для получения МСК-О или МСК-S соответственно.
Сбор кондиционированных сред (КС). Клетки 2D-МСК, 3D-МСК, МСК-О и МСК-S (1.25 × × 105 клеток/мл) культивировали на 12-луночных планшетах в течение 12 ч, после чего КС собирали и фильтровали с использованием 0.22-мкм мембран (“PALL”, США) для последующих экспериментов.
МТТ-тест. Для изучения влияния 2D- и 3D-МСК на клетки H460 и MES в культуры НМРЛ в 96-луночных планшетах вносили несколько видов КС от МСК. В контрольную группу добавляли полную среду HBMMSC. Выживаемость клеток H460 и MES определяли через 24, 48 и 72 ч с использованием МТТ (“Sigma”, Германия). Сначала в каждую лунку добавляли 20 мкл реагента МТТ (0.5 мг/мл) и помещали в клеточный инкубатор при температуре 37°C на 4 ч, после чего среду тщательно отбирали, вносили в каждую лунку 150 мкл DMSO (“Sigma”) и перемешивали в течение 2 мин для полного растворения кристаллов. Оптическую плотность измеряли при длине волны 492 нм на микропланшетном спектрофотометре (“Tecan”, Австрия). Для каждой экспериментальной группы использовали 6 лунок. Ингибирующую способность (IR) КС от МСК на пролиферацию клеток H460 и MES рассчитывали по следующей формуле:
(1)
${\text{IR}} = {\text{ }}(1 - {{{{{\text{A}}}_{{{\text{ex}}}}}} \mathord{\left/ {\vphantom {{{{{\text{A}}}_{{{\text{ex}}}}}} {{{{\text{A}}}_{{\text{c}}}}}}} \right. \kern-0em} {{{{\text{A}}}_{{\text{c}}}}}}) \times 100\% ,$Для изучения ингибирующего действия IL-24, секретируемого МСК, на пролиферацию клетки H460 и MES обрабатывали КС от 3D-МСК, МСК-О и МСК-S в течение 24, 48 и 72 ч соответственно. Протокол МТТ-анализа был такой же, как описано выше. Ингибирующую активность рассчитывали по формуле (1).
Анализ образования колоний. Чтобы выяснить, могут ли МСК ингибировать образование колоний клетками H460 и MES, мы провели соответствующий анализ. Клетки H460 и MES сначала высевали в 6-луночные планшеты по 103 клеток/лунка, обрабатывали полной средой HBMMSC или КС от 2D-МСК и 3D-МСК. Через 14 суток клетки дважды промывали PBS и фиксировали с помощью холодного метанола в течение 25 мин. В лунки вносили 1%-ный раствор кристаллического фиолетового (“Sangon Biotechnology”, Китай) так, чтобы покрыть дно лунок, и инкубировали при комнатной температуре в течение 30 мин. Раствор кристаллического фиолетового удаляли, а клетки дважды промывали ddH2O. Планшеты ставили вверх дном для просушки и далее помещали на специальную бумагу и подсчитывали число клеточных колоний.
Для изучения ингибирующего влияния IL-24, секретируемого МСК, на образование колоний клетками H460 и MES культуры обрабатывали КС от 3D-МСК, МСК-О и МСК-S в течение 14 суток. Для анализа образования колоний использовали вышеприведенный протокол.
Анализ миграции клеток. Для изучения ингибирующего влияния МСК на миграцию клеток H460 и MES проведен соответствующий анализ. Клетки НМРЛ культивировали в 6-луночных планшетах до достижения конфлюентности 90‒100% и наносили царапины с помощью стерильного наконечника для 200-микролитровой пипетки. Суспензионные клетки удаляли трехкратной промывкой PBS. К клеткам НМРЛ добавляли полную среду HBMMSC или КС от МСК. Заживление царапины наблюдали с помощью инвертированного микроскопа (“Nikon”, Япония) через 0 и 24 ч после нанесения. Каждую группу клеток анализировали в трех повторах. Для измерения заживления повреждения использовали программное обеспечение Image J (https://imagej.net/, RRID: SCR_003070). Для расчета изменения площади царапины использовали следующую формулу:
где Sw0 и Sw24 ‒ средняя площадь царапины соответственно в 0 и 24 ч.Способность КС от МСК ингибировать миграцию (IRm) клеток НМРЛ рассчитывали по следующей формуле:
(3)
${\text{I}}{{{\text{R}}}_{{\text{m}}}}\left( \% \right) = (1 - {{\Delta {{S}_{{{\text{ex}}}}}} \mathord{\left/ {\vphantom {{\Delta {{S}_{{{\text{ex}}}}}} {\Delta {{S}_{0}}}}} \right. \kern-0em} {\Delta {{S}_{0}}}}) \times 100\% ,$Для исследования ингибирующего действия IL-24, полученного из МСК, на миграцию клеток H460 и MES проводили еще один анализ миграции клеток с использованием вышеописанного протокола. После нанесения царпин к клеткам добавляли КС от 3D-МСК, МСК-О или МСК-S. Заживление ран наблюдали с помощью инвертированного микроскопа, фотографии делали через 0 и 24 ч после нанесения ран. Каждую группу клеток анализировали в трех повторах. Количественный анализ заживления ран и метод расчета изменения площади и ингибирующей способности описаны выше.
Анализ экспрессии генов рецепторов IL-24 в клетках H460 и MES методом ПЦР с обратной транскрипцией (ОТ-ПЦР). Чтобы проверить, имеют ли клетки H460 и MES рецепторы к IL-24, РНК экстрагировали из клеток H460 и MES с помощью реагента TRIzol. Обратную транскрипцию для получения кДНК проводили с помощью Reverse Transcription Kit (“Promega”, США). Для ПЦР-амплификации использовали праймеры к генам IL22RA1, IL20RA и IL20RB (табл. 1). Продукты ПЦР разделяли электрофорезом в 1%-ном агарозном геле и фотографировали, используя ультрафиолетовую подсветку (“Alfa Innotech”, США).
Анализ экспрессии IL24 в клетках H460 и MES методом ОТ-ПЦР в реальном времени. Чтобы проанализировать, повышается ли экспрессия IL-24 в клетках H460 и MES после их стимуляции КС от МСК, из клеток H460 и MES экстрагировали РНК и синтезировали кДНК. Количественную ПЦР в реальном времени проводили с помощью системы SLAN-96P (“Hongshitech”, Китай) с использованием набора GO Taq® qPCR Master Mixture kit (“Promega”). Экспрессию гена GAPDH использовали в качестве внутреннего контроля для вычисления ΔΔCT. Последовательности праймеров приведены в табл. 2.
Таблица 2.
Последовательности праймеров для ПЦР в реальном времени
| Ген | Праймеры, 5' → 3' | Длина, п.н. | Тпл, °C | Число циклов |
|---|---|---|---|---|
| IL24 | F: gtgatgaggagctgctttcg R: tctgctggctaaagtccaca |
135 | 55 | 30 |
| GAPDH | F: ccaaggagtaagacccctgg R: aggggagattcagtgtggtg |
117 | 55 | 30 |
Иммуноблотинг. С целью проанализировать механизм ингибирующего действия МСК на раковые клетки НМРЛ мы исследовали в них экспрессию p38 MAPK и CXCR4/AKT. Клетки НМРЛ обрабатывали полной средой HBMMSC или КС от 2D-МСК, 3D-МСК, МСК-О или МСК-S в течение 48 ч. Клетки лизировали с использованием буфера для радиоиммунопреципитации (RIPA; “Beyotime”, Китай), осветляли и готовили образцы для электрофореза, используя буфер для нанесения (“LABLEAD”, Китай). После электрофореза в SDS-ПААГ белки переносили на нитроцеллюлозную мембрану (“PALL”), используя технологию полусухого электропереноса, после чего мембрану инкубировали с 5%‑ным сухим обезжиренным молоком для блокирования неспецифических сайтов связывания, а затем с первичными антителами (см. табл. 3) при 4°С в течение ночи. На следующий день мембрану промывали (6 × 5 мин) TBST, содержащем 20 мМ Трис-HCl, pH 7.6, 150 мM NaCl и 0.1% Tween 20, и инкубировали со вторичными антителами при комнатной температуре в темноте в течение 1 ч. Мембрану промывали TBST (5 × 5 мин), а для последней промывки использовали TBS. Интенсивность белковых полос оценивали с помощью программного обеспечения Image J (https://imagej.net/, RRID: SCR_003070).
Таблица 3.
Антитела для иммуноблотинга
| Кат. № | Антителаa | Разведение | Производитель |
|---|---|---|---|
| YP0338 | Phospho-p38 MAPK (Thr180/Y182) Rabbit pAb | 1 : 500 | “Immunoway Biotechnology”, США |
| YT3511 | p38 MAPK Rabbit pAb | 1 : 1000 | “Immunoway Biotechnology” |
| YM3623 | Bax Mouse mAb | 1 : 1000 | “Immunoway Biotechnology” |
| YP0917 | Phospho-CXCR4 (Ser339) Rabbit pAb | 1 : 500 | “Immunoway Biotechnology” |
| YT1800 | CXCR4 Rabbit pAb | 1 : 1000 | “Immunoway Biotechnology” |
| YP0006 | Phospho-AKT (Ser473) Rabbit pAb | 1 : 1000 | “Immunoway Biotechnology” |
| YT0178 | AKT Rabbit pAb | 1 : 1000 | “Immunoway Biotechnology” |
| YT0991 | c-Myc Rabbit pAb | 1 : 1000 | “Immunoway Biotechnology” |
| YM3041 | Bcl-2 Mouse mAb | 1 : 1000 | “Immunoway Biotechnology” |
| YT2798 | MMP-2 Rabbit pAb | 1 : 1000 | “Immunoway Biotechnology” |
| AF1965 | IL-24 Goat pAb | 1 : 1000 | “R&D Systems”, США |
| 926-32213 | IRDye 680RD Donkey anti-Mouse Secondary Antibodies | 1 : 20 000 | “LI-COR”, США |
| 926-68076 | IRDye 680RD Donkey anti-Goat Secondary Antibodies | 1 : 20 000 | “LI-COR” |
| 926-68072 | IRDye 800CW Donkey anti-Rabbit Secondary Antibodies | 1 : 20 000 | “LI-COR” |
Экспрессию IL-24 в клетках МСК, МСК-О и МСК-S определяли по той же методике, используя в качестве первичных специфичные к IL-24 антитела (табл. 3).
Статистический анализ. Статистический анализ проводили с использованием программного обеспечения GraphPad Prism 8.0 (“La Jolla”, США). Данные представлены в виде среднего значения ± стандартная ошибка среднего. Двупарметрический t-критерий Стьюдента использовали для сравнения между двумя группами, а однофакторный ANOVA ‒ для сравнения более чем двух групп. Все эксперименты были проведены не менее трех раз. Обозначения статистической значимости: ns (незначимое; p > 0.05), *p < 0.05, **p < 0.01 и ***p < 0.001.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Ингибирующее действие 3D-МСК на пролиферацию клеток H460 и MES
Для изучения ингибирующего влияния МСК на пролиферацию клеточных линий H460 и MES раковые клетки культивировали в присутствии КС от МСК в течение 24, 48 и 72 ч. С помощью MTT-теста установлено, что КС от 2D- и 3D-МСК оказывали значительное ингибирующее действие на жизнеспособность клеток H460 и MES (*p < 0.05) (рис. 1) через 24, 48 и 72 ч культивирования. Ингибирующая способность КС от 2D-МСК в отношении клеток H460 и MES составила 39.1 и 27.8% соответственно. По сравнению с 2D-МСК КС от 3D-МСК сильнее подавляла пролиферацию клеток H460 и MES, максимальная ингибирующая способность этой среды достигала 44.6% (рис. 1a) и 39.6% (рис. 1б) через 48 ч.
Рис. 1.
Подавление пролиферации клеток НМРЛ с помощью 2D- и 3D-МСК. По результатам MTT-теста ингибирующая способность КС от 3D-МСК на клетки H460 (a) и MES (б) составляла 44.6 и 39.6% соответственно, что было достоверно выше, чем в группе 2D-МСК. Анализ образования колоний клетками H460 (в, г) и MES (д, е) показал, что число колоний клеток было значительно снижено в группах, получавших КС от 2D- и 3D-МСК, при этом эффект был более выражен в группе 3D-МСК.
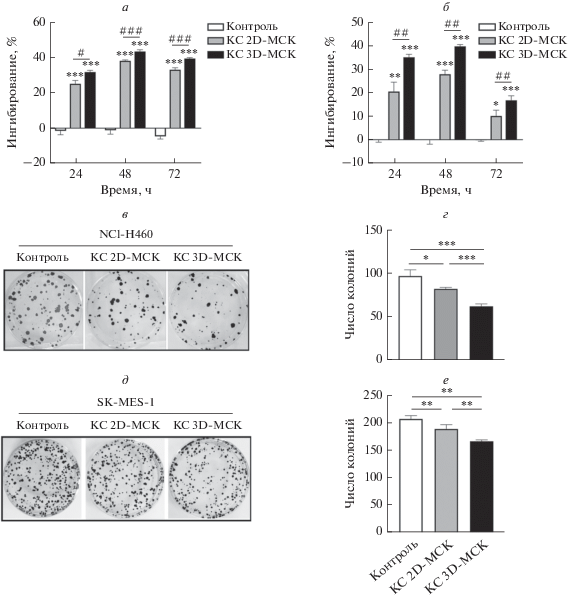
Для дальнейшего подтверждения наличия ингибирующего влияния 2D- и 3D-МСК на пролиферацию клеток H460 и MES проанализировано образование колоний этими клетками в присутствии КС от 2D- или 3D-МСК. Выявлено, что способность к образованию колоний клетками H460 и MES выше в контрольной группе по сравнению с группами, получавшими КС от 2D- или 3D-МСК (рис. 1в, д). В то же время клетки MES обладали большей пролиферативной активностью, чем клетки H460. Число клонов в группах 2D- и 3D-МСК было достоверно снижено (*p ≈ ≈ 0.05) по сравнению с контролем, а в группе 3D-МСК было ниже, чем в группе 2D-МСК (рис. 1г, е). На основании этих данных можно сделать вывод о том, что 3D-МСК обладают способностью ингибировать пролиферацию клеток H460 и MES по паракринному механизму.
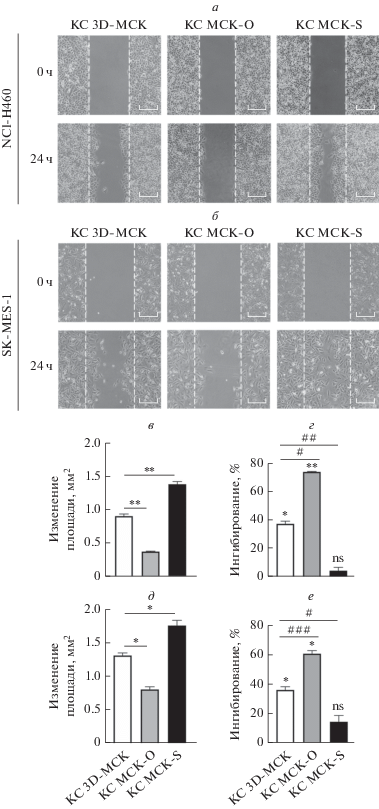
Ингибирующее действие 3D-МСК на миграцию клеток H460 и MES
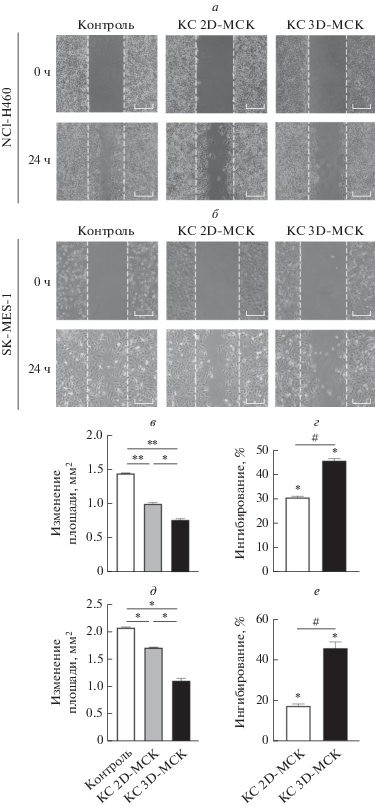
С целью проверить супрессорное действие МСК на миграцию клеток НМРЛ мы провели соответствующий in vitro тест. Обнаружено, что скорость заживления царапин в монослое клеток MES и H460 в контрольной группе была выше, чем в группах, получавших КС от 2D- и 3D-МСК (рис. 2a, б), причем способность к миграции клеток MES была более выражена, чем клеток H460. Изменение площади царапины в группе, получавшей КС от 3D-МСК, было достоверно меньше, чем в группе, получавшей КС от 2D-МСК (*p ≈ 0.05, рис. 2в, д), что соответствует более высокой ингибирующей активность 3D-МСК в отношении миграции клеток H460 и MES (*p < 0.05): 46.73 и 45.93% соответственно (рис. 2г, е).
Рис. 2.
Подавление миграции клеток НМРЛ под действием 2D- и 3D-МСК. Первичные результаты заживления царапин в монослое клеток H460 (a) и MES (б): изменение площади царапин (в, д); ингибирующая активность (г, е). Ингибирующая способность КС от 3D-МСК на миграцию клеток H460 и MES достигла 46.73 и 45.93% соответственно, что было значительно выше, чем в группе 2D-МСК. Масштаб = 500 мкм.
Клетки H460 и MES экспрессируют рецепторы IL-24
Ранее по данным транскриптомного анализа нами обнаружено, что IL24 относится к наиболее высокоэкспрессируемым генам в 3D-МСК по сравнению с 2D-МСК. Это наблюдение было подтверждено методами ОТ-ПЦР, ОТ-ПЦР в реальном времени и иммуноферментным анализом [18]. IL-24 ‒ эффективный противоопухолевый цитокин, действие которого на опухолевые клетки опосредовано гетеродимерными рецепторами IL-24 (IL-20R1/IL-20R2 или IL-22R1/IL-20R2). С целью установить, экспрессируют ли клетки H460 и MES рецепторы IL-24, мы измерили содержание мРНК IL-22R1, IL-20R1, IL-20R2 в клетках H460 и MES, используя ОТ-ПЦР. Установлено, что рецепторы IL-24: IL-22R1 (продукт 481 п.о.) и IL-20R2 (продукт 406 п.о.) экспрессируются в клетках H460 и MES (рис. 3a, б), тогда как экспрессия IL-20R1 не обнаружена. Таким образом, эти результаты подтверждают возможность IL-24, секретируемого 3D-МСК, оказывать противоопухолевое действие на клетки НМРЛ.
Получение МСК-О и МСК-S
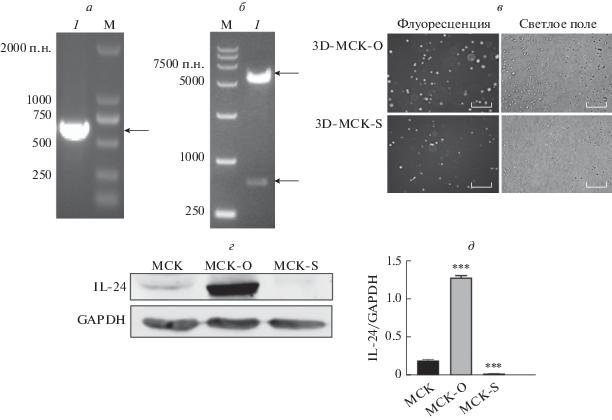
Для дальнейшего исследования противоопухолевого действия IL-24 мы сконструировали плазмиду со сверхэкспресией IL24 ‒ pIRES2-EGFP-IL-24 ‒ путем клонирования гена IL24 в вектор pIRES2-EGFP. Методом ОТ-ПЦР показано, что фрагмент IL24 длиной 621 п.н., действительно встроен в pIRES2-EGFP (рис. 4a). Результаты рестриктазного анализа подтвердили наличие двух фрагментов: длиной 5300 и 621 п.н. (рис. 4б). Кроме того, заданная структура плазмиды подтверждена с помощью секвенирования. Полученными плазмидами для сверхэкспрессии и сайленсинга гена IL24 (pIRES2-EGFP-IL-24 и pGPH1-GFP-IL24 соответственно) трансфицировали МСК. Отбор проводили путем добавления к клеткам G-418, затем среду дополняли EGF, IGF-1 и гидрокортизоном и культивировали клетки в течение 14 суток для получения поликлональных модифицированных МСК. МСК со сверхэкспрессией или сайленсинглом IL24 далее культивировали в 3D-формате для получения соответственно МСК-О и МСК-S. Зеленая флуоресценция клеток с избыточной или подавленной экспрессией IL24 достигала 68 и 60% (рис. 4в). Иммуноблотингом показано, что экспрессия IL-24 в МСК-О значительно повышена, в то время как в МСК-S, наоборот, сильно снижена (рис. 4г, д). Так, в результате проведенных экспериментов было доказано, что нами получены клетки с повышенной и пониженной экспрессиией IL-24 (МСК-О и МСК-S соответственно), которые можно использовать в дальнейшем.
Рис. 4.
Получение и анализ клеток со сверхэкспрессией и сайленсингом IL24 (МСК-О и МСК-S соответственно). a ‒ Анализ экспрессии IL24 в плазмиде pIRES2-EGFP-IL-24 методом ОТ-ПЦР: дорожка 1 ‒ экспрессия IL24; M ‒ маркеры длины ДНК DL2000. б ‒ Двойной рестрикционный анализ плазмиды pIRES2-EGFP-IL-24: дорожка 1 ‒ продукты расщепления pIRES2-EGFP-IL-24 (5300 п.н. pIRES2-EGFP и 621 п.н. IL24); M ‒ маркеры длина ДНК DL15 000. в ‒ Флуоресцентная микроскопия 3D-МСК-О и 3D-МСК-S, масштаб = 500 мкм. г, д ‒ Подтверждение методом иммуноблотинга сверхэкспрессии и подавления экспрессии белка IL-24 в МСК-О и МСК-S соответственно.
Сверхэкспрессия IL24 усиливала, а сайленсинг IL24 ослаблял ингибирующее действие МСК на пролиферацию клеток H460 и MES
Для выявления ингибирующего действия МСК-О и МСК-S на пролиферацию клетки H460 и MES обрабатывали КС от МСК-О и МСК-S в течение 24, 48 и 72 ч. Жизнеспособность клеток определяли с помощью МТТ-теста и затем рассчитывали эффективность ингибирования. Установлено, что КС от МСК-О по сравнению с 3D-МСК оказывала более сильное ингибирующее действие на клетки H460 и MES через 24, 48 и 72 ч (***p < 0.001) (рис. 5a, б). Ингибирующая активность увеличивалась с увеличением времени инкубации и через 72 ч достигала 53.0 и 45.6% для клеток H460 и MES соответственно. В то же время ингибирующий эффект КС от МСК-S на клетки H460 и MES был значительно снижен через 24, 48 и 72 ч (***р < 0.001), а самое высокое значение составляло только 12.8% через 72 ч и 14.0% через 48 ч соответственно.
Рис. 5.
Влияние МСК-О и МСК-S на пролиферацию клеток НМРЛ. По результатам МТТ-теста через 72 ч инкубации клеток H460 (а) и MES (б) с КС от МСК-О их пролиферация снижалась на 53.0 и 45.6% соответственно, что было выше, чем для КС от немодифицированных МСК. Для КС от МСК-S максимальный ингибирующий эффект на пролиферацию клеток H460 и MES достигал только значений 12.8% через 72 ч и 14.0% через 48 ч соответственно, что было ниже, чем для КС от МСК. Анализ образования колоний клетками H460 (в, г) и MES (д, е) показал, что по сравнению с группой 3D-МСК число колоний клеток H460 и MES в группе МСК-О достоверно уменьшилось, в то время как в группе МСК-S достоверно увеличилось.
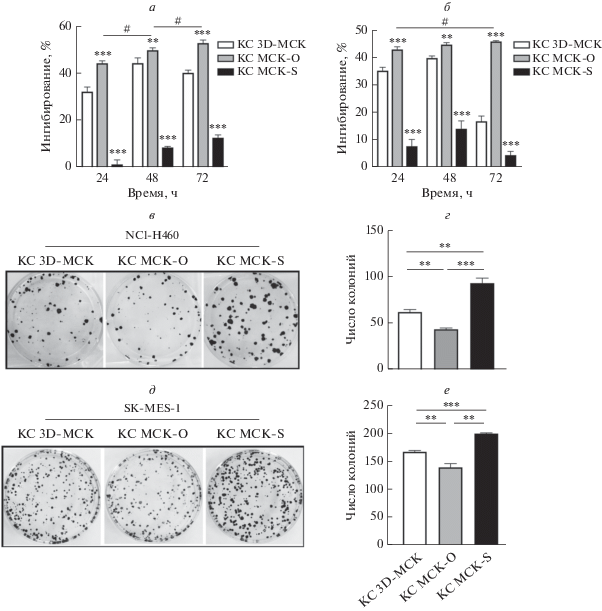
Для подтверждения полученных результатов провели анализ образования колоний. Для клеток H460 число клонов в группе, получавшей КС от МСК-О, было достоверно меньше, чем в группе 3D-МСК (***p < 0.001), в то время как в группе МСК-S было достоверно выше, чем в группе 3D-МСК (***p < 0.001) (рис. 5в, г). Для клеток MES результаты были сравнимы с таковыми для клеток H460 (***p < 0.001) (рис. 5д, е). Кроме того, сравнивая число колоний, мы обнаружили, что клетки MES обладают более сильной способностью образовывать колонии, чем клетки H460. На основании полученных результатов можно считать IL-24, секретируемый 3D-МСК, ключевым фактором, ингибирующим пролиферацию клеток H460 и MES.
Сверхэкспрессия IL24 усиливала, а сайленсинг IL24 ослаблял ингибирующее действие МСК на миграцию клеток H460 и MES
Для изучения влияния МСК-О и МСК-S на миграцию H460 и MES клетки культивировали с КС от МСК-О и МСК- S, а затем на монослой клеток наносили царапины и наблюдали их закрытие. Обнаружено, что ингибирующее влияние МСК на миграцию клеток значительно усиливается при сверхэкспрессии IL24 (рис. 6a, б). По сравнению с группой 3D-МСК изменение площади царапины в группе МСК-О было достоверно снижено (*p ≈ 0.05) (рис. 6в, д). Ингибирование миграции клеток H460 и MES через 24 ч после добавления КС от МСК-О увеличилось до 73.78 и 60.68%, по сравнению с 46.73 и 45.93% в группах, получавших КС от 3D-МСК (рис. 6г, е). Напротив, ингибирование миграции клеток H460 и MES при добавлении КС от МСК-S снизилось до 4.60 и 14.57% соответственно. Таким образом, можно сделать вывод, что 3D-МСК ингибируют миграцию клеток H460 и MES за счет секреции IL-24. Сверхэкспрессия IL-24 может значительно усилить ингибирующую способность МСК, в то время как подавление продукции IL-24 может значительно ослабить этот эффект.
Рис. 6.
Влияние МСК-О и МСК-S на миграцию клеток НМРЛ. Первичные результаты заживления царапин в монослое клеток H460 (a) и MES (б) при добавлении КС от МСК-О и МСК-S: изменение площади царапины (в, д); ингибирующая активность (г, е). Заживление царапин в группе МСК-О происходило медленнее, чем в группе 3D-МСК через 24 ч, что свидетельствует о способности КС от МСК-О ингибировать миграцию клеток НМРЛ. Ингибирующая способность достигала 73.78 и 60.68% для клеток H460 и MES соответственно. В то же время подавление миграции клеток H460 и MES в группе МСК- S было снижено до 4.60 и 14.57% соответственно. Масштаб = 500 мкм.
IL-24, секретируемый МСК, перепрограммирует сигнальные пути p38 MAPK и CXCR4/AKT в клетках H460 и MES
Для выяснения молекулярного механизма ингибирующего действия МСК на пролиферацию и миграцию раковых клеток мы провели анализ сигнальных путей IL-24 (рис. 7). По результатам иммуноблотинга, МСК не влияли на уровень экспрессии суммарного белка p38 MAPK в клетках H460 и MES. Однако по сравнению с группой 2D-МСК уровень фосфорилирования р38 MAPK был значительно выше в группах, получавших КС от 3D-МСК и МСК-О, и существенно снижен в группе, получавшей КС от МСК-S (рис. 7a‒в). В обработанных МСК клетках НМРЛ проанализировали регулируемую IL-24 экспрессию генов BAX и BCL2. Обнаружено, что уровень проапоптотического белка Bax был повышен, в то время как содержание антиапоптотического белка Bcl-2 было снижено. Известно, что повышение соотношения Bax/Bcl-2 способствует апоптозу клеток, а, следовательно, и исследованных нами клеток НМРЛ.
Рис. 7.
Влияние МСК на сигнальные пути р38 MAPK и CXCR4/AKT в клетках НМРЛ. Иммуноблотинг компонентов сигнального пути p38 MAPK. Уровни фосфорилированной формы p38 MAPK (p-p38 MAPK) и BAX в клетках НМРЛ значительно повышались под действием КС от 3D-МСК или МСК-О по сравнению с контролем и 2D-МСК, в то время как в группе МСК-S этот эффект отсутствовал; содержание антиапоптотического белка Bcl-2 снижалось при добавлении КС от 3D-МСК или МСК-О, но не МСК-S (a). Относительная интенсивность полос белков, вовлеченных в сигнальный путь p38 MAPK, в клетках H460 (б) и MES (в). По результатам ОТ-ПЦР в реальном времени относительный уровень мРНК IL-24 в клетках НМРЛ повышается при их обработке КС от 3D-МСК по сравнению с необработанными клетками, уровень экспрессии этой мРНК в которых принят за 1 (г). По результатам иммуноблотинга содержание компонентов сигнального пути CXCR4/AKT: p-CXCR4, CXCR4, p-AKT, AKT, c-Myc и MMP2 ‒ в клетках H460 и MES снижалось при их обработке КС от 3D-МСК или МСК-О, но не МСК-S (*p ≈ 0.05) (д). Относительная интенсивность полос белков, вовлеченных в сигнальный путь CXCR4/AKT, в клетках H460 (е) и MES (ж).
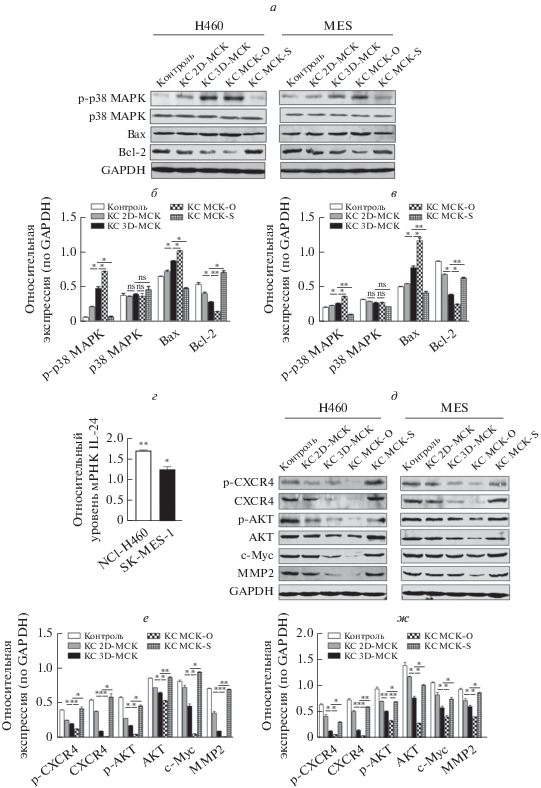
Ранее Sauane и др. [23] показали, что экзогенный белок IL-24 стимулирует опухолевые клетки через рецепторы IL-24 и дополнительно стабилизирует эндогенную мРНК IL-24 в них. Для оценки изменений в уровнях эндогенной мРНК IL-24 в клетках H460 и MES их обрабатывали КС от 3D-МСК, а затем выделяли и анализировали РНК. Результаты количественной ОТ-ПЦР в реальном времени показали, что экспрессия эндогенной мРНК IL-24 в обработанных клетках H460 и MES повышена по сравнению с контрольными клетками (рис. 7г). Этот молекулярный сигналинг приводит к супрессии пути CXCR4/AKT (рис. 7д‒ж). Так, общее содержание белков CXCR4 и AKT и их фосфорилированной формы в группе 3D-МСК было значительно снижено по сравнению с 2D-МСК. Также была снижена контролируемая CXCR4/AKT экспрессия белков, регулирующих пролиферацию (c-Myc) и миграцию (MMP2) клеток. В группе КС от МСК-О негативная регуляция этого сигнального пути была еще более усилена, тогда как в КС от МСК-S никакого изменения паттерна экспрессии практически не было. Таким образом, сигнальные пути p38 MAPK и CXCR4/AKT вовлечены в ингибирующее действие IL-24 на злокачественный фенотип клеток H460 и MES (рис. 8).
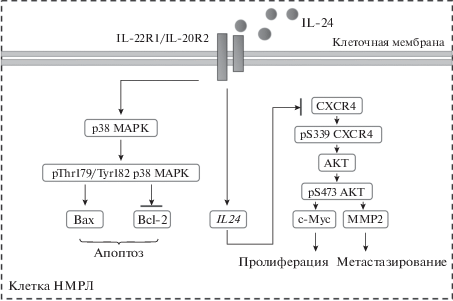
Рис. 8.
Механизмы ингибирующего действия 3D-МСК на клетки НМРЛ. IL-24, производимый 3D-МСК в качестве ключевого паракринного цитокина, через связывание с рецептором IL-22R1/IL-20R2 воздействует на сигнальные пути p38 MAPK и CXCR4/AKT и в результате приводит к изменениям в экспрессии белков, связанных с пролиферацией, апоптозом и миграцией.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
НМРЛ ‒ это широко распространенное онкологическое заболевание, характеризующееся высокой смертностью, а его терапия представляет проблему для мировой системы здравоохранения [24]. В последние годы использование стволовых клеток для лечения онкологических заболеваний привлекает все больше внимания, главным образом, благодаря их противоопухолевому действию, которое обусловлено либо секрецией противораковых факторов, либо возможностью выступать в роли нацеленных на опухоли средств доставки лекарственных препаратов [25‒27]. Большинство известных до сих пор данных по противоопухолевому действию стволовых клеток было получено на 2D-культурах МСК. Хорошо известно, что культивирование МСК в 3D-формате лучше воспроизводит физиологическое состояние, наблюдаемое in vivo.
В представленной работе мы исследовали паракринное действие 3D-МСК на пролиферацию и миграцию клеток НМРЛ и выяснили молекулярный механизм этого процесса. Клетки H460 и MES были выбраны в качестве репрезентативных клеток НМРЛ. Установлено, что 3D-МСК существенно ингибируют рост клеток НМРЛ: через 48 ч он замедлялся на 44.6 и 39.6% в клетках H460 и MES соответственно; при этом ингибирующая способность 3D-МСК была достоверно выше, чем 2D-МСК (39.13 и 27.83% для H460 и MES соответственно, **p < 0.01). Интересно, что подавление пролиферации достигало максимума через 48 ч, а затем снижалось через 72 ч, что навело нас на мысль о том, что содержание цитокинов в КС может опосредовать изменение ингибирующей способности МСК. Вопрос о том, как продлить время жизни цитокинов в КС и поддерживать эффективное подавление роста опухоли, еще предстоит изучить.
Точно так же 3D-МСК оказывали заметное ингибирующее действие на образование колоний клетками H460 и MES; причем этот эффект был выражен значительно сильнее для 3D-МСК, чем для 2D-МСК (**p < 0.01).
При анализе заживления царапин в монослое клеток обнаружено, что 3D-МСК существенно влияют на миграцию клеток H460 и MES. Их ингибирующая способность составила 46.73 и 45.93% соответственно, что было значительно выше, чем для 2D-МСК (31.39 и 17.53% соответственно, *p < 0.05). Кроме того, мы наблюдали разницу в эффективности ингибирования миграции и пролиферации клеток H460 и MES. Клетки H460, по-видимому, более чувствительны к КС от МСК, в то время как клетки MES более устойчивы.
Ген ассоциированного с дифференцировкой меланомы белка-7/интерлейкина-24 (MDA7/IL24) относится к противоопухолевым генам, белковый продукт которого ингибирует пролиферацию и миграцию раковых клеток без видимого влияния на нормальные клетки [28]. Ранее показано, что IL-24 ингибирует пролиферацию и способствует апоптозу во многих типах раковых клеток. Так, Chen и др. [29] сконструировали систему доставки на основе раковых клеток, модифицированных комплексом ПЭГ/липид/фосфат кальция (PLC-cancer cell delivery system), для использования IL-24 в терапии рака. Pradhan и др. [30] продемонстрировали, что IL-24 снижает экспрессию miR-221 и опосредует специфическую гибель раковых клеток. Кроме того, IL-24 дает синергетический эффект с другими противоопухолевыми препаратами и лучевой терапией, что усиливает действие последних [31, 32]. Согласно данным транскриптомного анализа, проведенного в нашей группе, уровень экспрессии IL-24 в 3D-МСК значительно выше, чем в 2D-МСК [18]. Теперь нами выявлена экспрессия и рецепторов IL-24: IL-22R1/IL-20R2, ‒ как в клетках H460, так и MES.
В связи с этим мы сосредоточились на IL-24, продуцируемом МСК, и предположили, что он играет ключевую роль в ингибировании опухоли. С целью подтвердить или опровергнуть эту гипотезу мы сконструировали системы МСК-О и МСК-S ‒ соответственно с избыточной и подавленной экспрессией гена IL24. Как мы и ожидали, ингибирование пролиферации и миграции клеток НМРЛ при использовании КС от МСК-О резко возросло по сравнению с немодифицированными МСК. Ингибирование пролиферации клеток H460 увеличилось с 44.6 до 53.0%, а в случае MES – с 39.6 до 45.6%, причем в обоих случаях эффект зависел от времени инкубации в течение 72 ч. Это может быть связано с длительностью воздействия высокой концентрации IL-24, содержащейся в КС. В то же время при использовании МСК-S ингибирование пролиферации и миграции, наоборот, заметно снижалось в течение 72 ч. Эти данные позволяют предположить, что IL-24 относится к важным секреторным факторам 3D-МСК, который супрессирует пролиферацию и миграцию клеток НМРЛ. Кроме того, в ходе проведенных экспериментов выявлено невысокое ингибирующее действие МСК-S ‒ c сайленсингом экспрессии IL24. Это может быть связано с тем, что МСК секретируют и другие цитокины, способные ингибировать рост клеток H460 и MES. В ряде исследований показано, что МСК секретируют различные цитокины и микровезикулы, нацеленные на опухолевые клетки: IL-1Ra [33], VEGF-A [7], микроРНК-145 [34]. Таким образом, функциональные связи между различными факторами, секретируемыми МСК, еще предстоит выявить в дальнейших исследованиях.
IL-24 ингибирует рост опухоли, используя различные механизмы. В нескольких исследованиях показано, что экзогенный IL-24 в опухолевых клетках индуцирует повышение экспрессии IL24 на транскрипционном уровне [23] и в дальнейшем вызывает изменения в сигнальном пути CXCR4/AKT [35]. Хемокиновый рецептор CXCR4, специфический рецептор хемокинового стромального клеточного фактора-1 (CXCL12), участвует во многих физиологических процессах, включая метастазирование опухолей, кроветворение, эмбриональное развитие и ВИЧ-инфекцию [36‒39]. В представленной работе нами выявлены изменения в экспрессии ключевых белков сигнального пути CXCR4/AKT, связанных с пролиферацией и миграцией. Установлено, что уровни как общего белка, так и фосфорилированных форм CXCR4 и AKT значительно снижались под действием КС от МСК, что приводило к пониженной экспрессии ассоциированного с пролиферацией клеток белка c-Myc и связанной с миграцией матриксной металлопротеиназы-2 (MMP2). Изменения в уровнях этих белков гораздо сильнее выражено в группе 3D-МСК, чем 2D-МСК. Более того, использование МСК-О усиливало эти эффекты, тогда как МСК-S наоборот предотвращало изменения в этом сигнальном пути. Известно, что сигнальный путь p38 MAPK играет важную роль в передаче сигнала от рецептора IL-24, индуцируя апоптоз опухолевых клеток [40]. Таким образом, выявленные нами изменения в уровне экспрессии ключевых белков сигнального пути p38 MAPK тесно связаны с IL-24. На основании результатов иммуноблотинга можно сделать вывод, что IL-24 из МСК позитивно регулирует фосфорилирование p38 MAPK в клетках H460 и MES, но не оказывает влияния на общий уровень белка. В то же время экспрессия апоптотического белка Bax усиливалась, тогда как экспрессия антиапоптотического белка Bcl-2 снижалась, что приводило к повышению соотношения Bax/Bcl-2 в клетках НМРЛ. Интересно, что IL-24, продуцируемый 3D-МСК, способен не только ингибировать пролиферацию и миграцию клеток H460 и MES, но и стимулировать их апоптоз. Основываясь на этих данных, мы предполагаем, что наблюдаемое нами ингибирование пролиферации клеток НМРЛ под действием 3D-МСК может быть опосредовано усилением апоптоза, хотя для подтверждения или опровержения этой гипотезы необходимо провести детальные исследования. В связи с этим важным представляется дальнейшее изучение эффектов IL-24, секретируемого МСК в 3D-культуре, на клетки H460 и MES; это влияние на апоптоз, аутофагию, антиангиогенез и иммунную регуляцию [22, 40‒42]. Необходимо установить, для каких из этих путей наблюдается активация, а для каких ослабление. Кроме того, для подтверждения выявленных для IL-24 эффектов необходимо провести эксперименты с IL-24, непосредственно введенным в среду культивирования, а также с антителом к IL-24 ‒ для подтверждения отмены IL-24-индуцированного эффекта. Экзогенное введение IL-24 и специфичного к нему антитела позволит дополнительно изучить действие IL-24. Также использование антител к рецептору IL-24 (IL-22R1/IL-20R2) позволит дополнительно прояснить и подтвердить механизм передачи сигнала от IL-24. В настоящее время считают, что IL-24 может изменять микроокружение опухоли, ингибировать рост опухоли и создавать внеклеточную среду, способствующую ее эрадикации [43]. Однако ответ на вопрос, как действует IL-24 на раковые клетки: непосредственно через рецепторы на опухолевых клетках, или опосредованно, через регуляцию иммунных клеток, или задействует оба механизма одновременно, ‒ лежит в сфере дальнейших исследований.
Таким образом, нами показано, что 3D-МСК оказывают значительное ингибирующее действие на пролиферацию и миграцию клеток H460 и MES, а IL-24, продуцируемый 3D-МСК, ‒ ключевой фактор этого процесса, действующий через сигнальные пути p38 MAPK и CXCR4/AKT. Мы надеемся, что это исследование будет способствовать разработке новых методов лечения онкологических заболеваний ‒ на основе мезенхимальных стволовых клеток.
Работа была поддержана Национальным фондом естественных наук Китая (National Natural Science Foundation of China; No 81201762).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Siegel R.L., Miller K.D., Jemal A. (2019) Cancer statistics, 2019. CA Cancer J. Clin. 69, 7‒34.
Wu Z., Qiu X., Gao B., Lian C., Peng Y., Liang A., Xu C., Gao W., Zhang L., Su P., Rong L., Huang D. (2018) Melatonin-mediated miR-526b-3p and miR-590-5p upregulation promotes chondrogenic differentiation of human mesenchymal stem cells. J. Pineal. Res. 65, e12483.
Camorani S., Hill B.S., Fontanella R., Greco A., Gramanzini M., Auletta L., Gargiulo S., Albanese S., Lucarelli E., Cerchia L., Zannetti A. (2017) Inhibition of bone marrow-derived mesenchymal stem cells homing towards triple-negative breast cancer microenvironment using an anti-PDGFRβ aptamer. Theranostics. 7, 3595‒3607.
Kupcova Skalnikova H. (2013) Proteomic techniques for characterisation of mesenchymal stem cell secretome. Biochimie. 95, 2196‒2211.
Li L., Tian H., Chen Z., Yue W., Li S., Li W. (2011) Inhibition of lung cancer cell proliferation mediated by human mesenchymal stem cells. Acta Biochim. Biophys. Sin. (Shanghai). 43, 143‒148.
Jung P.Y., Ryu H., Rhee K.J., Hwang S., Lee C.G., Gwon S.Y., Kim J., Kim J., Yoo B.S., Baik S.K., Bae K.S., Eom Y.W. (2019) Adipose tissue-derived mesenchymal stem cells cultured at high density express IFN-β and TRAIL and suppress the growth of H460 human lung cancer cells. Cancer Lett. 440‒441, 202‒210.
Pan M., Hou L., Zhang J., Zhao D., Hua J., Wang Z., He J., Jiang H., Hu H., Zhang L. (2018) Inhibitory effect and molecular mechanism of mesenchymal stem cells on NSCLC cells. Mol. Cell. Biochem. 441, 63‒76.
Fakiruddin K.S., Lim M.N., Nordin N., Rosli R., Zakaria Z., Abdullah S. (2019) Targeting of CD133+ cancer stem cells by mesenchymal stem cell expressing TRAIL reveals a prospective role of apoptotic gene regulation in non-small cell lung cancer. Cancers (Basel). 11, 1261.
Kim S.W., Lee Y.K., Hong J.H., Park J.Y., Choi Y.A., Lee D.U., Choi J., Sym S.J., Kim S.H., Khang D. (2018) Mutual destruction of deep lung tumor tissues by nanodrug-conjugated stealth mesenchymal stem cells. Adv. Sci. (Weinh.). 5, 1700860.
Gazdic M., Simovic Markovic B., Jovicic N., Misirkic-Marjanovic M., Djonov V., Jakovljevic V., Arsenijevic N., Lukic M.L., Volarevic V. (2017) Mesenchymal stem cells promote metastasis of lung cancer cells by downregulating systemic antitumor immune response. Stem Cells Int. 2017, 6294717.
Wang S., Li X., Xu M., Wang J., Zhao R.C. (2017) Reduced adipogenesis after lung tumor exosomes priming in human mesenchymal stem cells via TGFβ signaling pathway. Mol. Cell. Biochem. 435, 59‒66.
Luo D., Hu S., Tang C., Liu G. (2018) Mesenchymal stem cells promote cell invasion and migration and autophagy-induced epithelial-mesenchymal transition in A549 lung adenocarcinoma cells. Cell Biochem. Funct. 36, 88‒94.
Fregni G., Quinodoz M., Moller E., Vuille J., Galland S., Fusco C., Martin P., Letovanec I., Provero P., Rivolta C., Riggi N., Stamenkovic I. (2018) Reciprocal modulation of mesenchymal stem cells and tumor cells promotes lung cancer metastasis. EBioMedicine. 29, 128‒145.
Caliari S.R., Burdick J.A. (2016) A practical guide to hydrogels for cell culture. Nat. Methods. 13, 405‒414.
DeVolder R., Kong H.J. (2012) Hydrogels for in vivo-like three-dimensional cellular studies. Wiley Interdiscip. Rev. Syst. Biol. Med. 4, 351‒365.
Legant W.R., Chen C.S., Vogel V. (2012) Force-induced fibronectin assembly and matrix remodeling in a 3D microtissue model of tissue morphogenesis. Integr. Biol. (Camb.). 4, 1164‒1174.
Ravi M., Paramesh V., Kaviya S.R., Anuradha E., Solomon F.D. (2015) 3D cell culture systems: advantages and applications. J. Cell. Physiol. 230, 16‒26.
Zhao D., Hou L., Pan M., Hua J., Wang Z., He J., Hu H. (2018) Inhibitory effect and mechanism of mesenchymal stem cells cultured in 3D system on hepatoma cells HepG2. Appl. Biochem. Biotechnol. 184, 212‒227.
Chaudhuri O., Gu L., Klumpers D., Darnell M., Bencherif S.A., Weaver J.C., Huebsch N., Lee H.P., Lippens E., Duda G.N., Mooney D.J. (2016) Hydrogels with tunable stress relaxation regulate stem cell fate and activity. Nat. Mater. 15, 326‒334.
Pradhan A.K., Bhoopathi P., Talukdar S., Scheune-mann D., Sarkar D., Cavenee W.K., Das S.K., Emdad L., Fisher P.B. (2019) MDA-7/IL-24 regulates the miRNA processing enzyme DICER through downregulation of MITF. Proc. Natl. Acad. Sci. USA. 116, 5687‒5692.
Bhutia S.K., Das S.K., Azab B., Menezes M.E., Dent P., Wang X.Y., Sarkar D., Fisher P.B. (2013) Targeting breast cancer-initiating/stem cells with melanoma differentiation-associated gene-7/interleukin-24. Int. J. Cancer. 133, 2726‒2736.
Sarkar D., Su Z.Z., Lebedeva I.V., Sauane M., Gopalkrishnan R.V., Valerie K., Dent P., Fisher P.B. (2002) mda-7 (IL-24) mediates selective apoptosis in human melanoma cells by inducing the coordinated overexpression of the GADD family of genes by means of p38 MAPK. Proc. Natl. Acad. Sci. USA. 99, 10054‒10059.
Sauane M., Su Z.Z., Gupta P., Lebedeva I.V., Dent P., Sarkar D., Fisher P.B. (2008) Autocrine regulation of mda-7/IL-24 mediates cancer-specific apoptosis. Proc. Natl. Acad. Sci. USA. 105, 9763‒9768.
Torre L.A., Bray F., Siegel R.L., Ferlay J., Lortet-Tieulent J., Jemal A. (2015) Global cancer statistics, (2012) CA Cancer J. Clin. 65, 87‒108.
Kang S., Bhang S.H., Hwang S., Yoon J.K., Song J., Jang H.K., Kim S., Kim B.S. (2015) Mesenchymal stem cells aggregate and deliver gold nanoparticles to tumors for photothermal therapy. ACS Nano. 9, 9678‒9690.
Shen W.C., Lai Y.C., Li L.H., Liao K., Lai H.C., Kao S.Y., Wang J., Chuong C.M., Hung S.C. (2019) Methylation and PTEN activation in dental pulp mesenchymal stem cells promotes osteogenesis and reduces oncogenesis. Nat. Commun. 10, 2226.
Xu C., Lin L., Cao G., Chen Q., Shou P., Huang Y., Han Y., Wang Y., Shi Y. (2014) Interferon-α-secreting mesenchymal stem cells exert potent antitumor effect in vivo. Oncogene. 33, 5047‒5052.
Ma Q., Jin B., Zhang Y., Shi Y., Zhang C., Luo D., Wang P., Duan C., Song H., Li X., Deng X., Chen Z., Wang Z., Jiang H., Liu Y. (2016) Secreted recombinant human IL-24 protein inhibits the proliferation of esophageal squamous cell carcinoma Eca-109 cells in vitro and in vivo. Oncol. Rep. 35, 2681‒2690.
Chen J., Gao P., Yuan S., Li R., Ni A., Chu L., Ding L., Sun Y., Liu X.Y., Duan Y. (2016) Oncolytic adenovirus complexes coated with lipids and calcium phosphate for cancer gene therapy. ACS Nano. 10, 11548‒11560.
Pradhan A.K., Talukdar S., Bhoopathi P., Shen X.N., Emdad L., Das S.K., Sarkar D., Fisher P.B. (2017) mda-7/IL-24 mediates cancer cell-specific death via regulation of miR-221 and the Beclin-1 axis. Cancer Res. 77, 949‒959.
Dash R., Azab B., Quinn B.A., Shen X., Wang X.Y., Das S.K., Rahmani M., Wei J., Hedvat M., Dent P., Dmitriev I.P., Curiel D.T., Grant S., Wu B., Stebbins J.L., Pellecchia M., Reed J.C., Sarkar D., Fisher P.B. (2011) Apogossypol derivative BI-97C1 (Sabutoclax) targeting Mcl-1 sensitizes prostate cancer cells to mda-7/IL-24-mediated toxicity. Proc. Natl. Acad. Sci. USA. 108, 8785‒8790.
Zhao Y., Li Z., Sheng W., Miao J., Yang J. (2013) Radiosensitivity by ING4-IL-24 bicistronic adenovirus-mediated gene cotransfer on human breast cancer cells. Cancer Gene Ther. 20, 38‒45.
Zhang J., Hou L., Zhao D., Pan M., Wang Z., Hu H., He J. (2017) Inhibitory effect and mechanism of mesenchymal stem cells on melanoma cells. Clin. Transl. Oncol. 19, 1358‒1374.
Takahara K., Ii M., Inamoto T., Nakagawa T., Ibuki N., Yoshikawa Y., Tsujino T., Uchimoto T., Saito K., Takai T., Tanda N., Minami K., Uehara H., Komura K., Hirano H., Nomi H., Kiyama S., Asahi M., Azuma H. (2016) microRNA-145 mediates the inhibitory effect of adipose tissue-derived stromal cells on prostate cancer. Stem. Cells Dev. 25, 1290‒1298.
Panneerselvam J., Jin J., Shanker M., Lauderdale J., Bates J., Wang Q., Zhao Y.D., Archibald S.J., Hubin T.J., Ramesh R. (2015) IL-24 inhibits lung cancer cell migration and invasion by disrupting the SDF-1/CXCR4 signaling axis. PLoS One. 10, e0122439.
Moro M., Bertolini G., Pastorino U., Roz L., Sozzi G. (2015) Combination treatment with all-trans retinoic acid prevents cisplatin-induced enrichment of CD133+ tumor-initiating cells and reveals heterogeneity of cancer stem cell compartment in lung cancer. J. Thorac. Oncol. 10, 1027‒1036.
Teng F., Tian W.Y., Wang Y.M., Zhang Y.F., Guo F., Zhao J., Gao C., Xue F.X. (2016) Cancer-associated fibroblasts promote the progression of endometrial cancer via the SDF-1/CXCR4 axis. J. Hematol. Oncol. 9, 8.
Tsou L.K., Huang Y.H., Song J.S., Ke Y.Y., Huang J.K., Shia K.S. (2018) Harnessing CXCR4 antagonists in stem cell mobilization, HIV infection, ischemic diseases, and oncology. Med. Res. Rev. 38, 1188‒1234.
Xu J., Liang J., Meng Y.M., Yan J., Yu X.J., Liu C.Q., Xu L., Zhuang S.M., Zheng L. (2017) Vascular CXCR4 expression promotes vessel sprouting and sensitivity to sorafenib treatment in hepatocellular carcinoma. Clin. Cancer Res. 23, 4482‒4492.
Dash R., Bhoopathi P., Das S.K., Sarkar S., Emdad L., Dasgupta S., Sarkar D., Fisher P.B. (2014) Novel mechanism of MDA-7/IL-24 cancer-specific apoptosis through SARI induction. Cancer Res. 74, 563‒574.
Fan S., Gao H., Ji W., Zhu F., Sun L., Liu Y., Zhang S., Xu Y., Yan Y., Gao Y. (2020) Umbilical cord-derived mesenchymal stromal/stem cells expressing IL-24 induce apoptosis in gliomas. J. Cell Physiol. 235, 1769‒1779.
Ma M., Zhao L., Sun G., Zhang C., Liu L., Du Y., Yang X., Shan B. (2016) Mda-7/IL-24 enhances sensitivity of B cell lymphoma to chemotherapy drugs. Oncol. Rep. 35, 3122‒3130.
Ma Y.F., Ren Y., Wu C.J., Zhao X.H., Xu H., Wu D.Z., Xu J., Zhang X.L., Ji Y. (2016) Interleukin (IL)-24 transforms the tumor microenvironment and induces anticancer immunity in a murine model of colon cancer. Mol. Immunol. 75, 11‒20.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология



