Молекулярная биология, 2021, T. 55, № 4, стр. 634-642
USF1 подавляет экспрессию генов, кодирующих фибриллярный коллаген типа I, II И III и pNP ADAMTS-3, в клетках остеосаркомы
M. Alper a, *, **, T. Aydemir b, F. Köçkar c
a Medicinal and Aromatic Plants, Vocational School of Technical Sciences, Aksaray University
Aksaray, Turkey
b Izmir Biomedicine and Genome Center
35340 Izmir, Turkey
c Department of Molecular Biology and Genetics, Faculty of Science and Literature, Balıkesir University
10145 Balıkesir, Turkey
* E-mail: meltemalper@aksaray.edu.tr
** E-mail: biologmeltem@hotmail.com
Поступила в редакцию 30.06.2020
После доработки 13.09.2020
Принята к публикации 13.09.2020
Аннотация
Коллаген – важный компонент соединительных тканей человека. На экспрессию генов коллагена влияют различные факторы и цитокины, потенциально вовлеченные в развитие патологий, связанных с коллагенами. Нами показано, что фактор транскрипции USF1 регулирует экспрессию генов, кодирующих фибриллярные коллагены типа I, II и III, в остеобластах Saos-2 и MG-63. Эктопическая экспрессия гена USF1 человека приводит к снижению экспрессии генов коллагенов на уровне мРНК и белка ADAMTS-3 – протеазы, ответственной за N-концевое расщепление предшественников коллагена типа I и II. Промотор гена ADAMTS-3 содержит потенциальные сайты связывания USF1. Нами показано, что сверхэкспрессия USF1 приводит к снижению уровня мРНК и белка ADAMTS-3. USF1 негативно регулирует активность промотора ADAMTS-3. Кроме того, с помощью EMSA показано, что USF1 связывается с промоторной областью ADAMTS-3. Таким образом, ADAMTS-3 и USF1 вносят вклад в регуляцию генов, кодирующих коллагены, при остеосаркоме.
ВВЕДЕНИЕ
Коллагены – наиболее распространенные белки внеклеточного матрикса, необходимы для прикрепления и миграции, пролиферации и дифференцировки клеток соединительной ткани [1, 2]. Коллагены I–III формируют фибриллы. Коллаген типа I – это основной коллаген костной ткани, сухожилий, кожи, связок, роговицы и многих интерстициальных соединительных тканей. Коллаген типа II является характерным компонентом гиалинового хряща. Коллаген типа III широко представлен в тканях, содержащих коллаген I, за исключением костной ткани. Коллаген типа III – важный компонент ретикулярных волокон в интерстициальной ткани легких, печени, дермы, селезенки и сосудов, образует смешанные фибриллы с коллагеном типа I, он локализуется также в эластических тканях [3–7]. Поскольку паттерны экспрессии генов, кодирующих коллаген, могут изменяться при различных патологиях, важно понять, как эти гены контролируются специфическими регуляторными факторами. Например, обнаружение повышенной экспрессии гена Col1A2 при остеосаркоме позволило использовать белковый продукт этого гена в качестве диагностического маркера. Коллагенолитические матриксные металлопротеиназы (ММП) необходимы для инвазии злокачественных клеток, включая клетки остеосаркомы [8–18]. На созревание остеобластов способны влиять и некоторые факторы транскрипции, взаимодействующие как с коллагеном, так и с генами-супрессорами опухолевого роста, что связано с патогенезом остеосаркомы. Влияние фактора транскрипции USF1 на экспрессию генов коллагена изучено не до конца. Показано, что связывание USF1 с Е-боксом в 3'-фланкирующей области стимулирует транскрипцию гена коллагена I [19].
Нами изучена регуляция генов коллагенов I–III и процессирующей коллаген ММП ADAMTS-3 фактором транскрипции USF1. В моделях остеосаркомы USF1 взаимодействует с Е-боксом, он играет существенную роль в эмбриональном развитии, а также участвует в регуляции дифференцировки хондроцитов [20, 21]. Нами показано, что белок USF1 негативно регулирует экспрессию генов коллагенов I–III в клетках Saos-2 и MG-63. Кроме того, мы изучали USF1-зависимую регуляцию ADAMTS-3. Как член семейства pNp, ADAMTS-3 в первую очередь отвечает за N-концевое расщепление фибриллярного проколлагена II, а также проколлагена типа I. Ранее мы охарактеризовали промотор гена ADAMTS-3 человека и идентифицировали его SP1-зависимую транскрипционную регуляцию [22]. Поскольку промотор гена ADAMTS-3 содержит потенциальные Е-боксы, мы оценили влияние USF1 на активность промотора ADAMTS-3. С использованием репортерной системы на основе гена люциферазы показано, что USF1 подавляет активность промотора ADAMTS-3, что приводит к снижению уровня как мРНК ADAMTS-3, так и соответствующего белка. Методом EMSA показано, что USF1 связывается с промотором ADAMTS-3. Представленные данные свидетельствуют о том, что фактор USF1 влияет на экспрессию ADAMTS-3 и, следовательно, способствует дерегуляции экспрессии генов коллагена при остеосаркоме.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культуры клеток и транзиентная трансфекция. Клетки Saos-2 и MG-63 культивировали в модифицированной Дульбекко среде Игла (DMEM, “Gibco”, США), содержащей 10% эмбриональной сыворотки крупного рогатого скота (FCS, “Gibco”) и 2 мМ L-глутамин (“Gibco”). Все клетки культивировали при 37°C и 5% CO2 в инкубаторе. Генетические конструкции для изучения гена ADAMTS-3, а именно, pMET_TS-3[–1340…+40], pMET_TS-3[–879…+40], pMET_TS-3 [–576…+40] и pMET_TS-3 [–131…+40] получены, как описано ранее [22]. Плазмида, направляющая экспрессию USF1, подарена. Dipak P. Ramji (Cardiff School of Biosciences). Транзиентную трансфекцию генетических конструкций, содержащих промотор ADAMTS-3, проводили кальций-фосфатным методом [23]. Плазмиду, кодирующую USF1, трансфицировали одновременно с плазмидой, кодирующей промотор гена ADAMTS-3 и репортерный ген люциферазы (1 мкг). Плазмиду, направляющую экспрессию гена щелочной фосфатазы человека (SEAP, “Promega”, США), также трансфицировали (0.5 мкг) в клетки для нормирования эффективности трансфекции. Активность люциферазы и SEAP измеряли в надосадочных жидкостях, собранных через 48 и 72 ч после трансфекции, с помощью набора Ready-To-Glow™ Secreted Luciferase Reporter Systems (“Clontech”, США) и люминометра Fluoroskan Ascent FL в соответствии с протоколом. Нормированную активность различных фрагментов промоторов оценивали по соотношению активностей люциферазы светлячка и SEAP. Контрольную плазмиду pMetLuc и репортерную плазмиду pMetLuc (“Clontech”) добавляли в разные лунки для каждого экспериментального повтора и использовали в качестве положительного и отрицательного контроля. Опыты по трансфекции повторяли не менее 3 раз [23].
Выделение РНК и количественная ОТ-ПЦР. Набор RNeasy Kit (“Thermo Scientific”, США) использовали для выделения суммарной РНК из осадков клеток, трансфицированных плазмидой, направляющей экспрессию USF1 в соответствии с протоколом. Для синтеза кДНК использовали одинаковое количество РНК (1 мкг). кДНК синтезировали, как описано ранее [24]. кДНК (1 мкл) добавляли к 5 мкл Light Cycler-FastStart DNA Master SYBR Green I mix (“Roche”, Швейцария) в качестве матрицы и 0.5 мкл каждой пары праймеров (50 нг/мкл), указанных в табл. 1, в конечный объем ПЦР-смеси 10 мкл. ОТ-ПЦР проводили с использованием прибора Light Cycler 485 (“Roche Diagnostics”, Швейцария) в следующих условиях: начальная денатурация 95°С в течение 10 мин, затем 35 циклов: 95°С, 15 с; 58°С, 15 с; 72°С, 10 с; и финальная элонгация 72°С, 1 мин. Результаты определяли в трех повторностях для каждого образца, значение Ct определяли автоматически. Относительные изменения экспрессии генов между контрольной группой и группой со сверхэкспрессией USF1 рассчитывали как 2–ΔΔCT, используя среднее между экспрессией генов β2-микроглобулина (hβ-2) и рибосомного белка L13 (RPL13А) человека в качестве внутреннего контроля [25].
Таблица 1.
Последовательности праймеров, использованных в количественной ОТ-ПЦР и EMSA
| Праймер | Нуклеотидная последовательность |
|---|---|
| ADAMTS-3 F человека | 5′-TCAGTGGGAGGTCCAAATGCA-3′ |
| ADAMTS-3 R человека | 5′-GCAAAGAAGGAAGCAGCAGCC-3′ |
| COL1A1 F человека | 5′-CTAGACATGTTCAGCTTTGTGGACCT-3′ |
| COL1A1 R человека | 5′-GTTGTCGCAGACGCAGATCCG-3′ |
| COL2A1 F человека | 5′-TCGGAGAGTGCTGCCCCATCT-3′ |
| COL2A1 R человека | 5′-GGCAGCAAAGTTTCCACCAAGA-3′ |
| COL3A1 F человека | 5′-AGCTGGCTACTTCTCGCTCTGCT-3′ |
| COL3A1 R человека | 5′-GTTCTGAGGACCAGTAGGGCATGA-3′ |
| USF F человека | 5′-ACGTCTTCCGAACTGAGAATGG-3′ |
| USF R человека | 5′-GGTGAAAGCTCCCTGGATCA-3′ |
| β-2-Микроглобулин F человека | 5′-TTTCTGGCCTGGAGGCTATC-3′ |
| β-2-Микроглобулин R человека | 5′-CATGTCTCCATCCCACTTAACT-3′ |
| RPL13A F | 5′-CCTGGAGGAGAAGAGGAAAGAGA-3′ |
| RPL13A R | 5′-TTGAGGACCTCTGTGTATTTGTCAA-3′ |
| [–641…–607] проба | 5'-CATGATGTGGGCGCCACGGCGGGAGGGGCAGTCCG-3′ 5'-CGGACTGCCCCCTCCCGCCGTGGCGCCCACGTCATG-3' |
| [–973…–937] проба | 5′-GACTGGTGCCTGGAAGGGAGATCACCGCGTGGTTAAG-3′ 5-′CTTAACCACGCGGTGATCTCCCTTCCAGGCACCAGTC-3′ |
Выделение белков и Вестерн-блотинг. Выделение белков буфером RIPA и Вестерн-блотинг образцов из контрольных и сверхэкспрессирующих USF1 клеток проводили в соответствии с ранее описанными протоколами [26]. Концентрацию белка определяли с использованием флуориметра Quibit. Белок (50 мкг) вносили в SDS-полиакрил-амидный гель. Мембраны инкубировали с первичными антителами: поликлональными к белку ADAMTS-3 (3 мкг/мл) (“Abcam”, Великобритания, ab45037), поликлональными к коллагену типа II (Col2A1, 2.5 мкг/мл) (“Santa Cruz Biotech”, sc7764) при 4°С в течение ночи или моноклональными к β-актину (“Santa Cruz Biotech”, США, sc81178) при комнатной температуре в течение 1 ч. Мембраны промывали и инкубировали со вторичными антителами, конъюгированными с пероксидазой хрена (комнатная температура, 1 ч). Мембраны проявляли с помощью ECL (“Thermo Scientific”) и детектировали с использованием Fusion FX Vilber Lourmat. Количественный анализ проводили с помощью программного обеспечения ImageJ [27].
Анализ сдвига электрофоретической подвижности. 3′-Концы синтетических олигонуклеотидных зондов, специфичных к участкам (–641…–647) и (–973…–937) промотора ADAMTS-3, биотинилировали Biotin-11-UTP и терминальной дезоксинуклеотидилтрансферазой (TdT) с использованием набора Biotin 3′-End Labeling Kit (“Thermo Scientific”), затем их отжигали с комплементарными им цепями при 95°C в течение 5 мин в dH2O. Анализ подвижности проводили с использованием хемилюминесцентного набора LightShift EMSA Kit (“Thermo Scientific”) в соответствии с протоколом фирмы. В реакционную смесь объемом 20 мкл добавляли 4 мкг ядерного экстракта, 10% связующего буфера (340 мМ KCl, 50 мМ MgCl2, 1 мМ дитиотреитола, 0.1 мМ EDТА, 40 мМ KCl) и 0.05 мкг/мл рoly(dIdc) и инкубировали на льду в течение 10 мин. Затем в реакционную смесь добавляли 20 пмоль биотинилированных двухцепочечных олигонуклеотидов и инкубировали в течение 30 мин при комнатной температуре. Конкурентный анализ EMSA проводили в тех же условиях, добавляя 10000-кратное количество тех же немеченых двухцепочечных нуклеотидов или немеченых консенсусных USF1-олигонуклеотидов для изучения функционального связывания USF1 (табл. 1). Цельные клеточные экстракты получали из контрольных клеток и клеток Saos-2, сверхэкспрессирующих USF1, как описано ранее [24]. Электрофорез проводили в 6%-ном нативном полиакриламидном геле. Для переноса комплексов на нейлоновую мембрану использовали систему полусухого переноса. Мембрану подвергали УФ-облучению в течение 15 мин для сшивания. Сигналы биотина регистрировали с помощью хемилюминесцентного модуля для обнаружения нуклеиновых кислот Chemiluminescent Nucleic Acid Detection Module (“Thermofisher Scientific”) в соответствии с инструкциями производителя.
Анализ нуклеотидных последовательностей in silico. Предполагаемые сайты связывания факторов транскрипции в промоторной области гена ADAMTS-3 предсказаны с помощью MatInspector (программное обеспечение Genomatix) с порогом 0.9 [28, 29].
Статистический анализ. Стандартные отклонения значений p рассчитывали с помощью программного обеспечения Mini Tab 14 . Статистическую значимость оценивали с использованием однофакторного метода ANOVA.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
USF1 снижает экспрессию генов коллагена человека (типа I, II и III) в клетках остеосаркомы
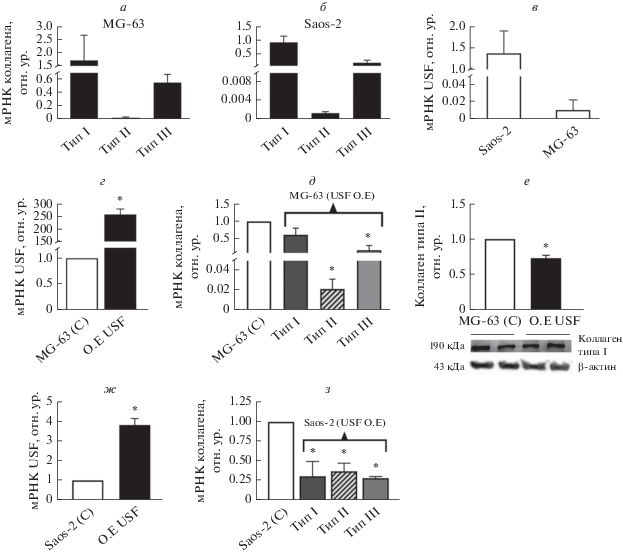
Известно, что ADAMTS-3 участвует в N-концевом процессинге проколлагена (главным образом коллагена типа II), поэтому мы определили уровни экспрессии генов коллагена типа I–III в перевиваемых остеобластах MG-63 и Saos-2. Количество мРНК оценивали методом ПЦР с использованием специфических пар праймеров (табл. 1). Показано, что как в клетках MG-63, так и Saos-2 преобладал коллаген типа I. В этих клетках обнаружены также коллагены типа III и II (рис. 1а, б). Эти клетки также различаются по уровню экспрессии эндогенного USF1 (рис. 1в). Чтобы оценить влияние белка USF1 на экспрессию этих типов коллагена, плазмиду, направляющую экспрессию hUSF1, трансфицировали в клетки MG-63 и Saos-2. Сверхэкспрессия USF1 подтверждена методом количественной ОТ-ПЦР с использованием специфических праймеров к USF1 (табл. 1) (рис. 1г, ж). Cверхэкспрессия USF1 в клетках MG-63 приводит к снижению экспрессии генов всех типов коллагена на уровне мРНК (рис. 1д). Экспрессия гена коллагена типа II снижается в 0.02 раза, III – в 0.2 и I – в 0.6 раза на уровне мРНК (рис. 1д). Эффект снижения уровня коллагена типа II выявлен при проведении вестерн-блот-анализа (рис. 1е). Влияние USF1 на коллаген этих типов изучено также на другой модели остеобластных клеток, Saos-2, чтобы лучше понять регуляцию экспрессии коллагена с помощью USF1 в клетках остеосаркомы. Сверхэкспрессия гена USF1 приводит к аналогичному снижению уровня мРНК всех типов коллагена статистически значимым образом (мРНК коллагенов I, II и III в 0.3, 0.4 и 0.3 раза соответственно). В клетках Saos-2 снижение уровня мРНК генов коллагена I и III было более выраженном, чем в MG-63 (рис. 1з).
Рис. 1.
а, б – Уровни экспрессии мРНК генов коллагенов I, II и III в клетках MG-63 и Saos-2. в – Уровни эндогенной экспрессии мРНК гена USF1 в клетках Saos-2 и MG-63. г – Подтверждение эктопической экспрессии USF на уровне мРНК в клетках MG-63 через 48 ч после трансфекции. д – Уровни мРНК коллагена I, II и III в клетках MG-63, сверхэкпрессирующих USF1. е – Уровень коллагена типа II в клетках MG-63, сверхэкпрессирующих USF1. ж – Подтверждение эктопической экспрессии USF на уровне мРНК в клетках Saos-2 через 48 ч после трансфекции. з – Уровни мРНК коллагена типа I, II и III в клетках Saos-2, сверхэкпрессирующих USF1. Звездочка – статистически значимые различия между группами (*p ≤ 0.05).
USF1 подавляет экспрессию гена ADAMTS-3 в двух различных моделях остеосаркомы
Чтобы оценить, регулирует ли белок USF1 экспрессию гена ADAMTS-3, методом количественной ОТ-ПЦР определили уровень мРНК ADAMTS-3 в образцах клеток MG-63, сверхэкспрессирующих USF1, и в контрольных образцах. Сверхэкспрессия USF1 привела к значительному снижению уровня мРНК ADAMTS-3 – в 0.4 раза по сравнению с контрольной группой (рис. 2а). Хотя USF1 значительно подавляет экспрессию мРНК гена ADAMTS-3, неизвестно, может ли USF1 снижать уровень кодируемого им белка. Уровень белка ADAMTS-3 детектировали также методом вестерн-блотинга в образцах клеток, сверхэкспрессирующих USF1 или контрольных. мРНК USF1 снижала уровень белка ADAMTS-3 в 0.56 раза (p ≤ 0.005, рис. 2б).
Рис. 2.
а, б – Экспрессия гена ADAMTS-3 на уровне мРНК и белка в клетках MG-63, сверхэкспрессирующих USF1. в, г – Экспрессия гена ADAMTS-3 на уровне мРНК и белка в клетках Saos-2, сверхэспрессирующих USF1. Звездочка – статистически значимые различия между группами (*р ≤ 0.05).
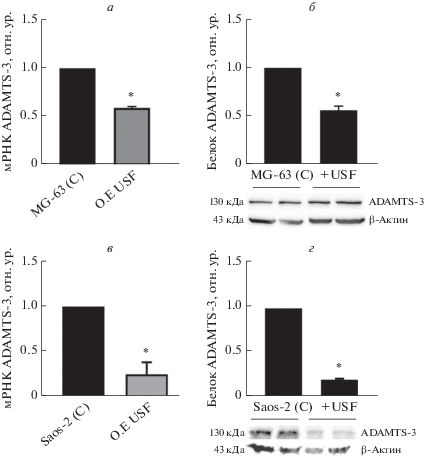
Снижение уровня мРНК и белка ADAMTS-3 в ответ на сверхэкспрессию USF1 было более выраженным в другой линии клеток остеосаркомы – Saos-2. В результате показали, что USF1 способен снижать уровень мРНК ADAMTS-3 (в 0.24 раза) и белка (в 0.2 раза) по сравнению с контролем (рис. 2в, г).
USF1 негативно регулирует активность промотора ADAMTS-3 в клетках Saos-2 и MG-63
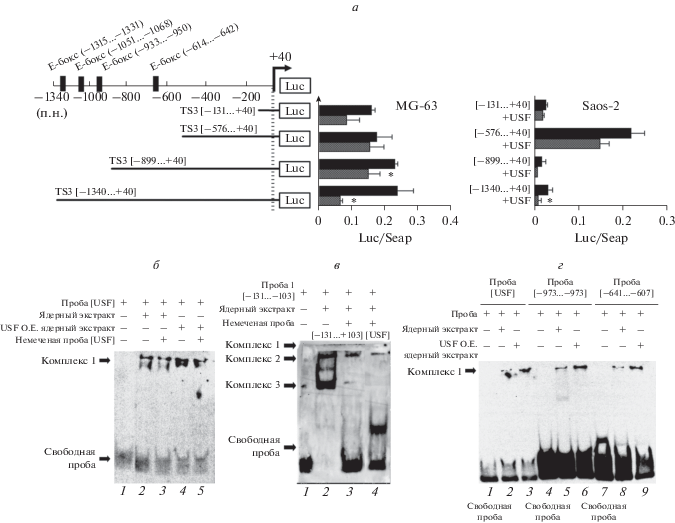
USF – это транскрипционный фактор с мотивом спираль-петля-спираль, который взаимодействует с последовательностями E-бокса в геноме [30]. Последовательности E-бокса выявлены в положениях –1315…–1331, –1051…–1068, –933…–950, и –614…–642 в области промотора гена ADAMTS-3. Чтобы понять, влияет ли USF1 на активность промотора ADAMTS-3, плазмиду, направляющую экспрессию USF1, котрансфицировали с четырьмя разными неполными фрагментами промотора ADAMTS-3, сконструированными ранее, а именно pMET_TS3[–131…+40], pMET_TS3[–576…+40], pMET_TS3[–879…+40] и pMET_TS3[–1340…+40], и определили люциферазную активность [24]. Как показано на рис. 3а, сверхэкспрессия USF1 незначительно снижает относительную активность люциферазы pMET_TS3[–131…+40] и pMET_TS3[–576…+40], которая не содержит мотива связывания USF1. Статистически значимым было снижение относительной люциферазной активности при исследовании промоторных конструкций pMET_TS3[–879…+40] и pMET_TS3[– ‒1340…+40], содержащих E-бокс, в клетках MG-63. Поскольку активность USF1 различалась в разных клетках, определили влияние этого фактора на активность промотора ADAMTS-3 и в других клетках остеосаркомы – Saos-2 [31]. В соответствии с данными, полученными на клетках MG-63, USF1 подавлял активность всех генетических вариантов промотора ADAMTS-3. Репрессия была статистически значимой в случае конструкции pMET_TS3[–1340…+40].
Рис. 3.
а – Относительная люциферазная активность промоторных репортерных конструкций ADAMTS-3 в клетках MG-63 и Saos-2, сверхэкспрессирующих USF. Схематическое изображение репортерных конструкций, использованных для транзиентной трансфекции (слева). Последовательности E-бокса показаны треугольниками. б, в, г – in vitro анализ связывания USF1 с промотором ADAMTS-3 методом EMSA. Звездочка – статистически значимое различие между группами (*p ≤ 0.05).
USF1 функционально связывает мотивы E-бокса в промоторной области ADAMTS-3
Взаимодействие между белком USF1 и промотором гена ADAMTS-3 изучали с помощью EMSA-анализа с использованием ядерных экстрактов клеток Saos-2 и биотин-меченых олигонуклеотидных зондов, а именно, консенсусного USF1-зонда, зонда 1 [–131…–103], зонда 2 [–641…–607] и зонда 3 [–973…–937]. Когда биотинилированный консенсусный зонд USF1 инкубировали с ядерным экстрактом Saos-2, в геле обнаруживали один комплекс (рис. 3б, дорожка 2). Специфичность последовательности ДНК-белкового комплекса проверяли, добавляя немеченый зонд USF1, в реакции связывания. Немеченый олигонуклеотид уменьшал образование комплекса (данные не показаны). Образование комплекса было сильнее, когда ядерный экстракт клеток, сверхэкспрессирующих USF1, инкубировали с биотинилированным зондом USF1, что свидетельствует о взаимодействии между USF1 и промотором ADAMTS-3 (рис. 3б, дорожка 3). Более прямые доказательства взаимодействия USF1 с последовательностями E-бокса в ядерных экстрактах клеток Saos-2 получали с помощью EMSA с использованием зондов [–641…–607] и [–973…–937]. В геле обнаружен один комплекс (рис. 3г, дорожки 5 и 8). Повышенная интенсивность образования комплексов в образцах, полученных из клеток, сверхэкспрессирующих USF1, указывает на специфическое взаимодействие между белком USF1 и промотором ADAMTS-3 (рис. 3г, дорожки 6 и 9).
По данным биоинформатического анализа последовательность E-бокса не обнаружена в области [–131…–103] промотора ADAMTS-3. Однако при использовании зонда [–131…–103] и ядерного экстракта Saos-2 в экспериментах EMSA получены три различных комплекса (рис. 3в, дорожка 2). Добавление немеченого зонда [–131…–103] препятствовало образованию комплексов 1 и 2, что указывает на специфическое связывание этого зонда с промотором ADAMTS-3 (рис. 3в, дорожка 3). Конкурентное связывание консенсусного зонда USF1 с зондом [–131…–103] также исключало образование комплексов 1 и 2. Эти результаты указывают на функциональное связывание белка USF1 с областью –131…–103 промотора ADAMTS-3.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Многообразие коллагенов и важность их функций послужила причиной проведения многочисленных исследований, направленных на изучение регуляторных элементов генов коллагенов, чтобы лучше понять молекулярные механизмы, контролирующие экспрессию этих генов в норме и при патологии. Регуляция транскрипционной активности генов коллагенов во многом зависит от типа клеток и других регуляторных факторов. Например, SOX9 действует как энхансер экспрессии коллагена типа II [32]. Обнаружено, что ELF3 модулирует транскрипцию гена коллагена типа II в хондроцитах [33]. Показано также, что YY1 может действовать как положительный регулятор транскрипции гена коллагена типа I [34]. В свою очередь, опосредованную USF1 регуляцию генов коллагена (I, II и III) ранее не изучали. Нами изучено влияние USF1 на транскрипцию гена коллагена типа II, основного субстрата ADAMTS-3, а также коллагенов I и III в моделях остеосаркомы. Помимо своей основной функции – N-концевого процессинга коллагена типа II, ADAMTS-3 способствует созреванию коллагенов типа I [35]. Согласно исследованиям, проведенным нами на клетках MG-63 и Saos-2, уровни экспрессии мРНК коллагенов типа I, II и III в этих линиях различаются, причем относительное содержание типов коллагена в этих клетках коррелирует с данными, полученными ранее [36, 37]. В обоих типах клеток сверхэкспрессия USF1 приводила к статистически значимому снижению уровней мРНК коллагенов типа I, II, III. Сверхэкспрессия USF1 приводила также к снижению уровня коллагена типа II, что подтверждает результат количественного определения мРНК в клетках MG-63. Влияние белка USF1 на экспрессию мРНК генов коллагена типа II и III в клетках MG-63 было сильнее выражено, чем в клетках Saos-2. С другой стороны, сверхэкспрессия USF1 в клетках Saos-2 приводила к сильному снижению уровня мРНК коллагена типа I.
Во-вторых, мы сосредоточились на опосредованной USF1 транскрипционной регуляции ADAMTS-3, вовлеченного в N-концевой процессинг проколлагенов I и II, а также на участии E‑бокса в промоторной области ADAMTS-3. Известно, что USF1 функционирует, взаимодействуя с мотивами E-бокса в геномных последовательностях. Итак, мы подумали, что USF1, вероятно, регулирует транскрипцию ADAMTS-3. Нами установлено, что в результате сверхэкспрессии USF1 в клетках MG-63 уровни экспрессии мРНК и белка ADAMTS-3 снизились в 0.6 раза. USF1 также уменьшил экспрессию мРНК и белка ADAMTS-3 в 0.2 раза в других клетках той же природы – Saos-2. Кроме того, мы показали, что котрансфекция белка USF1 снижает активность промотора ADAMTS-3. USF1 снижал максимальную активность промотора ADAMTS-3 pMET_TS3 [–1340…+40] и pMET_TS3 [–879…+40], включающего мотивы E-бокс, в клетках Saos-2. Хотя USF1 экспрессируется в клетках всех типов, однако уровень экспрессии зависит от типа клеток. Различия в уровнях экспрессии USF1, его транскрипционных кофакторов или других ДНК-связывающих белков могут приводить к изменению транскрипционной активности. Чтобы объяснить это, эффект белка USF1 был изучен на другой модели остеосаркомы – клетках MG-63. Как и в клетках Saos-2, USF1 подавлял активность промотора ADAMTS-3 и в клетках MG-63. Наконец, функциональное связывание белка USF1 с промотором ADAMTS-3 показано методом EMSA. Помимо консенсусного зонда USF1, зонды с последовательностью E-бокса, покрывающие области [–973…–937] и [–641…–607], формировали комплексы в геле. Кроме того, образование этих комплексов усиливалось при использовании клеточных экстрактов, сверхэкспрессирующих USF1. Хотя зонд, покрывающий область [–131…–103], не содержит последовательности E-бокса, методом EMSA подтверждено функциональное связывание USF1 с этой областью, вероятно, из-за функциональных взаимодействий между USF1 и другими регуляторными элементами. Таким образом, нами показано, что USF1 способен регулировать на уровне транскрипции синтез коллагенов типа I, II и III при остеосаркоме. USF1 связывает мотивы E-бокса в промоторе гена ADAMTS-3 и отрицательно регулирует этот ген, влияя тем самым на N-концевой процессинг проколлагенов типа II и I. Эти результаты способствуют пониманию регуляции генов коллагена и ADAMTS-3 в клетках остеосаркомы.
Клетки Saos-2 и экспрессионная плазмида USF1 любезно предоставлены Kenneth Wann и Dipak P. RAMJI (Cardiff, School of Biosciences, Cardiff UK) соответственно. Клетки MG-63 любезно предоставлены Berivan ÇEÇEN (Dokuzeylül University, Izmir, TURKEY).
Работа поддержана Советом по научно-техническим исследованиям Турции (TUBITAK), проект номер 114Z025.
Авторы заявляют об отсутствии конфликта интересов.
Статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Список литературы
Baumann S., Hennet T. (2016) Collagen accumulation in osteosarcoma cells lacking GLT25D1 collagen galactosyltransferase. J. Biol. Chem. 291, 18514–18524. https://doi.org/10.1074/jbc.M116.723379
Myllyharju J., Kivirikko K.I. (2004) Collagens, modifying enzymes and their mutations in humans, flies and worms. Trends Genet. 20, 33–43. https://doi.org/10.1016/j.tig.2003.11.004
Gelse K., Poschl E., Aigner T. (2003) Collagens—structure, function, and biosynthesis. Adv. Drug Deliv. Rev. 55(12), 1531–1546. https://doi.org/10.1016/j.addr.2003.08.002
Von der Mark K. (1999) Structure, biosynthesis and gene regulation of collagens in cartilage and bone. In: Dynamics Bone Cartilage Metabolism. Eds Seibel M.J., Robins S.P., Bilezikian J.P. San Diego: Acad. Press. 3– 29.
Hulmes D.J., Miller A. (1981) Molecular packing in collagen. Nature. 293, 234–239. https://doi.org/10.1038/230437a0
Rossert J., de Crombrugghe B. (2002) Type I collagen: structure, synthesis and regulation. In: Principles in Bone Biology. Eds Bilezkian J.P., Raisz L.G., Rodan G. Orlando: Acad. Press, 189–210.
Von der Mark K. (1981) Localization of collagen types in tissues. Int. Rev. Connect. Tissue Res. 9, 265–324.
Wu D., Chen K., Bai Y., Zhu X., Chen Z., Wang C., Zhao Y., Li M. (2014) Screening of diagnostic markers for osteosarcoma. Mol. Med. Repts. 10, 2415–2420. https://doi.org/10.3892/mmr.2014.2546
Pratap J., Galindo M., Zaidi S.K., Vradii D., Bhat B.M., Robinson J.A., Choi J.Y., Komori T., Stein J.L., Lian J.B., Stein G.S., van Wijnen A.J. (2003) Cell growth regulatory role of Runx2 during proliferative expansion of preosteoblasts. Cancer Res. 63(17), 5357–5362.
Thomas D.M., Johnson S.A., Sims N.A., Trivett M.K., Slavin J.L., Rubin B.P., Waring P., McArthur G.A., Walkley C.R., Holloway A.J., Diyagama D., Grim J.E., Clurman B.E., Bowtell D.D., Lee J.S., Gutierrez G.M., Piscopo D.M., Carty S.A., Hinds P.W. (2004) Terminal osteoblast differentiation, mediated by runx2 and p27KIP1, is disrupted in osteosarcoma. J. Cell Biol. 167(5), 925–934. https://doi.org/10.1083/jcb.200409187
Thomas D.M., Carty S.A., Piscopo D.M., Lee J.S., Wang W.F., Forrester W.C., Hinds P.W. (2001) The retinoblastoma protein acts as a transcriptional coactivator required for osteogenic differentiation. Mol. Cell. 8, 303–316. https://doi.org/10.1016/S1097-2765(01)00327-6
Mignatti P., Rifkin D.B. (1993) Biology and biochemistry of proteinases in tumor invasion. Physiol. Rev. 73, 161–195. https://doi.org/10.1152/physrev.1993.73.1.161
Holmbeck K., Bianco P., Caterina J., Yamada S., Kromer M., Kuznetsov S.A., Mankani M., Robey P.G., Poole A.R., Pidoux I., Ward J.M., Birkedal-Hansen H. (1999) MT1-MMP-deficient mice develop dwarfism, osteopenia, arthritis, and connective tissue disease due to inadequate collagen turnover. Cell. 99, 81–92.
Makareeva E., Han S., Vera J.C., Sackett D.L., Holmbeck K., Phillips C.L., Visse R., Nagase H., Leikin S. (2010) Carcinomas contain a matrix metalloproteinase-resistant isoform of type I collagen exerting selective support to invasion. Cancer Res. 70(11), 4366–4374. https://doi.org/10.1158/0008-5472
Yong H.Y., Moon A. (2007) Roles of calcium-binding proteins, S100A8 and S100A9, in invasive phenotype of human gastric cancer cells. Arch. Pharm. Res. 30, 75–81.
Chen P.N., Kuo W.H., Chiang C.L, Chiou H.L., Hsieh Y.S., Chu S.C. (2006) Black rice anthocyanins inhibit cancer cells invasion via repressions of MMPs and u-PA expression. Chem.-Biol. Interact. 163, 218–229. https://doi.org/10.1016/j.cbi.2006.08.003
Nabha S.M., dos Santos E.B., Yamamoto H.A., Belizi A., Dong Z., Meng H., Saliganan A., Sabbota A., Bonfil R.D., Cher M.L. (2008) Bone marrow stromal cells enhance prostate cancer cell invasion through type I collagen in an MMP-12 dependent manner. Int. J. Cancer. 122(11), 2482–2490. https://doi.org/10.1002/ijc.23431
Mori K., Enokida H., Kagara I., Kawakami K., Chiyomaru T., Tatarano S., Kawahara K., Nishiyama K., Seki N., Nakagawa M. (2009) CpG hypermethylation of collagen type I α 2 contributes to proliferation and migration activity of human bladder cancer. Int. J. Oncol. 34, 1593–1602. https://doi.org/10.3892/ijo_00000289
Rippe R.A., Umezawa A., Kimball J.P., Breindl M., Brenner D.A. (1997) Binding of upstream stimulatory factor to an E-box in the 3′-flanking region stimulates a1(I) collagen gene transcription. J. Biol. Chem. 272(3), 1753–1760.
Datta T.K., Rajput S.K., Wee G., Lee K., Folger J.K., Smith G.W. (2015) Requirement of the transcription factor USF1 in bovine oocyte and early embryonic development. Reproduction. 149, 203–212.
Goldring M.B., Sandell L.J. (2007) Transcriptional control of chondrocyte gene expression. Osteoarthritis, Inflammation Degradation: A Continuum. Eds Buckwalter J.A., Lotz M., Stoltz J.F. 70, 118–142.
Aydemir T.A., Alper M., Kockar F. (2018) SP-1 mediated downregulation of ADAMTS3 gene expression in osteosarcoma models. Gene. 659, 1–10.
Kockar F.T., Foka P., Hughes T.R., Kousteni S., Ramji D.P. (2001) Analysis of the Xenopus laevis CCAAT-enhancer binding protein alpha gene promoter demonstrates species-specific differences in the mechanisms for both autoactivation and regulation by Sp1. Nucl. Acids Res. 29, 362–372.
Alper M., Kockar F. (2014) IL-6 upregulates a disintegrin and metalloproteinase with thrombospondin motifs 2 (ADAMTS-2) in human osteosarcoma cells mediated by JNK pathway. Mol. Cell. Biochem. 393, 165–175.
Livak K.J., Schmittgen T.D. (2001) Analysis of relative gene expression data using real-time quantitative PCR and the 2(−DeltaDeltaC(T)) method. Methods. 25(4), 402–408.
Tokay E., Kockar F. (2016) Identification of intracellular pathways through which TGF-β1 upregulates URG-4/URGCP gene expression in hepatoma cells. Life Sciences. 144, 121–128. https://doi.org/10.1016/j.lfs.2015.12.010
Schneider C.A., Rasband W.S., Eliceiri K.W. (2012) NIH image to image: 25 years of image analysis. Nat. Methods. 9, 671–675.
Quandt K., Frech K., Karas H., Wingender E., Werner T. (1995) MatInd and MatInspector: new fast and versatile tools for detection of consensus matches in nucleotide sequence data. Nucl. Acids Res. 23, 4878–4884.
Cartharius K., Grote K., Klocke B., Haltmeier M., Klingenhoff A., Frisch M., Bayerlein M., Werner T. (2005) MatInspector and beyond: promoter analysis based on transcription factor binding sites. Bioinformatics. 21, 2933–2942. https://doi.org/10.1093/bioinformatics/bti473
Kiermaier A., Gawn J.M., Desbarats L., Saffrich R., Ansorge W., Farrell P.J., Eilers M., Packham G. (1999) DNA binding of USF is required for specific E-box dependent gene activation in vivo. Oncogene. 18(51), 7200–7211. https://doi.org/10.1038/sj.onc.1203166
Qyang Y., Luo X., Lu T., Ismail P.M., Krylov D., Vinson C., Sawadogo M. (1999) Cell-type dependent activity of the ubiquitous transcription factor USF in cellular proliferation and transcriptional activation. Mol. Cell. Biol. 19(2), 1508–1517.
Yasuda H., Oh C., Chen D., Crombrugghe B., Kim J.H. (2017) A novel regulatory mechanism of type II collagen expression via a SOX9-dependent enhancer in intron 6. J. Biol. Chem. 292(2), 528–538. https://doi.org/10.1074/jbc.M116.758425
Otero M., Peng H., Hachem K.E., Culley K.L., Wondimu E.B., Quinn J., Asahara H., Tsuchimochi K., Ko Hashimoto K., Goldring M.B. (2017) ELF3 modulates type II collagen gene (COL2A1) transcription in chondrocytes by inhibiting SOX9-CBP/p300-driven histone acetyltransferase activity. Connect. Tissue Res. 58(1), 15–26. https://doi.org/10.1080/03008207.(2016)1200566
Riquet F.B., Tan L., Choy B.K., Osaki M., Karsenty G., Osborne T.F., Auron P.E., Goldring M.B. (2001) YY1 is a positive regulator of transcription of the Col1a1 gene. J. Biol. Chem. 276(42), 38665–38672.
Le Goff C., Somerville R.P., Kesteloot F., Powell K., Birk D.E., Colige A.C., Apte S.S. (2006) Regulation of procollagen amino-propeptide processing during mouse embryogenesis by specialization of homologous ADAMTS proteases: insights on collagen biosynthesis and dermatosparaxis. Development. 133(8), 1587–1596.
Pautke C., Schieker M., Tischer T., Kolk A., Neth P., Mutschler W., Milz S. (2004) Characterization of osteosarcoma cell lines MG63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24, 3743–3748.
Fernandes R.J., Harkey M.A., Weis M., Askew J.W., Eyre D.R. (2007) The post-translational phenotype of collagen synthesized by Saos-2 osteosarcoma cells. Bone. 40(5), 1343–1351.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


