Молекулярная биология, 2021, T. 55, № 4, стр. 606-616
Комбинация цис-регуляторных элементов ARE и HRE повышает активность опухолеспецифического промотора hTERT
С. В. Калиниченко a, И. В. Коробко a, М. В. Шепелев b, *
a Институт биологии гена Российской академии наук
119334 Москва, Россия
b Центр высокоточного редактирования и генетических технологий для биомедицины,
Институт биологии гена Российской академии наук
119334 Москва, Россия
* E-mail: mshepelev@mail.ru
Поступила в редакцию 17.12.2020
После доработки 18.02.2021
Принята к публикации 26.02.2021
Аннотация
Опухолеспецифические промоторы и цис-регуляторные генетические элементы используют для транскрипционного контроля экспрессии терапевтических трансгенов в генной терапии рака. Цис-регуляторные элементы ответа на гипоксию (HRE) и антиоксидантного ответа (ARE), служащие мишенями транскрипционных факторов HIF1 и Nrf2, соответственно, опосредуют активацию транскрипции генов в ответ на гипоксию и окислительный стресс, присущие многим солидным опухолям. На этом свойстве основано применение элементов HRE и ARE в конструкциях для генной терапии рака с целью обеспечения опухолеспецифической экспрессии терапевтических трансгенов или репликации онколитических аденовирусов. На основе опухолеспецифического промотора hTERT сконструированы гибридные промоторы, несущие комбинации элементов HRE и ARE. Показано, что при имитации гипоксии в клеточных линиях рака легкого человека активность гибридного промотора HRE-ARE-hTERT существенно выше активности промоторов, несущих только HRE или ARE. На модели суицидальной генной терапии рака легкого in vitro с использованием системы фермент–пролекарство (цитозиндезаминаза : урацил-фосфорибозилтрансфераза/5-фторцитозин) показано, что при имитации гипоксии цитотоксический эффект от экспрессии цитозиндезаминазы : урацил-фосфорибозилтрансферазы под контролем промотора HRE-ARE-hTERT значимо выше, чем под контролем промоторов HRE-hTERT и ARE-hTERT. Новый гибридный промотор HRE-ARE-hTERT может найти применение для транскрипционного контроля экспрессии терапевтических трансгенов или репликации онколитических аденовирусов при разработке новых геннотерапевтических противоопухолевых средств.
ВВЕДЕНИЕ
Клиническое применение генной терапии началось в 1990 году с ретровирусной доставки гена аденозиндезаминазы в T-лимфоциты пациента с наследственным иммунодефицитом [1]. В настоящее время разрабатываются преимущественно противоопухолевые геннотерапевтические препараты [2]. Важное направление развития технологий и стратегий генной терапии – создание векторов для генной терапии рака [3]. Такие векторы находят применение для экспрессии терапевтических трансгенов при суицидальной генной терапии с использованием систем фермент–пролекарство, в которых фермент катализирует превращение нетоксичного пролекарства в токсичный метаболит, убивающий опухолевую клетку [4, 5]. При разработке подходов к генной терапии опухолей проблему представляет достижение оптимальной экспрессии терапевтического трансгена в опухолевых клетках. Это подразумевает определенный уровень продукции терапевтического трансгена для эффективной элиминации опухолевых клеток, а также опухолеспецифичность экспрессии трансгена для минимизации побочного действия геннотерапевтического препарата на неопухолевые клетки [4]. Одна из стратегий обеспечения опухолеспецифической экспрессии трансгенов основана на транскрипционном контроле (transcriptional targeting) за счет использования опухолеспецифических или тканеспецифических промоторов, а также цис-регуляторных генетических элементов или их комбинаций [6]. Например, промотор гена теломеразной обратной транскриптазы человека (hTERT) активен в широком спектре опухолей и используется в транскрипционном контроле терапевтических трансгенов [7], однако это достаточно слабый промотор, что указывает на необходимость повышения его активности с сохранением опухолеспецифичности.
Цис-действующие регуляторные элементы ответа на окислительный стресс (ARE) находят в промоторах генов, кодирующих белки антиоксидантной защиты, ферменты детоксикации, белки-транспортеры ксенобиотиков, которые обеспечивают защиту клеток от окислительного стресса [8]. Фактор транскрипции Nrf2, основной регулятор генов антиоксидантной защиты, связывается с элементами ARE в промоторах генов-мишеней и активирует их транскрипцию. Для опухолевых клеток характерен повышенный уровень продукции активных форм кислорода, обусловленный генетическими или метаболическими изменениями, который сопровождается аберрантной активацией механизмов антиоксидантной защиты и сигнального пути Keap1-Nrf2 [9]. Эти молекулярные изменения лежат в основе использования элементов ARE в генетических конструкциях для генной терапии рака.
В частности, эффективность элементов ARE из гена GCLM (glutamate-cysteine ligase modifier subunit) человека в векторах для суицидальной генной терапии показана ранее на мышиной модели рака легкого при модификации минимального промотора SV40 [10]. На клеточных линиях рака легкого нами показано, что ARE-элементы гена GCLM повышают активность промотора hTERT, не влияя на опухолеспецифический характер экспрессии [11].
Состояние гипоксии, характерное для большинства солидных опухолей, рассматривается как рациональная основа для использования цис-регуляторных элементов ответа на гипоксию (HRE, hypoxia response elements) в геннотерапевтических конструкциях [12]. Элементы HRE присутствуют в промоторах генов, кодирующих белки, обеспечивающие оксигенацию тканей и рост сосудов, и служат мишенью индуцируемого гипоксией гетеродимерного транскрипционного фактора HIF1 (Hypoxia inducible factor 1). В условиях гипоксии стабилизируется субъединица HIF1α, которая связывается с конститутивно экспрессируемой субъединицей HIF1β, формируя транскрипционно активный комплекс [13].
Цис-регуляторные элементы HRE достаточно давно применяют в конструкциях для генной терапии рака, чтобы обеспечить опухолеспецифическую экспрессию трансгенов [12]. HRE комбинировали как с минимальными вирусными промоторами, так и с такими цис-регуляторными элементами, как ERE (Estrogen response element) [14–17], или с опухолеспецифическими промоторами, например, с промотором гена α-фетопротеина человека для контроля репликации онколитического вируса [18]. Кроме того, создан ряд онколитических вирусов, несущих HRE-элементы и промотор hTERT. Однако в этом случае промотор и цис-регуляторные элементы HRE не были объединены в гибридном промоторе, а контролировали экспрессию различных транскриптов. В частности, ген E1A аденовируса находился под контролем промотора hTERT, а ген E1B – под контролем элемента HRE [19–22].
Таким образом, каждый из элементов – ARE и HRE – способен обеспечить опухолеспецифическую экспрессию трансгена, однако до настоящего времени комбинацию этих элементов в векторах для генной терапии рака не применяли. Предположили, что комбинация ARE и HRE может повысить активность опухолеспецифического промотора hTERT и эффективность суицидальной генной терапии по сравнению с использованием только одного генетического элемента.
Таким образом, цель данной работы состояла в изучении влияния комбинации цис-регуляторных элементов ARE и HRE на активность опухолеспецифического промотора hTERT и эффективность генной терапии рака на модели суицидальной генной терапии in vitro с использованием ЦД:УФРТ/5ФЦ в качестве системы фермент–пролекарство.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Плазмиды. В работе использовали плазмиды pGL3-Basic и pRL-TK компании “Promega”, США. Плазмиды phTERT-Luc и pARE-hTERT-Luc, кодирующие репортерный ген люциферазы под контролем промоторов hTERT и ARE-hTERT, и плазмида pCR-3DNMT1, несущая 3′НТО транскрипта гена ДНК-метилтрансферазы 1 человека (DNMT1) описаны ранее [11, 23, 24]. Плазмида pCI-FCU1, несущая кДНК ЦД:УФРТ, и полученная на основе вектора pCI “Promega”, любезно предоставлена М. Костиной (ИБХ РАН). Для получения плазмиды p2×HRE-Luc, кодирующей ген люциферазы под контролем двух копий HRE-элемента длиной 22 п.н. из гена LdhA мыши, синтетические одноцепочечные олигонуклеотиды (5′-ccggagctcCGGACGTGCGGGAACCCACGTGaaCGGACGTGCGGGAACCCACGTGcagct-3′ и 5′-gCACGTGGGTTCCCGCACGTCCGttCACGTGGGTTCCCGCACGTCCGgagctccgggtac-3′ (HRE-элемент выделен заглавным шрифтом, коровая последова-тельность HRE подчеркнута) гибридизовали для формирования двухцепочечного олигонуклеотида с липкими концами и клонировали по сайтам KpnI–SacI в вектор pGL3-Basic. Для получения плазмид, экспрессирующих люциферазу под контролем четырех и шести копий HRE-элементов (p4×HRE-Luc и p6×HRE-Luc соответственно), те же двухцепочечные олигонуклеотиды клонировали по сайтам KpnI–SacI в плазмиды p2×HRE-Luc и p4×HRE-Luc соответственно. Плазмиду pHRE-hTERT-Luc получали путем клонирования промотора hTERT из вектора phTERT-Luc по сайтам XhoI–HindIII в плазмиду p6×HRE-Luc. Фрагмент Ecl136I–SmaI из плазмиды p6×HRE-Luc клонировали в плазмиду pARE-hTERT-Luc по сайтам EcoRV или KpnI (обработан T4-ДНК-полимеразой), получая плазмиды pARE-HRE-hTERT-Luc и pHRE-ARE-hTERT-Luc соответственно.
Плазмиды для экспрессии химерного белка ЦД:УФРТ конструировали на основе векторов pBK-CMV и pBluescriptII SK(–), оба “Stratagene” США. C этой целью на матрице плазмид pARE-hTERT-Luc, pCI-FCU1 и pCR-DNMT1 с помощью ПЦР амплифицировали нуклеотидные последовательности элемента ARE (праймеры 5′‑ggtaccgtcgactgagtaacggttacgaagc-3′ и 5′-aagcttaagatatcaagacaatgactaagcagaa-3′), промотора hTERT (5′-ggtaccgatatccacagacgcccaggac-3′ и 5′-aagcttaaagtcgacccacgtgcgcagcagg-3′), химерного интрона из вектора pCI (5′-aagcttgaagttggtcgtgaggca-3′ и 5′‑gaattcaattgaactgggagtggac-3′), кДНК ЦД : УФРТ (5′-ggtaccaagcttgaattccaccatggtgaca-3′ и 5′-gcggccgctcgactcgagttaaacacagtagtatctgt-3′) и 3′НТО из гена DNMT1 человека (5′-atgcggccgctgtttctggcaccaggaat-3′ и 5′-attctagacttaagtggtttataggagagattta-3′) и клонировали продукты ПЦР в вектор pCR-Blunt (“Invitrogen”, США). Полученные плазмиды полностью секвенировали. Далее в вектор pBK-CMV клонировали 3'НТО DNMT1 по сайтам NotI–XbaI, из полученного вектора удаляли фрагмент SalI–XhoI, вектор лигировали сам на себя. В полученную плазмиду клонировали кДНК ЦД:УФРТ по сайтам KpnI–NotI, затем химерный интрон по сайтам HindIII–EcoRI, получая вектор pBK-INT-FCU1-3DNMT1, в который клонировали промотор hTERT по сайтам KpnI–HindIII, получая вектор pBK-hTERT-INT-FCU1-3DNMT1. Экспрессионные кассеты клонировали из векторов на основе pBK-CMV в вектор pBluescriptII SK(–) по сайтам KpnI–SacI, получая плазмиды pBl-INT-FCU1-3DNMT1 (контрольная плазмида без промотора) и pBl-hTERT-INT-FCU1-3DNMT1. Вектор pBl-ARE-hTERT-INT-FCU1-3DNMT1 получали путем клонирования ARE элемента в вектор pBK-INT-FCU1-3DNMT1 по сайтам KpnI–HindIII, последующего клонирования экспрессионной кассеты по сайтам KpnI–SacI в pBluescriptII SK(–) и клонирования промотора hTERT в полученный вектор по сайтам EcoRV–HindIII. Плазмиду pBl-HRE-ARE-hTERT-INT-FCU1-3DNMT1 получали путем клонирования фрагмента Ecl136I–SmaI с элементами HRE из плазмиды p6×HRE-Luc в вектор pBl-ARE-hTERT-INT-FCU1-DNMT1 по сайту KpnI, обработанному T4-ДНК-полимеразой. Плазмиду pBl-HRE-hTERT-INT-FCU1-3DNMT1 получали путем клонирования Ecl136I–HindIII (обработан фрагментом Кленова) фрагмента из вектора p6×HRE-hTERT-Luc в плазмиду pBl-INT-FCU1-3DNMT1 по сайту HindIII (обработан фрагментом Кленова). Плазмиду pBl-ARE-HRE-hTERT-INT-FCU1-DNMT получали путем клонирования HincII–HincII-фрагмента из плазмиды pARE-HRE-hTERT-Luc в вектор pBl-INT-FCU1-3DNMT по сайту HindIII (обработан фрагментом Кленова). Плазмидную ДНК из клеток Escherichia coli выделяли с использованием набора GenElute Plasmid MiniPrep Kit (“Sigma”, США) в соответствии с протоколом производителя.
Культуры клеток. Клетки линий NCI-H1299 (ATCC #CRL-5803), Calu-1 (ECACC, #93120818) и A549 (ATCC, #CRL-185) культивировали в среде DMEM/F12 (“HyClone”, США) с добавлением 10%-ной фетальной бычьей сыворотки (“HyClone”), 100 ед./мл пенициллина и 100 мкг/мл стрептомицина (“Gibco”, США). Клетки трансфицировали плазмидной ДНК, используя реагент EcoTransfect (“OZ Bioscience”, Франция).
Люциферазный анализ. Клетки линий NCI-H1299, Calu-1 и A549 рассевали в лунки 24-луночного планшета в плотности 20 000, 40 000 и 30 000 клеток на лунку, соответственно, в трех повторах для каждой экспериментальной точки. На следующий день клетки трансфицировали смесью указанных репортерных плазмид, экспрессирующих люциферазу светлячка, вместе с плазмидой pRL-TK, экспрессирующей люциферазу Renilla под контролем промотора гена тимидинкиназы вируса простого герпеса. Через 24 ч после трансфекции меняли среду и инкубировали клетки в присутствии 100 мкМ CoCl2 или без добавления CoCl2 в течение 24 ч, после чего измеряли активности люцифераз с помощью набора реагентов Dual-Luciferase® Reporter Assay System “Promega” в соответствии с протоколом производителя на люминометре GloMax 20/20 “Promega”. Активность люциферазы светлячка нормировали по активности люциферазы Renilla, вычисляли среднее значение люминесценции (ОЕЛ) и стандартное отклонение (СО).
Измерение цитотоксического эффекта. Оценку цитотоксического эффекта в схеме суицидальной генной терапии in vitro на основе системы фермент–пролекарство ЦД:УФРТ/5ФЦ проводили на клеточных линиях рака легкого человека. В первый день клетки линий NCI-H1299, A549 и Calu-1 рассевали в 1 мл среды в лунки 12-луночного планшета в плотности 40 000, 60 000 и 80 000 клеток на лунку соответственно. На второй день клетки трансфицировали соответствующими плазмидами. На третий день трансфицированные клетки рассевали в 96-луночный планшет в плотности 1200, 1800 и 2400 клеток на лунку в 100 мкл среды (по три повтора для каждой экспериментальной точки). На четвертый день к клеткам добавляли CoCl2 и/или 5ФЦ и инкубировали в течение 3 суток в присутствии 100 мкМ CoCl2 и/или 200 мкМ (NCI-H1299), или 500 мкМ (A549, Calu-1) 5ФЦ, либо без добавления CoCl2 и 5ФЦ. На восьмой день меняли культуральную среду на свежую, содержащую CoCl2 и 5ФЦ, как указано выше. На девятый день измеряли количество живых клеток в лунках, используя набор реагентов CellTiter96® AQueous One Solution Cell Proliferation Assay (“Promega”). Вычисляли среднее количество живых клеток в лунках, выраженное в относительных единицах (ОЕ), и стандартное отклонение (СО). Статистическую значимость различий между средними значениями количества живых клеток оценивали с помощью двунаправленного непарного t-критерия Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Выбор элементов HRE
Элементы HRE находят в промоторах многих индуцируемых гипоксией генов, таких как EPO (эритропоэтин), VEGFA (фактор А роста сосудистого эндотелия), PGK1 (фосфоглицераткиназа 1), LDHA (лактатдегидрогеназа A) [25]. Коровая последовательность HRE состоит из пяти нуклеотидов (5′-ACGTG-3′) и может располагаться в любой ориентации относительно сайта инициации транскрипции [26]. В условиях гипоксии, как показано ранее, нативные HRE из промотора гена LdhA мыши обеспечивают бóльшую индукцию репортерного гена по сравнению с часто используемыми элементами HRE из гена PGK1 человека. Аденовирус, экспрессирующий терапевтический трансген под контролем комбинации минимального промотора и HRE из гена LdhA, вызывал эффективную регрессию опухоли в мышиной модели [27]. Поэтому для включения в гибридный промотор выбрали элемент HRE длиной 22 п.н. из гена LdhA мыши (5′-CGGACGTGCGGGAACCCACGTG-3′), расположенный в геноме в обратной ориентации относительно сайта инициации транскрипции и несущий две копии корового HRE-элемента (подчеркнут). Элемент HRE расположен в положении –27…–48 относительно сайта начала транскрипции для мРНК гена LdhA мыши (NM_010699.2).
Анализ активности элементов HRE из гена LdhA
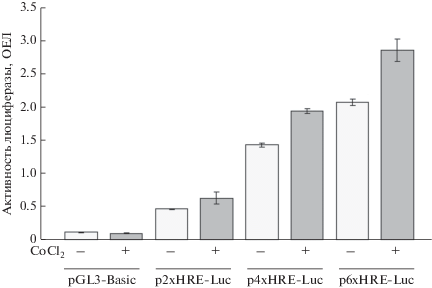
Функциональность выбранных HRE-элементов гена LdhA мыши анализировали, используя плазмидные конструкции на основе беcпромоторного вектора pGL3-Basic, несущие репортерный ген люциферазы под контролем двух, четырех и шести копий HRE-элемента (плазмиды p2×HRE-Luc, p4×HRE-Luc и p6×HRE-Luc соответственно, рис. 1). Определена активность люциферазы в транзиторно трансфицированных клетках линии NCI-H1299 в отсутствие или в присутствии 100 мкМ хлорида кобальта, обработка которым стабилизирует транскрипционный фактор HIF1α, имитируя тем самым условия гипоксии [28]. Установлено, что элементы HRE из гена LdhA мыши способны активировать транскрипцию репортерного гена, а степень его активации пропорциональна числу HRE-элементов (рис. 1), что характерно и для HRE из других генов [25]. Обработка хлоридом кобальта вызывала умеренное увеличение активности репортерного гена. Полученные данные указывают на то, что элемент HRE из гена LdhA функционален и способен активировать транскрипцию даже в отсутствие минимального промотора. С целью дальнейшего использования в генетических конструкциях для генной терапии выбран вариант, несущий шесть копий HRE и обладающий максимальной транскрипционной активностью (рис. 1).
Рис. 1.
Анализ активности репортерного гена люциферазы под контролем двух, четырех и шести копий HRE-элементов из гена LdhA мыши. Данные показаны в относительных единицах люминесценции (ОЕЛ) для люциферазы светлячка после нормирования по активности люциферазы Renilla как среднее значение для трех экспериментальных точек ± СО. Светло-серый цвет (–) – необработанные клетки; темно-серый цвет (+) – клетки, культивируемые в присутствии 100 мкМ хлорида кобальта (CoCl2) в течение 24 ч перед анализом активности люциферазы. Показаны результаты одного репрезентативного эксперимента (два независимых повтора).
Анализ активности гибридных промоторов с комбинацией цис-регуляторных элементов ARE и HRE
Для оценки возможного синергизма в действии ARE- и HRE-элементов на активность опухолеспецифического промотора hTERT получены плазмиды, экспрессирующие репортерный ген люциферазы под контролем ARE из гена GCLM человека и шести копий HRE-элемента, при дистальном и проксимальном расположении HRE-элемента относительно ARE (рис. 2а). Активность репортерного гена люциферазы, под контролем вариантов промотора hTERT анализировали в клетках линий рака легкого человека NCI-H1299, Calu-1 и А549, обработанных хлоридом кобальта в течение 24 ч для имитации гипоксии или без нее.
Рис. 2.
Повышение активности опухолеспецифического промотора hTERT в клеточных линиях рака легкого человека за счет комбинирования цис-регуляторных элементов HRE и ARE. а – Схемы плазмидных конструкций для экспрессии люциферазы (Luc) светлячка под контролем вариантов промотора hTERT. Все плазмиды содержали 3'-НТО вируса SV40 (3SV40). б–г – Анализ активности репортерного гена люциферазы под контролем вариантов промотора hTERT в клетках линий NCI-H1299 (б), A549 (в) и Calu-1 (г). Активность люциферазы светлячка показана в относительных единицах люминесценции (ОЕЛ) после нормирования на активность люциферазы Renilla (приведены средние значения для трех экспериментальных точек ± СО). Светло-серый цвет (–) – необработанные клетки; темно-серый цвет (+) – клетки, культивируемые в присутствии 100 мкМ хлорида кобальта (CoCl2) в течение 24 ч перед определением активности люциферазы. Показаны результаты одного репрезентативного эксперимента из двух независимых повторов.
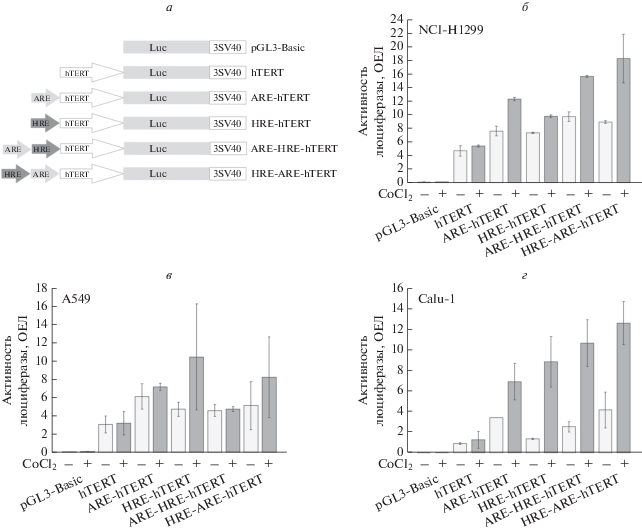
В отсутствие имитации условий гипоксии (образцы ${\text{CoCl}}_{2}^{ - }$) добавление ARE- и HRE-элементов или их комбинаций незначительно повышало активность промотора hTERT (в 1.6 раза для ARE-hTERT и HRE-hTERT и ~2 раза для ARE-HRE-hTERT и HRE-ARE-hTERT) в клетках линии NCI-H1299, при этом активность промоторов с комбинацией цис-элементов была статистически значимо выше активности промоторов, несущих лишь один цис-элемент (рис. 2б). Обработка хлоридом кобальта (образцы ${\text{CoCl}}_{2}^{ + }$) не влияла на активность промотора hTERT и вызывала умеренную активацию промоторов ARE-hTERT и HRE-hTERT. Обработка хлоридом кобальта приводила к 1.7–2.0-кратной активации промоторов с комбинацией цис-регуляторных элементов (ARE-HRE-hTERT и HRE-ARE-hTERT). При этом активность промоторов с комбинацией цис-элементов была значимо выше, чем промоторов ARE-hTERT и HRE-hTERT (рис. 2б).
В клетках линии Calu-1 в отсутствие имитации гипоксии (образцы ${\text{CoCl}}_{2}^{ - }$) добавление ARE повышало активность промотора hTERT в 3.8 раза (ARE-hTERT), добавление HRE-элемента не вызывало существенного эффекта (активация в 1.5 раза (HRE-hTERT)), а активность промоторов с комбинациями элементов ARE и HRE не отличалась статистически значимо от активности промотора ARE-hTERT (рис. 2г). Обработка хлоридом кобальта (образцы ${\text{CoCl}}_{2}^{ + }$) не влияла на активность промотора hTERT, но вызывала существенную активацию остальных гибридных промоторов. При этом активности промоторов ARE-hTERT, HRE-hTERT и ARE-HRE-hTERT не различались статистически значимо, а активность промотора HRE-ARE-hTERT была примерно в 2 раза выше активности промотора ARE-hTERT (рис. 2г) и в 9.88 раза выше активности немодифицированного промотора hTERT (рис. 2г).
В клетках линии А549 активность промотора ARE-hTERT примерно в 2 раза превышала активность промотора hTERT как при имитации гипоксии, так и в нормальных условиях, что соответствует данным [11]. Не выявлено значимых различий в активности HRE-hTERT, ARE-HRE-hTERT и HRE-ARE-hTERT по сравнению с промотором hTERT как при имитации гипоксии, так и в нормальных условиях (рис. 2в).
Таким образом, в клеточных линиях NCI-H1299 и Calu-1 рака легкого человека максимальная активность репортерного гена люциферазы детектировалась при использовании промотора HRE-ARE-hTERT в условиях, имитирующих гипоксию.
Повышение эффективности суицидальной генной терапии рака в схеме фермент–пролекарство in vitro при использовании гибридного промотора с комбинацией HRE- и ARE-элементов
Далее эффективность новых гибридных промоторов с комбинациями HRE- и ARE-элементов оценивали in vitro на модели суицидальной генной терапии фермент–пролекарство ЦД:УФРТ/5ФЦ в клетках рака легкого человека. Клетки трансфицировали плазмидами, экспрессирующими ЦД:УФРТ под контролем различных вариантов гибридных промоторов, и контрольной плазмидой без промотора (рис. 3а). Все экспрессионные конструкции включали химерный интрон из вектора pCI (“Promega”) для повышения уровня экспрессии ЦД:УФРТ и 3'НТО из гена DNMT1 человека, которая способствует повышению опухолеспецифичности экспрессии трансгена [24]. Клетки инкубировали в присутствии пролекарства 5ФЦ и хлорида кобальта для имитации гипоксии, и оценивали цитотоксический эффект от экспрессии терапевтического трансгена ЦД:УФРТ.
Рис. 3.
Модификация опухолеспецифического промотора hTERT с помощью комбинации HRE- и ARE-элементов усиливает цитотоксическое действие терапевтического трансгена в модели суицидальной генной терапии in vitro с использованием системы фермент–пролекарство ЦД:УФРТ/5ФЦ. а – Схемы плазмидных конструкций для экспрессии химерного белка ЦД:УФРТ (CD:UPRT). Все плазмиды содержали гибридный интрон (INT) и 3'НТО из транскрипта гена DNMT1 человека (3DNMT1). б, в – Клетки линии NCI-H1299 инкубировали (б) без CoCl2 (0 мкМ CoCl2) в присутствии 200 мкМ 5ФЦ (5ФЦ+) или без добавления 5ФЦ (5ФЦ–), либо (в) в присутствии 100 мкМ CoCl2 и 200 мкМ 5ФЦ (5ФЦ+) или без добавления 5ФЦ (5ФЦ–). г, д – Клетки линии Calu-1 инкубировали либо (г) без CoCl2 (0 мкМ CoCl2) в присутствии 500 мкМ 5ФЦ (5ФЦ+) или без добавления 5ФЦ (5ФЦ–), либо (д) в присутствии 100 мкМ CoCl2 и 500 мкМ 5ФЦ (5ФЦ+) или без добавления 5ФЦ (5ФЦ–). Приведены средние значения количества живых клеток в трех лунках для каждой экспериментальной точки относительно клеток, трансфицированных той же плазмидой, но инкубированных без добавления 5ФЦ, (ОЕ ± СО). Показаны результаты одного репрезентативного эксперимента из двух независимых повторов. Экспериментальные точки, количество живых клеток в которых различалось статистически значимо (p < 0.05; двунаправленный t-критерий Стьюдента), отмечены знаком *.
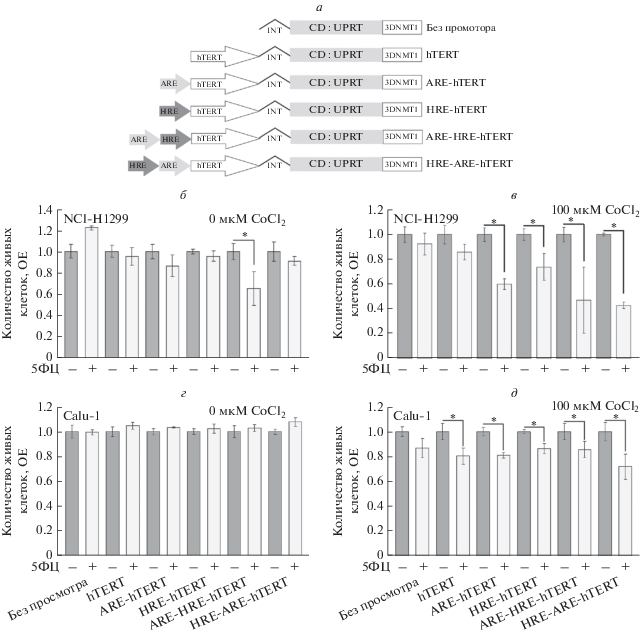
В клетках линии NCI-H1299 цитотоксический эффект экспрессии ЦД:УФРТ под контролем промотора ARE-HRE-hTERT наблюдали даже при инкубации клеток с 5ФЦ в отсутствие имитации гипоксии (рис. 3б, ARE-HRE-hTERT; 5ФЦ– и 5ФЦ+; p = 0.0256). При инкубации клеток с 5ФЦ в условиях, имитирующих гипоксию, отмечали существенный цитотоксический эффект экспрессии ЦД:УФРТ под контролем промоторов ARE-hTERT (p = 0.0007), HRE-hTERT (p = 0.0204), ARE-HRE-hTERT (p = 0.0294) и HRE-ARE-hTERT (p = = 0.0001), но не при использовании немодифицированного промотора hTERT или в отсутствие промотора (рис. 3в). При этом цитотоксический эффект при использовании промотора HRE-ARE-hTERT был статистически значимо выше, чем при экспрессии ЦД:УФРТ под контролем промоторов ARE-hTERT и HRE-hTERT (рис. 3в).
Экспрессия ЦД:УФРТ под контролем промотора hTERT и всех его модификаций (но не в составе беспромоторной конструкции) приводила к умеренному, но статистически значимому снижению количества живых клеток линии Calu-1 при добавлении 500 мкМ 5ФЦ только при инкубации клеток в присутствии 100 мкм CoCl2 (рис. 3г, д). Однако в клетках Calu-1, в отличие от клеток NCI-H1299, не выявлено значимых различий в цитотоксическом эффекте 5ФЦ при использовании промоторов с отдельными цис-элементами и их комбинациями.
Культивирование клеток линии A549 в присутствии 5ФЦ, но без имитации гипоксии не приводило к развитию цитотоксического эффекта, по сравнению с клетками, трансфицированных теми же плазмидами, но инкубуемых без 5ФЦ. При инкубации клеток A549 с 5ФЦ в присутствии 100 мкМ хлорида кобальта наблюдали статистически значимый (p = 0.00274; двунаправленный t‑критерий Стьюдента) цитотоксический эффект, вызванный экспрессией ЦД:УФРТ под контролем промотора HRE-hTERT, по сравнению с клетками, инкубированными без 5ФЦ. Цитотоксический эффект при использования промоторов с комбинацией элементов HRE и ARE не был статистически значимым (данные не показаны).
Таким образом, результаты, полученные на клеточной линии NCI-H1299, указывают на то, что гибридный промотор HRE-ARE-hTERT наиболее эффективен при экспрессии терапевтического трансгена в схеме суицидальной генной терапии рака легкого in vitro с использованием системы фермент–пролекарство (ЦД:УФРТ/5ФЦ).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Опухолеспецифический промотор hTERT достаточно давно находит применение в генетических конструкциях для генной терапии рака в силу того, что реактивация экспрессии гена TERT характерна для широкого спектра опухолей человека [29]. Однако промотор hTERT достаточно слабый, а его активность варьирует в зависимости от клеточных линий [23]. C целью поиска способов повышения активности промотора hTERT и создания более универсального опухолеспецифического промотора, активного в различных опухолях, мы оценили влияние комбинации ранее охарактеризованных элементов ARE из гена GCLM человека [10, 11, 30] и HRE-элементов из гена LdhA мыши [27] на активность промотора hTERT и эффективность суицидальной генной терапии рака с использованием системы фермент–пролекарство ЦД:УФРТ/5ФЦ in vitro.
Активность гибридных промоторов, несущих комбинации ARE и HRE, проанализировали в клеточных линиях рака легкого человека – NCI-H1299, Calu-1 и A549, высокий уровень ARE-зависимой транскрипции в которых обусловлен аберрантной активацией фактора транскрипции Nrf2 [11]. Показано, что в клеточной линии NCI-H1299 (как при имитации гипоксии, так и в нормальных условиях) активность промоторов с комбинацией цис‑действующих элементов (HRE-ARE-hTERT и ARE-HRE-hTERT) значимо выше, чем у промоторов, несущих лишь один из цис-регуляторных элементов. Не выявлено значимых различий в активности промоторов, несущих один цис-элемент или их комбинацию, в клетках линии Calu-1 в отсутствие имитации гипоксии. Однако при обработке клеток хлоридом кобальта отмечено существенное повышение активности промоторов, несущих как отдельные цис-элементы, так и их комбинации, а активность промотора HRE-ARE-hTERT была статистически значимо выше активности промотора ARE-hTERT (рис. 2г). Совокупность полученных результатов свидетельствует о синергическом действии цис-элементов ARE и HRE в контроле транскрипции репортерного гена люциферазы в клеточных линиях рака легкого. Это действие может проявляться как при имитации гипоксии, так и в нормальных условиях (клетки NCI-H1299) или только при имитации гипоксии (клетки Calu-1).
Известно, что промотор гена TERT человека содержит HRE-элементы и активируется в ответ на гипоксию [31]. Однако регуляция транскрипции гена TERT опосредована многими транскрипционными факторами, например, аберрантно активированным MYC, а также эпигенетическими механизмами [32]. Мы не обнаружили активацию репортерного гена под контролем промотора hTERT в клетках, обработанных хлоридом кобальта (рис. 2). По всей видимости, стабилизация фактора HIF-1α под действием хлорида кобальта не вносит существенного вклада в базальный уровень активности промотора hTERT в использованных клеточных линиях. Важно отметить, что существенная активация репортерного гена в ответ на обработку хлоридом кобальта отмечалась только после модификации промотора hTERT (добавление элементов ARE и HRE или их комбинации), но не при использовании немодифицированного промотора hTERT (рис. 2б, г). При этом максимальную активность промотора обеспечивала комбинация элементов HRE и ARE.
Оценка эффективности гибридных промоторов на модели суицидальной генной терапии in vitro на основе системы фермент–пролекарство ЦД:УФРТ/5ФЦ показала, что экспрессия ЦД:УФРТ под контролем промотора HRE-ARE-hTERT вызывает цитотоксический эффект в клетках линии NCI-H1299, инкубируемых в присутствии 5ФЦ в условиях имитации гипоксии. Этот эффект был существенно выше эффекта, наблюдаемого при экспрессии ЦД:УФРТ под контролем промоторов, несущих только один из цис-действующих элементов (рис. 3в). Однако использование комбинации элементов HRE и ARE не привело к статистически значимому усилению цитотоксического эффекта в клетках линии Calu-1 в условиях имитации гипоксии, несмотря на то что по результатам измерения активности люциферазы промотор HRE-ARE-hTERT был значимо активнее промотора ARE-hTERT. Это может быть обусловлено менее эффективной трансфекцией клеток Calu-1 по сравнению с NCI-H1299 и тем, что в отличие от определения активности люциферазы, цитотоксический эффект измеряли через 8 дней после трансфекции. За это время часть клеток может утратить трансфицированные плазмиды. Кроме того, клетки линии Calu-1 менее чувствительны к 5ФЦ, и для развития выраженного цитотоксического эффекта при экспрессии ЦД:УФРТ под контролем промотора ARE-hTERT требуется инкубация в присутствии 500–1000 мкМ 5ФЦ, в отличие от клеток NCI-H1299, существенный цитотоксический эффект в которых детектируется уже при 50–100 мкМ 5ФЦ [11]. В клетках линии A549 статистически значимый цитотоксический эффект выявлен лишь при использовании промотора HRE-hTERT и инкубации клеток в присутствии 5ФЦ и хлорида кобальта. Отсутствие существенного влияния комбинации цис-элементов на активность репортерного гена люциферазы в клетках A549 коррелирует в данном случае с отсутствием цитотоксического эффекта в схеме суицидальной генной терапии.
Таким образом, в схеме суицидальной генной терапии рака легкого in vitro с использованием системы фермент–пролекарство ЦД:УФРТ/5ФЦ в клетках линии NCI-H1299 в условиях имитации гипоксии гибридный промотор HRE-ARE-hTERT был более эффективным, чем промоторы, несущие лишь один цис-регуляторный элемент. В совокупности с результатами люциферазного анализа это свидетельствует о синергичном действии элементов HRE и ARE. Важно отметить, что мы имитировали условия гипоксии с помощью простой и доступной обработки клеток хлоридом кобальта. Можно предположить, что в условиях реальной гипоксии активность гибридного промотора HRE-ARE-hTERT и эффективность суицидальной генной терапии могут существенно возрасти.
Элементы ARE находят применение не только в генной терапии рака, но и в терапии сердечно-сосудистых патологий, ассоциированных с повышенной генерацией активных форм кислорода [30]. Подход, основанный на комбинировании элементов ARE и HRE, был применен ранее в генной терапии ишемического инсульта. В частности, создан вектор, экспрессирующий фактор транскрипции Nrf2 под контролем минимального цитомегаловирусного промотора, несущий комбинацию HRE-элементов из гена VEGF и элементов ARE из гена глутатион-S-трансферазы [33]. В этой экспериментальной системе именно комбинация элементов ARE и HRE обеспечивала максимальную защиту нейронов от гибели [33], что согласуется с результатами нашей работы. Cheng и соавт. [33] использовали систему фермент–пролекарство HSV-tk/ганцикловир, ARE и HRE других генов, модифицировали минимальный цитомегаловирусный промотор. Важно отметить, что именно в нашей работе впервые показан синергизм в действии элементов ARE и HRE в составе опухолеспецифического промотора hTERT на модели суицидальной генной терапии рака легкого.
Нами показана принципиальная возможность повышения активности опухолеспецифического промотора для генной терапии рака с помощью комбинации цис-регуляторных элементов ARE и HRE. Дальнейшая оптимизация предложенного подхода может включать анализ активности комбинаций элементов ARE и HRE из других генов и комбинаций ARE и HRE с другими опухолеспецифическими или тканеспецифическими промоторами. Все это может существенно повысить эффективность предложенного подхода к генной терапии рака на основе комбинирования элементов ARE и HRE.
В данной работе мы сконструировали новый гибридный промотор для генной терапии рака путем комбинирования цис-действующих генетических элементов ARE и HRE и опухолеспецифического промотора hTERT. Показано, что в клеточной линии NCI-H1299 рака легкого человека активность гибридного промотора HRE-ARE-hTERT существенно выше активности промоторов, несущих лишь один цис-элемент, как при имитации гипоксии, так и в нормальных условиях, а в клетках линии Calu-1 активность гибридного промотора HRE-ARE-hTERT статистически значимо превышала активность промотора ARE-hTERT, но не HRE-hTERT, только при имитации гипоксии. На клетках NCI-H1299 установлено, что промотор HRE-ARE-hTERT более эффективен в схеме суицидальной генной терапии рака легкого in vitro с использованием системы фермент–пролекарство ЦД:УФРТ/5ФЦ по сравнению с промоторами ARE-hTERT и HRE-hTERT. Полученные данные позволяют рассматривать HRE-ARE-hTERT как перспективный промотор для дальнейшей разработки противоопухолевых генотерапевтических препаратов. Промотор HRE-ARE-hTERT может найти применение в контроле экспрессии трансгенов в системах фермент–пролекарство или при создании онколитических аденовирусов, что будет способствовать повышению эффективности генной терапии рака и расширению спектра онкологических заболеваний, к которым применима генная терапия.
Данная работа поддержана грантом № 075-15-2019-1661 Министерства науки и высшего образования Российской Федерации.
В работе использована инфраструктура Центра коллективного пользования Института биологии гена Российской академии наук
В работе не использованы животные или биологические материалы, полученные от людей.
Авторы сообщают об отсутствии конфликта интересов.
Список литературы
Blaese R.M., Culver K.W., Miller A.D., Carter C.S., Fleisher T., Clerici M., Shearer G., Chang L., Chiang Y., Tolstoshev P., Greenblatt J.J., Rosenberg S.A., Klein H., Berger M., Mullen C.A., Ramsey W.J., Muul L., Morgan R.A., Anderson W.F. (1995) T lymphocyte-directed gene therapy for ADA-SCID: initial trial results after 4 years. Science. 270, 475–480.
Anguela X.M., High K.A. (2019) Entering the modern era of gene therapy. Annu. Rev. Med. 70, 273–288.
Pahle J., Walther W. (2016) Vectors and strategies for nonviral cancer gene therapy. Expert. Opin. Biol. Ther. 16, 443–461.
Das S.K., Menezes M.E., Bhatia S., Wang X.Y., Emdad L., Sarkar D., Fisher P.B. (2015) Gene therapies for cancer: strategies, challenges and successes. J. Cell. Physiol. 230, 259–271.
Malekshah O.M., Chen X., Nomani A., Sarkar S., Hatefi A. (2016) Enzyme/prodrug systems for cancer gene therapy. Curr. Pharmacol. Rep. 2, 299–308.
Dorer D.E., Nettelbeck D.M. (2009) Targeting cancer by transcriptional control in cancer gene therapy and viral oncolysis. Adv. Drug Deliv. Rev. 61, 554–571.
Fujiwara T., Urata Y., Tanaka N. (2007) Telomerase-specific oncolytic virotherapy for human cancer with the hTERT promoter. Curr. Cancer Drug Targets 7, 191–201.
Narayanan D., Ma S., Özcelik D. (2020) Targeting the redox landscape in cancer therapy. Cancers. 12.
Purohit V., Simeone D.M., Lyssiotis C.A. (2019) Metabolic regulation of redox balance in cancer. Cancers. 11.
Leinonen H.M., Ruotsalainen A.K., Maatta A.M., Laitinen H.M., Kuosmanen S.M., Kansanen E., Pikkarainen J.T., Lappalainen J.P., Samaranayake H., Lesch H.P., Kaikkonen M.U., Yla-Herttuala S., Levonen A.L. (2012) Oxidative stress-regulated lentiviral TK/GCV gene therapy for lung cancer treatment. Cancer Res. 72, 6227–6235.
Kalinichenko S.V., Shepelev M.V., Vikhreva P.N., Korobko I.V. (2017) A novel hybrid promoter ARE-hTERT for cancer gene therapy. Acta Naturae. 9, 66–73.
Javan B., Shahbazi M. (2017) Hypoxia-inducible tumour-specific promoters as a dual-targeting transcriptional regulation system for cancer gene therapy. Ecancermedicalscience 11, 751. https://doi.org/10.3332/ecancer.2017.751
Semenza G.L. (2002) HIF-1 and tumor progression: pathophysiology and therapeutics. Trends Mol. Med. 8, 02317–02311.
Dachs G.U., Patterson A.V., Firth J.D., Ratcliffe P.J., Townsend K.M., Stratford I.J., Harris A.L. (1997) Targeting gene expression to hypoxic tumor cells. Nat. Med. 3, 515–520.
Hsiao H.T., Xing L., Deng X., Sun X., Ling C.C., Li G.C. (2014) Hypoxia-targeted triple suicide gene therapy radiosensitizes human colorectal cancer cells. Oncol. Rep. 32, 723–729.
Gomes E.M., Rodrigues M.S., Phadke A.P., Butcher L.D., Starling C., Chen S., Chang D., Hernandez-Alcoceba R., Newman J.T., Stone M.J., Tong A.W. (2009) Antitumor activity of an oncolytic adenoviral-CD40 ligand (CD154) transgene construct in human breast cancer cells. Clin. Cancer Res. 15, 1317–1325.
Hernandez-Alcoceba R., Pihalja M., Qian D., Clar-ke M.F. (2002) New oncolytic adenoviruses with hypoxia- and estrogen receptor-regulated replication. Hum. Gene The. 13, 1737–1750.
Gao Y., Zhu Y., Huang X., Ai K., Zheng Q., Yuan Z. (2015) Gene therapy targeting hepatocellular carcinoma by a dual-regulated oncolytic adenovirus harboring the focal adhesion kinase shRNA. Int. J. Oncol. 47, 668–678.
Zhu W., Zhang H., Shi Y., Song M., Zhu B., Wei L. (2013) Oncolytic adenovirus encoding tumor necrosis factor-related apoptosis inducing ligand (TRAIL) inhibits the growth and metastasis of triple-negative breast cancer. Cancer Biol. Ther. 14, 1016–1023.
Wang X., Su C., Cao H., Li K., Chen J., Jiang L., Zhang Q., Wu X., Jia X., Liu Y., Wang W., Liu X., Wu M., Qian Q. (2008) A novel triple-regulated oncolytic adenovirus carrying p53 gene exerts potent antitumor efficacy on common human solid cancers. Mol. Cancer Ther. 7, 1598–1603.
Xie M., Niu J.H., Chang Y., Qian Q.J., Wu H.P., Li L.F., Zhang Y., Li J.L., Huang X.J., Ruan G.R. (2009) A novel triple-regulated oncolytic adenovirus carrying PDCD5 gene exerts potent antitumor efficacy on common human leukemic cell lines. Apoptosis. 14, 1086–1094.
Zhao H.C., Zhang Q., Yang Y., Lu M.Q., Li H., Xu C., Chen G.H. (2007) p53-expressing conditionally replicative adenovirus CNHK500-p53 against hepatocellular carcinoma in vitro. World J. Gastroenterol. 13, 683–691.
Shepelev M.V., Kopantzev E.P., Vinogradova T.V., Sverdlov E.D., Korobko I.V. (2016) hTERT and BIRC5 gene promoters for cancer gene therapy: a comparative study. Oncol. Lett. 12, 1204–1210.
Shepelev M.V., Korobko E.V., Georgiev G.P., Sverdlov E.D., Korobko I.V. (2011) Application of mRNA regulatory regions to improve tumor specificity of transgene expression. Cancer Gene Ther. 18, 682–684.
Marignol L., Lawler M., Coffey M., Hollywood D. (2005) Achieving hypoxia-inducible gene expression in tumors. Cancer Biol. Ther 4, 359–364.
Gao S., Zhou J., Zhao Y., Toselli P., Li W. (2013) Hypoxia-response element (HRE)-directed transcriptional regulation of the rat lysyl oxidase gene in response to cobalt and cadmium. Toxicol. Sci. 132, 379–389.
Cowen R.L., Williams K.J., Chinje E.C., Jaffar M., Sheppard F.C., Telfer B.A., Wind N.S., Stratford I.J. (2004) Hypoxia targeted gene therapy to increase the efficacy of tirapazamine as an adjuvant to radiotherapy: reversing tumor radioresistance and effecting cure. Cancer Res. 64, 1396–1402.
Munoz-Sanchez J., Chanez-Cardenas M.E. (2019) The use of cobalt chloride as a chemical hypoxia model. J. Appl. Toxicol. 39, 556–570.
Gu J., Fang B. (2003) Telomerase promoter-driven cancer gene therapy. Cancer Biol. Ther. 2, S64–70.
Hurttila H., Koponen J.K., Kansanen E., Jyrkkänen H.K., Kivelä A., Kylätie R., Ylä-Herttuala S., Levonen A.L. (2008) Oxidative stress-inducible lentiviral vectors for gene therapy. Gene Ther. 15, 1271–1279.
Nishi H., Nakada T., Kyo S., Inoue M., Shay J.W., Isaka K. (2004) Hypoxia-inducible factor 1 mediates upregulation of telomerase (hTERT). Mol.Cell. Biol. 24, 6076–6083.
Yuan X., Larsson C., Xu D. (2019) Mechanisms underlying the activation of TERT transcription and telomerase activity in human cancer: old actors and new players. Oncogene. 38, 6172–6183.
Cheng M.Y., Lee I.P., Jin M., Sun G., Zhao H., Steinberg G.K., Sapolsky R.M. (2011) An insult-inducible vector system activated by hypoxia and oxidative stress for neuronal gene therapy. Transl. Stroke Res. 2, 92–100.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


