Молекулярная биология, 2021, T. 55, № 4, стр. 683-696
Влияние свободных жирных кислот на накопление липидов, активацию лизосом и сдвиг метаболизма различных культивируемых клеток в сторону гликолиза
Х. С. Вишнякова a, К. В. Попов a, X. Pan a, М. В. Ясько a, Е. Е. Егоров a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: yegorov58@gmail.com
Поступила в редакцию 08.12.2020
После доработки 18.01.2021
Принята к публикации 21.01.2021
Аннотация
Любые гидрофобные молекулы, присутствующие в избытке, становятся опасными для клеток, поскольку растворяются в мембранах и нарушают их функции. Данные о влиянии свободных жирных кислот (СЖК) на клетки достаточно противоречивы. В представленной работе изучено действие СЖК на различные клетки человека в культуре. Показано, что добавление СЖК с длинной цепью (олеиновой, пальмитиновой, линолевой, линоленовой и др.) вызывает разнообразные эффекты в культивируемых клетках различного типа. В клетках (прежде всего в гепатоцитах и мышечных клетках) начинают накапливаться липиды, в них активируется первый этап аутофагии (активация лизосом) и происходит разобщение окислительного фосфорилирования. Хотя потребление кислорода клетками увеличивается, их энергетический метаболизм сдвигается в пользу гликолиза. Все эти эффекты выражены в разной степени в разных клетках и при добавлении разных СЖК. Обсуждаются механизмы действия СЖК, а также возможные биологические и медицинские приложения полученных результатов.
ВВЕДЕНИЕ
Липиды вообще и свободные жирные кислоты (СЖК) в частности обладают плохой растворимостью в воде и перемещаются внутри организма с помощью различных переносчиков, таких как хиломикроны, липопротеиды различной плотности, альбумин и липидсвязывающие белки.
До открытия пенициллина СЖК рассматривали как перспективные антибиотики. Антимикробное действие СЖК против возбудителя сибирской язвы обнаружил еще Роберт Кох в 1890 г. [1]. И в наше время продолжается изучение антимикробных эффектов жирных кислот, причем отмечается практическая невозможность возникновения у микробов резистентности к СЖК [2].
Считается, что основной антимикробный эффект СЖК связан с модификацией мембран. Описывают как прямое детергентное действие, так и модификации мембран, приводящие к нарушению дыхания и подавлению энергетики [3]. Эндогенные СЖК участвуют в антимикробной защите организма [4], а также широко используются в составе кремов для подавления роста грибков и лечения акне.
Механизмы действия СЖК на клетки человека чрезвычайно многообразны. Во-первых, СЖК – это высокоэнергетический субстрат, который подвергается бета-окислению и “питает” (ацетатом) цикл Кребса. Во-вторых, СЖК становятся готовыми блоками для синтеза фосфолипидов и триглицеридов. Организм человека “экономит” усилия, и часто жирные кислоты, поступившие с пищей, полностью входят в состав более сложных липидов [5]. Эта экономия способна модифицировать свойства мембран, изменяя их жирнокислотный состав.
СЖК входят в состав липидов, обладающих высокой биологической активностью: диацилглицеридов (вторичных посредников) и лизофосфатидных кислот (липидных гормонов, действие которых опосредуется рецепторами) [6].
СЖК являются лигандами рецепторов, активируемых пролифераторами пероксисом (PPAR, peroxisome proliferator-activated receptors), которые, в свою очередь, влияют на энергетический метаболизм, регулируя обмен глюкозы и биогенез митохондрий через индукцию транскрипционных факторов FOXO1 и PGC1-α. Известен ряд ядерных рецепторов, взаимодействующих с СЖК: LXR (печеночный рецептор Х, liver-X receptor), FXR (рецептор Х фарнезоида, farnesoid-X receptor), RAR (рецептор ретиноевой кислоты, retinoic acid receptor), VDR (рецептор витамина D, vitamin D receptor), TR (рецептор тиреоидного гормона, thyroid hormone receptor), HNF4a (ядерный фактор гепатоцитов 4а, Hepatocyte nuclear factor 4a). На поверхности клеток находятся сопряженные с G-белками рецепторы, узнающие СЖК (GPR40 и GPR120) [7].
До 2018 года даже полагали, что пальмитат активирует TLR4, однако оказалось, что это не так [8].
Жирные кислоты являются предшественниками огромного семейства простаноидов (простагландинов, тромбоксанов, лейкотриенов, резолвинов и др.), включающего тысячи соединений, ключевых регуляторов (индукторов и “завершателей”) воспаления [9]. Подавляющее большинство используемых сегодня противовоспалительных лекарств (аспирин, парацетамол, ибупрофен, индометацин и др.) это, по сути, ингибиторы образования простаноидов из СЖК. Один из механизмов действия глюкокортикоидов (дексаметазона) состоит в усилении экспрессии аннексинов, которые снижают доступность фосфолипидов для фосфолипаз А2 – ферментов, производящих сырье для простаноидов.
Данные об эффектах СЖК на клетки человека крайне противоречивы. Прежде всего, следует отметить существенные различия во влиянии СЖК на клетки разной дифференцировки [10–12]. Возможно, что многие противоречия обусловлены различиями в условиях экспериментов и в переносе данных, полученных в одной модели, на другую (работы на выделенных митохондриях, на клетках, in vivo).
Жирные кислоты проявляют свойства разобщителей окислительного фосфорилирования. Эндогенные разобщители действуют как регуляторы термогенеза. Именно этот механизм позволяет животным и человеку выживать в условиях низких температур и переживать зиму в условиях гибернации [13]. С другой стороны, известно, что разобщители способны увеличивать продолжительность жизни и бороться с распространенными патологиями [14].
Существуют только два варианта производства энергии в клетках человека: гликолиз и окислительное фосфорилирование. Соотношение этих процессов по-разному меняется в разных клетках в зависимости от энергетических потребностей и не только. В процессе гликолиза в клетках накапливается лактат. Отношение к лактату за последние годы претерпело существенный поворот. Если в течение примерно 100 лет его считали побочным бросовым продуктом, то теперь рассматривают теории о том, что лактат, возможно, является ключевым редокс-регулятором метаболизма [15]. В 2020 году опубликована статья, в которой лактат назван “гадким утенком” энергетического метаболизма [16]. Действительно, недавно показали, что подавление цепи переноса электронов и соответствующее увеличение продукции лактата стимулирует стволовые клетки волос и запускает цикл роста волоса [17–19].
Целью нашей работы было всестороннее изучение действия длинноцепочечных СЖК на разные типы клеток в культуре при стандартных условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клетки. В работе использовали следующие клеточные культуры: 977 – штамм эмбриональных фибробластов человека (получен от С.М. Терехова, МГНЦ РАМН); 977 hTERT – эмбриональные фибробласты, экспрессирующие белковый компонент теломеразы (получены самостоятельно); 1608 hTERT – линия фибробластов кожи взрослого человека, иммортализованных введением гена белкового компонента теломеразы человека (исходные штамм получен от С.М. Терехова, иммортализация проведена нами [20]); IC-21 – перевиваемая культура макрофагов мыши; Caki-1 – культура, полученная из светлоклеточного рака почки человека (сохраняет ряд характеристик первичной культуры); HepG2 – культура гепатоклеточной карциномы человека (сохраняет ряд характеристик гепатоцитов); SK-N-SH – культура нейробластомы человека; L6 – культура скелетных миобластов крысы; HaCat – иммортализованные кератиноциты человека.
Клетки (кроме IC-21) культивировали при 37°С в атмосфере 5% углекислого газа в среде DMEM (“ПанЭко”, Россия) с содержанием глюкозы 4.5 г/л и добавлением глутамина, гентамицина (40 мкг/мл) и 10% эмбриональной сыворотки крупного рогатого скота. Клетки IC-21 культивировали в среде RPMI-1640 с теми же добавками.
Опыты по изучению действия СЖК проводили в полной среде с сывороткой.
Реактивы. Определяли влияние длинноцепочечных СЖК на различные параметры жизнедеятельности клеток в культуре. В анализе использовали следующие жирные кислоты:
1. Пальмитиновая кислота, насыщенная С16:0, (“Sigma-Aldrich” P0500, CША);
2. Олеиновая кислота, С18:1, цис, омега 9 (“Sigma-Aldrich” O1630);
3. Линоленовая кислота, С18:3, омега 3, цис, цис, цис 9,12,15 (“Sigma-Aldrich” L2376);
4. Линолевая кислота, С18:2 омега 6, цис, цис 9,12 (“Sigma-Aldrich” L8134);
5. Конъюгированная линолевая кислота С18:2, смесь изомеров цис и транс 9,11 и 10,12. (“Sigma-Aldrich” O5507);
6. Элаидиновая кислота (транс-изомер олеиновой кислоты) (“Sigma-Aldrich” E4637);
7. Смесь перечисленных жирных кислот.
Для перевода СЖК в раствор готовили комплексы СЖК с сывороточным альбумином: смешивали горячий спиртовой раствор жирных кислот с теплым (37°С) раствором бычьего сывороточного альбумина (7–10%). После этого рН раствора доводили до 7.2–7.4 с помощью 10% гидроксида натрия. Раствор фильтровали через фильтр с диаметром пор 0.2 мкм, делили на аликвоты и хранили при –20°С.
Лактат определяли с использованием набора Lactate-Glo™ Assay (“Promega”, США) согласно рекомендациям производителя. Добавленная лактатдегидрогеназа реагирует с лактатом с образованием NADH. В присутствии NADH специальная редуктаза превращает пролюциферин в люциферин, который выявляют с помощью люциферазы. Измерения проводили через 2 дня после добавления СЖК.
Уровень глюкозы в среде определяли с помощью тест-полосок OneTouch Select Plus через 2 дня после добавления СЖК. При расчетах разницу между начальной и конечной концентраций глюкозы нормировали на количество клеток.
Потребление кислорода определяли с использованием набора ab197243 Extracellular O2 Consumption Reagent (“AbCAM”, Великобритания). Применяли методику, указанную производителем. К живым клеткам добавляли чувствительный к кислороду флуоресцентный краситель, диффузию кислорода из воздуха блокировали специальным (из набора) минеральным маслом. Кислород вызывает тушение флуоресценции красителя, уменьшая время жизни возбужденного состояния, которое измеряли, используя планшетный мультимодальный ридер Spark (“Tecan”, Швейцария), согласно рекомендациям производителя.
Жировые включения выявляли в клетках, фиксированных 4%-ным формальдегидом и окрашенных насыщенным раствором красителя Sudan 4. Морфологию клеток определяли с помощью инвертированного фазово-контрастного микроскопа Diaphot (“Nikon”, Япония) и фотоаппарата Nikon D5000.
Состояние лизосом оценивали с помощью прижизненной микроскопии клеток, окрашенных акридиновым оранжевым (1 мкг/мл) непосредственно в ростовой среде [21]. Фотографировали с помощью микроскопа Olympus BX53.
Активацию лизосом определяли с использованием проточного цитофлуориметра BD LSRFortessa. СЖК добавляли за сутки до измерения. Клетки снимали трипсином. Суспензию клеток (5 × 105 клеток/мл) окрашивали акридиновым оранжевым в течение 15 мин. Зеленую и красную флуоресценцию регистрировали в каналах FITC и PE-Cy5-5 соответственно.
Транскриптомный анализ проводили с использованием прибора HiSeq 2000 (“Illumina”, США), как описано ранее [22]. Смесь СЖК (суммарная концентрация 500 мкМ) добавляли к клеткам 1608hTERT за 24 ч до эксперимента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Первичный анализ эффектов СЖК
Токсичные концентрации СЖК были определены в предварительных экспериментах. С этой целью к растущим клеткам однократно добавляли СЖК в разных концентрациях. В концентрации 500 мкМ все использованные СЖК в разной степени угнетали рост клеток. При этом конъюгированная линолевая кислота оказывала цитотоксическое действие на клетки IC-21 и на HepG2, вызывая их гибель уже через 2 дня. Кератиноциты HaCat оказались наиболее, а макрофаги IC-21 – наименее устойчивыми к СЖК клетками.
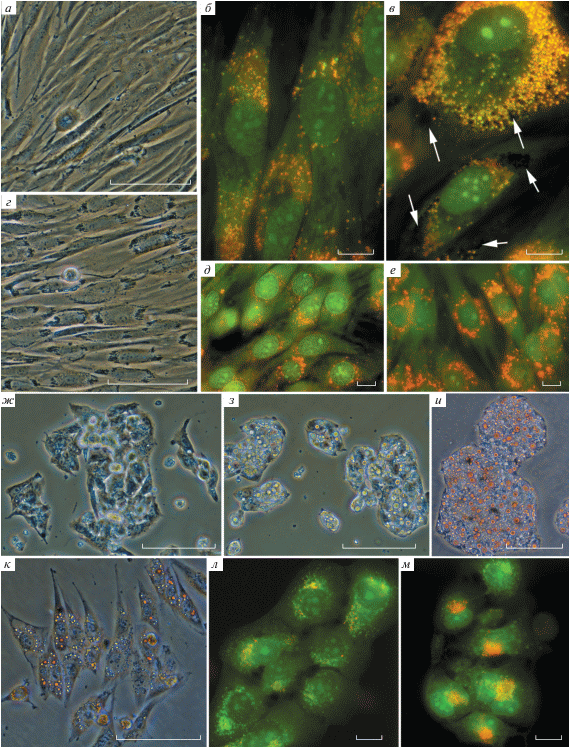
Действие СЖК приводило к специфическим изменениям морфологии клеток. В цитоплазме появлялись и росли гранулы, расположенные вокруг ядра (рис. 1г). Витальное окрашивание акридиновым оранжевым показало, что основой этого гранулярного материала являются лизосомы (рис. 1б, в, е, л, м). Также образуются в разной степени выраженные липидные пузырьки, которые при окрашивании акридиновым оранжевым выглядят черными (рис. 1в).
Рис. 1.
Видимые эффекты добавления СЖК к клеткам. а, б, в, г – клетки 977; д, е, к – клетки L6; ж, з, и – клетки HepG2; л, м – клетки HaCat. а, б, д, ж – Контроли. г – Добавление линоленовой кислоты. Видно, что вокруг ядер клеток собрался какой-то гранулярный материал, сильно преломляющий свет. Видна митотическая клетка. в – Гранулярный материал представлен активированными лизосомами (красные) и гидрофобными вакуолями (черные, показаны белыми стрелками), куда не входит акридиновый оранжевый. е – Хорошо заметна активация лизосом (красные). з – Клетки HepG2 после воздействия элаидиновой кислоты. Видны крупные круглые вакуоли. и – Окраска Суданом 4 выявляет липидные включения. к – Клетки L6 в присутствии конъюгированной линолевой кислоты, видны липидные включения; л – HaCat в присутствии пальмитиновой кислоты; м – HaCat в присутствии конъюгированной линолевой кислоты. а, г, ж, з, и, к – Фазовый контраст; и, к – окраска Суданом 4; б, в, д, е, л, м – окраска акридиновым оранжевым. Масштабный отрезок 100 мкм (а, г, ж, з, и, к); 10 мкм (б, в, д, е, л, м).
Комбинируя различные СЖК, мы получили смесь, отдаленно напоминающую смесь жирных кислот в плазме крови человека [23], которая сравнительно мало токсична для всех исследованных клеток. Эта смесь состоит из 65% олеиновой, 22% линолевой, 10% пальмитиновой и 3% линоленовой кислот и в концентрации 250 мкМ (суммарная концентрация СЖК) не вызывает угнетения роста всех исследованных клеток. В концентрации 500 мкМ смесь СЖК вызывает подавление пролиферации (однократное введение, длительность эксперимента 3 дня).
Степень активации лизосом и образования липидных включений были разными в разных клетках и при действии различных СЖК. Активацию лизосом (первый этап аутофагии) наблюдали, начиная с концентрации СЖК 125 мкМ. С помощью проточной цитометрии с прижизненной окраской акридиновым оранжевым проведено количественное исследование активации лизосом в клетках 1608hTERT (рис. 2). Известно, что соотношение красного и зеленого сигналов акридинового оранжевого отражает уровень аутофагии, определенный в других тестах [21].
Рис. 2.
Исследование активации лизосом с помощью акридинового оранжевого в клетках 1608hTERT. СЖК (по 500 мкМ) добавляли к клеткам за 24 ч до опыта. Приведены распределения сигналов зеленой и красной флуоресценции, а также бокового рассеяния (мера гранулярности объекта). На всех гистограммах по оси абсцисс показана интенсивность флуоресценции, а по оси ординат – количество событий (клеток). Сигналы от контрольных клеток приняты за 100%. Counts – число событий. Red/Green – соотношение средних сигналов по красному и зеленому каналам – отражает уровень аутофагии.
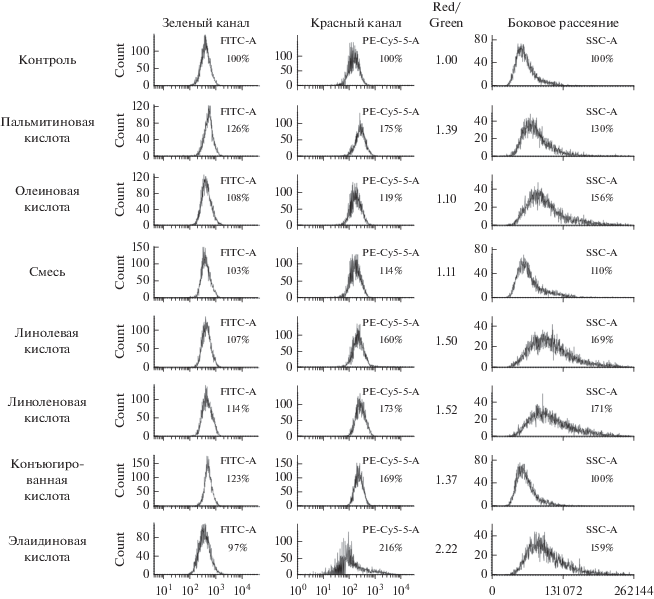
Наименьшую активацию вызывали олеиновая кислота и смесь на базе олеиновой (1.10 и 1.11 соответственно). Наибольшую активацию вызвала элаидиновая кислота (2.22). Однако этот результат свидетельствует скорее о токсическом действии элаидиновой кислоты, поскольку снизилась интенсивность сигналов клетки по зеленому каналу, что может быть связано с потерей мембранами барьерной функции. Также сигнал по красному каналу необычайно расширился, что указывает на рост гетерогенности клеток. Вероятно, мы зафиксировали промежуточный вариант начала гибели клеток под влиянием элаидиновой кислоты (транс-изомера олеиновой).
Из оставшихся вариантов наибольшую активность проявили линоленовая (1.52) и линолевая (1.50) кислоты. Пальмитиновая (1.39) и конъюгированная линолевая (1.37) оказались промежуточными.
Увеличение сигналов бокового рассеяния означает увеличение преломляющих поверхностей в клетках, т.е. образование и рост вакуолей (лизосом и липидных включений). Маленькое боковое рассеяние при действии конъюгированной линолевой кислоты (как в контроле) может отражать тот факт, что при действии конъюгированной линолевой кислоты клетки сжимаются, а лизосомы располагаются плотным комком, как показано на рис. 1м. Собирание лизосом в один комок обычно отражает токсическое действие, которое завершается гибелью клеток.
Вторым (помимо лизосом) заметным морфологическим проявлением действия СЖК стало появление липидных включений (табл. 1) (рис. 1в, з, и, к). Прежде всего стоит отметить, что пальмитат (единственная насыщенная СЖК в исследовании) способствует образованию липидных включений в меньшей степени, чем другие СЖК. Клетки, обработанные пальмитатом, претерпевают незначительные морфологические изменения и сходны с контрольными клетками (рис. 1л).
Таблица 1.
Накопление жировых включений в клетках, обработанных СЖК в концентрации 500 мкМ, в течение 3 дней
| Клетки | Пальми-тиновая кислота | Олеиновая кислота | Лино-левая кислота |
Линоленовая кислота | Конъюги-рованная линолевая кислота | Элаидиновая кислота | Смесь СЖК |
|---|---|---|---|---|---|---|---|
| IC-21 | 0 | ++ | ++ | ++ | ++ | ++ | ++ |
| HaCat | + | ++ | ++ | + | + | ++ | ++ |
| L6 | + | ++ | ++ | + | + | ++ | ++ |
| SK-N-SH | + | ++ | ++ | +++ | ++ | ++ | ++ |
| 977hTERT | + | ++ | +++ | ++ | + | ++ | + |
| Caki-1 | + | +++ | +++ | +++ | + | +++ | ++ |
| HepG2 | ++ | ++++ | ++++ | * | ++** | ++++ | ++++ |
Образование липидных включений очень сильно зависит от типа клеток. Сильнее всего этот процесс выражен в клетках печени (табл. 1) (рис. 1з, и). Липидные включения становились большими, круглыми и захватывали существенный объем цитоплазмы. Другие клетки, прежде всего клетки почек, мышечные и нервные, также образовывали значительные липидные накопления, но их размер был меньше (рис. 1к). Наименьшей способностью накапливать липидные включения обладали эпителиальные клетки эпидермиса HaCat.
Ненасыщенные СЖК (олеиновая, линолевая и линоленовая) способствовали формированию жировых включений в большей степени, действие смеси СЖК напоминало действие олеиновой кислоты (СЖК, наиболее представленная в смеси), конъюгированная линолевая кислота была явно слабее. Олеиновая и элаидиновая СЖК (цис- и транс-изомеры) действовали примерно одинаково (табл. 1).
Оценка гликолиза
При изучении действия СЖК нас интересовали изменения метаболизма, прежде всего гликолиза. В процессе гликолиза образуется пируват, который в дальнейшем либо восстанавливается до лактата (когда клетки усиленно нуждаются в гликолизе, часто при недостатке кислорода), либо пируват окисляется митохондриями [24, 25]. Образовавшийся лактат выделяется в среду, что ведет к ее закислению. Иногда гликолиз оценивают по внеклеточному закислению, например набор ab197244 Glycolysis Assay.
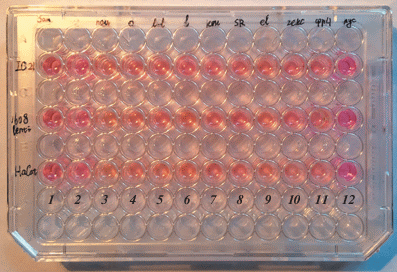
Мы наблюдали изменения рН, происходящие при росте клеток, по изменению цвета среды (рис. 3). Видно, что наибольшее закисление происходит в среде с пальмитатом (лунки под номером 3). Все остальные СЖК и их смеси вызывают примерно одинаковый более слабый эффект закисления.
Рис. 3.
Влияние СЖК на рН среды культивирования. В среду для культивирования клеток HaCat (нижний ряд), клеток 1608hTERT (средний ряд) и клеток IC-21 (верхний ряд) добавлен краситель (феноловый красный), цвет которого меняется при изменениях рН. При закислении среда желтеет, при защелачивании становится малиновой. В лунки 3–11 добавлены различные жирные кислоты и их смеси. Клетки росли 2 дня. В итоге все эти лунки более желтые. Стоит отметить, что непосредственно после добавления жирных кислот цвет всех лунок был одинаковым. 1 – разобщитель Bam-15, 2 – контроль, 3 – пальмитат, 4 – олеат, 5 – линоленовая кислота, 6 – линолевая кислота, 7 – конъюгированная линолевая кислота, 8 – смесь СВЖ, 9 – элаидиновая кислота, 10 и 11 – смеси СЖК, 12 – лунки без клеток.
Аналогичные изменения происходили при добавлении различных СЖК и их смесей к различным клеткам. Более сильный эффект закисления наблюдали в быстрорастущих клетках (HepG2, SK-N-SH и L6), менее заметный – в первичных фибробластах и макрофагах. При более плотной посадке клеток (когда они образовывали монослой и меньше делились) закисление среды уменьшалось.
Эффект закисления среды коррелировал с накоплением лактата (табл. 2) и потреблением глюкозы.
Таблица 2.
Накопление лактата (%) при действии свободных жирных кислот (500 мкМ)
| Свободная жирная кислота | 977 | IC-21 | HepG2 | HaCat | L6 | SK-N-SH |
|---|---|---|---|---|---|---|
| Контроль | 100 | 100 | 100 | 100 | 100 | 100 |
| Пальмитат | 106 | 105 | 87 | 112 | 109 | 111 |
| Линоленовая | 106 | 106 | 96 | 108 | 106 | 109 |
| Линолевая | 107 | 105 | 97 | 106 | 108 | 107 |
| Олеиновая | 105 | 103 | 94 | 106 | 107 | 108 |
| Конъюгированная | 100 | 99* | 70* | 104 | 102 | 102 |
| Элаидиновая | 104 | 105 | 96 | 105 | 107 | 106 |
Мы не наблюдали накопления лактата клетками HepG2, видимо, из-за особенностей метаболизма клеток печени, в которых образующийся лактат превращается в пируват (цикл Кори).
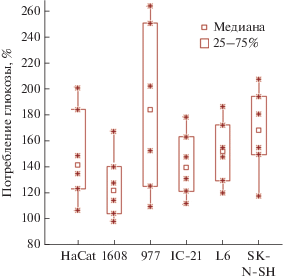
Уровень глюкозы в среде анализировали с помощью тест-полосок OneTouch Select Plus при исходной концентрации глюкозы 1 и 4.5 г/л. Во всех случаях в присутствии СЖК клетки потребляли больше глюкозы, чем без СЖК (табл. 3, рис. 4).
Таблица 3.
Потребление глюкозы фибробластами 977 в присутствии различных свободных жирных кислот (500 мкМ)
| Свободная жирная кислота | Глюкоза, мМ | Снижение концентрации глюкозы, мМ | Удельное потребление глюкозы, % |
|---|---|---|---|
| Контроль | 27.8 | 0.4 | 100 |
| Пальмитиновая | 27.3 | 0.9 | 241 |
| Олеиновая | 27.5 | 0.7 | 192 |
| Линолевая | 27.8 | 0.4 | 114 |
| Линоленовая | 27.1 | 1.1 | 322 |
| Конъюгированная линолевая | 27.7 | 0.5 | 170 |
Таким образом, в присутствии СЖК клетки сильнее закисляют среду, выделяют больше лактата и потребляют больше глюкозы, что означает стимуляцию гликолиза СЖК.
Изменения потребления кислорода клетками
Известно, что СЖК вызывают разобщение окислительного фосфорилирования в клетках, что сопровождается усилением потребления кислорода. Мы решили в этом убедиться, измерив потребление кислорода на целых клетках в полной среде культивирования. Действительно, СЖК вызывали усиление дыхания (рис. 5).
Рис. 5.
Потребление кислорода клетками при добавлении СЖК. а – Исходные кривые изменения времени жизни возбужденного состояния красителя, зависимого от кислорода. Начальный этап характеризуется диффузией кислорода из минерального масла. После установления равновесия кривая отражает скорость дыхания. б – Способ оценки скорости дыхания. В качестве меры дыхания выбран коэффициент при аргументе функции после проведения соответствующего тренда. в – Скорость дыхания. Указаны отдельные СЖК: bam – Bam-15, lino – линолевая, palm – пальмитиновая, mix – смесь, lilen – линоленовая, ole – олеиновая, conj – конъюгированная линолевая кислота. Статистическая обработка проведена по сумме СЖК.
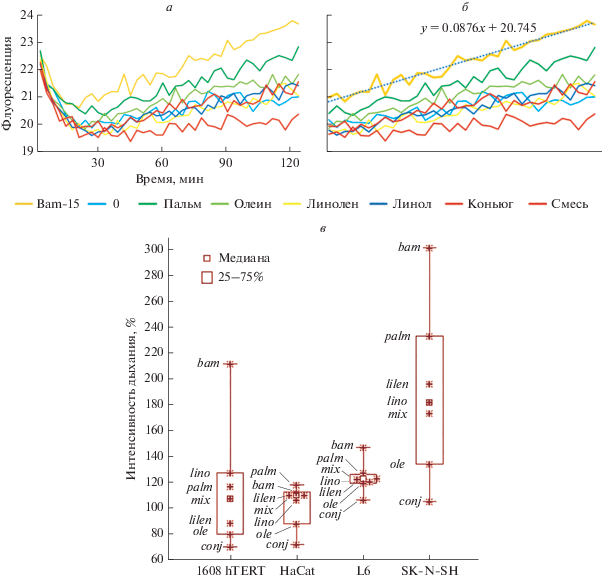
Наибольшей способностью стимулировать дыхание практически во всех исследованных клетках обладала пальмитиновая кислота. Ее эффект был сопоставим с действием разобщителя Bam-15 (10 мкМ) (рис. 5в) [26].
Конъюгированная линолевая кислота оказывала самое слабое разобщающее действие; в ряде случаев (совпадающих с цитотоксическим действием) можно было заключить, что она подавляет дыхание (рис. 5а, б).
Олеиновая кислота оказывала слабый эффект. Наблюдали также промежуточные эффекты: других СЖК, разные в разных клетках (рис. 5в). В ряде опытов отдельные СЖК не стимулировали дыхания.
Таким образом, показано, что большинство СЖК стимулируют потребление кислорода клетками.
Транскриптомный анализ
Проведено полнотранскриптомное исследование действия смеси СЖК на клетки 1608hTERT. Компьютерная обработка результатов выявила ряд процессов (клеточное деление, развитие, изменение обмена липидов), в которых участвует множество дифференциально экспрессируемых генов, однако не позволила оценить изменение интенсивности определенных процессов метаболизма. В то же время, ручная обработка результатов позволила составить следующую таблицу (табл. 4).
Таблица 4.
Изменения транскрипции ключевых генов гликолиза и разобщения в клетках 1608hTERT при добавлении смеси свободных жирных кислот
| Процесс | Ген | Изменение количества транскриптов | Генный продукт | Функции продукта |
|---|---|---|---|---|
| Гликолиз | HK1 | 5560 → 8550 | Гексокиназа | Первая реакция гликолиза |
| PFKP | 2982 → 5496 | Фосфофруктокиназы | Ключевая стадия гликолиза | |
| PFKL | 3818 → 5953 | |||
| PKM2 | 62733 → 125288 | Пируваткиназа | Образование АТР и пирувата | |
| LDHA | 41399 → 53613 | Лактатдегидрогеназы | Взаимопревращения лактата и пирувата | |
| LDHB | 4181 → 5771 | |||
| Разобщение | UCP1 | 0 → 0 | Разобщающие белки | Разобщение окислительного фосфорилирования |
| UCP2 | 26 → 227 | |||
| UCP3 | 32 → 18 |
Из табл. 4 следует, что экспрессия всех ключевых генов гликолиза увеличилась примерно в 1.5 раза. Активность гена разобщающего белка 2 (UCP2) возросла на порядок. Учитывая короткое время жизни UCP2 (около 30 мин) [27], можно считать, что экспрессия этого белка, ведущая к разобщению, возрастает в ответ на СЖК. Известно, что разобщители, в том числе СЖК, увеличивают экспрессию UCP2 [28].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Прежде всего мы хотим отметить, что в отличие от многих ученых, изучавших действие жирных кислот на различные клетки, мы не наблюдали особенно выраженного токсического действия пальмитата.
Липотоксичность пальмитата много раз показана на гепатоцитах [29, 30], миобластах [31–34], бета-клетках поджелудочной железы [35], клетках почки [36]. При изучении токсического действия пальмитата в момент его добавления использовали либо 1%-ную сыворотку, либо раствор альбумина (2–5%) [11, 29–38].
В наших опытах, наоборот, токсичность пальмитата была наименьшей из всех изученных СЖК. Это связано с проведением опытов в условиях, приближенных к условиям in vivo, в которых всегда присутствует смесь СЖК. Мы культивировали клетки в полной стандартной среде, а именно в среде с добавлением 10% сыворотки крови.
Известно, что сыворотка практически всегда улучшает выживаемость клеток. Механизмы протективного действия сыворотки могут быть различными: ингибирование протеаз, присутствие разнообразных факторов роста, снижение проницаемости плазмалеммы и т.д. Именно поэтому другие авторы все-таки используют хотя бы 1% сыворотки. Вероятно, в нашем случае происходило разбавление пальмитата другими СЖК из сыворотки. Известно, что пальмитат очень легко входит в состав жирных кислот фосфолипидов и его концентрация достигает больших величин (например, 43% от всех жирных кислот в составе фосфолипидов [29]).
Легко предположить, что фосфолипид, имеющий два остатка пальмитата, крайне необычен для мембран, он изменяет их кривизну и таким способом нарушает барьерные функции мембран, что ведет к фатальным последствиям [33].
“Разбавление” насыщенного пальмитата ненасыщенными жирными кислотами нормализует свойства образованных фосфолипидов и резко снижает токсичность. Известно, что олеат “спасает” мышечные клетки от токсического действия пальмитата [32, 33].
Наши расчеты показывают, что концентрация СЖК в сыворотке определяется жирными кислотами, связанными с альбумином, и не превышает 50 мкМ (в 10 раз меньше используемой нами). В опытах без сыворотки или с 1% сыворотки мы наблюдали выраженное токсическое действие пальмитата (данные не приведены). Мы полагаем, что известная токсичность пальмитата проявляется только в опытах, проведенных в отсутствие других жирных кислот, и поэтому является своего рода артефактом, поскольку не встречается in vivo.
Если один из двух источников “энергоснабжения” клеток уменьшается (в результате разобщения окислительного фосфорилирования), то альтернативный источник (гликолиз) должен расти, чтобы поддержать нормальный уровень энергопотребления. Именно так и происходит в наших опытах. Аналогичные результаты получены совсем недавно при разобщении с помощью Bam-15 [26]. Известно, что увеличенная экспрессия UCP2 (по сути, разобщение) стимулирует гликолитические ферменты и усиливает гликолиз [39]. При дифференцировке и созревании иммунных клеток происходят закономерные перестройки метаболизма между гликолитическим и окислительным [40, 41].
Поведение клеток в наших опытах можно рассматривать как попытку сохранить свой гомеостаз при действии токсических факторов внешней среды. СЖК, добавленные к клеткам в большом избытке, отсоединяются от своего внеклеточного переносчика (альбумина) и попадают внутрь клеток. В какой-то момент в клетках возникает недостаток внутриклеточных переносчиков СЖК. СЖК начинают растворяться в мембранах и менять их свойства (действие СЖК как антибиотиков), образовывать агломераты [3].
В случае пальмитата СЖК начинает интенсивно входить в состав фосфолипидов [29], что также меняет свойства мембран. Для поддержания жизнеспособности клетке надо избавляться от избытка СЖК.
1. Один из вариантов – это “сжечь” СЖК через бета-окисление, последующее прохождение цикла Кребса и дыхательную цепь. Однако в условиях частичного разобщения бета-окисление неспособно привести к увеличению продукции АТР, поскольку такая прибавка должна происходить также в результате окислительного фосфорилирования. Единственная возможность поддержать сократившийся уровень АТР – это продукция АТР, не связанная с дыхательной цепью митохондрий, т.е. гликолиз.
Хорошо известный пример стимуляции гликолиза – это ограничение доступности кислорода. Хотя при окислении жирных кислот можно получить больше АТР, чем при окислении глюкозы (на одинаковый вес субстрата), однако затраты кислорода на получение единицы АТР при бета-окислении выше за счет большего соотношения образующихся FADH2/NADH. Глюкоза дает 5.19 ккал/л кислорода, жирные кислоты 4.81 ккал/л кислорода [42]. Известно, что при увеличении физической нагрузки, когда возрастает потребность в АТР, метаболизм спортсменов переключается с сжигания липидов на сжигание углеводов.
Имеет ли ограничение доступности кислорода отношение к нашему случаю выращивания клеток в условиях атмосферного кислорода? Возможно имеет.
Клеточные биологи обычно рассуждают следующим образом. Поскольку концентрация кислорода в воздухе всегда выше, чем в организме, то клетки в термостате с атмосферным воздухом сталкиваются с избытком, но никак не с недостатком кислорода [43]. Однако благодаря низкой растворимости кислорода в среде и, главным образом, высокому диффузионному барьеру (слою среды толщиной в несколько мм) скорость потребления кислорода клетками на дне культурального флакона может превышать скорость его поступления [44]. Можно полагать, что в наших условиях (с учетом повышенного дыхания за счет разобщения) клетки могли находиться в условиях ограничения по кислороду, следовательно, переход энергетического метаболизма в сторону гликолиза закономерен.
2. Другой вариант защиты от избытка СЖК – это упаковка СЖК в триглицериды для дальнейшего хранения. Если в клетке экспрессируются соответствующие гены, то этот вариант предпочтителен [45]. В наших экспериментах все клетки аккумулировали (но в разной степени) липиды в виде липидных пузырьков – наиболее существенно клетки печени, далее клетки почки и мышц. Эпидермальные клетки и фибробласты делали это в меньшей степени.
3. В ответ на добавление СЖК в клетках увеличивается экспрессия UCP2 (и по нашим, и по опубликованным данным) [46–48]. Включается механизм разобщения, усиливается дыхание и происходит усиленное сжигание любого доступного субстрата, включая и конечные продукты бета-окисления жирных кислот, снижая тем самым концентрацию СЖК. Предполагается, что этот механизм работает в адипоцитах и предотвращает попадание СЖК в свободную циркуляцию [49].
4. Утилизация СЖК через аутофагию. Мы не нашли экспериментальных подтверждений прямой утилизации СЖК посредством аутофагии. Известно, что при липофагии (частный вариант аутофагии) деградации подвергается материал липидных пузырьков, но не СЖК [50]. При этом не происходит слияния лизосом с липидными пузырьками. Сначала на основе липидного пузырька формируется аутофагосома и лишь затем происходит слияние с лизосомой [51]. При этом СЖК прямо расходуются в процессе роста фагофоров. Синтез фосфолипидов происходит in situ [52].
Мы можем предположить, что благодаря низкой растворимости часть СЖК начинает взаимодействовать друг с другом, образуя надмолекулярные комплексы, напоминающие мицеллы [3], которые уже не могут вступать в свойственные СЖК реакции. Такие комплексы, вероятно, распознаются клеткой как мусор и поступают в лизосомы
Переключение энергетического метаболизма с митохондриального на гликолитический и обратно имеет место в процессах развития. Поэтому искусственное влияние на этот процесс (метаболическое репрограммирование) может иметь значение в терапии определенных расстройств. Например, воздействие разобщителей перестраивает метаболизм, что может положительно влиять на продолжительность жизни и течение многих патологий [14, 26].
В последние годы становится совершенно очевидным, что перестройка метаболизма с окислительного на гликолитический работает как регулятор дифференцировки клеток иммунной системы [53–55].
Классические активированные макрофаги (типа М1) имеют гликолитический метаболизм. Они нацелены против микробов и поддерживают воспаление. Метаболизм альтернативных, или регуляторных, макрофагов (М2) основан на митохондриальном окислении. Эти макрофаги наблюдают в микроокружении опухолей, они снижают воспаление [56].
Известно, что опухоли создают вокруг себя иммуносупрессивное окружение. Возможно, что основой этого является локально усиленная продукция лактата, который тормозит гликолиз и перепрограммирует макрофаги в регуляторный тип М2 [57, 58]. Многократно описаны антивоспалительные эффекты лактата [58–61] и даже регенерирующий ангиогенный эффект [62]. Возможно, что в регуляции лактатом участвуют эпигенетические механизмы [63–65].
Медицинское применение СЖК можно представить следующим образом. СЖК наносят (вводят) локально, после чего клетки, получившие СЖК, на длительное время становятся источником лактата. В результате локальное воспаление снижается, а привлеченные макрофаги оказывают регулирующий (регенеративный) эффект, пытаясь ликвидировать в организме область “гипоксии” (появление лактата признак гипоксии), способствуя ангиогенезу. В отличие от применения разобщителей, действие СЖК позволяет разделить клетки на две категории: клетки, в которых произошел длительный гликолитический сдвиг (клетки пытаются избавиться от избытка СЖК с помощью разобщения), и клетки (мигрирующие клетки иммунной системы), которые, реагируя на продукцию лактата, снижают уровень воспаления. При действии низкомолекулярных разобщителей, гликолитический сдвиг может оказывать провоспалительное действие, поскольку будет применим к большинству клеток организма.
Вопрос о терапевтическом применении СЖК необычайно сложен, поскольку многократно описаны токсические эффекты СЖК [66, 67]. Повышенная концентрация СЖК в плазме крови рассматривается как плохой прогностический признак, сопровождающий ожирение, сахарный диабет второго типа и атеросклероз. Проблема нуждается в дополнительных исследованиях.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 19-04-01071.
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Yoon B.K., Jackman J.A., Valle-González E.R., Cho N.-J. (2018) Antibacterial free fatty acids and monoglycerides: biological activities, experimental testing, and therapeutic applications. Int. J. Mol. Sci. 19, 1114. https://doi.org/10.3390/ijms19041114
Ruffell S.E., Müller K.M., McConkey B.J. (2016) Comparative assessment of microalgal fatty acids as topical antibiotics. J. Appl. Phycol. 28, 1695–1704.
Desbois A.P., Smith. V.J. (2010) Antibacterial free fatty acids: activities, mechanisms of action and biotechnological potential. Appl. Microbiol. Biotechnol. 85, 1629–1642. https://doi.org/10.1007/s00253-009-2355-3
Fischer C.L. (2020) Antimicrobial activity of host-derived lipids. Antibiotics. 9, 75.https://doi.org/10.3390/antibiotics/9020075
Viktorova E.G., Nchoutmboube J.A., Ford-Siltz L.A., Iverson E., Belov G.A. (2018) Phospholipid synthesis fueled by lipid droplets drives the structural development of poliovirus replication organelles. PLoS Pathol. 14, e1007280. https://doi.org/10.1371/journal.ppat.1007280
Carrasco S., Mérida I. (2006) Diacylglycerol, when simplicity becomes complex. Trends Biochem. Sci. 32, 27–36. https://doi.org/10.1016/j.tibs.11.004
Nakamura M.T., Yudel B.E., Loor J.J. (2014) Regulation of energy metabolism by long-chain fatty acids. Progress Lipid Res. 53, 124–144.
Lancaster G.I., Langley K.G., Berglund N.A., Kammoun H.L., Reibe S., Estevez E., Weir J., Mellett N.A., Pernes G., Conway J.R.W., Lee M.K.S., Timpson P., Murphy A.J., Masters S.L., Gerondakis S., Bartonicek N., Kaczorowski D.C., Dinger M.E., Meikle P.J., Bond P.J., Febbraio M.A. (2018) Evidence that TLR4 is not a receptor for saturated fatty acids but mediates lipid-induced inflammation by reprogramming macrophage metabolism. Cell Metabolism. 27, 1096–1110. https://doi.org/10.1016/j.cmet.2018.03.014
Serhan C.N., Levy B.D. (2018) Resolvins in inflammation: emergence of the pro-resolving superfamily of mediators. J. Clin. Invest. 128, 2657–2669. https://doi.org/10.1172/JCI97943
Plötz T., Krümmel B., Laporte A., Pingitore A., Persaud S.J., Jörns A., Elsner M., Mehmeti I., Lenzen S. (2017) The monounsaturated fatty acid oleate is the major physiological toxic free fatty acid for human beta cells. Nutrition Diabetes. 7, 305. https://doi.org/10.1038/s41387-017-0005-x
Tumova J., Malisova L., Andel M., Trnka J. (2015) Protective effect of unsaturated fatty acids on palmitic acid‑induced toxicity in skeletal muscle cells is not mediated by PPARδ activation. Lipids. 50, 955–964. https://doi.org/10.1007/s11745-015-4058-0
Patková J., Anděl M., Trnka J. (2014) Palmitate-induced cell death and mitochondrial respiratory dysfunction in myoblasts are not prevented by mitochondria-targeted antioxidants. Cell Physiol. Biochem. 33, 1439. https://doi.org/10.1159/000358709
Chouchani E.T., Kazak L., Jedrychowski M.P., Lu G.Z., Erickson B.K., Szpyt J., Pierce K.A., Laznik-Bogoslavski D., Vetrivelan R., Clish C.B., Robinson A.J., Gygi S.P., Spiegelman B.M. (2016) Mitochondrial ROS regulate thermogenic energy expenditure and sulfenylation of UCP1. Nat. 532, 112‒116.
Егоров Е.Е. (2020) Здоровое старение: антиоксиданты, разобщители и/или теломераза? Молекуляр. биология. 54(3), 355–361.https://doi.org/10.31857/S0026898420030052
Brooks G.A. (2020) Lactate as a fulcrum of metabolism. Redox Biol. 35, 101454.
Rabinowitz J.D., Enerbäck S. (2020) Lactate: the ugly duckling of energy metabolism. Nat. Metab. 2, 566–571. https://doi.org/10.1038/s42255-020-0243-4
Flores A., Schell J., Krall A., Jelinek D., Miranda M., Grigorian M., Braas D., White A. C., Zhou J., Graham N., Graeber T., Seth P., Evseenko D., Coller H., Rutter J., Christofk H., Lowry W. (2017) Lactate dehydrogenase activity drives hair follicle stem cell activation. Nat. Cell Biol. 19, 1017–1026. https://doi.org/10.1038/ncb3575
Miranda M., Christofk H., Jones D.L., Lowry W.E. (2018) Topical inhibition of the electron transport chain can stimulate the hair cycle. J. Invest. Dermatol. 138, 968e972. https://doi.org/10.1016/j.jid.2017.10.021
Son M.J., Jeong J.K., Kwon Y., Ryu J.S, Mun S.J., Kim H.J., Kim S.W., Yoo S., Kook J., Lee H., Kim J., Chung K.S. (2018) A novel and safe small molecule enhances hair follicle regeneration by facilitating metabolic reprogramming. Exper. Mol. Med. 50, 1–15. https://doi.org/10.1038/s12276-018-0185-z
Егоров Е.Е., Терехов С.М., Вишнякова Х.С., Караченцев Д.Н., Казимирчук Е.В., Цветкова Т.Г., Вейко Н.Н., Смирнова Т.Д., Макаренков А.С., Эльдаров М.А., Мещерякова Ю.А., Ляпунова Н.А., Зеленин А.В. (2003) Теломеризация – способ получения иммортальных клеток человека, сохраняющих нормальные свойства. Онтогенез. 34, 183–192.
Thomé M.P., Filippi-Chiela E.C., Villodre E.S., Migliavaca C.B., Onzi G.R., Felipe K. B., Lenz G. (2016) Ratiometric analysis of acridine orange staining in the study of acidic organelles and autophagy. J. Cell Sci. 129, 4622–4632. https://doi.org/10.1242/jcs.195057
Вишнякова Х.С., Бабижаев М.А., Алипер А.М., Буздин А.А., Кудрявцева А.В., Егоров Е.Е. (2014) Стимуляция пролиферации карнозином: клеточный и транскриптомный подход. Молекуляр. биология. 48, 824–833.
Miwa H. (2002) High-performance liquid chromatographic determination of free fatty acids and esterified fatty acids in biological materials as their 2-nitrophenylhydrazides. Anal. Chim. Acta. 465, 237–255.
Lunt S.Y., Heiden M.G.V. (2011) Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annu. Rev. Cell Dev. Biol. 27, 441–464. https://doi.org/10.1146/annurev-cellbio-092910-154237
DeBerardinis R.J., Chandel N.S. (2020) We need to talk about the Warburg effect. Nat. Metab. 2, 127–129. https://doi.org/10.1038/s42255-020-0172-2
Axelrod C.L., King W.T., Davuluri G., Noland R.C., Hall J., Hull M., Dantas W.S., Zunica E.R., Alexopoulos S.J., Hoehn K.L, Langohr I., Stadler K., Doyle H., Schmidt E., Nieuwoudt S., Fitzgerald K., Pergola K., Fujioka H., Mey J.T., Fealy C., Mulya A., Beyl R., Hoppel C.L., Kirwan J.P. (2020) BAM15-mediated mitochondrial uncoupling protects against obesity and improves glycemic control. EMBO Mol. Med. 12, e12088. https://doi.org/10.15252/emmm.202012088
Rousseta S., Mozoa J., Dujardinb G., EmreaY., Masscheleyna S., Ricquiera D., Cassard-Doulcier A.-M. (2007) UCP2 is a mitochondrial transporter with an unusual very short half-life. FEBS Lett. 581, 479–482.
Sreedhar A., Zhao Y. (2017) Uncoupling protein 2 and metabolic diseases. Mitochondrion. 34, 135–140.
Leamy A.K., Egnatchik R.A., Shiota M., Ivanova P.T., Myers D. S., Brown H.A., Young J.D. (2014) Enhanced synthesis of saturated phospholipids is associated with ER stress and lipotoxicity in palmitate treated hepatic cells. J. Lipid Res. 55, 1478–1488.
Nakamura S., Takamura T., Matsuzawa-Nagata N., Takayama H., Misu H., Noda H., Nabemoto S., Kurita S., Ota T., Ando H., Miyamoto K-I., Kaneko S. (2009) Palmitate induces insulin resistance in H4IIEC3 hepatocytes through reactive oxygen species produced by mitochondria. J. Biol. Chem. 284, 14809–14818.
de Vries J.E., Vork M.M., Roemen T.H.M., de Jong Y.F., Cleutjens J.P.M., van der Vusse G.J., van Bilsen M. (1997) Saturated but not mono-unsaturated fatty acids induce apoptotic cell death in neonatal rat ventricular myocytes. J. Lipid Res. 38, 1384–1394.
Coll T., Eyre E., Rodrıguez-Calvo R., Palomer X., Sanchez R.M., Merlos M., Laguna J.C., Vazquez-Carrera M. (2008) Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J. Biol. Chem. 283, 11107–11116.
Henique C., Mansouri A., Fumey G., Lenoir V., Girard J., Bouillaud F., Prip-Buus C., Cohen I. (2010) Increased mitochondrial fatty acid oxidation is sufficient to protect skeletal muscle cells from palmitate-induced apoptosis. J. Biol. Chem. 285, 36818–36827.
Turpin S.M., Lancaster G.I., Darby I., Febbraio M.A., Watt M.J. (2006) Apoptosis in skeletal muscle myotubes is induced by ceramides and is positively related to insulin resistance. Am. J. Physiol. Endocrinol. Metab. 291, E1341–E1350. https://doi.org/10.1152/ajpendo.00095.2006
Eitel K., Staiger H., Brendel M.D., Brandhorst D., Bretzel R.G., Häring H.-U., Kellerer M. (2002) Different role of saturated and unsaturated fatty acids in beta-cell apoptosis. Biochem. Biophys. Res. Commun. 299, 853–856. https://doi.org/10.1016/s0006-291x(02)02752-3
Johnson E.S., Lindblom K.R., Robeson A., Stevens R.D., Ilkayeva O.R., Newgard C.B., Kornbluth S., Andersen J.L. (2013) Metabolomic profiling reveals a role for caspase-2 in lipoapoptosis. J. Biol. Chem. 288, 14463–14475. https://doi.org/10.1074/jbc.M112.437210
Alnahdi A., John A., Raza H. (2019) Augmentation of glucotoxicity, oxidative stress, apoptosis and mitochondrial dysfunction in HepG2 cells by palmitic acid. Nutrients. 11, 1979. https://doi.org/10.3390/nu11091979
Plötz T., Krümmel B., Laporte A., Pingitore A., Persaud S.J., Jörns A., Elsner M., Mehmeti I., Lenzen S. (2017) The monounsaturated fatty acid oleate is the major physiological toxic free fatty acid for human beta cells. Nutrition Diabetes. 7, 305. https://doi.org/10.1038/s41387-017-0005-x
Sreedhar A., Petruska P., Miriyala S., Panchatcharam M., Zhao Y. (2017). UCP2 overexpression enhanced glycolysis via activation of PFKFB2 during skin cell transformation. Oncotarget. 8, 95504–95515.
Cunningham C.A., Hoppins S., Fink P.J. (2018) Cutting edge glycolytic metabolism and mitochondrial metabolism are uncoupled in antigen-activated CD8+ recent thymic emigrants. J. Immunol. 201, 1627–1632.
Jing C., Castro-Dopico T., Richoz N., Tuong Z.K., Ferdinand J.R., Lok L.S.C., Loudon K.W., Banham G.D., Mathews R.J., Cader Z., Fitzpatrick S., Bashant K.R., Kaplan M.J., Kaser A., Johnson R.S., Murphy M.P., Siegel R.M., Clatworthy M.R. (2020) Macrophage metabolic reprogramming presents a therapeutic target in lupus nephritis. Proc. Natl. Acad. Sci. USA. 117, 15160–15171.
Leverve X., Batandier C., Fontaine E. (2007) Choosing the right substrate. Rev. Novartis Found. Symp. 280, 108–127.
Halliwell B. (2003) Oxidative stress in cell culture: an under-appreciated problem? FEBS Lett. 540, 3–6.
Place T.L., Domann F.E., Case A.J. (2017) Limitations of oxygen delivery to cells in culture: an underappreciated problem in basic and translational research. Free Rad. Biol. Med. 113, 311–322. https://doi.org/10.1016/j.freeradbiomed.2017.10.003
Listenberger L.L. Han X.L., Lewis S.E., Cases S., Farese R.V., Ory D.S., Schaffer J.E. (2003) Triglyceride accumulation protects against fatty acid-induced lipotoxicity. Proc. Natl. Acad. Sci. USA. 100, 3077–3082.
Murray A.J., Anderson R.E., Watson G.C., Radda G.K., Clarke K. (2004) Uncoupling proteins in human heart. Lancet. 364, 1786–1788.
Cannon B., Nedergaard J. (2004) Brown adipose tissue: function and physiological significance. Physiol. Rev. 84, 277–359. https://doi.org/10.1152/physrev.00015.2003
Sreedhar A., Zhao Y. (2017) Uncoupling protein 2 and metabolic diseases. Mitochondrion. 34, 135–140. https://doi.org/10.1016/j.mito.2017.03.005
Maassen J.A., Romijn J.A., Heine R.J. (2007) Fatty acid-induced mitochondrial uncoupling in adipocytes as a key protective factor against insulin resistance and beta cell dysfunction: a new concept in the pathogenesis of obesity-associated type 2 diabetes mellitus. Diabetologia. 50, 2036–2041. https://doi.org/10.1007/s00125-007-0776-z
Singh R., Kaushik S., Wang Y., Xiang Y., Novak I., Komatsu M., Tanaka K., Cuervo A.M., Czaja M.J. (2009) Autophagy regulates lipid metabolism. Nature. 458, 1131–1137. https://doi.org/10.1038/nature07976
Onal G., Kutlu O., Gozuacik D., Emre S.D. (2017) Lipid droplets in health and disease. Lipids Health Dis. 16, 128. https://doi.org/10.1186/s12944-017-0521-7
Schüttera M., Graef M. (2020) Localized de novo phospholipid synthesis drives autophagosome biogenesis. Autophagy. 16, 770–771. https://doi.org/10.1080/15548627.2020.1725379
Suzuki H., Hisamatsu T., Chiba S., Mori K., Kitazume M.T., Shimamura K., Nakamoto N., Matsuoka K., Ebinuma H., Naganuma M., Kana T. (2016) Glycolytic pathway affects differentiation of human monocytes to regulatory macrophages. Immunol. Lett. 176, 18–27.
Kelly B., O’Neill L.A.J. (2015) Metabolic reprogramming in macrophages and dendritic cells in innate immunity. Cell Res. 25, 771–784. https://doi.org/10.1038/cr.2015.68
Viola A., Munari F., Sánchez-Rodríguez R., Scolaro T., Castegna A. (2019) The metabolic signature of macrophage responses. Front. Immunol. 10, 1462. https://doi.org/10.3389/fimmu.2019.01462
Yu Q., Wang Y., Dong L., He Y., Liu R., Yang Q., Cao Y., Wang Y., Jia A., Bi Y. Liu G. (2020) Regulations of glycolytic activities on macrophages functions in tumor and infectious inflammation. Front. Cell. Infect. Microbiol. 10, 287. https://doi.org/10.3389/fcimb.2020.00287
Colegio O.R., Chu N.Q., Szabo A.L., Chu T., Rhebergen A.M., Jairam V., Cyrus N., Brokowski C.E., Eisenbarth S.C., Phillips G.M., Cline G.W., Phillips A.J., Medzhitov R. (2014) Functional polarization of tumour-associated macrophages by tumour-derived lactic acid. Nat. 513, 559–563. https://doi.org/10.1038/nature13490
Errea A., Cayet D., Marchetti P., Tang C., Kluza J., Offermanns S., Sirard J.C., Rumbo M. (2016). Lactate inhibits the pro-inflammatory response and metabolic reprogramming in murine macrophages in a GPR81-independent manner. PLoS One. 11, e0163694. https://doi.org/10.1371/journal.pone.0163694
Hoque R., Farooq A., Ghani A., Gorelick F., Mehal W.Z. (2014) Lactate reduces liver and pancreatic injury in Toll-like receptor and inflammasome-mediated inflammation via GPR81-mediated suppression of innate immunity. Gastroenterology. 146, 1763–1774.
Iraporda C., Romanin D.E., Bengoa A.A., Errea A.J., Cayet D., Foligne B., Sirard J.C., Garrote G.L., Abraham A.G., Rumbo M. (2016). Local treatment with lactate prevents intestinal inflammation in the TNBS-induced colitis model. Front. Immunol. 7, 651. https://doi.org/10.3389/fimmu.2016.00651
Dietl K., Renner K., Dettmer K., Timischl B., Eberhart K., Dorn C., Hellerbrand C., Kastenberger M., Kunz-Schughart L.A., Oefner P.J., Andreesen R., Gottfried E., Kreutz M.P. (2010). Lactic acid and acidification inhibit TNF secretion and glycolysis of human monocytes. J. Immunol. 184, 1200–1209. https://doi.org/10.4049/jimmunol.0902584
Zhang J., Muri J., Fitzgerald G., Gorski T., Gianni-Barrera R., Masschelein E., D’Hulst G., Gilardoni P., Turiel G., Fan Z., Wang T., Planque M., Carmeliet P., Pellerin L., Wolfrum C., Fendt S.-M., Banfi A., Stockmann C., Soro-Amaiz I., Kopf M., De Bock K. (2020) Endothelial lactate controls muscle regeneration from ischemia by inducing M2-like macrophage polarization. Cell Metabolism. 31, 1136–1153. https://doi.org/10.1016/j.cmet.2020.05.004
Peng M., Yin N., Chhangawala S., Xu K., Leslie C.S., Li M.O. (2016). Aerobic glycolysis promotes T helper 1 cell differentiation through an epigenetic mechanism. Science. 354, 481–484. https://doi.org/10.1126/science.aaf6284
Zhang D., Tang Z., Huang H., Zhou G., Cui C., Weng Y., Liu W., Kim S., Lee S., Perez-Neut M., Ding J., Czyz D., Hu R., Ye Z., He M., Zheng Y.G., Shuman H.A., Dai L., Ren B., Roeder R.G., Becker L., Zhao Y. (2019) Metabolic regulation of gene expression by histone lactylation. Nature. 574, 575–580.
Izzo L.T., Wellen K.E. (2019) Lactate links metabolism to genes. Nature. 574, 492–493.
Freigang S., Ampenberger F., Weiss A., Kanneganti T.D., Iwakura Y., Hersberger M., Kopf M. (2013) Fatty acid–induced mitochondrial uncoupling elicits inflammasome-independent IL-1a and sterile vascular inflammation in atherosclerosis. Nat. Immunol. 14, 1045–1053. https://doi.org/10.1038/ni.2704
Oh Y.S., Bae G.D., Baek D.J., Park E.Y., Jun H.S. (2018) Fatty acid-induced lipotoxicity in pancreatic beta-cells during development of type 2 diabetes. Front. Endocrinol. 9, 384. https://doi.org/10.3389/fendo.2018.00384
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология