Молекулярная биология, 2021, T. 55, № 6, стр. 1021-1029
При инициации долговременной потенциации в нейрональной культуре субъединица PHF10 ремоделирующего хроматин комплекса PBAF меняет свою локализацию и взаимодействует с c-FOS
А. М. Азиева a, b, *, А. А. Шейнов a, Д. А. Кириллова b, Е. В. Татарский a, С. Г. Георгиева a, c, Н. В. Сошникова a
a Институт биологии гена Российской академии наук
119334 Москва, Россия
b Национальный исследовательский центр “Курчатовский институт”
123182 Москва, Россия
c Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: so2615nat@gmail.com
Поступила в редакцию 16.10.2020
После доработки 15.04.2021
Принята к публикации 19.05.2021
Аннотация
Комплекс PBAF, ремоделирующий хроматин, взаимодействует со многими активаторами транскрипции и рекрутируется на таргетные участки хроматина. PBAF играет важную роль в поддержании и изменении структуры хроматина в клетках нервной системы млекопитающих. Субъединица комплекса PBAF – транскрипционный фактор PHF10 – необходим для пролиферации нейрональных предшественников на ранних стадиях развития головного мозга мышей и экспрессии генов в дифференцированных нейронах. Мы показали, что PHF10 взаимодействует с белковым продуктом гена раннего ответа c-Fos, транскрипционным активатором c-FOS, который экспрессируется в ответ на индукцию долговременной потенциации (ДВП). Индукция ДВП запускает транскрипцию генов и синтез белков, обеспечивающих изменения, приводящие к установлению долговременных контактов между нейронами. После индукции ДВП в клетках дифференцированной нейрональной культуры начинает экспрессироваться c-FOS, который первоначально локализуется в цитоплазме, а далее перемещается в ядро. PHF10 экспрессируется в нейрональных клетках до индукции ДВП и имеет ядерную локализацию. Однако через 1 ч после индукции PHF10 детектируется в цитоплазме вместе с c-FOS, а затем вместе с ним перемещается в ядро. Важно, что такое поведение PHF10 в ответ на стимуляцию KCl специфично для нейрональных культур. Предполагается, что в процессе ДВП PHF10 совместно с c-FOS участвует в активации генов вторичного ответа, регулирующих поддержание пластических модификаций и гомеостаз синапсов нейронов. Экспорт PHF10 из ядра и его быстрое возвращение вместе с c-FOS в ядро, возможно, необходимо для быстрой модуляции экспрессии таргетных генов вторичного ответа в процессе ДВП.
ВВЕДЕНИЕ
Долговременная потенциация (ДВП) – это стабильное усиление синаптической передачи между двумя нейронами, возникающее при повторяющейся передаче сигнала. ДВП лежит в основе установления нейрональных связей в процессе дифференцировки головного мозга млекопитающих, обеспечивает пластичность нейрональных связей и считается одним из основных механизмов, важных для обучения и памяти. Нарушения в ДВП активно изучаются в связи с болезнью Альцгеймера и другими заболеваниями нервной системы.
Хотя сам эффект ДВП был открыт на нейронах гиппокампа кролика, в настоящее время понятно, что он существует во всех отделах головного мозга млекопитающих. Молекулярные механизмы, лежащие в основе ДВП, пока недостаточно изучены. Известно, что ДВП у млекопитающих стимулируется стрессом, факторами роста, нейротрансмиттерами, увеличением концентрации глутаминовой кислоты. Эти факторы приводят к росту концентрации внутрицитоплазматического кальция и активации Cа2+-зависимого киназного каскада, который ведет к фосфорилированию транскрипционного фактора CREB [1, 2]. В лабораторных условиях при работе со срезами мозга или культурами клеток ДВП и активацию CREB можно вызвать высокочастотной стимуляцией (тетанизацией) или кратковременным увеличением концентрации внеклеточного калия [3].
Активация CREB запускает экспрессию многих генов, в том числе генов раннего ответа c-Fos, Arc, Egr1 [4] – мощных активаторов транскрипции, которые инициируют вторую волну экспрессии генов, включающую эффекторные гены, регулирующие поддержание пластических модификаций и гомеостаза синапса [5, 6]. Экспрессия c-FOS служит маркером активности нейронов, представляющей ключевой этап изменения фенотипа клетки, лежащего в основе нейропластичности [7].
Изменение экспрессии генов всегда происходит при участии дополнительных факторов транскрипции, важнейшие из которых – комплексы, ремоделирующие хроматин. Некоторые субъединицы ремоделирующего хроматин комплекса SWI/SNF взаимодействуют с c-FOS [8]. Мультибелковый комплекс SWI/SNF (2 МДа) подразделяется на два подсемейства (BAF и PBAF) и состоит из коровых и специфических модульных субъединиц. Коровые субъединицы выполняют ремоделирующую функцию, а модульные определяют специфичность работы комплекса на генах. Субъединичный состав комплексов SWI/SNF непостоянен и зависит от типа клеток и их функции. Гетерогенные и высокоспецифичные клетки мозга млекопитающего содержат большое количество специфичных субъединиц комплекса SWI/SNF, входящих в его состав на разных этапах нейродифференцировки. Показано, что коровые субъединицы BRG1, BAF155, BAF170 важны на всех стадиях нейрогенеза: при эмбриональном и взрослом нейрогенезе, при созревании нейронов, при формировании астроцитов, олигодендроцитов и Шванновских клеток [9]. Специфические субъединицы, например, BAF53b необходимы для формирования долговременной памяти [10], а Crest/SS18L1 участвует в корректном образовании дендритов [11, 12].
Одна из субъединиц комплекса подсемейства PBAF, играющая важную роль в нейрогенезе, – PHF10 (BAF45a). На разных стадиях развития головного мозга мыши PHF10 экспрессируется в виде четырех изоформ, которые отличаются N- и C-концевыми доменами и подвергаются интенсивному фосфорилированию [13]. PHF10 необходим для поддержания пролиферации клеток-предшественников головного мозга на ранних стадиях его развития [11]. В составе комплекса PBAF PHF10 локализуется на промоторах генов сигнальных путей и способствует привлечению РНК-полимеразы II на эти промоторы [14, 15].
В рамках изучения молекулярных механизмов регуляции экспрессии генов при ДВП на культуре клеток коры головного мозга новорожденных мышей мы установили, что PHF10 взаимодействует с активатором транскрипции c-FOS, а также изучили динамику экспрессии и локализации белков c-FOS и PHF10 в стимулируемых KCl нейрональных культурах. Показано, что в отсутствие стимуляции PHF10 экспрессируется и локализуется в ядрах дифференцированной нейрональной культуры. Экспрессия c-FOS начинается после стимуляции ДВП с помощью KCl. Через 1 ч после стимуляции c-FOS и PHF10 локализуются в цитоплазме клеток, а через 4 ч снова перемещаются в ядро. Необычное изменение локализации PHF10 специфично для нейрональных культур.
Мы предполагаем, что PHF10 совместно с c-FOS участвует в активации генов вторичного ответа, регулирующих поддержание пластических модификаций и гомеостаз синапса. Экспорт PHF10 из ядра и его быстрое возвращение вместе с c-FOS в ядро, возможно, необходимо для быстрой модуляции экспрессии таргетных генов в процессе стимуляции ДВП.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Содержание животных. Работа проведена на первичных культурах мозга новорожденных мышей линии C57BL/6. Основные правила содержания и ухода за экспериментальными животными соответствовали нормативам, указанным в Приказе Минздрава России № 267 от 19.06.2003 “Об утверждении правил лабораторной практики в Российской Федерации”. Животных содержали в условиях вивария при комнатной температуре с 12-часовым циклом свет/темнота, свободным доступом к воде и пище, на стандартной диете в соответствии с нормами содержания лабораторных животных.
Получение и культивирование первичной диссоциированной культуры нервных клеток. Предварительно дно чашек обработали поли-L-лизином для лучшей адгезии клеток. Клетки мозга новорожденных мышей диссоциировали, обрабатывая 0.25%-ным трипсином (“Invitrogen”, США) и распределяли по 300000 клеток в чашку. Жизнеспособность нейронов поддерживали в культуральной нейробазальной среде NeurobasalTM (“Invitrogen”) в комплексе с биоактивной добавкой 2% В27 (“Invitrogen”), 0.5 мМ глутамином (“Invitrogen”) и пенициллином-стрептомицином (“Life Technologies”, CША) в инкубаторе GALAXY 170S (“New Brunswick Scientific”, США) при постоянных условиях (37°C, 100%-ная влажность и 5% CO2). Половину объема среды заменяли новой каждые 3 дня [16].
Культивирование клеток линии HEK293T. В качестве негативного контроля использовали линию клеток эмбриональной почки человека 293Т (HEK293Т) [17].
Клетки культивировали в среде DMEM (Dulbecco’s Modified Eagle Medium, “GIBCO”, США), содержащей 10% сыворотки FBS (“Sigma”, США), 2 мМ добавки GlutaMax-I (“GIBCO”) и пенициллин-стрептомицин (“Life Technologies”) в инкубаторе GALAXY 170S (“New Brunswick Scientific”) при постоянных условиях (37°C, 100%-ная влажность, 5% CO2).
Для последующего иммуноцитохимического анализа из чашек Петри с клетками удаляли старую среду, промывали клетки PBS (1.7 мМ KH2PO4; 5.2 мМ Na2HPO4; 150 мМ NaCl), добавляли 0.05% трипсина (“Invitrogen”) на 3 мин. Всю среду с клетками помещали в пробирку. Снова центрифугировали в течение 4 мин при 800 об./мин. Супернатант удаляли, осадок ресуспендировали в чистой̆ среде и переносили на покровные стекла, расположенные в чашках Петри.
Клетки HEK293T для проведения иммунопреципитации выращивали примерно до 100% монослоя, затем удаляли питательную среду и смывали клетки с чашек Петри, промывали PBS (1.7 мМ KH2PO4; 5.2 мМ Na2HPO4; 150 мМ NaCl). Полученную суспензию клеток осаждали центрифугированием в течение 5 мин при 2500 об./мин. После удаления супернатанта клетки лизировали в буфере, содержащем 10 мM HEPES-KOH (pH 7.9), 5 мM MgCl2, 0.5% NP-40, 0.45 M NaCl, 1 мM ДTT и коктейль ингибиторов протеаз (PIC) (“Roche”, Швейцария). После получасового лизиса на льду экстракт центрифугировали в течение 15 мин при 12 000 об./мин и температуре 4°С. Затем супернатант разводили тремя объемами буфера, содержащего 10 мM HEPES-KOH (pH 7.9), 5 мM MgCl2, 1 мM ДTT, PIC и ДНКазу I (“Thermo Fischer Scientific”, США). Разбавленный экстракт повторно центрифугировали (12000 об./мин, 15 мин, 4°С).
Трансфекция клеток HEK293T. Для временной совместной экспрессии рекомбинантных белков HA-c-FOS и FL-PHF10-Pl/Sl клетки линии HEK293T рассаживали на 60 мм чашки Петри с 50% монослоя. На следующий день к клеткам добавляли смесь ДНК и полиэтиленимина в среде Optimem (“Gibco”). На каждую чашку суммарно брали 9 мкг плазмид: HA-c-FOS-pcDNA (6 мкг) и одну из Fl-PHF10-Pl-pcDNA (3 мкг) или Fl-PHF10-Sl-pcDNA (3 мкг), или контрольной Fl-pcDNA-MCS (3 мкг), 20 мкл (20 мкг) полиэтиленимина (“Polysciences”, ФРГ) и 450 мкл Optimem. На следующий день среду меняли на свежую, спустя 48 ч после трансфекции клетки собирали для последующей иммунопреципитации. Клетки снимали с помощью версена (“Панэко”, Россия), осаждали центрифугированием при 2500 об./мин и лизировали с помощью FLB-буфера (40 мM Tрис-HCl, pH 7.8; 100 мM NaCl; 2.5 мM MgCl2; PIC (“Roche”); PhIC (“Sigma”)) на льду. Затем растирали в гомогенизаторе Даунса с пестиком A, центрифугировали в течение 1 мин, супернатант использовали как цитоплазматическую фракцию для последующей иммунопреципитации.
Иммунопреципитация. Иммунопреципитацию проводили с помощью HA-агарозы (“Sigma”) или белок A-сефарозы (“Sigma”), предварительно обогащенной антителами к PHF10 (получены ранее в нашей лаборатории [15]).
К сефарозе, связанной с антителами, добавляли суммарный клеточный лизат (2 × 106 клеток), инкубировали в течение ночи при 4°С при постоянном перемешивании. После этого сефарозу последовательно промывали буфером IP500 (25 мМ Трис-HCl (pH 7.9), 5 мМ MgCl2, 10% глицерина, 100 мМ NaCl, 0.1% NP-40) и буфером IP100 (25 мМ Трис-HCl (pH 7.9), 5 мМ MgCl2, 10% глицерина, 100 мМ NaCl, 0.1% NP-40). Белки, специфически связавшиеся с антителами, элюировали нагреванием до 99°С в течение 10 мин в 1/10 объема полного клеточного экстракта SDS-содержащим буфером (50 мМ Трис-HCl (pH 6.8), 10% глицерина, 4% SDS, 4 мМ EDТА, 0.1 М ДTT, 0.1% бромфенолового синего). Полученные образцы анализировали методом электрофореза в ПААГ.
Стимуляция ДВП. В рамках работы получено 138 культур клеток головного мозга новорожденной мыши. Стимуляцию ДВП в нейронах проводили, добавляя в культуральную среду 50 мМ раствора KCl (3 раза в течение 2 мин в CO2 инкубаторе), между стимуляциями культуры инкубировали в течение 5 мин в чистой культуральной среде [18].
Иммуноцитохимия. После стимуляции 50 мМ раствором KCl каждую культуру перемещали на лед, чтобы максимально подавить экспрессию генов и другие процессы жизнедеятельности, сразу же отмывали от культуральной среды и фиксировали с помощью 4%-ного параформальдегида в течение 7–10 мин.
После фиксации клетки отмывали 3 раза по 5 мин в однократном растворе PBS (137 мM NaCl, 2.7 мM KCl, 1.4 мM KH2PO4, 4.3 мM NaH2PO4, pH 7.4). Для перфорации плазматической мембраны использовали 0.03%-ный раствор Triton Х100 (“Bio-Rad”, США) в буфере PBS (5 мин при комнатной температуре). Для клеток линии HEK293Т использовали 0.3%-ный раствор Triton Х100.
Неспецифическое связывание перед аппликацией антител снижали с помощью инкубации клеток с 3%-ным раствором БСА (“Sigma”) в PBS в течение 30 мин.
Клетки одновременно подвергали реакциям иммуногистохимического окрашивания на белок c-FOS, а также на клеточные ядра с помощью ДНК-специфического маркера DAPI (“Sigma”).
Клетки инкубировали в течение 12–13 ч при температуре 4оС с первичными мышиными антителами к c-FOS (“Invitrogen”) и кроличьими к PHF10 (получены в нашей лаборатории). Раствор антител готовили в PBS в объеме 300 мкл с добавлением 3% БСА. После инкубации клетки отмывали раствором PBS (3 раза в течение 3–5 мин). После этого проводили инкубацию со вторичными антителами, конъюгированными с флуорохромом: Alexa Fluor 647 donkey anti-mouse (“Invitrogen”) и Alexa Fluor 568 goat anti-rabbit (“Invitrogen”).
После инкубации клетки отмывали раствором PBS (3 раза в течение 3–5 мин). Затем ядра окрашивали DAPI (1 мкг/мл в течение 10 мин) и заключали в водную заливочную среду Fluoromount (“Sigma”) на предметных стеклах.
Микроскопия. Флуоресцентную микроскопию образцов выполняли при одной и той же интенсивности возбуждающего света и экспозиции на конфокальном микроскопе Olympus Fluoview 10i. Сначала создавали обзорную карту препарата для навигации путем автоматической сшивки полей зрения объектива × 10. Далее детектировали флуоресцентные метки в интересующих полях зрения (объективы ×10 и ×60) с одновременным получением изображений по методу фазового контраста.
Фотографировали флуоресцентный сигнал красной метки Alexa Fluor 647 в каждом поле зрения, свидетельствующий об экспрессии белка PHF10, сигнал зеленой метки Alexa Fluor 568, свидетельствующий об экспрессии белка c-FOS, флуоресцентный сигнал голубой метки DAPI, указывающий на общее количество клеточных ядер, а также вид культуры в белом свете.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
PHF10 взаимодействует с c-FOS
PHF10 входит в состав ремоделирующего хроматин комплекса PBAF и является коактиватором транскрипции, способствуя привлечению РНК-полимеразы II на таргетные гены [15]. Ранее показали, что PHF10 экспрессируется в пролиферирующих и дифференцированных нейронах в виде нескольких изоформ, играющих разную роль в активации транскрипции [13, 14]. Кроме того, PHF10 влияет на экспрессию генов многих сигнальных путей, регулируемых факторами транскрипции – продуктами генов раннего ответа, в том числе активатором транскрипции c-FOS [14].
Поэтому изучено взаимодействие эндогенного PHF10 с активатором транскрипции c-FOS. Экспрессию c-FOS в клетках HEK293T индуцировали путем обработки форболовым эфиром (PMA) в течение 2 ч. Далее с помощью антител к PHF10 проводили коиммунопреципитацию белков из экстракта клеток. Осажденные белки разделяли в SDS-ПААГ с последующим вестерн-блотингом, мембрану окрашивали антителами к c-FOS и PHF10.
Полученные данные показывают, что уровень изоформ PHF10 в клетках не меняется после обработки РМА (рис. 1а, верхняя панель, inputs). Как и ранее в наших работах [13, 15, 19–21], PHF10 был представлен несколькими полосами, соответствующими различным изоформам с разной степенью фосфорилирования. При иммунопреципитации практически весь PHF10 осаждался антителами (рис. 1а, верхняя панель).
Рис. 1.
а – Коиммунопреципитация c-FOS из лизата клеток HEK293Т с помощью антител к PHF10. Верхняя панель – вестерн-блот, окрашенный антителами к PHF10. Нижняя панель – вестерн-блот, окрашенный антителами к c-FOS. PHF10-IP – осаждение антителами к PHF10, output – истощенный антителами лизат после осаждения. Стрелками показаны формы c-FOS, которые копреципитируются антителами к PHF10. б – Коиммунопреципитация Fl-PHF10-Pl/Sl (две изоформы PHF10 – Fl-Pl и Fl-Sl) из лизата клеток HEK293T при совместной экспрессии с HA-c-FOS с помощью антител к HA-эпитопу. Верхняя панель – вестерн-блот, окрашенный антителами к Flag-эпитопу. Нижняя панель – вестерн-блот, окрашенный антителами к HA-эпитопу. HA-c-FOS и Fl-PHF10-Sl (Fl-Sl) использованы в качестве контроля неспецифического осаждения на HA-агарозу. HA-IP – осаждение HA-c-FOS-антителами к НА-эпитопу. Input – исходный клеточный лизат. Справа указаны молекулярные массы (55 и 70 кДа) маркерных белков.
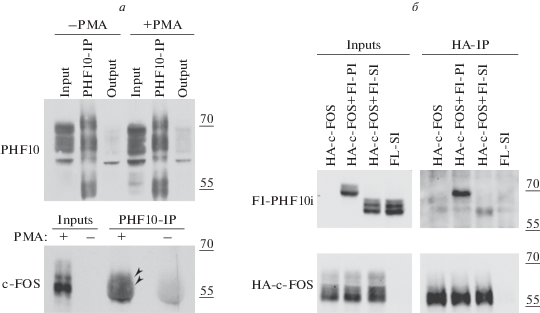
Обработка РМА индуцирует экспрессию c-FOS в клетках HEK293T (рис. 1а, нижняя панель, inputs). При этом c-FOS соосаждается антителами к PHF10 (рис. 1а, нижняя панель). Некоторая размытость полосы, соответствующей c-FOS (рис. 1а), связана с тем, что подвижность c-FOS в ПААГ примерно совпадает c подвижностью антител.
Прямое взаимодействие между транскрипционным активатором c-FOS и PHF10 подтверждали путем совместной экспрессии рекомбинантного белка HA-c-FOS и изоформ Fl-PHF10-Pl (Fl-Pl) или Fl-PHF10-Sl (Fl-Sl) с последующим осаждением HA-c-FOS из цитоплазматической фракции клеток HEK293T на HA-агарозу. Как показано нами ранее, рекомбинантные изоформы Fl-PHF10i при сверхэкспрессии частично локализуются в цитоплазме в несвязанном с комплексом PBAF состоянии [20]. После осаждения на HA-агарозу изоформы Fl-PHF10-Pl/Sl выявили с помощью вестерн-блотинга во фракциях, в которых экспрессируется также HA-c-FOS (рис. 1б). В контрольных фракциях HA-c-FOS и Fl-PHF10-Sl (Fl-Sl) неспецифический сигнал не наблюдали.
Таким образом, PHF10, субъединица ремоделирующего хроматин комплекса PBAF, взаимодействующая с активатором c-FOS и PHF10, может участвовать в активации транскрипции c-FOS-зависимых генов.
При стимуляции ДВП в нейрональных культурах PHF10 перемещается из ядра в цитоплазму, а затем транслоцируется в ядро вместе c с-FOS
На первой стадии ДВП наблюдается первичная однократная стимуляция нейронов и кратковременная экспрессия генов, ответственных за возникновение синапсов при последующей долговременной стимуляции. c-Fos – это ген раннего ответа, и белок c-FOS начинает транслироваться в цитоплазме нейронов в ответ на стимуляцию ДВП через 30–90 мин [3]. При определенных стимулах c-FOS может локализоваться не только в ядре, но и в цитоплазме и дендритах нейронов, например клеток Пуркинье [22]. Ранее мы обнаруживали и ядерную, и цитоплазматическую локализацию PHF10 в клетках [15]. Быстрое изменение локализации транскрипционных факторов – транспорт из цитоплазмы в ядро или из ядра в цитоплазму с возможной последующей деградацией или возвращением в ядро, может быть одним из вариантов регуляции экспрессии генов.
Мы предположили, что взаимодействие c-FOS и PHF10 может обуславливать их одновременное перемещение между ядром и цитоплазмой нейрона. На культуре клеток головного мозга новорожденных мышей изучена динамика экспрессии и локализации белков c-FOS и PHF10 при стимуляции ДВП с помощью KCl. Первичные нервные клетки после выделения культивировали в течение 22 дней до достижения состояния зрелых нейронов. Далее для индукции ДВП культуру обрабатывали 50 мМ KCl и последовательно фиксировали с промежутком 1 ч в течение 6 ч. Иммуноокрашивание клеток антителами, специфически узнающими c-FOS, показало, что c-FOS появляется в нейрональных клетках через 1 ч после стимуляции ДВП. Первоначально c-FOS локализуется в цитоплазме, затем постепенно транслоцируется в ядро и через 5–6 ч после индукции становится полностью ядерным (рис. 2).
Рис. 2.
Иммуноцитохимический анализ экспрессии и локализации транскрипционных активаторов PHF10 и c-FOS в первичных диссоциированных нейрональных культурах в ответ на стимуляцию 50 мМ KCl. Белыми стрелками обозначены ядра (иммунофлуоресцентное окрашивание антителами к PHF10). Белая шкала в секторе DAPI, 0 ч обозначает масштаб, равный 20 мкМ. PHF10 + DAPI – наложение двух каналов – PHF10 и DAPI.
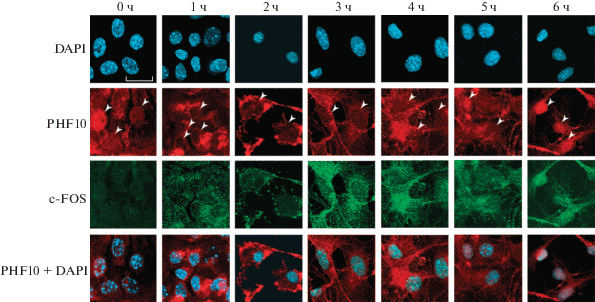
Интересно, что PHF10 присутствует в ядрах нейрональных клеток до индукции ДВП. Однако через 1 ч после индукции локализация PHF10 меняется на цитоплазматическую (рис. 2).
Далее локализация PHF10 и c-FOS совпадает: через 4 ч PHF10 вместе с c-FOS перемещается обратно в ядро. Полностью PHF10 и c-FOS находились в ядрах через 5 ч после обработки нейрональной культуры KCl (рис. 2).
Таким образом, c-FOS начинает интенсивно экспрессироваться в ответ на стимуляцию нейрональных культур KCl и в течение 5 ч транслоцируется из цитоплазмы в ядро. PHF10 после стимуляции KCl быстро (в течение 1 ч) перемещается в цитоплазму, но затем через 5 ч возвращается вместе с c-FOS в ядро.
Изменение локализации PHF10 при стимуляции KCl специфично для нейрональной культуры
Явление ДВП, наблюдаемое в первичных диссоциированных нейрональных культурах в ответ на стимуляцию KCl, специфично для зрелых нейронов. Мы выявили изменение локализации транскрипционного коактиватора PHF10 в этих культурах и проверили специфичность этого свойства для нейронов. В качестве контроля использовали культуру клеток HEK293T, в которой PHF10 экспрессируется на высоком уровне.
Клетки HEK293T высаживали на стекла, обрабатывали KCl и фиксировали с такими же временными промежутками (в течение 6 ч с интервалом 1 ч). Мы выполнили окрашивание PHF10 антителами и выявили постоянную интенсивную локализацию PHF10 в ядре в каждой временной точке после обработки KCl (рис. 3). Ядерная локализация PHF10 не изменялась в ответ на стимуляцию клеток HEK293T с помощью KCl.
Рис. 3.
Иммуноцитохимический анализ экспрессии и локализации PHF10 в клетках HEK293T в ответ на стимуляцию 50 мM KCl. Белыми стрелочками обозначены ядра (иммунофлуоресцентное окрашивание антителами к PHF10). Белая шкала в секторе DAPI 0 ч обозначает масштаб, равный 20 мкМ. PHF10 + DAPI –наложение двух каналов – PHF10 и DAPI.
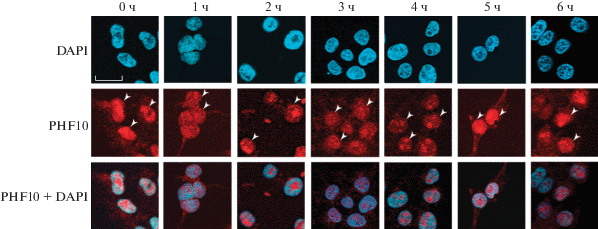
Таким образом, изменения локализации PHF10 специфичны для нейрональных культур. Быстрая транслокация PHF10 из ядра в цитоплазму и последующая колокализация с c-FOS может быть связана с особенностями регуляции экспрессии генов в ответ на стимуляцию ДВП.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Транскрипционный фактор c-FOS является сильным активатором транскрипции. В частности, c-FOS активирует гены пролиферации, нейропластичности и гены ответа на стресс. В процессах активации генов важную роль играют также коактиваторные комплексы – ремоделеры хроматина. В частности, ремоделирующий хроматин комплекс PBAF важен для пролиферации и дифференцировки нейрональных клеток головного мозга млекопитающих [13–15]. Мы показали, что c-FOS взаимодействует с одной из специфических субъединиц комплекса PBAF – PHF10, которая отвечает за связывание комплекса с хроматином на регуляторных областях гена и за привлечение на промотор РНК-полимеразы II [15].
Транскрипция гена FOS характерна для недавно активированных нейронов и необходима для ДВП – усиления синаптической передачи сигнала между нейронами, сохраняющейся на протяжении длительного времени [23]. На срезах коры головного мозга крысы показано, что максимальная экспрессия c-FOS наблюдается через 1.5 ч после стимуляции [24]. А на срезах гиппокампа мыши установлено, что экспрессия c-FOS максимальна через 2 ч после стимуляции нейронов [25]. В наших экспериментах, выполненных на первичной нейрональной культуре, максимальный уровень экспрессии c-FOS наблюдали через 3 ч, а максимальную концентрацию c-FOS в ядре – через 5–6 ч. Возможно, это связано с недостаточной дифференцировкой первичной культуры нейрональных клеток, культивированных на чашках.
Также мы изучили изменение локализации PHF10. Белок PHF10, самый нестабильный из всех субъединиц PBAF, сильно фосфорилирован и частично локализуется в цитоплазме клеток [20]. Обычно белки, обладающие этими свойствами, интенсивно регулируются в ответ на внешние стимулы и сами действуют как активаторы различных транскрипционных процессов. Быстрая транслокация транскрипционного фактора из ядра в цитоплазму – еще один способ регуляции транскрипции. Например, FOXO1 в ответ на стимуляцию IGF-1 фосфорилируется киназой Akt1 и экспортируется из ядра. При этом активируются многие гены фазы G1/S клеточного цикла [26]. Еще один пример – онкосупрессор Rb, который при обработке миофибрилл скелетных мышц человека TNF-α фосфорилируется киназой CDK4 и также уходит из ядра, что приводит к снятию репрессии генов, отвечающих за пролиферацию клеток [27].
В ответ на обработку клеток KCl РHF10 быстро перемещается из ядра в цитоплазму, что может приводить к ингибированию ряда генов, активно транскрибирующихся и ремоделирующихся комплексом PBAF. Однако затем вместе с c-FOS, активатором PHF10, возвращается в ядро, что ведет к активации паттернов других генов, ответственных за синаптогенез и формирование пластичности нервной ткани. Возможно также, что c-FOS, взаимодействует с PHF10 в цитоплазме, и PHF10 способствует его транслокации в ядро на таргетные сайты хроматина для последующей активации специфических генов (рис. 4).
Рис. 4.
Схема экспрессии и транслокации c-FOS и PHF10 в нейрональных клетках в ответ на стимуляцию ДВП с помощью KCl. До стимуляции PHF10 в составе комплекса PBAF находится в ядре, отвечая за транскрипцию некоторого набора генов (0ч-KCl). Через 1 ч после стимуляции в цитоплазме начинает экспрессироваться c-FOS, а PHF10 транслоцируется из ядра в цитоплазму. Предполагается, что экспрессия таргетных генов прекращается. PHF10 взаимодействует с c-FOS (1ч-KCl. Через 5 ч после стимуляции c-FOS и PHF10 локализуются в ядре, стимулируя транскрипцию других генов – генов вторичного ответа, активируемых c-FOS (5ч-KCl). 0ч-KCl, 1ч-KCl, 5ч-KCl – время с момента обработки KCl нейрональных клеток – до обработки, 1 и 5 ч соответственно.
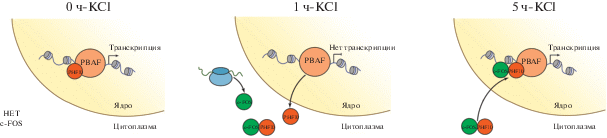
Таким образом, изменение локализации PHF10 и его колокализация с активатором c-FOS может регулировать изменение паттернов экспрессирующихся генов в ответ на стимуляцию ДВП.
Работа поддержана грантом Российского научного фонда (18-14-00303), выданному Н.В. Сошниковой.
Условия содержания экспериментальных животных соответствовали нормативам, указанным в Приказе Минздрава России № 267 от 19.06.2003 “Об утверждении правил лабораторной практики в Российской Федерации”.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Ghosh A., Ginty D.D., Bading H., Greenberg M.E. (1994) Calcium regulation of gene expression in neuronal cells. J. Neurobiol. 25, 294–303.
Mermelstein P.G., Bito H., Deisseroth K., Tsien R.W. (2000) Critical dependence of cAMP response element-binding protein phosphorylation on L-type calcium channels supports a selective response to EPSPs in preference to action potentials. J. Neurosci. 20, 266–273.
Fleck M.W., Palmer A.M., Barrionuevo G. (1992) Potassium-induced long-term potentiation in rat hippocampal slices. Brain Res. 580, 100–105.
Minatohara K., Akiyoshi M., Okuno H. (2016) Role of immediate-early genes in synaptic plasticity and neuronal ensembles underlying the memory trace. Front. Mol. Neurosci. 8, 243. https://doi.org/10.3389/fnmol.2015.00078
Gallo F.T., Katche C., Morici J.F., Medina J.H., Weisstaub N.V. (2018) Immediate early genes, memory and psychiatric disorders: focus on c-Fos, Egr1 and Arc. Front. Behav. Neurosci. 12, 79.
Sheng M., Greenberg M.E. (1990) The regulation and function of c-fos and other immediate early genes in the nervous system. Neuron. 4, 477–485.
Oma Y., Harata M. (2011) Actin-related proteins localized in the nucleus. Nucleus. 2, 38–46.
Li X., Wang W., Wang J., Malovannaya A., Xi Y., Li W., Guerra R., Hawke D.H., Qin J., Chen J. (2015) Proteomic analyses reveal distinct chromatin-associated and soluble transcription factor complexes. Mol. Syst. Biol. 11, 775.
Sokpor G., Xie Y., Rosenbusch J., Tuoc T. (2017) Chromatin remodeling BAF (SWI/SNF) complexes in neural development and disorders. Front. Mol. Neurosci. 10, 78.
Vogel-Ciernia A., Matheos D.P., Barrett R.M., Kramár E.A., Azzawi S., Chen Y., Magnan C.N., Zeller M., Sylvain A., Haettig J., Jia Y., Tran A., Dang R., Post R.J., Chabrier M., Babayan A.H., Wu J.I., Crabtree G.R., Baldi P., Baram T.Z., Lynch G., Wood M.A. (2013) The neuron-specific chromatin regulatory subunit BAF53b is necessary for synaptic plasticity and memory. Nat. Neurosci. 16, 552–561.
Qiu Z., Ghosh A. (2008) A calcium-dependent switch in a CREST-BRG1 complex regulates activity-dependent gene expression. Neuron. 60, 775–787.
Staahl B.T., Tang J., Wu W., Sun A., Gitler A.D., Yoo A.S., Crabtree G.R. (2013) Kinetic analysis of npBAF to nBAF switching reveals exchange of SS18 with CREST and integration with neural developmental pathways. J. Neurosci. 33, 10348–10361.
Азиева А.М., Шейнов А.А., Галкин Ф.А., Георгиева С.Г., Сошникова Н.В. (2018). Влияние фосфорилирования субъединиц ремоделирующего хроматин комплекса PBAF на их стабильность в головном мозге мыши. ДАН. 479, 212–215.
Lessard J., Wu J.I., Ranish J.A., Wan M., Winslow M.M., Staahl B.T., Wu H., Aebersold R., Graef I.A., Crabtree G.R. (2007) An essential switch in subunit composition of a chromatin remodeling complex during neural development. Neuron. 55, 201–215.
Brechalov A.V., Georgieva S.G., Soshnikova N.V. (2014) Mammalian cells contain two functionally distinct PBAF complexes incorporating different isoforms of PHF10 signature subunit. Cell Cycle. 13, 1970–1979.
Sokolov I., Azieva A., Burtsev M. (2016) Patterns of spiking activity of neuronal networks in vitro as memory traces. In: Advances in Intelligent Systems and Computing. Biologically Inspired Cognitive Architectures (BICA) for Young Scientists. Cham Springer Internat. Publ., 241–247.
Stepanenko A.A., Dmitrenko V.V. (2015) HEK293 in cell biology and cancer research: phenotype, karyotype, tumorigenicity, and stress-induced genome-phenotype evolution. Gene. 569, 182–190.
Schoenenberger P., Gerosa D., Oertner T.G. (2009) Temporal control of immediate early gene induction by light. PloS One. 4, e8185.
Бречалов А.В., Валиева М.Е., Георгиева С.Г., Сошникова Н.В. (2016) Изоформы белка PHF10 подвергаются фосфорилированию в составе ремоделирующего хроматин комплекса PBAF млекопитающих. Молекуляр. биология. 50(2), 320‒326.
Tatarskiy V.V., Simonov Y.P., Shcherbinin D.S., Brechalov A.V., Georgieva S.G., Soshnikova N.V. (2017) Stability of the PHF10 subunit of PBAF signature module is regulated by phosphorylation: role of β-TrCP. Sci. Rep. 7, 5645.
Sheynov A., Feoktistov A., Georgieva S., Soshnikova N. (2019) AKT kinase phosphorylates PHF10, a subunit of PBAF chromatin remodeling complex. FEBS Open Bio. 9, 124.
Tian J.B., Bishop G.A. (2002) Stimulus-dependent activation of c-Fos in neurons and glia in the rat cerebellum. J. Chem. Neuroanat. 23, 157–170.
Flavell S.W., Greenberg M.E. (2008) Signaling mechanisms linking neuronal activity to gene expression and plasticity of the nervous system. Annu. Rev. Neurosci. 31, 563–590.
Chaudhuri A., Zangenehpour S., Rahbar-Dehgan F., Ye F. (2000) Molecular maps of neural activity and quiescence. Acta Neurobiol. Exp. (Warsz.). 60, 403–410.
Gandolfi D., Cerri S., Mapelli J., Polimeni M., Tritto S., Fuzzati-Armentero M.-T., Bigiani A., Blandini F., Mapelli L., D’Angelo E. (2017) Activation of the CREB/c-Fos pathway during long-term synaptic plasticity in the cerebellum granular layer. Front. Cell. Neurosci. 11, 184.
Schachter T.N., Shen T., Liu Y., Schneider M.F. (2012) Kinetics of nuclear-cytoplasmic translocation of Foxo1 and Foxo3A in adult skeletal muscle fibers. Am. J. Physiol.–Cell Physiol. 303, C977–C990.
Araki K., Kawauchi K., Hirata H., Yamamoto M., Taya Y. (2013) Cytoplasmic translocation of the retinoblastoma protein disrupts sarcomeric organization. eLife. 2, e01228.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


