Молекулярная биология, 2021, T. 55, № 6, стр. 987-998
Иммуногенные свойства ДНК-конструкции, кодирующей рецепторсвязывающий домен белка шипа SARS-CoV-2
М. Б. Боргоякова a, *, Л. И. Карпенко a, А. П. Рудомётов a, Д. В. Шаньшин a, А. А. Исаева a, b, В. С. Несмеянова a, b, Н. В. Волкова a, С. В. Беленькая a, Д. Е. Мурашкин a, Д. Н. Щербаков a, b, Е. А. Волосникова a, Е. В. Старостина a, Л. А. Орлова a, Н. В. Данильченко a, А. В. Зайковская a, О. В. Пьянков a, А. А. Ильичёв a
a Государственный научный центр вирусологии и биотехнологии “Вектор” Роспотребнадзора
630559Кольцово, Новосибирская область, Россия
b Государственный научный центр вирусологии и биотехнологии “Вектор” Роспотребнадзора, Центр геномных исследований мирового уровня по обеспечению биологической безопасности и технологической независимости
в рамках Федеральной научно-технической программы развития генетических технологий
630559 Кольцово, Новосибирская область, Россия
* E-mail: borgoyakova_mb@vector.nsc.ru
Поступила в редакцию 07.03.2021
После доработки 19.04.2021
Принята к публикации 20.04.2021
Аннотация
В связи с пандемией COVID-19 ‒ заболевания, вызванного новым коронавирусом SARS-CoV-2, ‒ чрезвычайно актуальна задача скорейшей разработки профилактической вакцины. Нами cконструирована плазмида pVAX-RBD, которая несет последовательность, кодирующую рецепторсвязывающий домен (RBD) белка шипа (S) SARS-CoV-2 в качестве иммуногена и уникальную сигнальную последовательность 176, способствующую секреции целевого белка во внеклеточное пространство, для повышения эффективности индукции гуморального иммунного ответа на вирусный антиген. Для доставки pVAX-RBD в клетки использован конъюгат полиглюкина со спермидином (PGS). При сравнении иммуногенности “голой” ДНК, pVAX-RBD, и pVAX-RBD в оболочке PGS (pVAX-RBD‒PGS) показано, что последняя эффективнее индуцирует иммунный ответ у мышей. Так, по результатам иммуноферментного анализа, у животных в группе pVAX-RBD титр RBD-специфичных антител не превышал 1 : 1000, а в группе pVAX-RBD–PGS составил 1 : 42 000. ДНК-конструкт pVAX-RBD‒PGS эффективно индуцировал и клеточный иммунный ответ. Методом ELISpot показано, что спленоциты иммунизированных животных эффективно продуцируют интерферон-γ в ответ на стимуляцию пулом пептидов из белка S. На основании полученных результатов композицию pVAX-RBD в оболочке конъюгата полиглюкина со спермидином можно рассматривать в качестве перспективной ДНК-вакцины против COVID-19.
Для создания вакцины против коронавируса-2, вызывающего тяжелый острый респираторный синдром (SARS-CoV-2), задействованы все известные на данный момент платформы: инактивированный вирус [1, 2], рекомбинантные белки и синтетические пептиды [3‒5], векторные вакцины [6, 7], конструкции на основе ДНК [8, 9] и мРНК [10, 11]. Все эти подходы имеют свои преимущества и недостатки. ДНК-вакцины отличает быстрота и простота разработки, низкая стоимость производства, безопасность в использовании, 1способность индуцировать как гуморальный, так и клеточный иммунитет. Несмотря на то, что первые поколения ДНК-вакцин не отличались высокой иммунологической эффективностью, дальнейшее развитие этой платформы продолжалось и было направлено на поиски средств доставки и адъювантов, способных усилить эффект ДНК-вакцинации. По данным ВОЗ, на июнь 2021 года 10 ДНК-вакцин против SARS-CoV-2 находится на стадии клинических и еще 16 – на стадии доклинических испытаний (https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines).
К основным мишеням конструируемых вакцин против SARS-CoV-2 относятся белок шипа (S) и его рецепторсвязывающий домен (RBD), который связывается с ангиотензинконвертирующим ферментом-2 (ACE2) на поверхности клетки-мишени, тем самым инициируя проникновение вируса в клетку [12]. Несколько групп, уже имеющих в своем арсенале рабочие векторные плазмиды, смогли быстро создать вакцинные прототипы и исследовать их иммуногенность на животных, буквально спустя несколько недель после появления последовательности гена S-белка SARS-CoV-2 в открытом доступе [8].
Нами сконструирована кандидатная вакцинная ДНК, кодирующая RBD белка S SARS-CoV-2 (pVAX-RBD). Для повышения синтеза белка-иммуногена, кодируемого этой плазмидой, мы оптимизировали состав кодонов целевого гена. Для эффективного транспорта белка из клетки в состав pVAX-RBD входит последовательность, кодирующая оригинальную лидерную последовательность 176 ‒ гибрид сигнальных последовательностей двух активно секретируемых белков: люциферазы и фиброина. Для упаковки и доставки ДНК-вакцины использован поликатионный конъюгат полиглюкина со спермидином (далее PGS), который ранее опробован нами при разработке вакцин против ВИЧ-1 [13, 14], вируса Эбола [15] и мРНК-вакцины против SARS-CoV-2 [16]. Теперь мы представляем результаты исследования иммуногенности плазмиды pVAX-RBD в оболочке PGS как потенциальной ДНК-вакцины против SARS-CoV-2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Конструирование иммуногенов. Для конструирования иммуногенов использовали последовательность гена, кодирующего полноразмерный белок S SARS-CoV-2 (GenBank Acc. No. MN908947). Для оптимизации состава кодонов, а также вторичной структуры РНК для эффективной экспрессии в клетках млекопитающих использовали программу GeneOptimizer (https://www.thermofisher.com/ ru/en/home/life-science/cloning/gene-synthesis/geneart-gene-synthesis/geneoptimizer.html). Полученную нуклеотидную последовательность синтезировали в ООО “ДНК-синтез” (Россия) и клонировали в составе вектора pGH.
Для амплификации фрагмента, кодирующего RBD белка S (320V–542N) и сигнальную последовательность 176 (MMRTLILAVLLVYFCATVHC) на 5'-конце, использовали праймеры: 5'-TAATACGACTCACTATAGGCTAGCCT-3' (прямой) и 5'-AAAAAAGCGGCCGCTCATTAGTTGAAGTTCACGCATTTGTTCTTC-3' (обратный), ‒ и матрицу, содержащую указанный фрагмент (любезно предоставлена лабораторией иммунохимии ФБУН ГНЦ ВБ “Вектор” Роспотребнадзора). Продукт амплификации встраивали в вектор pVAX (“Thermo Fisher Scientific”, США) по сайтам NheI и NotI. Структуру полученной конструкции подтверждали секвенированием по методу Сэнгера в ЦКП “Геномика” (Россия). Полученную конструкцию обозначили pVAX-RBD.
Наработка плазмидной ДНК для иммунизации. Клетки Escherichia coli Stbl3 трансформировали плазмидами pVAX и pVAX-RBD с помощью хлористого кальция. Наработку плазмидной ДНК для иммунизации проводили в 2.7 л питательной среды LB с добавлением канамицина (25 мкг/мл). Плазмидную ДНК выделяли и очищали с помощью набора EndoFree Plasmid Giga Kit (“QIAGEN”, Германия) согласно рекомендациям производителя. Количество эндотоксинов определяли LAL-тестом по инструкции производителя, образование геля определяли визуально (“Charles River”, США).
Трансфекция клеток HEK-293T и CHO-K1 ДНК-конструкциями. Клеточные культуры HEK-293T и CHO-K1 были получены из Коллекции культур клеток ФБУН ГНЦ ВБ “Вектор” Роспотребнадзора. Трансфекцию клеток HEK-293T и CHO-K1 проводили с помощью Lipofectamine 3000 (“Invitrogen”, США) согласно инструкции производителя. Клетки высевали на 24-луночные планшеты в количестве 107 клеток на лунку и культивировали в среде DMEM с добавлением 10% фетальной сыворотки крупного рогатого скота (FBS). В день трансфекции среду заменяли на поддерживающую, содержащую 2% FBS. В лунки планшета вносили по 2 мкг плазмидной ДНК с Lipofectamine 3000 и помещали планшет в инкубатор с 5% СО2. Через 48 ч после трансфекции клетки вместе с культуральной средой переносили в пробирки и центрифугировали 5 мин при 800 × g, после чего в осадке и супернатанте оценивали экспрессию гена, кодирующего RBD, используя ПЦР с обратной транскрипцией (ОТ-ПЦР) и иммуноблотинг.
Оценка экспрессии целевого белка методом иммуноблотинга. Осадок клеток CHO-K1 ресуспендировали в PBS и лизировали с помощью ультразвука на гомогенизаторе Soniprep 150 Plus (“MSE”, Великобритания). Для разделения белков в лунки 12%‑ного полиакриламидного геля вносили 10 мкл лизата клеток CHO-K1, трансфицированных плазмидами pVAX-RBD или pVAX, или 10 мкл супернатанта (среда после культивирования клеток), после чего проводили электрофорез с последующим переносом белков на нитроцеллюлозную мембрану, которую затем блокировали BSA, отмывали и инкубировали с гипериммунной мышиной сывороткой, разведенной в 5000 раз (сыворотка была получена из крови мышей, иммунизированных инактивированным вирусом SAR-CoV-2 (неопубликованные данные). В качестве вторичных антител использовали конъюгированные со щелочной фосфатазой антитела кролика против IgG мыши (“Sigma”, США), а в качестве субстратов ‒ BCIP (5-bromo-4-chloro-3-indolyl phosphate) и NBT (nitro blue tetrazolium) (“Thermo Fisher Scientific”).
ОТ-ПЦР. Уровень экспрессии мРНК RBD оценивали методом ОТ-ПЦР. Тотальную РНК выделяли из клеток, трансфицированных pVAX-RBD или pVAX, с использованием набора для выделения РНК (ООО “Биолабмикс”, Россия) и транскрибировали получившуюся РНК в кДНК с последующим проведением ПЦР с помощью набора для ОТ-ПЦР (ООО “Биолабмикс”) со специфическими праймерами к гену, кодирующему RBD: 5'‑TAATACGACTCACTATAGGCTAGCCT-3' (прямой) и 5'-AAAAAAGCGGCCGCTCATTAGTTGAAGTTCACGCATTTGTTCTTC-3' (обратный). ОТ-ПЦР проводили в следующих условиях: обратная транскрипция 30 мин при 45°C, начальная денатурация 5 мин при 95°C, 30 циклов последовательных денатурации (15 с при 95°C), отжига праймеров (20 с при 58°C) и элонгации (1 мин при 72°C) и терминальная элонгация 5 мин при 72°C. Продукты реакции анализировали с помощью электрофореза в 1%-ном агарозном геле.
Получение комплексов ДНК‒PGS. На первом этапе получали активированный декстран путем его окисления по гликолям. Для этого 1 моль декстрана 40 000 (“MPBiomedicals™”, США) обрабатывали 40 молями периодата натрия в течении 60 мин, после чего очищали окисленный продукт от избытка окислителя на колонке с сефадексом G-25 в 50 мМ карбонатном буфере (pH 8.6). Далее в раствор окисленного декстрана добавляли раствор спермидина (“Sigma”) из расчета 15 молей на 1 моль декстрана, инкубировали в течение 2 ч и добавляли в смесь боргидрид натрия из расчета 80 молей на 1 моль декстрана. Смесь инкубировали еще 2 ч и очищали целевой продукт от непрореагировавших компонентов гель-фильтрацией на сефадексе G-25, уравновешенном PBS. Для формирования комплексов ДНК смешивали с PGS в массовом соотношении 1 : 10 [15, 16] и оценивали выход по изменению электрофоретической подвижности ДНК в 1%-ном агарозном геле.
Иммунизация мышей. Работу с животными проводили согласно “Правилам проведения работ с использованием экспериментальных животных”. Эксперименты были одобрены на заседании биоэтической комиссии ФБУН ГНЦ ВБ “Вектор” Роспотребнадзора, номер протокола ГНЦ ВБ “Вектор”/10-09.2020.
В исследовании использовали самок мышей BALB/c весом 16‒18 г, которых случайным образом разделили на 4 группы по 6 животных. Каждая группа была проиммунизирована трижды с двухнедельным интервалом одним из следующих препаратов: pVAX-RBD‒PGS (группа pVAX-RBD‒PGS), pVAX-RBD (группа pVAX-RBD) и плазмидой pVAX–PGS (плазмида pVAX в оболочке PGS; группа pVAX‒PGS). Для инъекций использовали раствор 100 мкг соответствующей ДНК в 200 мкл физиологического раствора, который вводили животным внутримышечно в задние лапы (по 100 мкл в каждую).
Иммуноферментный анализ сывороток. Уровень индуцированных вакцинными препаратами антител определяли в сыворотках крови животных через 6 недель после первой иммунизации. Сыворотки отделяли от клеточных элементов центрифугированием (9000 × g, 15 мин) и полученный супернатант прогревали при 56°C в течение 30 мин для инактивации системы комплемента.
В качестве антигена для иммуноферментного анализа (ИФА) использовали белок RBD, полученный в эукариотических продуцентах (клетках CHO-K1) и очищенный с помощью методов аффинной и ионнообменной хроматографии (чистота белка составляла более 98%) (белок любезно предоставлен лабораторией иммунохимии ФБУН ГНЦ ВБ “Вектор” Роспотребнадзора). Белок RBD (1 мкг/мл в 2 М мочевине) сорбировали на 96-луночные планшеты (“Greiner Bio-One”, Германия) при 4°C в течение ночи, планшет промывали в PBS с 0.05% Tween 20 (PBST) и блокировали 1%-ным раствором казеина в том же буфере в течение 60 мин при комнатной температуре. Затем в лунки добавляли сыворотки в трехкратном серийном разведении, начиная с 1 : 50, в блокирующем растворе и инкубировали в течение 60 мин при комнатной температуре. Планшет промывали, добавляли конъюгированные с пероксидазой хрена кроличьи антитела против IgG мыши (“Sigma”) и инкубировали в течение 60 мин при комнатной температуре. В лунки планшета, промытого PBST, вносили субстрат TMB (3,3',5,5'-tetramethylbenzidine) (“Amresco”, США). Оптическую плотность измеряли при длине волны 450 нм на микропланшетном ридере ChroMate-4300 (“Awareness Technology Inc.”, США). За титр в ИФА принимали разведение сыворотки, при котором значение оптической плотности более чем в два раза превышало таковую для отрицательного контроля (в лунки вместо сыворотки добавлен блокирующий буфер).
Оценка вируснейтрализующей активности сывороток. В работе использован штамм nCoV/Victoria/1/2020 SARS-CoV-2 (Государственная коллекция возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ БВ “Вектор” Роспотребнадзора). Пул вируса был наработан на культуре клеток Vero E6 (Коллекция культур клеток ФБУН ГНЦ БВ “Вектор” Роспотребнадзора) с титром 6.5 lgТЦД50/мл (50%-ная тканевая цитопатическая доза). Рабочая доза вируса составила 100 ТЦД50. Для оценки эффективности нейтрализующей активности сывороток готовили их серийные двукратные разведения, начиная с разведения 1 : 10 до 1 : 2560. Для разведения сывороток использовали среду DMEM с L-глутамином и антибиотиками (100 ед/мл пенициллин, 100 мкг/мл стрептомицин). Образцы разведений сыворотки и вируса в рабочей дозе смешивали в равных объемах, инкубировали 1 ч при комнатной температуре, вносили в лунки 96-луночного планшета с монослоем культуры клеток Vero E6 и инкубировали в течение 4 суток при 37°C в атмосфере 5% CO2. Для окрашивания клеток в каждую лунку планшета добавляли 150 мкл 0.2%-ного раствора генцианвиолета (1 г генцианвиолета в 20 мл 96%-ного этанола, 120 мл 40%-ного формалина и 350 мл раствора Хенкса). Через 30 мин жидкость из лунок удаляли и промывали водой. Результаты регистрировали визуально. Любое специфическое повреждение клеточной культуры в лунке считалось цитопатическим эффектом вируса. Нейтрализующую активность сывороток иммунизированных животных оценивали по титру (разведению) сывороток, при котором регистрировали защиту клеток от цитопатического действия вируса в 50% лунок. Титр нейтрализующих антител рассчитывали по формуле Рида–Менча [17].
Оценка Т-клеточного иммунного ответа. Величину Т-клеточного иммунного ответа определяли с помощью метода ELISpot с использованием набора Mouse IFN-gamma ELISpot kit (“BD”, США). Селезенки животных извлекали через две недели после третьей иммунизации. Спленоциты получали последовательной гомогенизацией через фильтры 70 и 40 мкм (“BD Falcon”, США). После лизиса эритроцитов лизирующим буфером (“Sigma”) спленоциты дважды отмывали в среде RPMI и помещали в 1 мл среды RPMI с 2 мМ L‑глутамина и 50 мкг/мл гентамицина. На 96‑луночном планшете из набора были иммобилизованы антитела против интерферона-γ (IFN-γ) мыши. После блокировки планшета RPMI спленоциты пассировали в количестве 5 × 105 клеток/лунка и стимулировали смесью пептидов в концентрации 20 мкг/мл для каждого пептида. Клетки инкубировали 20 ч при 37°С в атмосфере 5% CO2, затем плашки отмывали, добавляли биотинилированные антитела против мышиного IFN-γ, которые проявляли с помощью конъюгата стрептавидин-пероксидаза хрена и субстрата AEC (3-amino-9-ethylcarbazole). Число IFN-γ-продуцирующих клеток подсчитывали с помощью ELISpot-ридера (“Carl Zeiss”, Германия).
Для стимуляции спленоцитов, выделенных из иммунизированных животных, использовали пул из 20 пептидов из последовательности S-белка SARS-CoV-2, рестриктируемых молекулами главного комплекса гистосовместимости (MHC) класса I (H-2-Dd, H-2-Kd, H-2-Ld) и класса II (H2-IAd, H2-IEd) мышей BALB/c (табл. 1). Пептиды были синтезированы компанией “AtaGenix Laboratories” (Китай), чистота пептидов составляла более 80%.
Таблица 1.
Список пептидов S-белка SARS-CoV-2, использованных для стимуляции спленоцитов мышей BALB/c, при определении Т-клеточного ответа методом ELISpot
| № п/п | Пептиды | MHC-рестрикция |
|---|---|---|
| 1 | SGTNGTKRF | H-2-Dd |
| 2 | YYHKNNKSW | H-2-Kd |
| 3 | KYNENGTIT | H-2-Kd |
| 4 | VYAWNRKRI | H-2-Kd |
| 5 | FERDISTEI | H-2-Ld |
| 6 | CGPKKSTNL | |
| 7 | SYQTQTNSP | H-2-Kd |
| 8 | SKPSKRSFI | H-2-Dd |
| 9 | KYFKNHTSP | H-2-Kd |
| 10 | YPDKVFRSSVLHSTQ | H2-IEd |
| 11 | DPFLGVYYHKNNKSW | H2-IEd |
| 12 | KNIDGYFKIYSKHTP | H2-IEd |
| 13 | RFASVYAWNRKRISN | H2-IEd, H2-IAd |
| 14 | VGGNYNYLYRLFRKS | H2-IEd |
| 15 | GGNYNYLYRLFRKSN | H2-IEd |
| 16 | YNYKLPDDFTGCVIA | H2-IEd |
| 17 | NATRFASVYAWNRKR | H2-IEd, H2-IAd |
| 18 | SNGTHWFVTQRNFYE | H2-IEd |
| 19 | YEQYIKWPSGRLVPR | H2-IEd |
| 20 | KNKCVNFNFNGLTGT | H2-IEd |
Статистическая обработка. Сравнение полученных результатов выполнено с использованием непараметрического метода Манна‒Уитни с помощью программного обеспечения GraphPadPrism 6.0. При p < 0.05 различия между двумя группами считали статистически значимыми.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Дизайн конструкции и проверка ее свойств in vitro
Последовательность, выбранная нами для работы, соответствует опубликованной в GenBank для гена S-белка SARS-CoV-2 (MN908947). Для повышения экспрессии и иммуногенности созданной ДНК-конструкции мы провели оптимизацию состава кодонов последовательности ДНК, кодирующей S-белок SARS-CoV-2, с использованием программы GeneOptimizer. Оптимизированную последовательность ДНК, кодирующую S-белок, синтезировали и клонировали в составе векторной плазмиды pGh. Фрагмент, кодирующий RBD и сигнальную последовательность 176, клонировали в вектор pVAX по сайтам NheI и NotI (рис. 1) под немедленный ранний промотор цитомегаловируса человека (CMV).
Рис. 1.
Генетическая карта плазмиды pVAX-RBD. Обозначения: ori ‒ точка начала репликации; bGH poly(A) (bovine growth hormone polyadenylation) – терминальная последовательность, обеспечивающая экспрессию белка в эукариотических клетках; NeoR/KanR – ген устойчивости к неомицину и канамицину.
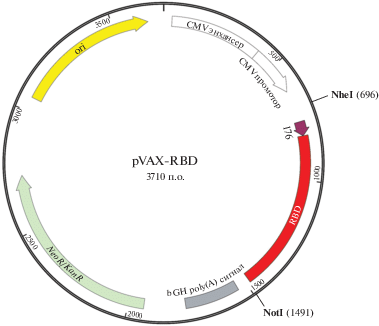
В результате получена ДНК-конструкция pVAX-RBD, кодирующая RBD с сигнальной последовательностью. Препарат экспериментальной ДНК-вакцины был наработан и очищен, содержание эндотоксинов в конечном препарате не превышало 4 единиц (ЕЭ) на одну дозу (100 мкг ДНК), что ниже пороговых значений, установленных для вакцинных препаратов [18].
Экспрессия последовательности, кодирующей RBD, в клетках HEK-293T
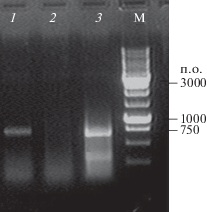
Экспрессию нуклеотидной последовательности, кодирующей RBD, в клетках HEK-293T оценивали с помощью ОТ-ПЦР. Для этого клетки трансфицировали плазмидами pVAX-RBD и pVAX, выделяли тотальную РНК, а затем получали кДНК с RBD-кодирующей последовательности с помощью специфических праймеров. На электрофореграмме (рис. 2) видно, что размер амплифицированного фрагмента, полученного из клеток, трансфицированных pVAX-RBD, соответствует размеру последовательности, кодирующей RBD (750 п.о.). По наличию мРНК RBD в трансфицированных клетках HEK-293T судили об эффективности трансфекции клеток плазмидами.
Рис. 2.
Электрофоретический анализ продуктов ОТ-ПЦР в 1%-ном агарозном геле. Дорожки 1 и 2 – продукты, полученные из суммарной РНК клеток HEK-293T, трансфицированных pVAX-RBD и pVAX соотсветственно; дорожка 3 – продукт, полученный с помощью ПЦР из плазмиды pVAX-RBD, кодирующей RBD, в качестве положительного контроля. М – маркер молекулярных масс ДНК M12 (“СибЭнзим”, Россия).
Экспрессия RBD в трансфицированных клетках CHO-K1
Экспрессию RBD в клетках CHO-K1 оценивали методом иммуноблотинга (рис. 3). На дорожках 2 и 5 видны белковые полосы, соответствующие по молекулярной массе RBD (~35 кДа) и связывающиеся с антителами мышей, иммунизированных SARS-CoV-2. Следовательно, в трансфицированных клетках присутствует целевой белок (дорожка 2), который секретируется клетками в культуральную среду (дорожка 5). Заметим, что в лизате полоса с подвижностью несколько выше 25 кДа (дорожка 2) может быть связана с тем, что продукт не полностью/совсем не гликозилирован (масса белка без гликозилирования – 27 кДа). В лизате и культуральной среде клеток CHO-K1, трансфицированных контрольной плазмидой pVAX, не обнаружено белков, специфически реагирующих с антителами мышей, иммунизированных SARS-CoV-2 (дорожки 3 и 4).
Рис. 3.
Анализ экспрессии RBD в клетках CHO-K1, трансфицированных pVAX-RBD и pVAX. Дорожка 1 ‒ маркер молекулярных масс белков; 2 и 3 – лизат клеток CHO-K1, трансфицированных pVAX-RBD и pVAX соответственно; 4 и 5 – культуральная среда клеток CHO-K1, трансфицированных pVAX и pVAX-RBD соответственно.

Таким образом, после трансфекции клеточной линии CHO-K1 конструкцией pVAX-RBD ген, кодирующий RBD, экспрессируется как на уровне РНК, так и на уровне белка.
Получение комплексов ДНК с PGS
Оптимальное соотношение масс компонентов для формирования комплексов ДНК‒полимер подбирали на основании результатов анализа степени комплексообразования, полученных нами ранее [15]. Соотношение масс ДНК : PGS для образования комплексов составило 1 : 10. Взаимодействие ДНК с конъюгатом PGS оценивали по смещению электрофоретической подвижности в агарозном геле (рис. 4). Это же соотношение использовано для создания комплекса контрольной плазмиды pVAX с конъюгатом PGS.
pVAX-RBD индуцирует гуморальный иммунный ответ у мышей
Для оценки иммуногенности вакцинных конструкций pVAX-RBD‒PGS и pVAX-RBD мышей иммунизировали трижды в дни 0, 14, 28 и через шесть недель после начала эксперимента у животных брали кровь для анализа (рис. 5а). Полученные сыворотки крови исследовали на наличие RBD-специфичных антител методом ИФА и в реакции нейтрализации SARS-CoV-2. В качестве контроля использовали сыворотку мышей, иммунизированных комплексом pVAX‒PGS.
Рис. 5.
Гуморальный иммунный ответ у мышей на ДНК-конструкции pVAX-RBD‒PGS, pVAX-RBD и pVAX‒PGS. a ‒ Схема иммунизации и забора образцов: вакцинные конструкции вводили мышам трижды с двухнедельным интервалом. Через шесть недель после первой иммунизации у мышей брали кровь и селезенку для анализа. б ‒ Титры RBD-специфичных антител IgG определяли метом ИФА. На графике представлены обратные значения титров (разведения). в ‒ Вируснейтрализующую активность сывороток определяли в реакции нейтрализации SARS-CoV-2 (штамм nCoV/Victoria/1/2020). На графике представлены обратные значения титров. Статистический анализ проводили с использованием программного обеспечения GraphPad Prism 6.0. Данные представлены как среднее значение ± стандартное отклонение (SD). Достоверность рассчитывали с использованием непараметрического метода Манна‒Уитни (n.s. – нет статистической достоверности, *p < 0.01, **p < 0.05).
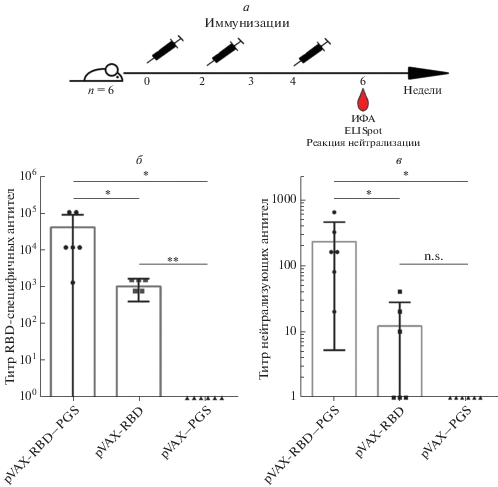
По результатам ИФА через две недели после третьей иммунизации средние титры специфических антител у животных, иммунизированных pVAX-RBD‒PGS, были примерно в 40 раз выше по сравнению с животными, иммунизированными pVAX-RBD (p < 0.01), и в 10 000 раз выше, чем титры в контрольной группе, которой вводили pVAX‒PGS (p < 0.01) (рис. 5б).
Вируснейтрализующую активность полученных сывороток оценивали в реакции нейтрализации in vitro с живым вирусом SARS-CoV-2. Сыворотки мышей, иммунизированных pVAX-RBD‒PGS, нейтрализовали штамм nCoV/Victoria/1/2020 SARS-CoV-2 в разведении 1 : 200, тогда как сыворотки группы, иммунизированной pVAX-RBD, ‒ в разведении 1 : 12 (p < 0.01). Сыворотки контрольных животных не проявили нейтрализующей активности (рис. 5в).
pVAX-RBD индуцирует клеточный иммунный ответ
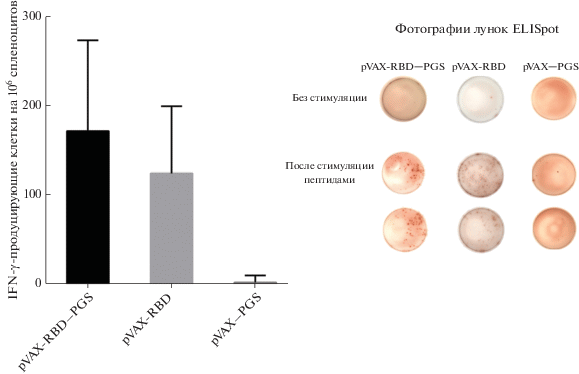
Т-клеточный иммунный ответ оценивали по числу спленоцитов, продуцирующих IFN-γ, используя технологию ELISpot. Спленоциты стимулировали пулом пептидов, входящих в состав белка S.
Показано, что спленоциты, выделенные из селезенок мышей через две недели после третьей иммунизации pVAX-RBD в оболочке PGS и без нее, сильнее отвечали на стимуляцию вирусными пептидами выбросом IFN-γ, чем контрольная группа (p < 0.01) (рис. 6). Из этого можно сделать вывод о развитии у иммунизированных животных RBD-специфичного Т-клеточного ответа. В группе животных, иммунизированной pVAX-RBD‒PGS, содержание Т-лимфоцитов, продуцирующих IFN-γ, было несколько выше, чем в группе, иммунизированной “голой” ДНК ‒ pVAX-RBD, ‒ однако эти различия не были статистически достоверными.
Рис. 6.
Сравнение Т-клеточного ответа у мышей, иммунизированных pVAX-RBD‒PGS, pVAX-RBD или pVAX‒PGS. Число клеток, продуцирующих IFN-γ, определяли методом ELISpot. Различия между группами, иммунизированными вакцинными конструкциями и контрольной плазмидой, были статистически значимыми (p < 0.01), а между группами, иммунизированными pVAX-RBD‒PGS и pVAX-RBD, не были достоверными. Статистический анализ проводили с использованием программного обеспечения GraphPad Prism 6.0. Данные представлены как среднее значение ± SD. Достоверность рассчитывали с использованием непараметрического метода Манна‒Уитни.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ДНК-вакцины ‒ одна из платформ, на основе которой были разработаны и уже дошли до III фазы клинических испытаний кандидатные вакцины против COVID-19. Такие вакцины можно быстро создать, зная нуклеотидную последовательность вирусного генома. Среди преимуществ ДНК-вакцин можно перечислить следующие: антиген экспрессируется в нативной конформации, активация гуморального и клеточного иммунитета, простота изготовления, низкая стоимость, отсутствие требований к особым условиям хранения и безопасность.
К основным недостаткам ДНК-вакцин относится их низкая иммуногенность при внутримышечном введении “голой” плазмидной ДНК [9]. Для повышения эффективности доставки ДНК-вакцин в антигенпрезентирующие клетки часто используют катионные полимеры, белки или липиды, способные компенсировать отрицательный заряд нуклеиновой кислоты и тем самым облегчить ее проникновение через клеточную мембрану антигенпрезентирующих клеток; иногда применяют безыгольные инжекторы и электропораторы [19‒23].
Так, Smith с соавт. [8] иммунизировали мышей ДНК-конструкцией, кодирующей полноразмерный белок S, с помощью электропоратора. Однократное введение дозы, составляющей всего 2.5 мкг, индуцировало гуморальный иммунный ответ (с титром антител 1 : 1 000) и Т-клеточный ответ (1000 IFN-γ-продуцирующих клеток на 106 спленоцитов). Seo c соавт. [24] также сконструировали ДНК, кодирующую S-белок и N-концевую часть тканевого активатора плазминогена в качестве лидерной последовательности. После двукратной иммунизации мышей этой ДНК-конструкцией (50 мкг) с использованием электропорации обнаружили формирование сильного специфического ответа: титры антител составили 1 : 10 000, а число IFN-γ-продуцирующих Т‑лимфоцитов в некоторых случаях достигало 2000 на 106 спленоцитов. Prompetchara c соавт. [25] также исследовали иммуногенные свойства ДНК-конструкций, кодирующих полноразмерный S-белок или два домена: S1 и S2. Иммунизацию проводили трижды с использованием электропоратора, доза ДНК составляла 100 мкг. В результате трехкратного введения каждой из этих конструкций авторы регистрировали специфические антитела (титр 1 : 2000) и высокие показатели Т-клеточного ответа, особенно для ДНК-конструкции, кодирующей полноразмерный S-белок (3000 IFN-γ-продуцирующих клеток на 106 спленоцитов). Группа японских исследователей, Nishikawa с соавт. [26], использовала для подкожного введения мышам кандидатной ДНК-вакцины струйный инжектор Pyro-drive Jet. После трехкратной иммунизации авторы обнаружили формирование высокого уровня специфических антител, титры которых составили 1 : 10 000, в то время как Т-клеточный ответ был ниже, чем для вакцинных конструкций, вводимых с использованием электропоратора (150 IFN-γ-продуцирующих клеток на 106 спленоцитов vs 1000‒3000 для электропоратора) [26]. Резюмируя вышесказанное, заметим, что использование электропорации для введения вакцинных ДНК-конструкций индуцирует у животных развитие как гуморального, так и клеточного иммунного ответа на целевой антиген. К недостаткам электропорации относится болезненность в месте инъекции и потребность в специализированных приборах, которые пока не сертифицированы для вакцинации людей.
В настоящее время несколько компаний разрабатывают ДНК-вакцины против COVID-19. Фирмы “Inovio”, “AnGes” и “Zydus Cadila” приступили к стадии III клинических испытаний своих вакцин (https://www.who.int/publications/m/item/ draft-landscape-of-covid-19-candidate-vaccines), еще восемь находятся на более ранних стадиях клинических испытаний.
Среди 10 ДНК-вакцин, находящихся на стадии клинических испытаний, большинство предлагается вводить с помощью специальных устройств и только в одном случае применяется система доставки с использованием липосом (https://clinicaltrials.gov/ct2/show/NCT04591184). Для этого была специально разработана платформа Fusogenix, состоящая из смеси нейтральных липидов и малых мембранных белков, участвующих в слиянии мембран. Несмотря на то, что токсичность таких липосом сильно снижена, они все же не лишены некоторых серьезных недостатков, связанных как с природой липосом, так и с технологической сложностью транспортировки и хранения препаратов, требующие соблюдения условий холодовой цепи [16, 27].
Нами предложен новый способ доставки ДНК-вакцин, заключающийся в упаковке нуклеиновой кислоты в поликатионный конъюгат полиглюкина со спермидином, названный нами PGS. Этот выбор основан на результатах, полученных нами ранее при исследовании PGS как “упаковки” для доставки в клетки вакцинных конструкций на основе нуклеиновых кислот [14‒16]. PGS включен в кандидатную вакцину против ВИЧ-1 ‒ КомбиВИЧвак, ‒ которая прошла фазу I клинических испытаний на безопасность [14]. PGS-содержащий препарат ДНК можно лиофилизовать (что отличает его от липосомсодержащего препарата) и хранить при 4°С не менее двух лет без потери активности. Важно, что компоненты PGS биоразлагаемы и безопасны для человека; их низкая стоимость, безопасность и возможность лиофилизации с длительным хранением дают дополнительные технологические преимущества при производстве и транспортировке вакцинного препарата.
Известно, что ДНК-вакцины, как правило, индуцируют более эффективно Т-клеточный ответ и менее эффективно В-клеточный, так как синтез и процессинг антигена, который кодирует ДНК-вакцина, происходит внутри клетки, а внутриклеточные белки презентируются связанными с молекулами MHC класса I, что приводит к активации цитотоксических Т-лимфоцитов, активность которых нацелена на устранение зараженных вирусом клеток. Для успешной защиты от SARS-CoV-2 важно, чтобы вакцина индуцировала развитие как клеточного, так и гуморального ответа [28]. Учитывая это, мы предположили, что введение в состав иммуногена лидерной последовательности 176, гибрида сигнальных последовательностей двух активно секретируемых белков, обеспечит эффективную секрецию RBD из клетки и тем самым приведет к усилению гуморального звена иммунного ответа на вводимую ДНК-конструкцию.
Способность разработанной нами вакцинной ДНК-конструкции обеспечивать секрецию целевого белка из эукариотической клетки проанализирована на культуральной жидкости от клеток CHO-K1, трансфицированных pVAX-RBD (рис. 3).
Для получения комплексов ДНК‒PGS плазмиду pVAX-RBD и конъюгат PGS смешивали в массовом соотношении 1 : 10, контролируя комплексообразование с помощью электрофореза в 1%-ном агарозном геле (рис. 4).
При сравнении иммуногенности “голой” плазмиды, pVAX-RBD, и pVAX-RBD в оболочке PGS, pVAX-RBD‒PGS, показано, что последняя эффективнее индуцирует иммунный ответ у животных. По результатам ИФА, в сыворотках животных в группе pVAX-RBD титр RBD-специфичных антител составил 1 : 1000, а в группе pVAX-RBD‒PGS – 1 : 42 000 (рис. 5б, в). ДНК-конструкция pVAX-RBD в оболочке PGS и без нее эффективно индуцировала у животных и клеточный иммунный ответ. По результатам ELISpot спленоциты иммунизированных животных эффективно продуцировали INF-γ в ответ на стимуляцию пулом пептидов из S-белка SARS-CoV-2 (рис. 6).
Таким образом, композицию pVAX-RBD в оболочке конъюгата полиглюкина со спермидином можно рассматривать как перспективную кандидатную ДНК-вакцину против COVID-19 ‒ ее иммунологические характеристики сравнимы с таковыми для вакцинных ДНК-конструкций, испытанных на мышах [8, 24‒26].
Исследование было выполнено при поддержке Министерства науки и высшего образования Российской Федерации (соглашение № 075-15-2019-1665).
Работу с животными проводили согласно “Правилам проведения работ с использованием экспериментальных животных”. Эксперименты были одобрены на заседании биоэтической комиссии ФБУН ГНЦ ВБ “Вектор” Роспотребнадзора (номер протокола ГНЦ ВБ “Вектор”/10-09.2020).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Gao Q., Bao L., Mao H., Wang L., Xu K., Yang M., Li Y., Zhu L., Wang N., Lv Z., Gao H., Ge X., Kan B., Hu Y., Liu J., Cai F., Jiang D., Yin Y., Qin C., Li J., Gong X., Lou X., Shi W., Wu D., Zhang H., Zhu L., Deng W., Li Y., Lu J., Li C., Wang X., Yin W., Zhang Y., Qin C. (2020) Development of an inactivated vaccine candidate for SARS-CoV-2. Science. 369, 77‒81.
Wang H., Zhang Y., Huang B., Deng W., Quan Y., Wang W., Xu W., Zhao Y., Li N., Zhang J., Liang H., Bao L., Xu Y., Ding L., Zhou W., Gao H., Liu J., Niu P., Zhao L., Zhen W., Fu H., Yu S., Zhang Z., Xu G., Li C., Lou Z., Xu M., Qin C., Wu G., Gao G.F., Tan W., Yang X. (2020) Development of an inactivated vaccine candidate, BBIBP-CorV, with potent protection against SARS-CoV-2. Cell. 182, 39‒51.
Keech C., Albert G., Cho I., Robertson A., Reed P., Neal S., Plested J.S., Zhu M., Cloney-Clark S., Zhou H., Smith G., Patel N., Frieman M.B., Haupt R.E., Logue J., McGrath M., Weston S., Piedra P.A., Desai C., Callahan K., Lewis M., Price-Abbott P., Formica N., Shinde V., Fries L., Lickliter J.D., Griffin P., Wilkinson B., Glenn G.M. (2020) Phase 1-2 trial of a SARS-CoV-2 recombinant spike protein nanoparticle vaccine. N. Engl. J. Med. 383, 2320‒2332.
Ravichandran S., Coyle E.M., Klenow L., Tang J., Grubbs G., Liu S., Wang T., Golding H., Khurana S. (2020) Antibody signature induced by SARS-CoV-2 spike protein immunogens in rabbits. Sci. Transl. Med. 12, eabc3539.
Quinlan B.D., He W., Mou H., Zhang L., Guo Y., Chang J., Peng S., Ojha A., Tavora R., Parcells M.S., Luo G., Li W., Zhong G., Choe H., Farzan M. (2020) An engineered receptor-binding domain improves the immunogenicity of multivalent SARS-CoV-2 vaccines. bioRxiv. 2020.11.18.388934. https://doi.org/10.1101/2020.11.18.388934
García-Arriaza J., Garaigorta U., Pérez P., Lázaro-Frías A., Zamora C., Gastaminza P., Del Fresno C., Casasnovas J.M., Sorzano C.Ó.S., Sancho D., Esteban M. (2021) COVID-19 vaccine candidates based on modified vaccinia virus Ankara expressing the SARS-CoV-2 spike induce robust T- and B-cell immune responses and full efficacy in mice. J. Virol. 95(7), e02260-20. https://doi.org/10.1128/JVI.02260-20
Logunov D.Y., Dolzhikova I.V., Zubkova O.V., Tukhvatulin A.I., Shcheblyakov D.V., Dzharullaeva A.S., Grousova D.M., Erokhova A.S., Kovyrshina A.V., Botikov A.G., Izhaeva F.M., Popova O., Ozharovskaya T.A., Esmagambetov I.B., Favorskaya I.A., Zrelkin D.I., Voronina D.V., Shcherbinin D.N., Semikhin A.S., Simakova Y.V., Tokarskaya E.A., Lubenets N.L., Egoro-va D.A., Shmarov M.M., Nikitenko N.A., Morozova L.F., Smolyarchuk E.A., Kryukov E.V., Babira V.F., Borisevich S.V., Naroditsky B.S., Gintsburg A.L. (2020) Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. Lancet. 396, 887‒897.
Smith T.R.F., Patel A., Ramos S., Elwood D., Zhu X., Yan J., Gary E.N., Walker S.N., Schultheis K., Purwar M., Xu Z., Walters J., Bhojnagarwala P., Yang M., Chokkalingam N., Pezzoli P., Parzych E., Reuschel E.L., Doan A., Tursi N., Vasquez M., Choi J., Tello-Ruiz E., Maricic I., Bah M.A., Wu Y., Amante D., Park D.H., Dia Y., Ali A.R., Zaidi F.I., Generotti A., Kim K.Y., Herring T.A., Reeder S., Andrade V.M., Buttigieg K., Zhao G., Wu J.M., Li D., Bao L., Liu J., Deng W., Qin C., Brown A.S., Khoshnejad M., Wang N., Chu J., Wrapp D., McLellan J.S., Muthumani K., Wang B., Carroll M.W., Kim J.J., Boyer J., Kulp D.W., Hu-meau L.M.P.F., Weiner D.B., Broderick K.E. (2020) Immunogenicity of a DNA vaccine candidate for COVID-19. Nat. Commun. 11, 2601.
Yu J., Tostanoski L.H., Peter L., Mercado N.B., McMahan K., Mahrokhian S.H., Nkolola J.P., Liu J., Li Z., Chandrashekar A., Martinez D.R., Loos C., Atyeo C., Fischinger S., Burke J.S., Slein M.D., Chen Y., Zuiani A., Lelis F.J.N., Travers M., Habibi S., Pessaint L., Van Ry A., Blade K., Brown R., Cook A., Finneyfrock B., Dodson A., Teow E., Velasco J., Zahn R., Wegmann F., Bondzie E.A., Dagotto G., Gebre M.S., He X., Jacob-Dolan C., Kirilova M., Kordana N., Lin Z., Maxfield L.F., Nampa-nya F., Nityanandam R., Ventura J.D., Wan H., Cai Y., Chen B., Schmidt A.G., Wesemann D.R., Baric R.S., Alter G., Andersen H., Lewis M.G., Barouch D.H. (2020) DNA vaccine protection against SARS-CoV-2 in rhesus macaques. Science. 369, 806‒811.
Walsh E.E., Frenck R.W. Jr, Falsey A.R., Kitchin N., Absalon J., Gurtman A., Lockhart S., Neuzil K., Mulligan M.J., Bailey R., Swanson K.A., Li P., Koury K., Kalina W., Cooper D., Fontes-Garfias C., Shi P.Y., Türeci Ö., Tompkins K.R., Lyke K.E., Raabe V., Dormitzer P.R., Jansen K.U., Şahin U., Gruber W.C. (2020) Safety and immunogenicity of two RNA-based Covid-19 vaccine candidates. N. Engl. J. Med. 383, 2439‒2450.
Baden L.R., El Sahly H.M., Essink B., Kotloff K., Frey S., Novak R., Diemert D., Spector S.A., Rouphael N., Creech C.B., McGettigan J., Khetan S., Segall N., Solis J., Brosz A., Fierro C., Schwartz H., Neuzil K., Corey L., Gilbert P., Janes H., Follmann D., Marovich M., Mascola J., Polakowski L., Ledgerwood J., Graham B.S., Bennett H., Pajon R., Knightly C., Leav B., Deng W., Zhou H., Han S., Ivarsson M., Miller J., Zaks T. (2021) Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N. Engl. J. Med. 384, 403‒416.
Verdecchia P., Cavallini C., Spanevello A., Angeli F. (2020) The pivotal link between ACE2 deficiency and SARS-CoV-2 infection. Eur. J. Intern. Med. 76, 14‒20.
Karpenko L.I., Lebedev L.R., Bazhan S.I., Korneev D.V., Zaitsev B.B., Ilyichev A.A. (2017) Visualization of CombiHIVvac vaccine particles using electron microscopy. AIDS Res. Hum. Retroviruses. 33, 323‒324.
Карпенко Л.И., Бажан С.И., Богрянцева М.П., Рындюк Н.Н., Гинько З.И., Кузубов В.И., Лебедев Л.Р., Каплина О.Н., Регузова А.Ю., Рыжиков А.Б., Усова С.В., Орешкова С.Ф., Нечаева Е.А., Даниленко Е.Д., Ильичев А.А. (2016) Комбинированная вакцина против ВИЧ-1 на основе искусственных полиэпитопных иммуногенов: результаты I фазы клинических испытаний. Биоорган. химия. 42, 191‒204.
Karpenko L.I., Apartsin E.K., Dudko S.G., Starostina E.V., Kaplina O.N., Antonets D.V., Volosnikova E.A., Zaitsev B.N., Bakulina A.Y., Venyaminova A.G., Ilyichev A.A., Bazhan S.I. (2020) Cationic polymers for the delivery of the Ebola DNA vaccine encoding artificial T-cell immunogen. Vaccines. 8, 718.
Karpenko L.I., Rudometov A.P., Sharabrin S.V., Shcherbakov D.N., Borgoyakova M.B., Bazhan S.I., Volosnikova E.A., Rudometova N.B., Orlova L.A., Pyshnaya I.A., Zaitsev B.N., Volkova N.V., Azaev M.S., Zaykovskaya A.V., Pyankov O.V., Ilyichev A.A. (2020) Delivery of mRNA vaccine against SARS-CoV-2 using a polyglucin:spermidine conjugate. Vaccines. 9, 76.
Reed L.J., Muench H. (1938) A simple method of estimating fifty per cent endpoints. Am. J. Hyg. 27(3), 493–497. https://doi.org/10.1093/oxfordjournals.aje.a118408
Brito L.A., Singh M. (2011) Acceptable levels of endotoxin in vaccine formulations during preclinical research. J. Pharm. Sci. 100, 34‒37.
Milani A., Bolhassani A., Heshmati M. (2017) Delivery of HIV-1 Nef linked to heat shock protein 27 using a cationic polymer is more effective than cationic lipid in mammalian cells. Bratisl. Lek. Listy. 118, 334‒338.
Saljoughian N., Zahedifard F., Doroud D., Doustdari F., Vasei M., Papadopoulou B., Rafati S. (2013) Cationic solid-lipid nanoparticles are as efficient as electroporation in DNA vaccination against visceral leishmaniasis in mice. Parasite Immunol. 35, 397‒408.
Jiang J. (2021) Cell-penetrating peptide-mediated nanovaccine delivery. Curr. Drug Targets. 22(8), 896‒912. https://doi.org/10.2174/1389450122666210203193225
Akhtar N., Singh V., Yusuf M., Khan R.A. (2020) Non-invasive drug delivery technology: development and current status of transdermal drug delivery devices, techniques and biomedical applications. Biomed Tech. 65, 243‒272.
Tebas P., Yang S., Boyer J.D., Reuschel E.L., Patel A., Christensen-Quick A., Andrade V.M., Morrow M.P., Kraynyak K., Agnes J., Purwar M., Sylvester A., Pawlicki J., Gillespie E., Maricic I., Zaidi F.I., Kim K.Y., Dia Y., Frase D., Pezzoli P., Schultheis K., Smith T.R.F., Ramos S.J., McMullan T., Buttigieg K., Carroll M.W., Ervin J., Diehl M.C., Blackwood E., Mammen M.P., Lee J., Dallas M.J., Brown A.S., Shea J.E., Kim J.J., Weiner D.B., Broderick K.E., Humeau L.M. (2021) Safety and immunogenicity of INO-4800 DNA vaccine against SARS-CoV-2: a preliminary report of an open-label, phase 1 clinical trial. EClinicalMedicine. 31, 100689. https://doi.org/10.1016/j.eclinm.2020.100689
Seo Y.B., Suh Y.S., Ryu J.I., Jang H., Oh H., Koo B.S., Seo S.H., Hong J.J., Song M., Kim S.J., Sung Y.C. (2021) Soluble spike DNA vaccine provides long-term protective immunity against SARS-CoV-2 in mice and nonhuman primates. Vaccines. 9, 307.
Prompetchara E., Ketloy C., Tharakhet K., Kaewpang P., Buranapraditkun S., Techawiwattanaboon T., Sathean-Anan-Kun S., Pitakpolrat P., Watcharaplueksadee S., Phumiamorn S., Wijagkanalan W., Patarakul K., Palaga T., Ruxrungtham K. (2021) DNA vaccine candidate encoding SARS-CoV-2 spike proteins elicited potent humoral and Th1 cell-mediated immune responses in mice. PLoS One. 16, e0248007.
Nishikawa T., Chang C.Y., Tai J.A., Hayashi H., Sun J., Torii S., Ono C., Matsuura Y., Ide R., Mineno J., Sasai M., Yamamoto M., Nakagami H., Yamashita K. (2021) Anti-CoVid19 plasmid DNA vaccine induces a potent immune response in rodents by Pyro-drive Jet Injector intradermal inoculation. bioRxiv. https://doi.org/10.1101/2021.01.13.426436
Chang H.I., Yeh M.K. (2012) Clinical development of liposome-based drugs: formulation, characterization, and therapeutic efficacy. Int. J. Nanomedicine. 7, 49‒60.
Lagunas-Rangel F.A, Chávez-Valencia V. (2021) What do we know about the antibody responses to SARS-CoV-2? Immunobiology. 226, 152054.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология



