Молекулярная биология, 2021, T. 55, № 6, стр. 982-986
Белковый транс-сплайсинг рекомбинантного стрептавидина на магнетосомах, опосредованный интеином
S. B. Duan a, b, S. S. Wei a, b, H. M. Wang a, b, S. H. Ding a, b, Y. Z. Chen a, b, J. J. Tian a, b, Y. J. Wang a, W. Chen c, J. Chen c, *, Q. L. Meng a, **
a Suzhou Institute of Biomedical Engineering and Technology
215163 Suzhou, China
b Jihua Laboratory
315200 Foshan, China
c Suzhou Blood Center
215006 Suzhou, China
* E-mail: 108065767@qq.com
** E-mail: 69161018@qq.com
Поступила в редакцию 18.11.2020
После доработки 22.02.2021
Принята к публикации 12.03.2021
Аннотация
Большую проблему при экспрессии рекомбинатного стрептавидина на магнетосомах (называемых бактериальными магнитными наночастицами, или BMP) представляет присутствие эндогенного биотина. Мы соединили мономерный фрагмент стрептавидина (SA1-116) с N-концом интеина и получили предшественник SA1-116-IN, который экспрессировали в клетках Escherichia coli (BL21). Параллельно фрагмент SA117-160 сшивали с С-концом интеина, после чего полученный химерный полипептид экспрессировали на магнетосомах за счет соединения с мембранным белком магнетосом MamF. Далее в системе in vitro белкового сплайсинга смешивали очищенные сконструированные магнетосомы (BMP-SA117-160-IC) и предшественник SA1-116-IN. Наконец, для получения функциональных магнитных частиц BMP-SA индуцировали опосредованный интеином транс-сплайсинг. Наши результаты указывают на возможность использования транс-сплайсинга, опосредованного интеином, для эффективного получения рекомбинантного стрептавидина на магнетосомах, а также показывают возможности этого метода для получения других функциональных магнитных наночастиц.
ВВЕДЕНИЕ
Магнетосомы (называемые также бактериальными магнитными наночастицами, или BMP) – это окруженные мембраной однодоменные магнитные нанокристаллы, синтезируемые магнитотактическими бактериями. ВМР обладают высокой чувствительностью к магнитному полю, имеют небольшие размеры и видоспецифичную морфологию кристаллов [1, 2]. В состав мембраны ВМР входят специальные трансмембранные белки. Показано, что на мембранах ВМР наиболее представлены два белка – MamC и MamF [3]. Таким образом, генетическая инженерия MamC или MamF может использоваться для экспрессии чужеродных функциональных белков на поверхности ВМР [4]. Сделаны попытки получить различные функционализированные BMP, например, за счет дисплея на BMP функциональных компонентов, таких как ферменты, антитела, функциональные пептиды, рецепторные белки, частицы золота или олигонуклеотиды [5–8]. Значительное внимание в последнее время уделяется технологиям магнитной сепарации и иммуномагнитного анализа с использованием BMP [9, 10]. BMP сходны с коммерческими микро- и нано-иммуномагнитными частицами с двухфазной (ядро–оболочка) структурой, однако обладают, как правило, большим магнетизмом, поскольку их ядра состоят из однодоменных магнитных кристаллов и содержат больше магнетита. Над BMP легко производить манипуляции, так как они обладают сильным магнетизмом и небольшими размерами [11–13].
Стрептавидин (SA) – гомотетрамерный белок из Streptomyces avidinii, проявляет крайне высокую специфичность к молекулам биотина. За счет сильного, стабильного, нековалентного связывания стрептавидина и биотина иммунохимические методы анализа с использованием этой системы характеризуются наибольшей чувствительностью и позволяют обнаружить даже незначительные количества анализируемого вещества в биологических образцах [14]. Например, магнитные частицы, связанные со стрептавидином, часто используют в качестве твердой фазы в иммунохимии и в производстве диагностических препаратов [15]. Ранее мы получили рекомбинантный штамм магнитотактических бактерий для продукции ВМР, связанных с мономерным стрептавидином. Однако присутствие эндогенного биотина в магнитотактических бактериях может приводить к образованию комплексов стрептавидин-биотин, что затрудняет получение чистых функциональных BMP-SA.
Белковый сплайсинг – это посттрансляционное ремоделирование белков, катализируемое интеином. Разделенный интеин обладает способностью вырезать свои части из белков-предшественников и сшивать фланкирующие полипептиды (экстеины) для получения зрелого белка и стабильного интеина. В настоящем исследовании для сшивания фрагментов SA1-116 и SA117-160 использовали разделенный интеин, состоящий из N-концевого фрагмента (IN) и С-концевого фрагмента (IC). SA117-160-IC далее экспрессировали на BMP за счет объединения с белком MamF в рекомбинантном штамме магнитотактических бактерий. Наконец, очищенные предшественники BMP-SA117-160-IC и SA1-116-IN используют в in vitro белковом транс-сплайсинге, опосредованном интеином, для получения функциональных BMP-SA.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Бактериальные штаммы и плазмиды. Штаммы бактерий, мутанты, плазмиды и праймеры, использованные в работе, перечислены в табл. 1. Культуры Escherichia coli растили при 37°C в среде Luria–Bertani (LB). Культуры Magnetospirillum gryphiswaldense (MSR-1) растили при 30°C в среде LAY, как описано ранее [16].
Таблица 1.
Штаммы и плазмиды
| Название | Описание | Источник |
|---|---|---|
| Штаммы | ||
| MSR-1/∆F | M. gryphiswaldense MSR-1 с удаленным mamF | [10] |
| MSR-1/∆F-SA117-160-IC | MSR-1 с удаленным mamF, содержащий pBBR-mamF-SA117-160-IC; Kmr, Gmr | Данная работа |
| E. coli S17-1 | Pro thi hsdR recA, хромосомная интеграция RP4-2-Tc::Mu-Km::Tn7, SmrTra+ | [10] |
| BL21-SA1-116-IN | E. coli BL21, содержащий pET28a-SA1-116-IN | Данная работа |
| Плазмиды | ||
| pET28a-SA1-116-IN | pET28a вектор с фрагментом SA1-116-IN; Kmr1 | Данная работа |
| pBBR-mamF-SA117-160-IC | pBBR1MCS-2 вектор с фрагментом mamF-SA117-160-IC; Kmr1 | Данная работа |
Конструирование рекомбинантных плазмид. Кодирующая последовательность SA1-116-IN получена путем сшивания последовательностей SA1-116 и IN1-104 из Ssp DnaX с последующим клонированием в вектор экспрессии pET28a-SA1-116-IN. Конструкция SA117-160-IC-MamF получена путем объединения последовательностей SA117-160, IC105-163 и гена mamF с последующим клонированием в вектор pBBR для получения плазмиды pBBR-mamF-SA117-160-IC. Экспрессионную плазмиду pET28a-SA1-116-IN использовали для трансформации компетентных клеток E. coli BL21 с целью получения штамма BL21-SA1-116-IN. Рекомбинантной плазмидой pBBR-mamF-SA117-160-IC трансформировали клетки E. coli S17-1, а затем переносили ее в штамм MSR-1/∆F посредством конъюгации. Мутантные штаммы MSR-1/∆F-SA117-160-IC отбирали согласно [16].
Экспрессия и очистка SA1-116-IN. Колонию штамма BL21-SA1-116-IN выращивали в жидкой среде LB в присутствии 25 мкг/мл канамицина при 37°C. При достижении оптической плотности (OD600), равной 0.4–0.6, добавляли 1 мМ ИПТГ и культивировали клетки при 37°C в течение 3–6 ч для индукции синтеза рекомбинантного белка. Культуру центрифугировали при 5000 g в течение 20 мин, затем помещали в лизирующий буфер (50 мМ Трис-HCl, 1 ммоль/л EDТА, 100 ммоль/л NaCl и 1 мг/мл лизоцима, pH 8.0) и обрабатывали ультразвуком. Далее после центрифугирования (12 000 g, 30 мин, 4°C) раствор фильтровали через 0.45 мкм фильтр и наносили на колонку с Ni-NTA. Белок SA1-116-IN элюировали 100 мМ имидазолом и анализировали электрофорезом в 12%-ном полиакриламидном геле (SDS-PAGE).
Экспрессия и очистка BMP-SA117-160-IC. Клетки штамма MSR-1/∆F-SA117-160-IC пересевали 3 раза, а затем нарабатывали в ферментере объемом 10 л. Условия культивирования и среду подбирали ранее [17, 18]. Клетки MSR-1/∆F-SA117-160-IC собирали, помещали в PBS (10 мМ, pH 7.4; 20 мл/г осадка бактерий) и обрабатывали ультразвуком. Частицы BMP-SA117-160-IC выделяли с помощью магнитного штатива, ресуспендировали в PBS и снова озвучивали в течение нескольких подходов. Очищенные BMP-SA117-160-IC помещали в стерильный 25%-ный раствор глицерина и хранили при 4°C.
Белковый транс-сплайсинг, опосредованный интеином. Для проведения in vitro транс-сплайсинга 20 мкМ SA1-116-IN смешивали с 0.5 мг BMP-SA117-160-IC в буфере для сплайсинга (20 мМ Трис-HCl, 0.15 М NaCl, pH 7.9). Далее добавляли DTT в концентрации 1 мМ и инкубировали при комнатной температуре в течение ночи на шейкере. Реакцию останавливали, выделяя BMP с помощью магнита. Продукты сплайсинга анализировали с помощью SDS-PAGE и визуализировали, окрашивая Coomassie Brilliant Blue R-250. Активность BMP-SA проверяли по взаимодействию с биотинилированной ДНК с последующим электрофорезом в агарозном геле.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
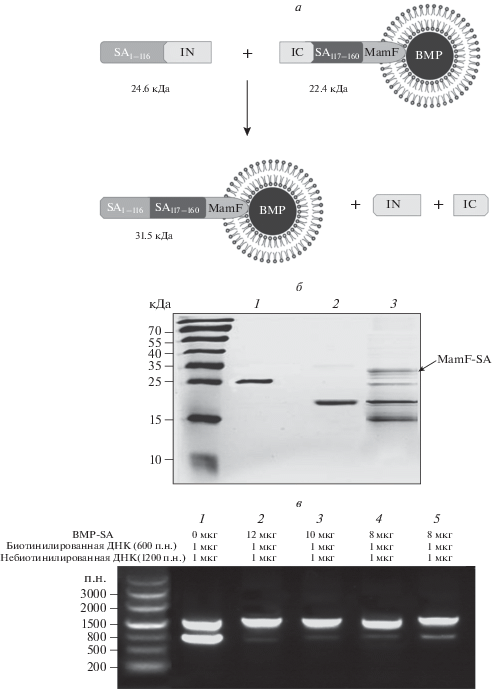
Продукт гена Ssp DnaX – это интеин, обнаруженный в предшественнике ДНК-хеликазы Synechocystis sp. штамм PCC6803 [19, 20]. Мини-интеин получен путем сшивания N- и С-концевых последовательностей интеина Ssp DnaX. На рис. 1а показано, что интеин фланкирован предшественником SA1-116 в качестве N-экстеина и SA117-160 в качестве С-экстеина. В данном исследовании последовательность SA1-116-IN получена путем сшивания SA1-116 и IN1-104 из Ssp DnaX. Клетки E. coli BL21 трансформировали плазмидой pET28a-SA1-116-IN для получения белка SA1-116-IN после индукции синтеза с помощью ИПТГ. Очищенный белок анализировали с помощью электрофореза (рис. 1б). Конструкция SA117-160-IC-MamF получена путем объединения последовательностей SA117-160 IC105-163 из Ssp DnaX и гена mamF. Далее SA117-160-IC-mamF клонировали в вектор pBBR для получения pBBR-mamF-SA117-160-IC. Этой плазмидой трансфицировали MSR-1/∆F с помощью конъюгации, а затем отбирали клоны MSR-1/ ∆F-SA117-160-IC. Частицы BMP-SA117-160-IC выделяли и очищали из культуры клеток MSR-1/∆F-SA117-160-IC. Мембранный белок MamF-SA117-160-IC анализировали с помощью электрофореза (рис. 1б). Очищенные SA1-116-IN и BMP-SA117-160-IC смешивали в буфере для сплайсинга и индуцировали перенос экстеина SA1-116 (N-экстеин) на N-конец SA117-160 (C‑экстеин), получая таким образом BMP-SA. Продукты сплайсинга, включая белок MamF-SA, анализировали с помощью электрофореза. Эффективность реакции составляла примерно 20% (рис. 1б). Активность BMP-SA оценивали, добавляя разное количество этих частиц к биотинилированной ДНК (1 мкг). По данным электрофореза в агарозном геле (рис. 1в) 10 мкг частиц BMP-SA связывали как минимум 1 мкг биотинилированной ДНК (600 п.н.). Не обнаружили связывания небиотинилированной ДНК (1 мкг, 1200 п.н.), использованной в качестве контроля, с частицами BMP-SA (рис. 1в).
Рис. 1.
а – Схематичное изображение белкового транс-сплайсинга, опосредованного интеином. б – Анализ с помощью SDS-PAGE белков SA1-116-IN (1), MamF-SA117-160-IC (2) и сплайсированных белков (3, MamF-SA соответствует размеру 31.5 кДа). в – Анализ взаимодействия между BMP-SA и биотинилированной ДНК с помощью электрофореза в агарозном геле. На первой дорожке в качестве контроля к смеси биотинилированной (600 п.н.) и небиотинилированной (1200 п.н.) ДНК не добавляли BMP-SA. На дорожках 2–5 титровали концентрацию BMP-SA в смеси ДНК и обнаруживали связывание с биотинилированной ДНК (600 п.н.).
Уникальной особенностью BMP является возможность экспрессировать на их поверхности функциональные белки с помощью генетической инженерии. В ряде исследований получены частицы с функциональными белками, такими как белок А, наноантитела, ферменты. Благодаря большому количеству активных молекул на поверхности функционализированных BMP, комплексы BMP-белок удобны для магнитной сепарации и иммуномагнитного анализа. При этом сложность экспрессии белков в магнитотактических бактериях делает невозможной экспрессию некоторых активных факторов на поверхности BMP. Так, присутствие эндогенного биотина в магнитотактических бактериях может повлиять на активность BMP-SA за счет блокирования активных сайтов стрептавидина. Таким образом, нами описана новая стратегия встраивания определенных пептидов в мембранный белок BMP с помощью белкового сплайсинга, опосредованного интеином. BMP представляют собой биогенные магнитные экологичные наноматериалы. Интеиновый транс-сплайсинг используется для сплайсинга и лигирования белков в различных областях, включая сшивку, мечение, очистку и перевод в растворимую форму. Нами показано, что предложенный подход удобен для получения функционализированных частиц BMP.
Работа поддержана Фондом естественных наук провинции Цзянсу (грант № BK20180224), Программой науки и образования Департамента Здравоохранения Сучжоу (KJXW2017056), Исследовательским фондом лаборатории Джихуа (грант № X190171TD190) и Проектом развития научного оборудования Китайской академии наук (грант № YJKYYQ20200037).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Uebe R., Schuler D. (2016) Magnetosome biogenesis in magnetotactic bacteria. Nat. Rev. Microbiol. 14, 621–637.
Bazylinski D.A., Frankel R.B. (2004) Magnetosome formation in prokaryotes. Nat. Rev. Microbiol. 2, 217–230.
Grunberg K., Muller E.C., Otto A., Reszka R., Linder D., Kube M., Reinhardt R., Schuler D. (2004) Biochemical and proteomic analysis of the magnetosome membrane in Magnetospirillum gryphiswaldense. Appl. Environ. Microbiol. 70, 1040–1050.
Greene S.E., Komeili A. (2012) Biogenesis and subcellular organization of the magnetosome organelles of magnetotactic bacteria. Curr. Opin. Cell Biol. 24, 490–495.
Yan L., Da H., Zhang S., Lopez V.M., Wang W. (2017) Bacterial magnetosome and its potential application. Microbiol Res. 203, 19–28.
Xu J., Liu L., He J., Ma S., Li S., Wang Z., Xu T., Jiang W., Wen Y., Li Y., Tian J., Li F. (2019) Engineered magnetosomes fused to functional molecule (protein A) provide a highly effective alternative to commercial immunomagnetic beads. J. Nanobiotechnology. 17, 37.
Pollithy A., Romer T., Lang C., Muller F.D., Helma J., Leonhardt H., Rothbauer U., Schuler D. (2011) Magnetosome expression of functional camelid antibody fragments (nanobodies) in Magnetospirillum gryphiswaldense. Appl. Environ. Microbiol. 77, 6165–6171.
Wu W., Wu Z., Yu T., Jiang C., Kim W.S. (2015) Recent progress on magnetic iron oxide nanoparticles: synthesis, surface functional strategies and biomedical applications. Sci. Technol. Adv. Mater. 16, 023501.
Li A., Zhang H., Zhang X., Wang Q., Tian J., Li Y., Li J. (2010) Rapid separation and immunoassay for low levels of Salmonella in foods using magnetosome-antibody complex and real-time fluorescence quantitative PCR. J. Sep. Sci. 33, 3437–3443.
Xu J., Hu J., Liu L., Li L., Wang X., Zhang H., Jiang W., Tian J., Li Y., Li J. (2014) Surface expression of protein A on magnetosomes and capture of pathogenic bacteria by magnetosome/antibody complexes. Front. Microbiol. 5, 136.
Ali I., Peng C., Khan Z.M., Naz I. (2017) Yield cultivation of magnetotactic bacteria and magnetosomes: a review. J. Basic Microbiol. 57, 643–652.
Tanaka T., Matsunaga T. (2000) Fully automated chemiluminescence immunoassay of insulin using antibody-protein A-bacterial magnetic particle complexes. Anal. Chem. 72, 3518–3522.
Jacob J.J., Suthindhiran K. (2016) Magnetotactic bacteria and magnetosomes – Scope and challenges. Mater. Sci. Eng. C Mater. Biol. Appl. 68, 919–928.
Lim K.H., Huang H., Pralle A., Park S. (2013) Stable, high-affinity streptavidin monomer for protein labeling and monovalent biotin detection. Biotechnol. Bioeng. 110, 57–67.
Dundas C.M., Demonte D., Park S. (2013) Streptavidin-biotin technology: improvements and innovations in chemical and biological applications. Appl. Microbiol. Biotechnol. 97, 9343–9353.
Liu J., Ding Y., Jiang W., Tian J., Li Y., Li J. (2008) A mutation upstream of an ATPase gene significantly increases magnetosome production in Magnetospirillum gryphiswaldense. Appl. Microbiol. Biotechnol. 81, 551–558.
Zhang Y., Zhang X., Jiang W., Li Y., Li J. (2011) Semicontinuous culture of Magnetospirillum gryphiswaldense MSR-1 cells in an autofermentor by nutrient-balanced and isosmotic feeding strategies. Appl. Environ. Microbiol. 77, 5851–5856.
Yang C., Takeyama H., Matsunaga T. (2001) Iron feeding optimization and plasmid stability in production of recombinant bacterial magnetic particles by Magnetospirillum magneticum AMB-1 in fed-batch culture. J. Biosci. Bioeng. 91, 213–216.
Liu X.Q., Hu Z. (1997) Identification and characterization of a cyanobacterial DnaX intein. FEBS Lett. 408, 311–314.
Zhang X., Liu X.Q., Meng Q. (2019) Engineered Ssp DnaX inteins for protein splicing with flanking proline residues. Saudi J. Biol. Sci. 26, 854–859.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


