Молекулярная биология, 2021, T. 55, № 6, стр. 999-1010
Упаковка молекул ДНК субхромосомного размера в хроматиновых тельцах макронуклеусов инфузорий
О. Г. Леонова a, А. А. Потехин b, c, И. В. Некрасова b, Б. П. Караджян d, Б. В. Сёмин e, В. С. Прасолов a, В. И. Попенко a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Санкт-Петербургский государственный университет, биологический факультет, кафедра микробиологии
199034 Санкт-Петербург, Россия
c Зоологический институт Российской академии наук
199034 Санкт-Петербург, Россия
d Институт цитологии Российской академии наук
194064 Санкт-Петербург, Россия
e Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения Российской Федерации
119435 Москва, Россия
* E-mail: popenko@eimb.ru
Поступила в редакцию 31.03.2021
После доработки 11.05.2021
Принята к публикации 12.05.2021
Аннотация
Принципиальное отличие соматических ядер (макронуклеусов) инфузорий от клеточных ядер высших эукариот состоит в том, что геном макронуклеуса представлен огромным числом (до десятков и сотен тысяч) минихромосом генного (0.5–25 т.п.н.) или субхромосомного (до 2000 т.п.н.) размера. Методом электронной микроскопии показано, что на стадии интерфазы хроматин макронуклеусов обычно имеет вид хроматиновых телец, или тяжей, толщиной 200–300 нм. Однако открытым остается вопрос о количестве молекул ДНК в индивидуальных хроматиновых тельцах. Нами изучена организация хроматина в макронуклеусах инфузории Didinium nasutum и трех видов Paramecium sp, отличающихся по пульс-электрофоретическому кариотипу, а также соответствие организации хроматина соматических ядер модели топологически ассоциированных доменов в ядрах высших эукариот. С помощью пульс-электрофореза показано, что размеры ДНК макронуклеуса изученных видов лежат в диапазоне 50–1700 т.п.н., однако основная часть молекул имеет длину менее 500 т.п.н. Сравнительный количественный анализ данных пульс-электрофореза и электронной микроскопии показал, что на стадии логарифмического роста культуры хроматиновые тельца P. multimicronucleatum содержат по одной минихромосоме, в то время как тельца в макронуклеусе D. nasutum – две и более молекул ДНК. Однако при снижении активности макронуклеусов при голодании хроматиновые тельца агрегируют, что приводит к увеличению их размера и/или формированию 200–300 нм фибрилл, состоящих из нескольких хроматиновых телец. Предложена модель формирования таких структур. Показано, что по топологическим характеристикам хроматиновые тельца в макронуклеусах инфузорий с субхромосомным размером ДНК соответствуют топологически-ассоциированным доменам высших эукариот.
ВВЕДЕНИЕ
Архитектура клеточного ядра и пространственная организация структур хроматина в ядре являются важными факторами, определяющими функционирование клеточного генома [1, 2]. Более того, осознание важности пространственной организации хроматина в ядре для обеспечения активации-репрессии больших групп генов и ее связи с возникновением различных заболеваний привело к появлению нового направления – 3D геномики [3].
Вопрос о компактизации ДНК в хромосомах и в структурах интерфазного хроматина изучают на протяжении многих лет. Ранние биохимические и электронно-микроскопические исследования выявили в структуре хроматина петли размером ~ 100 т.п.н. (обзор [4]). Изучены последовательности ДНК, лежащих в основании таких петель, которые получили название SAR/MAR (Scaffold/ Matrix Attached Regions), поскольку предполагалось, что они связаны с белками скаффолда, или ядерного матрикса [5–7]. Предложен ряд моделей компактизации ДНК в метафазных хромосомах, среди которых можно выделить радиально-петельную модель, привлекательную простотой интерпретации [8], модель иерархии спиралей [9], а также модель дискретных уровней организации хроматина [10, 11]. Последняя модель предполагала существование нескольких уровней компактизации хроматина в ядре (нуклеосомы–нуклеосомные фибриллы–нуклеомеры–20–30 нм фибриллы–хромомеры–хромонемы–хромосома) и хорошо согласовывалась с рядом биохимических и электронно-микроскопических данных [10, 11].
Однако за последние 10–15 лет получены данные, которые поставили под сомнение существование ядерного матрикса как интактной структуры в клеточном ядре [12]. Кроме того, методами криоэлектронной микроскопии не обнаружено наднуклеосомных уровней организации хроматина ни в интерфазных клетках высших эукариот, ни в метафазных хромосомах [13, 14]. Предполагается, что наднуклеосомные структуры, визуализированные на электронно-микроскопических препаратах, являются артефактами фиксации, в частности, в присутствии ионов двухвалентных металлов [14]. Развитие молекулярных методов исследования организации ядра (Hi-C) позволило получить карты распределения контактов между разными участками геномной ДНК в ядрах различных эукариотических клеток, фиксированных формальдегидом [15, 16 ] . Полученные данные позволили предложить новую концепцию организации хроматина в ядрах высших эукариот, согласно которой нуклеосомные фибриллы хроматина сами формируют пространственную конфигурацию хроматина в ядре за счет взаимодействия разных участков самой нуклеосомной фибриллы, энтропийных сил, краудинга и других слабых взаимодействий [17, 18]. Формируемые при этом топологически-ассоциированные домены (ТАДы) содержат в основном неактивный хроматин. Согласно этой модели транскрипция происходит либо на развернутых участках хроматина в интерТАДах, либо на поверхности ТАДов. ТАДы обнаружены у млекопитающих, насекомых и птиц, но отсутствуют у бактерий [18].
Инфузории – уникальные биологические объекты, которые обладают истинным ядерным дуализмом. Каждая клетка инфузорий содержит ядра двух типов: генеративные, транскрипционно-неактивные микронуклеусы и (обычно одно) крупное соматическое ядро – макронуклеус, обеспечивающее функционирование клетки на протяжении вегетативного цикла. Макронуклеус формируется в результате полового процесса. После слияния двух пронуклеусов в зачатке макронуклеуса происходят сложные биохимические процессы, включающие амплификацию ДНК, рестрикцию, элиминацию части хроматина и достраивание теломерных последовательностей на фрагментированных отрезках ДНК. В результате геном макронуклеуса представлен большим (от нескольких сотен до нескольких тысяч) набором минихромосом (см. обзоры [19–21]). Всех инфузорий можно грубо подразделить на две большие группы: виды с “генным” размером молекул ДНК макронуклеуса (обычно от 0.5 до 25 т.п.н.) и виды с “субхромосомными” молекулами ДНК макронуклеуса, размер которых составляет от нескольких десятков до нескольких сотен т.п.н. [21]. Типичной формой организации хроматина в интерфазных макронуклеусах инфузорий с субхромосомным размером ДНК являются хроматиновые тельца размером ~ 0.1–0.2 мкм [20].
Электронно-микроскопические данные, полученные при изучении декомпактизации хроматиновых телец в гипотонических растворах, показали, что нуклеосомные фибриллы организованы в них по радиально-петельному принципу [22–24] и могут рассматриваться как аналоги хромомеров в хромосомах высших эукариот [25]. Однако в настоящее время нет точных данных о том, сколько молекул ДНК находится в каждом хроматиновом тельце. Цель настоящей работы состояла в том, чтобы, используя данные пульс-электрофореза и электронной микроскопии, определить, как организованы молекулы ДНК в хроматиновых тельцах макронуклеусов с “субхромосомной” организацией генома, и выяснить, в какой мере организация хроматина соматических ядер соответствует модели ТАДов в ядрах высших эукариот.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Культуры клеток. Инфузории Paramecium multimicronucleatum, P. tetraurelia и P. quadecaurelia получены из коллекции культур инфузорий RC CCM Ресурсного Центра “Культивирование микроорганизмов” СПбГУ. Инфузорий культивировали по стандартным методикам [26] на салатной среде, инокулированной бактериями Klebsiella aerogenes.
Инфузории Didinium nasutum (“Sciento”, Великобритания) выращивали при комнатной температуре в кипяченой водопроводной воде. В качестве корма использовали P. caudatum, культивируемые отдельно. Чтобы добиться снижения активности соматического ядра, клетки пересаживали в среду без корма, препараты готовили через 36–48 ч после исчезновения остатков пищи внутри инфузорий.
Пульс-электрофорез проводили согласно [27, 28]. Для выделения ДНК культуры инфузорий отмывали от питательной среды и оставляли голодать до исчезновения содержимого из пищеварительных вакуолей. Клетки (104–105) осаждали центрифугированием при 500 g в течение 5 мин, концентрируя в объеме 0.3–0.5 мл. Суспензию клеток смешивали в соотношении 1 : 1 с нагретой до 50оС 1.5%-ной агарозой SeaKem (“FMC Corp.”, США), приготовленной на 0.125 M EDТА, pH 8.0, и формировали агарозные блоки, как описано в [28]. Блоки помещали в лизирующий буфер (0.5 M EDTA, pH 9.5; 10% лаурилсаркозината натрия; 100 мг/мл протеиназы K (“Sigma Chem. Co.”, США)) и инкубировали в течение 48 ч при 55°C. Полученные блоки хранили в лизирующем буфере при 4°C. В качестве маркеров использовали конкатемеры ДНК фага λ (“New England BioLabs”, США), хромосомы дрожжей Saccharomyces cerevisiae штамм 15V-P4 [29] и хромосомы S. cerevisiae (CHEF DNA Size Marker #170-3605; “Bio-Rad Laboratories”, Германия).
Для проведения ПЭФ использовали прибор авторской конструкции [27] с углом переориентации двух электрических полей 120°. Гели толщиной 4 мм из 1%-ной SeaKem агарозы (“FMC Corp.”) готовили на 0.5× TBE-буфере (45 мМ Tрис, 45 мМ борная кислота, 2 мМ EDТА, рН 8.0). Электрофорез проводили в том же буфере при температуре 14–16°C. Режимы пульсации и длительность периода каждого времени пульса выбирали в соответствии с данными [27, 28]. Затем гели окрашивали в растворе бромистого этидия (0.5 мкг/мл). Для количественной обработки использовали две–пять электрофореграмм, полученных в разных режимах.
Электронная микроскопия. Интерфазные клетки на стадии логарифмического роста культуры фиксировали в растворе 2.5%-ного глутаральдегида на 0.1 M фосфатном буфере pH 7.3 в течение 1 ч при комнатной температуре, дегидратировали в серии спиртов возрастающей концентрации и заключали в смесь эпон-аралдита по стандартной методике. Срезы толщиной 50–70 нм получали на ультратоме LKB III (“LKB”, Швеция) и контрастировали уранилацетатом и цитратом свинца по стандартной методике. Препараты просматривали в электронном микроскопе JEM-100CX (“JEOL”, Япония), находящемся в ЦКП “Коллекция UNIQEM” ФИЦ Биотехнологии РАН при ускоряющем напряжении 80 кВ. Калибровку увеличения проводили с помощью частиц латекса диаметром 109 ± 3 нм (“Serva”, Германия) или дифракционной решетки 2160 линий/мм. Негативы (увеличение ×10 000) сканировали с конечным разрешением 480 пикселей на 1 мкм среза. Для определения диаметра телец измеряли площадь S каждого отдельного тельца с помощью программы ImageJ (http://rsbweb.nih.gov/ij) и рассчитывали его диаметр (Dхт) как Dхт =(4S/π)1/2.
Построение гистограмм распределения молекул ДНК по длинам. ПЭФ гель фотографировали на изопанхроматическую пленку “Микрат-300”. Пленку проявляли в стандартном проявителе СТ1. Оптическую плотность (OD) измеряли с помощью сканера Epson Perfection Photo 3200, откалиброванного с помощью спектрофотометра Cary 100SCAN (“Varian”, США), в режиме без программной коррекции (“no ICM mode”).
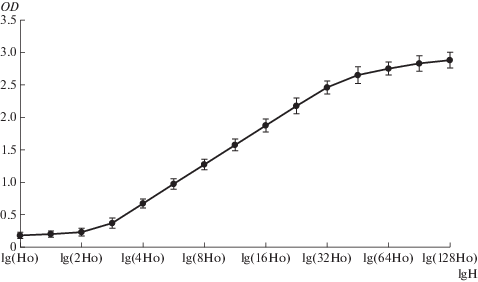
Характеристическая кривая фотопленки “Микрат 300” имела типичную для негативных пленок S-образную форму с ODвуали = 0.15–0.18 (рис. 1). Максимальное значение OD составило 2.8–3.0. Для количественной оцифровки использовали микрофотографии не перегруженных гелей с OD = 0.3–2.3, находящейся на линейном участке характеристической кривой, где зависимость OD от логарифма световой экспозиции (т.е. количества освещения, лк/с) H описывается уравнением OD = γlgH + b, где b – постоянная величина, характеризующая свойства фотопленки и условия проявления, γ – коэффициент контраста. Экспозиция Н есть сумма Нфон (фоновой экспозиции от геля) и HДНК – экспозиции от ДНК. При этом HДНК = NLα, где L – длина молекул ДНК (т.п.н.), α – экспозиция от 1 т.п.н. ДНК, N – количество молекул длиной L. Следовательно, значение фоновой OD геля вне дорожек равно:
Рис. 1.
Характеристическая кривая фотопленки “Микрат-300”, проявленной до коэффициента контраста γ = 2. По оси абсцисс – логарифм освещенности H (лк×с), по оси ординат – оптическая плотность пленки. Ho – произвольно выбранная для измерений точка начала отсчета освещенности. Коэффициент контраста γ равен тангенсу угла наклона прямолинейного участка характеристической кривой.
а на дорожках с ДНК
(2)
$\begin{gathered} OD = {\text{ }}\gamma \lg ({{{\text{Н}}}_{{{\text{фон}}}}} + {{{\text{H}}}_{{{\text{ДНК}}}}}) + b = \\ = \,\,\gamma \lg ({{{\text{Н}}}_{{{\text{фон\;}}}}} + NL\alpha ) + b. \\ \end{gathered} $Из формул (1) и (2) следует, что N = = $\frac{{{{{\text{Н}}}_{{{\text{фон}}}}}}}{{L{{\alpha }}}}\left( {{{{10}}^{{\frac{{OD{\text{ - }}O{{D}_{{{\text{фон}}}}}}}{{{\gamma }}}}}} - 1} \right).$ Отсюда относительное (нормированное) распределение молекул ДНК по длинам определяется по формуле
Размер молекул ДНК, содержащихся в одном хроматиновом тельце, оценивали, аппроксимируя хроматиновые тельца и нуклеосомы сферами соответствующего размера. Тогда длина ДНК в одном хроматиновом тельце Lхт будет равна:
или
Учитывая, что нуклеосомы плотно упакованы в хроматиновых тельцах [32], использовали коэффициент упаковки k = 0.74 (из хорошо известной математической задачи “о плотной упаковке апельсинов в бочке” [33]).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследования проводили на инфузориях D. nasutum, P. tetraurelia, P. quadecaurelia, и P. multimicronucleatum. Результаты ПЭФ ДНК исследованных видов инфузорий приведены на рис. 2, а распределение OD вдоль дорожек – на рис. 3a, в, д, ж. Как показано ранее на инфузориях Paramecium [27], распределение блоков, полос и/или участков различной плотности в спектре отражает частоту и распределение сайтов фрагментации хромосом микронуклеуса при формировании нового макронуклеуса и является характерной особенностью каждого конкретного вида парамеций.
Рис. 2.
Результаты пульс-электрофоретического разделения ДНК Paramecium multimicronucleatum, P. tetraurelia, P. quadecaurelia, Didinium nasutum.
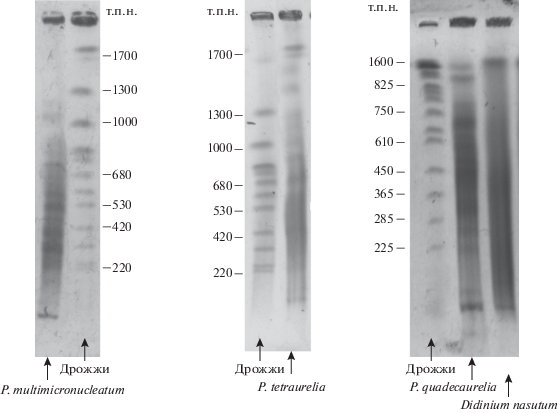
Рис. 3.
Обработка результатов пульс-электрофореза ДНК. Распределение величин OD вдоль дорожек гелей (а, в, д, ж) и нормированное распределение молекул ДНК макронуклеусов (N/Nmax) по размерам (б, г, е, з) P. multimicronucleatum (а, б), P. tetraurelia (в, г), P. quadecaurelia (д, е), D. nasutum (ж, з). По оси абсцисс – размер ДНК в т.п.н.
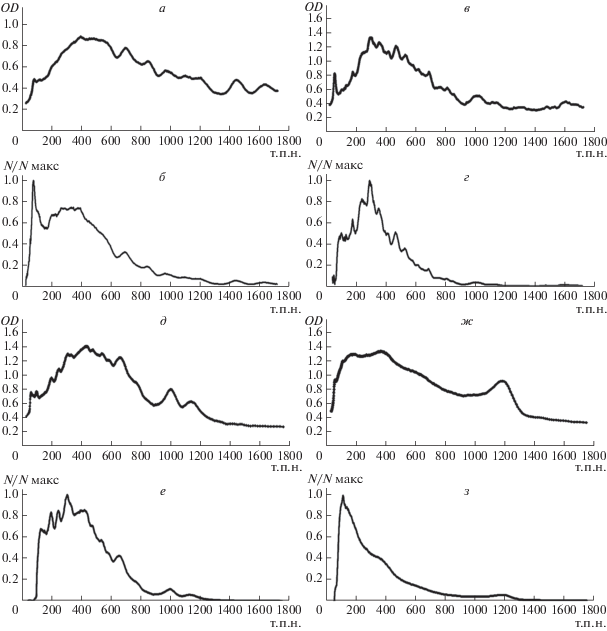
Наиболее широкий спектр молекул ДНК выявлен у P. multimicronucleatum (~50–1700 т.п.н.) –видны полосы, а также участки с разной величиной OD. В области 1300–1700 т.п.н хорошо выражены два широких пика. У близкородственных видов P. tetraurelia и P. quadecaurelia диапазоны размеров фрагментов ДНК и картины распределения OD были схожими. Основная часть молекул располагается в диапазоне длин от ~50 до 1100 т.п.н. На фоне непрерывного спектра заметны отдельные блоки и полосы. Полученные картины ПЭФ хорошо совпадают с данными, полученными методами ПЭФ и секвенирования генома макронуклеуса [27, 28, 34]. Это подтверждает вывод о стабильности молекулярной композиции генома макронуклеуса у разных видов инфузорий и возможности использования ПЭФ для получения характерного электрокариотипа данного вида.
Фрагменты ДНК D. nasutum в гелях ПЭФ образуют непрерывный спектр в диапазоне ~ 50–1000 т.п.н. ОD вдоль дорожки, начиная с 50 т.п.н., постепенно увеличивается и выходит на плато в диапазоне около 250 т.п.н. После участка с максимальной OD (диапазон длин ДНК 250–400 т.п.н.) OD быстро уменьшается. В отличие от представленных выше ПЭФ-кариотипов видов Paramecium, в которых хорошо различимы отдельные зоны и полосы, в кариотипе D. nasutum отдельные полосы не различаются, что указывает на отсутствие в его макронуклеусе гиперамплифицированных молекул ДНК с одинаковой длиной.
Следует отметить, однако, что распределение OD вдоль дорожек гелей ПЭФ не дает корректного представления о распределении числа молекул ДНК по длине. Действительно, рассмотрим два участка одной и той же дорожки геля с одинаковой OD, которые соответствуют разным длинам молекул ДНК L1 и L2 (L1 >L2). Тогда число пар нуклеотидов в них будет одинаковым, но число отдельных молекул ДНК будет больше в участке, соответствующем L2. Поэтому на основании данных ПЭФ, используя калибровочные кривые сканера и фотопленки (см. “Экспериментальную часть”), мы построили нормированные спектры распределения по длинам молекул ДНК макронуклеуса (рис. 3б, г, е, з). При анализе учитывали, что молекулы размером более ~1700 т.п.н. представляют ДНК микронуклеусов [27]. Кроме того, известно, что у Paramecium молекулы ДНК длиной ~ 50 и ~ 100 т.п.н. соответствуют мтДНК [35–37]. В связи с этим пики в области 50 и 100 т.п.н. аппроксимировали распределением Гаусса и вычитали из общего спектра.
Как видно из рис. 3, распределения молекул ДНК макронуклеусов по размерам оказались существенно отличными от распределения OD вдоль дорожек гелей. Спектры распределения молекул ДНК по длинам несимметричны и смещены в область более коротких молекул: во всех исследованных инфузориях подавляющая часть ДНК макронуклеуса представлена молекулами размером менее 500 т.п.н.
Электронные микрофотографии интерфазных макронуклеусов инфузорий на стадии логарифмического роста культуры показаны на рис. 4. На ультратонких срезах видно, что молекулы ДНК макронуклеусов упакованы в структуры хроматина, имеющие вид более или менее округлых телец. Гистограммы размеров хроматиновых телец показаны на рис. 5. Средний диаметр составляет 139 ± 26, 143 ± 30, 136 ± 25 и 155 ± 31 нм у P. multimicronucleatum, P. tetraurelia, P. quadecaurelia и D. nasutum соответственно (n = 1000–1100). Важно отметить, что использованные для электронной микроскопии фиксаторы не содержали двухвалентных катионов. Добавление в фиксаторы 1 мМ MgCl2 не приводило к изменению морфологии и распределения хроматиновых телец по размерам. Например, у P. multimicronucleatum средний размер телец, измеренный на препаратах, фиксированных без двухвалентных катионов и в присутствии MgCl2, составил 139 ± 26 и 138 ± 28 нм соответственно. Этот результат хорошо согласуется с известными данными о плотной упаковке нуклеосом в хроматиновых тельцах инфузорий [32]. Это позволяет, зная длину молекулы ДНК макронуклеуса, определить диаметр хроматинового тельца, в котором она компактизована. Предполагая, что каждое хроматиновое тельце содержит одну плотноупакованную молекулу ДНК, по полученным спектрам длин ДНК в макронуклеусах (рис. 3) мы построили ожидаемые из данных ПЭФ распределения хроматиновых телец по размерам и сравнили их с гистограммами размеров телец, определенных электронно-микроскопически (рис. 5).
Рис. 4.
Электронно-микроскопические срезы макронуклеусов P. multimicronucleatum (а), P. tetraurelia (б), P. quadecaurelia (в), D. nasutum (г). N – ядрышки. Масштабный отрезок 1 мкм.
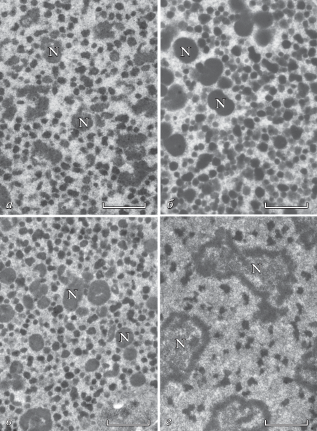
Рис. 5.
Гистограммы размеров хроматиновых телец (сплошные линии), измеренных на ультратонких срезах P. multimicronucleatum (а), P. tetraurelia (б), P. quadecaurelia (в), D. nasutum (г). Точечные линии – ожидаемые распределения размеров хроматиновых телец по данным пульс-электрофореза (рис. 3) при условии, что каждое тельце содержит одну молекулу ДНК. По оси абсцисс – диаметры телец, нм.
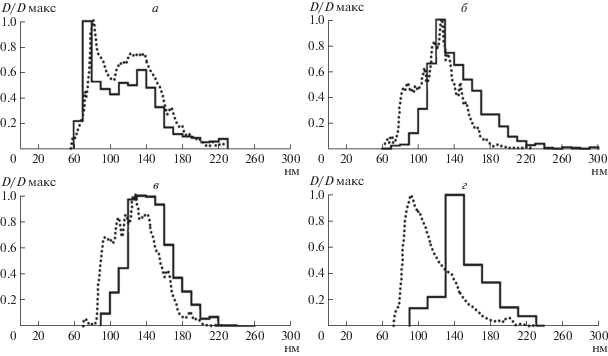
На рис. 5а мы видим хорошее совпадение обоих распределений у P. multimicronucleatum, что указывает на то, что каждое хроматиновое тельце содержит только одну минихромосому. Напротив, сильное расхождение гистограмм на рис. 5г свидетельствует о том, что большинство телец в макронуклеусе D. nasutum содержат две или более минихромосомы. Промежуточная картина наблюдается в макронуклеусах P. tetraurelia, P. quadecaurelia (рис. 5б, в).
Следует отметить, что при определении размеров мы измеряли одиночные хроматиновые тельца с хорошо различимым контуром и не учитывали структуры, которые выглядели как агрегаты из нескольких сближенных телец. Очевидно, что такие труктуры образованы несколькими минихромосомами.
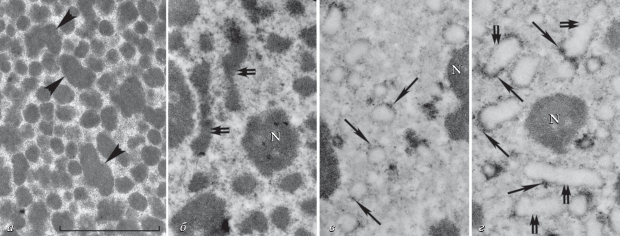
Морфология структур хроматина в макронуклеусах меняется при культивировании инфузорий в условиях голодания, когда активность макронуклеуса снижается. Эти изменения происходят в двух направлениях: хроматиновые тельца несколько увеличиваются в размере, а также агрегируют с образованием крупных структур, часто имеющих вид фибрилл толщиной 200–300 нм. На рис. 6 представлены микрофотографии хроматиновых структур в макронуклеусах P. multimicronucleatum и D. nasutum после голодания в течение 48 ч. Средний размер хроматиновых телец P. multimicronucleatum увеличивается с 139 ± 26 нм в условиях логарифмического роста культуры до 153 ± 31 нм при голодании. Хорошо видно образование крупных структур, формирующихся из двух и более хроматиновых телец (рис. 6а). Таких структур значительно больше, чем в макронуклеусах тех же инфузорий, но культивируемых в оптимальных условиях. В макронуклеусах D. nasutum появляется большое количество фибрилл толщиной 200–300 нм, состоящих из двух–пяти сближенных телец (рис. 6б). При этом транскрипционная активность в таких структурах хроматина сохраняется. На рис. 6в, г показаны микрофотографии срезов макронуклеусов D. nasutum при оптимальных условиях культивирования и в условиях голодания, контрастированных по методу Bernhard [38]. При этом контрастируются РНП-структуры, а ДНК-содержащие структуры клетки остаются неокрашенными. Хорошо видно, что РНП-структуры выявляются на поверхности хроматиновых телец, между ними и на поверхности 200–300 нм фибрилл. При этом транскрипция происходит не равномерно по всей поверхности телец и фибрилл, а в отдельных локусах (рис. 6в, г).
Рис. 6.
Структура хроматина в макронуклеусах P. multimicronucleatum при голодании (а), в макронуклеусах D. nasutum при голодании (б, г) и в оптимальных условиях культивирования (в). в, г – Дифференциальное контрастирование нуклеиновых кислот по Bernhard [38]. При голодании наблюдается укрупнение хроматиновых телец, образование агрегатов из нескольких телец (головки стрелок), образование коротких фибрилл (двойные стрелки). Одиночными стрелками показаны структуры РНП на поверхности телец и фибрилл хроматина. N – ядрышки. Масштабный отрезок – 1 мкм.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Данные ПЭФ показывают, что все исследованные инфузории относятся к видам с “субхромосомным” размером молекул генома макронуклеуса. Размеры молекул ДНК варьируют от ~50 до ~1000–1100 т.п.н. у P. tetraurelia, P. quadecaurelia и D. nasutum, до ~ 1700 т.п.н. и более у P. multimicronucleatum, что хорошо согласуется с данными [27]. Однако распределение молекул ДНК по длинам несимметрично и смещено в область коротких молекул ~50–500 т.п.н. (рис. 3б, г, е, з). Можно высказать предположение, что такое распределение молекул ДНК связано с расщеплением более длинных фрагментов в процессе приготовления препаратов для ПЭФ. Однако, во-первых, наблюдаемые нами паттерны распределения OD в гелях ПЭФ хорошо согласуются с описанными в ряде других работ [27, 28]. Во-вторых, показано хорошее совпадение данных ПЭФ с длинами скаффолдов ДНК макронуклеуса P. tetraurelia, полученными при секвенировании [28, 34], что невозможно при неспецифической деградации макронуклеарной ДНК в ходе выделения.
В макронуклеусах молекулы ДНК организованы в хроматиновые тельца, схожие по организации с хромомерами в хромонемах эукариотических хромосом [9, 36–38]. Заметим, что в последние годы появились работы, в которых утверждают, что структуры более высокого уровня организации, чем нуклеосомные фибриллы, выявляются на электронно-микроскопических препаратах вследствие артефактов фиксации, в частности, в присутствии двухвалентных катионов [12, 13]. Однако это не так в случае хроматина макронуклеусов инфузорий. Так, все представленные в работе микрофотографии получены при фиксации без двухвалентных катионов, причем добавление 1 мМ MgCl2 не приводило к изменению размеров телец. Более того, хроматиновые тельца наблюдали и при фиксации параформальдегидом без двухвалентных катионов и на оптическом уровне [20].
Сравнение размеров хроматиновых телец, измеренных на ультратонких срезах, и ожидаемых размеров, определенных из данных ПЭФ, показывает, что количество молекул ДНК в хроматиновых тельцах разных видов различается. Так, у P. multimicronucleatum индивидуальные тельца содержат только одну молекулу ДНК (распределения совпадают, рис. 5а), в то время как большинство телец в макронуклеусе D. nasutum содержат две минихромосомы или более (рис. 5г), что следует из значительного расхождения распределений размеров хроматиновых телец, ожидаемых из результатов ПЭФ и измеренных на срезах.
Такое расхождение не может объясняться неточным вычислением ожидаемого размера телец на основе данных ПЭФ. Плотная упаковка нуклеосом в хроматиновых тельцах подтверждается как электронно-микроскопическими данными по негативному контрастированию хроматиновых телец [33], так и тем фактом, что размеры телец, измеренные нами на ультратонких срезах, не изменялись при добавлении в фиксатор 1 мМ MgCl2. В расчетах мы аппроксимировали нуклеосомные тельца сферами радиусом 10 нм [30], объем которых больше суммарного объема гистонового кора нуклеосомы и навитой на него нуклеосомной ДНК [39], поэтому ясно, что расхождение распределений у D. nasutum не может быть меньше, чем представленное на рис. 5г, т.е. большинство телец в макронуклеусе D. nasutum содержат несколько минихромосом.
В соматических ядрах P. tetraurelia и P. quadecaurelia на стадии логарифмического роста культуры наблюдается промежуточная картина. Основная часть хроматиновых телец, по-видимому, содержит одну молекулу ДНК. Однако сравнение распределений размеров телец, полученных из данных ПЭФ и электронной микроскопии (рис. 5в, г), показывает наличие несовпадающего “крыла” в левой части распределений. То есть некоторая часть телец содержит две и более молекулы ДНК. Такие тельца могут образовываться при агрегации двух и более телец, содержащих по одной молекуле ДНК.
Как структурно организована ДНК в хроматиновых тельцах? Электронно-микроскопически показано, что в гипотонических условиях хроматиновые тельца макронуклеусов инфузорий Bursaria truncatella, D. nasutum, Paramecium, Spirotricha декомпактизуются с образованием петель фибрилл хроматина вокруг электронно-плотного центра [22–24]. Murti K.G и Prescott D.M. [41, 42] показали, что концевые участки ДНК макронуклеуса Stylonychia lemnae, содержащие длинные теломерные повторы, при взаимодействии с теломер-связывающими белками (TeBP) образуют между собой стабильные комплексы. Такие структуры, находящиеся в основании петель фибрилл хроматина, разрушались при обработке протеиназой К [40, 41]. В работах сотрудников лаборатории Lipps H.J. [42] также установлено наличие квадруплексов концевых участков ДНК макронуклеуса в комплексе с TeBP, получены антитела к этим структурам [43]. На препаратах хроматина B. truncatella, распластанного в присутствии 70%-ного формамида на поверхности гипофазы из дистиллированной воды, электронно-микроскопически визуализированы молекулы ДНК макронуклеуса, отходящие от “организующих центров” хроматиновых телец [44]. С учетом того, что размер петель ДНК в хроматине высших эукариот составляет ~ 100 т.п.н. [4], в каждом хроматиновом тельце одна молекула ДНК образует 1–10 петель.
На рис. 7 представлены два варианта образования таких петель. В первом случае (рис. 7а) основания петель закреплены в центральной части хроматинового тельца наподобие концевых теломерных фрагментов минихромосом. Такая модель аналогична модели организации хромомеров в ядрах эукариот, предложенной Cook [11], с той разницей, что в модели Cook петли закреплены в центральной части хромомеров с помощью РНК-полимераз и белков – факторов транскрипции, входящих в состав так называемых транскрипционных фабрик, а в хроматиновых тельцах инфузорий теломерные концы молекул ДНК связаны с TeBP. Однако в настоящее время нет подтвержденных данных о содержании в центральной части молекул ДНК макронуклеусов последовательностей, гомологичных теломерным концевым фрагментам. Кроме того, при такой организации затруднена транскрипция генов, расположенных в центральной части телец. Можно предположить (рис. 7б), что петли в хроматиновых тельцах образуются за счет динамических взаимодействий различных участков нуклеосомной фибриллы (как в ТАД-модели хроматина). С помощью компьютерного моделирования показано, что нуклеосомная фибрилла будет сворачиваться в компактную глобулу, если в результате модификации гистонов часть нуклеосом (в нетранскрибируемых участках) будет иметь большее сродство друг к другу, чем нуклеосомы в транскрибируемых участках [45]. При этом петли транскрибируемого хроматина располагались на поверхности смоделированной глобулы [45]. Кроме того, известно, что петли фибрилл хроматина могут стабилизироваться за счет взаимодействия энхансеров и промоторов при участии белка CTCF и когезина [46]. Такая организация дает возможность динамического выпетливания части молекулы ДНК для транскрипции на поверхности ТАДа (рис. 7б, звездочки). Именно такая картина наблюдается в макронуклеусах инфузорий при дифференцированном контрастировании нуклеиновых кислот: РНП выявляются в некоторых участках на поверхности хроматиновых телец (рис. 6в, г).
Рис. 7.
Модели петельной организации хроматиновых телец. а – Петли фибрилл хроматина закреплены в центральной части телец. б – Петли хроматина образованы по принципу организации ТАДов. Звездочками отмечены участки транскрипционно-активного хроматина. Темные точки – квадруплексы теломерных концов минихромосом макронуклеуса в комплексе с белком TeBP.
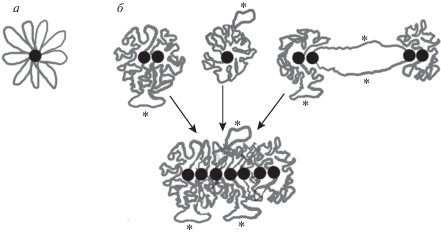
ТАДы обнаружены не только в клетках высших эукариот, но и у дрозофилы, где они имеют вид дисков в политенных хромосомах [47]. Наши данные показывают, что по топологическим характеристикам хроматиновые тельца в макронуклеусах инфузорий с субхромосомным размером ДНК также соответствуют ТАДам высших эукариот. Как и ТАДы, хроматиновые тельца содержат по 90–1000 т.п.н. ДНК, организованы по петельному принципу, центральная часть телец содержит неактивный хроматин, а транскрипция происходит по периферии телец, как в случае транскрипции по периферии ТАДов или в интерТАДах высших эукариот [3]. Представленная на рис. 7б модель организации хроматина в соматических ядрах инфузорий позволяет легко объяснить укрупнение телец и образование фибрилл толщиной 200–300 нм при снижении активности макронуклеуса (рис. 6). Если ТеВР и другие белки, входящие в организующие центры хроматиновых телец, имеют большее сродство друг к другу, чем белки нуклеосомных фибрилл хроматина, то сначала агрегация организующих центров будет приводить к некоторому укрупнению телец, а затем, в силу стерических ограничений, дальнейшая агрегация организующих центров будет происходить только в продольном направлении, что приводит к формированию 200–300 нм фибрилл, аналогично модели образования хромонем из хромомеров [11]. Предложенная модель позволяет также предсказать, что в макронуклеусах видов с длинными молекулами ДНК должны преобладать структуры в виде одиночных хроматиновых телец, в то время как у видов с короткими минихромосомами чаще должны встречаться 200–300 нм фибриллы хроматина. Проверить это предсказание планируется в ближайших исследованиях.
Работа поддержана Программой фундаментальных исследований Государственных академий наук на 2013–2020 годы (тема № 01201363823).
Настоящая статья не содержит каких-либо исследований с использованием людей или животных в качестве объектов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Cremer T., Cremer M., Cremer C. (2018) 4D-нуклеом: компартментализация генома в контексте эволюции. Биохимия. 83, 452–466.
Postberg J., Lipps H.J., Cremer T. (2010) Evolutionary origin of the cell nucleus and its functional architecture. Essays Biochem. 48, 1–24.
Разин С.В., Ульянов С.В., Гаврилов А.А. (2019) 3D геномика. Молекуляр. биология. 53, 911–923.
Razin S.V. (1996) Functional architecture of chromosomal DNA domains. Crit. Rev. Eukaryot. Gene Expr. 6, 247–269.
Cockerill P.N., Garrard W.T. (1986) Chromosomal loop anchorage sites appear to be evolutionarily conserved. FEBS Lett. 204, 5–7.
Gasser S.M., Laemmli U.K. (1986) The organization of chromatin loops: characterization of a scaffold attachment site. EMBO J. 5, 511–518.
Iarovaia O., Hancock R., Lagarkova M., Miassod R., Razin S.V. (1996) Mapping of genomic DNA loop organization in a 500-kilobase region of the Drosophila X chromosome by the topoisomerase II-mediated DNA loop excision protocol. Mol. Cell. Biol. 16, 302–308.
Marsden M.P.F., Laemmli U.K. (1979) Metaphase chromosome structure: evidence for a radial loop model. Cell. 17, 849–858.
Belmont A.S., Sedat J.W., Agard D.A. (1987) A three-dimensional approach to mitotic chromosome structure: evidence for a complex hierarchical organization. J. Cell Biol. 105, 77–92.
Zatsepina O.V., Polyakov V.Yu., Chentsov Yu.S. (1983) Chromosoma. 88, 91–97.
Cook P.R. (1995) A chromomeric model for nuclear and chromosome structure. J. Cell Sci. 108, 2927–2935.
Razin S.V., Iarovaia O.V., Vassetzky Y.S. (2014) A requiem to the nuclear matrix: from a controversial concept to 3D organization of the nucleus. Chromosoma. 123, 217–224.
Nishino Y., Eltsov M., Joti Y., Ito K., Takata H., Takahashi Y., Hihara S., Frangakis A.S., Imamoto N., Ishikawa T., Maeshima K. (2012) Human mitotic chromosomes consist predominantly of irregularly folded nucleosome fibres without a 30-nm chromatin structure. EMBO J. 31, 1644–1653.
Ou H.D., Phan S., Deerinck T.J., Thor A., Ellisman M.H., O’Shea C.C. (2017) Visualizing 3D chromatin structure and compaction in interphase and mitotic cells. Science. 357(6349).
Lieberman-Aiden E., van Berkum N.L., Williams L., Imakaev M., Ragoczy T., Telling A., Amit I., Lajoie B.R., Sabo P.J., Dorschner M.O., Sandstrom R., Bernstein B., Bender M.A., Groudine M., Gnirke A., Stamatoyannopoulos J., Mirny L.A., Lander E.S., Dekker J. (2009) Comprehensive mapping of long-range interactions reveals folding principles of the human genome . Science. 326, 289–293.
Kalhor R., Tjong H., Jayathilaka N., Alber F., Chen L. (2012) Genome architectures revealed by tethered chromosome conformation capture and population-based modeling. Nat. Biotechnol. 30, 90–98.
Kantidze O.L., Razin S.V. (2020) Weak interactions in higher-order chromatin organization. Nucl. Acids Res. 48, 4614–4626.
Разин С.В., Гаврилов А.А. (2018) Структурнофункциональные домены эукариотического генома. Биохимия. 83, 440–451.
Jahn C.L., Klobutcher L.A. (2002) Genome remodeling in ciliated protozoa. Ann. Rev. Microbiol. 56, 489–520.
Raikov I.B. (1982) The protozoan nucleus. morphology and evolution. Cell Biol. Monogr. 9, 1–474.
Некрасова И.В., Потехин А.А. (2018) Интерференция РНК в формировании соматического генома у инфузорий Paramecium и Tetrahymena. Экологическая генетика. 16, 5–22.
Martinkina L.P., Vengerov Yu.Yu., Bespalova I.A., Tikhonenko A.S., Sergejeva G.I. (1983) The structure of inactive interphase macromolecular chromatin of the ciliate Bursaria truncatella. Radial loops in the structure of chromatin clumps. Eur. J. Cell Biol. 30, 47–53.
Борхсениус О.Н., Беляева Н.Н., Осипов Д.В. (1988) Структура хроматина соматического ядра инфузории Spirostomum ambiguum. Цитология. 30, 762–769.
Karajan B.P., Popenko V.I., Raikov I.B. (1995) Organization of transcriptionally inactive chromatin of interphase macronucleus of the ciliate Didinium nasutum. Acta Protozool. 34, 135–141.
Леонова О.Г., Иванова Ю.Л., Караджан Б.П., Попенко В.И. (2004) Динамика ультраструктурных изменений хроматина и ядрышек макронуклеуса инфузорий Paramecium caudatum и Bursaria truncatella при гипотонической обработке. Цитология. 46, 456–464.
Sonneborn T.M. (1970) Methods in Paramecium research. Methods Cell Physiol. 4, 241–339.
Rautian M.S., Potekhin A.A. (2002) Electrokaryotypes of macronuclei of several Paramecium species. J. Eukaryot. Microbiol. 49, 296–304.
Nekrasova I.V., Przybos E., Rautian M.S., Potekhin A.A. (2010) Electrophoretic karyotype polymorphism of sibling species of the Paramecium aurelia complex. J. Eukaryot. Microbiol. 57, 494–507.
Тимофеева А.С., Раутиан М.С. (1997) Определение размера генома внутриядерной симбиотической бактерии Holospora undulata методом пульс-электрофореза. Цитология. 39, 634–639.
Kornberg R.D. (1977) Structure of chromatin. Ann. Rev. Biochem. 46, 931–954.
Olins A.L., Olins D.E. (1974) Spheroid chromatin units (ν bodies). Science. 183, 330–332.
Tikhonenko A.S., Bespalova I.A., Martinkina L.P., Popenko V.I., Sergejeva G.I. (1984) Structural organization of macronuclear chromatin of the ciliate Bursaria truncatella in resting cysts and at excysting. Eur. J. Cell. Biol. 33, 37–42.
Sloane N.J.A. (1984) The packing of spheres. Sci. American. 25, 116–124.
Duret L., Cohen J., Jubin C., Dessen F., Goüt J.-F., Mousset S., Aury J.-M., Jaillon O., Noël B., Arnaiz O., Bétermier M., Wincker P., Meyer E., Sperling L. (2008) Analysis of sequence variability in the macronuclear DNA of Paramecium tetraurelia: a somatic view of the germline. Genome Res. 18, 585–596.
Pritchard A.E., Seilhamer J.J., Mahalingam R., Sable C.L., Venuti S.E., Cummings D.J. (1990) Nucleotide sequence of the mitochondrial genome of Paramecium. Nucl. Acids Res. 18, 173–180.
Johri P., Marinov G.K., Doak T.G., Lynch M. (2019) Population genetics of Paramecium mitochondrial genomes: recombination, mutation spectrum, and efficacy of selection. Genome Biol. Evol. 11, 1398–1416.
Arnaiz O., Meyer E., Sperling L. (2020) Paramecium DB 2019: integrating genomic data across the genus for functional and evolutionary biology. Nucl. Acids Res. 48, D599–D605.
Bernhard W. (1969) A new staining procedure for electron microscopical cytology. J. Ultrastruct. Res. 27, 250–265.
Richmond T.J., Davey C.A. (2003) The structure of DNA in the nucleosome core. Nature. 423, 145–150.
Murti K.G., Prescott D.M. (1999) Telomeres of polytene chromosomes in a ciliated protozoan terminate in duplex DNA loops. Proc. Natl. Acad. Sci. USA. 96, 14436–14439.
Murti K.G., Prescott D.M. (2002) Topological organization of DNA molecules in the macronucleus of hypotrichous ciliated protozoa. Chromosome Res. 10, 165–173.
Jönsson F., Postberg J., Schaffitzel C., Lipps H.J. (2002) Organization of the macronuclear gene-sized pieces of stichotrichous ciliates into a higher order structure via telomere-matrix interactions. Chromosome Res. 10, 445–453.
Schaffitzel C., Postberg J., Paeschke K., Lipps H.J. (2010) Probing telomeric G-quadruplex DNA structures in cells with in vitro generated single-chain antibody fragments. Meth. Mol. Biol. 608, 159–181.
Новикова Е.Г., Попенко В.И. (1998) Визуализация организующих центров хроматина макронуклеуса инфузории Bursaria truncatella. Молекуляр. биология. 37, 567–575.
Gavrilov A.A., Shevelyov Y.Y., Ulianov S.V., Khrameeve E.E., Kos P., Chertovich A., Razin S.V. (2016) Unraveling the mechanisms of chromatin fibril packaging. Nucleus. 7, 319–324.
Rao S.S., Huntley M.H., Durand N.C., Stamenova E.K., Bochkov I.D., Robinson J.T., Sanborn A.L., Machol I., Omer A.D., Lander E.S., Aiden E.L. (2014) A 3D map of the human genome at kilobase resolution reveals principles of chromatin looping. Cell. 159, 1665–1680.
Колесникова Т.Д. (2018) Дисковый рисунок политенных хромосом как отражение универсальных принципов организации хроматина в топологические домены. Биохимия. 83, 480–492.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


