Молекулярная биология, 2022, T. 56, № 1, стр. 147-156
Низкий титр лентивирусного вектора, содержащего ген TRIM5α-HRH, обусловлен экспрессией TRIM5α-HRH в клетках-продуцентах и влиянием промотора Ef1α
Ф. А. Урусов a, b, *, Д. В. Глазкова a, Г. М. Цыганова a, Д. В. Поздышев c, Е. В. Богословская a, Г. А. Шипулин a
a Центр стратегического планирования и управления медико-биологическими рисками здоровью Федерального медико-биологического агентства Российской Федерации
119992 Москва, Россия
b Научно-исследовательский институт медицины труда им. академика Н.Ф. Измерова
105275 Москва, Россия
c Научно-исследовательский институт физико-химической биологии им. А.Н. Белозерского Московского государственного университета им. М.В. Ломоносова
119992 Москва, Россия
* E-mail: flanger.fx@mail.ru
Поступила в редакцию 02.04.2021
После доработки 11.06.2021
Принята к публикации 11.06.2021
- EDN: DXBDNG
- DOI: 10.31857/S0026898422010104
Аннотация
Химерный белок TRIM5α-HRH – перспективный для генной терапии ВИЧ-инфекции фактор, способный защитить клетки, блокируя ВИЧ-1 в цитоплазме. Разрабатываемая нами стратегия генной терапии ВИЧ-инфекции предполагает доставку гена TRIM5α-HRH в CD4+ Т-лимфоциты c помощью лентивирусных векторов. Однако такие векторы, содержащие TRIM5α-HRH, имеют низкий инфекционный титр, что препятствует эффективной модификации Т-клеток. Нами установлено, что одной из причин низкого титра является белок TRIM5α-HRH, присутствующий в клетках HEK293T во время наработки псевдовирусных частиц. Другая причина – промотор Ef1α, входящий в состав разрабатываемой нами конструкции, замена которого на промотор СMV приводит к пятикратному повышению титра вируса. Полученные результаты позволили определить направления дальнейшей оптимизации вектора, содержащего ген TRIM5α-HRH, с целью повышения его инфекционного титра.
ВВЕДЕНИЕ
ВИЧ-инфекция – неизлечимое на сегодняшний день заболевание. Антиретровирусные (АРВ) препараты подавляют репликацию вируса и снижают вирусную нагрузку, но не позволяют полностью элиминировать вирус из организма. По этой причине ВИЧ-инфицированные пациенты вынуждены принимать АРВ-препараты пожизненно, что почти всегда сопряжено с побочными эффектами. Режим приема этих препаратов должен строго соблюдаться, в противном случае возрастает риск возникновения устойчивых к АРВ-препаратам вариантов вируса [1, 2]. Эти проблемы заставляют искать новые подходы к лечению ВИЧ-инфекции, один из которых – генная терапия (ГТ), предполагающая введение генов, блокирующих вирус, в геном CD4+ Т-лимфоцитов или CD34+ стволовых гемопоэтических предшественников, которые дают начало всем клеточным популяциям, вовлеченным в развитие инфекции [3, 4]. Наиболее эффективным средством доставки на сегодняшний день считаются лентивирусные векторы (ЛВ), сконструированные на основе ВИЧ. Они способны эффективно доставлять трансген в CD4+ Т-лимфоциты, обеспечивать его встраивание в геном, поддерживать постоянную экспрессию и возможность передачи дочерним клеткам в процессе пролиферации [5]. Безопасность ЛВ подтверждена многочисленными доклиническими и клиническими исследованиями препаратов на основе этих векторов для лечения различных патологий [6–14].
Белки TRIM5α (TRIpartite Motif, 5α-изоформа) способны блокировать различные ретровирусы в цитоплазме клетки, причем спектр нейтрализуемых вирусов специфичен для разных видов млекопитающих [15, 16]. Так, белок TRIM5α макаков резусов TRIM5α-rh (TRIM5α rhesus) способен предотвратить инфекцию ВИЧ-1, в то время как человеческий гомолог huTRIM5α не защищает клетки от ВИЧ-инфекции [17]. Созданный в 2005 году химерный белок TRIM5α-HRH (human-rhesus hybrid) – это модифицированный huTRIM5α, в котором 11 аминокислотных остатков в PRYSPRY-домене, определяющем противовирусную специфичность, заменены на 13 аминокислотных остатков из TRIM5α-rh [18]. В результате такой замены белок TRIM5α-HRH приобрел способность ингибировать репликацию ВИЧ-1 в клетках человека [19].
TRIM5α-HRH – перспективный фактор для ГТ ВИЧ-инфекции. Однако существуют сложности с производством ЛВ, содержащих данный ген. При наработке такие ЛВ имеют низкий титр [19, 20], что препятствует эффективной модификации CD4+ лимфоцитов и затрудняет дальнейшее развитие ГТ. Настоящая работа посвящена поиску причин низкого титра ЛВ, содержащих TRIM5α-HRH.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клонирование конструкций. ЛВ конструировали на основе вектора pLVX Puro (“Clontech”, США), содержащего интактные длинные концевые повторы (LTR), CMV-промотор и экспрессионную кассету PGK-puro. Из данного вектора с использованием ранее описанной методики был удален элемент cPPT (central polypurine tract), а селективный маркер устойчивости к пуромицину puro заменен на ген зеленого флуоресцентного белка (eGFP) [21]. Полученная конструкция названа pLVX eGFP. В результате удаления последовательности промотора CMV из pLVX eGFP по сайтам ClaI и BamH1 получена конструкция eGFP-LV. Для получения Ef-PGK-eGFP-LV промотор CMV в pLVX eGFP заменили на Ef1α по сайтам ClaI и BamH1. Последовательность Ef1α получена амплификацией геномной ДНК человека с праймерами atcgataccgtcagtgggcaga и ggatccaggggtagttttcacga. Затем в Ef-PGK-eGFP-LV по BamH1- и XbaI-сайтам встроили линкер с необходимыми сайтами рестрикции, полученный отжигом олигонуклеотидов gatcctgctagaattctcagcatatggtct и ctagagaccatatgctgagaattctagcag. Гены huTRIM5α и TRIM5α-HRH получены согласно [21] и клонированы в pGEM-T (“Promega”, США). В плазмидах pGEM-huTRIM и pGEM-TRIM-HRH кодон atg в положении 47 заменили с помощью сайт-направленного мутагенеза на taa и получили в результате конструкции pGEM-huTRIM47TAA и pGEM-TRIM-HRH47TAA. Далее последовательности TRIM5α реамплифицировали и вставили по сайтам EcoR1 и XbaI в Ef-PGK-eGFP-LV. Для получения CMV-TRIM-HRH-LV амплифицированный ген TRIM5α-HRH встроили в pLVX eGFP по сайтам XhoI и XbaI. Праймеры для реамплификации, матрицы и полученные конструкции указаны в табл. 1.
Таблица 1.
Праймеры для реамплификации генов TRIM5α, матрицы и названия полученных конструкций
| Праймер (5' → 3') | Матрица | Конструкция |
|---|---|---|
| agcgaattccgccaccatggcttctggaatcctgg, gttctagattatcaagagcttggtgagcacagagt | pGEM-TRIM-HRH | TRIM-HRH-LV |
| agcgaattccgccaccatggcttctggaatcctgg, gttctagattatcaagagcttggtgagcacagagt | pGEM-huTRIM | huTRIM-LV |
| agcgaattctaagcttctggaatcctggttaatgta, gttctagattatcaagagcttggtgagcacagagt* | pGEM-TRIM-HRH47TAA | stopTRIM-HRH-LV |
| agcgaattctaagcttctggaatcctggttaatgta, gttctagattatcaagagcttggtgagcacagagt* | pGEM-huTRIM47TAA | stophuTRIM-LV |
| agcgaattctaagcttctggaatcctggttaatgta, gttctagattaccatccacaccctgaagcagctcca* | pGEM-huTRIM | stop½huTRIM-N-LV |
| agcgaattcgcttcagggtgtggatggcgtcat, gttctagattatcaagagcttggtgagcacagagt | pGEM-TRIM-HRH | ½TRIM-HRH-C-LV |
| agcgaattcgcttcagggtgtggatggcgtcat, gttctagattatcaagagcttggtgagcacagagt | pGEM-huTRIM | ½huTRIM-C-LV |
| gaactcgagcgccaccatggcttctggaatcctgg, gttctagattatcaagagcttggtgagcacagagt | pGEM-TRIM-HRH | CMV-TRIM-HRH-LV |
Для получения конструкции noEf-TRIM-HRH-LV из вектора TRIM-HRH-LV по сайтам ClaI и BamH1 удалили промотор Ef1α, вектор лигировали сам на себя.
Клеточные линии. Клетки лимфобластоидной линии SupT1 (ATCC CRL‑1942) культивировали в среде Advanced RPMI1640 (“Thermo Fisher Scientific”, США) c добавлением 2% фетальной сыворотки крупного рогатого скота (FBS, “Gibco”, США) и L-глутамина до 4 мМ (“ПанЭко”, Россия). Клетки линии HEK293T (ATCC® CRL‑3216) культивировали в среде DMEM (“ПанЭко”) с 10% FBS (“Gibco”) и 4 мМ L-глутамином (“ПанЭко”). Все клеточные линии культивировали при температуре 37°C и 5% СО2.
Получение лентивирусных частиц. Для получения частиц, псевдотипированных VSV-G (белок G вируса везикулярного стоматита), клетки HEK293T трансфицировали смесью упаковочных плазмид второго поколения (0.6 мкг pCMV-dR8.91, 0.1 мкг pCMV-VSV-G [20] и соответствующей ЛВ конструкцией (0.6 мкг) в 6-луночных культуральных планшетах (“TPP”, Швейцария). Использовали линейный полиэтиленимин (PEI MAX 40000; “Polysciences Inc.”, CША). Трансфекцию, сбор и хранение ЛВ-частиц проводили согласно [20].
Вестерн-блотинг. Клетки линии HEK293T, собранные после наработки лентивирусных частиц с одной лунки, лизировали в 0.5 мл реагента для лизиcа Proteojet (“Thermo Fisher Scientific”). Лизат (10 мкл) использовали для нанесения на полиакриламидный гель с последующим переносом на PVDF-мембрану Immun-Blot® (“BioRad”). Использовали антитела: против β-актина (ab8227, “Abcam”, Великобритания) 1 : 8000, против TRIM5α (ab59000, “Abcam”) 1 : 500, вторичные антикроличьи антитела, меченные пероксидазой хрена (ab6721, “Abcam”) 1 : 12 000.
Определение инфекционного титра псевдовирусных частиц. Инфекционный титр псевдовирусных частиц (единицы трансдукции/мл, или ТU/мл) определяли путем титрования ЛВ-суспензии на клеточной линии SupT1. Для этого из свежеразмороженных аликвот ЛВ готовили серию пятикратных разведений (1, 1/5, 1/25, 1/125), которыми трансдуцировали 105 клеток в присутствии 2 мкг/мл полибрена в объеме 0.3 мл на 48‑луночном планшете (“TPP”). На следующий день заменяли ростовую среду на свежую. Через 48 ч после трансдукции измеряли долю клеток, экспрессирующих маркер eGFP (eGFP+ клетки) с помощью проточного цитофлуориметра NovoCyte Quanteon (“Agilent Technologies”, США). Титр рассчитывали по формуле: a × 105 × d/v, где a – доля eGFP+ клеток, 105 – общее количество клеток, d – коэффициент разведения вируса, v – объем вируса, добавляемый в лунку. При расчете использовали разведения, в которых получали культуру, содержащую не более 30% клеток eGFP+. Для определения титра с помощью количественной ПЦР клетки SupT1, полученные после трансдукции разведениями ЛВ, культивировали в течение 3 недель, чтобы избавиться от остаточной плазмидной ДНК, привнесенной в культуру вместе с ЛВ-частицами. Клетки обрабатывали бензоназой (“Merck”, Германия) в разведении 1 : 37 000 в течение 1 ч при 37°C. Из клеточных линий, трансдуцированных различными количествами вектора, выделяли ДНК и определяли число копий вектора, встроенных в геном, используя праймеры ccttgtataaatcctggttgctgtct, ggaaaggagctgacaggtggt и зонд R6G-tcaggcaacgtggcgtggtgtg-BHQ2. Для нормирования числа копий вектора (ЧКВ) на количество клеток использовали ген β-глобина (праймеры gtcagggcagagcctctattgct, ccacatgcccagtttctattggtct и зонд Fam-tgcccagggcctcaccacca-BHQ1), получая среднее ЧКВ на клетку. В качестве количественного стандарта использовали линию клеток SupT1, содержащую 1 копию встроенного ЛВ на клетку. График зависимости среднего ЧКВ на клетку от объема добавленного ЛВ (разведения 1/125, 1/25 и 1/5) строили в программе MS Exel. По уравнению линейной аппроксимирующей кривой вычисляли инфекционный титр вектора – число трансдукционных единиц в 1 мл вирусной суспензии.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Белки TRIM5α-HRH и huTRIM5α снижают титр ЛВ
Одной из причин снижения титра ЛВ, содержащих TRIM5α-HRH, может быть присутствие белка TRIM5α-HRH в клетках-продуцентах HEK293T, поскольку его гомолог – белок TRIM5α-rh –обладает способностью снижать продукцию ВИЧ-1 и ЛВ в культурах клеток HEK293T [22, 23]. Экспрессия TRIM5α-HRH во время наработки ЛВ обеспечивается плазмидой, кодирующей векторную РНК.
Влияние белков TRIM5α на титр ЛВ оценивали с использованием ЛВ-конструкций, схемы которых приведены на рис. 1а. Конструкции TRIM-HRH-LV и huTRIM-LV содержат гены TRIM5α-HRH и huTRIM5α под контролем промотора Ef1α, а также маркерный ген eGFP под контролем промотора PGK. Конструкции stopTRIM-HRH-LV и stophuTRIM-LV лишены стартового кодона ATG и содержат терминирующие кодоны в начале рамки считывания, что препятствует инициации трансляции белка (см. Экспериментальную часть). В качестве контрольного ЛВ использовали eGFP-LV, содержащий только кассету для экспрессии маркерного гена (рис. 1а). Эти конструкции использовали для наработки псевдовирусных частиц (рис. 1б). Эффективность подавления трансляции мы оценивали, определяя количество белка TRIM5α в клетках-продуцентах HEK293T с помощью вестерн-блотинга (рис. 1б). В клетках с вектором TRIM-HRH-LV обнаружено значительное количество белка. В клетках с вектором stopTRIM-HRH-LV выявлен слабый сигнал, такой же, как и в клетках с eGFP-LV. Сигнал в stopTRIM-HRH-LV и eGFP-LV, по-видимому, обусловлен присутствием эндогенного белка TRIM5α.
Рис. 1.
Оценка влияния белков TRIM5α на продукцию ЛВ. а – Схемы ЛВ-конструкций: LTR – длинный концевой повтор, Ef1α – промотор гена фактора элонгации 1 человека, PGK – промотор гена фосфоглицераткиназы мыши; “stop” – положение терминирующего кодона; заштрихованным прямоугольником в рамке гена TRIM5α-HRH отмечена последовательность, кодирующая участок PRYSPRY-домена, содержащий аминокислоты из TRIM5α-rh; б – схема эксперимента и вестерн-блот-анализ белка TRIM5α в клетках HEK293T. При создании схемы эксперимента использованы изображения с ресурса Biorender. в – Инфекционный титр конструкций, определенный на клетках SupT1. Инфекционный титр контрольного вектора eGFP-LV, принятого за 100%, составил 1 × 107 TU/мл. *p > 0.05 согласно критерию Манна–Уитни, n = 4.
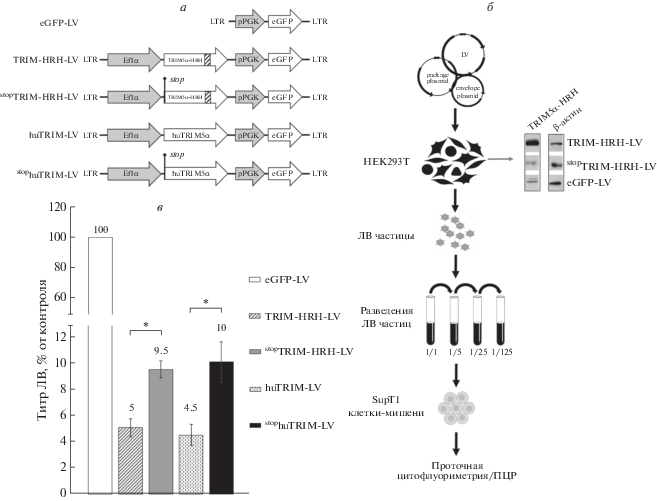
Титры TRIM-HRH-LV и huTRIM-LV оказались в 20 раз ниже, чем титр контрольного вектора (рис. 1в). Установлено, что подавление трансляции белков TRIM5α в ЛВ конструкциях stopTRIM-HRH-LV и stophuTRIM-LV усиливает их продукцию в 2 раза (рис. 1в). Следовательно, оба белка – TRIM5α-HRH и huTRIM5α – снижают титр ЛВ.
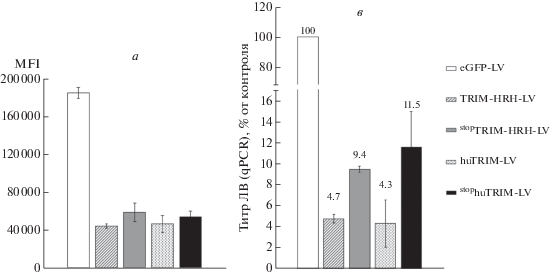
При оценке инфекционного титра мы обратили внимание на тот факт, что медиана интенсивности флуоресценции белка eGFP (MFI) в клетках с конструкциями, которые содержат гены TRIM5α под промотором Ef1α, примерно в 4.5 раза ниже, чем в клетках с контрольным вектором (рис. 2а). Снижение интенсивности флуоресценции маркера затрудняет разделение eGFP+ и eGFP– популяций клеток на проточном цитометре, что в свою очередь может уменьшать чувствительность определения титра ЛВ и приводить к неправильной его оценке. Чтобы исключить недооценку титра при измерении с помощью флуоресцентного маркера, мы оценили титр альтернативным способом. Из клеток, в которых мы измеряли флуоресценцию eGFP, была выделена геномная ДНК для оценки титра с помощью количественной ПЦР. Измерение титра каждого из представленных на рис. 2б ЛВ с помощью ПЦР дало значения, схожие со значениями, полученными при измерении титра по флуоресценции eGFP (рис. 1в). Таким образом, в данном случае eGFP-маркер корректно отражает инфекционный титр исследуемых ЛВ.
Рис. 2.
Медиана интенсивности флуоресценции и оценка инфекционного титра ЛВ с помощью количественной ПЦР. а – Медиана интенсивности флуоресценции (MFI) в eGFP+-популяции клеток SupT1 при определении инфекционного титра, n = 4. б – Инфекционный титр конструкций, определенный на клетках SupT1 c помощью количественной ПЦР. Инфекционный титр контрольного вектора eGFP-LV, принятого за 100%, составил 8 × 106 TU/мл; n = 4.
Нуклеотидная последовательность гена TRIM5α per se не влияет на продукцию лентивирусных векторов
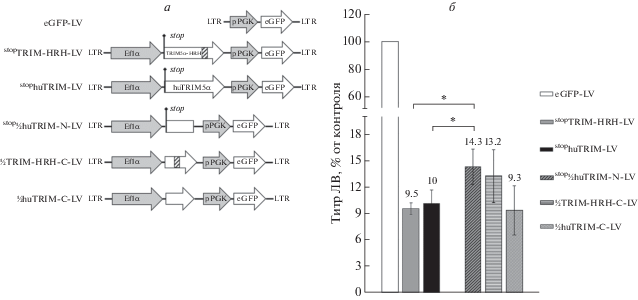
Обнаруженное нами влияние белков TRIM5α на титр ЛВ (снижение титра в 2 раза) не в полной мере объясняет 20-кратную разницу между контрольным вектором и векторами, содержащими гены TRIM5α-HRH и huTRIM5α. Мы предположили, что еще одной причиной низкого титра может быть нуклеотидная последовательность гена TRIM5α per se. Для проверки этого предположения мы разбили гены TRIM5α-HRH и huTRIM5α на две равные части и вставили их в ЛВ под промотор Ef1α. Получили конструкцию stop½huTRIM-N-LV, содержащую N-концевую часть гена, и две конструкции – ½TRIM-HRH-C-LV и ½huTRIM-C-LV, содержащие С-концевые области (рис. 3а). В начале каждой из половин генов TRIM5α отсутствуют стартовые кодоны, что исключает трансляцию укороченных вариантов белка. Существование двух вариантов С-концевой последовательности обусловлено различиями в этой части белков TRIM5α-HRH и huTRIM5α. Мы наработали указанные ЛВ и оценили их титр. Ожидалось, что, если в конструкции, содержащей одну из половин гена, находится последовательность, неблагоприятная для продукции ЛВ, то мы увидим существенное увеличение титра у конструкции, содержащей другую половину. Однако инфекционные титры конструкций stop½huTRIM-N-LV, ½TRIM-HRH-C-LV и ½huTRIM-C-LV не различались статистически значимо. Титры конструкций ½TRIM-HRH-C-LV и ½huTRIM-C-LV оказались сопоставимыми со значениями титров ЛВ с полноразмерными генами stopTRIM5α, а конструкция stop½huTRIM-N-LV обеспечивала увеличение титра только в 1.4 раза (рис. 3б). Таким образом, в генах TRIM5α отсутствуют какие-либо структуры, существенно влияющие на титр ЛВ.
Рис. 3.
Анализ инфекционного титра конструкций, содержащих половины генов TRIM5α. а – Схемы ЛВ-конструкций, элементы ЛВ обозначены как на рис. 1а. б – Инфекционный титр конструкций, определенный на клетках SupT1 по флуоресценции eGFP-маркера. Инфекционный титр контрольного вектора eGFP-LV, принятого за 100%, составил 1 × 107 TU/мл; *p > 0.05 согласно критерию Манна–Уитни, n = 4.
Промотор Ef1α в составе ЛВ-конструкции снижает титр псевдовирусных частиц
Помимо последовательности целевого гена и его продукта на титр могут влиять и другие элементы ЛВ-конструкции. Анализируя причины низкого титра, мы акцентировали внимание на промоторе Ef1а, который в наших конструкциях обеспечивает экспрессию TRIM5α-HRH. С целью изучения влияния промотора получили следующие конструкции (рис. 4а): 1) Ef-PGK-eGFP-LV, в которой сохранен промотор Ef1α, но отсутствует последовательность гена TRIM5α-HRH; 2) noEf-TRIM-HRH-LV, содержащая только ген TRIM5α-HRH, без промотора Ef1α; 3) CMV-TRIM-HRH-LV, где мы заменили Ef1α на цитомегаловирусный промотор (CMV). Все конструкции содержали кассету pPGK-eGFP для экспрессии маркерного гена.
Рис. 4.
Влияние промотора на титр ЛВ. а – Схемы ЛВ-конструкций, элементы ЛВ обозначены, как и на рис. 1а. б – Инфекционный титр конструкций, определенный на клетках SupT1 по флуоресценции eGFP-маркера, n = 4. Инфекционный титр контрольного вектора eGFP-LV, принятого за 100%, составил 8 × 106 TU/мл.
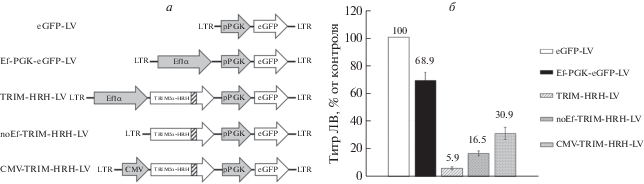
Наработка ЛВ и оценка их титров позволила установить, что добавление только промотора Ef1α в контрольный вектор приводит (как показывает анализ конструкции Ef-PGK-eGFP-LV) к снижению титра примерно на 30%. Удаление Ef1α из конструкции TRIM-HRH-LV или его замена на CMV-промотор приводит к увеличению титра конструкций noEf-TRIM-HRH-LV и CMV-TRIM-HRH-LV в 2.8 и 5.2 раза соответственно, по сравнению с TRIM-HRH-LV (рис. 4б). Следовательно, промотор Ef1α отрицательно влияет на титр ЛВ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Белок TRIM5α-HRH – перспективный для генотерапии ВИЧ-инфекции защитный фактор, блокирующий репликацию вируса [18, 19, 24]. Однако ЛВ, кодирующие ген TRIM5α-HRH, имеют низкий инфекционный титр, что усложняет процесс модификации первичных CD4+ клеток [20] и неизбежно увеличивает стоимость производства. Определение причин низкого титра ЛВ и поиск способов решения проблемы крайне актуальны, поскольку на этапе клинических исследований это может стать серьезным ограничением для применения данного вектора в генотерапии.
Мы определяли причины низкого титра созданных нами ЛВ, содержащих ген TRIM5α-HRH под контролем промотора Ef1α. При наработке ЛВ в клетках-продуцентах экспрессируется ген TRIM5α-HRH, находящийся на векторной плазмиде. Появление белка TRIM5α-HRH во время наработки частиц мы рассматривали в качестве основной причины низкого титра ЛВ, поскольку известно, что белки TRIM5α вовлечены в процесс снижения продукции ВИЧ-1 и ЛВ в клетках HEK293T [22, 23]. Это явление названо рестрикцией на позднем этапе жизненного цикла вируса. В первых работах было показано, что позднюю рестрикцию может обеспечивать только TRIM5α-rh [22]. Однако затем установили, что это не так, и huTRIM5α также ингибирует продукцию ВИЧ-1 [25]. В составе химерного белка TRIM5α-HRH большая часть принадлежит белку человека, поэтому следовало ожидать, что и он может влиять на титр ЛВ. Это предположение подтвердилось в результате проделанных нами экспериментов – оказалось, что белок TRIM5α-HRH, а также huTRIM5α в равной степени влияют на титр ЛВ, снижая его примерно в 2 раза. Чтобы устранить это влияние, необходимо исключить или существенно снизить экспрессию TRIM5α-HRH в клетках HEK293T во время наработки частиц. С этой целью можно использовать систему производства ЛВ, которая предотвращает экспрессию гена интереса в клетках-продуцентах. Описаны потенциально перспективные подходы, применимые для решения поставленной задачи [26–28]. Однако следует отметить, что влияние белка оказалось не столь существенным, как ожидалось.
Выяснилось, что присутствие промотора Ef1α снижает титр ЛВ-частиц. Влияние внутреннего промотора или его положения в векторе на титр ЛВ описано ранее [29, 30]. Наиболее вероятной причиной данного явления представляется интерференция внутреннего промотора с близко расположенными промоторами, включая промотор, контролирующий образование векторной РНК. Так, Ef1α обладает способностью подавлять другой промотор в составе ЛВ, который располагается выше Ef1α [31]. Аналогичным образом присутствие Ef1α в нашем векторе может подавлять промотор в составе LTR, который регулирует продукцию геномной РНК ЛВ. В основе интерференции между указанными промоторами может лежать конкуренция за связывание с факторами транскрипции [32]. Сайты связывания одних и тех же факторов транскрипции присутствуют в Ef1α и LTR [33, 34].
Интерференцией между Ef1α и нижележащим промотором PGK можно объяснить и снижение экспрессии eGFP в конструкциях, представленных на рис. 2а, поскольку такой эффект не наблюдался при удалении промотора Ef1α или при его замене на CMV (данные не представлены). Следует отметить, что в дальнейшем при переходе к клинической фазе исследований необходимо будет удалить маркерный ген и его промотор. Таким образом, в нашем случае интерференция между внутренними промоторами не имеет практической значимости.
Заменив промотор Ef1α на промотор CMV нам удалось существенно (в 5 раз) повысить титр вектора, несущего целевой ген TRIM5α-HRH. Однако эта конструкция может оказаться малоэффективной для генотерапии, так как промотор CMV проявляет слабую активность в целевых CD4+ клетках [35]. Кроме того, этот промотор подвержен метилированию, а активность экспрессии гена под его контролем постепенно снижается [36, 37]. Учитывая выявленное влияние промотора Ef1α на титр ЛВ, несущего ген TRIM-HRH, целесообразно будет провести поиск альтернативного промотора, который не будет препятствовать получению титра ЛВ, приемлемого для работы. При этом новый промотор должен обеспечивать длительную экспрессию трансгена в CD4+ лимфоцитах на уровне, достаточном для их защиты от ВИЧ-1, что усложняет поставленную задачу.
Мы установили, как минимум, две причины, обуславливающие низкий титр ЛВ, содержащего TRIM5α-HRH под контролем промотора Ef1α, – это способность белка TRIM5α-HRH снижать титр ЛВ во время наработки в клетках-продуцентах и присутствие промотора Ef1α в составе вектора. Однако не исключено, что на титр влияют и другие факторы. В частности, мы рассматривали последовательность гена TRIM5α-HRH per se как одну из рабочих версий, которая не нашла подтверждений. Кроме того, к параметрам, которые влияют на титр, относится длина ЛВ. Известно, что увеличение размера ЛВ-вставки неизбежно приводит к снижению титра [38, 39]. Промотор Ef1α и ген TRIM5α-HRH состоят из 1189 и 1488 п.н. соответственно, что может сказываться на титре ЛВ. Однако наши результаты показывают, что длина не является основной причиной низкого титра вектора TRIM-HRH-LV. К примеру, длина вектора CMV-TRIM-HRH-LV на 604 п.н. больше, чем у noEf-TRIM-HRH-LV (рис. 4а), но титр CMV-TRIM-HRH-LV при этом примерно в 2 раза выше. По всей видимости, причин, воздействующих на титр ЛВ, может быть множество, и оценить влияние каждого фактора не всегда просто. По-видимому, решить проблему низкого титра можно с помощью эмпирического подхода, который в перспективе позволит найти оптимальные комбинации элементов ЛВ-конструкции.
Написание статьи не потребовало специального финансирования.
Статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Bangsberg D.R. (2008) Preventing HIV antiretroviral resistance through better monitoring of treatment adherence. J. Infect. Dis. 197(S3), S272–S278.
Pasternak A.O., de Bruin M., Jurriaans S., Bakker M., Berkhout B., Prins J.M., Lukashov V.V. (2012) Modest nonadherence to antiretroviral therapy promotes residual HIV-1 replication in the absence of virological rebound in plasma. J. Infect. Dis. 206(9), 1443–1452.
Peterson C.W., Kiem H.P. (2017) Cell and gene therapy for HIV cure in HIV-1 latency. Curr. Top. Microbiol. Immunol. Eds Silvestri G., Lichterfeld M. Springer, Cham, 417, 211–248.
Ahlenstiel C.L., Turville S.G. (2019) Delivery of gene therapy to resting immune cells for an HIV cure. Curr. Opin. HIV AIDS. 14(2), 129–136.
Зайкова Е.К., Левчук К.Л., Поздняков Д.Ю., Дакс А.А., Зарицкий А.Ю., Петухов А.В. (2020) Эффективная трансдукция Т-лимфоцитов лентивирусными частицами в онкоиммунологических исследованиях. Клин. онкогематология. 13(3), 295–306.
Cartier N., Hacein-Bey-Abina S., Bartholomae C.C., Veres G., Schmidt M., Kutschera I., Vidaud M., Abel U., Dal-Cortivo L., Caccavelli L., Mahlaoui N., Kiermer V., Mittelstaedt D., Bellesme C., Lahlou N., Lefrère F., Blanche S., Audit M., Payen E., Leboulch P., l’Homme B., Bougnères P., Von Kalle C., Fischer A., Cavazzana-Calvo M., Aubourg P. (2009) Hematopoietic stem cell gene therapy with a lentiviral vector in X-linked adrenoleukodystrophy. Science. 326(5954), 818–823.
DiGiusto D.L., Krishnan A., Li L., Li H., Li S., Rao A., Mi S., Yam P., Stinson S., Kalos M., Alvarnas J., Lacey S.F., Yee J.K., Li M., Couture L., Hsu D., Forman S.J., Rossi J.J., Zaia J.A. (2010) RNA-based gene therapy for HIV with lentiviral vector-modified CD34+ cells in patients undergoing transplantation for AIDS-related lymphoma. Sci. Transl. Med. 2(36), 36ra43.
McGarrity G.J., Hoyah G., Winemiller A., Andre K., Stein D., Blick G., Greenberg R.N., Kinder C., Zo-lopa A., Binder-Scholl G., Tebas P., June C.H., Humeau L.M., Rebello T. (2013) Patient monitoring and follow-up in lentiviral clinical trials. J. Gene Med. 15(2), 78–82.
Lidonnici M.R., Paleari Y., Tiboni F., Mandelli G., Rossi C., Vezzoli M., Aprile A., Lederer C.W., Ambrosi A., Chanut F., Sanvito F., Calabria A., Poletti V., Mavilio F., Montini E., Naldini L., Cristofori P., Ferrari G. (2018) Multiple integrated non-clinical studies predict the safety of lentivirus-mediated gene therapy for β-thalassemia. Mol. Ther. Methods Clin. Dev. 11, 9–28.
Palfi S., Gurruchaga J.M., Lepetit H., Howard K., Ralph G.S., Mason S., Gouello G., Domenech P., Buttery P.C., Hantraye P., Tuckwell N.J., Barker R.A., Mitrophanous K.A. (2018) Long-term follow-up of a phase I/II study of proSavin, a lentiviral vector gene therapy for Parkinson’s disease. Hum. Gene Ther. Clin. Dev. 29(3), 148–155.
Cornetta K., Duffy L., Turtle C.J., Jensen M., Forman S., Binder-Scholl G., Fry T., Chew A., Maloney D.G., June C.H. (2018) Absence of replication-competent lentivirus in the clinic: analysis of infused T cell products. Mol. Ther. 26(1), 280–288.
Mamcarz E., Zhou S., Lockey T., Abdelsamed H., Cross S.J., Kang G., Ma Z., Condori J., Dowdy J., Triplett B., Li C., Maron G., Aldave Becerra J.C., Church J.A., Dokmeci E., Love J.T., da Matta Ain A.C., van der Watt H., Tang X., Janssen W., Ryu B.Y., De Ravin S.S., Weiss M.J, Youngblood B., Long-Boyle J.R., Gottschalk S., Meagher M.M., Malech H.L., Puck J.M., Cowan M.J., Sorrentino B.P. (2019) Lentiviral gene therapy combined with low-dose busulfan in infants with SCID-X1. N. Engl. J. Med. 380(16), 1525–1534.
Ferrua F., Cicalese M.P., Galimberti S., Giannelli S., Dionisio F., Barzaghi F., Migliavacca M., Bernardo M.E., Calbi V., Assanelli A.A., Facchini M., Fossati C., Albertazzi E., Scaramuzza S., Brigida I., Scala S., Basso-Ricci L., Pajno R., Casiraghi M., Canarutto D., Salerio F.A., Albert M.H., Bartoli A., Wolf H.M., Fiori R., Silvani P., Gattillo S., Villa A., Biasco L., Dott C., Culme-Seymour E.J., van Rossem K., Atkinson G., Valsecchi M.G., Roncarolo M.G., Ciceri F., Naldini L., Aiuti A. (2019) Lentiviral haemopoietic stem/progenitor cell gene therapy for treatment of Wiskott–Aldrich syndrome: interim results of a non-randomised, open-label, phase 1/2 clinical study. Lancet Haematol. 6(5), e239–e253.
Kohn D.B., Booth C., Kang E.M., Pai S.Y., Shaw K.L., Santilli G., Armant M., Buckland K.F., Choi U., De Ravin S.S., Dorsey M.J., Kuo C.Y., Leon-Rico D., Rivat C., Izotova N., Gilmour K., Snell K., Dip J.X., Darwish J., Morris E.C., Terrazas D., Wang L.D., Bauser C.A., Paprotka T., Kuhns D.B., Gregg J., Raymond H.E., Everett J.K., Honnet G., Biasco L., Newburger P.E., Bushman F.D., Grez M., Gaspar H.B., Williams D.A., Malech H.L., Galy A., Thrasher A.J., Net4CGD consortium (2020) Lentiviral gene therapy for X-linked chronic granulomatous disease. Nat. Med. 6(2), 200–206.
Stremlau M., Perron M., Welikala S., Sodroski J. (2005) Species-specific variation in the B30.2 (SPRY) domain of TRIM5alpha determines the potency of human immunodeficiency virus restriction. J. Virol. 79(5), 3139–3145.
Nakayama E.E., Shioda T. (2015) Impact of TRIM5α in vivo. AIDS. 29(14), 1733–1743.
Stremlau M., Owens C.M., Perron M.J., Kiessling M., Autissier P., Sodroski J. (2004) The cytoplasmic body component TRIM5alpha restricts HIV-1 infection in Old World monkeys. Nature. 427(6977), 848–853.
Sawyer S.L., Wu L.I., Emerman M., Malik H.S. (2005) Positive selection of primate TRIM5alpha identifies a critical species-specific retroviral restriction domain. Proc. Natl. Acad. Sci. USA. 102(8), 2832–2837.
Anderson J., Akkina R. (2008) Human immunodeficiency virus type 1 restriction by human-rhesus chimeric tripartite motif 5alpha (TRIM 5alpha) in CD34+ cell-derived macrophages in vitro and in T cells in vivo in severe combined immunodeficient (SCID-hu) mice transplanted with human fetal tissue. Hum. Gene Ther. 19(3), 217–228.
Омельченко Д.О., Глазкова Д.В., Богословская Е.В., Урусов Ф.А., Жогина Ю.А., Цыганова Г.М., Шипулин Г.А. (2018) Защита лимфоцитов от ВИЧ с помощью лентивирусного вектора, несущего комбинацию генов TRIM5α-HRH и микроРНК против CCR5. Молекуляр. биология. 52(2), 294–305.
Жогина Ю.А., Глазкова Д.В., Ветчинова А.С., Богословская Е.В., Цыганова Г.М., Шипулин Г.А. (2014) Сравнительная оценка активности различных генетических конструкций, направленных на подавление репликации ВИЧ-1. Биофармацевтический журн. 6(5), 11–18.
Sakuma R., Noser J.A., Ohmine S., Ikeda Y. (2007) Rhesus monkey TRIM5alpha restricts HIV-1 production through rapid degradation of viral Gag polyproteins. Nat. Med. 13(5), 631–635.
Sakuma R., Ohmine S., Ikeda Y. (2010) Determinants for the rhesus monkey TRIM5alpha-mediated block of the late phase of HIV-1 replication. J. Biol. Chem. 285(6), 3784–3793.
Глазкова Д.В., Урусов Ф.А., Богословская Е.В., Шипулин Г.А. (2020) Фактор рестрикции ретровирусов TRIM5α: механизм действия и перспективы использования в генной терапии ВИЧ-инфекции Молекуляр. биология. 54(5), 707–717.
Zhang F., Perez-Caballero D., Hatziioannou T., Bieniasz P.D. (2008) No effect of endogenous TRIM5alpha on HIV-1 production. Nat. Med. 14(3), 235–236.
Bagnis C., Zwojsczyki G., Chiaroni J., Bailly P. (2014) Off-on polyadenylation strategy as a supplemental mechanism for silencing toxic transgene expression during lentiviral vector production. Biotechniques. 56(6), 311–312, 314–318.
Maunder H.E., Wright J., Kolli B.R., Vieira C.R., Mkandawire T.T., Tatoris S., Kennedy V., Iqball S., Devarajan G., Ellis S., Lad Y., Clarkson N.G., Mitrophanous K.A., Farley D.C. (2017) Enhancing titres of therapeutic viral vectors using the transgene repression in vector production (TRiP) system. Nat. Commun. 27(8), 14834.
Delviks-Frankenberry K.A., Ackerman D., Timberlake N.D., Hamscher M., Nikolaitchik O.A., Hu W.S., Torbett B.E., Pathak V.K. (2019) Development of lentiviral vectors for HIV-1 gene therapy with Vif-resistant APOBEC3G. Mol. Ther. Nucl. Acids. 18, 1023–1038.
Liu Y.P., Vink M.A., Westerink J.T., de Arellano E.R., Konstantinova P., Ter Brake O., Berkhout B. (2010) Titers of lentiviral vectors encoding shRNAs and miRNAs are reduced by different mechanisms that require distinct repair strategies. RNA. 16(7), 1328–1339.
Ben-Dor I., Itsykson P., Goldenberg D., Galun E., Reubinoff B.E. (2006) Lentiviral vectors harboring a dual-gene system allow high and homogeneous transgene expression in selected polyclonal human embryonic stem cells. Mol. Ther. 14(2), 255–267.
Curtin J.A, Dane A.P., Swanson A., Alexander I.E., Ginn S.L. (2008) Bidirectional promoter interference between two widely used internal heterologous promoters in a late-generation lentiviral construct. Gene Ther. 15(5), 384–390.
Karreth F.A., Tay Y., Pandolfi P.P. (2014) Target competition: transcription factors enter the limelight. Genome Biol. 15, 114.
Rad S.M.A.H., Poudel A., Tan G.M.Y., McLellan A.D. (2020) Promoter choice: who should drive the CAR in T cells? PLoS One. 15 (7), e0232915.
Roebuck K.A., Saifuddin M. (1999) Regulation of HIV-1 transcription. Gene Expr. 8(2), 67–84.
Jones S., Peng P.D., Yang S., Hsu C., Cohen C.J., Zhao Y., Abad J., Zheng Z., Rosenberg S.A., Morgan R.A. (2009) Lentiviral vector design for optimal T cell receptor gene expression in the transduction of peripheral blood lymphocytes and tumor-infiltrating lymphocytes. Hum. Gene Ther. 20(6), 630–640.
Brooks A.R., Harkins R.N., Wang P., Qian H.S., Liu P., Rubanyi G.M. (2004) Transcriptional silencing is associated with extensive methylation of the CMV promoter following adenoviral gene delivery to muscle. J. Gene Med. 6(4), 395–404.
Yang Y., Chusainow M.J., Yap M.G. (2010) DNA methylation contributes to loss in productivity of monoclonal antibody-producing CHO cell lines. J. Biotechnol. 147(3–4), 180–185.
Kumar M., Keller B., Makalou N., Sutton R.E. (2001) Systematic determination of the packaging limit of lentiviral vectors. Hum. Gene Ther. 12(15), 1893–1905.
Canté-Barrett K., Mendes R.D., Smits W.K., van Helsdingen-van Wijk Y.M., Pieters R., Meijerink J.P. (2016) Lentiviral gene transfer into human and murine hematopoietic stem cells: size matters. BMC Res. Notes. 9, 312.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


