Молекулярная биология, 2022, T. 56, № 3, стр. 418-427
МикроРНК miR-375 как многофункциональный регулятор сердечно-сосудистой системы
Н. А. Матвеева a, b, Н. М. Баулина a, b, И. С. Киселев a, b, Б. В. Титов a, b, О. О. Фаворова a, b, *
a Национальный медицинский исследовательский центр кардиологии Министерства здравоохранения
Российской Федерации
121552 Москва, Россия
b Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Министерства здравоохранения Российской Федерации
117997 Москва, Россия
* E-mail: olga_favorova@mail.ru
Поступила в редакцию 21.09.2021
После доработки 12.10.2021
Принята к публикации 12.10.2021
- EDN: DWACQF
- DOI: 10.31857/S0026898422020100
Аннотация
МикроРНК miR-375 действует как многофункциональный регулятор активности многих физиологических и патологических клеточных процессов путем взаимодействия с большим числом генов-мишеней. Эта микроРНК вовлечена в регуляцию дифференцировки и функционирования клеток нервной и иммунной систем, костной и жировой ткани и даже жизненного цикла ряда вирусов. Изменения экспрессии miR-375 обнаружены при канцерогенезе, воспалении, аутоиммунных и сердечно-сосудистых заболеваниях. С каждым годом появляются новые исследования, расширяющие наше представление о круге процессов, регулируемых этой микроРНК. Согласно последним данным, miR-375 может быть использована в качестве биомаркера и терапевтической мишени при некоторых заболеваниях. В этом обзоре обсуждается роль miR-375 в функционировании сердечно-сосудистой системы в норме и при патологических состояниях.
ВВЕДЕНИЕ
МикроРНК – класс одноцепочечных некодирующих РНК длиной 21–23 н. Эти РНК регулируют экспрессию генов на транскрипционном и/или посттранскрипционном уровне за счет специфического связывания с 3′-нетранслируемой областью своих мРНК-мишеней, что приводит к последующей деградации этих мРНК и/или блокированию процесса их трансляции [1]. Опосредованная микроРНК регуляция экспрессии генов описана у животных, растений, зеленых водорослей и некоторых вирусов [2]. По данным последней версии miRBase (выпуск 22) всего у 271 вида найдено 48860 зрелых микроРНК, из них 2654 идентифицированы в организме человека [3]. Гены микроРНК обычно располагаются в межгенных областях или в интронах кодирующих и некодирующих генов; они транскрибируются в виде первичных транскриптов (при-микроРНК) и далее подвергаются многоступенчатому биогенезу, при котором сначала процессируются в пре-микроРНК и, наконец, в зрелые микроРНК. Гены микроРНК могут транскрибироваться как поодиночке, так и в составе кластера в виде полицистронного транскрипта. Зрелые микроРНК содержат на 5'-конце затравочную область (область узнавания мишени длиной 6–8 н.), которая в первую очередь отвечает за связывание микроРНК с мРНК-мишенью [4]. МикроРНК на основании сходства последовательности их затравочных областей группируются в семейства [5].
Экспрессия отдельных микроРНК в зависимости от типа клеток и стадии эмбрионального и постэмбрионального развития варьирует от высокоспецифичной до повсеместной, причем различия в профилях микроРНК между клеточными линиями и тканями в основном обусловлены изменениями в экспрессии относительно небольшого числа микроРНК [6].
Для микроРНК характерна плейотропность (одна микроРНК может связываться со многими мРНК-мишенями) и вырожденность или избыточность (уровень одной мРНК может регулироваться многими микроРНК) [7]. Формируя сложную регуляторную сеть, молекулы микроРНК обеспечивают дополнительный контроль различных биологических процессов, таких как развитие и старение организма [8, 9], пролиферация и дифференцировка отдельных клеточных популяций [10, 11], апоптоз [12], иммунный ответ [13], проведение сигнала [14], метаболизм [15] и др. Показано участие отдельных микроРНК в развитии различных заболеваний [7, 16, 17], в том числе сердечно-сосудистых [18, 19].
Настоящий обзор посвящен роли одной из микроРНК – miR-375 – в развитии и функционировании сердечно-сосудистой системы в норме и при патологии. Согласно современным представлениям, miR-375, первоначально описанная как наиболее экспрессируемая в бета-клетках поджелудочной железы [20], действует как многофункциональный регулятор различных клеточных путей [21].
ГЕН MIR375 И РЕГУЛЯЦИЯ ЕГО ЭКСПРЕССИИ
Ген MIR375 человека, кодирующий микроРНК miR-375, расположен в межгенной области на хромосоме 2 [22]. Он локализован в области 2q35 между генами CRYBA2 (Crystallin Beta A2) и CFAP65 (Cilia- and flagella-associated protein 65, coiled-coil domain-containing protein 108) и транскрибируется с собственного промотора с помощью РНК-полимеразы II с образованием при-микроРНК (primary miRNA) pri-miR-375 (рис. 1). В результате гидролиза pri-miR-375 с помощью микропроцессорного комплекса, включающего РНКазу III Drosha и белок DGCR8 (DiGeorge syndrome critical region gene), образуется предшественник микроРНК (precursor miRNA) pre-miR-375, который представляет собой шпильку длиной ~70 н., состоящую из двухцепочечного стебля и одноцепочечного участка со свободным 3'-концом. После транспорта pre-miR-375 в цитоплазму мультибелковый комплекс, включающий РНКазу III Dicer, вырезает петлевой участок pre-miR-375 с образованием дцРНК длиной 21–23 п.н., состоящей из зрелых miR-375-3p и miR-375-5p [23]. Далее в обзоре мы будем уточнять, какую из зрелых miR-375 изучали исследователи, если эта информация была предоставлена.
Рис. 1.
Хромосомная локализация гена MIR375 и биогенез зрелой микроРНК. а – Структура области гена MIR375. Ген MIR375 располагается в локусе 2q35 (поблизости от генов FEV, CRYBA2, LOC120977024, LOC100129175 и CFAP65) и транскрибируется с собственного промотора. На расстоянии 24 н. от точки начала транскрипции (transcription start site, TSS) располагаются ТAТА-бокс и три E-бокса (Е1, Е2 и Е3). Показаны два CpG-островка; для поддержания активной экспрессии MIR375 CpG-1 должен быть гиперметилирован, а CpG-2 – гипометилирован. б – Процессинг miR-375. После синтеза первичного транскрипта гена MIR375 (pri-miR-375) происходит его ядерный процессинг с образованием микроРНК-предшественника (pre-miRNA-375) и транспорт последнего в цитоплазму, где образуются зрелые микроРНК (miR-375-3p и miR-375-5p).
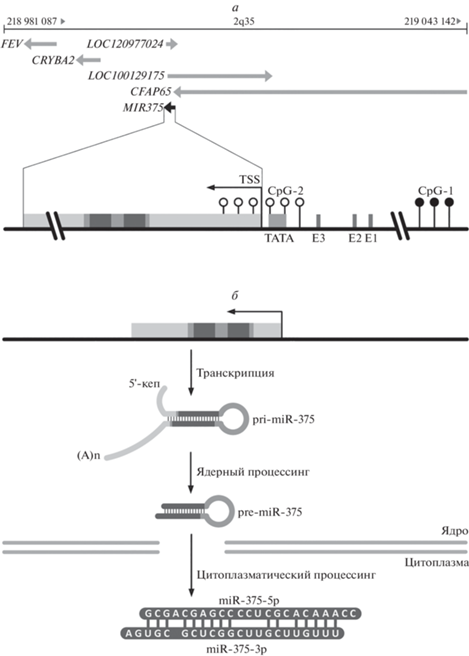
Перед геном MIR375 расположена высоко консервативная область, содержащая TATA-бокс и три E-бокса [24]. С ТАТА-боксом связывается РНК-полимераза II, которая транскрибирует MIR375. С E-боксами могут связываться факторы транскрипции, имеющие мотив спираль-петля-спираль, которые опосредуют инициацию транскрипции и регулируют экспрессию miR-375 (рис. 1).
Помимо транскрипционных факторов, на экспрессию miR-375 могут оказывать влияние эпигенетические факторы, в частности, метилирование ДНК. Найдены два CpG-островка (рис. 1), метилирование цитозинов в которых может регулировать экспрессию miR-375 у людей: первый (CpG-1) находится на 2000 п.н. выше гена и имеет размер примерно 700 п.н., а второй (CpG-2) охватывает примерно 850 п.н. и перекрывается с сайтом начала транскрипции. Оказалось, что активная транскрипция MIR375 происходит при гиперметилировании первого сайта и гипометилировании второго [25].
В регуляторной области гена MIR375 обнаружены консенсусные последовательности для связывания фактора транскрипции CTCF. Белок CTCF – многофункциональный транскрипционный фактор, содержащий 11 мотивов цинковых пальцев, может действовать и как активатор, и как репрессор транскрипции. Предполагают, что связывание CTCF с неметилированной ДНК в CpG-1 блокирует транскрипцию miR-375, в то время как метилирование этой области препятствует взаимодействию ДНК с CTCF и тем самым активирует транскрипцию [25].
При патологических состояниях наблюдаются изменения уровня экспрессии гена MIR375 (в том числе активируется его эктопическая экспрессия), обусловленные, в основном, изменением метилирования его промотора или активностью кольцевых и других некодирующих РНК, выступающих в роли “микроРНК-губок” [21, 26].
Наиболее полно нарушение регуляции экспрессии miR-375 изучено при онкологических заболеваниях и при сахарном диабете. Исследование метилирования промотора гена miR-375, которое проводилось на различных клеточных линиях человека, включая гепатокарциному и меланому, показало, что статус метилирования отрицательно коррелирует с уровнем экспрессии miR-375. Нарушение метилирования промотора рассматривается как одна из причин снижения уровня miR-375, которое часто наблюдается при разных видах злокачественных опухолей [23]. В целом, опухолевые клетки человека имеют высокий уровень метилирования промотора гена miR-375 и, как следствие, низкий уровень miR-375 по сравнению с нормальными тканями.
МикроРНК miR-375 КАК РЕГУЛЯТОР СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
Опубликованные данные об участии miR-375 в физиологических процессах, происходящих в сердечно-сосудистой системе человека, весьма немногочисленны. В основном изучают возможность использования этой микроРНК в качестве биомаркера различных сердечно-сосудистых заболеваний (ССЗ) или проводят эксперименты на животных или клеточных линиях.
Cao и соавт. показали, что miR-375 экспрессируется на высоком уровне в сердце мыши в эмбриогенезе [27], а нарушение экспрессии miR-375 ассоциировано с врожденным пороком сердца (ВПС). Так, значительное повышение уровня miR-375 по сравнению с контролем наблюдали в миокарде межжелудочковой перегородки у 22-недельных плодов с дефектом межжелудочковой перегородки [28]. Избыточная экспрессия miR-375 нарушала эмбриональное развитие сердца у рыб Danio rerio: выявлено снижение частоты сердечных сокращений, отек перикарда и аномальное образование сердечной петли [29].
Связанные с ВПС изменения в экспрессии miR-375 обнаружены у беременных: у женщин, носящих плод с ВПС, в сыворотке крови значительно повышен уровень miR-375-3р, наряду с miR-19b, miR-22 и miR-29c, что может быть использовано для пренатальной диагностики пороков сердца на 18–22 неделе беременности [30]. В работе [31] подтверждено повышение уровня miR-375 в сыворотке крови женщин, вынашивающих плод с ВПС, а также описан возможный механизм влияния miR-375 на кардиомиоциты при ВПС. Поскольку ВПС часто приводит к гипоксии миокарда, для изучения функциональной роли miR-375 использовали миобласты крысы H9c2, находящиеся в состоянии хронической гипоксии, которая индуцирует снижение жизнеспособности клеток H9c2, повышение скорости апоптоза и возрастание активности каспазы-3, что сопровождалось повышением уровня miR-375-3p. Сверхэкспрессия miR-375-3p способствовала индуцированному гипоксией апоптозу в клетках H9c2, тогда как нокдаун miR-375-3p препятствовал его развитию [31]. Обсуждается возможность оценки уровня miR-375-3p в материнской сыворотке в качестве потенциального биомаркера для пренатального выявления пороков сердца плода.
Существуют некоторые противоречия между результатами [31] и данными работы [32], опубликованной приблизительно в то же время и выполненной также на клетках H9c2. В ней утверждается, что повреждение клеток H9c2, вызванное гипоксией с последующей реоксигенацией, которое приводит к значительному увеличению скорости апоптоза и активности каспазы-3, напротив, сопровождается понижением уровня miR-375, а сверхэкспрессия miR-375 заметно снижает апоптоз и уровни каспазы-3 по сравнению с нормальными клетками. Авторы даже предлагают использовать при инфаркте миокарда (ИМ) miR-375-мимики (mimic-miR-375) – синтетические короткие двухцепочечные олигонуклеотиды, имитирующие предшественники микроРНК [32]. Возможным объяснением различий, полученных в цитированных работах, могут быть особенности гипоксического воздействия, применявшегося в этих исследованиях. В [31] анализировали клетки в состоянии хронической гипоксии и наблюдали постепенное нарастание уровня miR-375 через 24, 48 и 72 ч после начала воздействия, а в [32] снижение уровня miR-375 детектировали после гипоксии в течение 24 ч с последующей реоксигенацией в течение 6 ч.
Показана также вовлеченность miR-375 в развитие заболеваний сердца, обусловленных атеросклерозом, к которым в первую очередь относят ишемическую болезнь сердца и ее наиболее тяжелую клиническую форму – острый ИМ. Как известно, ведущую роль в развитии атеросклероза играет воспаление, в котором принимают активное участие различные клетки иммунной системы [33]. Недавно на распространенной модели атеросклероза у мышей с дефицитом ApoE детально описали роль miR-375 в функционировании клеток иммунной системы [34]. Наблюдали повышенную экспрессию miR-375 в атеросклеротических бляшках в аорте, в макрофагах костного мозга и перитонеальных макрофагах, полученных от таких мышей. Ингибирование miR-375 значительно снижало образование пенистых клеток, что сопровождалось усиленной экспрессией генов, участвующих в оттоке холестерина, и снижением экспрессии генов, участвующих в притоке холестерина. Кроме того, подавление экспрессии miR-375 способствовало увеличению экспрессии маркеров противовоспалительных макрофагов M2 и снижению – провоспалительных макрофагов M1; сверхэкспрессия miR-375 приводила к противоположным результатам. В итоге снижение образования пенистых клеток и ослабление провоспалительного ответа макрофагов приводили к замедлению развития атеросклероза у мышей с дефицитом ApoE [34].
Значительный интерес представляют данные о том, что уровень циркулирующей miR-375 в плазме крови больных значимо понижается после ИМ, вследствие чего эта микроРНК может рассматриваться, наряду с рядом других микроРНК, в качестве маркера ИМ. Анализ уровней различных микроРНК в плазме периферической крови с использованием ДНК-микрочипа [35] или высокопроизводительного секвенирования [36] показал, что у больных ИМ с подъемом сегмента ST уровень miR-375 существенно снижается в течение суток после появления первых симптомов заболевания в сравнении со здоровыми индивидами. Эти результаты валидированы в обеих работах методом полимеразной цепной реакции с обратной транскрипцией. Спустя 5 дней после ИМ различия между уровнями циркулирующей miR-375 у больных и в контроле становились незначимыми [35]. Поскольку известны механизмы избирательного транспорта микроРНК из сосудистого русла в окружающие ткани путем эндоцитоза экзосом и микровезикул [37, 38], предположили, что причиной снижения уровня miR-375 в плазме может быть ее активный импорт в клетки, участвующие в патогенезе ИМ [36]. Мы оценили диагностический потенциал снижения уровня miR-375 в плазме больных ИМ, используя величину площади под ROC-кривой (Area Under The ROC Curve, AUC), и показали высокую эффективность классификатора (AUC = 0.94) [32]. Уменьшение уровня miR-375 в плазме крови наблюдали также у больных системной красной волчанкой при развитии у них атеросклероза [39]. Не выявлено различий в уровне циркулирующей miR-375 у больных ИМ разного типа [40].
Данные об изменении уровня miR-375 в плазме крови при ишемии, полученные в экспериментах с модельными животными, не столь однозначны. Согласно [35], ни острая ишемия миокарда, ни острая ишемия задних конечностей у мышей не приводили к существенному изменению уровня miR-375 в плазме. Однако в работе [32] снижение уровня этой микроРНК наблюдали в плазме крови мышей с острым ИМ.
В отличие от плазмы крови, где уровень miR-375 при ИМ снижается, в тканях сердца он, напротив, повышается [41, 42]. Так, подавление экспрессии miR-375 с помощью анти-miR-375 при экспериментальном ИМ у мышей снижает воспалительную реакцию, уменьшает апоптоз кардиомиоцитов в ишемизированном миокарде и размер зоны инфаркта, улучшает функцию левого желудочка и реваскуляризацию [41]. Похожий эффект достигается и при трансплантации в зону ишемизированного миокарда стволовых клеток костного мозга (BMPAC), в которых предварительно проведен ex vivo нокдаун гена miR-375 [42]. На моделях экспериментального ИМ in vivo и гипоксического повреждения желудочковых кардиомиоцитов новорожденных мышей in vitro показано, что подавление апоптоза после ИМ обусловлено связыванием miR-375 длинной некодирующей РНК LNC_000898 [26].
Четырехлетнее проспективное исследование, направленное на сравнение уровней циркулирующих микроРНК у больных острым коронарным синдромом и ишемическим инсультом, не выявило различий в уровне miR-375 и ее связи с последующими сердечно-сосудистыми событиями [43] При атеросклерозе внутренних сонных артерий уровень miR-375 в сыворотке крови коррелировал с типом бляшки: в фиброзных бляшках он был выше, чем в богатых липидами, тромботических и кальцифицированных бляшках [44].
Многие заболевания сердца в конечном итоге приводят к хронической сердечной недостаточности (ХСН). Анализ in silico выявил, что miR-375 в числе других микроРНК ассоциирована с ремоделированием левого желудочка и прогрессированием ХСН после ИМ [45]. Показано, что циркулирующую miR-375 можно использовать для дифференциальной диагностики форм ХСН с сохраненной и со сниженной фракцией выброса: ее уровень был ниже у больных со сниженной фракцией выброса, а наилучшие результаты для дифференциальной диагностики (AUC = 0.854) давала совместная оценка уровней натрийуретического пептида типа В и miR-328, -30c, -221 и -375 [46].
Исследование механизма действия miR-375 при ХСН проведено in vivo на мышиной модели сердечной недостаточности, вызванной доксорубицином, и in vitro на кардиомиоцитах крыс (H9c2) и кардиомиоцитах мышей, обработанных доксорубицином. Доксорубицин значительно усиливал экспрессию miR-375 in vitro и in vivo, а ингибирование miR-375 восстанавливало окислительно-восстановительный гомеостаз миокарда, предотвращало индуцированный доксорубицином окислительный стресс и апоптоз кардиомиоцитов [47].
Опубликованы единичные работы, в которых оценивали уровень miR-375 при других заболеваниях сердечно-сосудистой системы: фибрилляции предсердий [48], поражении миокарда при сепсисе [49], гипертрофии миокарда [50, 51] и др. Не выявлено изменений в уровне циркулирующей miR-375 при фибрилляции предсердий [48]. Уменьшение экспрессии miR-375-3p наблюдали в миокарде крыс с экспериментальным сепсисом, а повышение или понижение miR-375-3p уменьшало или усиливало повреждение миокарда соответственно [49].
Пилотное исследование на 10 животных выявило снижение уровня miR-375 в сыворотке крови собак с миксоматозной дегенерацией митрального клапана, приводящей к эксцентрической гипертрофии сердца, по сравнению с контрольной группой [51].
Гипертрофия сердца у крыс, вызванная поперечным сужением аорты, а также гипертрофия кардиомиоцитов in vitro, индуцированная ангиотензином II, приводили к увеличению экспрессии miR-375-3р. Нокдаун miR-375-3p уменьшал гипертрофию кардиомиоцитов, снижал уровни мРНК и белка тяжелой цепи β-миозина и натрийуретического пептида типа В, т.е. уменьшал проявления гипертрофии и вызванной ею сердечной недостаточности. Проведенное на тех же моделях параллельное определение уровня лактатдегидрогеназы B (LDHB) – одного из ключевых ферментов клеточного метаболизма – показало, что эффект LDHB противоположен эффекту miR-375. При этом наличие сайта связывания miR-375 в мРНК LDHB позволило предположить, что нокдаун miR-375-3p подавляет вызванную ангиотензином II гипертрофию кардиомиоцитов за счет увеличения экспрессии LDHB [50].
Несмотря на ограниченное число клинических исследований, можно констатировать, что miR-375 является перспективным биомаркером различных ССЗ, особенно в сочетании с другими потенциальными маркерами. Как показывают эксперименты на модельных животных и клеточных линиях, представление о miR-375, как о новом многофункциональном регуляторе [21], полностью справедливо для сердечно-сосудистой системы в норме и при патологии.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ДЕЙСТВИЯ микроРНК miR-375 ПРИ ССЗ
МикроРНК miR-375, как и другие микроРНК, характеризуются плейотропностью: согласно miRTarBase – базе данных по экспериментально подтвержденным мишеням микроРНК [52], мишенями miR-375 служат более 450 различных генов. При этом опубликованные к настоящему моменту исследования в основном посвящены механизмам молекулярного действия miR-375 в контексте ее влияния на сигнальный каскад PI3K/PDK1/Akt1.
При экспериментальном ИМ у мышей ведение анти-miR-375 нарушало связывание miR-375 с PDK1 и таким образом способствовало активации сигнального каскада PI3K/PDK1/Akt1. Это воздействие оказывало терапевтический эффект на клетки ишемизированного миокарда, снижая воспалительный ответ, подавляя апоптоз кардиомиоцитов и улучшая функции левого желудочка [41, 42]. С использованием доксорубициновой модели ХСН показано, что ингибирование miR-375 повышает активность PI3K/PDK1/Akt1, уменьшает повреждение миокарда и апоптоз кардиомиоцитов в первую очередь за счет нарушения связывания miR-375 с транскриптом гена PDK1 [47].
Напротив, по данным [49], связывание miR-375 с глобальным регулятором транскрипции BRD4 приводит к активации пути PI3K/PDK1/Akt1 и уменьшению повреждений миокарда у крыс с сепсисом. Показано также, что miR-375 связывается с 3'-UTR мРНК фактора роста соединительной ткани Ctgf, который способен активировать каскад PI3K/PDK1/Akt1; однако воздействие мимика miR-375 на клетки PC12 после ишемии/реперфузии усиливало экспрессию PI3K, Akt1 и p21, а также приводило к усилению миграции и пролиферации клеток [53]. Эти данные свидетельствуют о сложности регуляторных воздействий miR-375, нарушение равновесия между которыми в разных условиях приводит к разнонаправленному влиянию на сигнальный каскад PI3K/PDK1/Akt1. Можно предположить, что такое разнонаправленное действие miR-375 определяется ее плейотропностью, поскольку многие из ее многочисленных генов-мишеней участвуют в антагонистичных процессах.
В последние годы для поиска ключевых генов-мишеней микроРНК все чаще применяется биоинформатический анализ, что позволяет выделить среди всего множества мишеней те, которые могут иметь наибольшее функциональное значение при тех или иных физиологических или патологических состояниях.
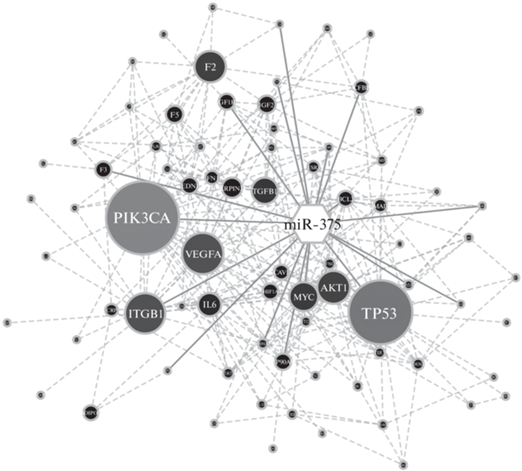
С целью поиска генов, преимущественно вовлеченных в развитие ССЗ, в исследовании [36] из числа всех экспериментально подтвержденных генов-мишеней miR-375 выбраны те, связь которых с ССЗ, согласно базе данных DisGenNet [54], показана в двух или более работах. Таких генов оказалось 21: ADIPOR2, BCL2, CASP3, CDKN2B, CTGF, F3, HSP90AA1, IGF1R, IGFBP3, INSIG2, ITGB1, MYC, NPPB, PARP1, PIK3CA, PROCR, PTPN1, SGMS2, TNNI3, TP53, YWHAZ (рис. 2). Одним из двух центральных элементов в сети взаимодействий этих генов ожидаемо был ключевой участник сигнального каскада PI3K/PDK1/Akt1 – ген PIK3CA. Вторым таким геном оказался TP53, который кодирует белок-онкосупрессор р53.
Рис. 2.
Сеть взаимодействий miR-375 (шестиугольник) и ее генов-мишеней, вовлеченных в развитие ССЗ (кружки). Сплошными линиями обозначены взаимодействия miR-375 c ее генами-мишенями, пунктирными – взаимодействия между мишенями. Возрастание размеров и градиент цвета кружков от черного к серому показывают увеличение параметра центральности генов-мишеней в сети их взаимодействия [36].
Появление открытых наборов данных о совокупности транскриптов (транскриптомном профиле) ткани сердца, полученных с использованием высокопроизводительных методов, позволило применить похожий подход для поиска генов-мишеней miR-375, экспрессия которых специфична для миокарда. Гены-мишени miR-375, экспрессирующиеся в сердечной мышце, были отобраны с использованием баз данных The Human Protein Atlas [55], miRTarBase [52] и STRING [56]. Ключевыми звеньями сети их взаимодействий, помимо PIK3CA, уже идентифицированного ранее [36], оказались гены RHOA, MAPK3, PAFAH1B1, CTNNB1, MYC, PRKCA, ERBB2 и CDC42. Анализ перепредставленности этих генов в известных сигнальных путях показал, что основная функция miR-375 в сердечной мышце может состоять в регуляции сигнальных путей, зависимых от Rho-GTPаз [57].
В ряде экспериментальных работ обнаружено, что ключевыми генами-мишенями miR-375 в сердечно-сосудистой системе могут служить гены сигнального пути Notch, очень важного для развития аортального клапана, желудочков, атриовентрикулярного канала и других структур сердца. Повышенная экспрессия miR-375-3p приводила к апоптозу, ингибированию пролиферации и дифференцировки клеток линии Р19 в кардиомиоциты in vitro через сигнальный путь Notch [28]. В эндотелиальных клетках микрососудов легких (PMEC, Pulmonary Microvascular Endothelial Cells) miR-375-3p подавляла экспрессию Notch1 [58]. У D. rerio избыточная экспрессия miR-375 приводила к подавлению многих генов, в том числе notch2, и нарушала эмбриональное развитие сердца [29].
В единичных работах обнаружено влияние miR-375 и на другие сигнальные пути. Согласно [31], в клетках H9c2 miR-375-3p подавляет экспрессию фактора транскрипции FOXP1, который участвует в морфогенезе сердца, мозга и легких, и Bcl2-подобного антиапоптотического белка. В тех же клетках, трансфицированных miR-375-мимиком, значительно увеличивалась экспрессия мРНК протеинкиназы NLK и самого фермента, входящего в семейство митоген-активируемых протеинкиназ и участвующего в регуляции пролиферации и дифференцировки кардиомиоцитов [32]. В клетках иммунной системы мышей с дефицитом ApoE нокдаун miR-375 стимулировал экспрессию фактора транскрипции KLF4, который участвует в поляризации макрофагов и способствует их переходу к M2-фенотипу [34]. Важно отметить, что выраженность регуляторных эффектов микроРНК на их гены-мишени может зависеть не только от уровня экспрессии самих микроРНК, но и от наличия в мРНК-мишенях полиморфных вариантов в области их связывания с микроРНК. Так, при изучении 10 полиморфных вариантов генов, связанных с кардиометаболическими фенотипами, показано [59], что полиморфизмы, расположенные в сайтах посадки микроРНК, могут влиять на взаимодействие микроРНК с мРНК-мишенью. В частности, это показано для полиморфизма rs11735092, расположенного в сайте посадки miR-375 в гене HSD17B13 (Hydroxysteroid 17-Beta Dehydrogenase 13). Этот ген участвует в регуляции гомеостаза липидов печени, и носительство аллеля rs11735092*С препятствует микроРНК-зависимой регуляции экспрессии и способствует липогенезу [59].
В целом, полученные к настоящему моменту экспериментальные данные свидетельствуют о том, что основные молекулярные эффекты miR-375 при ССЗ связаны в первую очередь с регуляцией экспрессии ряда важнейших компонентов сигнальных каскадов PI3K/PDK1/Akt1 и Notch, а результаты анализа in silico указывают на вовлечение этой микроРНК еще и в тесно связанные с этими каскадами p53- и Rho-зависимые сигнальные пути, участвующие в поддержании равновесия между смертью и выживанием клетки. Все это делает miR-375 важным участником процессов, связанных с ответом клетки на гипоксические воздействия и воспалительные реакции, занимающие центральное положение в патогенезе многих распространенных ССЗ.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (грант № 20-015-00123).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Jonas S., Izaurralde E. (2015) Towards a molecular understanding of microRNA-mediated gene silencing. Nat. Rev. Genet. 16, 421–433.
Kamanu T.K.K., Radovanovic A., Archer J.A.C., Bajic V.B. (2013) Exploration of miRNA families for hypotheses generation. Sci. Rep. 3, 2940.
Kozomara A., Birgaoanu M., Griffiths-Jones S. (2019) miRBase: from microRNA sequences to function. Nucl. Acids Res. 47, D155–162.
Bartel D.P. (2009) MicroRNAs: target recognition and regulatory functions. Cell. 136, 215–233.
Lim L.P., Lau N.C., Weinstein E.G., Abdelhakim A., Yekta S., Rhoades M.W., Burge C.B., Bartel D.P. (2003) The microRNAs of Caenorhabditis elegans. Genes Dev. 17, 991–1008.
Landgraf P., Rusu M., Sheridan R., Sewer A., Iovino N., Aravin A., Pfeffer S., Rice A., Kamphorst A.O., Landthaler M., Lin C., Socci N.D., Hermida L., Fulci V., Chiaretti S., Foà R., Schliwka J., Fuchs U., Novosel A., Müller R.U., Schermer B., Bissels U., Inman J., Phan Q., Chien M., Weir D.B., Choksi R., De Vita G., Frezzetti D., Trompeter H.I., Hornung V., Teng G., Hartmann G., Palkovits M., Di Lauro R., Wernet P., Macino G., Rogler C.E., Nagle J.W., Ju J., Papavasiliou F.N., Benzing T., Lichter P., Tam W., Brownstein M.J., Bosio A., Borkhardt A., Russo J.J., Sander C., Zavolan M., Tuschl T. (2007) A mammalian microRNA expression atlas based on small RNA library sequencing. Cell. 129, 1401–1414.
Baulina N.M., Kulakova O.G., Favorova O.O. (2016) MicroRNAs: the role in autoimmune inflammation. Acta Naturae. 8, 21–33.
Ivey K.N., Srivastava D. (2015) microRNAs as developmental regulators. Cold Spring Harb. Perspect. Biol. 7, a008144.
Smith-Vikos T., Slack F.J. (2012) MicroRNAs and their roles in aging. J. Cell Sci. 125, 7–17.
Hwang H.-W., Mendell J.T. (2006) MicroRNAs in cell proliferation, cell death, and tumorigenesis. Br. J. Cancer. 94, 776–780.
Song L., Tuan R.S. (2006) MicroRNAs and cell differentiation in mammalian development. Birth Defects Res. Part C Embryo Today Rev. 78, 140–149.
Subramanian S., Steer C.J. (2010) MicroRNAs as gatekeepers of apoptosis. J. Cell. Physiol. 223, 289–298.
Momen-Heravi F., Bala S. (2018) miRNA regulation of innate immunity. J. Leukoc. Biol. 103, 1205–1217.
Inui M., Martello G., Piccolo S. (2010) MicroRNA control of signal transduction. Nat. Rev. Mol. Cell Biol. 11, 252–263.
Vienberg S., Geiger J., Madsen S., Dalgaard L.T. (2017) MicroRNAs in metabolism. Acta Physiol. Oxf. Engl. 219, 346–361.
Peng Y., Croce C.M. (2016) The role of microRNAs in human cancer. Signal Transduct. Target. Ther. 1, 15004.
Viswambharan V., Thanseem I., Vasu M.M., Poovathinal S.A., Anitha A. (2017) miRNAs as biomarkers of neurodegenerative disorders. Biomark. Med. 11, 151–167.
Zhou S.S., Jin J.P., Wang J.Q., Zhang Z.G., Freedman J.H., Zheng Y., Cai L. (2018) miRNAS in cardiovascular diseases: potential biomarkers, therapeutic targets and challenges. Acta Pharmacol. Sin. 39, 1073–1084.
Khudiakov A.A., Panshin D.D., Fomicheva Y.V., Knyazeva A.A., Simonova K.A., Lebedev D.S., Mik-haylov E.N., Kostareva A.A. (2021) Different expressions of pericardial fluid microRNAs in patients with arrhythmogenic right ventricular cardiomyopathy and ischemic heart disease undergoing ventricular tachycardia ablation. Front. Cardiovasc. Med. 8, 647812.
Poy M.N. Eliasson L., Krutzfeldt J., Kuwajima S., Ma X., Macdonald P.E., Pfeffer S., Tuschl T., Rajewsky N., Rorsman P., Stoffel M. (2004) A pancreatic islet-specific microRNA regulates insulin secretion. Nature. 432, 226–230.
Liu Y., Wang Q., Wen J., Wu Y., Man C. (2021) MiR-375: a novel multifunctional regulator. Life Sci. 275, 119323.
Baroukh N.N., Van Obberghen E. (2009) Function of microRNA-375 and microRNA-124a in pancreas and brain. FEBS J. 276, 6509–6521.
Yan J.-W., Lin J.-S., He X.-X. (2014) The emerging role of miR-375 in cancer: the emerging role of miR-375 in cancer. Int. J. Cancer. 135, 1011–1018.
Avnit-Sagi T., Kantorovich L., Kredo-Russo S., Hornstein E., Walker M.D. (2009) The promoter of the pri-miR-375 gene directs expression selectively to the endocrine pancreas. PLoS One. 4, e5033.
de Souza Rocha Simonini P., Breiling A., Gupta N., Malekpour M., Youns M., Omranipour R., Malekpour F., Volinia S., Croce C.M., Najmabadi H., Diederichs S., Sahin O., Mayer D., Lyko F., Hoheisel J.D., Riazalhosseini Y. (2010) Epigenetically deregulated microRNA-375 is involved in a positive feedback loop with estrogen receptor alpha in breast cancer cells. Cancer Res. 70, 9175–9184.
Yan M., Liu Q., Jiang Y., Wang B., Ji Y., Liu H., Xie Y. (2020) Long noncoding RNA LNC_000898 alleviates cardiomyocyte apoptosis and promotes cardiac repair after myocardial infarction through modulating the miR-375/PDK1 axis. J. Cardiovasc. Pharmacol. 76, 77–85.
Cao L., Kong L.P., Yu Z.B., Han S.P., Bai Y.F., Zhu J., Hu X., Zhu C., Zhu S., Guo X.R. (2012) microRNA expression profiling of the developing mouse heart. Int. J. Mol. Med. 30, 1095–1104.
Wang L., Song G., Liu M., Chen B., Chen Y., Shen Y., Zhu J., Zhou X. (2016) MicroRNA-375 overexpression influences P19 cell proliferation, apoptosis and differentiation through the Notch signaling pathway. Int. J. Mol. Med. 37, 47–55.
Zhuang S., Fu Y., Li J., Li M., Hu X., Zhu J., Tong M. (2020) MicroRNA-375 overexpression disrupts cardiac development of zebrafish (Danio rerio) by targeting Notch2. Protoplasma. 257, 1309–1318.
Zhu S., Cao L., Zhu J., Kong L., Jin J., Qian L., Zhu C., Hu X., Li M., Guo X., Han S., Yu Z. (2013) Identification of maternal serum microRNAs as novel non-invasive biomarkers for prenatal detection of fetal congenital heart defects. Clin. Chim. Acta Int. J. Clin. Chem. 424, 66–72.
Li Y., Li X., Wang L., Han N., Yin G. (2021) miR-375-3p contributes to hypoxia-induced apoptosis by targeting forkhead box P1 (FOXP1) and Bcl2 like protein 2 (Bcl2l2) in rat cardiomyocyte h9c2 cells. Biotechnol. Lett. 43, 353–367.
Ali Sheikh M.S. (2020) Overexpression of miR-375 protects cardiomyocyte injury following hypoxic-reoxygenation injury. Oxid. Med. Cell. Longev. 2020, 7164069.
Libby P. (2002) Inflammation in atherosclerosis. Nature. 420, 868–874.
Qiu Y., Xu J., Yang L., Zhao G., Ding J., Chen Q., Zhang N., Yang R., Wang J., Li S., Zhang L. (2021) MiR-375 silencing attenuates pro-inflammatory macrophage response and foam cell formation by targeting KLF4. Exp. Cell Res. 400, 112507.
D’Alessandra Y., Devanna P., Limana F., Straino S., Di Carlo A., Brambilla P.G., Rubino M., Carena M.C., Spazzafumo L., De Simone M., Micheli B., Biglioli P., Achilli F., Martelli F., Maggiolini S., Marenzi G., Pompilio G., Capogrossi M.C. (2010) Circulating microRNAs are new and sensitive biomarkers of myocardial infarction. Eur. Heart J. 31, 2765–2773.
Baulina N., Osmak G., Kiselev I., Matveeva N., Kukava N., Shakhnovich R., Kulakova O., Favorova O. (2018) NGS-identified circulating miR-375 as a potential regulating component of myocardial infarction associated network. J. Mol. Cell. Cardiol. 121, 173–179.
Valadi H., Ekström K., Bossios A., Sjöstrand M., Lee J.J., Lötvall J.O. (2007) Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat. Cell Biol. 9, 654–659.
Xu D., Tahara H. (2013) The role of exosomes and microRNAs in senescence and aging. Adv. Drug Deliv. Rev. 65, 368–375.
Kay S.D., Carlsen A.L., Voss A., Burton M., Diederichsen A., Poulsen M.K., Heegaard N. (2019) Associations of circulating cell-free microRNA with vasculopathy and vascular events in systemic lupus erythematosus patients. Scand. J. Rheumatol. 48, 32–41.
Gacoń J., Kabłak-Ziembicka A., Stępień E., Enguita F.J., Karch I., Derlaga B., Żmudka K., Przewłocki T. (2016) Decision-making microRNAs (miR-124, -133a/b, -34a and -134) in patients with occluded target vessel in acute coronary syndrome. Kardiol. Pol. 74, 280–288.
Garikipati V.N.S., Verma S.K., Jolardarashi D., Cheng Z., Ibetti J., Cimini M., Tang Y., Khan M., Yue Y., Benedict C., Nickoloff E., Truongcao M.M., Gao E., Krishnamurthy P., Goukassian D.A., Koch W.J., Kishore R. (2017) Therapeutic inhibition of miR-375 attenuates post-myocardial infarction inflammatory response and left ventricular dysfunction via PDK-1-AKT signalling axis. Cardiovasc. Res. 113, 938–949.
Garikipati V.N.S., Krishnamurthy P., Verma S.K., Khan M., Abramova T., Mackie A.R., Qin G., Benedict C., Nickoloff E., Johnson J., Gao E., Losordo D.W., Houser S.R., Koch W.J., Kishore R. (2015) Negative regulation of miR-375 by interleukin-10 enhances bone marrow-derived progenitor cell-mediated myocardial repair and function after myocardial infarction. Stem Cells Dayt. Ohio. 33, 3519–3529.
Gacoń J., Badacz R., Stępień E., Karch I., Enguita F.J., Żmudka K., Przewłocki T., Kabłak-Ziembicka A. (2018) Diagnostic and prognostic micro-RNAs in ischaemic stroke due to carotid artery stenosis and in acute coronary syndrome: a four-year prospective study. Kardiol. Pol. 76, 362–369.
Badacz R., Przewłocki T., Gacoń J., Stępień E., Enguita F.J., Karch I., Żmudka K., Kabłak-Ziembicka A. (2018) Circulating miRNA levels differ with respect to carotid plaque characteristics and symptom occurrence in patients with carotid artery stenosis and provide information on future cardiovascular events. Postepy W Kardiologii Interwencyjnej Adv. Interv. Cardiol. 14, 75–84.
Charrier H., Cuvelliez M., Dubois-Deruy E., Mulder P., Richard V., Bauters C., Pinet F. (2019) Integrative system biology analyses identify seven microRNAs to predict heart failure. Non-Coding RNA. 5, E22.
Watson C.J., Gupta S.K., O’Connell E., Thum S., Glezeva N., Fendrich J., Gallagher J., Ledwidge M., Grote-Levi L., McDonald K., Thum T. (2015) MicroRNA signatures differentiate preserved from reduced ejection fraction heart failure. Eur. J. Heart Fail. 17, 405–415.
Zhang H., Tian Y., Liang D., Fu Q., Jia L., Wu D., Zhu X. (2020) The effects of inhibition of microRNA-375 in a mouse model of doxorubicin-induced cardiac toxicity. Med. Sci. Monit. Int. Med. J. Exp. Clin. Res. 26, e920557.
Zhelankin A.V., Vasiliev S.V., Stonogina D.A., Babalyan K.A., Sharova E.I., Doludin Y.V., Shchekochi-khin D.Y., Generozov E.V., Akselrod A.S. (2020) Elevated plasma levels of circulating extracellular miR-320a-3p in patients with paroxysmal atrial fibrillation. Int. J. Mol. Sci. 21, E3485.
Hong X., Wang J., Li S., Zhao Z., Feng Z. (2021) MicroRNA-375-3p in endothelial progenitor cells-derived extracellular vesicles relieves myocardial injury in septic rats via BRD4-mediated PI3K/AKT signaling pathway. Int. Immunopharmacol. 96, 107740.
Feng H., Wu J., Chen P., Wang J., Deng Y., Zhu G., Xian J., Huang L., Ouyang W. (2019) MicroRNA-375-3p inhibitor suppresses angiotensin II-induced cardiomyocyte hypertrophy by promoting lactate dehydrogenase B expression. J. Cell. Physiol. 234, 14198–14209.
Ro W.-B., Kang M.-H., Song D.-W., Lee S.-H., Park H.-M. (2021) Expression profile of circulating MicroRNAs in dogs with cardiac hypertrophy: a pilot study. Front. Vet. Sci. 8, 652224.
http://mirtarbase.cuhk.edu.cn/
Ou J., Kou L., Liang L., Tang C. (2017) MiR-375 attenuates injury of cerebral ischemia/reperfusion via targetting Ctgf. Biosci. Rep. 37, BSR20171242.
https://www.disgenet.org/
https://www.proteinatlas.org/
https://string-db.org/
Osmak G., Kiselev I., Baulina N., Favorova O. (2020) From miRNA target gene network to miRNA function: miR-375 might regulate apoptosis and actin dynamics in the heart muscle via Rho-GTPases-dependent pathways. Int. J. Mol. Sci. 21, E9670.
An Y., Liu Z., Ding H., Lv Q., Fan H., Hou S., Cai W., Liu S. (2020) MiR-375-3p regulates rat pulmonary microvascular endothelial cell activity by targeting Notch1 during hypoxia. J. Int. Med. Res. 48, 030006052092685.
Ghanbari M., Franco O.H., de Looper H.W.J., Hofman A., Erkeland S.J., Dehghan A. (2015). Genetic variations in microRNA-binding sites affect microRNA-mediated regulation of several genes associated with cardio-metabolic phenotypes. Circ. Cardiovasc. Genet. 8, 473–486.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


