Молекулярная биология, 2022, T. 56, № 4, стр. 595-603
Cнижение экспрессии тканеспецифичной изоформы OCT-1L оказывает противоопухолевый эффект в клетках лимфомы Беркитта Namalwa
Т. Н. Порцева a, А. П. Котнова a, Е. В. Булавкина a, А. А. Макарова a, С. Г. Георгиева a, А. Г. Степченко a, Е. В. Панкратова a, *
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: pank@eimb.ru
Поступила в редакцию 08.12.2021
После доработки 17.02.2022
Принята к публикации 24.02.2022
- EDN: JKHJAD
- DOI: 10.31857/S0026898422040097
Аннотация
Повышенный уровень фактора транскрипции Oct-1 считается одним из ключевых маркеров неблагоприятного течения канцерогенеза. Кроме убиквитарной изоформы Oct-1А, представленной во всех клетках организма, существует и тканеспецифическая изоформа Oct-1L, которая экспрессируется в гемопоэтических клетках. Oct-1L не только повышает устойчивость клеток к разным видам стресса, но и регулирует экспрессию генов, отвечающих за дифференцировку гемопоэтических клеток и клеток иммунной системы. Уровень экспрессии тканеспецифической изоформы Oct-1L значительно увеличен в лимфобластных В-клеточных линиях Namalwa и Raji и в Т-клеточной лимфо-бластной линии Jurkat по сравнению с нормальными B- и Т-клетками. Вероятно, аберрантная сверхэкспрессия Oct-1L приводит не только к повышению стрессоустойчивости клеток, но и к дезорганизации путей их развития, способствуя злокачественной трансформации. В этой работе нами показано, что направленное подавление экспрессии тканеспецифичной изоформы Oct-1L снижает скорость деления клеток Namalwa, вызывает значительное увеличение их гибели в условиях гипоксии, а также повышает чувствительность к химиотерапевтическим препаратам – доцетакселу и доксорубицину. Полученные результаты свидетельствуют о перспективности таргетной терапии, направленной на подавление отдельных изоформ Oct-1, уровень экспрессии которых повышен в опухолевой клетке, а не всех изоформ одновременно, что даст возможность избежать травмирующего эффекта полного нокдауна Oct-1. Избирательное подавление изоформ Oct-1 считается перспективной стратегией в терапии опухолей лимфоидного ряда и, по-видимому, может способствовать облегчению течения болезни и повышению выживаемости пациентов.
ВВЕДЕНИЕ
Фактор транскрипции Oct-1, содержащий высококонсервативный ДНК-связывающий домен (POU-домен), – один из главных регуляторов дифференцировки иммунных клеток [1, 2]. Оct-1 модулирует экспрессию специфических генов В‑клеток, а также выживаемость и пролиферацию клеток иммунной системы [3, 4]. При онкотрансформации клеток концентрация Oct-1, необходимая для поддержания клеточного гомеостаза, может возрастать в 10 раз и более, так как этот белок способствует устойчивости к генотоксическому и окислительному стрессу и гликолитическому метаболизму, обеспечивая выживаемость раковых клеток при большой стрессовой нагрузке, которая развивается при онкотрансформации [5, 6]. Эти же функции Oct-1 выполняет в нормальных клетках [5].
Oct-1 охарактеризован достаточно давно, однако интерес к нему в настоящее время существенно возрос, поскольку обнаружили тесную корреляцию между злокачественностью опухоли, ее устойчивостью к терапии и высоким уровнем экспрессии Oct-1 в опухолевых клетках. Такая корреляция установлена при раке желудка [7–9], предстательной железы [10], раке шейки матки [11] и колоректальном раке [12]. Сверхэкспрессия Oct-1 коррелирует с агрессивностью многих типов опухолей [13–15].
Помимо убиквитарной изоформы Oct-1А, представленной во всех клетках на протяжении всей жизни организма, существуют тканеспецифические изоформы, экспрессирующиеся в ограниченных популяциях клеток в определенный период времени. Все эти изоформы образуют семейство факторов Oct-1 (у человека обнаружены 7 RefSeq и 14 дополнительных мРНК Oct-1 (GeneBank)) [3, 4, 16–18]. В клетке могут экспрессироваться одновременно несколько изоформ Oct-1, и эту совокупность изоформ мы определяем как “тотальный Oct-1”. Несколько альтернативных изоформ Oct-1 найдены у мыши [1, 19, 20]. Ген POU2F1 человека и мыши содержит альтернативные промоторы U и L [16, 20–24]. Считываемые с них транскрипты имеют разные первые экзоны и кодируют разные изоформы: Oct-1A считывается с промотора U, а Oct-1L – с промотора L. Как видно из рис. 1а, эти белки различаются своими N‑концевыми последовательностями, что характерно для изоформ, которые различаются тканевой специфичностью экспрессии и регулируемыми генами-мишеням [25]. Oct-1L экспрессируется в клетках крови и в мозге. B наибольшем количестве эта изоформа представлена в В-клетках [3, 16, 20]. Минорная тканеспецифическая изоформа Oct-1R специфична только для В-клеток [3]. Паттерны экспрессии различных изоформ Oct-1 изменяются во время дифференцировки гемопоэтических клеток-предшественников (CD34+, CD19+, CD14+ и CD3+) [3, 18]. Так Oct-1L экспрессируется на высоком уровне в CD34+. Уровень экспрессии резко падает во время дифференцировки Т-клеток, а при дифференцировке В-клеток он почти не изменяется.
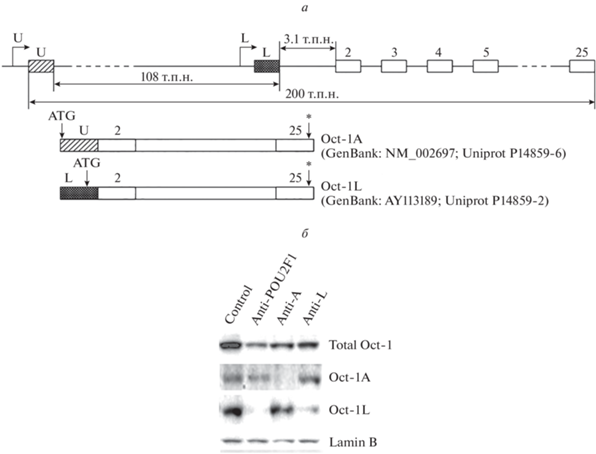
Рис. 1.
Подавление экспрессии мРНК POU2F1(Oct-1) и его изоформ Oct-1A и Oct-1L в стабильно трансдуцированных клетках лимфомы Беркитта Namalwa под действием shРНК. а – Схема строения гена POU2F1 и двух основных его изоформ, транскрибирующихся с убиквитарного промотора U и тканеспецифичного промотора L. б – Вестерн-блот-гибридизация с антителами к тотальному Oct-1 и его изоформам Oct-1A и Oct-1L. Здесь и далее: клеточные линии Namalwa “control” – клетки, трансдуцированные контрольной лентивирусной конструкцией, не имеющей значимой гомологии с геномом человека; Namalwa “anti-POU2F1” – клетки, трансдуцированные лентивирусной конструкцией, синтезирующей shРНК к тотальному Oct-1; Namalwa “anti-A” – клетки, трансдуцированные лентивирусной конструкцией, синтезирующей shРНК к изоформе Oct-1A; Namalwa “anti-L” – клетки, трансдуцированные лентивирусной конструкцией, синтезирующей shРНК к изоформе Oct-1L. Контроль нанесения образцов – гибридизация с антителами к ламину В. На дорожки нанесено по 10 мкг клеточного экстракта.
Помимо повышения устойчивости к разным видам стресса, тканеспецифические изоформы Oct-1 регулируют гены, отвечающие за дифференцировку и фенотипы стволовых гемопоэтических клеток и клеток иммунной системы [3, 4]. Таким образом, увеличение концентрации тканеспецифических изоформ в онкотрансформированных клетках приводит не только к повышению стрессоустойчивости, но и к дезорганизации путей их развития. Проонкогенные функции Oct-1 описаны при лимфоме Ходжкина, лимфоме тимуса, остром миелоидном лейкозе [26, 27]. Сверхэкспрессия Oct-1 часто наблюдается при диффузной В-крупноклеточной лимфоме и считается независимым прогностическим фактором неблагоприятного исхода при этом заболевании [28].
Существование альтернативных промоторов в гене POU2F1, кодирующем белок Oct-1, указывает на возможность воздействия не на экспрессию тотального Oct-1, а на экспрессию тех его изоформ, уровень которых возрастает в опухолевых клетках.
Мы провели серию экспериментов по направленному ингибированию экспрессии как отдельных изоформ Oct-1, так и тотального Oct-1 с использованием малых интерферирующих РНК, специфичных как к отдельным изоформам, так и ко всем изоформам соответственно. Затем мы проанализировали эффект подавления как отдельных изоформ, так и тотального Oct-1 на пролиферацию и стрессоустойчивость клеток В-лимфобластной линии клеток Namalwa, полученной из лимфомы Беркитта. Показано, что нокдаун белка Oct-1 или отдельных его изоформ снижает скорость деления В-лимфобластных клеток, вызывает увеличение их гибели в условиях гипоксии, а также повышает чувствительность к химиотерапевтическим препаратам. Избирательное подавление экспрессии тканеспецифичной изоформы Oct-1L играет ведущую роль в снижении скорости деления клеток и повышения их гибели в условиях гипоксии. Полученные результаты свидетельствуют о возможности таргетной терапии, направленной на подавление отдельных изоформ Oct-1 в опухолевых клетках, что позволит снизить травмирующий эффект полного нокдауна Oct-1 или избежать его.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Клеточные линии. В работе использовали линию клеток аденокарциномы молочной железы человека MDA MB-231. Клетки культивировали в полной среде ДМЕМ (“GIBCO”, “Thermo Fisher Scietific”, США), содержащей 10% эмбриональной сыворотки крупного рогатого скота (FBS; “HyClone”, США), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина.
Нокдаун гена POU2F1. Для нокдауна гена POU2F1 использовали технологию РНК-интерференции. На основе лентивирусного вектора pGPV.ma4 созданы конструкции для синтеза коротких РНК со шпилечной структурой (shРНК): scrambled (контрольная) и anti-POU2F1 (shРНК для нокдауна мРНК всех изоформ Oct-1), anti-A (shРНК для нокдауна мРНК изоформы Oct-1А, “Евроген”, Россия), которыми трансфицировали клетки HEK-293 и получали соответствующие лентивирусные стоки. Клетки Namalwa (106 клеток) трансдуцировали полученными лентивирусными частицами. После селекции с использованием пуромицина, получили четыре линии клеток Namalwa со стабильным нокдауном тотального Oct-1, Oct-1А, Oct-1L и контрольную линию клеток Namalwa.
shРНК к мРНК Oct-1 (анти-POU2F1):
5'-GATCCGCCAAGACCTTCAAACAAATTCAAGAGATTTGTTTGAAGGTCTTGGCT-TTTTTG-3'.
shРНК к мРНК Oct-1А (anti-А): 5'-GATCCACGGAGGAGCAGCGAGTCATTCAAGAGATGACTCGCTGCTCCTCCGTTTTTTTG-3'.
shРНК к мРНК Oct-1L (anti-L): 5'-GATCCGTGCAGTGACTATGTTCTAGTTCAAGAGACTAGAACATAGTCACTGCATTTTTTG-3'.
shРНК control – нуклеотидная последовательность, не имеющая гомологии с РНК человека, использована в качестве отрицательного контроля:
5'-GATCCGCAAAAATTCTCCGAACGTGTT-CAAGAGACACGTTCGGAGAATTTTTGT-TTTTTG-3'.
Уровень экспрессии Oct-1 измеряли с использованием количественной ПЦР и иммуноблотинга.
Выделение РНК и RT-qPCR. РНК выделяли из клеточных линий с использованием Trizol. Уровни мРНК измеряли с помощью обратной транскрипции и ПЦР реальном времени (RT-PCR) и нормировали по мРНК, кодирующей глюкуронидазу B (GUS). Обратную транскрипцию выполняли с использованием 2 мкг суммарной РНК и набора Maxima First Strand cDNA Synthesis Kit для RT-qPCR (“Thermo Scientific”) в соответствии с рекомендациями производителя. кДНК синтезировали с использованием смешанных олиго(dT)18 и случайных гексамерных праймеров. Использовали следующие праймеры: Oct‑1A-F: 5'-TATTCAAAATGGCGGACGGA-3'; Oct-1A-R: 5'-GTTTCTGACGGATTGTTCATTC-3'; GUS-F: 5'- CGTGGTTGGAGAGCTCATTTGGA-3' и GUS-R: 5'-ATTCCCCAGCACTCTCGTCGGT-3'. RT-PCR выполняли в термоциклере LightCycler96 (“Roche”, США). Стандартная реакционная смесь (25 мкл) содержала соответствующие пары праймеров, кДНК, эквивалентную 50 нг cуммарной РНК, и мастер-смесь qPCRmix-HS SYBR (“Eвроген”). ПЦР в реальном времени проводили в следующих условиях: 55°C в течение 2 мин, 95°C в течение 5 мин, затем 40 циклов: 95°C, 10 с и 59°C, 30 с (температура получения сигнала). В каждом случае измерения проводили как минимум в трех повторностях и рассчитывали средние значения. Данные обрабатывали с помощью программного обеспечения LightCycler96 Instrument. Данные RT-PCR обрабатывали путем расчета ∆Ct.
Вестерн-блотинг. Клеточные экстракты (10 мкг белка), смешанные с буфером Laemmli, содержащим дитиотреитол, инкубировали при 40°C в течение 10 мин, затем наносили на 8%-ный денатурирующий полиакриламидный гель и переносили на нитроцеллюлозную мембрану (“GE Healthcare”, США) в растворе 25 мМ Tрис, 192 мМ глицина и 20% этанола с последующим блокированием мембраны 5%-ным обезжиренным молоком в PBS в течение 1 ч при комнатной температуре. Антитела против Oct-1, его изоформ Oct-1A и Oct-1L, ламина B использовали для иммуноокрашивания мембран. Ламин B использовали в качестве контроля нанесения. Мембраны инкубировали с первичными антителами в PBS с добавлением 0.1% Tween-20 (PBS-T) в 5%-ном обезжиренном молоке в PBS-T при 4°C в течение ночи, а затем промывали 3 раза в течение 20 мин PBS-T и инкубировали в течение 1 ч при комнатной температуре с антителами, конъюгированными с пероксидазой хрена (HRP). После четырех дополнительных стадий промывки PBS-T сигнал детектировали в соответствии со стандартным протоколом с использованием реагента ECL (“GE Helthcare”, США). Использовали поликлональные антитела кролика к изоформам Oct-1A и Oct-1L, полученные ранее в нашей лаборатории [4], поликлональные антитела кролика к Oct-1 (“Abcam”, Ab66132, Великобритания), моноклональные антитела мыши к ламину B1 (sc-377000; “SantaCruse”), вторые антимышиные антитела козы, конъюгированные с HRP (“Jackson ImmunoResearch”, США, 115-035-174) и вторые антикроличьи антитела козы, конъюгированные с HRP (“Jackson ImmunoResearch”, 111-035-144).
Результаты вестерн-блотинга визуализировали, сигнал количественно оценивали с использованием системы визуализации ChemiDoc MP (“Bio-Rad”, США) с помощью программного обеспечения Bio-Rad Image Lab. Все измерения проводили не менее, чем в трех повторностях и рассчитывали средние значения.
Клеточный стресс. Гипоксия. Для изучения роли нокдауна Oct-1 в клеточном ответе на гипоксию или обработку химиотерапевтическими препаратами клетки Namalwa культивировали в 96-луночных планшетах (30 000 клеток в лунке, пять повторностей) в полной среде ДMEM. Устойчивость к гипоксии определяли, используя культивирование клеток при 37°С и 0.5% O2 (гипоксия) в течение 24 ч. Жизнеспособность клеток определяли с помощью CytoTox-Glo Cytotoxicity Assay (“Promega”, США). Рассчитывали содержание (%) мертвых клеток относительно общего числа клеток и средние значения. Устойчивость к химиотерапевтическим препаратам определяли, используя обработку доцетакселом (500 нг/мл), доксорубицином (500 нг/мл), туникамицином (2 мкг/мл) в течение 48 ч. Содержание (%) живых клеток определяли с помощью набора CellTiter 96(R) AQueous One Solution Assay (“Promega”) относительно контрольных необработанных клеток, которые культивировали в тех же условиях, но без добавления химиотерапевтических препаратов.
Статистика. Сравнение экспериментальных групп проводили с использованием t-критерия Стьюдента. Все данные представлены в виде среднего значения ± стандартное отклонение (SD), рассчитанных на основании не менее трех независимых экспериментов. Различия считали статистически значимыми при P < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Получены линии опухолевых клеток с пониженным уровнем экспрессии Oct-1 и его изоформ: убиквитарной Oct-1A и тканеспецифичной Oct-1L
Нами созданы конструкции shРНК для нокдауна отдельных изоформ, а также мРНК Oct-1. На основе лентивирусного вектора pGPV.ma4 получены четыре конструкции для синтеза shРНК. Конструкция (scram) – контрольная; конструкция (anti-POU) – shРНК для нокдауна мРНК всех изоформ Oct-1; конструкция (anti-A) – shРНК для нокдауна мРНК изоформы Oct-1A; конструкция (anti-L) – shРНК для нокдауна изоформы Oct-1L. Получены соответствующие лентивирусные стоки и проведена трансдукция клеток линий Namalwa. С помощью пуромицина проведена селекция, получены линии клеток со стабильным нокдауном тотального Oct-1 и его отдельных изоформ.
С помощью количественной ПЦР и Вестерн-блот-гибридизации показано специфическое для каждой конструкции подавление мРНК Oct-1 (тотального Oct-1, изоформы Oct-1A и Oct-1L).
Как видно из представленных результатов (рис. 1б), конструкции, трансдуцированные в клетки линии Namalwa, эффективно подавляют экспрессию как тотального белка Oct-1 (примерно в 6 раз), так и изоформ Oct-1A (в 9 раз) и Oct-1L (в 8 раз), при этом shРНК anti-Oct-1A избирательно и специфично подавляет экспрессию Oct-1A, тогда как shРНК anti-Oct-1L избирательно и специфично подавляет экспрессию Oct-1L. Поскольку в клетках Namalwa изоформа Oct-1L является основной, то при ее нокдауне количество тотального Oct-1 снижается в несколько раз сильнее, чем при нокдауне Oct-1A.
В последующих экспериментах мы оценивали влияние понижения уровня тотального Oct-1 и его изоформ Oct-1A и Oct-1L на пролиферацию клеток Namalwa, их устойчивость к гипоксии и химиотерапевтическим препаратам.
Нокдаун изоформы Oct-1L снижает скорость деления опухолевых клеток
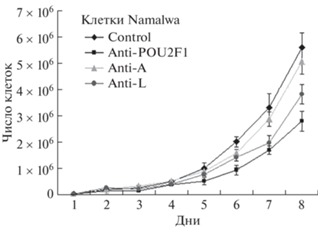
Изменения скорости деления опухолевых клеток при нокдауне тотального белка Oct-1 и его изоформ Oct-1A и Oct-1L оценивали на линиях клеток Namalwa “anti-POU2F1”, Namalwa “anti-A”, Namalwa “anti-L” и Namalwa “control”. Нами показано, что подавление экспрессии Oct-1 в клетках Namalwa приводит к статистически значимому снижению скорости их деления. Максимальный эффект наблюдается при подавлении Oct-1 или изоформы Oct-1L, тогда как нокдаун Oct-1A почти не влияет на скорость деления клеток (рис. 2).
Рис. 2.
Влияние подавления экспрессии Oct-1 и его отдельных изоформ на скорость деления клеток лимфомы Беркитта Namalwa. Клетки культивировали в полной среде ДМЕМ в 24-луночных планшетах в пяти повторах для каждой временной точки и каждой линии. Описание клеточных линий как на рис. 1. Каждый день забирали все клетки из лунки и подсчитывали их число. На графиках представлено среднее значение ± SD, вычисленное по пяти независимым экспериментальным точкам.
Понижение экспрессии изоформ Oct-1 вызывает увеличение гибели клеток в условиях гипоксии
Опухолевые клетки адаптируются к гипоксии и приобретают более агрессивные терапевтически устойчивые фенотипы. После получения клеточных линий Namalwa с пониженной экспрессией тотального белка Oct-1 либо его изоформ Oct-1A или Oct-1L оценивали влияние подавления экспрессии Oct-1 на устойчивость раковых клеток к гипоксии. Клетки инкубировали в условиях “жесткой” гипоксии (0.5% О2) в течение 24 ч, после чего определяли количество (%) погибших клеток методом CytoTox-GloAssay (“Promega”). Во всех полученных нами линиях с нокдауном Oct-1 в условиях гипоксии наблюдалось увеличение числа погибших клеток по сравнению с контрольной линией (рис. 3).
Рис. 3.
Нокдаун как тотального Oct-1, так и его изоформ Oct-1A или Oct-1L понижает выживаемость клеток лимфомы Беркитта Namalwa при гипоксии. Гистограмма доли погибших клеток в условиях гипоксии (0.5% О2 в течение 24 ч). Клеточные линии: Namalwa. Описание клеточных линий см. на рис. 1. Количество мертвых клеток определяли с помощью CytoTox-Glo Cytotoxicity Assay (“Promega”). На графиках представлено среднее значение ± SD, вычисленное по пяти независимым экспериментам. С помощью t-тестов определяли существование значимых различий между средними значениями для контрольных клеток и клеток с нокдауном (**P < 0.01).
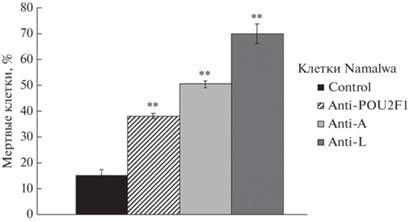
Результаты эксперимента показали, что понижение экспрессии Oct-1 в клетках лимфомы Беркитта приводит к значительному снижению устойчивости клеток к гипоксии. Особенно существенно гибели клеток способствовало подавление экспрессии изоформы Oct-1L.
Нокдаун изоформ Oct-1 увеличивает чувствительность опухолевых клеток к химиотерапевтическим препаратам
На следующем этапе мы провели in vitro aнализ устойчивости опухолевых клеток В-клеточной лимфомы Namalwa к химиотерапевтическим препаратам при избирательном подавлении экспрессии тотального белка Oct-1 и его изоформ Oct-1A и Oct-1L.
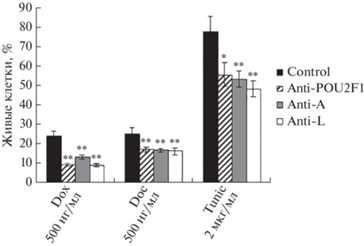
Наши результаты показывают, что в клеточной линии лимфомы Беркитта Namalwa понижение экспрессии Oct-1 или его отдельных изоформ приводит к усилению химиотерапевтического действия лекарственных веществ и цитотоксических препаратов (доцетаксел, доксорубицин, туникамицин). Эти вещества воздействуют на разные системы клетки, механизмы их действия принципиально различаются, однако понижение уровня Oct-1 приводит к снижению защиты клеток Namalwa от повреждающего действия всех трех веществ (рис. 4).
Рис. 4.
Влияние подавления экспрессии Oct-1 и его отдельных изоформ на чувствительность клеток лимфомы Беркитта Namalwa к химиотерапевтическим препаратам. Клетки культивировали в полной среде ДМЕМ с указанными веществами в течение 48 ч. Количество (%) живых клеток подсчитывали с помощью набора CellTiter 96(R) AQueous One Solution Assay (“Promega”) относительно контрольных необработанных клеток, которые культивировали в тех же условиях, но без добавления токсических веществ. Dox – Доксорубицин, Doc – доцеткасел, Tunic – туникамицин. На графиках представлено среднее значение ± SD, вычисленное для пяти независимых точек. Статистическую значимость различий между средними значениями для контрольных и обработанных клеток (*P <0.05 и **P < 0.01) оценивали с помощью t-тестов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Повышение уровня фактора транскрипции Oct-1 в различных злокачественных новообразованиях сделало этот фактор одним из ключевых маркеров неблагоприятного течения опухолевого процесса. Однако несмотря на то, что этот белок можно рассматривать как потенциальную лекарственную мишень, ни одно лекарство, нацеленное на POU2F1(Oct-1), еще не разработано, что обусловлено чрезвычайной структурной и функциональной гибкостью Oct-1 и существованием альтернативных промоторов в его гене [4, 29]. Кроме того, Oct-1 – убиквитарный белок, который экспрессируется во всех клетках организма и необходим для нормальной жизнедеятельности клеток. Полное подавление этого фактора может привести к нежелательным последствиям для организма. На модельной системе острого миелобластного лейкоза у мышей с одновременным нокаутом POU2F1(Oct-1) показано, что потеря одного аллеля POU2F1(Oct-1), т.е. уменьшение в 2 раза количества белка Oct-1 в клетке, значительно задерживает развитие лейкоза, а делеция обоих аллелей гена Oct-1 полностью защищает мышей от лейкоза, но приводит к недостаточности костного мозга и гибели животных [25].
В этой работе нами разработана модельная система избирательного подавления отдельных изоформ Oct-1. Оценено влияние подавления отдельных изоформ Oct-1 на снижение злокачественного фенотипа В-клеточной лимфобластомы линии Namalwa. Показано, что понижение уровня лимфоцитспецифической изоформы Oct-1L при сохранении неизменного уровня экспрессии Oct-1A может быть значимым для снижения агрессивности этих опухолевых клеток: мы наблюдали снижение скорости деления, значительный рост гибели клеток в условиях гипоксии, а также повышение их чувствительности к химиотерапевтическим препаратам.
Использование каждой из трех конструкций для нокдауна приводит к трем разным вариантам изменения соотношения изоформ Oct-1 в клетках Namalwa. Из результатов экспериментов мы видим, что во всех трех случаях наблюдается общая тенденция изменений клеточной пролиферации, ответа на гипоксию и ответа на химиотерапевтические препараты. Однако соотношение изоформ Oct-1 специфически влияет на каждый из трех процессов (пролиферацию, ответ на гипоксию, ответ на химические вещества).
Ранее мы показали, что регуляторное взаимодействие между изоформами Oct-1 способствует нормальному гемопоэзу, а дисбаланс изоформ коррелирует с злокачественной трансформацией В‑клеток [3]. Так, например, при дифференцировке гемопоэтических клеток значительно изменяются уровни экспрессии отдельных изоформ, тогда как изменение количества тотального Oct-1 выражено не столь существенно [3]. Это связано с тем, что изменение состава и относительных соотношений изоформ Oct-1 приводит к изменению паттернов экспрессии генов-мишеней, регулируемых Oct-1 [3, 4], и способствует регуляции дифференцировки и клеточного ответа на стресс. Таким образом, в ответе клетки на внешние воздействия важную роль играет не только общее количество Oct-1, но и количественное соотношение изоформ Oct-1. Этот вывод подтверждается результатами нашей работы.
Oct-1 имеет важное значение для регуляции ранних стадий дифференцировки B-клеток и T‑клеток [3, 4, 30–32]. Ранее мы показали, что сверхэкспрессия тканеспецифических изоформ Oct-1 в клетках Namalwa приводит к репрессии многих генов, участвующих в дифференцировке В- и Т-лимфоцитов, а также клеток моноцитарного ряда [12, 13]. Тканеспецифические изоформы Oct-1 регулируют гены, направляющие дифференцировку клеток-предшественников по пути B‑клеток, но они же предотвращают терминальную дифференцировку В-клеток [3, 4, 30]. Например, они подавляют транскрипцию гена рецептора B-клеточного антигена (BCR), активность которого важна для нормальной дифференцировки B‑клеток. Они также репрессируют гены, участвующие в путях передачи сигнала, и отвечают за ответ клетки на хемокин-опосредованный сигнальный путь и рецепторные сигналы цитокин-цитокин, участвуют в репрессии сигнальных путей IFN (тип I) и IFNγ (тип II), которые важны для диффренцировки клеток иммунной системы [3, 4]. Уровень экспрессии тканеспецифической изоформы Oct-1L, но не других изоформ Oct-1, значительно повышен в В-клеточных лимфобластомах Namalwa и Raji и в Т-клеточной лимфобластоме Jurkat по сравнению с нормальными B- и Т-клетками. Вероятно, аберрантная экспрессия тканеспецифических изоформ Oct-1 играет важную роль в остановке дифференцировки В- и Т-клеток на ранних стадиях, способствуя их злокачественной трансформации. Можно предположить, что, хотя Oct-1L необходим для поддержания пула В-клеток на определенном этапе дифференцировки в нормальных условиях, чрезмерное повышение уровня Oct-1L приводит к снижению чувствительности дифференцирующихся лимфоцитов к регуляторным сигналам, которые должны подавлять пролиферацию и индуцировать дифференцировку.
Наши результаты показывают, что при использовании Oct-1 в качестве терапевтической мишени следует иметь в виду, что Oct-1 присутствует в клетках человека не в виде отдельного белка, но как целое семейство функционально различных изоформ [3, 4], и для снижения злокачественного потенциала опухолевых В-лимфобластных клеток можно использовать подавление экспрессии тканеспецифической изоформы Oct-1L, но не других изоформ Oct-1. О важности поставленной задачи свидетельствует сверхэкспрессия и проонкогенные свойства Oct-1 при лимфоме Ходжкина, диффузной В-крупноклеточной лимфоме, лимфоме Беркитта, лимфоме тимуса, остром миелоидном лейкозе. В частности, Oct-1 – это один из основных факторов транскрипции в патогенезе и прогнозе диффузной В-крупноклеточной лимфомы. Диффузная В-крупноклеточная лимфома является основным подтипом неходжкинской лимфомы [26], она составляет почти 50% всех неходжкинских лимфом. Меньше половины всех взрослых пациентов с неходжкинскими лимфомами излечиваются, а высокий уровень экспрессии Oct-1 коррелирует с неблагоприятным прогнозом и низкой выживаемостью пациентов [26].
Разработка способов избирательного подавления изоформ Oct-1 рассматривается как перспективная стратегия терапии опухолей лимфоидного ряда, применение которой, по-видимому, будет способствовать облегчению течения болезни и повышению выживаемости пациентов.
Работа выполнена при поддержке гранта Российского научного фонда (№ 19-14-00365).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Сытина Е.В., Панкратова Е.В. (2003) Фактор транскрипции Oct-1 – пластичность и полифункциональность. Молекуляр. биология. 37, 755‒767.
Shakya A., Goren A., Shalek A., German C.N., Snook J., Kuchroo V.K., Yosef N., Chan R.C., Regev A., Williams M.A., Tantin D. (2015) Oct1 and OCA-B are selectively required for CD4 memory T cell function. J. Exp. Med. 212, 2115–2131.
Pankratova E.V., Stepchenko A.G., Krylova I.D., Portseva TN., Georgieva S.G. (2018) The regulatory interplay between Oct-1 isoforms contributes to hematopoiesis and the isoforms imbalance correlates with a malignant transformation of B cells. Oncotarget. 9, 29892‒29905.
Pankratova E.V., Stepchenko A.G., Portseva T., Mogila V.A., Georgieva S.G. (2016) Different N-terminal isoforms of Oct-1 control expression of distinct sets of genes and their high levels in Namalwa Burkitt’s lymphoma cells affect a wide range of cellular processes. Nucl. Acids Res. 44, 9218‒9230.
Maddox J., Shakya A., South S., Shelton D., Andersen J.N., Chidester S., Kang J., Gligorich K.M., Jones D.A., Spangrude G.J., Welm B.E., Tantin D. (2012) Transcription factor Oct1 is a somatic and cancer stem cell determinant. PLoS Genet. 8, e1003048.
Wang P., Jin T. (2010) Oct-1 functions as a sensor for metabolic and stress signals. Islets. 2, 46‒48.
Qian J., Kong X., Deng N., Tan P., Chen H., Wang J., Li Z., Hu Y., Zou W., Xu J., Fang J.-Y. (2015) OCT1 is a determinant of synbindin-related ERK signalling with independent prognostic significance in gastric cancer. Gut. 64, 37‒48.
Almeida R., Almeida J., Shoshkes M., Mendes N., Mesquita P., Silva E., Van Seuningen I., Reis C.A., Santos-Silva F., David L. (2005) OCT-1 is over-expressed in intestinal metaplasia and intestinal gastric carcinomas and binds to, but does not transactivate, CDX2 in gastric cells. J. Pathol. 207, 396‒401.
Jeong S.H., Lee Y.J., Cho B.I., Ha W.-S., Choi S.-K., Jung E.-J., Ju Y.-T., Jeong C.-Y., Ko G.H., Yoo J., Hong S.-C. (2014) OCT-1 overexpression is associated with poor prognosis in patients with well-differentiated gastric cancer. Tumour Biol. 35, 5501‒5509.
Obinata D., Takayama K., Urano T., Murata T., Kumagai J., Fujimura T., Ikeda K., Horie-Inoue K., Homma Y., Ouchi Y., Takahashi S., Inoue S. (2012) Oct1 regulates cell growth of LNCaP cells and is a prognostic factor for prostate cancer. Int. J. Cancer. 130, 1021‒1028.
Xiao S., Liao S., Zhou Y., Jiang B., Li Y., Xue M. (2014) High expression of octamer transcription factor 1 in cervical cancer. Oncol Lett. 7, 1889‒1894.
Kuzmanov A., Johansen P., Hofbauer G. (2020) FBXO25 promotes cutaneous squamous cell carcinoma growth and metastasis through cyclin D1. J. Invest. Dermatol. 140, 2496‒2504.
Wang Y.P., Song G.H., Chen J., Xiao C., Li C., Zhong L., Sun X., Wang Z.-W., Deng G.-L., Yu F.-D., Xue Y.-M., Tang H.-M., Peng Z.-H., Wang X.-L. (2016) Elevated OCT1 participates in colon tumorigenesis and independently predicts poor prognoses of colorectal cancer patients. Tumour Biol. 37, 3247‒3255.
Hwang-Verslues W.W., Chang P.H., Jeng Y.M., Kuo W.-H., Chiang P.-H., Chang Y.-C., Hsieh T.-H., Su F.-Y., Lin L.-C., Abbondante S., Yang C.-Y., Hsu H.-M., Yu J.-C., Chang K.-J., Shew J.-Y., Lee E.Y.-H.P., Lee W.-H. (2013) Loss of corepressor PER2 under hypoxia up-regulates OCT1-mediated EMT gene expression and enhances tumor malignancy. Proc. Natl. Acad. Sci. USA. 110, 12331‒12336.
Sharpe D.J., Orr K.S., Moran M., White S.J., McQuaid S., Lappin T.R., Thompson A., James J.A. (2014) POU2F1 activity regulates HOXD10 and HOXD11 promoting a proliferative and invasive phenotype in head and neck cancer. Oncotarget. 5, 8803‒8815.
Luchina N.N., Krivega I.V., Pankratova E.V. (2003) Human Oct-1L isoform has tissue-specific expression pattern similar to Oct-2. Immunol. Lett. 85, 237‒241.
Stepchenko A.G., Portseva T.N., Glukhov I.A., Kotnova A.P., Georgieva S.G., Pankratova E.V. (2021) Primate-specific stress-induced transcription factor POU2F1Z protects human neuronal cells from stress. Sci. Rep. 11, 18808.
Stepchenko A.G., Lyanova B.M., Krylova I.D., Ilyin Y.V., Georgieva S.G., Pankratova E.V. (2018) Differentiation of monocytic cells is accompanied by a change in the expression of the set of Oct-1 isoforms. Dokl. Biochem. Biophys. 483, 306‒308.
Stepchenko A.G. (1992) The nucleotide sequence of mouse OCT-1 cDNA. Nucl. Acids Res. 20, 1419.
Pankratova E.V., Deyev I.E., Zhenilo S.V., Polanovsky O.L. (2001) Tissue-specific isoforms of the ubiquitous transcription factor Oct-1. Mol. Genet. Genomics. 266, 239‒245.
Панкратова Е.В., Порцева Т.Н., Макарова А.А., Льянова Б.М., Георгиева С.Г., Степченко А.Г. (2021) POU2F1(Oct-1) разнонаправленно участвует в ауторегуляции альтернативных промоторов за счет связывания с различными регуляторными участками гена POU2F1. Молекуляр. биология. 55, 972‒981.
Крылова И.Д., Порцева Т.Н., Георгиева С.Г., Степченко А.Г., Панкратова Е.В. (2013) Новая изоформа мРНК фактора транскрипции Оct-1 транскрибируется с альтернативного промотора. Молекуляр. биология. 47, 634‒641.
Степченко А.Г., Георгиева С.Г., Панкратова Е.В. (2019) Множественный характер взаимодействия транскрипционного фактора Oct-1 (POU2F1) с последовательностями PORE и MORE. Молекуляр. биология. 53, 430‒435.
Pankratova E., Sytina E., Polanovsky O. (2006) Autoregulation of Oct-1 gene expression is mediated by two octa-sites in alternative promoter. Biochimie. 88, 1323‒1329.
Stepchenko A.G., Pankratova E.V., Doronin S.A., Gulag P.V., Georgieva S.G. (2011) The alternative protein isoform NK2B, encoded by the vnd/NK-2 proneural gene, directly activates transcription and is expressed following the start of cells differentiation. Nucl. Acids Res. 39, 5401‒5411.
García-Cosío M., Santón A., Martín P., Camarasa N., Montalbán C., García J.F., Bellas C. (2004) Analysis of transcription factor OCT.1, OCT.2 and BOB.1 expression using tissue arrays in classical Hodgkin’s lymphoma. Mod. Pathol. 17, 1531‒1538.
Jafek J.L., Shakya A., Tai P.Y., Ibarra A., Kim H., Maddox J., Chumley J., Spangrude G.J., Miles R.R., Kelley T.W., Tantin D. (2019) Transcription factor Oct1 protects against hematopoietic stress and promotes acute myeloid leukemia. Exp. Hematol. 76, 38‒48.e2.
Gouveia G.R., Ferreira S.C., Siqueira S.A.C., de Pádua Covas Lage L.A., Hallack Neto A.E., de Oli-veira Costa R., Pereira J. (2020) Overexpression of OCT-1 gene is a biomarker of adverse prognosis for diffuse large B-cell lymphoma (DLBCL): data from a retrospective cohort of 77 Brazilian patients. BMC Cancer. 20, 1041.
Dey A., Sen S., Uversky V.N., Maulik U. (2021) Structural facets of POU2F1 in light of the functional annotations and sequence-structure patterns. J. Biomol. Struct. Dyn. 39, 1093‒1105.
Matthias P. (1998) Lymphoid-specific transcription mediated by the conserved octamer site: who is doing what? Semin. Immunol. 10, 155‒163.
Kim E.C., Edmonston C.R., Wu X., Schaffer A., Casali P. (2004) The HoxC4 homeodomain protein mediates activation of the immunoglobulin heavy chain 3' hs1,2 enhancer in human B cells. Relevance to class switch DNA recombination. J. Biol. Chem. 279, 42258‒42269.
Hwang S.S., Kim L.K., Lee G.R., Flavell R.A. (2016) Role of OCT-1 and partner proteins in T cell differentiation. Biochim Biophys Acta. 1859, 825‒831.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


