Молекулярная биология, 2022, T. 56, № 5, стр. 774-782
Моделирование инфекции SARS-CoV-2 у мышей за счет транзиентной экспрессии гена ACE2 человека путем интраназального введения AAV-hACE2
Д. В. Глазкова a, Е. В. Богословская a, Ф. А. Урусов a, b, *, Н. П. Карташова c, Е. А. Глубокова c, А. В. Грачева c, Е. Б. Файзулоев c, Г. В. Трунова d, В. А. Хохлова d, О. А. Безбородова d, А. А. Панкратов d, И. А. Ленева c, Г. А. Шипулин a
a Центр стратегического планирования и управления медико-биологическими рисками здоровью
Федерального медико-биологического агентства Российской Федерации
119992 Москва, Россия
b Научно-исследовательский институт медицины труда им. академика Н.Ф. Измерова
105275 Москва, Россия
c Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
105064 Москва, Россия
d Национальный медицинский исследовательский центр радиологии Министерства здравоохранения Российской Федерации
125284 Москва, Россия
* E-mail: flanger.fx@mail.ru
Поступила в редакцию 25.01.2022
После доработки 08.04.2022
Принята к публикации 12.04.2022
- EDN: BTGHCG
- DOI: 10.31857/S0026898422050068
Аннотация
Один из важнейших этапов в создании препаратов и вакцин для борьбы с новой коронавирусной инфекцией, COVID-19, ‒ это их тестирование на релевантной модели животных. В экспериментальной медицине удобной моделью, с хорошо изученной иммунологией, считаются лабораторные мыши. Однако эти животные не подвержены заражению коронавирусом-2, вызывающим тяжелый острый респираторный синдром (SARS-CoV-2) у человека, из-за отсутствия на клетках его рецептора ‒ ангиотензинпревращающего фермента-2 человека (hACE2), необходимого для проникновения вируса в клетку. Нами показано, что интраназальное введение аденоассоциированных вирусных векторов: AAV9 и AAV-DJ, ‒ кодирующих hACE2, приводит к высокому уровню экспрессии гена этого белка, ACE2, в легких, в отличие от вектора AAV6, введение которого вызывает низкую экспрессию ACE2. При заражении SARS-CoV-2 мышей, экспрессирующих hACE2, вирус реплицировался в легких, что приводило к развитию бронхопневмонии на седьмые сутки после инфицирования. Таким образом, впервые предложена простая методика доставки гена ACE2 человека в легкие мышей путем интраназального введения аденоассоциированного вектора, позволяющая в короткие сроки получить модель животных для изучения инфекции SARS-CoV-2.
Для разработки и тестирования терапевтических и профилактических лекарственных средств против любой инфекции, включая новую коронавирусную инфекцию, COVID-19, необходимо использовать релевантные модели животных. Наиболее распространенные и доступные животные – лабораторные мыши – не могут быть использованы для моделирования течения заболевания, вызванного вирусом SARS-CoV-2. Это связано с тем, что для проникновения в хозяйскую клетку вирионам SARS-CoV-2 необходим клеточный рецептор ‒ ангиотензинпревращающий фермент-2 человека (hACE2), ‒ связываясь с которым, вирус начинает свой инфекционный цикл. Мышиный же ортолог hACE2 (Асе2) не узнается этим коронавирусом, то есть не служит его рецептором, и поэтому SARS-CoV-2 не может инфицировать клетки мышей. Появление в 2021 году трансгенных мышей, у которых ген hACE2, ACE2, присутствует в геноме и экспрессируется в клетках легких, отчасти решает эту проблему [1]. Однако эти животные не всегда доступны и, кроме того, ограничены линией с определенным генетическим бэкграундом, что не позволяет изучать влияние генетических особенностей на течение заболевания. Более простым и доступным решением может стать введение мышам вектора, несущего ген ACE2. Hassan A. и соавт. [2] показали, что интраназальное введение аденовирусного вектора (AdV), кодирующего hACE2, позволяет достичь экспрессии этого белка в легких мышей и получить животных, чувствительных к заражению SARS-CoV-2. Однако введение AdV сопровождается воспалительным процессом в бронхах, что может при последующем заражении искажать картину течения инфекции COVID-19. Также для доставки гена ACE2 было предложено использование адноассоциированных вирусных векторов (AAV-векторов), не вызывающих воспаления, хотя в этом случае эффективным оказалось только интратрахеальное введение AAV-вектора в респираторный тракт мышей [3, 4]. Следует отметить, что интратрахеальное введение относится к инвазивным методам, что сильно усложняет получение трансдуцированных животных. На основании этих фактов мы поставили перед собой задачу оптимизировать доставку гена ACE2 с помощью AAV-векторов в респираторный тракт мышей BALB/c и охарактеризовать экспериментальную модель инфекции COVID-19 у этих лабораторных животных.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Вирусы, клетки. Клетки линии HEK-293FT (“Invitrogen”, США) культивировали в среде DMEM (“Gibco”, США), содержащей 10% эмбриональной сыворотки крупного рогатого скота (FBS; “Gibco”) и 0.01 М HEPES (“Gibco”). Клетки линии Vero CCL81 (ATСС, США) из коллекции Научно-исследовательского института вакцин и сывороток им. И.И. Мечникова (Россия) культивировали в среде DMEM с 5% FBS, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина. Лабораторный штамм SARS-CoV-2 Dubrovka (GenBank Acc. No. MW161041.1) был выделен на культуре клеток Vero CCL81 из назофарингеального мазка больного СOVID-19. Штамм прошел 20 последовательных пассажей на клетках Vero CCL81 и вызывал выраженное цитопатическое действие.
Конструирование плазмиды pAAV-hACE2. Плазмида pcDNA3-sACE2(WT)-Fc(IgG1), содержащая N-концевую часть гена АСЕ2, кодирующего белок hACE2, получена из “Addgene” (Addgene plasmid #154104) [5]. Сборку С-концевой части проводили методом ПЦР с удлинением перекрывающихся участков [6]. Перекрывающиеся N- и С-концевые участки амплифицировали и объединяли, используя ПЦР. Фрагмент, содержащий полный ген, интегрировали в плазмидный вектор pAAV-GFP (“CellBioLabs, Inc.”, США) и получили плазмиду pAAV-hACE2, которую валидировали секвенированием.
Получение векторных частиц AAV-hACE2. Для наработки AAV-векторов использовали хелперную плазмиду pHelper (“CellBioLabs, Inc.”), векторную плазмиду pAAV-hACE2 и одну из плазмид pAAV6-RC6, pAAV9-RC или pAAVDJ-RC, кодирующих белки капсидов AAV серотипов 6, 9 или DJ (“CellBioLabs, Inc.”). Получение векторных частиц и их очистку проводили, используя протокол трансфекции с полиэтиленимином и очистки полиэтиленгликолем (PEG 8000), описанный T. Kimura и др. [7].
Определение титра AAV методом ПЦР. Для определения титра AAV (числа векторных геномов в 1 мл, вг/мл) ДНК из образца выделяли с помощью набора реагентов АмплиТест РИБО-преп (ФГБУ “Центр стратегического планирования и управления медико-биологическими рисками здоровью” ФМБА России, Россия) в соответствии с рекомендациями производителя. ПЦР в реальном времени проводили на приборе RotorGene Q, используя праймеры на область ITR AAV и соответствующую программу амплификации [8].
Экспериментальные животные. В исследовании использовали самок мышей линии BALB/c с массой тела 18‒20 г, которые были получены из “БиоПитомника СТЕЗАР” (Россия).
Введение мышам вектора AAV-hACE2. Суспензию векторных частиц вводили мышам интраназально в общем объеме 60 мкл (30 мкл в каждую ноздрю) под легким эфирным наркозом, держа животных под углом 45° с зафиксированным в закрытом положении ртом [9].
Заражение животных. Мышей заражали вирусом SARS-CoV-2, взятым в титре 3.2 × 106 ТЦИД50/мл, интраназально: общий объем ‒ 60 мкл (по 30 мкл в каждую ноздрю) ‒ под легким эфирным наркозом. Животным, входящим в группы сравнения, таким же образом и в таком же объеме интраназально вводили фосфатно-солевой буфер.
Определение инфекционного титра вируса в легких. Здесь и далее материал для исследований получали от гуманно умерщвленных под наркозом животных. В стерильных условиях извлекали легкие, которые гомогенизировали и ресуспендировали в фосфатно-солевом буфере. Суспензию осветляли центрифугированием. Клетки Vero CCL81 рассевали в 96-луночные планшеты (“Costar”, США) с плотностью 2 × 104 клеток на лунку и культивировали в течение 3 суток. Готовили 10-кратные разведения проб вируса из легких, которые вносили в лунки планшета (200 мкл/лунка) и инкубировали при 37°С в течение 5 суток до появления цитопатического действия в клетках вирусного контроля. Расчет титра вируса проводили по методу, описанному M.A. Ramakrishnan [10], и выражали в lg (ТЦИД50/мл). Предел чувствительности метода составлял 1.5 lg.
Экстракция РНК из образцов легких мышей. Легкие извлекали, гомогенизировали в стерильных условиях в 1 мл раствора ExtractRNA (“Евроген”, Россия). Лизат осветляли центрифугированием и проводили экстракцию РНК хлороформом. Далее РНК выделяли с помощью набора реагентов АмплиТест РИБО-преп (ФГБУ “Центр стратегического планирования и управления медико-биологическими рисками здоровью” ФМБА России) согласно рекомендациям производителя.
Анализ экспрессии гена АСЕ2 в легких мышей. Образцы РНК обрабатывали ДНКазой в течение 20 мин, после чего прогревали при 70°С 10 мин. Количество мРНК hACE2 в образцах определяли с помощью ПЦР в реальном времени, используя праймеры: 5'-CTGGGAATCCAACCAACTCTG-3', 5'-CCACTACAATCACGTCCATC-3' ‒ и зонд 5'-Fam-CCAGCCCCCCGTTAGTATTTGGCTC-BHQ1-3'. В качестве внутреннего контроля использовали ПЦР в реальном времени с праймерами на ген бета-глюкуронидазы мыши (Gusb).
Определение РНК SARS-CoV-2 в легких. Тестирование образцов РНК на наличие РНК SARS-CoV-2 проводили с помощью набора реагентов АмплиТест SARS-CoV-2 (ФГБУ “Центр стратегического планирования и управления медико-биологическими рисками здоровью” ФМБА России) согласно инструкции производителя.
Морфологичеcкое исследование. Правое легкое мышей фиксировали в 10%-ном нейтральном забуференном формалине в течение 24 ч, обезвоживали и заливали в Гистомикс (“BioVitrum”, Россия). На этапе заливки материал ориентировали вдоль длинной оси. Cерийные срезы толщиной 3‒5 мкм изготавливали на ротационном микротоме Leica RM 2125 RTS (“Leica”, Германия), затем окрашивали гематоксилином и эозином и заключали в канадский бальзам. Гистологические препараты исследовали под световым микроскопом BX 51 (“Olympus”, Япония) с системой фоторегистрации материала.
Статистическая обработка. Для количественных данных вычисляли групповое среднее арифметическое и стандартную ошибку среднего. Статистический анализ выполняли с использованием программы Statistica 8.0. Достоверность различий между группами данных оценивали с применением U-критерия Манна‒Уитни. Различия считали достоверными при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Экспрессия гена АСЕ2 в легких мышей после введения вектора
Для получения модельных мышей с транзиентной экспрессией hACE2 необходимо доставить ген ACE2 в клетки легких. После интраназального введения AAV-вектор при вдыхании проникает в нижние дыхательные пути и трансдуцирует эпителиальные клетки легких. Экспрессия АСЕ2 в этих клетках приводит к появлению hACE2 на их поверхности, а значит к возможности связывания с ними вируса SARS-CoV-2. После связывания с hACE2 вирус проникает в клетку и запускает цикл репликации.
Для интраназального введения мы использовали модифицированную методику L. Santry и соавт. [9]. В первом эксперименте сравнивали экспрессию hАСЕ2 в легких животных при использовании для доставки АСЕ2 AAV c капсидами трех разных серотипов: AAV9, AAV6 и AAV-DJ. AAV-векторы в дозах, указанных в табл. 1, вводили мышам в соответствии с процедурой, описанной в “Экспериментальной части”; AAV-вектор каждого серотипа вводили группе из трех животных. На 7, 14 и 21 сутки после введения AAV проводили забор легких и оценивали количество мРНК hАСЕ2, используя обратную транскрипцию (ОТ) с ПЦР в реальном времени. Также для оценки эффективности выделения РНК и прохождения ОТ-ПЦР в образцах измеряли уровень мРНК бета-глюкуронидазы мыши (Gusb). Средний пороговый цикл (Ct) для мРНК Gusb составлял 18.4, а стандартное отклонение по Ct в образцах от разных животных не превышало 7%, что позволило сравнивать результаты измерения мРНК hАСЕ2 без нормализации, используя в качестве параметра для сравнения значения Ct для АСЕ2.
Таблица 1.
Средние значения пороговых циклов (Ct) для гена АСЕ2 в образцах, полученных из легких мышей, после введения AAV-векторов
| Вектор | Дозаa | Среднее значение порогового цикла, Ct | ||
|---|---|---|---|---|
| время, сутки | ||||
| 7 | 14 | 21 | ||
| AAV9 | 6 × 1010 | 19.7 ± 0.8 | 19.2 ± 1.0 | 20.3 ± 0.1 |
| 2 × 1010 | 23.3 ± 1.8 | 20.4 ± 0.3 | 20.2 ± 0.3 | |
| 6 × 109 | 21.0 ± 0.5 | 21.7 ± 0.4 | 20.1 ± 0.8 | |
| AAV6 | 2 × 1010 | 30.4 ± 1.6 | 30.2 (1 из 3)b | 30.5 ± 0.2 (2 из 3)b |
| 6 × 109 | 31.6 (1 из 3)b | 33.2 (1 из 3) b | 34.3 (1 из 3)b | |
| AAV-DJ | 2 × 1010 | 21.7 ± 2.0 | 20.3 ± 1.4 | 21.1 ± 1.1 |
| 6 × 109 | 21.0 ± 0.5 | 23.0 ± 1.6 | 20.5 ± 0.5 | |
Как видно из данных, приведенных в табл. 1, введение АСЕ2 с помощью вектора AAV6 приводило к экспрессии этого гена на очень низком уровне у части животных, у остальных мРНК hACE2 вообще не удалось обнаружить. После введения гена АСЕ2 с помощью векторов AAV9 и AAV-DJ наблюдали его стабильную экспрессию в легких. Уровень экспрессии АСЕ2 статистически значимо не отличался при доставке векторами AAV9 и AAV-DJ. При сравнении количества мРНК hАСЕ2 в легких мышей при введении различных доз препаратов (от 6 × 109 до 6 × 1010 для вектора AAV9 и от 6 × 109 до 2 × 1010 для вектора AAV-DJ) выявлено, что экспрессия АСЕ2 отличалась незначительно и сохранялась на одном уровне вплоть до 21 суток. Для дальнейших экспериментов был выбран вектор AAV-DJ, так как при наработке давал более высокий выход.
Развитие инфекции, вызванной SARS-CoV-2, у трансдуцированных AAV-DJ-hАСЕ2 мышей
Дизайн эксперимента по изучению развития инфекции, вызываемой SARS-CoV-2, у трансдуцированных и нетрансдуцированных животных представлен в табл. 2.
Таблица 2.
Дизайн эксперимента по заражению мышей SARS-CoV-2
| №a | Число мышей | Время, сутки | |||||
|---|---|---|---|---|---|---|---|
| 1 | 10 | 14 (4 dpid) | 17 (7 dpid) | ||||
| введение вектораb | заражениеc | левое легкое | правое легкое | левое легкое | правое легкое | ||
| 1 | 3 | – | – | н.з.e | н.з. | н.з. | Гистология |
| 2 | 6 | + | – | РНКf | ИТg | РНК ИТ |
Гистология |
| 3 | 6 | + | + | РНК | ИТ | РНК ИТ |
Гистология |
| 4 | 6 | – | + | РНК | ИТ | РНК ИТ |
Гистология |
a Номер группы; b вектор AAV-DJ-hАСЕ2 в дозе 2 × 1010 вводили мышам интраназально; c мышей заражали вирусом SARS-CoV-2; d (day post-infection) ‒ день после заражения; в каждой группе проводили забор легких у трех животных; e легкие не забирали; f определение РНК SARS-CoV-2; g инфекционный титр SARS-CoV-2.
На 4 и 7 сутки после заражения у животных забирали легкие для определения инфекционного титра вируса, РНК SARS-CoV-2 и проведения гистологического исследования ‒ в соответствии с табл. 2.
Результаты измерения инфекционного титра SARS-CoV-2 в легких приведены в табл. 3. В незараженной группе 2 все образцы были отрицательными. В группе 3, трансдуцированной AAV-DJ-hACE2, на четвертые сутки после заражения инфекционный титр, lg ТЦИД50/мл, составлял в среднем 3.08 ± 0.14 lg. В те же сроки у животных группы 4 ‒ не трансдуцированных вектором ‒ титр был на порядок меньше и составлял 2.08 ± ± 0.14 lg. У животных, получивших AAV-DJ-hACE2, инфекционный титр снижался с 3.08 ± ± 0.14 lg на четвертых сутках до 2.17 ± 0.14 lg на седьмые, а в группе 4 на седьмые сутки вирус не детектировался вообще.
Таблица 3.
Анализ инфекционного титра и РНК SARS-CoV-2 в легких мышей
| Группа | № мыши | Время, сутки | |||
|---|---|---|---|---|---|
| 4 dpi | 7 dpi | ||||
| титр вируса, lg(ТЦИД50) |
вирусная РНК, Ct | титр вируса, lg(ТЦИД50) |
вирусная РНК, Ct | ||
| 1 | 1 | н.о.a | н.о. | ||
| 2 | н.о. | н.о. | |||
| 3 | н.о. | н.о. | |||
| 2 (+AAV-DJ-hACE2) |
1 | ‒b | ‒ | ‒ | ‒ |
| 2 | ‒ | ‒ | ‒ | ‒ | |
| 3 | ‒ | ‒ | ‒ | ‒ | |
| 3 (+AAV-DJ -hACE2 +SARS-CoV-2) |
1 | 3.25 | 28.4 | 2.25 | 29.1 |
| 2 | 3.0 | 24.1 | 2.25 | ‒ | |
| 3 | 3.0 | 27.5 | 2.0 | ‒ | |
| Среднее значение | 3.08 ± 0.14 | 26.7 ± 2.3 | 2.17 ± 0.14 | ||
| 4 (+SARS-CoV-2) |
1 | 2.0 | ‒ | н.о. | ‒ |
| 2 | 2.25 | 24.8 | н.о. | ‒ | |
| 3 | 2.0 | 26.8 | н.о. | ‒ | |
| Среднее значение | 2.08 ± 0.14 | ||||
При тестировании РНК SARS-CoV-2 с помощью набора АмплиТест SARS-CoV-2 методом ОТ-ПЦР в реальном времени выделение РНК и качество анализа оценивали по внутреннему контролю, разброс значений Ct для которого не превышал 1, что позволило сравнивать значения Ct для РНК SARS-CoV-2 без нормализации. На четвертые сутки достоверных отличий в уровне РНК SARS-CoV-2 между группами 3 и 4 не было. Образцы, полученные от всех трех мышей группы 3, были положительными ‒ среднее значение Ct составляло 26.7. В группе 4 один из трех образцов был отрицательным, значения Ct для остальных составляли 24.8 и 26.8. РНК SARS-CoV-2 в образцах, полученных на седьмые сутки, не определялась, за исключением одного образца из группы 3, где был выявлен ее низкий уровень (Ct = 29.1)
Морфологическое исследование легких мышей
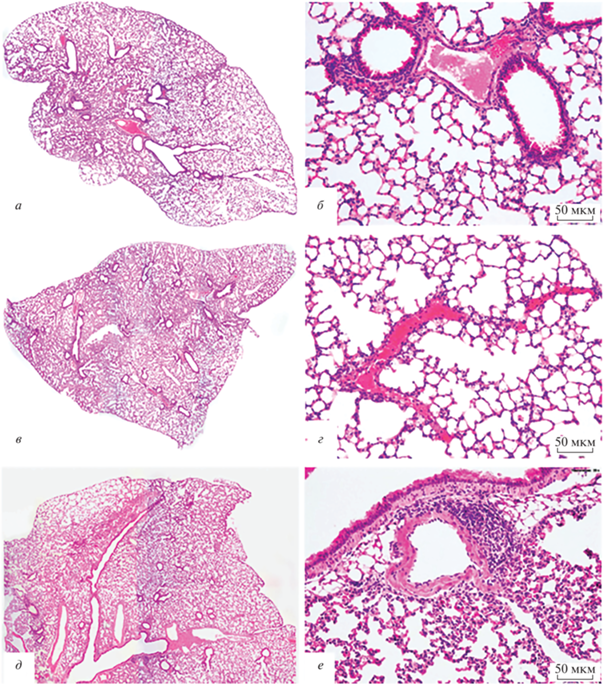
На 17 сутки эксперимента (7 день после заражения SARS-CoV-2 групп 3 и 4) у части животных проводили морфологическое исследование легких. Показано, что легкие интактных мышей (группа 1) и мышей группы 2 (17 сутки после введения AAV-DJ-hАСЕ2) имели нормальное строение (рис. 1а‒г). На 7 сутки после инфицирования SARS-CoV-2 у мышей из группы 4 (не трансдуцированных AAV-DJ-hАСЕ2) гистоструктура легких в целом соответствовала норме. Однако в стенке отдельных бронхов и в соединительной ткани вокруг единичных сосудов выявляли небольшие лимфогистиоцитарные скопления (рис. 1д, е).
Рис. 1.
Морфологическая характеристика легких мышей на 17 сутки эксперимента. Представлены легкие животных из контрольной группы 1 (а, б), из группы 2 (17 сутки после введения AАV-DJ-hАСЕ2) (в, г) и из группы 4 (7 день после заражения SARS-CoV-2) (д, е). В легких животных групп 1 и 2 (а–г) просветы бронхов свободные, в их стенке видны единичные лимфоциты, равномерно воздушные просветы альвеолярных ходов и альвеол, тонкие межальвеолярные перегородки. В группе 4 в стенке бронха и периваскулярно расположены небольшие лимфогистиоцитарные скопления. Окраска гематоксилином и эозином; увеличение: ×40 (а, в, д) и ×200 (б, г, е).
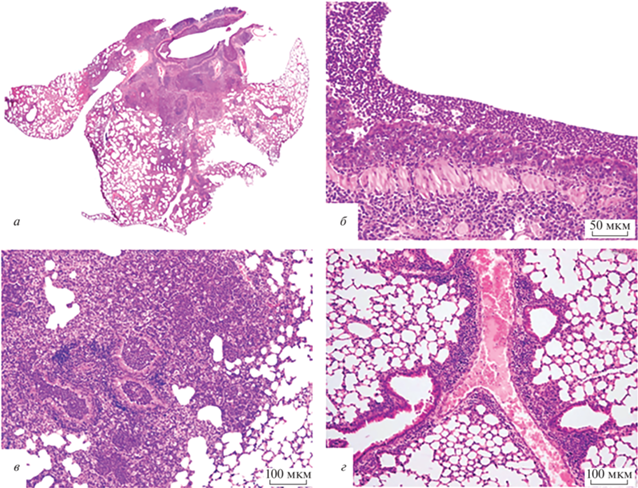
При микроскопическом исследовании легких мышей из группы 3 (получивших AAV-DJ-hACE2) ‒ на 7 сутки после заражения SARS-CoV-2 ‒ у двух мышей из трех обнаружены участки с выраженными альтеративными и воспалительными изменениями. В легком одной мыши безвоздушные очаги и участки со сниженной воздушностью занимали 60‒70% площади среза, у другой – 25‒30% (рис. 2а). Просветы бронхов в этих очагах были заполнены гнойным экссудатом. Эпителиальная выстилка бронхов содержала клетки с дистрофическими изменениями, часть эпителиоцитов была слущена в просвет ‒ вследствие цитопатического действия коронавируса. Собственная пластинка слизистой оболочки бронхов была умеренно инфильтрирована лимфоцитами, гистиоцитами и нейтрофилами (рис. 2б). В адвентициальном слое бронхов отмечена гиперплазия бронхоассоциированной лимфоидной ткани (БАЛТ). В расположенных перибронхиально альвеолярных ходах, альвеолах и периваскулярно выявлена выраженная воспалительная инфильтрация из лимфоцитов и гистиоцитов, чередующаяся с обширными зонами гнойного воспаления, в которых просвет альвеол и межальвеолярные перегородки не определялись (рис. 2в). В зонах вне пневмонии видна гиперемия сосудов, выраженная гиперплазия БАЛТ и периваскулярной лимфоидной ткани (рис. 2г). Таким образом, на седьмые сутки после интраназального заражения SARS-CoV-2 мышей, экспрессирующих hАСЕ2, в легких животных выявляли безвоздушные участки паренхимы, соответствовавшие бактериально-вирусной бронхопневмонии с началом абсцедирования.
Рис. 2.
Морфологическая характеристика легких мышей из группы 3, трансдуцированных AАV-DJ-hАСЕ2 и зараженных SARS-CoV-2, на 17 сутки эксперимента. а – Картина бронхопневмонии; б – просвет крупного бронха содержит гнойный экссудат, эпителий с дистрофическими изменениями, лейкопедез, воспалительная инфильтрация стенки; в – очаг бронхопневмонии: просветы бронхов, бронхиол и альвеол заполнены гнойным экссудатом со значительной примесью макрофагов; г – зона вне бронхопневмонии: муфтообразный периваскулярный лимфогистиоцитарный инфильтрат, гиперплазия БАЛТ, полнокровие сосуда. Окраска гематоксилином и эозином. Увеличение: ×40 (а), ×200 (б), ×100 (в, г).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ни одну из моделей животных, используемых сегодня для моделирования COVID-19, нельзя считать идеальной и полностью отражающей течение инфекции в организме человека. Широко используемая модель заболевания на сирийских хомячках поддерживает размножение вируса и вызывает патологический процесс в легких животных, но не приводит к летальным исходам. Использование мышей имеет свои преимущества. Мыши – наиболее распространенные мелкие лабораторные животные, их использование дешевле и удобнее для проведения масштабных исследований. Важное преимущество мышей – возможность детально исследовать Т-клеточный ответ, причем как с точки зрения его развития при инфекции COVID-19, так и после вакцинации [11]. Большой интерес представляет “летальная модель” трансгенных мышей, в геном которых встроен ген, кодирующий АСЕ2 человека ‒ ACE2, ‒ но доступ к таким животным ограничен.
Попытки обеспечить транзиентную экспрессию АСЕ2 для создания модели мышей, пригодной для инфицирования как SARS-CoV-1, так и SARS-CoV-2, предпринимались ранее. Для доставки гена АСЕ2 использовали аденовирусный вектор или аденоассоциированные векторы [2‒4, 12]. C.-P. Sun и соавт. [12] показали, что интраназальное введение мышам AAV6-hACE2 приводит к низкой трансдукции, в то время как интратрахеальное введение ‒ к высокой эффективности трансдукции клеток легких. L. Santry и др. [9] предложили модифицированную методику интраназального введения, которая позволила провести эффективную доставку вектора AAV6 с маркерным геном GFP в легкие мышей. Мы также использовали модифицированную методику для интраназального введения AAV. Однако введение вектора AAV6-hАСЕ2 приводило к очень низкому или недетектируемому уровню экспрессии hАСЕ2 в легких мышей. В то же время использование векторов других серотипов: AAV9 и AAV-DJ ‒ позволило успешно трансдуцировать клетки легких и достигнуть высокого и воспроизводимого уровня экспрессии ACE2. Таким образом, нам удалось избежать проблем, сопряженных с использованием интратрахеального введения вектора ‒ сложного и инвазивного метода, который приводит к большой вариабельности результатов.
При заражении животных, трансдуцированных AAV-DJ-hACE2, SARS-CoV-2 эффективно реплицировался в легких модельных мышей: инфекционный титр на 4 сутки составлял 3.08 lg и на 7 сутки снижался до 2.17 lg. Эти данные несколько отличаются от результатов, полученных B. Israelow и соавт. [3], которые показали полную элиминацию инфекционного вируса из легких на 7 сутки при использовании схожей модели. Неожиданным для нас фактом стало определение инфекционного вируса в низком титре у тех животных, которым не вводили AAV-hACE2, на 4 сутки после заражения SARS-CoV-2.
Данные по выявлению вирусной РНК оказались менее информативными, чем результаты по определению инфекционного титра: на 4 сутки после заражения вирусную РНК обнаруживали и в группе мышей, получивших AAV-DJ-hACE2, и в группе без AAV-DJ-hACE2. То, что вирусная РНК может циркулировать у мышей, не поддерживающих репликацию SARS-CoV-2, было продемонстрировано и в ранее опубликованных работах [3, 13].
Репликация SARS-CoV-2 в легких животных, трансдуцированных AAV-DJ-hACE2, приводила к развитию бактериально-вирусной бронхопневмонии на 7 сутки после заражения, в отличие от животных, не получивших AAV-DJ-hACE2. Присоединению бактериальной микрофлоры, вероятно, способствовало нарушение мукоцилиарного барьера воздухоносных путей, обусловленное прямым действием вируса на мерцательный эпителий бронхов. В легких нетрансдуцированных мышей на 7 сутки после заражения SARS-CoV-2 патологических изменений не обнаружено.
Таким образом, в проведенных нами экспериментах продемонстрирована возможность быстрого получения релевантной модели мышей, которые чувствительны к заражению SARS-CoV-2 и могут быть использованы для исследования эффективности разрабатываемых вакцин и препаратов для профилактики и лечения COVID-19.
Представленная нами модель может быть в дальнейшем усовершенствована для получения “летальной модели” инфекции SARS-CoV-2, которая наиболее востребована для исследования вакцин и лекарственных препаратов. Интересным направлением в оптимизации модели может быть введение AAV-hACE2 гуманизированным мышам. Использование таких мышей позволяет более точно имитировать клинические проявления COVID-19 у человека, в частности хроническое течение, развитие фиброза легких, а также системную лимфопению [13].
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-04-60100. Работа выполнена с использованием оборудования Центра коллективного пользования Научно-исследовательского института вакцин и сывороток им. И.И. Мечникова.
Все работы с животными проводились в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных (Страсбург, 1986); Приказом Министерства здравоохранения Российской Федерации № 199Н от 1 апреля 2016 года, Principles of Good Laboratory Practice (OECD, ENV/MC/CUEM (98)17, 1997); ГОСТ 33044-2014 “Принципы надлежащей лабораторной практики” (идентичен GLP OECD); Good Laboratory Practice for Nonclinical Laboratory Studies (21 CFR Part 58, 1978, USA, FDA), рассмотрены и утверждены комиссией ФГБНУ “Научно-исследовательского института вакцин и сывороток им. И.И. Мечникова” по уходу и использованию животных на предмет соответствия регулирующим актам.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Winkler E.S., Bailey A.L., Kafai N.M., Nair S., McCune B.T., Yu J., Fox J.M., Chen R.E., Earnest J.T., Keeler S.P., Ritter J.H., Kang L.I., Dort S., Robichaud A., Head R., Holtzman M.J., Diamond M.S. (2020) SARS-CoV-2 infection of human ACE2-transgenic mice causes severe lung inflammation and impaired function. Nat. Immunol. 21(11), 1327‒1335.
Hassan A.O., Case J.B., Winkler E.S., Thackray L.B., Kafai N.M., Bailey A.L., McCune B.T., Fox J.M., Chen R.E., Alsoussi W.B., Turner J.S., Schmitz A.J., Lei T., Shrihari S., Keeler S.P., Fremont D.H., Greco S., McCray P.B., Jr., Perlman S., Holtzman M.J., Ellebedy A.H., Diamond M.S. (2020) A SARS-CoV-2 infection model in mice demonstrates protection by neutralizing antibodies. Cell. 182(3), 744‒753.e4.
Israelow B., Song E., Mao T., Lu P., Meir A., Liu F., Alfajaro M.M., Wei J., Dong H., Homer R.J., Ring A., Wilen C.B., Iwasaki A. (2020) Mouse model of SARS-CoV-2 reveals inflammatory role of type I interferon signaling. J. Exp. Med. 7, 217(12), e20201241.
Sun J., Zhuang Z., Zheng J., Li K., Wong R. L., Liu D., Huang J., He J., Zhu A., Zhao J., Li X., Xi Y., Chen R., Alshukairi A. N., Chen Z., Zhang Z., Chen C., Huang X., Li F., Lai X., Chen D., Wen L., Zhuo J., Zhang Y., Wang Y., Huang S., Dai J., Shi Y., Zheng K., Leidin-ger M.R., Chen J, Li Y., Zhong N., Meyerholz D.K., McCray P.B. Jr, Perlman S., Zhao, J. (2020) Generation of a broadly useful model for COVID-19 pathogenesis, vaccination, and treatment. Cell. 182(3), 734–743.
Chan K.K., Dorosky D., Sharma P., Abbasi S.A., Dye J.M., Kranz D.M., Herbert A.S., Procko E. (2020). Engineering human ACE2 to optimize binding to the spike protein of SARS coronavirus 2. Science. 369(6508), 1261‒1265.
Higuchi R., Krummel B., Saiki R. (1988) A general method of in vitro preparation and specific mutagenesis of DNA fragments: study of protein and DNA interactions. Nucleic Acids Res. 16(15), 7351–7367.
Kimura T., Ferran B., Tsukahara Y., Shang Q., Desai S., Fedoce A., Pimentel D.R., Luptak I., Adachi T., Ido Y., Matsui R., Bachschmid M.M. (2019) Production of adeno-associated virus vectors for in vitro and in vivo applications. Sci. Rep. 9(1), 13601.
Aurnhammer C., Haase M., Muether N., Hausl M., Rauschhuber C., Huber I., Nitschko H., Busch U., Sing A., Ehrhardt A., Baiker A. (2012) Universal real-time PCR for the detection and quantification of adeno-associated virus serotype 2-derived inverted terminal repeat sequences. Hum. Gene Ther. Methods. 23(1), 18‒28.
Santry L.A., Ingrao J.C., Yu D.L., de Jong J.G., van Lieshout L.P., Wood G.A., Wootton S.K. (2017) AAV vector distribution in the mouse respiratory tract following four different methods of administration. BMC Biotechnol. 17(1), 43.
Ramakrishnan M.A. (2016) Determination of 50% endpoint titer using a simple formula. World J. Virol. 5(2), 85–86.
Veit S., Jany S., Fux R., Sutter G., Volz A. (2018) CD8+ T cells responding to the middle east respiratory syndrome coronavirus nucleocapsid protein delivered by vaccinia virus MVA in mice. Viruses. 10(12), 718.
Sun C.-P., Jan J.-T., Wang I.-H., Ma H.-H., Ko H.-Y., Wu P.-Y., Kuo T.-J., Liao H.-N., Lan Y.-H., Sie Z.-L., Chen Y.-H., Ko Y.-A., Liao C.-C., Chen L.-Y., Lee I.-J., Tsung S.-I., Lai Y.-J., Chiang M.-T., Liang J.-J., Liu W.-C., Wang J.-R., Yuan J.P.-Y., Lin Y.-S., Tsai Y.-C., Hsieh S.-L., Li C.-W., Wu H.-C., Ko T.-M., Lin Y.-L., Tao M.-H. (2021) Rapid generation of mouse model for emerging infectious disease with the case of severe COVID-19. PLoS Pathog. 17(8), e1009758.
Sefik E., Israelow B., Mirza H., Zhao J., Qu R., Kaffe E., Song E., Halene S., Meffre E., Kluger Y., Nussenzweig M., Wilen C.B., Iwasaki A., Flavell R.A. (2022) A humanized mouse model of chronic COVID-19. Nat. Biotechnol. 40, 906–920.https://doi.org/10.1038/s41587-021-01155-4
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


