Молекулярная биология, 2022, T. 56, № 5, стр. 795-807
Экспрессия обратной транскриптазы ВИЧ-1 вызывает усиление дыхательной активности митохондрий в клетках аденокарциномы мышей
Н. Ф. Закирова a, А. С. Кондрашова b, *, М. В. Голиков a, О. Н. Иванова a, А. В. Иванов a, М. Г. Исагулянц a, c, d, e, Е. О. Баюрова b, d
a Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
b Федеральный научный центр исследований и разработки иммунобиологических препаратов им. М.П. Чумакова Российской академии наук (Институт полиомиелита)
108819 Москва, Россия
c Российский университет дружбы народов
117198 Москва, Россия
d Национальный исследовательский центр эпидемиологии и микробиологии им. почетного академика Н.Ф. Гамалеи Министерства здравоохранения России
123098 Москва, Россия
e Рижский университет им. Страдыня
LV-1007 Рига, Латвия
* E-mail: kondrashova_as@chumakovs.su
Поступила в редакцию 03.05.2022
После доработки 04.05.2022
Принята к публикации 04.05.2022
- EDN: VZNDIQ
- DOI: 10.31857/S0026898422050160
Аннотация
Изменения метаболических путей часто связаны с развитием широкого спектра патологий. Усиленный гликолиз в условиях достаточного снабжения тканей кислородом и его разобщение с циклом Кребса, известные как аэробный гликолиз, или эффект Варбурга, ‒ отличительная черта многих злокачественных новообразований. Идентификация конкретных метаболических сдвигов позволяет характеризовать метаболическое программирование отдельных типов опухолевых клеток, стадию их трансформации и прогнозировать их метастатический потенциал. Вирусная инфекция также может изменять метаболизм клеток для обеспечения процесса вирусной репликации. Инфекция вирусом иммунодефицита человека 1 типа (ВИЧ-1) ассоциирована с повышенной частотой развития различных онкологических заболеваний, а для отдельных вирусных белков выявлен онкогенный потенциал. В частности, ранее нами показано, что экспрессия обратной транскриптазы (ОТ) ВИЧ-1 в клетках аденокарциномы молочной железы 4T1 приводит к усилению туморогенного и метастатического потенциала клеток in vitro и in vivo по механизму, связанному со способностью ОТ индуцировать в клетках активные формы кислорода (АФК). Целью представленной работы было изучение молекулярного механизма этого процесса, а именно влияние ОТ ВИЧ-1 на ключевые метаболические пути, связанные с опухолевой прогрессией: гликолиз и митохондриальное дыхание. Экспрессия ОТ ВИЧ-1 не оказывала эффекта на процесс гликолиза. В то же время она приводила к усилению митохондриального дыхания и уровня синтеза АТФ в клетке, при этом не влияя на доступность субстратов – доноров углерода для цикла Кребса, – что исключает влияние ОТ на метаболитические ферменты клеток. Усиление митохондриального дыхания было связано с восстановлением митохондриальной сети, несмотря на ОТ-индуцированное снижение митохондриальной массы. Усиление митохондриального дыхания может увеличивать подвижность клеток, что объясняет их повышенную туморогенность и метастатический потенциал. Эти данные важны для понимания патогенеза инфекции ВИЧ-1, включая стимуляцию процесса образования и распространения ассоциированных с ВИЧ-1 злокачественных новообразований.
Развитие широкого спектра патологий сопровождается изменением метаболизма клеток. К наиболее известным примерам относится эффект Варбурга, заключающийся в усилении гликолиза и разобщении этого процесса с циклом Кребса [1]. Такое усиление сопровождается активацией анаболических путей, связанных с гликолизом: пентозофосфатного пути (биосинтез нуклеотидов), de novo биосинтеза серина/глицина (связанных с фолатным циклом), пути биосинтеза глюкозаминогликанов и т.д. [1]. Разобщение гликолиза и цикла Кребса не означает снижения дыхательной активности митохондрий, так как донорами углерода могут становиться процессы глутаминолиза [2], окисления жирных кислот [3], синтеза ацетилкоэнзима А напрямую из ацетата [4, 5]. В опухолевых клетках происходит нарушение интенсивности системы окислительного фосфорилирования и связанной с ней продукции активных форм кислорода (АФК), что приводит к окислительному стрессу [6, 7]. Считается, что митохондрии вносят наибольший вклад во внутриклеточную продукцию АФК в большинстве типов клеток [8‒10]. Сдвиги в использовании субстрата в метаболизме, характерные для опухолевых клеток, могут быть зарегистрированы посредством измерения скорости поглощения кислорода (OCR, oxygen consumption rate) для количественной оценки митохондриального дыхания и скорости внеклеточного закисления культуральной среды (ECAR, extracellular acidification rate) ‒ индикатора гликолиза. Такие измерения позволяют охарактеризовать метаболическое программирование отдельных типов опухолевых клеток, стадию их трансформации и прогнозировать их метастатический потенциал.
Около 10% всех опухолей связаны с инфекцией онкогенными вирусами, к которым принято относить вирус гепатита С (ВГС), вирус гепатита В (ВГВ), вирусы папилломы человека высокого канцерогенного риска (ВПЧ ВКР), вирус Эпштейна‒Барр (ВЭБ), вирус герпеса, ассоциированный с саркомой Капоши, вирус Т-клеточного лейкоза человека I типа и полиомавирус клеток Меркеля [11, 12]. C инфекцией ВПЧ ВКР ассоциировано до 4.5% общего числа зарегистрированных злокачественных новообразований и большинство случаев рака шейки матки (вирусную ДНК выявляют у 99.7% больных), злокачественных опухолей аногенитальной области, рака головы и шеи [13, 14]. До 65% зарегистрированных в мире случаев наиболее распространенной формы злокачественного новообразования печени ‒ гепатоцеллюлярной карциномы ‒ ассоциировано с хронической инфекцией ВГВ и/или ВГС [15].
Для многих вирусных инфекций описаны нарушения тех или иных метаболических путей в инфицированных клетках [16, 17]. Интересно, что, по крайней мере, ряд хронических вирусных инфекций вызывает в клетках и в организме в целом метаболитические изменения, сходные с таковыми в опухолевых клетках и злокачественных новообразованиях [18–20]. Яркий пример ‒ эффект Варбурга. Это преимущественная выработка опухолевыми клетками энергии не в цикле Кребса и окислительного фосфорилирования в митохондриях, а путем анаэробного гликолиза, заключающегося в преимущественном поглощении глюкозы с образованием молочной кислоты не в митохондриях, а в цитоплазме – даже в присутствии в клетках достаточного количества кислорода [21]. Важная роль эффекта Варбурга заключается в обеспечении быстро делящихся опухолевых клеток достаточным количеством нуклеотидов, аминокислот и липидов [22]. Логично предположить, что это необходимо и вирусам для обеспечения синтеза компонентов вирионов. И действительно, при хронической вирусной инфекции часто происходит усиление эффекта Варбурга и глутаминолиза (например, см. [18, 19, 23]). Этот феномен может отражать как создание условий для индукции вирусассоциированного онкогенеза, так и быть его следствием (последствием уже индуцированной вирусом злокачественной трансформации) [24]. Кроме того, вирусы способны изменять метаболизм клетки для противодействия АФК, вырабатываемым хозяином в ответ на вирусную инфекцию [25, 26]. Для молекулярной медицины крайне актуально изучение механизмов вирусассоциированной злокачественной трансформации клеток и влияния инфекции на опухолевую прогрессию.
Инфекция ВИЧ-1 ассоциирована с повышенной частотой развития различных онкологических заболеваний как связанных, так и не связанных с развитием синдрома приобретенного иммунного дефицита (СПИД) [27, 28]. Принято считать, что ВИЧ-1-ассоциированный онкогенез связан с иммуносупрессией и системной иммунной дисфункцией, не полностью преодолеваемыми антиретровирусной терапией [29‒31]. Однако канцерогенный потенциал выявлен и для целого ряда белков ВИЧ-1 [32]. Недавно нами показано, что экспрессия обратной транскриптазы (ОТ) ВИЧ-1 в клетках аденокарциономы молочной железы 4T1 приводит к усилению туморогенного и метастатического потенциала этих клеток in vitro и in vivo по механизму, зависящему от ОТ-индуцированного повышения уровня АФК [33].
Целью представленной работы было изучение молекулярных механизмов, вовлеченных в этот процесс, в частности влияния продукции ОТ ВИЧ-1 на два ключевых метаболических процесса клеток: гликолиз и митохондриальное дыхание, ‒ в значительной степени определяющих опухолевую прогрессию.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Производные клеточной линии 4T1luc2, стабильно экспрессирующие ОТ ВИЧ-1. В работе была использована клеточная линия аденокарциномы молочной железы мышей 4T1luc2 (Bioware Ultra Cell Line 4T1luc2; “Caliper Life Sciences Inc.”, США) и ее производные, экспрессирующие консенсусный вариант ОТ ВИЧ-1: 4T1luc2_RT-1.3, 4T1luc2_RT-5.3, 4T1luc2_RT-20.1, ‒ описанные нами ранее [33] и характеризующиеся возрастающей продукцией ОТ на клетку (40‒200 фемтограммов (фг)).
Культивирование клеточных линий. Клетки культивировали при 37°С во влажной атмосфере с 5% СО2 в среде RPMI-1640 (“Gibco”, США), содержащей 10% фетальной сыворотки крупного рогатого скота (FBS; “HyClone”, США), 2 мМ глутамин (“ПанЭко”, Россия), 50 ед./мл пенициллина (“ПанЭко”) и 50 мкг/мл стрептомицина (“ПанЭко”). Пересев клеток проводили каждые 2–3 суток при достижении 90–95% монослоя.
Анализ интенсивностей гликолиза и митохондриального дыхания. За 24 ч до анализа высаживали 3 × 104 клеток на ячейку планшета для анализатора Seahorse XFe24 (“Agilent”, США) в среде RPMI-1640 c 10% FBS. За 30 мин до анализа культуральную среду заменяли на среду DMEM (“Gibco”), не содержащую бикарбонатного буфера и фенолового красного и содержащую 2 мМ глутамин и, в случае теста Mitostress, 11 мМ глюкозы (“Sigma”, Германия), и до проведения теста держали в СО2-термостате при температуре 37°С и концентрации СО2 5%. Тест проводили на анализаторе Seahorse, как описано ранее [34]. После проведения анализа клетки лизировали и измеряли концентрацию тотального белка с использованием набора PierceBCA Protein Assay Kit (“Thermo Fisher Scientific”, США), согласно инструкции производителя. Результаты тестов Mitostress и Glycostress нормировали на уровни тотального белка.
Анализ цитотоксичности ингибиторов метаболических ферментов. За 24 ч до начала эксперимента высаживали 1 × 104 клеток на ячейку 96-луночного планшета, затем вносили ингибитор гликолиза (2-дезокси-D-глюкоза; “Sigma”) в диапазоне концентраций 0.63–15 мМ, глутаминолиза (СВ839; “Cayman Chemical”, США) в концентрациях 0.5–10 мкМ, карнитинового транспортера (Etomoxir; “Sigma”) в концентрациях 31–500 мкМ или ингибиторов респираторых комплексов: метформина (“Sigma”) и фенформина (“Sigma”) в концентрациях 0.5–10 мМ и 1–50 мкМ соответственно. Через 48 ч оценивали количество жизнеспособных клеток стандартным МТТ-тестом, как описано ранее [34].
Измерение массы митохондрий. Клетки 4Т1luc2 и производные линии, экспрессирующие ОТ ВИЧ-1, высевали на 12-луночные планшеты при плотности 2 × 105 клеток/ячейка. При достижении 90%-ного монослоя культуральную среду удаляли и заменяли свежей, содержащей 1.5 мкМ красителя Mitotracker Red CM-H2XROS (“Thermo Fisher Scientific”). После 45 мин инкубации при 37°С клетки промывали теплой свежей средой, обрабатывали 0.05%-ным раствором трипсина с ЭДТА (“Serva”, Германия), ресуспендировали, осаждали центрифугированием и ресуспендировали в свежей среде DMEM без фенолового красного. Уровни флуоресценции измеряли на проточном цитометре BD LSR Fortessa Flow Cytometer (“Becton Dickinson”, США) при возбуждении флуоресценции лазером с длиной волны 561 нм и регистрации сигнала при 610 нм. Анализ данных проводили при помощи программы Flowing Software версия 2.5.1 (https://bioscience.fi/services/cell-imaging/flowing-software/; University of Turku, Финляндия).
Анализ морфологии митохондрий. Клетки высевали в конфокальные чашки диаметром 35 мм со стеклянными вставками. Через 24 ч добавляли Mitotracker Red CM-H2XROS до конечной концентрации 1.5 мкМ в свежей, предварительно нагретой среде; через 45 мин клетки промывали теплым фосфатно-солевым буфером, а затем средой DMEM без фенолового красного. Конфокальные 8-битные цифровые изображения получали с использованием конфокального лазерного сканирующего микроскопа Leica TCS SP5 (“Leica Microsystems”, Германия), оснащенного масляным иммерсионным объективом HCX PLAPO CS 63 × 1.4. Флуоресценцию возбуждали при 543 нм и регистрировали в диапазоне 560–600 нм. Доступ к фенотипу митохондриальной морфологии был получен, по крайней мере, в 30 клетках. Каждая клетка была классифицирована в соответствии с общим статусом фенотипа митохондрий. Клетку относили к нитчатому фенотипу, если >70% митохондрий в ней были удлиненными, к фрагментированному фенотипу, если <30% митохондрий были слившимися, или к промежуточному фенотипу (50%). Подсчет проводили вслепую, независимо два исследователя. Оценивали число клеток, принадлежащих к каждому из фенотипов, относительно общего числа полученных изображений клеток.
Статистический анализ данных. Все данные представляют средние значения ± стандартное отклонение (SD). Для тестов, в которых число измерений (повторов измерений) или число независимых измерений не превышало 10, статистическую значимость оценивали с помощью критерия Крускала‒Уоллиса с критерием множественных сравнений Данна и попарно с применением критерия Манна‒Уитни (Prism, GraphPad Software, США). Корреляции между наборами данных оценивали с использованием критерия ранжирования Спирмена (Prism). Для остальных тестов разницы величин оценивали t-тестом с применением критерия Стьюдента, тогда как множественные сравнения были выполнены с помощью дисперсионного анализа (ANOVA) с апостериорным критерием Тьюки или по Фридману с критерием согласованности Кендалла для сравнения зависимых выборок. Для парных сравнений использовали знаковый тест (sign test). Величина р < 0.05 считалась статистически значимой, если не указано иное (Statistica Axa 11, “Tibco”, США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Экспрессия ОТ ВИЧ-1 не влияет на гликолиз
Гликолиз представляет собой процесс превращения глюкозы в пируват, который может быть транспортирован в митохондрии для последующего включения в цикл Кребса или секретирован в форме лактата. Оценку эффективности гликолиза оценивали при использовании анализатора Seahorse, который позволяет оценивать уровни закисления культуральной среды. Измерение проводили согласно методике теста Glycostress, т.е. сначала в отсутствие глюкозы (определяют уровень негликолитического закисления, который обусловлен отличными от гликолиза процессами в клетке), затем в присутствии глюкозы в концентрациях 1 г/л (11 мМ) и 4.5 г/л (30 мМ) (т.е., в стандартной и высокоглюкозной среде DMEM), после добавления ингибитора АТФазы митохондрий олигомицина (активирует гликолиз до максимально возможного уровня для компенсации синтеза АТФ), а в завершение – после добавления ингибитора первой стадии гликолиза, 2-дезокси-D-глюкозы (рис. 1а). Емкость гликолитического резерва рассчитывали как разницу между максимальной гликолитической способностью и уровнем гликолиза при 30 мМ глюкозы.
Рис. 1.
Экспрессия обратной транскриптазы ВИЧ-1 в клетках 4T1luc2 не влияет на уровень гликолиза. а ‒ Эффективность гликолиза ОТ-экспрессирующих вариантов: 4T1luc2_RT-1.3, 4T1luc2_RT-5.3, 4T1luc2_RT-20.1 ‒ оценивали с использованием анализатора Seahorse, согласно методике теста Glycostress. Определение ECAR в среде со стандартной, 11 мМ (б), и высокой, 30 мМ (в), концентрацией глюкозы. г ‒ Максимальные значения ECAR при стимуляции 1 мкМ олигомицином. д ‒ Емкость гликолитического резерва, рассчитанная как разница между максимальной гликолитической способностью и уровнем ECAR в высокоглюкозной (30 мМ) среде. е ‒ ECAR перед введением глюкозы (негликолитическое закисление). Значения ECAR выражены в единицах мрН/мин и нормализованы на 1 мг клеточного белка (mpH/min/Norm. Unit). Гистограммы представлены как среднее значение ± SD для анализа, проведенного в четырех повторах. Статистическую значимость оценивали с помощью критерия Крускала‒Уоллиса с критерием множественных сравнений Данна и попарно с применением критерия Манна‒Уитни (*p < 0.05).

В результате проведенных измерений показано, что клеточная линия 4Т1luc2 и ее ОТ-экспрессирующие производные: 4T1luc2_RT-1.3, 4T1luc2_RT-5.3, 4T1luc2_RT-20.1 [33] ‒ имели сходные уровни базального (в стандартной и высокоглюкозной среде) и максимального гликолиза (рис. 1б‒г), т.е. экспрессия ОТ ВИЧ-1 в клетках опухоли молочной железы мышей не приводила к заметным изменениям в процессе гликолиза. Из различий в параметрах гликолиза между исходной линией и субклонами можно отметить пониженное негликолитическое закисление для субклона 4T1luc2_RT-20.1 в сравнении с остальными линиями (рис. 1е). Также для этого субклона был отмечен пониженный гликолитический резерв, по крайней мере в сравнении с субклоном 4T1luc2_RT-1.3 (рис. 1д).
Экспрессия ОТ ВИЧ-1 усиливает дыхательную активность митохондрий клеток
Еще один важнейший метаболический процесс ‒ дыхание митохондрий, показывающее активность работы системы окислительного фосфорилирования и связанных с ней процессов цикла Кребса, который обеспечивает дыхательную систему субстратами. Влияние ОТ ВИЧ-1 на дыхательную активность митохондрий, как и оценку эффективности гликолиза, определяли на анализаторе Seahorse, позволяющем также измерять уровни поглощения кислорода. Измерение дыхания по методике Mitostress проводили после последовательного добавления реагентов. Сначала определяли базовый уровень дыхания. Затем клетки обрабатывали олигомицином; уровень падения дыхательной активности отражал уровень синтеза АТФ системой окислительного фосфорилирования. Далее к клеткам добавляли разобщитель транспорта протонов через мембрану митохондрий и АТФ-синтазы ‒ карбонилцианид-4-трифторметоксифенилгидразон (FCCP); при этом дыхание достигало максимально возможного уровня. Так как при высоких концентрациях разобщитель может, наоборот, ингибировать дыхание, то измерение проводили в присутствии двух концентраций FCCP. На основании полученных данных рассчитывали разницу между уровнями базального и максимального дыхания, определяемую как “свободный дыхательный запас” (spare respiratory capacity). На финальной стадии вносили ингибиторы митохондриальных комплексов I и III ротенон и антимицин и определяли остаточный уровень дыхания, отражающий уровень поглощения кислорода немитохондриальными ферментами (системами), ‒ немитохондриальное дыхание. Разница между максимальным уровнем поглощения кислорода и уровнем после добавления олигомицина отражала интенсивность утечки протонов.
Результаты представлены на рис. 2. Можно видеть, что экспрессия ОТ ВИЧ-1 влияла на митохондриальное дыхание (рис. 2а‒ж). В частности, достоверно повышался базальный уровень дыхания, продукция АТФ (рис. 2б, г, р < 0.05), максимальный уровень дыхания (рис. 2д, е) и свободный дыхательный запас (рис. 2ж, тенденция, р = 0.05, достоверно при попарных сравнениях). Экспрессия ОТ ВИЧ-1 не влияла ни на утечку протонов (рис. 2в), за исключением некоторого ее повышения для субклона 4T1luc2_RT-20.1 в сравнении с остальными линиями, ни на немитохондриальное дыхание (рис. 2з). Таким образом, синтез ОТ ВИЧ-1 в клетках опухоли молочной железы мышей индуцировал усиление их метаболитической активности.
Рис. 2.
Экспрессия обратной транскриптазы ВИЧ-1 в клетках 4T1luc2 усиливает дыхательную активность митохондрий. а ‒ Дыхательную активность ОТ-экспрессирующих вариантов: 4T1luc2_RT-1.3, 4T1luc2_RT-5.3, 4T1luc2_RT-20.1 ‒ анализировали при помощи технологии Seahorse и набора реагентов Mitostress. б ‒ Базальный уровень дыхания определяли как разницу между базовым и немитохондриальным значениями OCR. в ‒ Интенсивность утечки протонов оценивали после обработки олигомицином. г ‒ АТФ-связанный OCR получен как разница между базальным значением OCR и OCR, ингибированным антимицином А. д, е ‒ Максимальную величину OCR стимулировали добавлением FCCP в концентрациях 0.75 и 1.5 мкМ соответственно. ж ‒ Свободный дыхательный запас рассчитывали как разницу между максимальным и базальным OCR. з ‒ Базовые митохондриальные показания OCR получали путем вычитания немитохондриального OCR. и ‒ Корреляция показателей базального дыхания и продукции АТФ. Значения OCR выражены в единицах пмоль/мин и нормализованы на 1 мг клеточного белка (pmol/min/Norm. Unit). Гистограммы представлены как среднее значение ± SD для анализа, проведенного в четырех повторах. Статистическую значимость оценивали с помощью критерия Крускала‒Уоллиса с критерием множественных сравнений Данна (*р < 0.05) и попарно с применением критерия Манна‒Уитни. Уровни базального дыхания и продукции АТФ коррелировали с использованием критерия ранжирования Спирмена.
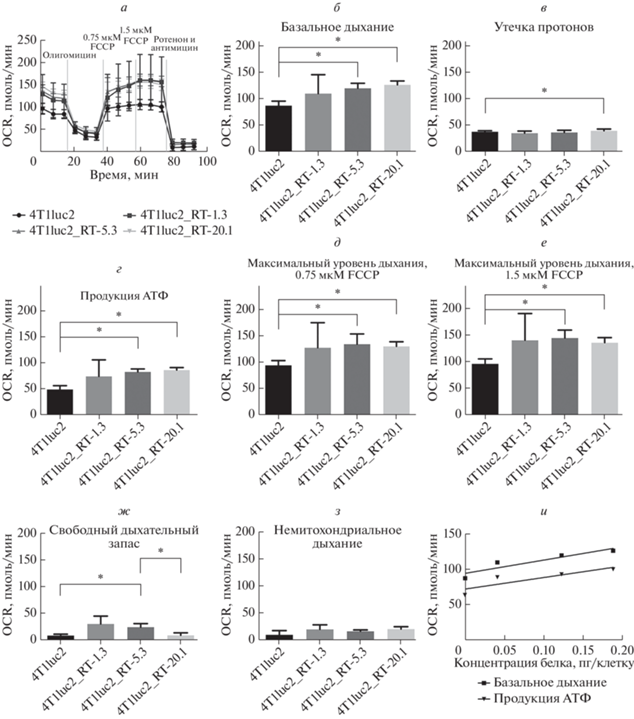
Субклоны 4T1luc2_RT-1.3, 4T1luc2_RT-5.3, 4T1luc2_RT-20.1 продуцировали ОТ ВИЧ-1 в количестве 40, 125 и 190 фг на клетку соответственно; уровень эндогенной ОТ в клетках 4Т1luc2 был ниже порога чувствительности метода определения (<1 фг) [33]. Наличие этих данных позволило оценить количественную зависимость дыхательной активности митохондрий от уровня синтеза ОТ. Выявлено, что уровень базального дыхания и продукция АТФ напрямую зависят от количества синтезируемой клетками ОТ (рис. 2и); у обоих суб-клонов, характеризующихся высоким уровнем продукции ОТ (4T1luc2_RT-5.3 и 4T1luc2_RT-20.1), эти параметры были достоверно повышены по сравнению с исходной клеточной линией (рис. 2б, г; р < 0.05). В остальном различия в параметрах митохондриального дыхания между субклонами были минимальными. В частности, можно отметить пониженный “свободный дыхательный запас” для 4T1luc2_RT-20.1 в сравнении с 4T1luc2_RT-5.3 (рис. 2г; p < 0.05 ‒ тест Манна‒Уитни).
ОТ ВИЧ-1 не влияет на основные метаболические пути клетки
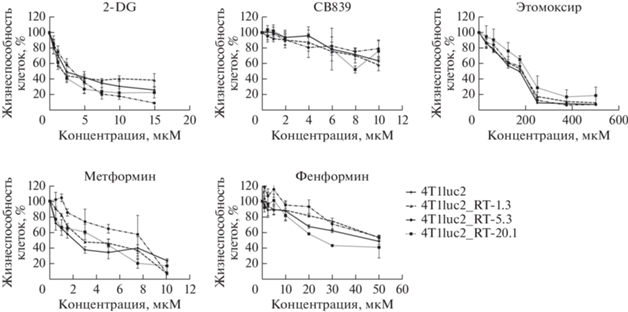
Одной из причин усиления дыхательной активности митохондрий может быть повышение внутриклеточных концентраций субстратов – доноров углерода для цикла Кребса [35]. Вклад отдельных путей в усиление дыхательной активности можно оценить, изучив чувствительность клеток к ингибиторам соответствующих метаболических ферментов, как показано нами ранее [34]. В связи с этим следующим этапом стал анализ цитотоксичности блокаторов гликолиза, глутаминолиза и окисления жирных кислот: ингибиторов гексокиназы (2-дезокси-D-глюкозы), глутаминазы (CB839) и карнитинового транспортера митохондрий (этомоксира) соответственно. Кроме того, в исследовании использованы и ингибиторы митохондриальных респираторных комплексов: метформин и фенформин. Результаты представлены на рис. 3. Можно видеть, что экспрессия ОТ ВИЧ-1 не влияла на чувствительность клеток к указанным выше соединениям (при сравнении с исходной линией все р > 0.05). Отсюда можно сделать вывод, что усиление дыхательной активности митохондрий не связано с усилением активности гликолиза, глутаминолиза или окисления жирных кислот.
Рис. 3.
Экспрессия обратной транскриптазы ВИЧ-1 не влияет на чувствительность клеток 4T1luc2 к ингибиторам метаболических путей. Клетки выдерживали в присутствии ингибиторов гликолиза (2-дезокси-D-глюкоза, 2-DG), глутаминолиза (CB839), карнитинового транспортера митохондрий (Этомоксир) и респираторных комплексов (Метформин, Фенформин) в течение 48 ч с последующим анализом жизнеспособности МТТ-тестом. Статистический анализ показал отсутствие различий между исходной линией и экспрессирующими ОТ ВИЧ-1 субклонами (все р > 0.05).
Высокий уровень экспрессии ОТ ВИЧ-1 снижает общую массу митохондрий
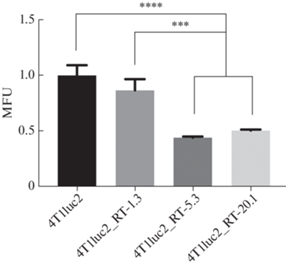
Другой причиной повышения дыхательной активности клеток может быть усиление биогенеза митохондрий и/или подавление их уничтожения (митофагии), что приводит к увеличению митохондриальной массы. Именно поэтому следующей задачей работы стала оценка влияния ОТ ВИЧ-1 на содержание митохондриальной массы, что было выполнено окраской клеток красителем MitoTracker Red с последующим измерением уровня флуоресцентного сигнала проточной цитометрией. Однако, вопреки ожиданиям, экспрессия ОТ ВИЧ-1 вызывала не повышение, а снижение митохондриальной массы (рис. 4). Эффект проявлялся для субклонов 4T1luc2_RT-5.3 и 4T1luc2_RT-20.1, характеризующихся высоким уровнем синтеза ОТ и усиленной дыхательной активностью митохондрий. Таким образом, усиление дыхания было сопряжено не с увеличением митохондриальной массы, а, напротив, с ее уменьшением.
Рис. 4.
Экспрессия обратной транскриптазы ВИЧ-1 в клетках 4T1luc2 приводит к снижению массы митохондрий. Общую массу митохондрий оценивали окрашиванием клеток реагентом MitoTracker Red с последующим измерением уровня сигнала проточной цитометрией (mean fluorescent unit, MFU). Различия проанализированы с использованием двустороннего непарного t-критерия Стьюдента, множественные сравнения выполнены с помощью дисперсионного анализа (ANOVA) с апостериорным критерием Тьюки. ***р < 0.001, ****р < 0.000).
Экспрессия ОТ ВИЧ-1 изменяет структуру митохондриальной сети
Еще одно возможное объяснение повышенной дыхательной активности ‒ перестройка митохондрий в обширную сеть [36]. Структуру митохондриальной сети оценивали с помощью конфокальной микроскопии путем высаживания клеточных линий на чашки со стеклянным дном и окрашивания красителем MitoTracked Red. В каждом эксперименте визуализировали 30 клеток. Фенотип митохондрий каждой отдельной клетки классифицировали по окрашиванию на нитевидные митохондриальные сети (MN > 70% слившихся митохондрий), промежуточные (примерно равное число слившихся и поделившихся мембран, MN ≈ 50%) и фрагментированные (MN < 30% слившихся митохондрий). Типичные изображения и количественный анализ представлены на рис. 5а‒д. Можно видеть, что во всех субклонах бóльшая часть клеток содержала разрозненные или частично ассоциированные митохондрии. В случае клеток с максимальной экспрессией ОТ наблюдалось появление протяженных митохондриальных сетей, однако их доля не превышала 30%.
Рис. 5.
Обратная транскриптаза ВИЧ-1 изменяет структуру митохондриальной сети в клетках. а ‒ Клетки обрабатывали MitoTracker Red, окрашивание визуализировали конфокальной микроскопией. б ‒ Количественное определение клеток с нитевидными (MN > 70%), промежуточными (MN ≈ 50%) и фрагментированными (MN < 30%) митохондриями проводили путем подсчета процента клеток, принадлежащих к каждому из фенотипов, от общего числа клеток. Пропорция клеток с фенотипом митохондрий MN > 70% (в), MN ≈ 50% (г), MN < 30% (д). *р < 0.05 (ANOVA, Фридман).
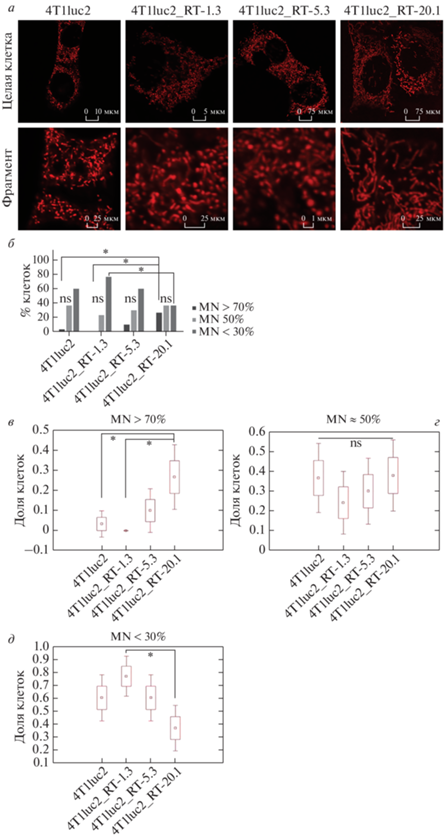
Частота клеток с фенотипом митохондрий MN > 70% в исходной клеточной линии 4T1luc2 и субклонах 4T1luc2_RT-1.3 и 4T1luc2_RT-5.3 не различалась (p > 0.1, знаковый тест; рис. 5б, в). Однако в субклоне 4T1luc2_RT-20.1, сверхэкспрессирующем ОТ, доля клеток с фенотипом MN > 70% значительно увеличилась (4T1luc2 по сравнению с 4T1luc2_RT-20.1, p = 0.023, знаковый тест; рис. 5б, в). Кроме того, в субклоне 4T1luc2_RT-20.1 было значительно больше клеток с фенотипом MN > 70%, чем в 4T1luc2_RT-1.3 (p = 0.01, знаковый тест; рис. 5б, в). Частота клеток с фенотипом митохондрий MN ≈ 50% и MN < < 30% не различалась между клетками исходной линии 4T1luc2 и субклонами, а также между субклонами (рис. 5б, г, д). Линия 4T1luc2_RT-20.1 имела слабую тенденцию к снижению числа клеток с фенотипом MN < 30% (p = 0.096) в сравнении с исходной линией 4T1luc2 и значительно меньше клеток с фенотипом MN < 30%, чем 4T1luc2_RT-1.3 (p = 0.01, знаковый тест; рис. 5б, д). По-видимому, это значит, что избыточная экспрессия ОТ ВИЧ-1 восстанавливает митохондриальные сети, нарушенные в исходных клетках и в субклонах с низким уровнем экспрессии ОТ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В клетках опухоли молочной железы снижен резерв митохондриального дыхания [37]. Однако недавно показано, что метастатическая аденокарцинома молочной железы характеризуется усиленным митохондриальным биогенезом и дыханием [38]. Согласно этим выводам, усиление митохондриального дыхания клеток злокачественного новообразования молочной железы может привести к их повышенной метастатической активности, а именно опухолевые клетки с более высокой емкостью митохондриального дыхания будут с большей вероятностью мигрировать с образованием метастаз. Это согласуется с ранее опубликованными нами данными по экспрессии ОТ в клетках опухоли молочной железы 4T1. В in vivo исследовании на сингенных мышах мы продемонстрировали повышенную метастатическую активность клеток аденокарциномы молочной железы мышей 4Т1luc2, экспрессирующих ОТ ВИЧ-1, в сравнении с исходными клетками 4Т1luc2 [33]. Теперь нами показано, что в субклонах 4Т1luc2 с высоким уровнем продукции ОТ (>100 фг на клетку) усилено митохондриальное дыхание, в частности более интенсивно базальное дыхание, повышены уровни АТФ и максимального дыхания. Уровни базального дыхания и продукции АТФ прямо коррелировали с уровнем продукции ОТ в клетках.
Интересно также отметить повышенный дыхательный запас, наблюдаемый у субклонов с низким и средним уровнями синтеза ОТ (4T1luc2_RT-1.3, 4T1luc2_RT-5.3), но не у сверхпродуцирующего субклона. Свободный дыхательный запас представляет собой особенно надежный функциональный параметр для оценки митохондриального резерва и приспособленности клетки (fitness) [35, 39]. Свободный дыхательный запас определяется как разница между уровнями базального и максимального дыхания. Когда клетки подвергаются стрессу, потребность в энергии увеличивается, что требует бóльших затрат АТФ для поддержания клеточных функций. Клетка со значительным свободным дыхательным запасом может производить больше АТФ и преодолевать больший стресс, включая окислительный стресс [40] и стресс эндоплазматического ретикулума [41]. Фактически нами показано, что ОТ ВИЧ-1, даже в относительно малом количестве (40 фг на клетку в случае суб-клона T1luc2-RT-1.3), индуцирует повышенную толерантность к стрессу в клетках аденокарциномы молочной железы.
Важно отметить, что экспрессия ОТ ВИЧ-1 не оказывала никакого влияния на процесс гликолиза, с усилением которого чаще всего связывают повышенную метастатическую активность. Так, недавно показано, что при злокачественном новообразовании желудка в клетках с высокой метастатической активностью происходит полное переключение метаболизма с окислительного фосфорилирования на аэробный гликолиз [42]. Гипергликолитическим фенотипом обладают и метастазирующие клетки опухоли молочной железы [43]. Нами описан альтернативный механизм повышенной агрессивности эпителиальных клеток аденокарциномы молочной железы мышей, обусловленный воздействием на опухолевые клетки белка ОТ ВИЧ-1. Скорее всего, ОТ воздействует на злокачественную эпителиальную клетку, повышая метастатическую активность за счет усиления митохондриального дыхания, что говорит о прямой роли белков ВИЧ-1 в индукции канцерогенеза [32]. Линия клеток аденокарциномы молочной железы мышей, использованная нами в этой работе, ‒ классическая модель опухоли молочной железы человека [44], поэтому можно предположить, что аналогичный эффект ОТ ВИЧ-1 будет оказывать и на опухолевые клетки человека. На это косвенно указывают и эпидемиологические данные по высокой частоте встречаемости опухоли молочной железы среди инфицированных ВИЧ-1 [45].
В проведенном исследовании мы попытались установить механизм индуцированного ОТ ВИЧ-1 усиления дыхательной активности митохондрий. Усиление дыхания может быть связано с повышенными уровнями субстратов, поступающих в цикл Кребса посредством гликолиза, глутаминолиза, окисления жирных кислот или других путей. Однако при анализе цитотоксичности блокаторов этих процессов: гексокиназы (2-дезокси-D-глюкоза), глутаминазы (CB839) и карнитинового транспортера митохондрий (этомоксир) ‒ не выявлено изменений в чувствительности клеток, экспрессирующих ОТ ВИЧ-1, к этим соединениям. Таким образом, нами показано, что ОТ-зависимое усиление дыхательной активности митохондрий не связано с усилением активности гликолиза, глутаминолиза или окисления жирных кислот. Следовательно, изменение дыхания не может быть результатом усиления митохондриального биогенеза, а вызвано другими факторами.
К одному из таких факторов относится структурная реорганизация митохондрий. Структура и расположение митохондрий в клетках имеют решающее значение и жестко регулируются процессами деления и слияния, биогенеза и митофагии, обеспечивая относительно постоянную митохондриальную популяцию [46]. Усиление митохондриального дыхания может быть связано с перестройкой митохондриальной сети. Действительно, ранее сообщалось, что в нитевидных митохондриях, по сравнению с фрагментированными, усилено окислительное фосфорилирование [36, 47]. Для исследования этой возможности мы проанализировали состояние митохондриальных сетей в ОТ-экспрессирующих субклонах в сравнении с исходными клетками. Оказалось, что высокий уровень экспрессии ОТ достоверно восстанавливал митохондриальные сети по сравнению с исходной линией 4Т1Luc2 и субклонами с низким уровнем экспрессии ОТ, что выражалось в значимом увеличении доли клеток с митохондриальным фенотипом MN > 70% (р = 0.023) и значительным (по сравнению с низкоэкспрессирующими) и незначительным (по сравнению с исходной клеточной линией) уменьшением числа клеток с фенотипом MN < 30%. Однако при этом не происходило увеличения митохондриальной массы. Наоборот, усиление дыхательной активности и увеличение пропорции клеток с превалирующим фенотипом митохондрий (MN > 70%) регистрировали для субклонов, отличающихся сниженной митохондриальной массой. Одним из объяснений может служить сборка дыхательных комплексов в “суперкомплексы”, характеризующиеся повышенной эффективностью потока электронов и продукции АТФ [48].
Отсутствие зависимости параметров дыхания митохондрий от базовых ферментативных активностей и обратное ожиданиям снижение митохондриальной массы указывали на наличие регуляторного ОТ-зависимого механизма. В частности, эффективность митохондриального дыхания определяется повышенной скоростью потока электронов и продукцией АТФ, необходимыми для функционирования дыхательных “суперкомплексов”.
Важную роль в регуляции митохондриального дыхания играют тирозинкиназы семейства Src. Src-киназы локализованы в нескольких внутриклеточных компартментах, включая митохондрии, где они нацелены на несколько белков, модулирующих активность этой органеллы. Сверхэкспрессия Src приводит к снижению жизнеспособности клеток, укорочению клеточного цикла, увеличению инвазивной способности и метастатической активности злокачественных клеток, что характерно для опухоли молочной железы [37]. Известно, что активность Src-киназ регулируется окислительно-восстановительными процессами и инактивируется путем окисления [49, 50]. Мы показали, что ОТ ВИЧ-1 индуцирует окислительный стресс в экспрессирующих ее клетках с продукцией АФК [33, 51]. АФК, индуцированные ОТ, могут инактивировать Src-киназы, приводя к восстановлению митохондриального дыхания. Это согласуется с описанной нами ранее прямой зависимостью между уровнями синтезируемой ОТ и продукцией АФК [33] и полученными теперь результатами по зависимости между уровнем ОТ и параметрами митохондриального дыхания (рис. 2). Ряд белков ВИЧ-1, таких как gp120, tat, nef и p17, также индуцирует продукцию АФК как в инфицированных, так и в неинфицированных “клетках-свидетелях” [32, 52]. Логично предположить, что они воздействуют на клетки опухоли молочной железы по типу ОТ. Вовлеченность в процесс усиления митохондриального дыхания Scr-киназ заслуживает отдельного исследования.
Таким образом, нами выявлено ОТ-индуцированное усиление митохондриального дыхания в клетках аденокарциномы молочной железы, объясняющее их повышенную туморогенную и метастатическую активность. Способность ОТ ВИЧ-1 влиять на метаболизм опухолевых клеток может играть важную роль в патогенезе инфекции ВИЧ-1, тем самым объясняя феномен ВИЧ-1-ассоциированного канцерогенеза, не связанного с иммунной супрессией и иммунной дисфункцией. Детальный механизм ОТ-индуцированного усиления митохондриального дыхания клеток аденокарциномы молочной железы и его последствий для патогенеза ВИЧ-1 еще предстоит установить.
Выполненные в период с 2017 по 2021 г. исследования, в части обоснования целей и задач, создания субклонов и характеристики их свойств, были поддержаны грантами РФФИ: 17-54-30002/ NIH R01CA217715 (2017–2020 гг.), 19-04-01034 (2019‒2021 гг.) ‒ и Российским научным фондом (грант № 21-74-10146) в части метаболитических измерений. Работа М.И. была поддержана грантом ЕС “Twinning on DNA Based Cancer Vaccines” No. 692293 (2016–2018).
Настоящая статья не содержит каких-либо исследований с участием людей или животных в качестве объектов исследований.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Vaupel P., Multhoff G. (2021) Revisiting the Warburg effect: historical dogma versus current understanding. J. Physiol. 599, 1745–1757.
Wang Z., Liu F., Fan N., Zhou C., Li D., Macvicar T., Dong Q., Bruns C.J., Zhao Y. (2020) Targeting glutaminolysis: new perspectives to understand cancer development and novel strategies for potential target therapies. Front. Oncol. 10, 589508.
Dong W., Nie X., Zhu H., Liu Q., Shi K., You L., Zhang Y., Fan H., Yan B., Niu C., Lyu L.D., Zhao G.P., Yang C. (2021) Mycobacterial fatty acid catabolism is repressed by FdmR to sustain lipogenesis and virulence. Proc. Natl. Acad. Sci. USA. 118(16), e2019305118.
Comerford S.A., Huang Z., Du X., Wang Y., Cai L., Witkiewicz A.K., Walters H., Tantawy M.N., Fu A., Manning H.C., Horton J.D., Hammer R.E., McKnight S.L., Tu B.P. (2014) Acetate dependence of tumors. Cell. 159, 1591‒1602.
Mashimo T., Pichumani K., Vemireddy V., Hatanpaa K.J., Singh D.K., Sirasanagandla S., Nannepaga S., Piccirillo S.G., Kovacs Z., Foong C., Huang Z., Barnett S., Mickey B.E., DeBerardinis R.J., Tu B.P., Maher E.A., Bachoo R.M. (2014) Acetate is a bioenergetic substrate for human glioblastoma and brain metastases. Cell. 159, 1603‒1614.
Foo B.J., Eu J.Q., Hirpara J.L., Pervaiz S. (2021) Interplay between mitochondrial metabolism and cellular redox state dictates cancer cell survival. Oxid. Med. Cell Longev. 2021, 1341604.
Lee H.Y., Nga H.T., Tian J., Yi H.S. (2021) Mitochondrial metabolic signatures in hepatocellular carcinoma. Cells. 10(8), 1901.
Zorov D.B., Juhaszova M., Sollott S.J. (2006) Mitochondrial ROS-induced ROS release: an update and review. Biochim. Biophys. Acta. 1757, 509‒517.
Ott M., Gogvadze V., Orrenius S., Zhivotovsky B. (2007) Mitochondria, oxidative stress and cell death. Apoptosis. 12, 913‒922.
Murphy M.P. (2009) How mitochondria produce reactive oxygen species. Biochem. J. 417(Pt. 1), 1‒13.
Ivanov A.V., Valuev-Elliston V.T., Tyurina D.A., Ivanova O.N., Kochetkov S.N., Bartosch B., Isaguliants M.G. (2017) Oxidative stress, a trigger of hepatitis C and B virus-induced liver carcinogenesis. Oncotarget. 8, 3895‒3932.
Plummer M., de Martel C., Vignat J., Ferlay J., Bray F., Franceschi S. (2016) Global burden of cancers attri-butable to infections in 2012: a synthetic analysis. Lancet Glob. Health. 4, e609‒e616.
Jiang B., Xue M. (2015) Correlation of E6 and E7 levels in high-risk HPV16 type cervical lesions with CCL20 and Langerhans cells. Genet. Mol. Res. 14, 10473‒10481.
de Martel C., Plummer M., Vignat J., Franceschi S. (2017) Worldwide burden of cancer attributable to HPV by site, country and HPV type. Int. J. Cancer. 141, 664‒670.
Baecker A., Liu X., La Vecchia C., Zhang Z.F. (2018) Worldwide incidence of hepatocellular carcinoma cases attributable to major risk factors. Eur. J. Cancer Prev. 27, 205‒212.
Thaker S.K., Ch’ng J., Christofk H.R. (2019) Viral hijacking of cellular metabolism. BMC Biol. 17, 59.
Allen C.N.S., Arjona S.P., Santerre M., Sawaya B.E. (2022) Hallmarks of metabolic reprogramming and their role in viral pathogenesis. Viruses. 14(3), 602.
Mikaeloff F., Svensson Akusjarvi S., Ikomey G.M., Krishnan S., Sperk M., Gupta S., Magdaleno G.D.V., Escos A., Lyonga E., Okomo M.C., Tagne C.T., Babu H., Lorson C.L., Vegvari A., Banerjea A.C., Kele J., Hanna L.E., Singh K., de Magalhaes J.P., Benfeitas R., Neogi U. (2022) Trans cohort metabolic reprogramming towards glutaminolysis in long-term successfully treated HIV-infection. Commun. Biol. 5, 27.
Gelpi M., Mikaeloff F., Knudsen A.D., Benfeitas R., Krishnan S., Svenssson Akusjarvi S., Hogh J., Murray D.D., Ullum H., Neogi U., Nielsen S.D. (2021) The central role of the glutamate metabolism in long-term antiretroviral treated HIV-infected individuals with metabolic syndrome. Aging (Albany N.Y.). 13, 22732‒22751.
Levy P., Bartosch B. (2016) Metabolic reprogramming: a hallmark of viral oncogenesis. Oncogene. 35, 4155‒4164.
Alfarouk K.O. (2016) Tumor metabolism, cancer cell transporters, and microenvironmental resistance. J. Enzyme Inhib. Med. Chem. 31, 859‒866.
Vander Heiden M.G., Cantley L.C., Thompson C.B. (2009) Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029‒1033.
Levy P.L., Duponchel S., Eischeid H., Molle J., Michelet M., Diserens G., Vermathen M., Vermathen P., Dufour J.F., Dienes H.P., Steffen H.M., Odenthal M., Zoulim F., Bartosch B. (2017) Hepatitis C virus infection triggers a tumor-like glutamine metabolism. Hepatology. 65, 789‒803.
Yu L., Chen X., Wang L., Chen S. (2018) Oncogenic virus-induced aerobic glycolysis and tumorigenesis. J. Cancer. 9, 3699‒3706.
Su M.A., Huang Y.T., Chen I.T., Lee D.Y., Hsieh Y.C., Li C.Y., Ng T.H., Liang S.Y., Lin S.Y., Huang S.W., Chiang Y.A., Yu H.T., Khoo K.H., Chang G.D., Lo C.F., Wang H.C. (2014) An invertebrate Warburg effect: a shrimp virus achieves successful replication by altering the host metabolome via the PI3K-Akt-mTOR pathway. PLoS Pathog. 10, e1004196.
Chen I.T., Lee D.Y., Huang Y.T., Kou G.H., Wang H.C., Chang G.D., Lo C.F. (2016) Six hours after infection, the metabolic changes induced by WSSV neutralize the host’s oxidative stress defenses. Sci. Rep. 6, 27732.
Franzetti M., Ricci E., Bonfanti P. (2019) The pattern of non-AIDS-defining cancers in the HIV population: epidemiology, risk factors and prognosis. A review. Curr. HIV Res. 17(1), 1‒12.
Yarchoan R., Uldrick T.S. (2018) HIV-associated cancers and related diseases. N. Engl. J. Med. 378, 1029‒1041.
Petkov S., Chiodi F. (2022) Impaired CD4+ T cell differentiation in HIV-1 infected patients receiving early anti-retroviral therapy. Genomics. 114, 110367.
Liu X., Lin L., Lu L., Li X., Han Y., Qiu Z., Li X., Li Y., Song X., Cao W., Li T. (2022) Comparative transcriptional analysis identified characteristic genes and patterns in HIV-infected immunological non-responders. Front. Immunol. 13, 807890.
Wilson E.M., Sereti I. (2013) Immune restoration after antiretroviral therapy: the pitfalls of hasty or incomplete repairs. Immunol. Rev. 254, 343‒354.
Isaguliants M., Bayurova E., Avdoshina D., Kondra-shova A., Chiodi F., Palefsky J.M. (2021) Oncogenic effects of HIV-1 proteins, mechanisms behind. Cancers (Basel). 13(2), 305.
Bayurova E., Jansons J., Skrastina D., Smirnova O., Mezale D., Kostyusheva A., Kostyushev D., Petkov S., Podschwadt P., Valuev-Elliston V., Sasinovich S., Korolev S., Warholm P., Latanova A., Starodubova E., Tukhvatulin A., Latyshev O., Selimov R., Metalnikov P., Komarov A., Ivanova O., Gorodnicheva T., Kochetkov S., Gottikh M., Strumfa I., Ivanov A., Gordeychuk I., Isaguliants M. (2019) HIV-1 reverse transcriptase promotes tumor growth and metastasis formation via ROS-dependent upregulation of twist. Oxid. Med. Cell Longev. 2019, 6016278.
Golikov M.V., Karpenko I.L., Lipatova A.V., Ivanova O.N., Fedyakina I.T., Larichev V.F., Zakirova N.F., Leonova O.G., Popenko V.I., Bartosch B., Kochetkov S.N., Smirnova O.A., Ivanov A.V. (2021) Cultivation of cells in a physiological plasmax medium increases mitochondrial respiratory capacity and reduces replication levels of RNA viruses. Antioxidants (Basel). 11(1), 97.
Marchetti P., Fovez Q., Germain N., Khamari R., Kluza J. (2020) Mitochondrial spare respiratory capacity: mechanisms, regulation, and significance in non-transformed and cancer cells. FASEB J. 34, 13106‒13124.
Zorov D.B., Vorobjev I.A., Popkov V.A., Babenko V.A., Zorova L.D., Pevzner I.B., Silachev D.N., Zorov S.D., Andrianova N.V., Plotnikov E.Y. (2019) Lessons from the discovery of mitochondrial fragmentation (fission): a review and update. Cells. 8(2), 175.
Djeungoue-Petga M.A., Lurette O., Jean S., Hamel-Cote G., Martin-Jimenez R., Bou M., Cannich A., Roy P., Hebert-Chatelain E. (2019) Intramitochondrial Src kinase links mitochondrial dysfunctions and aggressiveness of breast cancer cells. Cell Death Dis. 10, 940.
Fendt S.M., Frezza C., Erez A. (2020) Targeting metabolic plasticity and flexibility dynamics for cancer therapy. Cancer Discov. 10, 1797‒1807.
Jang D.H., Greenwood J.C., Spyres M.B., Eckmann D.M. (2017) Measurement of mitochondrial respiration and motility in acute care: sepsis, trauma, and poisoning. J. Intensive Care Med. 32, 86‒94.
Hill B.G., Dranka B.P., Zou L., Chatham J.C., Darley-Usmar V.M. (2009) Importance of the bioenergetic reserve capacity in response to cardiomyocyte stress induced by 4-hydroxynonenal. Biochem. J. 424, 99‒107.
Knupp J., Arvan P., Chang A. (2019) Increased mitochondrial respiration promotes survival from endoplasmic reticulum stress. Cell Death Differ. 26, 487‒501.
Kogure A., Naito Y., Yamamoto Y., Yashiro M., Kiyono T., Yanagihara K., Hirakawa K., Ochiya T. (2020) Cancer cells with high-metastatic potential promote a glycolytic shift in activated fibroblasts. PLoS One. 15, e0234613.
Fujita M., Imadome K., Somasundaram V., Kawanishi M., Karasawa K., Wink D.A. (2020) Metabolic characterization of aggressive breast cancer cells exhibi-ting invasive phenotype: impact of non-cytotoxic doses of 2-DG on diminishing invasiveness. BMC Cancer. 20, 929.
Pulaski B.A., Ostrand-Rosenberg S. (2001) Mouse 4T1 breast tumor model. Curr. Protoc. Immunol. Chapter 20, Unit 20.2. https://doi.org/10.1002/0471142735.im2002s39
Chirkut S. (2019) Breast cancer, human immunodeficiency virus and highly active antiretroviral treatment; implications for a high-rate seropositive region. Oncol. Rev. 13, 376.
Osellame L.D., Blacker T.S., Duchen M.R. (2012) Cellular and molecular mechanisms of mitochondrial function. Best Pract. Res. Clin. Endocrinol. Metab. 26, 711‒723.
Picard M., Shirihai O.S., Gentil B.J., Burelle Y. (2013) Mitochondrial morphology transitions and functions: implications for retrograde signaling? Am. J. Physiol. Regul. Integr. Comp. Physiol. 304, R393‒R406.
Vercellino I., Sazanov L.A. (2022) The assembly, regulation and function of the mitochondrial respiratory chain. Nat. Rev. Mol. Cell Biol. 23, 141‒161.
Dustin C.M., Heppner D.E., Lin M.J., van der Vliet A. (2020) Redox regulation of tyrosine kinase signalling: more than meets the eye. J. Biochem. 167, 151‒163.
Kemble D.J., Sun G. (2009) Direct and specific inactivation of protein tyrosine kinases in the Src and FGFR families by reversible cysteine oxidation. Proc. Natl. Acad. Sci. USA. 106, 5070‒5075.
Isaguliants M., Smirnova O., Ivanov A.V., Kilpelainen A., Kuzmenko Y., Petkov S., Latanova A., Krotova O., Engstrom G., Karpov V., Kochetkov S., Wahren B., Starodubova E. (2013) Oxidative stress induced by HIV-1 reverse transcriptase modulates the enzyme’s performance in gene immunization. Hum. Vaccin. Immunother. 9, 2111‒2119.
Ivanov A.V., Valuev-Elliston V.T., Ivanova O.N., Kochetkov S.N., Starodubova E.S., Bartosch B., Isaguliants M.G. (2016) Oxidative stress during HIV infection: mechanisms and consequences. Oxid. Med. Cell. Longev. 2016, 8910396.
Дополнительные материалы отсутствуют.
Инструменты
Молекулярная биология


